糖基化修饰广泛存在于天然化合物中,其可有效提高天然化合物的水溶性和生物活性[1],在食品、医药和化妆品等行业具有重要的应用价值。由于形成糖苷的单糖有α-和β-两种构象的端基异构体,所以在形成糖苷化合物时会产生2种不同构型的糖苷,即α-糖苷和β-糖苷。不同构型的糖苷通常表现出不同的物理化学性质以及生物活性,例如,与L-薄荷醇-α-葡萄糖苷相比,L-薄荷醇-β-葡萄糖苷表现出更高的水溶解性,更好的清凉感和皮肤渗透性[2]。
利用化学法合成小分子化合物糖苷的方法已被广泛应用,比如L-薄荷醇-β-葡萄糖苷、香兰素、乙基香兰素-β-葡萄糖苷和香叶醇-β-葡萄糖苷等等,但化学法往往需要繁琐的保护和去保护步骤,且涉及重金属催化剂,容易产生大量的污染物。此外,化学法的区域选择性和立体选择性也较差。相比之下,生物酶法糖基化通常可一步实现端基异构体构型的糖基化,包括α-糖基化和β-糖基化,且具有良好的区域选择性[3]。其中,酶法合成α-糖苷被报道的相对较多,比如α-糖苷酶、环糊精糖基转移酶和蔗糖磷酸化酶。这种方法能以廉价原料为糖基供体,可有效地糖基化多种小分子化合物生产α-糖苷产物[4]。近些年来,一些小分子化合物的酶法合成β-糖苷也被相继报道,比如,低聚β-半乳糖、烷基-β-糖苷等的合成,如图1所示。已报道的相关的β-糖基化酶在碳水化合物活性酶数据库(carbohydrate-actie enzymes, CAZy)中主要分布于糖苷水解酶(glycoside hydrolase, GH)家族和糖基转移酶(glycosyltransferase, GT)家族[5-6]。其中,GT催化合成β-糖苷的效率较高,但其糖基供体价格昂贵;而GH糖基供体廉价,底物广泛,其作为小分子化合物的β-糖基化酶,具备一定的应用价值。
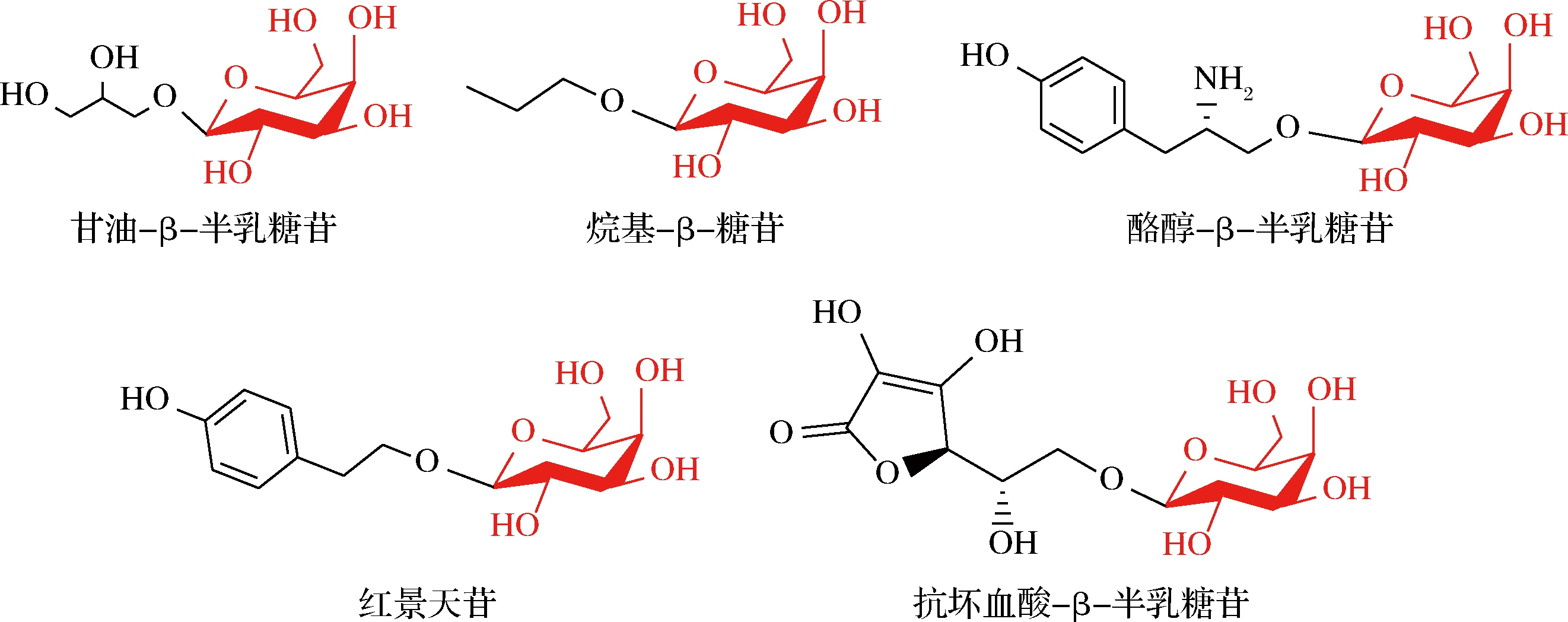
图1 酶法合成的小分子化合物β-糖苷
Fig.1 β-Glycoside of small molecule compounds synthesized by enzymatic method
1 β-异头选择性糖基化的反应类型
许多已商业化的小分子化合物的β-糖苷是由化学法合成,主要由4步反应组成。首先是葡萄糖的保护反应,即由乙酸酐和碘过氧乙酰化,生成β-五乙酰糖;再与HBr/AcOH在葡萄糖的异头过氧乙酰化位置卤化,生成卤化的β-乙酰化糖,目标糖基受体底物与Lewis酸催化的活化糖基供体反应,生成β-乙酰化糖苷;最后,经甲醇钠催化去保护反应,形成目标化合物的β-糖苷产物[7]。
在酶法催化β-异头选择性糖基化反应方面,根据催化作用机制的不同可分为2类:反转型和保留型(图2)。

a-反转机制;b-保留机制
图2 β-糖基化酶的2种催化机制
Fig.2 Two catalytic mechanisms of β-glycosylase
反转型反应机制通常为一步催化(图2-a),由α-糖苷原料作为糖基供体合成β-糖苷产物。催化过程中,糖基受体作为亲核试剂被活化,用于直接置换并反转异头取代基,形成反转的糖苷键。保留型反应机制(图2-b)常分为2步,第一步以酶的一个催化残基作为亲核试剂,攻击异头中心以取代苷元R1并形成α-糖基酶中间体,同时其他残基起到酸催化剂的作用,并在键断裂时使糖苷氧质子化;第二步中,另一个催化残基充当碱催化剂,在另一个含有羟基的小分子化合物R2攻击下使糖基酶中间体去质子化,形成β-糖基化合物[8]。
2 具有β-糖基化反应的酶
2.1 糖苷水解酶
糖苷水解酶(glycoside hydrolases, GHs)又称糖苷酶,能够催化糖与糖或糖与其他苷元之间糖苷键水解的酶。此外,其中一些酶还具有转糖基活性,即可对小分子化合物进行糖基化修饰。其中催化β-糖苷合成的GH主要分布于GH13、GH16、GH68、GH70和GH77这5个家族中。自上世纪末,AJISAKA等[9]利用杏仁的β-葡萄糖苷酶在90%的葡萄糖溶液中合成4种β-糖苷键连接的葡萄糖二糖以来,研究人员发现了许多GH能催化β-糖苷化合物的合成[10]。
不同来源的β-糖苷酶具有不同的催化特性、不同的糖基供体和受体底物,例如Bacillus circulans来源的β-半乳糖苷酶合成具有β-(1→2)、β-(1→3)、β-(1→4)和β-(1→6)连接的低聚糖,而Geobacillus stearothermophilus和Bifidobacterium infantis来源的β-半乳糖苷酶主要产生β-(1→3)连接的低聚糖,Kluyeromyces lactis来源的β-半乳糖苷酶则主要产生β-(1→4)糖苷键。除此之外,不同来源的酶的受体和供体底物的选择性也有所不同,如表1所示。
表1 β-糖苷酶酶学性质与底物特异性
Table 1 β-Glycosidase enzyme properties and substrate specificity
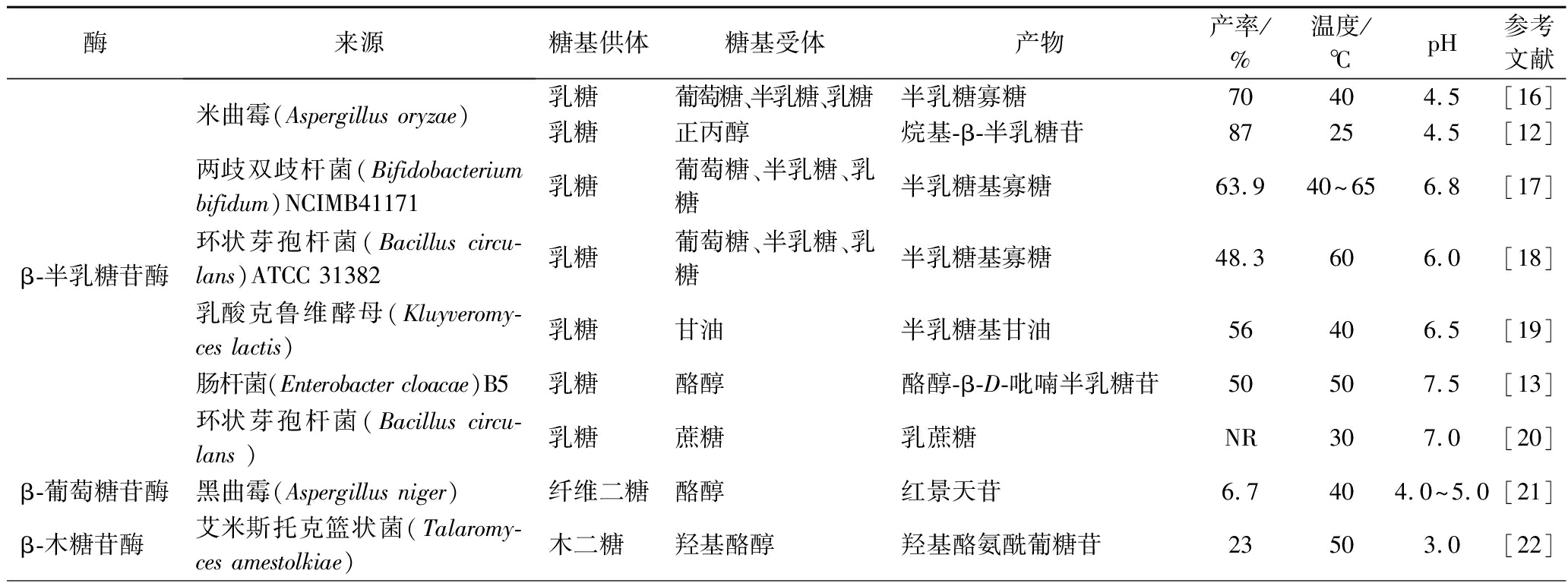
酶来源糖基供体糖基受体产物产率/%温度/℃pH参考文献β-半乳糖苷酶米曲霉(Aspergillus oryzae)两歧双歧杆菌(Bifidobacterium bifidum)NCIMB41171环状芽孢杆菌(Bacillus circu-lans)ATCC 31382乳酸克鲁维酵母(Kluyeromy-ces lactis)肠杆菌(Enterobacter cloacae)B5环状芽孢杆菌(Bacillus circu-lans )乳糖葡萄糖、半乳糖、乳糖半乳糖寡糖70404.5[16]乳糖正丙醇烷基-β-半乳糖苷87254.5[12]乳糖葡萄糖、半乳糖、乳糖半乳糖基寡糖63.940~656.8[17]乳糖葡萄糖、半乳糖、乳糖半乳糖基寡糖48.3606.0[18]乳糖甘油半乳糖基甘油56406.5[19]乳糖酪醇酪醇-β-D-吡喃半乳糖苷50507.5[13]乳糖蔗糖乳蔗糖NR307.0[20]β-葡萄糖苷酶黑曲霉(Aspergillus niger)纤维二糖酪醇红景天苷6.7404.0~5.0[21]β-木糖苷酶艾米斯托克篮状菌(Talaromy-ces amestolkiae)木二糖羟基酪醇羟基酪氨酰葡糖苷23503.0[22]
续表1

酶来源糖基供体糖基受体产物产率/%温度/℃pH参考文献β-甘露糖苷酶海栖热袍菌(Thermotoga mari-tima)MSB8甘露糖醇或半乳糖烷基-β-甘露糖苷、寡糖NR50~957.0[23]β-糖苷酶硫化叶菌(Sulfolobus shibatae)乳糖蔗糖β-D-吡喃半乳糖基蔗糖2050~955.0~6.0[24]
注:NR,未报道(下同)
低聚半乳糖(galactooligosaccharides, GOS)是益生元的一种,能够选择性的刺激肠道内双歧杆菌的生长,具有调节肠道微生态、提高机体免疫力等作用。广泛存在于一系列微生物中的具有转半乳糖基化活性的β-半乳糖苷酶是GOS生物合成的良好催化剂,其催化乳糖水解与转半乳糖基化生成GOS,最高产量达到315 g/L[11]。有研究表明,在所有真菌来源的β-半乳糖苷酶中,Aspergillus oryzae产生的GOS浓度最高。而在细菌中,早期的研究表明Bacillus circulans来源的β-半乳糖苷酶可实现高效生产GOS[12]。
除了GOS外,近年来研究发现β-糖基化酶对多种潜香化合物、脂肪醇和维生素类化合物也显示出转糖基活性[13-14]。随着天然酶数据库的不断扩大,有研究发现一种具有新型糖基转移反应的酶lasGT。有趣的是,具有2种异头构型的各种芳基和烷基葡萄糖苷都是该酶的底物[15]。
2.2 糖苷磷酸化酶
糖苷磷酸化酶(glycoside phosphorylases, GPs),能够可逆地催化糖苷键的形成和断裂,其可使用稳定的糖磷酸为糖基供体,将糖基转移到特定的糖受体上。这种独特的可逆反应优势,加上严格的区域选择性,且能够使用单糖磷酸作为活性糖基供体,使GP成为有价值的合成β-糖苷的催化剂。最近报道了一些GP在合成复杂糖苷中的应用,其中包括合成β-构型的二糖和寡糖等,如表2所示。
表2 糖苷磷酸化酶酶学性质与底物特异性
Table 2 Enzymatic properties and substrate specificity of glycoside phosphorylase

酶温度/℃pH糖基供体产物参考文献纤维二糖磷酸化酶377.0纤维二糖β-D-吡喃葡萄糖基单糖[25]β-1,3-葡聚糖磷酸化酶407.01-磷酸-α-葡萄糖1,3-1,4-β-葡萄糖基寡糖[26]D-半乳糖基磷酸化酶377.01-磷酸-α-半乳糖半乳糖-N-二糖/乳糖-N-二糖[27]纤维糊精磷酸化酶377.21-磷酸-α-半乳糖纤维寡糖[28]纤维糖酸磷酸化酶356.0~7.01-磷酸-α-葡萄糖4-O-β-D-吡喃葡萄糖基-D-葡萄糖酸、3-O-β-D-吡喃葡萄糖基-D-葡萄糖醛酸[29]
目前鉴定的GP的底物多样性相对较小,限制了它们的实际应用。有研究开发了一种高通量的筛选方法,使用活化底物2,4-二硝基苯基β-D-葡萄糖苷和无机磷酸盐来鉴定GP活性,并使用它来筛选大型插入宏基因组文库,通过该方法研究人员从CAZy家族GH3中鉴定了一个以前未知的β保留GP,该酶具有磷酸化纤维素和纤维寡糖的β-1,4糖苷键的能力[30]。除此之外,近年来利用酶的偶联反应合成β-糖苷也得到了广泛的研究,例如使用无糖基化活性的蔗糖磷酸化酶将蔗糖分解为磷酸化葡萄糖和果糖,再通过纤维二糖磷酸化酶将磷酸化葡萄糖转移至烷基醇,设计出一种以蔗糖为糖供体合成烷基β-糖苷的新方法[31]。这种酶偶联反应也被报道用于乳糖-N-二糖的千克规模制备[32]。
2.3 糖基转移酶
糖基转移酶(glycosyltransferase, GTs)是自然界大量天然糖苷的合成酶,例如萜类和黄酮类化合物等,具有来源广泛、种类多样、转糖基活性较高、底物专一性和区域选择性高等特点,这些酶需利用活化的二磷酸核苷糖化合物(UDP-Glu、UDP-Gal、GDP-Man等)作为糖基供体底物。研究显示,在提供多个糖基化位点的受体反应中,GT通常显示出良好的区域位点选择性。因此,GT亦被认为是潜在的高活性糖基化催化剂,能够在一步转化中实现多种复杂化合物的β-糖苷的定点合成,如表3所示。
在GT合成β-糖苷的应用方面,为了避免使用昂贵的活化糖基供体,近年来研究人员通过多酶联用构建代谢改造的工程化细胞工厂来合成活化的糖基供体,再通过高密度发酵在细胞内对多种产物进行糖基化修饰[33-34]。以焦磷酸化酶的UDP-糖基供体的循环再生为例,在体内,UDP-葡萄糖焦磷酸化酶可以催化1-磷酸葡萄糖和UTP合成UDP-G作为糖原合成的活化糖基供体。按照该方法,研究人员在体外构建了UDP-半乳糖和UDP-葡萄糖的循环再生,并偶联GT进行化合物的糖基化,其反应过程如图3所示。PANDEY等[33]构建了一个大肠杆菌细胞工厂,其中编码UDP-木糖途径葡萄糖变位酶(nfa44530)、葡萄糖-1-磷酸尿苷酰转移酶(galU)、UDP-葡萄糖脱氢酶(calS8)和UDP-葡萄糖醛酸脱羧酶(calS9)以及来自拟南芥的GT(arGt-3)的基因在大肠杆菌BL21(DE3)中过表达,用来生产槲皮素3-O-木糖苷,经条件优化后槲皮素糖苷的转化率由54.75%提高到98%。吲哚酚是蓝色染料靛蓝一种高反应性前体,通过异源表达靛蓝植物Polygonum tinctorium来源的β-葡萄糖基转移酶PtUGT1对吲哚酚进行β-葡萄糖基化,可形成稳定且更易溶解的葡萄糖苷衍生物[35]。阿维菌素对多种线虫和节肢动物寄生虫具有良好的疗效,但其水溶性较低,通过地衣芽孢杆菌的糖基转移酶BLC对其进行糖基化形成糖苷,实验表明阿维菌素糖苷的水溶性提高了大约50倍,且抗线虫活性提高大约30倍[36]。
表3 糖基转移酶酶学性质与底物特异性
Table 3 Enzymatic properties and substrate specificity of glycosyltransferase

来源酶的名称糖基供体糖基受体产物转化率参考文献拟南芥(Arabidop-sisthaliana)AtUGT78D2UDP-N-乙酰氨基葡萄糖槲皮素槲皮素3-O-N-乙酰氨基葡萄糖苷0.84[37]arGt-3UDP-木糖槲皮素槲皮素3-O-木糖苷0.97[33]AtUGT78D2AtUGT78D1AtUGT89C1UDP-葡萄糖UDP-鼠李糖槲皮素槲皮素3-O-葡萄糖苷-7-O-鼠李糖苷槲皮素3,7-O-双鼠李糖苷NR[38]RAFL15-41-P03UDP-葡萄糖芹菜素黄芩素芹菜素-7-O-β-D-葡萄糖苷黄芩素-7-O-β-D-葡萄糖苷0.910.77[35]香石竹(Dianthus caryophyllus)DicGT4UDP-葡萄糖柚皮素柚皮素-7-O-葡萄糖苷柚皮素-4-O-葡萄糖苷0.71[39]流感嗜血杆菌(Hae-mophilus influenzae)lgtDUDP-N-乙酰氨基半乳糖乳糖球形异四糖(GalNAcβ-3Galα-4Galβ-4Glc)0.96[40]
注:NR,未报道

图3 糖基转移酶参与的糖基化循环过程
Fig.3 The glycosylation cycle of glycosyltransferase
3 β-糖基化酶的定向改造
GTs虽然是绝大多数天然化合物β-糖苷的生物合成酶,但因使用昂贵且稳定性差的活化糖基供体,其应用受到限制。近年来,因糖苷酶可利用简单且廉价的底物对小分子化合物进行β-糖基化修饰,其应用潜力被不断开发。但天然糖苷酶往往存在催化活性低或者区域选择性差等问题,难以满足工业应用的要求。为了克服天然酶存在的局限性,通过定向进化方法可改善糖苷酶的转糖基特性,包括催化活性、热稳定性、底物选择性和对有机试剂的耐受性等。
3.1 底物谱拓展
通常底物特异性的改变是一项困难的任务,因为酶在结合糖基供体和糖基受体的亚位点都表现出非常高的选择性。尽管如此,通过酶工程调节,已有一些在改变糖基供体或者糖基受体选择性上成功的案例,从而拓宽了β-葡萄糖苷酶的糖基供体底物。有研究发现Sulfolobus solfataricus 的β-糖苷酶中的残基W433和E432是糖苷供体底物特异性的决定因素,而突变体E432C和W433C可以消除其与糖底物的4位羟基和3位羟基的关键相互作用,从而降低了糖基供体底物识别的专一性特性,可识别葡萄糖、半乳糖和岩藻糖等糖基,因此产生了糖基供体底物拓宽的2种突变体糖苷酶[41]。植物来源的野生型β-葡萄糖苷酶对二糖和三糖具有活性,其突变体R342Y和R342A对四糖或五糖表现出较高的偏好[42]。
不同的β-糖基化酶对各种糖基受体具有不同的偏好。例如,β-半乳糖苷酶一般催化半乳糖和受体醇羟基之间O-糖苷键的形成,而酚羟基的糖基化报道较少。但LU等[43]通过对L.bulgaricus L3的β-半乳糖苷酶(BgaL3)进行合理设计,增强了BgaL3对酚羟基的偏好,通过推测BgaL3的活性中心入口处的第980位色氨酸残基(W980)在酶的糖基受体底物选择中起关键作用。随后对该位点进行饱和突变产生了一个突变体W980F,该突变体对儿茶酚、对苯二酚和苯酚的糖基化活性从7.6%提高到53.1%。
3.2 提高转糖基化效率
GH能同时催化水解和转糖基化反应,所以催化反应产物中往往包含水解产物。β-糖基化酶可通过突变亲核催化残基改变其对产物的水解活性,即减弱水解活性的同时保留转糖基活性,尽管酶的水解活性难以完全消除,但对催化残基外的定点突变也可以改善转糖基活性。
有研究通过合理设计获得了Thermus thermophilus的β-糖苷酶(Ttβ-gly, GH1 家族)的2个单一突变体 F401S 和 N282T,它们显示出比野生型酶更高的转糖基化/水解比[44]。在此基础上,研究者又对Ttβ-gly进行单点突变,得到了4个新的突变体,它们合成β-构型寡糖的转糖基活性从野生型酶36%的转化率提高到了68%~90%[45]。也有研究团队通过改造Thermotoga maritima的β-葡萄糖苷酶获得了6个突变体,其中突变体N222F的糖基供体底物从纤维二糖变成了龙胆二糖,使用对硝基苯酚糖苷和己醇进行转糖基反应时,生成己基-β-糖苷的产率达到了84.7%,且水解下降了57.4%[46]。LUNDEMO等[47]将Thermotoga neapolitana的GH1家族的β-葡萄糖苷酶第220 位残基采用3个不同氨基酸进行替换,突变体的转糖基活性与水解活性的比率从0.33提高到1.45~2.27,通过调节pH,突变体的水解活性在pH为10时基本消失。这些研究结果表明,通过蛋白质工程和催化条件优化,可减弱水解活性且保持转糖基化活性。
3.3 区域选择性
酶促β-糖苷的区域选择性取决于β-糖苷酶的来源,一些酶具有专一的区域选择性,而有些酶的区域选择性较为复杂。例如生物合成的寡糖通常由聚合度2~3甚至更高的低聚糖的混合物形成,根据酶的来源不同,其催化合成的糖苷键也有所不同,这对于寡糖的产物纯化与鉴定造成了困难。通过酶工程进行改造后,其糖苷键的连接和寡糖的聚合度更加专一,这对于生物合成特定的低聚寡糖的益生元具有重要意义。
针对Bacillus circulans ATCC 31382来源的β-半乳糖苷酶BgaD-D中8个活性位点氨基酸残基(Arg185、Asp481、Lys487、Tyr511、Trp570、Trp593、Glu601 和 Phe616)进行突变分析(如图4所示),结果表明与野生型相比,突变体 D481N合成异乳糖的产量增加了2.3倍,证实D481位点的突变有利于具有β-(1→3)和β-(1→6)连接的GOS的合成[48]。DRONE等[49]根据WITHERS策略,突变了T.thermophilus的Tt-β-Gly糖苷酶。突变体以α-D-吡喃糖基氟物为糖基供体,产生半乳糖基和葡萄糖基β-(1→3)-糖苷产物的产率高达90%,而野生型酶催化的产物中还有存在数量较大的β-(1→6)连接的糖苷区域异构体。GH116家族Thermoanaerobacterium的木聚糖酶突变体 E441G 和 E441S比野生型酶的转糖苷活性明显提高,且糖苷键的产生更偏好于β-(1→4)连接的糖苷键[50]。

图4 β-半乳糖苷酶BgaD-D活性中心
Fig.4 The actie center junction of β-galactosidase BgaD-D
4 总结
近些年来,合成β-糖苷的诸多方法中,通过酶促进行β-异构体选择性糖基化的方法被广泛关注。虽然与化学合成法相比,酶促法合成β-异构体选择性糖基化具有一定的优势,但也常常受限于较低的活性或昂贵的糖基供体底物,比如UDP-糖或纤维二糖。此外,酶促法合成β-糖苷的效率也往往低于酶促法合成α-糖苷。α-糖基化酶的活性相对较高,且来源广泛,其糖基供体底物廉价易得,比如蔗糖、糊精、淀粉等。因此,未来还需要从多个方面对β-糖基化酶进行研究:(1)筛选更多具有高β-转糖基化活性的糖基转移酶;(2)利用基因及蛋白质工程技术改造现有的具有糖基化活性的酶,比如使其可采用廉价原料作为糖基供体、提高转糖基活性和区域选择性等;(3)构建活性糖基供体合成的高效细胞工厂平台,从而使来源广泛且功能多样的糖基转移酶用于更多小分子化合物的β-糖基化。
[1] AHMED A, PETERS N R, FITZGERALD M K, et al.Colchicine glycorandomization influences cytotoxicity and mechanism of action[J].Journal of the American Chemical Society, 2006, 128(44):14 224-14 225.
[2] CHOI H Y, KIM B M, MORGAN A M A, et al.Improement of the pharmacological actiity of menthol ia enzymatic β-anomer-selectie glycosylation[J].AMB Express, 2017, 7(1):167.
[3] KRUSCHITZ A, NIDETZKY B.Downstream processing technologies in the biocatalytic production of oligosaccharides[J].Biotechnology Adances, 2020, 43:107568.
[4] GOEDL C, SAWANGWAN T, WILDBERGER P, et al.Sucrose phosphorylase:A powerful transglucosylation catalyst for synthesis of α-D-glucosides as industrial fine chemicals[J].Biocatalysis and Biotransformation, 2010, 28(1):10-21.
[5] KLEWICKI R, BELINA I, WOJCIECHOWSKA A, et al.Synthesis of galactosyl mannitol deriatie using β-galactosidase from Kluyeromyces lactis[J].Polish Journal of Food and Nutrition Sciences, 2017, 67(1):33-39.
[6] DE BRUYN F, MAERTENS J, BEAUPREZ J, et al.Biotechnological adances in UDP-sugar based glycosylation of small molecules[J].Biotechnology Adances, 2015, 33(2):288-302.
[7] MUKHOPADHYAY B, KARTHA K P R, RUSSELL D A, et al.Streamlined synthesis of per-O-acetylated sugars, glycosyl iodides, or thioglycosides from unprotected reducing sugars[J].The Journal of Organic Chemistry, 2004, 69(22):7 758-7 760.
[8] ÜNLIGIL U M, RINI J M.Glycosyltransferase structure and mechanism[J].Current Opinion in Structural Biology, 2000, 10(5):510-517.
[9] AJISAKA K, NISHIDA H, FUJIMOTO H.The synthesis of oligosaccharides by the reersed hydrolysis reaction of β-glucosidase at high substrate concentration and at high temperature[J].Biotechnology Letters, 1987, 9(4):243-248.
[10] LOMBARD , GOLACONDA RAMULU H, DRULA E, et al.The carbohydrate-actie enzymes database (CAZy) in 2013[J].Nucleic Acids Research, 2013, 42(D1):D490-D495.
[11] PARK H Y, KIM H J, LEE J K, et al.Galactooligosaccharide production by a thermostable β-galactosidase from Sulfolobus solfataricus[J].World Journal of Microbiology and Biotechnology, 2008, 24(8):1 553-1 558.
[12] NAKANISHI K, MATSUNO R, TORII K, et al.Properties of immobilized β-D-galactosidase from Bacillus circulans[J].Enzyme and Microbial Technology, 1983, 5(2):115-120.
[13] ERA C, GUERRERO C, WILSON L, et al.Synthesis of propyl-β-D-galactoside with free and immobilized β-galactosidase from Aspergillus oryzae[J].Process Biochemistry, 2017, 53:162-171.
[14] QI T T, GU G F, XU L, et al.Efficient synthesis of tyrosol galactosides by the β-galactosidase from Enterobacter cloacae B5[J].Applied Microbiology and Biotechnology, 2017, 101(12):4 995-5 003.
[15] KOBAYASHI K, SHIMIZU H, TANAKA N, et al.Characterization and structural analyses of a noel glycosyltransferase acting on the β-1, 2-glucosidic linkages[J].The Journal of Biological Chemistry, 2022, 298(3):101606.
[16] URRUTIA P, RODRIGUEZ-COLINAS B, FERNANDEZ-ARROJO L, et al.Detailed analysis of galactooligosaccharides synthesis with β-galactosidase from Aspergillus oryzae[J].Journal of Agricultural and Food Chemistry, 2013, 61(5):1 081-1 087.
[17] OSMAN A, TZORTZIS G, RASTALL R A, et al.BbgI is an important Bifidobacterium β-galactosidase for the synthesis of prebiotic galactooligosaccharides at high temperatures[J].Journal of Agricultural and Food Chemistry, 2012, 60(3):740-748.
[18] YIN H F, BULTEMA J B, DIJKHUIZEN L, et al.Reaction kinetics and galactooligosaccharide product profiles of the β-galactosidases from Bacillus circulans, Kluyeromyces lactis and Aspergillus oryzae[J].Food Chemistry, 2017, 225:230-238.
[19] WEI W, QI D P, ZHAO H Z, et al.Synthesis and characterisation of galactosyl glycerol by β-galactosidase catalysed reerse hydrolysis of galactose and glycerol[J].Food Chemistry, 2013, 141(3):3 085-3 092.
[20] DUARTE L S, DA NATIIDADE SCHÖFFER J, LORENZONI A S G, et al.A new bioprocess for the production of prebiotic lactosucrose by an immobilized β-galactosidase[J].Process Biochemistry, 2017, 55:96-103.
[21] POTOCK E, MASTIHUBO
E, MASTIHUBO M, MASTIHUBA .Enzymatic synthesis of tyrosol glycosides[J].Journal of Molecular Catalysis B:Enzymatic, 2015, 113:23-28.
M, MASTIHUBA .Enzymatic synthesis of tyrosol glycosides[J].Journal of Molecular Catalysis B:Enzymatic, 2015, 113:23-28.
[22] NIETO-DOM NGUEZ M, DE EUGENIO L I, PE
NGUEZ M, DE EUGENIO L I, PE ALER P, et al.Enzymatic synthesis of a noel neuroprotectie hydroxytyrosyl glycoside[J].Journal of Agricultural and Food Chemistry, 2017, 65(48):10 526-10 533.
ALER P, et al.Enzymatic synthesis of a noel neuroprotectie hydroxytyrosyl glycoside[J].Journal of Agricultural and Food Chemistry, 2017, 65(48):10 526-10 533.
[23] ZHANG M, JIANG Z Q, LI L T, et al.Biochemical characterization of a recombinant thermostable β-mannosidase from Thermotoga maritima with transglycosidase actiity[J].Journal of Molecular Catalysis B:Enzymatic, 2009, 60(3-4):119-124.
[24] PARK N Y, BAEK N I, CHA J, et al.Production of a new sucrose deriatie by transglycosylation of recombinant Sulfolobus shibatae β-glycosidase[J].Carbohydrate Research, 2005, 340(6):1 089-1 096.
[25] PERCY A, ONO H, WATT D, et al.Synthesis of β-D-glucopyranosyl-(1 → 4)-D-arabinose, β-D-glucopyranosyl-(1 → 4)-L-fucose and β-D-glucopyranosyl-(1 → 4)-D-altrose catalysed by cellobiose phosphorylase from Cellibrio gilus[J].Carbohydrate Research, 1997, 305(3-4):543-548.
[26] FUKAMIZO T, HAYASHI K, TAMOI M, et al.Enzymatic hydrolysis of 1, 3-1, 4-β-glucosyl oligosaccharides by 1, 3-1, 4-β-glucanase from Synechocystis PCC6803:A comparison with assays using polymer and chromophoric oligosaccharide substrates[J].Archies of Biochemistry and Biophysics, 2008, 478(2):187-194.
[27] NAKAJIMA M, NISHIMOTO M, KITAOKA M.Characterization of β-1, 3-galactosyl-N-acetylhexosamine phosphorylase from Propionibacterium acnes[J].Applied Microbiology and Biotechnology, 2009, 83(1):109-115.
[28] NIHIRA T, SAITO Y, NISHIMOTO M, et al.Discoery of cellobionic acid phosphorylase in cellulolytic bacteria and fungi[J].FEBS Letters, 2013, 587(21):3 556-3 561.
[29] PALCIC M M.Glycosyltransferases as biocatalysts[J].Current Opinion in Chemical Biology, 2011, 15(2):226-233.
[30] MACDONALD S S, PATEL A, LARMOUR L C, et al.Structural and mechanistic analysis of a β-glycoside phosphorylase identified by screening a metagenomic library[J].Journal of Biological Chemistry, 2018, 293(9):3 451-3 467.
[31] KINO K, SATAKE R, MORIMATSU T, et al.A new method of synthesis of alkyl β-glycosides using sucrose as sugar donor[J].Bioscience, Biotechnology, and Biochemistry, 2008, 72(9):2 415-2 417.
[32] NISHIMOTO M, KITAOKA M.Practical preparation of lacto-N-biose I, a candidate for the bifidus factor in human milk[J].Bioscience, Biotechnology, and Biochemistry, 2007, 71(8):2 101-2 104.
[33] PANDEY R P, MALLA S, SIMKHADA D, et al.Production of 3-O-xylosyl quercetin in Escherichia coli[J].Applied Microbiology and Biotechnology, 2013, 97(5):1 889-1 901.
[34] THUAN N H, PARK J W, SOHNG J K.Toward the production of flaone-7-O-β-D-glucopyranosides using Arabidopsis glycosyltransferase in Escherichia coli[J].Process Biochemistry, 2013, 48(11):1 744-1 748.
[35] HSU T M, WELNER D H, RUSS Z N, et al.Employing a biochemical protecting group for a sustainable indigo dyeing strategy[J].Nature Chemical Biology, 2018, 14(3):256-261.
[36] CHOI H Y, LIM H S, PARK K H, et al.Directed eolution of glycosyltransferase for enhanced efficiency of aermectin glucosylation[J].Applied Microbiology and Biotechnology, 2021, 105(11):4 599-4 607.
[37] KIM B G, SUNG S H, AHN J H.Biological synthesis of quercetin 3-O-N-acetylglucosamine conjugate using engineered Escherichia coli expressing UGT78D2[J].Applied Microbiology and Biotechnology, 2012, 93(6):2 447-2 453.
[38] KIM H J, KIM B G, AHN J H.Regioselectie synthesis of flaonoid bisglycosides using Escherichia coli harboring two glycosyltransferases[J].Applied Microbiology and Biotechnology, 2013, 97(12):5 275-5 282.
[39] WERNER S R, MORGAN J A.Controlling selectiity and enhancing yield of flaonoid glycosides in recombinant yeast[J].Bioprocess and Biosystems Engineering, 2010, 33(7):863-871.
[40] ANTOINE T, BOSSO C, HEYRAUD A, et al.Large scale in io synthesis of globotriose and globotetraose by high cell density culture of metabolically engineered Escherichia coli[J].Biochimie, 2005, 87(2):197-203.
[41] HANCOCK S M, CORBETT K, FORDHAM-SKELTON A P, et al.Deeloping promiscuous glycosidases for glycoside synthesis:Residues W433 and E432 in Sulfolobus solfataricus β-glycosidase are important glucoside- and galactoside-specificity determinants[J].Chembiochem, 2005, 6(5):866-875.
[42] HORIKOSHI S, SABURI W, YU J, et al.Substrate specificity of glycoside hydrolase family 1 β-glucosidase AtBGlu42 from Arabidopsis thaliana and its molecular mechanism[J].Bioscience, Biotechnology, and Biochemistry, 2021, 86(2):231-245.
[43] LU L L, XU L J, GUO Y C, et al.Glycosylation of phenolic compounds by the site-mutated β-galactosidase from Lactobacillus bulgaricus L3[J].PLoS One, 2015, 10(3):e0121445.
[44] FENG H Y, DRONE J, HOFFMANN L, et al.Conerting a β-glycosidase into a β-transglycosidase by directed eolution[J].The Journal of Biological Chemistry, 2005, 280(44):37 088-37 097.
[45] TEZE D, HENDRICKX J, CZJZEK M, et al.Semi-rational approach for conerting a GH1 β-glycosidase into a β-transglycosidase[J].Protein Engineering, Design and Selection, 2013, 27(1):13-19.
[46] XUE Y M, XUE M K, XIE F, et al.Engineering Thermotoga maritima β-glucosidase for improed alkyl glycosides synthesis by site-directed mutagenesis[J].Journal of Industrial Microbiology & Biotechnology, 2021, 48(5-6):kuab031.
[47] LUNDEMO P, KARLSSON E N, ADLERCREUTZ P.Eliminating hydrolytic actiity without affecting the transglycosylation of a GH1 β-glucosidase[J].Applied Microbiology and Biotechnology, 2017, 101(3):1 121-1 131.
[48] YIN H F, PIJNING T, MENG X F, et al.Biochemical characterization of the functional roles of residues in the actie site of the β-galactosidase from Bacillus circulans ATCC 31382[J].Biochemistry, 2017, 56(24):3 109-3 118.
[49] DRONE J, FENG H Y, TELLIER C, et al.Thermus thermophilus glycosynthases for the efficient synthesis of galactosyl and glucosyl β-(1→3)-glycosides[J].European Journal of Organic Chemistry, 2005, 2005(10):1 977-1 983.
[50] PENGTHAISONG S, HUA Y L, KETUDAT CAIRNS J R.Structural basis for transglycosylation in glycoside hydrolase family GH116 glycosynthases[J].Archies of Biochemistry and Biophysics, 2021, 706:108924.