胆固醇是人体或动物细胞内产生的甾醇类脂,属于环戊烷多氢菲的衍生物,也是胆汁酸、固醇激素和维生素D产生的重要前体[1-2]。在一定水平上,胆固醇对人体十分有益,但高胆固醇血症与许多疾病有关。胆固醇在人体内的流动运输主要是基于与血液中低密度脂蛋白的结合,过量的胆固醇会沉积在动脉中,促进斑块的形成,导致动脉粥样硬化。血液中胆固醇超过200 mg/dL,有患心脏病的风险[3]。
近年来,随着人口老龄化的加速,心血管类的疾病已成为威胁人体健康的重要因素,人体摄入过多胆固醇引起疾病的风险仍然存在。因此,除了适量减少对高胆固醇食物的摄入,及时有效地对食品中的胆固醇进行检测与脱除具有重要的意义。本文综述了食品中胆固醇的检测技术,包括比色法、酶-荧光法、色谱法、近红外光谱法和电化学法,以及食品中胆固醇脱除的物理(蒸馏法、吸附法和超临界流体萃取法)、化学(沉淀法和微胶囊包合法)、生物(微生物法和酶法)技术,讨论了食品中常见的检测与脱除技术的特点、原理和应用,并对未来食品中胆固醇检测与脱除技术的发展进行了展望。
1 食品中胆固醇的检测技术
目前食品中胆固醇的检测与定量分析一直在改进完善中,胆固醇的检测技术主要有比色法、酶-荧光法、色谱法、近红外光谱法和电化学法。
1.1 比色法
比色法是以显色反应为基础,通过比较或测定有色物质浓度来间接确定待定组分含量的方法。样品中脂肪提取后,经乙醇-KOH皂化,用正己烷萃取,浓缩后加入乙酸酐,以NH4Fe(SO4)2为显色剂,用分光光度计进行胆固醇的定量。张晓儒[4]比较了比色法和气相色谱法对内蒙古家畜肉中胆固醇含量的测定,结果表明比色法测定样品中胆固醇的含量较气相色谱法高4.74%。利用传统的化学比色法测定食品中胆固醇时,食品中某些脂类也会与显色剂发生反应造成定量误差,导致测定结果偏大。马丽娜等[5]建立了一种快速测定禽蛋中胆固醇的酶比色法,胆固醇通过酶水解生成胆甾-4-烯-3-酮和H2O2,H2O2经过氧化物酶作用在4-氨基安替比林及苯酚参与下, 生成红色醌亚胺,并在波长505 nm处测定样品吸光度,确定显色时间15 min,显色温度37 ℃的最优条件下,胆固醇的检出限为1.0 mg/100 g。将纳米技术与传统的化学比色法相结合,基于铜纳米团簇的过氧化酶活性,胆固醇被催化氧化产生H2O2,以愈创木酚作为显色底物, 利用铜纳米团簇的纳米探针比色来定量牛奶中的胆固醇,检出限为5 μg/mL[6]。
传统的化学比色法方法重现性良好,但操作复杂,样品的前处理和脂肪的提取消耗时间长,溶剂消耗量大,有一定的测定误差;酶比色法无需使用有毒试剂,操作步骤简单,但需要对显色时间和显色温度进行优化;纳米探针比色法简单快速,抗干扰性强,但纳米团簇的合成与表征比较耗时。传统的化学比色法已经不适合食品中胆固醇的精准定量,酶比色法和纳米探针比色法很好地实现了对一些食品胆固醇的检测分析[5-6]。目前这些新型的比色法多应用于血清中胆固醇的快速检测[7],受限于食品基质的复杂性,在食品中的应用并不广泛。
1.2 酶-荧光法
利用胆固醇氧化酶(cholesterol oxidase, ChOx)来测定食品中总胆固醇的含量是基于酶偶联反应。20世纪70年代后,利用ChOx反应间接定量胆固醇已得到广泛应用[8]。如图1所示,胆固醇被ChOx氧化成4胆甾烯-3-酮,副产物H2O2极易被高灵敏的荧光探针检测。10-乙酰基-3,7-二羟基吩噁嗪能在辣根过氧化酶(horseradish peroxidase,HRP)的催化作用下形成H2O2存在下的荧光产物9-羟基-3-异吩噁嗪酮而被用作胆固醇的测定[9]。此外,酪胺能够作为氧化物酶的理想供氢荧光底物,利用ChOx反应间接定量胆固醇。

图1 酶-荧光法的酶偶联反应示意图
Fig.1 The scheme of the enzyme-coupled reaction of fluorometric enzymatic assay
王令臣等[10]利用H2O2在氯化血红素催化下氧化酪胺产生荧光,通过计算H2O2的量间接定量胆固醇,确定了ChOx含量28 mU/mL。氯化血红素浓度0.1 mmol/L。酪胺浓度0.7 mmol/L。反应时间15 min的最优条件,此时检测限为0.08 μmol/L,并将其应用于牛奶中胆固醇的加标检测,相对标准偏差<3.1%,回收率高达98.7%~112.7%。LARSEN[11]利用酶-荧光法测定出牛乳中的胆固醇含量为80~756 μmol/L,其原理也是胆固醇氧化分解后产生H2O2,H2O2在过氧化物酶的影响下与非荧光物质发生化学反应产生等量的荧光物质。
然而,酶-荧光法对胆固醇的测定不具有严格的选择性。ChOx也可能与其他固醇发生反应[12]。此外,样品中存在的一些化学物质(如抗坏血酸和胆红素)可能消耗H2O2,在间接测定胆固醇时发生定量误差。
1.3 色谱法
1.3.1 气相色谱法
气相色谱法(gas chromatography,GC)因选择性高,分离效果好,操作简单而用于食品中胆固醇的检测。陈月晓等[13]采用GC测定植物油中的胆固醇,该法可使植物油中的胆固醇与各类甾醇有效分离。以5α-胆甾烷为内标参照物,测得玉米油中的胆固醇含量为4.54 mg/100 g,检出限和定量限低,分别为0.3和1.0 mg/100 g。GC测定食品中的胆固醇时,为提高分析的精准度,消除实验引起的误差,常采用内标法,5α-胆甾烷为常用的内标参照物。衍生化的处理方式也会提高GC测定的准确度,通过GC结合火焰离子化检测器分析衍生化物-三甲基甲硅烷基醚来定量胆固醇。该法已被用于母乳中胆固醇的检测分析,与传统采用KOH与甲醇混合液进行皂化相比,运用脂肪酶对样品酶解,采用K2CO3-乙醇皂化法效果更好,所耗时间更少[14]。
GC的选择性与分离性也是相对的,当样品中含有的杂质较多,分离效果变差时,检测结果的误差也难以有效控制。
1.3.2 气相色谱-质谱法
质谱技术已经成为食品科学分离学科中最受欢迎的检测技术之一。相较于GC,气相色谱-质谱法(gas chromatography-mass spectrometry,GC-MS)更能准确地分离并定量动物源食品的胆固醇,且定量更准确,误差更小[15]。目前, GC-MS检测食品中胆固醇的技术日趋完善。CHEN等[16]建立了一种不经衍生化的GC-MS,测定普通植物油、鸡蛋和奶粉中的胆固醇。样品用7.5%(质量分数)KOH的乙醇进行皂化,(正己烷)∶(石油醚)=1∶1萃取,四氢呋喃定容,该法定量限为2 mg/kg,加标回收率在91%~100%。陈树东等[17]开发了一种基于固相萃取作为预处理方式的GC-MS,用来测定植物油中的胆固醇。该法采用Florisil固相萃取柱萃取,无须皂化和衍生化,其中胆固醇的检出限为0.2 mg/kg,回收率为84.5%~105.0%,适用于油类的胆固醇测定。
随着前处理条件的不断优化,食品中胆固醇的检测时间也在不断缩短。但GC-MS测定结果的准确性会受到食品基质的干扰。与GC相似,利用GC-MS测定食品中的胆固醇,采用内标法能使基质效应的影响降到最低。高灵敏度、高精密度、高选择性等优点使GC-MS成为食品中胆固醇检测的主流技术之一。
1.3.3 高效液相色谱法
基于从非皂化物中分离胆固醇的测定目的,高效液相色谱法(high performance liquid chromatography, HPLC)逐渐被应用到食品中胆固醇含量的测定。
食品中胆固醇测定的HPLC选择极性有机溶剂乙腈与甲醇、乙醇或异丙醇作为混合流动相,采用硅胶与辛基(C8)或十八烷基(C18)的合相为固定相。DANESHFAR等[18]提出了一种基于分散液-液微萃取的快速、简便、灵敏的样品制备方法,利用 HPLC测定食品中的胆固醇,检出限和定量限分别为0.01 μg/L和0.03 μg/L, 并用于牛奶、蛋黄中的胆固醇分析。张晓林等[19]针对动物源食品中含有大量的甾醇和脂肪的特点,建立了加速溶剂萃取-凝胶色谱净化的HPLC,通过凝胶色谱净化,排除了甾醇和脂肪等杂质的干扰。测定结果表明,胆固醇浓度在1.0~40.0 mg/L,相对标准偏差为3.1%~7.8%,对于富含脂类的动物源食品有较好的检测效果。
相比于传统的HPLC,超高效液相色谱法(ultra high performance liquid chromatography,UHPLC)能够有效地减少有机溶剂的消耗、缩短分析时间,且分离效果更好。ALBUQUERQUE等[20]研究发现,相较于HPLC,简单、可靠、经济和快速的UHPLC对于动物源食品基质中胆固醇含量的质量控制更好,并易于被分析实验室采用。
色谱法因具有高选择性、低检出限和高准确度的优点,将长期用于实验室中食品胆固醇的定量分析。
1.4 近红外光谱法
近红外光谱技术作为一种准确、快速和无损的质量分析技术,近年来发展迅速。目前近红外光谱技术已普遍运用到肉与肉制品的感官品质及理化指标的分析检测中[21-22],但在食品中胆固醇检测方面的研究较为有限。早期用于胆固醇定量的近红外光谱技术是基于对样品中的胆固醇的化学提取,但没有达到省时的目的。通过将近红外光谱技术与化学计量相结合,以偏最小二乘法(partial least-squares,PLS)为基础,分析模型的构建,快速定量食品中的胆固醇。研究发现,中波近红外光谱技术在60~100 mg/100 g和50~70 mg/100 g区间定量分析生鲜鸡肉和牛肉中胆固醇的效果最好,其适用于生鲜鸡肉和牛肉中胆固醇的定量分析[23-24]。CHITRA等[25]利用傅里叶变换近红外光谱结合化学计量学技术构建的二阶导数PLS模型,具有最佳性能指标。测得不同奶粉中胆固醇的含量在61.40~235.22 mg/100 g,交叉验证的均方根误差只有 1.05 mg/100 g。应用人工神经网络模型与近红外光谱技术结合也可定量胆固醇,已开发的人工神经网络可通过紫外可见-近红外光谱来区分低、中、高胆固醇值[26]。
近红外光谱技术可用于肉类、奶粉中胆固醇的定量。近红外光谱技术往往与化学计量或人工神经网络模型相结合,在相应的浓度区间对胆固醇准确定量。该技术最大的优势是快速无损,绿色环保。因此,通过定量模型的构建与优化,未来近红外光谱技术在食品中胆固醇的定量仍可作为一种常规方式。
1.5 电化学法
电化学法具有高选择性、易制样、仪器成本低、简便快速的优点,是胆固醇检测的常用方式。其中酶传感器的应用由来已久。目前,大多数利用酶传感器对胆固醇测定是基于固定在导电聚合物、金属及其氧化物纳米材料、碳纳米材料和复合型纳米材料等电极表面的ChOx的氧化反应,通过H2O2还原或氧化电流来间接定量胆固醇[27]。XIA等[28]开发了一种ChOx传感器,通过加入氧化还原介质[Fe(CN)63-]促进胆固醇氧化过程中从分析物到修饰电极的方法,检出限低至0.11 nmol/L。相较于酶电化学法,非酶传感器显示出独特的优越性。DERINA等[29]报道了一种基于1,4-二乙酰基甘脲二膦酸作为电极表面修饰剂的新型非酶传感器,表现出高稳定性和高灵敏度,胆固醇能在修饰的碳基电极上获得稳定的阳极响应,测得牛奶中胆固醇含量在15~25 mg/100 g,相对标准偏差均小于2.6。WILLYAM等[30]制备了一种灵敏、特异和小型化的非酶胆固醇传感器,如图2所示,通过利用β-环糊精与含不同浓度胆固醇溶液之间反应释放的甲基蓝电化学测量结果作输入信号间接计算胆固醇浓度,可以在0~150 μmol/L的浓度范围内实现良好的线性关系、出色的准确度和可重复性,检出限为 2.88 μmol/L。
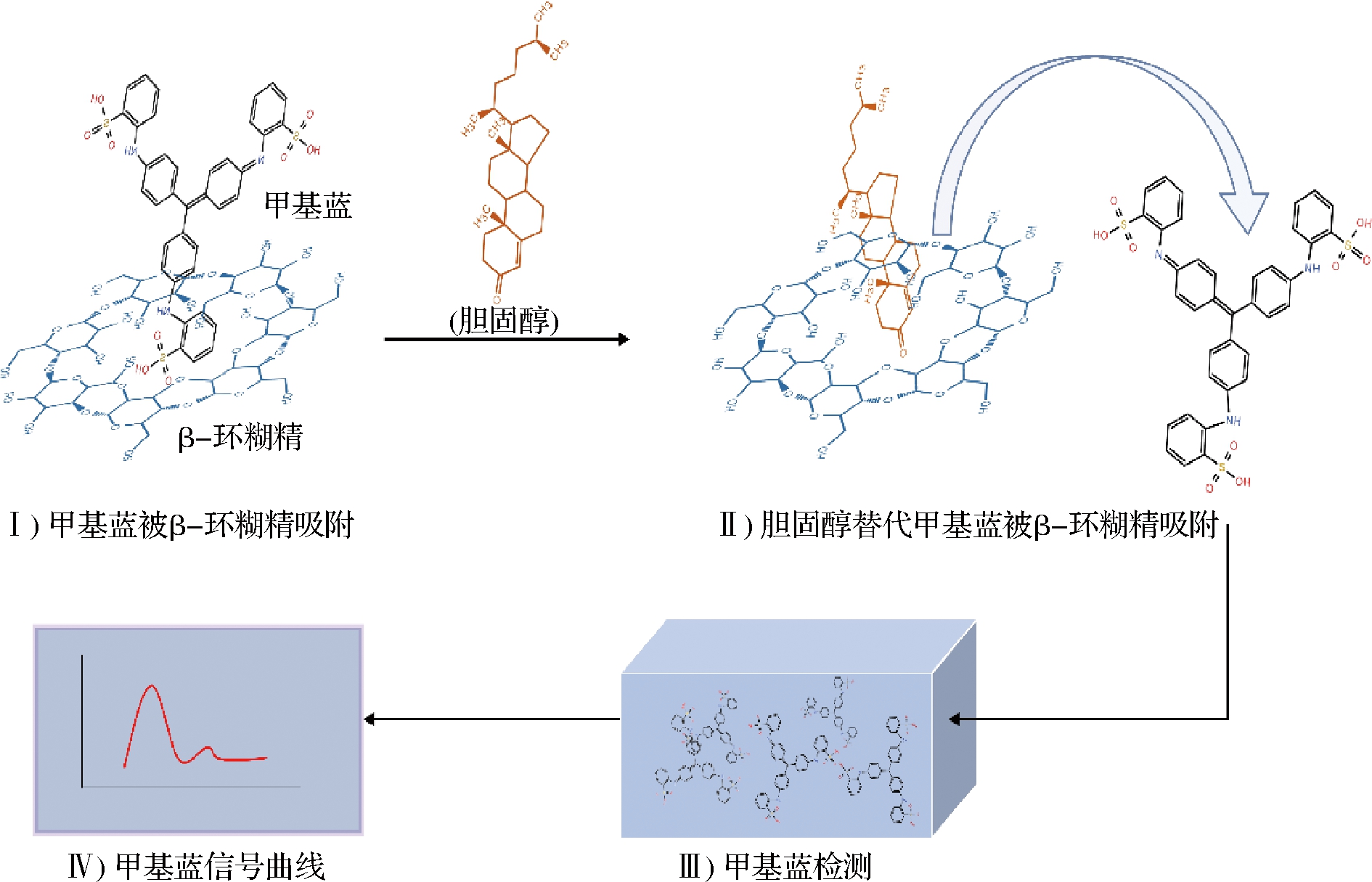
图2 利用β-环糊精的非酶电化学胆固醇检测机制
Fig.2 Non-enzymatic electrochemical cholesterol detection mechanism using β-cyclodextrin
电化学酶传感器在制备过程中,固载材料和固定方法选择尤为重要,这直接影响到传感器的性能。与酶传感器相似,非酶传感器的制备也十分依赖电极表面修饰材料的选择。目前利用电化学法主要通过收集电信号的形式来间接测定胆固醇的含量,多应用于人体的血清[31],由于食品天然基质的复杂性,电化学法在食品中胆固醇的定量检测实践不多。
迄今为止,比色法、酶-荧光法、色谱法、近红外光谱法和电化学法都在食品胆固醇的检测分析方面有所应用,表1列出了各种方法的优缺点。
表1 食品中胆固醇检测技术优缺点
Table 1 Adantages and disadantages of cholesterol detection techniques in food

检测方法优点缺点参考文献比色法操作简单,成本低,分析速度快测定误差大,对样品纯度要求很高[4-6]酶-荧光法适用于常规分析,检测限低,检测范围广选择性差,不利于复杂基质食品的检测,对环境要求严格[8-11]色谱法选择性高,分离效果好,分析速度快,需要样品少,检出限低,可用于多组分同时分析仪器成本高,优化条件复杂[13-20]近红外光谱法快速无损,绿色环保,重现性高依赖于模型的建立与优化[21-26]电化学法高选择性,易制样,仪器成本低,简便快速稳定性不高,食品适用度低,易受食品基质干扰[27-31]
传统比色法作为最经典的食品中胆固醇定量方法一直被沿用,但存在测定误差,酶比色法和纳米探针比色法逐渐被应用于胆固醇的定量。酶-荧光法虽适用于胆固醇的常规分析,但因食品基质的复杂性,酶-荧光法对胆固醇的测定选择性较差。色谱法具有选择性高,分离效果好,分析所需样品较少的特点,但色谱技术的性能更依赖于样品制备,如皂化、萃取和浓缩。近红外光谱法在食品中胆固醇的检测应用较少,对于定量模型的选择更为重要。电化学法最主要的特点在于简便快速,但酶电化学法稳定性低,温度和酸碱度等因素会影响实际工作中酶传感器的性能,而非酶传感器的主要挑战是化学修饰电极选择性。
2 食品中胆固醇的脱除技术
目前食品中胆固醇的脱除方法包括物理法(蒸馏法、吸附法和超临界流体萃取法)、化学法(沉淀法和微胶囊包合法)、生物法(微生物法和酶法)。
2.1 物理法
2.1.1 蒸馏法
目前食品中胆固醇的脱除方法包括蒸汽蒸馏法和分子蒸馏法。BOUDREAU等[32]利用真空蒸汽蒸馏实现乳脂中胆固醇的分离,在真空环境中,蒸汽通过鼓泡的形式穿过液态乳脂,可去除乳脂中93%的游离胆固醇。此法对乳脂中胆固醇的脱除率很高,但实际应用成本较高。分子蒸馏法的原理是在合理控制压强和温度的情况下,使胆固醇从蒸发液体的热表面转移到冷凝器的冷表面,此法要考虑到食品中营养物质的挥发和胆固醇氧化的问题。BERTI等[33]通过分子蒸馏技术分离乳脂中的胆固醇,并分析处理前后的乳脂感官特性,该法可除去约60%的胆固醇,可用于乳脂中胆固醇的脱除。
采用蒸馏法会导致食品中其他挥发性成分的损失。因此,如何有效地回收这些挥发性成分是蒸馏法脱除胆固醇亟待解决的问题。
2.1.2 吸附法
吸附法是利用物理吸附作用,对食品中的胆固醇进行脱除。朱林韬等[34]分析比较了6种不同的吸附剂对蚕蛹油中胆固醇的脱除效果,其中中性Al2O3的效果最明显,胆固醇的脱除率达到(38.24±2.92)%。冯艳平等[35]利用活性白土吸附鱼油中的胆固醇,在190 ℃,真空条件下吸附45 min,鱼油中胆固醇的脱除率达到72.89%。YILMAZ等[36]利用金属有机骨架对黄油和羊脂中的胆固醇进行脱除,含金属的单元与具有永久孔隙率结构的有机分子或晶体框架结合,铝-金属有机骨架和钛-金属有机骨架的降胆固醇率分别为27.45%和26.28%,不会对原样品造成危害。
近年来,分子印迹聚合物逐渐地应用于食品中胆固醇的脱除。KARTAL等[37]开发了从牛奶样品中分离胆固醇分子印迹的低温凝胶珠,具有特定的胆固醇结合位点,通过吸附牛奶中的胆固醇达到胆固醇脱除的目的,脱除率高达60%,回收率为94.3~100.3%,相对标准偏差为2.0~5.2%。这表明利用分子印迹低温凝胶珠吸附牛奶中的胆固醇能达到很好的效果。使用这些吸附材料进行吸附作用时,要同时顾及吸附材料对食品造成的安全性问题。如何减少甚至消除吸附性残留的危害,开发更绿色环保的吸附材料是未来研究的重点方向。
2.1.3 超临界流体萃取法
超临界流体萃取因良好的萃取效果广泛用于规模化生产中。如图3所示,利用超临界CO2萃取法能特定进行胆固醇的分离,并实现CO2的循环利用。同时合理地改变压力或温度能提高超临界流体的溶解能力,使得从更加复杂的化合物中分离胆固醇成为可能[38]。

图3 超临界CO2萃取胆固醇流程图
Fig.3 Flow chart of supercritical CO2 extraction of cholesterol
CHITRA等[39]研究了超临界CO2萃取对于全脂奶粉中的胆固醇脱除的影响,确定在68 ℃,20.7 MPa的条件下,静态时间40 min,动态时间2 h,流速6 L/min时,胆固醇降低约55.8%,且全脂奶粉中的有益成分不会减少。有研究表明,相较于超临界CO2,对于某些卵粉的胆固醇溶解性在超临界四氟乙烷中要好[40]。DEY PAUL等[41]采用乙醇作为共溶剂的超临界CO2从全脂奶粉中提取胆固醇,采用响应面法优化工艺参数,在48 ℃、17 MPa和31 mL共溶剂的优化条件下,胆固醇降低了约46%。同时全脂奶粉的脂肪含量、溶解指数和透光率限值分别为183.67 g/kg、96.3%和96.90%,对理化性质变化影响不大。
超临界流体萃取法可对特定食品中的胆固醇进行脱除,通过优化调节超临界流体的温度、压力、密度和流量等参数,能不断提高胆固醇的脱除率。
2.2 化学法
2.2.1 沉淀法
研究表明,植物中的皂苷可脱除奶油中胆固醇[42]。皂苷可以与胆固醇相互作用,形成胆固醇-皂苷复合物。65 ℃混合1 h后,通过硅藻土过滤并洗涤可使奶油中的胆固醇减少80%,且不会对奶油产生不良影响。海星中也存在有胆固醇结合能力的皂苷,最高结合胆固醇达33%,对食品中的胆固醇的脱除有着重要意义[43]。RAJU等[44]研究了在不同条件下,利用皂苷和硅藻土联合去除凡纳滨对虾头胸部脂质中的胆固醇,在脂质与皂苷质量比1∶6并混合20倍体积50%乙醇的条件下,胆固醇去除率达到(88.77±0.18)%。
沉淀法所用的天然皂苷可以从人参或者文冠果叶中提取得到[45],其易与胆固醇结合,具有良好的降胆固醇的功效,优化皂苷的提取与寻找有效天然的沉淀材料将有助于这项技术的发展。
2.2.2 微胶囊包合法
微胶囊包合法的原理是某些具有胆固醇选择性的高分子化合物与胆固醇相结合,形成稳定的包合复合物,利用特定的分离技术,将复合物从原有的食品体系中分离出来。
目前应用最多的微胶囊是β-环糊精(β-cyclodextrin,β-CD),利用β-CD对胆固醇的包合作用进行胆固醇脱除的应用十分广泛。β-CD是由β-1, 4-糖苷键连接的截锥晶形结构的环状寡糖,对胆固醇等非极性分子有亲和力,因此β-CD可以与胆固醇形成非共价的主客体包合物。β-CD无毒、不吸湿、具有良好的化学稳定性和可食用性[46]。刘琳等[47]利用β-CD对牛油中胆固醇的脱除工艺进行了优化,胆固醇脱除率可达到(47±1.83)%,且对牛油感官品质的影响较小。JIA等[48]开发合成了一种基于玉米蛋白与β-CD为主体的玉米蛋白-接枝-β-CD薄膜(图4)。这种薄膜有良好的胆固醇吸附能力,最大吸附量达(5.70±0.56)mg/g,在3次重复使用后仍然保持(3.10±0.89)mg/g的吸附能力,采用蛋白酶与淀粉酶混合形成的复合酶1周内降解率达到98.81%。在未来的食品工业中,基于β-CD作为吸附剂对食品中胆固醇脱除的良好效果,以β-CD为主体与某些化合物结合使用将是食品中胆固醇脱除的重要发展方向。

a-薄膜的合成;b-薄膜吸附胆固醇与酶降解
图4 玉米蛋白-接枝-β-CD薄膜的合成、吸附胆固醇的过程与酶降解[48]
Fig.4 Synthesis, adsorption of cholesterol and enzyme degradation of zein-graft-β-CD film[48]
2.3 生物法
2.3.1 微生物法
研究表明,许多微生物都具有转化降解胆固醇的能力,如乳杆菌属[49-50]、双歧杆菌属[51]等。乳酸菌降解胆固醇主要机制的争论在于乳酸菌对胆固醇的共沉淀作用与吸收作用。酵母菌主要通过产生的胆盐水解酶与胆固醇的共沉淀作用以及酵母菌细胞壁上的膳食纤维对胆固醇进行吸收。郭晶晶等[49]从天然发酵豆酱样品中筛选出的3株乳酸菌对胆固醇的降解率分别为34.56%、27.12%和29.20%。王成涛等[52]利用筛选出的红球菌和短杆菌脱除2种鲜肉糜中胆固醇,脱除率分别为40.5%和41.3%,并将其产生的粗酶液应用于实际香肠制作中,降胆固醇效果明显,食品风味保持良好。
用于食品中胆固醇脱除的微生物最好是从同类型食品中筛选出来,并且尽可能避免对食品的营养与感官品质造成影响。尽管如此,考虑到微生物的来源与种类不同,微生物本身的代谢活动也会影响胆固醇的降解,微生物对胆固醇的降解均建立在实验研究的角度,在实际中微生物脱除食品中胆固醇应用并不广泛。
2.3.2 酶法
相比于直接利用微生物降解胆固醇,多数研究更倾向于将微生物产生的酶进行分离纯化再直接作用于胆固醇的降解。KHIRALLA等[53]从羊肉中筛选出14种乳酸菌,从中分离纯化的ChOx能对肉汤中90%的胆固醇进行降解。JITPAKDEE等[54]将从发酵食品中筛选出的2种乳酸菌共同培养,产出的ChOx能有效地降低牛奶中的胆固醇(10.98±3.80)%。除了胆固醇氧化物酶,从细菌和植物叶子中能够提取的胆固醇还原酶,可将牛奶、奶油、碎牛肉和猪肉中的胆固醇转化为粪甾烷醇,达到胆固醇脱除的作用。
目前利用微生物降解能力对食品中胆固醇的脱除没有在食品商业运作中得到推广。从微生物中分离出ChOx的方法早已经建立,胆固醇还原酶也可通过分离纯化得到,但基于胆固醇氧化与还原产物的安全性问题始终没有定论。目前研究者们也在积极寻找具有胆固醇降解能力的微生物及相关酶。
不同食品中胆固醇的脱除技术都有优势和局限性(表2)。物理法中的蒸馏法和化学法脱除率高,但会造成食品中部分成分的损失;超临界流体萃取法和微胶囊包合法适合工业化生产;生物法还处于实验研究阶段。目前大多数胆固醇脱除技术更适用于液体类的食品,如油脂、牛奶、奶油,蛋黄等,固体类食品中胆固醇脱除的技术并不成熟。从实际食品加工来看,低胆固醇食品的开发和胆固醇的脱除需要有配套的技术。目前,保持食品原有风味是胆固醇脱除所面临的挑战。
表2 食品中胆固醇脱除技术优缺点
Table 2 Adantages and disadantages of cholesterol remoal techniques in food

脱除方法优点缺点参考文献物理法蒸馏法脱除率高条件苛刻,造成其他成分损失[32-33]吸附法操作简单吸附剂残留[34-37]超临界流体萃取法安全无毒,萃取能力强对设备要求高[38-41]化学法沉淀法脱除率高,保质性好沉淀原料少[42-45]微胶囊包合法脱除率高,稳定性好,可重复利用造成部分脂类损失[46-48]生物法微生物法成本低降解率低,微生物代谢产物影响食品风味[49-52]酶法转化率高易分解失活[53-54]
3 总结与展望
随着经济社会的不断发展,人们对食品营养的要求也逐渐提高,低胆固醇食品的开发有着十分广阔的发展前景,因此对现有技术进行创新是适应未来发展的必由之路。本文系统地阐述了食品中胆固醇的检测及脱除技术的应用,总结了各种技术的优势和局限性。
传统比色法的测定误差较大,不适合胆固醇的精准定量,新型比色法与酶荧光法均利用胆固醇水解酶产生H2O2来间接定量胆固醇,多应用于血清、牛奶等液体样品中胆固醇的检测。由于食物天然基质的复杂性,近红外光谱法和电化学法测定食品中的胆固醇的应用有限。色谱法因具有选择性高、分离效果好、分析所需样品较少的特点,是目前食品中胆固醇检测最主流的方法。色谱法应用广泛,不仅可以定量牛奶、动物油以及蛋黄液等液体样品中的胆固醇,各类动物组织肉、水产品中的胆固醇都可采用色谱法进行分离定量。针对未来食品中胆固醇的检测,色谱法仍是最受欢迎的检测技术,尤其是GC-MS和HPLC。建立一套针对不同类型食品的检测体系势在必行,可以更加快速、准确地对食品中的胆固醇进行检测定量。
特定食品中胆固醇脱除符合未来人们对食品安全的要求。从目前脱除技术的特点来看,微胶囊包合法和超临界流体萃取法可大规模应用于商业性胆固醇的脱除。以β-CD为主的微胶囊包合法和以CO2为主的超临界流体萃取法可使鲜奶、稀奶油、蛋黄液中胆固醇得以脱除,为生产低胆固醇奶、低胆固醇奶油(奶油粉)以及低胆固醇蛋黄粉奠定了坚实的基础。β-CD法的应用也为我国乳制品的生产提出了新的方向,而超临界CO2流体萃取法也成为乳制品中胆固醇脱除的重要手段,可以通过研究超临界流体萃取法的工业化工艺降低其对试剂的限制。目前研究者们也在积极寻找能提取出具有胆固醇降解能力的微生物及相关酶,这必然会推动这项技术的发展。未来可通过多种胆固醇脱除技术的结合,构建高效、绿色、经济和保质的联合脱除技术,以满足实际食品生产的需要。
[1] FARIDI K F, LUPTON J R, MARTIN S S, et al.itamin D deficiency and non-lipid biomarkers of cardioascular risk[J].Archies of Medical Science:AMS, 2017, 13(4):732-737.
[2] BOYER J L, SOROKA C J.Bile formation and secretion:An update[J].Journal of Hepatology, 2021, 75(1):190-201.
[3] LIU C Q, ZHANG Y, DING D, et al.Cholesterol efflux capacity is an independent predictor of all-cause and cardioascular mortality in patients with coronary artery disease:A prospectie cohort study[J].Atherosclerosis, 2016, 249:116-124.
[4] 张晓儒. 内蒙古家畜肉胆固醇含量测定及两种检测方法比较[D].呼和浩特:内蒙古农业大学, 2017.
ZHANG X R.Determination on cholesterol of Inner Mongolian domestic animal meats and comparison of two detection method[D].Hohhot:Inner Mongolia Agricultural Uniersity, 2017.
[5] 马丽娜, 葛庆联, 陈大伟, 等.酶比色法测定禽蛋中的胆固醇含量[J].食品安全质量检测学报, 2017, 8(8):2 880-2 884.
MA L N, GE Q L, CHEN D W, et al.Determination of cholesterol in eggs by enzyme colorimetry[J].Journal of Food Safety & Quality, 2017, 8(8):2 880-2 884.
[6] 刘迪, 尚华.基于铜纳米团簇的纳米探针比色法检测牛奶中胆固醇含量[J].食品科学, 2014, 35(12):143-147.
LIU D, SHANG H.Copper nanoclusters-based nanoprobes for colorimetric detection of cholesterol in milk[J].Food Science, 2014, 35(12):143-147.
[7] HONG C Y, ZHANG X X, WU C Y, et al.On-site colorimetric detection of cholesterol based on polypyrrole nanoparticles[J].ACS Applied Materials & Interfaces, 2020, 12(49):54 426-54 432.
[8] SU L, YU X N, CAI Y X, et al.Ealuation of fluorogenic substrates for Ni/Co LDHs peroxidase mimic and application for determination of inhibitory effects of antioxidant[J].Analytica Chimica Acta, 2017, 987:98-104.
[9] AMUNDSON D M, ZHOU M J.Fluorometric method for the enzymatic determination of cholesterol[J].Journal of Biochemical and Biophysical Methods, 1999, 38(1):43-52.
[10] 王令臣, 洪诚毅, 黄志勇.基于氯化血红素模拟酶活性的荧光分析法检测牛奶中胆固醇含量[J].中国食品学报, 2021, 21(5):363-368.
WANG L C, HONG C Y, HUANG Z Y.Fluorescence detection of cholesterol in milk based on hemin as peroxidase mimetic[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(5):363-368.
[11] LARSEN T.Enzymatic-fluorometric quantification of cholesterol in boine milk[J].Food Chemistry, 2012, 135(3):1 261-1 267.
[12] XU D, LI C, ZI Y, et al.MOF@MnO 2 nanocomposites prepared using in situ method and recyclable cholesterol oxidase-inorganic hybrid nanoflowers for cholesterol determination[J].Nanotechnology, 2021, 32(31):315502.
[13] 陈月晓, 何涛, 唐凌轩, 等.气相色谱法同时测定食品中的胆固醇和植物甾醇[J].食品科学, 2016, 37(14):180-183.
CHEN Y X, HE T, TANG L X, et al.Simultaneous determination of cholesterol and phytosterol in foods by gas chromatography[J].Food Science, 2016, 37(14):180-183.
[14] BEGGIO M, CRUZ-HERNANDEZ C, GOLAY P A, et al.Quantification of total cholesterol in human milk by gas chromatography[J].Journal of Separation Science, 2018, 41(8):1 805-1 811.
[15] 应璐, 张书芬, 邢家溧, 等.快速皂化-气相色谱-串联质谱法同时测定乳粉中胆固醇和维生素E 4种异构体[J].色谱, 2020, 38(11):1 340-1 347.
YING L, ZHANG S F, XING J L, et al.Determination of cholesterol and itamin E isomers in milk powder by gas chromatography-tandem mass spectrometry coupled with rapid saponification[J].Chinese Journal of Chromatography, 2020, 38(11):1 340-1 347.
[16] CHEN Y Z, KAO S Y, JIAN H C, et al.Determination of cholesterol and four phytosterols in foods without deriatization by gas chromatography-tandem mass spectrometry[J].Journal of Food and Drug Analysis, 2015, 23(4):636-644.
[17] 陈树东, 林晓佳, 吴钟玲, 等.固相萃取-气相色谱-质谱联用法测定植物油中的胆固醇和4种植物甾醇[J].中国油脂, 2016, 41(7):94-98.
CHEN S D, LIN X J, WU Z L, et al.Determination of cholesterol and four phytosterols in egetable oil by solid phase extraction and GC-MS[J].China Oils and Fats, 2016, 41(7):94-98.
[18] DANESHFAR A, KHEZELI T, LOTFI H J.Determination of cholesterol in food samples using dispersie liquid-liquid microextraction followed by HPLC-U[J].Journal of Chromatography B, 2009, 877(4):456-460.
[19] 张晓林, 曲世超, 黄大亮, 等.加速溶剂萃取-凝胶色谱净化高效液相色谱法测定动物源性食品中的胆固醇[J].化学通报, 2015, 78(3):281-284.
ZHANG X L, QU S C, HUANG D L, et al.Determination of cholesterol in animal originated food using accelerated solent extraction and gel permeation chromatography purification with high performance liquid chromatography[J].Chemistry, 2015, 78(3):281-284.
[20] ALBUQUERQUE T G, OLIEIRA M B P P, SANCHES-SILA A, et al.Cholesterol determination in foods:Comparison between high performance and ultra-high performance liquid chromatography[J].Food Chemistry, 2016, 193:18-25.
[21] 王新怡, 杨鸿博, 张一敏, 等.肉类品质快速无损分析技术的研究进展[J].食品与发酵工业, 2021, 47(11):279-286.
WANG X Y, YANG H B, ZHANG Y M, et al.Progress of rapid non-inasie meat quality analysis technology[J].Food and Fermentation Industries, 2021, 47(11):279-286.
[22] 褚小立, 陈瀑, 李敬岩, 等.近红外光谱分析技术的最新进展与展望[J].分析测试学报, 2020, 39(10):1 181-1 188.
CHU X L, CHEN P, LI J Y, et al.Progresses and perspecties of near infrared spectroscopy analytical technology[J].Journal of Instrumental Analysis, 2020, 39(10):1 181-1 188.
[23] 王辉, 田寒友, 张顺亮, 等.基于中波近红外光谱构建生鲜鸡肉胆固醇定量分析模型[J].食品科学, 2016, 37(20):134-140.
WANG H, TIAN H Y, ZHANG S L, et al.Establishment of quantitatie analysis model of chicken cholesterol based on medium-waelength near-infrared spectroscopy[J].Food Science, 2016, 37(20):134-140.
[24] 王辉, 田寒友, 张顺亮, 等.基于中波近红外光谱定量分析生鲜牛肉胆固醇[J].食品科学, 2016, 37(24):185-189.
WANG H, TIAN H Y, ZHANG S L, et al.Quantitatie analysis of cholesterol in fresh beef based on medium-waelength NIR spectroscopy[J].Food Science, 2016, 37(24):185-189.
[25] CHITRA J, GHOSH M, MISHRA H N.Rapid quantification of cholesterol in dairy powders using Fourier transform near infrared spectroscopy and chemometrics[J].Food Control, 2017, 78:342-349.
[26] PUERTAS G,  ZQUEZ M.U-IS-NIR spectroscopy and artificial neural networks for the cholesterol quantification in egg yolk[J].Journal of Food Composition and Analysis, 2020, 86:103350.
ZQUEZ M.U-IS-NIR spectroscopy and artificial neural networks for the cholesterol quantification in egg yolk[J].Journal of Food Composition and Analysis, 2020, 86:103350.
[27] 范佳琳, 王新宇, 陈雪, 等.胆固醇电化学生物传感器的研究与进展[J].分析试验室, 2021, 40(6):736-744.
FAN J L, WANG X Y, CHEN X, et al.Research and deelopment of electrochemical biosensor for cholesterol[J].Chinese Journal of Analysis Laboratory, 2021, 40(6):736-744.
[28] XIA T Z, LIU G Y, WANG J J, et al.MXene-based enzymatic sensor for highly sensitie and selectie detection of cholesterol[J].Biosensors and Bioelectronics, 2021, 183:113243.
[29] DERINA K, KOROTKOA E, TAISHIBEKOA Y, et al.Electrochemical nonenzymatic sensor for cholesterol determination in food[J].Analytical and Bioanalytical Chemistry, 2018, 410(20):5 085-5 092.
[30] WILLYAM S J, SAEPUDIN E, IANDINI T A.Β-cyclodextrin/Fe3O4 nanocomposites for an electrochemical non-enzymatic cholesterol sensor[J].Analytical Methods:Adancing Methods and Applications, 2020, 12(27):3 454-3 461.
[31] KHALIQ N, RASHEED M A, KHAN M, et al.oltage-switchable biosensor with gold nanoparticles on TiO 2 nanotubes decorated with CdS quantum dots for the detection of cholesterol and H2O2[J].ACS Applied Materials & Interfaces, 2021, 13(3):3 653-3 668.
[32] BOUDREAU A, ARUL J.Cholesterol reduction and fat fractionation technologies for milk fat:An oeriew[J].Journal of Dairy Science, 1993, 76(6):1 772-1 781.
[33] BERTI J, GROSSO N R, FERNANDEZ H, et al.Sensory quality of milk fat with low cholesterol content fractioned by molecular distillation[J].Journal of the Science of Food and Agriculture, 2018, 98(9):3 478-3 484.
[34] 朱林韬, 彭展彬, 曾艺涛, 等.降低蚕蛹油中胆固醇的方法研究[J].食品工业科技, 2014, 35(13):219-223.
ZHU L T, PENG Z B, ZENG Y T, et al.Methods for the reduction of cholesterol in silkworm chrysalis oil[J].Science and Technology of Food Industry, 2014, 35(13):219-223.
[35] 冯艳平, 张海, 王勇, 等.活性白土吸附脱除鱼油中胆固醇的工艺研究[J].中国油脂, 2013, 38(11):7-10.
FENG Y P, ZHANG H, WANG Y, et al.Remoal of cholesterol from fish oil by actiated clay adsorption[J].China Oils and Fats, 2013, 38(11):7-10.
[36] YILMAZ E,  ENEL E, OK S.Cholesterol remoal by selected metal-organic frameworks as adsorbents[J].Journal of Food Science and Technology, 2020, 57(1):173-181.
ENEL E, OK S.Cholesterol remoal by selected metal-organic frameworks as adsorbents[J].Journal of Food Science and Technology, 2020, 57(1):173-181.
[37] KARTAL F, DENIZLI A.Molecularly imprinted cryogel beads for cholesterol remoal from milk samples[J].Colloids and Surfaces B:Biointerfaces, 2020, 190:110860.
[38] GHOSH M, SRIASTAA SHUBHANGI C J, MISHRA H N.Adent of clean and green technology for preparation of low-cholesterol dairy cream powder:Supercritical fluid extraction process[J].Food Quality and Safety, 2018, 2(4):205-211.
[39] CHITRA J, DEB S, MISHRA H N.Selectie fractionation of cholesterol from whole milk powder:Optimisation of supercritical process conditions[J].International Journal of Food Science & Technology, 2015, 50(11):2 467-2 474.
[40] SUI X, FENG X M, YUE R Y, et al.Optimization of subcritical 1, 1, 1, 2-tetrafluoroethane(R134a) remoal of cholesterol from spray-dried Sthenoteuthis oualaniensis egg powder using response surface methodology[J].Adanced Materials Research, 2014, 1 033-1 034:717-723.
[41] DEY PAUL I, JAYAKUMAR C, NIWAS MISHRA H.Optimization of process parameters for supercritical fluid extraction of cholesterol from whole milk powder using ethanol as co-solent[J].Journal of the Science of Food and Agriculture, 2016, 96(15):4 885-4 895.
[42] RICCOMINI M, WICK C, PETERSON A, et al.Cholesterol remoal from cream and anhydrous butter fat using saponins[J].Journal of Dairy Science, 1990, 73(1):107.
[43] SHARMIN F, KOYAMA T, KOYAMA H, et al.Cholesterol-binding ability of saponin from Japanese starfish[J].Journal of Food Science and Technology, 2021, 58(8):3 056-3 064.
[44] RAJU N, BENJAKUL S.Application of saponin for cholesterol remoal from Pacific white shrimp (Litopenaeus annamei) lipid[J].European Journal of Lipid Science and Technology, 2020, 122(8):2000078.
[45] 邱悦, 潘佳, 沈明浩.文冠果叶总皂苷的提取工艺优化及减肥降脂功效[J].西北农林科技大学学报(自然科学版), 2020, 48(11):113-122;132.
QIU Y, PAN J, SHEN M H.Extraction process optimization of total saponins from leaes of Xanthoceras sorbifolia Bunge and the effect on weight loss and lipid-lowering[J].Journal of Northwest A & F Uniersity (Natural Science Edition), 2020, 48(11):113-122;132.
[46] DUMU![]() A A, MIHALI C, BERINDE Z, et al.Milk cholesterol reduction at pilot station leel using beta-cyclodextrin[J].Bulletin of Uniersity of Agricultural Sciences and eterinary Medicine Cluj-Napoca Food Science and Technology, 2020, 77(2):82.
A A, MIHALI C, BERINDE Z, et al.Milk cholesterol reduction at pilot station leel using beta-cyclodextrin[J].Bulletin of Uniersity of Agricultural Sciences and eterinary Medicine Cluj-Napoca Food Science and Technology, 2020, 77(2):82.
[47] 刘琳, 谢勇, 刘越, 等.低胆固醇牛油的制备及其理化性质分析[J].食品与发酵工业, 2020, 46(22):187-195.
LIU L, XIE Y, LIU Y, et al.Preparation and physicochemical properties of low cholesterol tallow[J].Food and Fermentation Industries, 2020, 46(22):187-195.
[48] JIA X M, YANG N, QI X C, et al.Adsorptie remoal of cholesterol by biodegradable zein-graft-β-cyclodextrin film[J].International Journal of Biological Macromolecules, 2020, 155:293-304.
[49] 郭晶晶, 张鹏飞, 曹承旭, 等.自然发酵豆酱中降胆固醇乳酸菌的筛选鉴定及对大鼠血清胆固醇的影响[J].食品与发酵工业, 2019, 45(2):15-24.
GUO J J, ZHANG P F, CAO C X, et al.Cholesterol-lowering lactic acid bacteria isolated from the naturally fermented soybean sauces and their effects on serum cholesterol leels in rats[J].Food and Fermentation Industries, 2019, 45(2):15-24.
[50] 刘江, 程群, 王振兴, 等.云南乳饼中乳酸菌的筛选及其功能活性[J].食品与发酵工业, 2020, 46(4):160-166.
LIU J, CHENG Q, WANG Z X, et al.Screening and functional actiity of lactic acid bacteria in Yunnan milk cake[J].Food and Fermentation Industries, 2020, 46(4):160-166.
[51] WANG G Q, CHEN X, WANG L F, et al.Dierse conditions contribute to the cholesterol-lowering ability of different Lactobacillus plantarum strains[J].Food & Function, 2021, 12(3):1 079-1 086.
[52] 王成涛, 籍保平, 牛天贵, 杨宏志.高效降解胆固醇菌株的筛选及其在食品中的应用[J].中国食品学报, 2005, 5(3):52-56.
WANG C T, JI B P, NIU T G, et al.Highly efficient cholesterol-degrading bacterium separating and screening and their application in food key LabI[J].Journal of Chinese Institute of Food Science and Technology, 2005, 5(3):52-56.
[53] KHIRALLA G M.Cholesterol degradation by some bacteria isolated from food[J].Food Science and Technology Research, 2015, 21(5):685-693.
[54] JITPAKDEE J, KANTACHOTE D, KANZAKI H, et al.Selected probiotic lactic acid bacteria isolated from fermented foods for functional milk production:Lower cholesterol with more beneficial compounds[J].LWT, 2021, 135:110061.