人参植物的主要活性成分是人参皂苷,在人参植物中已发现了超过150种的人参皂苷[1-2]。人参皂苷Rc是人参植物中主要皂苷之一,在人参和西洋参中的含量丰富,其中人参和西洋参根总皂苷中的Rc质量分数达12%~17%,茎叶总皂苷中Rc质量分数达5%~9%[3-4]。人参皂苷Rc具有抗炎、抗氧化、抗肿瘤、调节血脂、预防糖尿病和保护神经系统的药理功能[5-6],但其人体吸收率低,生理活性弱[7-8]。研究表明,人参皂苷生理活性与人参皂苷分子糖基数量有关,皂苷糖基数量越少其皂苷人体吸收率越高,生物利用度和药理活性越高[8-12]。人参皂苷Rc分子有3-O-β-D-Glc-(1-2)-β-D-Glc和20-O-α-L-Araf-(1-6)-β-D-Glc等4个糖基,因此,Rc药理活性低于3个糖基的稀有皂苷C-Mc1及2个糖基的稀有皂苷C-Mc[8,13]。而人参皂苷C-Mc和C-Mc1在人参、西洋参等人参植物中几乎不存在[4,13],因此将人参中含量高的Rc皂苷转化为稀有皂苷C-Mc1和C-Mc,将会大大提高Rc的生物利用度,对人参类制品和药物的开发具有重要意义。
为了得到稀有人参皂苷C-Mc1和C-Mc,UPADHYAYA等[14]从Armillaria mellea菌丝中分离筛选出能水解β-葡萄糖苷的酶,该酶分子质量为121.5 kDa,能将人参皂苷Rc转化为C-Mc和C-Mc1,但大量制备的可行性有待于进一步研究验证。课题组曾用Aspegillus niger g.848发酵得到人参皂苷酶I型并利用该酶将一些二醇类人参皂转化为稀有皂苷C-Mc、C-Y、F2和C-K[15-16],但其产物分离工序复杂且没有制备C-Mc1。TEN等[17]利用Sphingopyxis sp.BG97转化制备了稀有皂苷C-Mc1,但没有制备C-Mc。本课题组在前期的研究中,筛选到Terrabacter ginsenosidimutans菌能产人参皂苷酶,调取到该酶基因,转化至Escherichia coli上,表达得到人参皂苷酶。进一步的研究表明,该酶能水解Rb1和Rb2等人参二醇皂苷的3-O-葡萄糖基,生成Gyp17、Gyp75、C-O和C-Y等稀有皂苷[18-19]。本文主要研究了基因工程菌产人参皂苷3-O-β-D-葡萄糖苷酶的性质,系统研究了该酶水解人参皂苷Rc的3-O-β-D-葡萄糖基催化特性,建立了酶转化制备C-Mc1和C-Mc的方法,以期为今后人参成分的保健食品、化妆品和人参药物开发,提供新原料稀有人参皂苷,也为其产业化提供依据。
1 材料与方法
1.1 材料与仪器
人参皂苷标准品C-K、Rc、Rh2、C-Mc1和C-Mc,成都乐科技有限公司;薄层色谱硅胶板,杭州禾慧化工有限公司;克隆用试剂盒EzCloning Kit和pGEX 4T-1(GST基因融合载体),韩国Enzynomics公司。
Waters 2695色谱仪,美国Waters公司;Unitary C18柱(5 μm,Φ3 mm×250 mm),华谱新创科技有限公司;蛋白色谱柱TOSOH TSK-Gel-2000 SW(Φ7.8 mm×300 mm),日本TOSOH生物科学公司。
1.2 实验方法
1.2.1 酶的制备与纯化
将T.ginsenosidimutans(Gsoil 308 2T)的人参皂苷3-O-β-D-葡萄糖苷酶DNA片段(bgpA,1 947 bp),利用EzCloning Kit试剂盒,插入于pGEX 4T-1(GST基因融合载体),形成GST-bgpA 融合基因,再转入E.coli C41(DE3)细胞表达,其细胞在LB-氨苄青霉素培养基中40 ℃培养到OD600=0.6时加入0.5 mmol/L的IPTG诱导蛋白表达(20 ℃,12 h)。冷冻离心收集细胞,用磷酸钠缓冲液(含5 mmol/L的EDTA和体积分数1%的Triton X-100)洗涤后将细胞悬浮于0.05 mol/L的pH 7.0磷酸钠缓冲液中,用超声波破碎法破碎细胞,离心除去不溶物。上清液经谷胱甘肽-Sepharose 4B柱分离得到了带有GST标签的融合蛋白,用凝血酶处理切割GST标签,得到以包涵体形式表达的目的蛋白(原体冻干粉)。
将上述克隆表达的目的蛋白冻干粉200 mg与尿素14.4 g, 10 μL巯基乙醇和30 mL磷酸缓冲液(pH 7.0,0.02 mol/L)混合,常温下轻微摇晃2 h使包涵体被充分溶解,再加入1.2 L磷酸缓冲液(含有体积分数5%的甘油、0.5 g/L聚乙二醇、体积分数0.003 7%巯基乙醇、0.1 g/L NaCl)混合均匀,待恢复酶蛋白空间结构后即为粗酶液,4 ℃保存待用。
上述粗酶液经通过Capto Q阴离子交换层析[20]分离纯化,得到人参皂苷3-O-β-D-葡萄糖苷酶。通过HPLC和SDS-PAGE法检测确定其为纯酶,酶的分子质量测定以标准蛋白的分子质量为依据,SDS-PAGE法测定。
人参皂苷3-O-β-D-葡萄糖苷酶对人参皂苷Rc的催化反应:将0.2 mL 4 g/L的人参皂苷Rc与0.2 mL的酶液混合(pH 5.0),在40 ℃分别反应6、16、36 h,采用HPLC方法检测,计算底物和产物含量比例。酶活力定义为最适反应条件下,每小时水解1 mmol底物所需酶量为1个酶活力单位。
1.2.2 纯酶的最适pH和最适温度
取0.1 mL 4 g/L的人参皂苷Rc溶液在不同pH的磷酸缓冲液体系下与等体积纯酶反应,在40 ℃下反应6 h后经薄层色谱(thin-layer chromatography,TLC)检测,以pH为横坐标,相对酶活力为纵坐标作图,确定最适pH。
取0.1 mL 4 g/L的人参皂苷Rc溶液(pH 7.0)在不同温度下与等体积纯酶反应6 h,TLC检测相对酶活力,以温度为横坐标,相对酶活力为纵坐标作图,确定酶的最适温度。
1.2.3 酶反应动力学
上述人参皂苷3-O-β-D-葡萄糖苷酶米氏常数Km和最大酶反应速度max测定:配制浓度为10、13.3、20、26.7、40 mmol/L的人参皂苷Rc溶液,在40 ℃分别反应0.5、1、1.5、2、2.5 h;其反应液经HPLC分析,计算底物减少初速度,建立1/S对1/曲线(Linweaer-Burk plots)[21],得到Km和m值,其米氏方程如公式(1)所示:
![]()
(1)
1.2.4 底物浓度和时间对粗酶反应的影响
用pH 7.0磷酸缓冲液配制0.2 mL的质量浓度为10、20、50、100 g/L的人参皂苷Rc溶液,与等体积粗酶液混合,使最终人参皂苷Rc质量浓度为5、10、25、50 g/L,40 ℃反应24 h。TLC检测人参皂苷Rc的转化,确定最佳底物浓度。
取0.2 mL 10 g/L的人参皂苷Rc溶液与等体积酶液在40 ℃下分别反应3、12、24、40、60 h,TLC检测人参皂苷Rc的转化,确定最佳反应时间。
1.2.5 利用粗酶制备稀有皂苷C-Mc和C-Mc1
C-Mc的制备:将8 g人参皂苷Rc在最佳条件下与粗酶反应60 h,然后在预先装好的AB-8大孔树脂柱上过柱,待皂苷都吸附在树脂后用去离子水洗去蛋白和糖类,然后用体积分数90%的乙醇将皂苷全部洗脱下来,再经D-280树脂脱色,过滤旋蒸后得到C-Mc单体皂苷。
C-Mc1的制备:在粗酶最佳转化条件下,将40 g人参皂苷Rc与粗酶反应24 h,然后经AB-8大孔树脂柱纯化和D-280树脂脱色,得到C-Mc1和C-Mc的混合品,其混合品经硅胶柱分离,得到C-Mc1和C-Mc单体产物。
硅胶柱层析:将混合皂苷用工业甲醇溶解,可加入少量氯仿促进溶解,加入样品质量2.5倍的80~100目硅胶,不断搅拌蒸干,碾碎后即为样品胶。将15倍样品质量的300~400目分离胶均匀装在柱内压实,下端用脱脂棉塞紧。样品胶均匀铺在分离胶上,并用3层脱脂棉覆盖压实,然后用氯仿-甲醇洗脱液洗脱,柱的下端放置100 mL三角瓶接取洗脱液,每瓶洗脱液都经TLC检测确定其中皂苷种类。
1.2.6 检测方法
TLC检测:根据点样的数量裁剪合适尺寸的硅胶板,距离板底部0.7 cm出作点样线,样品间距3 cm,用毛细管吸取样品进行点样,然后放入展开剂中,待展开剂到距顶部3 cm时放入显色剂中,硅胶板完全浸湿用热吹风吹干。展开剂为(正丁醇)∶(乙酸乙酯)∶(水)=4∶1∶2。显色剂为体积分数10%的硫酸,在100 ℃下显色。用Bandscan 5.0软件对TLC板上点的面积、颜色深浅进行分析。
人参皂苷的HPLC检测:2 mg样品溶于1 mL色谱甲醇待检测,流动相:乙腈(A)-水(B):0~20 min,20% A;20~31 min,20%~32% A;31~40 min,32%~43% A;40~70 min,43%~100% A。进样量10 μL,柱温35 ℃,体积比流速0.6 mL/min,检测波长203 nm。
酶蛋白的HPLC检测:流动相为含有0.5 g/L的NaN3的0.02 mol/L磷酸缓冲液(pH 6.7),进样量20 μL,柱温35 ℃,体积比流速1.0 mL/min。
2 结果与分析
2.1 酶的纯化结果及其催化特性
酶的纯化结果如图1所示,纯化后的酶在HPLC检测中是单峰(图1-a);在SDS-PAGE中为单带(图1-b),即可判断纯化后的酶为单一蛋白。依据标准蛋白的分子质量,通过SDS-PAGE所计算出酶蛋白的分子质量为72.4 kDa,与T.ginsenosidimutans菌的人参皂苷酶基因序列(bgpA,1 947 bp)翻译后的氨基酸序列分子质量(理论值)基本相符。

a-HPLC图;b-SDS-PAGE图[1-目的蛋白, 2-标准蛋白:磷酸酶b(97.2 kDa),牛血清蛋白(66.4 kDa)、 卵清蛋白(44.3 kDa)、碳酸苷酶(29.0 kDa)、胰蛋白酶 抑制剂(20.1 kDa)和溶菌酶(14.3 kDa)]
图1 纯酶的HPLC和SDS-PAGE图
Fig.1 Purified recombinant enzyme in HPLC and SDS-PAGE analysis
为了解人参皂苷3-O-β-D-葡萄糖苷酶对Rc的催化特性,对人参皂苷Rc不同酶反应时间的反应产物进行HPLC分析,结果如图2-a所示。酶反应6 h,50%以上的人参皂苷Rc反应生成C-Mc1;反应16 h,大部分人参皂苷Rc反应生成C-Mc1和少量C-Mc;当反应36 h,人参皂苷Rc全部反应生成C-Mc1和C-Mc。如图2-b所示,该异源表达的人参皂苷3-O-β-D-葡萄糖酶催化人参皂苷Rc的过程为:先水解人参皂苷Rc的3-O-β-D-葡萄糖基生成C-Mc1,再水解C-Mc1的3-O-β-D-葡萄糖基生成C-Mc。

a-不同酶反应时间人参皂苷Rc的酶解产物的HPLC图; b-人参皂苷3-O-β-D-葡萄糖酶水解Rc的反应式
图2 人参皂苷3-O-β-D-葡萄糖酶水解Rc的反应
Fig.2 Ginsenoside Rc hydrolysis by recombinant ginsenoside-3-O-β-D-glucosidase 注:A-酶反应6 h的产物;B-酶反应16 h的产物; C-酶反应36 h的产物
2.2 纯酶的最适pH和最适温度
2 g/L的人参皂苷Rc在不同pH磷酸缓冲液反应体系下与纯酶反应6 h,其酶活力如图3所示,人参皂苷3-O-β-D-葡萄糖苷酶反应的最适pH为7.0。
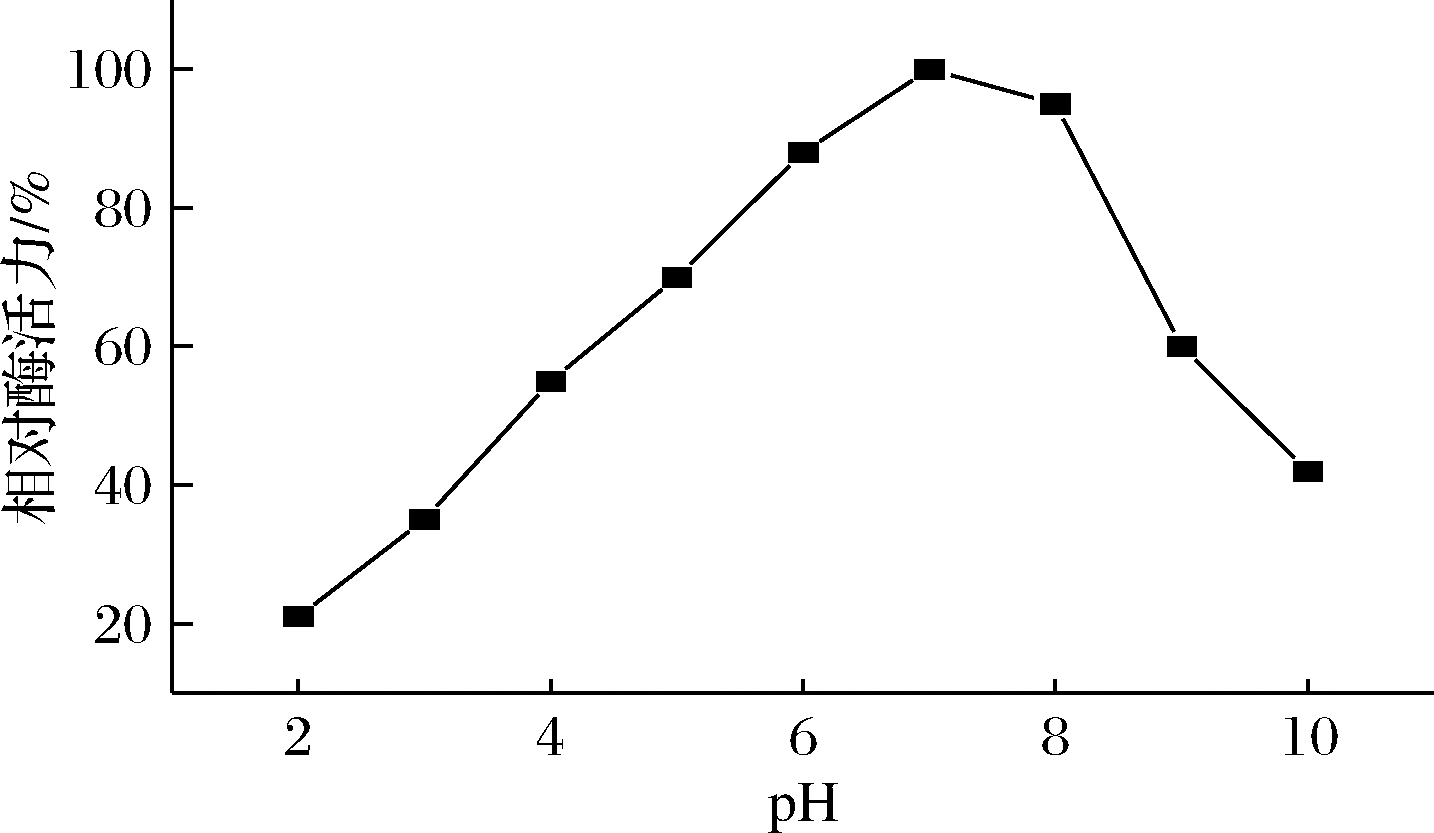
图3 不同pH对人参皂苷3-O-β-D-葡萄糖 酶活力的影响
Fig.3 Effect of different pH on ginsenoside-3-O- β-D-glucosidase actiity
2 g/L的人参皂苷Rc在pH 7.0条件下,在不同温度中与纯酶反应6 h。其酶活力检测结果如图4所示,酶反应的最适温度为40 ℃。

图4 不同温度对人参皂苷3-O-β-D-葡萄糖 酶活力的影响
Fig.4 Effect of different temperature on ginsenoside- 3-O-β-D-glucosidase actiity
综上可知,人参皂苷3-O-β-D-葡萄糖苷酶水解Rc最适pH为7.0,最适温度为40 ℃。
2.3 酶反应动力学
人参皂苷3-O-β-D-葡萄糖苷酶米氏常数Km和最大酶反应速度max测定:底物浓度[S]为10、13.3、20、26.7、40 mmol/L人参皂苷Rc,在40 ℃分别进行酶反应0.5、1、1.5、2、2.5 h;经HPLC分析,计算底物减少的初速度,建立1/S对1/值(表1)的曲线(Linweaer-Burk plots),如图5所示,得到Km值为6.25 mmol/L,m值为19.6 mmol/(h·L)。根据米氏方程:人参皂苷Rc浓度为5 mmol/L时酶反应速度为=8.67 mmol/(h·L)。
表1 不同底物浓度的酶促反应初速度
Table 1 The initial reaction rate of pure enzyme with Rc at different substrate concentrations

[S]/(mmol·L-1)1013.32026.740/[mmol·(L·h)-1]12.013.314.51616.91/[S](L·mmol-1)0.10.0750.050.0370.0251/[(L·h)·mmol-1]0.0830.075 30.0690.062 50.059

图5 人参皂苷3-O-β-D-葡萄糖苷酶的双倒数图
Fig.5 Linweaer-Burk plot of combinant ginsenoside- 3-O-β-D-glucosidase
2.4 底物浓度和时间对粗酶反应的影响
由于酶的纯化成本高,如下用粗酶转化制备C-Mc和C-Mc1。通过1.2.1中的方法制得了粗酶液,为了解粗酶的反应条件,探讨了pH和温度对粗酶反应的影响,其结果与纯酶相同。
进一步探讨了粗酶制备C-Mc1的最佳底物浓度,如图6所示。5 g/L的Rc皂苷酶反应24 h,人参皂苷Rc完全反应,产物主要为C-Mc1和C-Mc;10和25 g/L的Rc皂苷酶反应24 h,人参皂苷Rc几乎全部转化为C-Mc1;50 g/L的Rc皂苷酶反应24 h,只有部分Rc皂苷转化为C-Mc1。因此,要从Rc皂苷制备C-Mc1,需酶反应体系中人参皂苷Rc质量浓度为10~25 g/L;要制备C-Mc皂苷,需酶反应体系中人参皂苷Rc质量浓度为5 g/L。

a,b,c,d,e分别为Rc、C-Mc1、C-Mc、C-K、Rh2人参皂苷标准品; 1~4分别为底物质量浓度5、10、25、50 g/L
图6 不同Rc底物质量浓度对粗酶反应的影响TLC图
Fig.6 Effect of Rc concentration on crude enzyme reaction by TLC
反应时间对粗酶反应的影响如图7所示,5 g/L的Rc酶反应3 h和12 h,部分人参皂苷Rc被反应生成C-Mc1;反应24 h,人参皂苷Rc几乎全部反应,生成大量C-Mc1和少量的C-Mc;反应40 h,主要产物为C-Mc1和C-Mc;反应60 h,Rc全部反应生成C-Mc。

a,b,c,d,e分别为Rc、C-Mc1、C-Mc、C-K、Rh2人参皂苷标准品; 1~5分别为反应时间3、12、24、40、60 h的产物
图7 反应时间对Rc粗酶反应的影响TLC图
Fig.7 Reaction time effect on ginsenoside Rc crude enzyme reaction by TLC
综上可知,利用粗酶转化人参皂苷Rc制备C-Mc1,需10~25 g/L的Rc在40 ℃下反应24 h;制备C-Mc,需5 g/L的Rc在40 ℃下反应60 h。
2.5 利用粗酶制备稀有皂苷C-Mc和C-Mc1
C-Mc的制备:将8 g的Rc皂苷(7.4 mmol)配制成800 mL质量浓度为10 g/L的人参皂苷Rc溶液,再与等体积粗酶液混合(最终人参皂苷Rc质量浓度为5 g/L),在40 ℃下反应60 h,吸附、洗脱并脱色后,最后将乙醇洗脱液过滤,旋蒸得到5.2 g(6.9 mmol)的C-Mc单体,经HPLC检测,其纯度达到90%以上(图8),C-Mc的摩尔得率高达93.2%。
C-Mc1的制备:将40 g底物Rc(37.1 mmol)配制成1 L的人参皂苷Rc溶液,与等体积粗酶液在40 ℃条件下搅拌反应24 h(人参皂苷Rc终浓度为20 g/L),吸附、洗脱并脱色后,过滤旋蒸得到30 g的C-Mc和C-Mc1混合品。将混合品用甲醇溶解,再与80~100目硅胶混合搅拌,蒸干后均匀铺在预先装好的分离胶上方,用纯氯仿通柱,然后用(氯仿)∶(甲醇)=8.5∶1.5的洗脱液洗脱,分别收集合并C-Mc1和C-Mc的洗脱液,过滤旋蒸后得到25.5 g的C-Mc1(27.8 mmol)和3.1 g的C-Mc(4.1 mmol)单体,经HPLC检测,其纯度都在90%以上(图8),C-Mc1的摩尔得率为74.9%,C-Mc的摩尔得率为11.1%。

图8 粗酶转化Rc制备的稀有人参皂苷C-Mc1和 C-Mc单体HPLC图
Fig.8 The HPLC of ginsenoside C-Mc1 and C-Mc from Rc by crude enzyme reaction
3 结论与讨论
利用E.coli细胞异源表达了来自T.ginsenosidimutans 菌的人参皂苷3-O-β-D-葡萄糖苷酶,经测定酶分子质量为72.4 kDa,确定了酶最适反应pH为7.0,最适反应温度40 ℃,Km值为6.25 mmol/L,m值为19.6 mmoL/(h·L)。该酶能水解人参中含量较高的人参皂苷Rc的末端3-O-β-D-葡萄糖基,生成稀有皂苷C-Mc1, 进一步水解C-Mc1的3-O-β-D-葡萄糖基生成稀有皂苷C-Mc。
利用基因工程菌制取的粗酶,转化Rc皂苷制备C-Mc1和C-Mc中,20 g/L的Rc粗酶反应24 h,C-Mc1摩尔得率达74.9%,C-Mc摩尔得率为11.1%,并经硅胶柱分离可得C-Mc1和C-Mc单体皂苷;5 g/L的Rc粗酶反应60 h,C-Mc的摩尔得率高达93.2%,文中所述的酶转化Rc皂苷制备C-Mc1和C-Mc的方法,为今后高活性稀有人参皂苷C-Mc1和C-Mc的产业化提供依据。
[1] 金凤燮. 天然产物生物转化[M].北京:化学工业出版社, 2009.
JIN F X.Biotransformation of Natural Products[M].Beijing:Chemical Industry Press, 2009.
[2] CHRISTENSEN L P.Ginsenosides chemistry, biosynthesis, analysis, and potential health effects[J].Adances in Food and Nutrition Research, 2009, 55:1-99.
[3] 刘春莹, 宋建国, 李鹏飞, 等.3种人参中的皂苷的组成[J].大连工业大学学报, 2011, 30(2):79-82.
LIU C Y, SONG J G, LI P F, et al.Ginsenoside contents in three different ginseng[J].Journal of Dalian Polytechnic Uniersity, 2011, 30(2):79-82.
[4] 李鹏飞, 刘春莹, 郭俊莹, 等.不同种类人参茎叶中皂苷成分的比较[J].安徽农业科学, 2010, 38(24):13 077-13 079.
LI P F, LIU C Y, GUO J Y, et al.Comparison of the saponin composition in the stem and leaf of different type of ginseng[J].Journal of Anhui Agricultural Sciences, 2010, 38(24):13 077-13 079.
[5] YU T, YANG Y Y, KWAK Y S, et al.Ginsenoside Rc from Panax ginseng exerts anti-inflammatory actiity by targeting TANK-binding kinase 1/interferon regulatory factor-3 and p38/ATF-2[J].Journal of Ginseng Research, 2017, 41(2):127-133.
[6] 鲁文茜, 张斯琪, 沈尚竹, 等.人参皂苷Rc药理作用和药动学研究进展[J].中草药, 2018, 49(24):5 961-5 967.
LU W X, ZHANG S Q, SHEN S Z, et al.Research progress in pharmacological effects and pharmacokinetics of ginsenoside rc[J].Chinese Traditional and Herbal Drugs, 2018, 49(24):5 961-5 967.
[7] HASEGAWA H.Proof of the mysterious efficacy of ginseng:Basic and clinical trials:Metabolic actiation of ginsenoside:Deglycosylation by intestinal bacteria and esterification with fatty acid[J].Journal of Pharmacological Sciences, 2004, 95(2):153-157.
[8] TAWAB M A, BAHR U, KARAS M, et al.Degradation of ginsenosides in humans after oral administration[J].Drug Metabolism and Disposition, 2003, 31(8):1 065-1 071.
[9] PARK C S, YOO M H, NOH K H, et al.Biotransformation of ginsenosides by hydrolyzing the sugar moieties of ginsenosides using microbial glycosidases[J].Applied Microbiology and Biotechnology, 2010, 87(1):9-19.
[10] CHOI S H, SHIN T J, HWANG S H, et al.Differential effects of ginsenoside metabolites on HERG k channel currents[J].Journal of Ginseng Research, 2011, 35(2):191-199.
[11] LEE J H, AHN J Y, SHIN T J, et al.Effects of minor ginsenosides, ginsenoside metabolites, and ginsenoside epimers on the growth of Caenorhabditis elegans[J].Journal of Ginseng Research, 2011, 35(3):375-383.
[12] POPOICH D G, KITTS D D.Structure-function relationship exists for ginsenosides in reducing cell proliferation and inducing apoptosis in the human leukemia (THP-1) cell line[J].Archies of Biochemistry and Biophysics, 2002, 406(1):1-8.
[13] SUN H X, YANG Z G, YE Y P.Structure and biological actiity of protopanaxatriol-type saponins from the roots of Panax notoginseng[J].International Immunopharmacology, 2006, 6(1):14-25.
[14] UPADHYAYA J, YOON M S, KIM M J, et al.Purification and characterization of a noel ginsenoside rc-hydrolyzing β-glucosidase from Armillaria mellea mycelia[J].AMB Express, 2016, 6(1):112.
[15] LIU C Y, ZHOU R X, SUN C K, et al.Preparation of minor ginsenosides C-Mc, C-Y, F2, and C-K from American ginseng PPD-ginsenoside using special ginsenosidase type-I from Aspergillus niger g.848[J].Journal of Ginseng Research, 2015, 39(3):221-229.
[16] 肖永坤, 刘春莹, 鱼红闪, 等.人参二醇类皂苷的生物转化动态及人参稀有皂苷C-K或F2的制备[J].高等学校化学学报, 2019, 40(6):1 184-1 192.
XIAO Y K, LIU C Y, YU H S, et al.Dynamic biotransformation of protopanaxadiol-ginsenosides and preparation of minor ginsenosides C-K or F2[J].Chemical Journal of Chinese Uniersities, 2019, 40(6):1 184-1 192.
[17] TEN L N, CHAE S M, YOO S A.Biotransformation of ginsenoside rc into C-Mc1 by the bacterium Sphingopyxis sp.BG97[J].Chemistry of Natural Compounds, 2014, 50(3):565-567.
[18] AN D S, CUI C H, LEE H G, et al.Identification and characterization of a noel Terrabacter ginsenosidimutans sp.no.beta-glucosidase that transforms ginsenoside Rb1 into the rare gypenosides XII and LXX[J].Applied and Enironmental Microbiology, 2010, 76(17):5 827-5 836.
[19] JIN X F, YU H S, WANG D M, et al.Kinetics of a cloned special ginsenosidase hydrolyzing 3-O-glucoside of multi-protopanaxadiol-type ginsenosides, named ginsenosidase type III[J].Journal of Microbiology and Biotechnology, 2012, 22(3):343-351.
[20] LIU C Y, JIN Y H, YU H S, et al.Biotransformation pathway and kinetics of the hydrolysis of the 3-O- and 20-O-multi-glucosides of PPD-type ginsenosides by ginsenosidase type I[J].Process Biochemistry, 2014, 49(5):813-820.
[21] LINEWEAER H, BURK D.The determination of enzyme dissociation constants[J].Journal of the American Chemical Society, 1934, 56(3):658-666.