白酒大曲的制作在中国已有2 000多年的历史,高温大曲是酱香型白酒酿造所用的唯一糖化发酵剂,通过高温发酵、培菌来实现制曲过程微生物的演替和酶系的有效积累[1]。曲是产生香味的前驱物质为白酒带来特有的香味成分。大曲采用生料制曲、添加母曲自然接种、经40 d发酵逐渐形成了以细菌、霉菌和酵母菌为主的群落结构[2]。酱香型高温大曲的制曲温度最高可达60 ℃,水分多、温度高,有利于细菌的增殖,霉菌与酵母由于受制曲环境的影响,使得两者在大曲中的含量减少[3],有研究表明在高温大曲中,细菌占绝对优势,其数量达90%以上[4-6]。细菌在高温大曲中的作用主要是产香,其中Bacillus licheniformis和Bacillus amyloliquefaciens是典型的嗜热芽孢杆菌,也是大曲中产酱香功能细菌,在发酵体系中能产生大量淀粉酶以及蛋白酶[7-10],是形成酱香型白酒典型香气特性的主要菌群。因此,研究酱香型高温大曲中细菌群落组成结构有利于为后期解析产酱香的独特风味的作用机制提供理论基础。
目前,业内对高温大曲中细菌菌落结构研究方法主要有传统微生物培养技术和免培养技术。近年来,二代测序平台—454测序平台[11]的兴起,结束了以Sanger测序为主导的第一代测序时代[12],随着核酸检测技术的发展,以第二代测序为支柱的核酸测序技术仍在各方面的应用中面临很多挑战。而以第三代测序技术(PacBio SMRT)为核心的核酸检测与诊断革新已在生物医药领域崭露头角,可以实现兆碱基级别超长测序、无扩增基因组修饰检测,具有快速、实时、高通量的优点,使其在传染性疾病的及时诊断、精准医疗、药物研发等领域具有广泛的应用前景[13-15]。SMRT测序技术在微生物领域研究广泛,CAO等[16]通过SMRT技术对泡菜盐水进行16S rRNA 基因全长测序,结果表明Lactobacillus acetotolerans的丰度与酸度呈正相关,且乳酸菌属内的菌种越多(丰度>1%),机会致病菌越多;边燕飞等[17]采用SMRT测序技术全评价婴幼儿配方奶粉的微生物污染情况,初步建立婴幼儿配方奶粉的微生物检测技术。
本研究采用PacBio SMRT三代测序技术,对贵州习酒公司制曲八轮次机械制曲和人工制曲过程中(曲胚入房0 d、一次翻曲7 d、二次翻曲14 d、拆曲40 d 4个工艺环节)的细菌群落多样性及变化规律进行研究,比较分析了机械制曲和人工制曲的细菌多样性结构、重要细菌属种间的差异性,确定了酱香型大曲的优势菌群,为进一步解析酱香型大曲功能微生物,筛选优良酿造微生物奠定基础。
1 材料与方法
1.1 样品采集
高温大曲样品采集自贵州茅台酒厂(集团)习酒有限责任公司制曲第八轮次机械制曲和人工制曲,共采集到8个样品,其中机械压曲4个、人工踩曲4个。具体采样方法为:曲坯入房(AQ)、一次翻曲(YF)、二次翻曲(EF)和拆曲(CQ),每个工艺环节按发酵仓的门、中、窗不同位置各取3块高温大曲,于4 ℃条件下立即带回实验室进行粉碎并按1∶1∶1质量比混合为1个样品。样品编号为:AQ1、YF1、EF1、CQ1、AQ2、YF2、EF2和CQ2(1表示样品来自机械曲;2表示样品来自人工曲)。
1.2 主要设备与试剂
1.2.1 试剂
KOD FX Neo PCR酶,TOYOBO;MagicPure Size Selection DNA Beads,北京全式金;Power DNA Isolation Kit试剂盒,美国Mibio公司。
1.2.2 设备
SynergyHTX型酶标仪,Gene Company Limited基因有限公司;Legend Micro 21型高速离心机,EPPENDORF;G560 E型振荡器,美国Scientific Industries公司;9902型 96 well PCR仪,美国ThermoFisher公司;BC/BD-629 HK型卧式冷藏冷冻转换柜,海尔公司。
1.3 大曲总DNA提取及PacBio SMRT测序方法
DNA提取:取大曲0.25 g,按照PowerSoil® DNA Isolation kit试剂盒方法提取DNA。扩增细菌16S全长,选择27F(5′-AGRGTTTGATYNTGGCTCAG-3′)和1492R(5′-TASGGHTACCTTGTTASGACTT-3′)为扩增引物。
PCR扩增体系:基因组DNA 5~50 ng/(X μL)、*n F(10 μmol/L) 1 μL、*n R(10 μmol/L) 1 μL、KOD FX Neo 0.4 μL、KOD FX Neo Buf(2X)10 μL、2 mmol/L dNTP 4 μL、ddH2O补至总体系20 μL。
PCR反应程序:95 ℃预变性5 min,95 ℃变性处理30 s,50 ℃退火30 s,72 ℃延伸1 min/kb,30个循环;72 ℃延伸7 min。使用MagicPure Size Selection DNA Beads磁珠对PCR产物进行纯化,使用Nanodrop 2 000定量后,按照质量比1∶1进行混样测序。
PacBio SMRT测序:纯化后的PCR产物由北京擎科生物科技有限公司进行建库和细菌多样性分析。
1.4 数据处理及分析
对原始下机subreads使用SMRT Link8.0进行校正得到CCS(Circular Consensus Sequencing)序列,然后使用lima (1.7.0)软件,通过barcode序列识别不同样品的CCS序列并去除嵌合体(UCHIME,ersion 8.1),得到高质量的CCS序列。使用UNITE为参考数据库进行物种注释,基于Sila库对97%相似水平的操作分类单元(operational taxonomic units,OTU)代表序列进行分类学注释分析,利用QIIME软件对样本进行Chao1、Shannon和Simpson指数分析及α多样性分析。使用TBtools软件对样品进行热图聚类分析,Cytoscape 5.0软件进行相关性网络分析。
2 结果与分析
2.1 酱香型高温大曲制作过程中的细菌多样性分析
2.1.1 稀释性曲线分析
稀释性曲线[18]用于验证测序数据量是否足以反映样品中的物种多样性,并间接反映样品中物种的丰富程度。由图1可知,8个大曲样品细菌的稀释性曲线都趋于平坦,说明测序的数据量足够大,对酱香型高温大曲中微生物多样性分析基本覆盖酱香型高温大曲中细菌的种类。
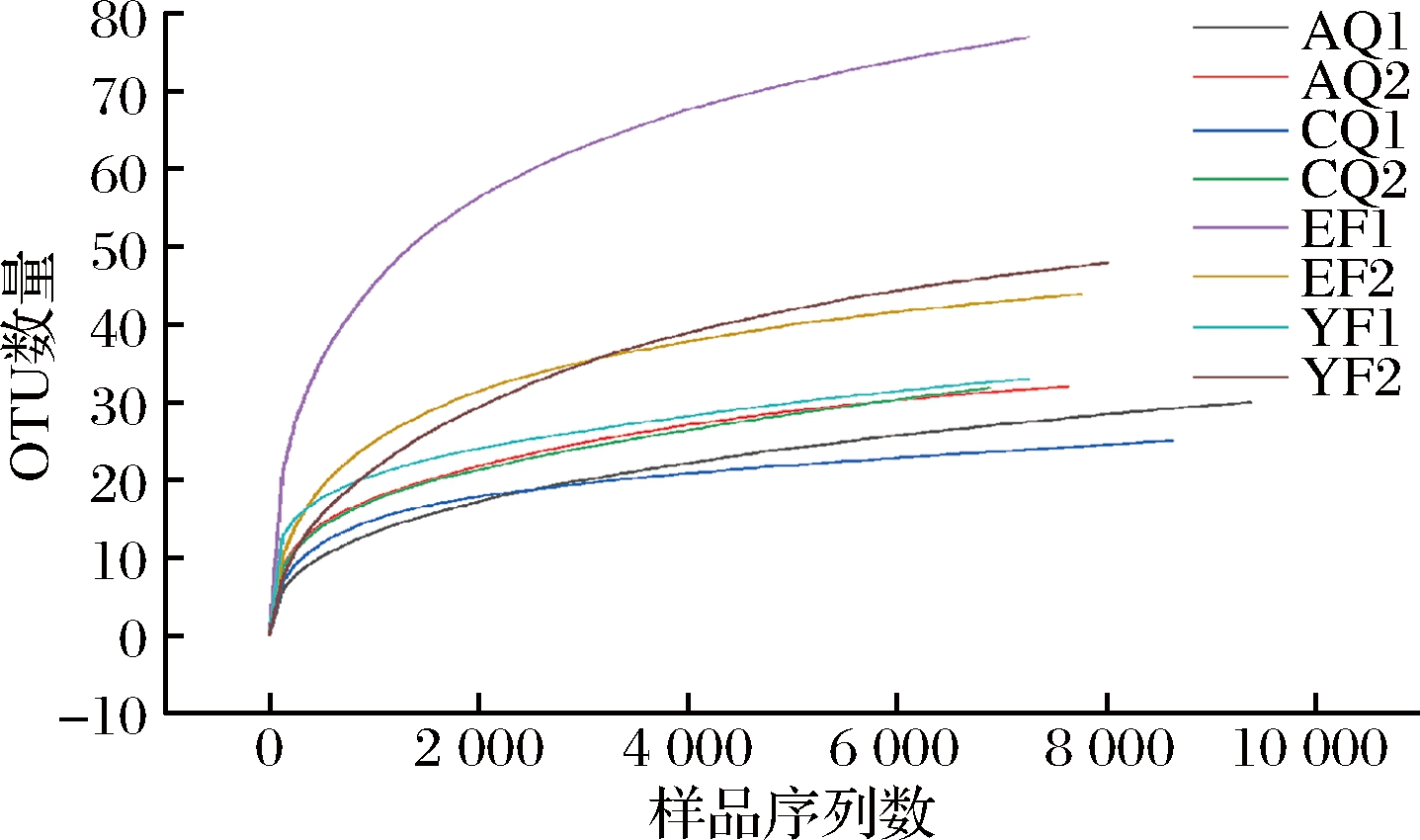
图1 样品稀释性曲线
Fig.1 The rarefaction cure of samples
2.1.2 α多样性分析
α多样性反映的是单个样品物种丰度及物种多样性。本研究得到8个大曲样品α多样性指数值统计如表1所示。
表1 样品α多样性指数
Table 1 α-Diersity indexes of samples
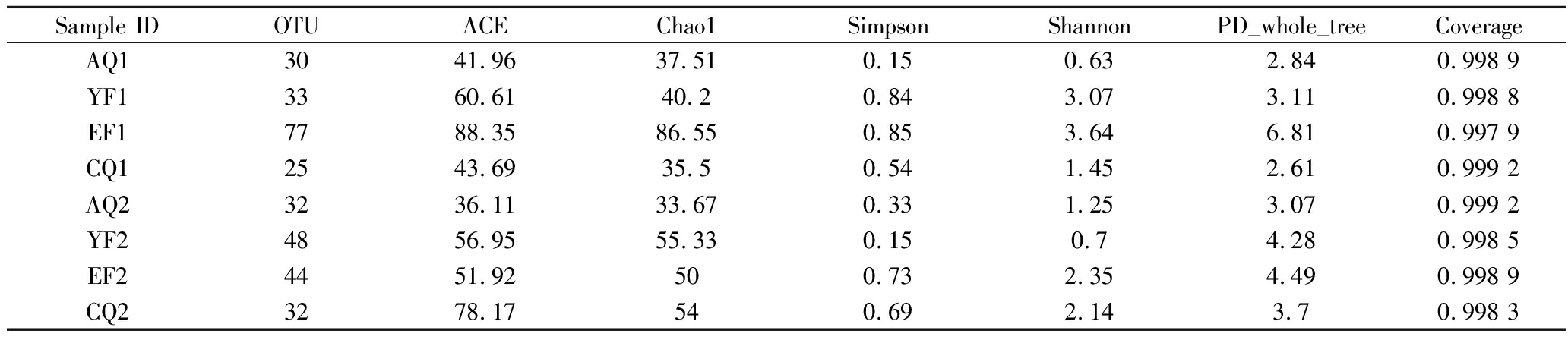
Sample IDOTUACEChao1SimpsonShannonPD_whole_treeCoerageAQ13041.9637.510.150.632.840.998 9YF13360.6140.20.843.073.110.998 8EF17788.3586.550.853.646.810.997 9CQ12543.6935.50.541.452.610.999 2AQ23236.1133.670.331.253.070.999 2YF24856.9555.330.150.74.280.998 5EF24451.92500.732.354.490.998 9CQ23278.17540.692.143.70.998 3
在97%相似度水平下共获得的OTU数为321,其中在EF1的OTU数最高,为77。酱香型高温大曲样品的Shannon和Simpson指数表明,机械曲和人工曲从安曲至拆曲环节的α多样性指数呈先增后降,YF1和EF1的细菌多样性和物种丰富度明显高于人工制曲,且随着发酵时间的进行,到后期的拆曲环节细菌多样性和物种丰度明显降低。所有样品的Coerage指数均>0.99,说明各采样的高温大曲样品文库的覆盖率足够大,样品中的序列基本被全部测出,测序结果可体现高温大曲样品细菌群落多样性的真实情况。
2.1.3 基于门水平的细菌菌群结构多样性分析
酱香型大曲制曲8轮次安曲至拆曲环节发酵过程中共检测10个门,如图2所示。其中机械曲在发酵过程中检出10个门、人工曲检出8个门。机械曲从AQ至CQ发酵大曲中检测到Firmicutes、Proteobacteria、Actinobacteria、Cyanobacteria、Bacteroidetes、Acidobacteria等10个门;人工曲中未检出Tenericutes、errucomicrobia。
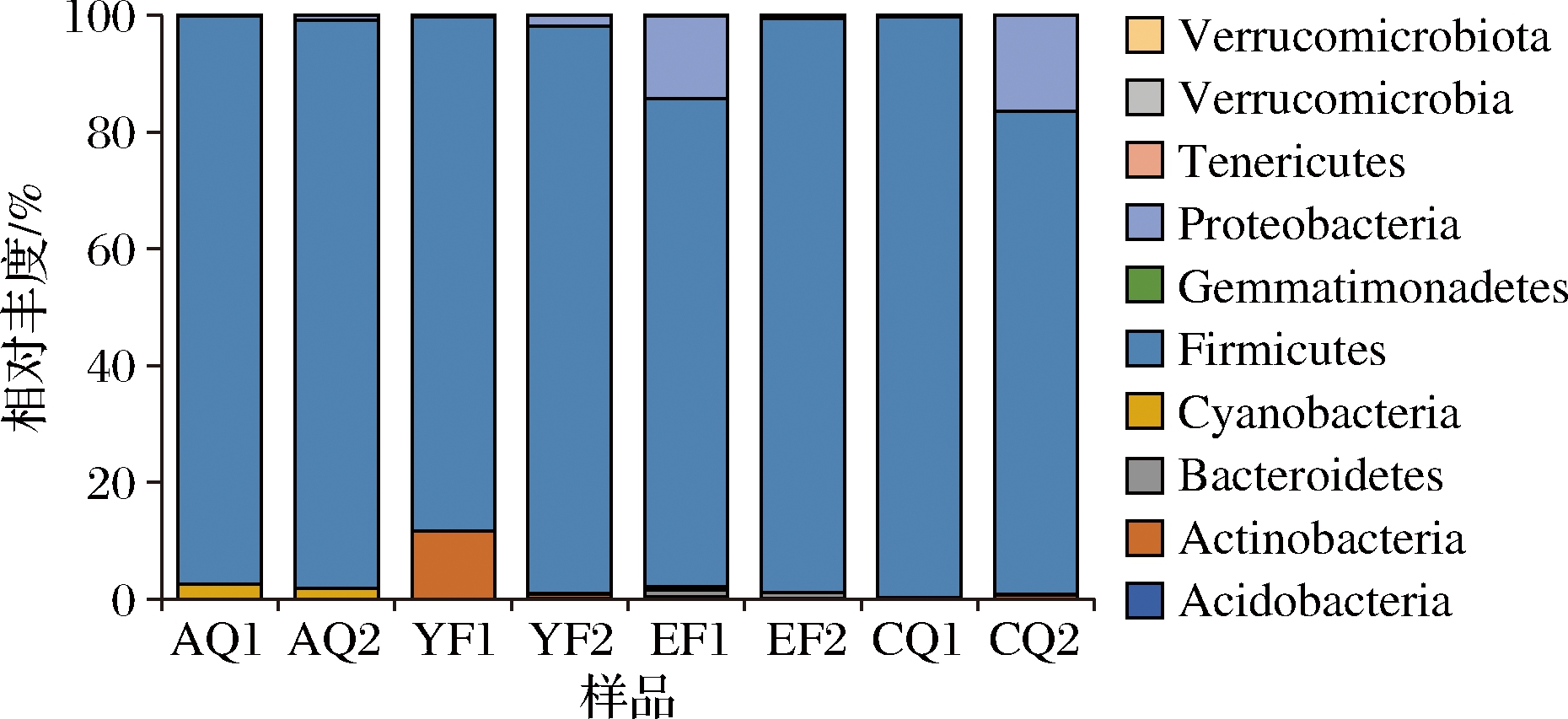
图2 门水平的细菌菌群结构
Fig.2 Bacteria diersity at phylum leel
在门水平上,机械曲和人工曲整个发酵过程中,皆以Firmicutes为主导菌门,占整个机械制曲和人工制曲的82.7%~99.45%,其中在拆曲环节机械曲占比最高,为99.45%。该结果与戴奕杰等[19]研究酱香型大曲、张双燕等[20]研究清香型大曲、李申奥[21]研究兼香型大曲发酵过程微生物的研究结论一致,表明高温大曲在发酵过程中,细菌门水平群落多样性降低,微生态结构由多菌系转变为单一的厚壁菌门为主导的发酵门水平上微生态变化的规律性模式。
2.1.4 基于属水平的细菌菌群结构多样性分析
人工曲和机械曲在整个制曲发酵过程中共检出122个细菌属,其中人工曲在发酵过程中检出60个细菌属、机械曲检出62个细菌属。图3为平均相对丰度至少在一个大曲样品中>1%的菌群结构。

图3 属水平的细菌菌群结构
Fig.3 Bacteria diersity at genus leel
由图3可知,人工曲和机械曲从安曲至拆曲发酵大曲中检测到优势细菌属共20个,包括Weissella、Kroppenstedti、Thermoastinomyces、Lentibacillus、Scopulibacillus、Bacillus、Oceanobacillus、Saccharopolyspora、Lactobacillus、Massillia、Acetobacter、Acinetobacter、Cutibacterium、Lactococcus等。其中在AQ环节的优势菌属均为Weissella(86.73%、94.46%)。YF2主要以Thermoastinomyces(92.3%)为主要菌属;YF1环节则以Weissella(23.56%)、Scopulibacillus(24.8%)、Bacillus(21.03%)为主要菌属。在EF环节,人工曲和机械曲均以多菌属存在发酵,人工曲以Lentibacillus(42.59%)为主要菌属、其次是Oceanobacillus(31.22%);机械曲以Weissella(39.02%)为主要菌属,其次是Thermoastinomyces(12.87%)、Lentibacillus(8.49%)。CQ环节人工曲和机械曲均以Kroppenstedtia(76.52%、60.25%)为主要菌属,其次是Lentibacillus(6.19%、35%)。
在属水平上,在整个制曲发酵过程中机械曲和人工曲细菌多样性呈动态变化趋势,在制曲发酵过程中细菌群落结构具有很高的相似性。酱香型高温大曲曲坯初入房时不处于高温阶段,此时温度较低湿度较高,适合笼络环境中多种微生物生长和代谢,随着温度的升高实现了对嗜热微生物的筛选[22]。高通量测序技术在酒曲研究中应用广泛, 已成功揭示了在不同香型酒曲中的微生物多样性,相关研究所使用的测序平台、方法和数据库具有相似性。目前,关于高通量测序技术在酒曲微生物多样性相关研究方面层出不穷,WANG等[23]利用Roche 454GS-FLX+system平台,首次在茅台大曲中报道了Sporolactobacillaceae、Streptomycetaceae、Pseudomonadaceae、Actinopolysporaceae、Caulobacteraceae、Pseudonocardiaceae、 Nocardiaceae 、Methlobacteriaceae等优势菌;陈蒙恩等[24]使用Illumina MiSeq PE250分析了陶融型大曲的优势菌属主要为乳杆菌属、魏斯氏菌属、泛菌属、明串珠菌属四大类;张倩等[25]使用Illumina MiSeq 2500平台解析了浓香型大曲发酵过程中,曲皮、曲心的优势菌为Bacillales、Lactobacillales、Pseudomonadales、Thermoactinomyces、Weissella、Leuconostoc、Acinetobacter。
2.1.5 基于种水平的细菌菌群结构多样性分析
人工曲和机械曲在整个制曲发酵过程中共检出169个细菌种,其中人工曲在发酵过程中检出80个细菌种,机械曲检出89个细菌种。图4为平均相对丰度至少在一个大曲样品中>1%的菌群结构。人工曲和机械曲从AQ至CQ发酵大曲中检测到优势细菌种共26个,包括Weissella cibaria、Weissella paramesenteroides、Thermoactinomyces ulgaris、Scopulibacillus daqui、Oceanobacillus indicireducens、Oceanobacillus caeni、Lentibacillus massiliensis、Kroppenstedtia eburnea等。图4结果表明,在AQ环节,Weissella cibaria(81.42%、92.03%)为主要优势菌种,AQ1、AQ2菌种组成相似,在丰度含量上存在一定差异;在YF环节,优势菌种在组成上存在较大差异,YF1的优势菌种为S.daqui(24.8%)、B.licheniformis(21%)、W.paramesenteroides(17.56%),YF2的优势菌种为T.ulgaris(92.09%);在EF环节,人工曲和机械曲的优势菌种组成差异明显,菌种多样性最丰富,EF1的优势菌种为W.cibaria(31.51%)、S.daqui(12.8%),EF2的优势菌种为L.massiliensis(42.59%)、O.indicireducens(19.51%)、K.sanguinis(19.32%),S.daqui在该环节未被检出;在CQ环节,人工曲和机械曲的多样性降低,主要的优势菌种为K.sanguinis(40.28%/57.88%)、L.massiliensis(6.19%/35.43%)、K.eburnea(36.24%、2.36%),CQ2环节检出M.aurea(8.4%)、M.haematophila(4.98%),而CQ1环节未被检出。
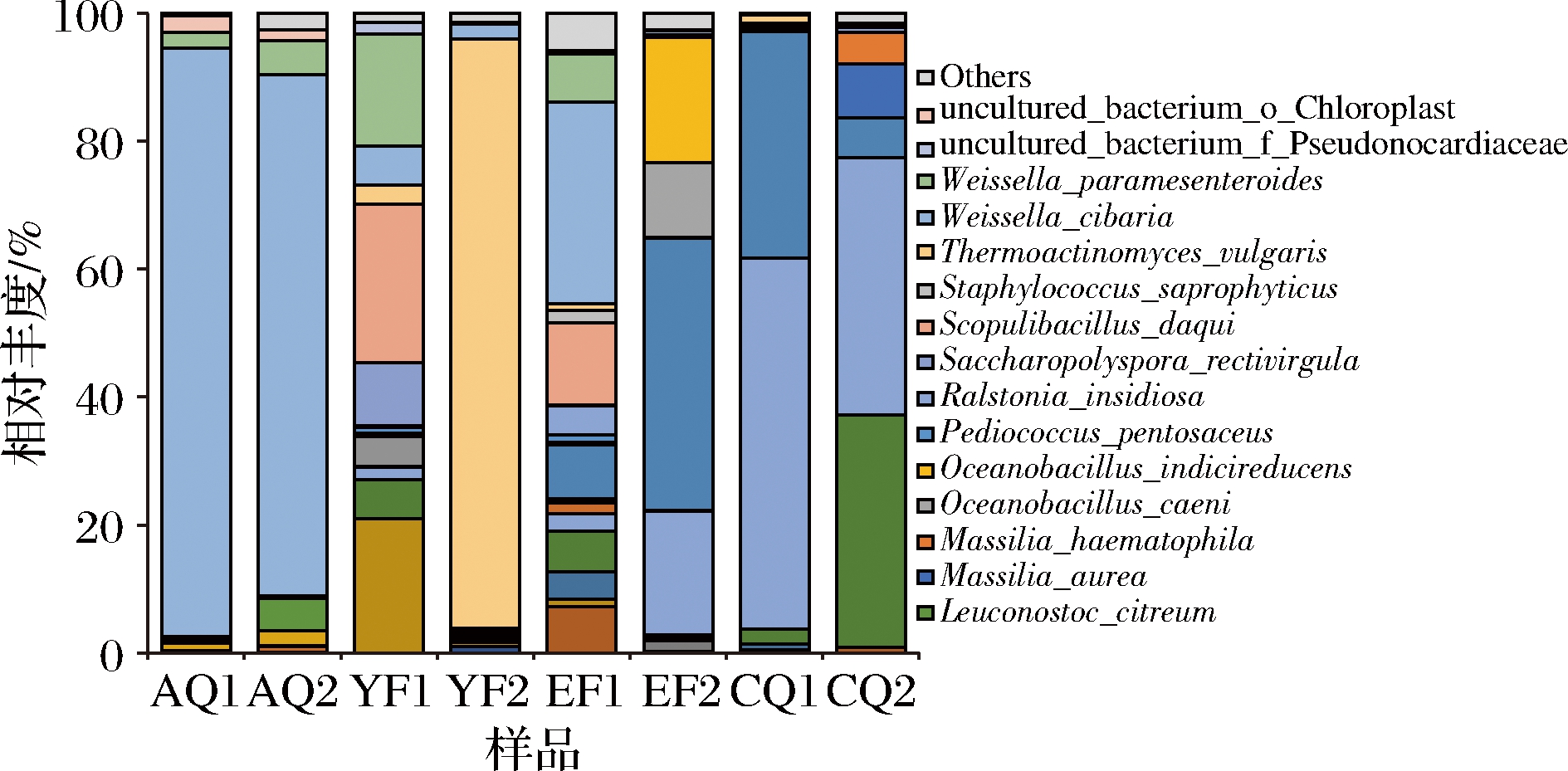
图4 种水平上细菌群落组成
Fig.4 Bacteria diersity at species leel
选择相对丰度前50的细菌种进行聚类分析,结果如图5所示。根据聚类结果可知,每类细菌群落组成较为相似但又区别于其他类别,这进一步表明在曲坯出仓前,特别是在AQ环节,主要是由于优势菌种的丰度不同和菌种的组成差异而导致样品存在差异。
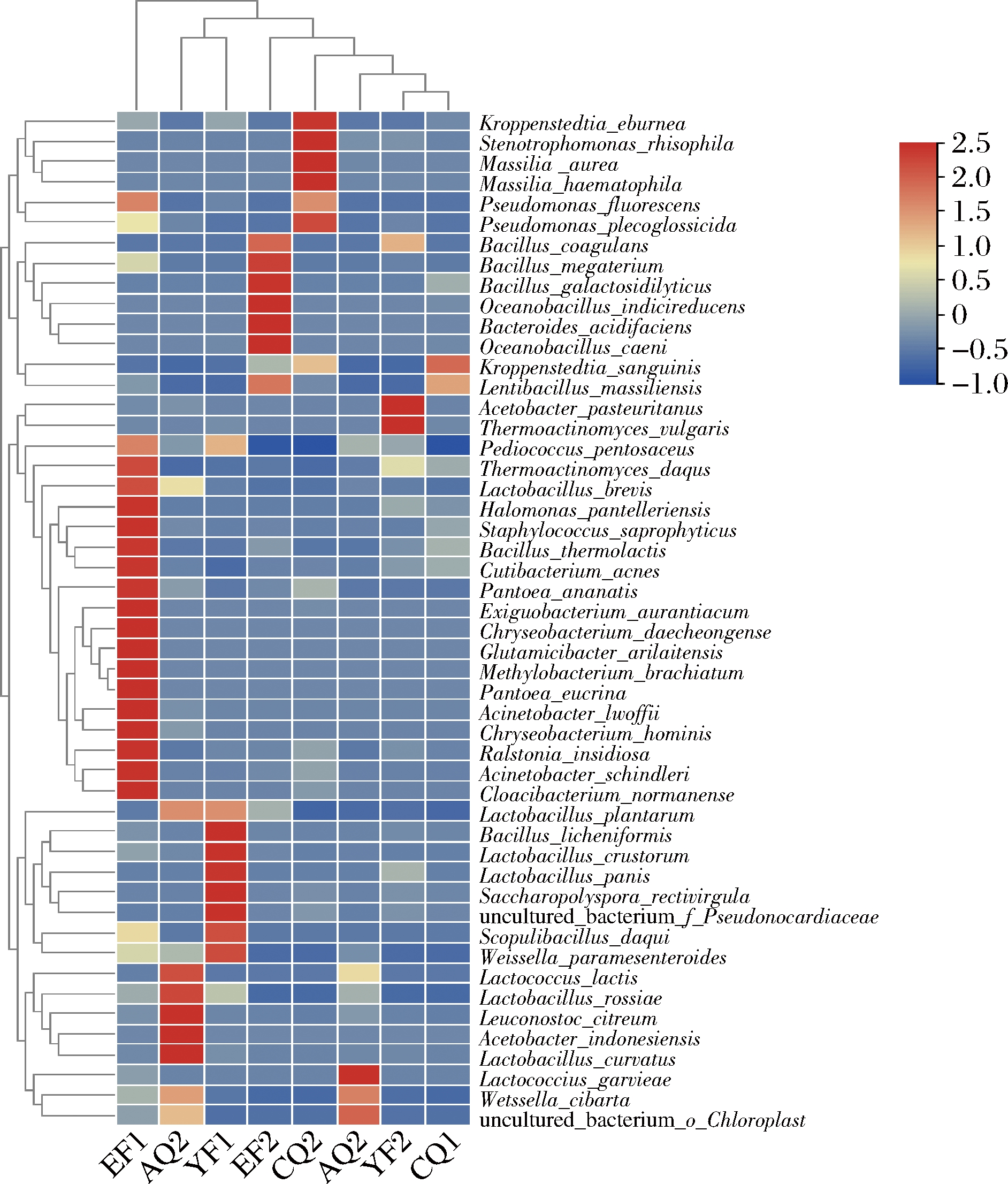
图5 相对丰度前50种细菌水平上相对丰度热图
Fig.5 Relatie abundance heatmap of top 50 species
但随着发酵的进行,到CQ环节,机械曲和人工曲中细菌群落较为相似,主要优势细菌种为K.sanguinis、L.massiliensis、K.eburnea,表明采用机械制曲方式生产的高温大曲在发酵结束后,与人工制曲的细菌群落基本一致。
2.1.6 相关性网络分析图
为进一步研究酱香型高温大曲制作过程中细菌群落之间的相互关系,选取属水平总丰度前50的物种,分别计算两两细菌属间的斯皮尔曼(Spearman)等级相关系数,可以获得物种在环境样本中的共存关系。人工曲和机械曲物种之间的相关性分析结果如图6所示。
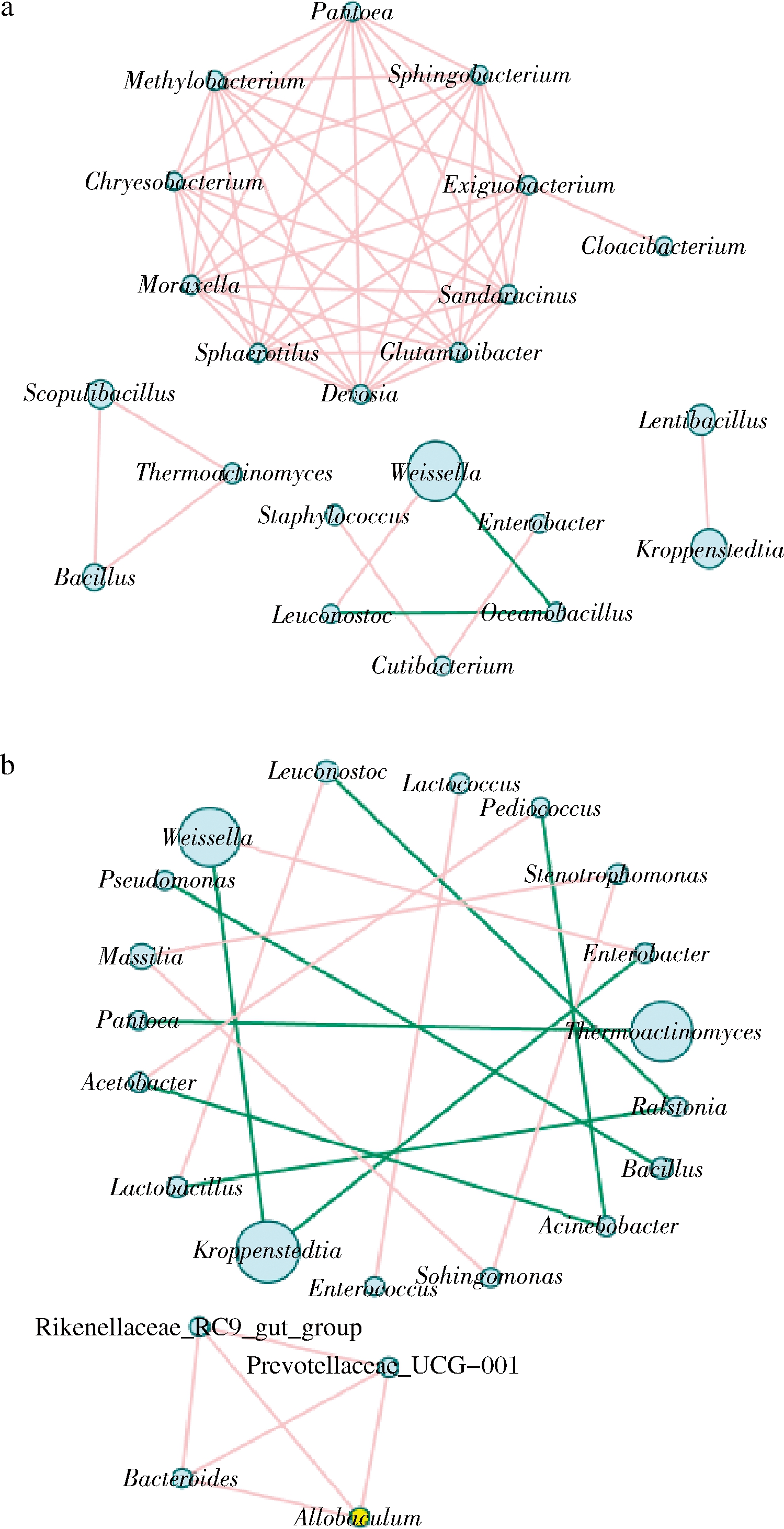
a-机械曲细菌菌群相关性网络图;b-人工曲细菌菌群相关性网络图
图6 高温大曲制作过程细菌菌群相关性网络图(属水平)
Fig.6 Correlation network diagram of fungal communities in the process of high-temperature Daqu making at genus leel 注:图中节点的大小表示物种丰度的大小;物种之间连线的颜色 表示正负相关性,红色代表正相关,绿色代表负相关
酱香型高温大曲制作过程中机械制曲和人工制曲细菌菌群之间的相关性结果表明,绝大多数的微生物菌属之间呈现显著正相关调节机制。机械制曲细菌群落之间的相关性网络图中(图6-a),包含52个细菌属间的正相关关系,2个负相关关系;人工制曲细菌群落之间的相关性网络图中(图6-b),包含44个细菌属间的正相关关系,8个负相关关系。这些相互生物学关系构成了发酵过程的基本生物学调控机制,也是发酵过程发酵动力、风味动力形成和调控机制的基本组成[28]。
从机械制曲细菌群落之间的相关性网络图中(图6-a)发现Weissella节点丰度最高,为39.29%;与Oceanobacillus之间存在负相关关系,与Leuconostoc之间是正相关关系,而Oceanobacillus、Leuconostoc两两之间存在负相关关系;在整个机械制曲环节,Weissella、Leuconostoc相对丰度逐渐降低,在最后CQ1环节均未检出该菌属。Kroppenstedtia与Lentibacillus之间存在正相关关系,Kroppenstedtia在整个机械制曲环节相对丰度从AQ环节的0.19%上升至CQ环节的60%;Lentibacillus从0.01%上升至CQ环节的35%。
从人工制曲细菌群落之间的相关性网络图中(图6-b)发现存在8个负相关关系的节点,其中Kroppenstedtia与Weissella、Enterobacter之间存在负相关关系,且在整个发酵过程中三者的相对丰度均呈现逐渐下降的趋势。Rikenellaceae_RC9_gut_group、Preotellaceae_UCG-001、Allobaculum和Bacillus 4个菌属之间存在6个节点的正相关性,其中Rikenellaceae_RC9_gut_group、Preotellaceae_UCG-001、Allobaculum存在于EF2环节,且相对丰度均<1%,Bacillus在AQ2、YF2、EF2环节相对丰度逐渐升高,在CQ2环节则未检出。
从图6可知,人工曲之间的网络相关性相互关系节点数低于机械制曲,由此可知,机械制曲在一定程度上可以取代人工制曲,大幅降低劳动强度及生产成本,还能避免工人在恶劣的环境下操作,对推动酱香型白酒行业的机械化与现代化发展具有促进作用。
3 结论
本研究首次应用SMRT三代测序技术对酱香型白酒高温大曲发酵过程中细菌群落结构进行解析。结果表明在酱香型白酒高温大曲发酵过程中,机械曲的细菌多样性明显高于人工曲。在门水平上,整个发酵过程中皆以Firmicutes为主导;在属水平上,优势细菌属共20个,其中在AQ环节的优势菌属均为Weissella;在YF环节,人工曲以Thermoastinomyces为优势菌属,机械曲则以Weissella、Scopulibacillus、Bacillus为优势菌属;在EF环节,人工曲和机械曲均以多菌属存在发酵,人工曲以Lentibacillus为主要菌属,机械曲以Weissella为主要菌属;在CQ环节细菌多样性降低,主要以Kroppenstedtia为主要菌属,其细菌群落组成相似,表明采用机械制曲和人工踩曲的方式制作的高温大曲在发酵结束后,其细菌群落组成无明显差别。
机械制曲和人工制曲细菌菌群之间的相关性结果表明,高温大曲制作过程中细菌群落间存在复杂的相互作用关系,多数细菌属之间呈显著正相关调节机制。本研究揭示了酱香型白酒高温大曲制作过程中,机械制曲和人工制曲的细菌群落结构之间相互作用关系,构成了发酵过程的基本生物学调控机制,为明确酱香型白酒高温大曲发酵机理提供基础数据,对推动酱香型白酒行业的机械化与现代化发展具有促进作用。
[1] 左乾程, 黄永光, 郭敏, 等.酱香型白酒机械化制曲发酵细菌群落的演替[J].食品科学, 2021, 42(18):150-156.
ZUO Q C, HUANG Y G, GUO M, et al.Succession of bacterial community during mechanized fermentation of Maotai-flaor Daqu[J].Food Science, 2021, 42(18):150-156.
[2] 王晓丹, 雷安亮, 班世栋, 等.酱香型大曲细菌的多样性[J].食品与发酵工业, 2017, 43(5):70-75.
WANG X D, LEI A L, BAN S D, et al.Research on bacterial diersity of Maotai-flaor Daqu[J].Food and Fermentation Industries, 2017, 43(5):70-75.
[3] 王小平, 黄永光, 周文美.酱香型白酒大曲细菌菌群结构及功能研究进展[J].中国酿造, 2020, 39(2):19-25.
WANG X P, HUANG Y G, ZHOU W M.Research progress on structure and function of bacterial community in Moutai-flaor Baijiu Daqu[J].China Brewing, 2020, 39(2):19-25.
[4] 姚粟, 葛媛媛, 李辉, 等.利用非培养技术研究芝麻香型白酒高温大曲的细菌群落多样性[J].食品与发酵工业, 2012, 38(6):1-6.
YAO S, GE Y Y, LI H, et al.Analysis on bacterial communities in high temperature Daqu of sesame flaor liquor through culture-free approach[J].Food and Fermentation Industries, 2012, 38(6):1-6.
[5] 孙利林, 李立郎, 胡萍, 等.酱香型白酒第四轮次酒酿造过程中真菌多样性分析[J].中国酿造, 2019, 38(11):24-30.
SUN L L, LI L L, HU P, et al.Analysis of fungal diersity in Moutai-flaor Baijiu during the fourth round fermentation[J].China Brewing, 2019, 38(11):24-30.
[6] 郭敏. 基于高通量测序对酱香大曲制曲微生态多样性的研究[D].贵阳:贵州大学, 2018.
GUO M.Study on microecological diersity of Maotai flaor Daqu based on high-throughput sequencing[D].Guiyang:Guizhou Uniersity, 2018.
[7] NURSTEN H E.The Maillard Reaction[Electronic Resource]:Chemistry, Biochemistry, and Implications[M].Cambridge:Royal Society of Chemistry, 2005.
[8] MARCHAND S, DE REEL G, ERCAUTEREN J, et al.Possible mechanism for inolement of cysteine in aroma production in wine[J].Journal of Agricultural and Food Chemistry, 2002, 50(21):6 160-6 164.
[9] PRIPIS-NICOLAU L, DE REEL G, BERTRAND A, et al.Formation of flaor components by the reaction of amino acid and carbonyl compounds in mild conditions[J].Journal of Agricultural and Food Chemistry, 2000, 48(9):3 761-3 766.
[10] 李登勇, 黄钧, 丁晓菲, 等.酱香大曲间微生物群落结构时空特征的表征[J].食品工业科技, 2018, 39(23):139-145.
LI D Y, HUANG J, DING X F, et al.Characterization of the spatial-temporal feature of microbial community structure in Maotai-flaor liquor Daqu[J].Science and Technology of Food Industry, 2018, 39(23):139-145.
[11] MARGULIES M, EGHOLM M, ALTMAN W E, et al.Genome sequencing in microfabricated high-density picolitre reactors[J].Nature, 2005, 437(7 057):376-380.
[12] SANGER F, COULSON A R.A rapid method for determining sequences in DNA by primed synthesis with DNA polymerase[J].Journal of Molecular Biology, 1975, 94(3):441-448.
[13] 刘玉洁, 胡海洋.第三代测序技术及其在生物学领域的革新[J].科技与创新, 2021(5):34-39.
LIU Y J, HU H Y.The third generation sequencing technology and its innoation in biology[J].Science and Technology & Innoation, 2021(5):34-39.
[14] 王曦路. Nanopore单分子测序基因组结构变异分析流程比较[J].世界最新医学信息文摘(连续型电子期刊), 2020, 20(54):25-26;34.
WANG X L.Analysis process comparison of nanopore single molecule sequencing genome structure ariation[J].World Latest Medicine Information, 2020, 20(54):25-26;34.
[15] 王秋权, 黄莎莎, 袁永一, 等.第三代测序技术在遗传性耳聋基因拷贝数变异检测的临床应用[J].中华耳科学杂志, 2021, 19(2):227-231.
WANG Q Q, HUANG S S, YUAN Y Y, et al.Clinical application of third-generation sequencing technology in detecting hereditary hearing loss gene copy number ariations[J].Chinese Journal of Otology, 2021, 19(2):227-231.
[16] CAO J L, YANG J X, HOU Q C, et al.Assessment of bacterial profiles in aged, home-made Sichuan Paocai brine with arying titratable acidity by PacBio SMRT sequencing technology[J].Food Control, 2017, 78:14-23.
[17] 边燕飞, 席晓霞, 郑艺, 等.基于PacBio SMRT技术的婴幼儿配方奶粉微生物安全性评价[J].中国食品学报, 2019, 19(10):212-220.
BIAN Y F, XI X X, ZHENG Y, et al.Ealuation of microbial safety in infant formula based on PacBio SMRT sequencing[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(10):212-220.
[18] WANG Y, SHENG H F, HE Y, et al.Comparison of bacterial diersity in freshwater, intertidal wetland, and marine sediments using millions of Illumina tags[J].Applied and Enironmental Microbiology, 2012, 78(23):8 264-8 271.
[19] 戴奕杰, 李宗军, 田志强.酱香型白酒大曲和糟醅的细菌多样性分析[J].食品科学, 2019, 40(4):152-159.
DAI Y J, LI Z J, TIAN Z Q.Analysis of bacterial diersity in daqu and fermented grains for Maotai-flaor liquor[J].Food Science, 2019, 40(4):152-159.
[20] 张双燕, 廖永红, 纪南, 等.基于高通量测序技术分析北京清香型大曲微生物多样性[J].中国酿造, 2016, 35(11):49-53.
ZHANG S Y, LIAO Y H, JI N, et al.Analysis on microbial diersity of Beijing light-flaor Daqu by high-throughput sequencing[J].China Brewing, 2016, 35(11):49-53.
[21] 李申奥. 兼香型白酒高温大曲微生物群落演替规律的研究[D].武汉:华中农业大学, 2016.
LI S A.The study on the succession law of microbial community from high temperature Daqu of Maotai-Luzhou-flaor liquor[D].Wuhan:Huazhong Agricultural Uniersity, 2016.
[22] 王和玉, 刘延峰, 张巧玲, 等.1株来源于茅台酒酿造过程宛氏拟青霉MTDF-01的全基因组测序及分析[J].食品科学, 2019, 40(24):185-192.
WANG H Y, LIU Y F, ZHANG Q L, et al.Whole-genome sequencing and analysis of Paecilomyces ariotii MTDF-01, isolated during Maotai-flaor liquor brewing[J].Food Science, 2019, 40(24):185-192.
[23] WANG X D, BAN S D, HU B D, et al.Bacterial diersity of Moutai-flaour Daqu based on high-throughput sequencing method[J].Journal of the Institute of Brewing, 2017, 123(1):138-143.
[24] 陈蒙恩, 赵聪, 韩素娜, 等.基于高通量测序的陶融型大曲微生物群落结构分析[J].食品科学, 2021, 42(8):106-113.
CHEN M G, ZHAO C, HAN S N, et al.High-throughput sequencing reeals the microbial community structure in Taorong-type Daqu[J].Food Science, 2021, 42(8):106-113.
[25] 张倩, 韩保林, 李子健, 等.浓香型白酒包包曲微生物种群多样性及形成机制[J].食品与发酵工业, 2021, 47(18):99-106.
ZHANG Q, HAN B L, LI Z J, et al.Diersity and formation mechanism of the microflora in strong flaor Baijiu Baobaoqu[J].Food and Fermentation Industries, 2021, 47(18):99-106.
[26] 胡小霞, 黄永光, 涂华彬, 等.酱香型白酒1轮次酿造细菌的菌群结构[J].食品科学, 2020, 41(14):175-182.
HU X X, HUANG Y G, TU H B, et al.Bacterial diersity structure during the first round of pile and pit fermentation of Moutai-fiaor Baijiu[J].Food Science, 2020, 41(14):175-182.