食醋是具有悠久酿造历史的酸性调味品和保存剂,在人类生产生活中发挥非常重要的作用[1]。食醋酿造包括酒精发酵和醋酸发酵2个阶段,具体酿造流程为:糯米→粉碎→蒸煮→糖化→酒精发酵→酒醅→拌麸皮、大糠→醋酸发酵→封醅→淋醋→煎醋→贮存→成品。酒精发酵阶段将淀粉转化为乙醇,发酵成为用于制作食醋的低度酒(制醋酒),随后制醋酒进入醋酸发酵阶段,将乙醇转化成醋酸最终成为食醋。
食醋酒精发酵阶段包括淀粉质原料的糊化、糖化和酒化,与我国黄酒生产方式相似[2],主要是通过糖化酶、淀粉酶以及酒化酶系共同催化完成。在醋酸发酵阶段主要是通过醋酸菌、乳酸菌等微生物将乙醇氧化为醋酸,这些微生物除了产生乙酸还能产生大量的风味物质,赋予食醋丰富的口感和协调的香气[3-4]。食醋酒精发酵作为食醋酿造的第一阶段,对食醋质量具有重要影响,不仅为醋酸发酵提供前体乙醇,同时制醋酒中的氨基酸、有机酸及多种挥发性香气物质也是食醋风味的来源。
目前,已有诸多学者对食醋醋酸发酵阶段的风味及微生物群落结构动态变化进行研究[5-10],然而对食醋酒精发酵阶段的研究却鲜有报道。本研究首次通过HPLC及三代测序技术对食醋酒精发酵阶段的非挥发风味物质及微生物群落结构的动态变化进行详细分析,揭示食醋酒精发酵阶段酿造机理。
1 材料与方法
1.1 材料与试剂
食醋发酵醪样品和酒曲取自江苏制醋工厂车间。分别取0、48、96、144 h的发酵醪样品,设置3个平行,样品于-80 ℃保存。
三氯乙酸、异丙醇、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)等试剂均为分析纯,标准样品均为色谱纯。PrimeSTAR® Max DNA Polymerase、DNA marker,宝生物工程(大连)有限公司;4S Green Plus 无毒核酸染料染色,上海生工;FastDigest Green Buffer 2×,Thermo Fisher公司;PCR产物纯化试剂,杭州宝塞生物科技有限公司;引物由南京金斯瑞生物科技有限公司合成。
1.2 仪器与设备
PacBio RS II三代测序仪,美国太平洋生物科学公司;Waters e2695高效液相色谱仪,美国Waters公司;Thermo Fisher Trace气相色谱质谱联用仪,美国Thermo公司;5804R台式高速大容量离心机,德国Eppendorf公司;164-5050电泳仪,北京六一仪器厂;Uniersal Hood Ⅱ凝胶成像系统,美国Bio-RAD公司。
1.3 实验方法
样品预处理:将取得的发酵醪液于10 000 r/min条件下离心10 min,取离心后上清液进行指标测定。
1.3.1 基本理化指标的测定
总酸、pH和酒精度检测方法参照GB/T 13662—2018《黄酒》,还原糖浓度的测定采用DNS法[11]。
1.3.2 有机酸及氨基酸的测定
8种有机酸参照余宁华等[12]的方法进行测定,处理方法:0.75 mL上清液加入等体积三氯乙酸溶液(10%),摇匀后于4 ℃静置5 h,经10 000 r/min离心10 min,吸取上清液过0.22 μm滤膜,用于HPLC分析。17种游离氨基酸参照QB/T 4356—2012《黄酒中游离氨基酸的测定 高效液相色谱法》进行测定。
1.3.3 微生物群落结构的测定
提取不同批次、不同时间点发酵醪和酒曲的基因组,并扩增分析,样品信息如表1。
表1 样品信息
Table 1 Sample information
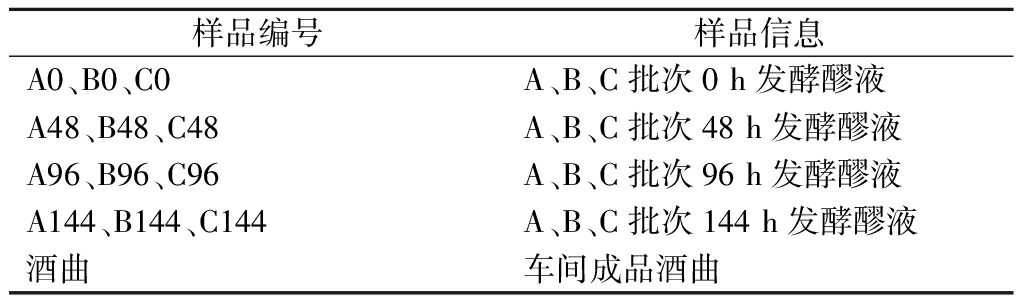
样品编号样品信息A0、B0、C0A、B、C批次0 h发酵醪液A48、B48、C48A、B、C批次48 h发酵醪液A96、B96、C96A、B、C批次96 h发酵醪液A144、B144、C144A、B、C批次144 h发酵醪液酒曲车间成品酒曲
提取发酵醪液与酒曲的基因组,提取方法参考文献[13]。
扩增分析:基因组扩增参照文献[14],选择细菌16S rDNA、真菌28S rDNA通用引物进行扩增。PCR产物纯化后用1.0%的琼脂糖凝胶电泳检测,送至内蒙古农业大学测序。测序结果利用QIIME软件[15]进行OTU分布统计、微生物群落、多样性分析等统计学分析。
2 结果与分析
2.1 食醋酒精发酵阶段基本理化指标测定
食醋酒精发酵阶段采用先糖化后发酵工艺,先将液化酶、糖化酶作用于米粉,后接种酵母、酒曲进行发酵,形成用于制造食醋的低度酒(制醋酒)。本研究分析制醋酒理化指标变化,如图1所示,发酵0 h时还原糖质量浓度为50.34 g/L,随着发酵的进行,因微生物生长及产酒消耗还原糖呈现先急后缓的下降趋势,在144 h降到2.50 g/L。总酸和酒精度呈现上升趋势,在144 h时总酸(以乙酸计)和酒精度分别达到4.71 g/L和8.43%ol,pH值在发酵过程中并未有明显的变化。
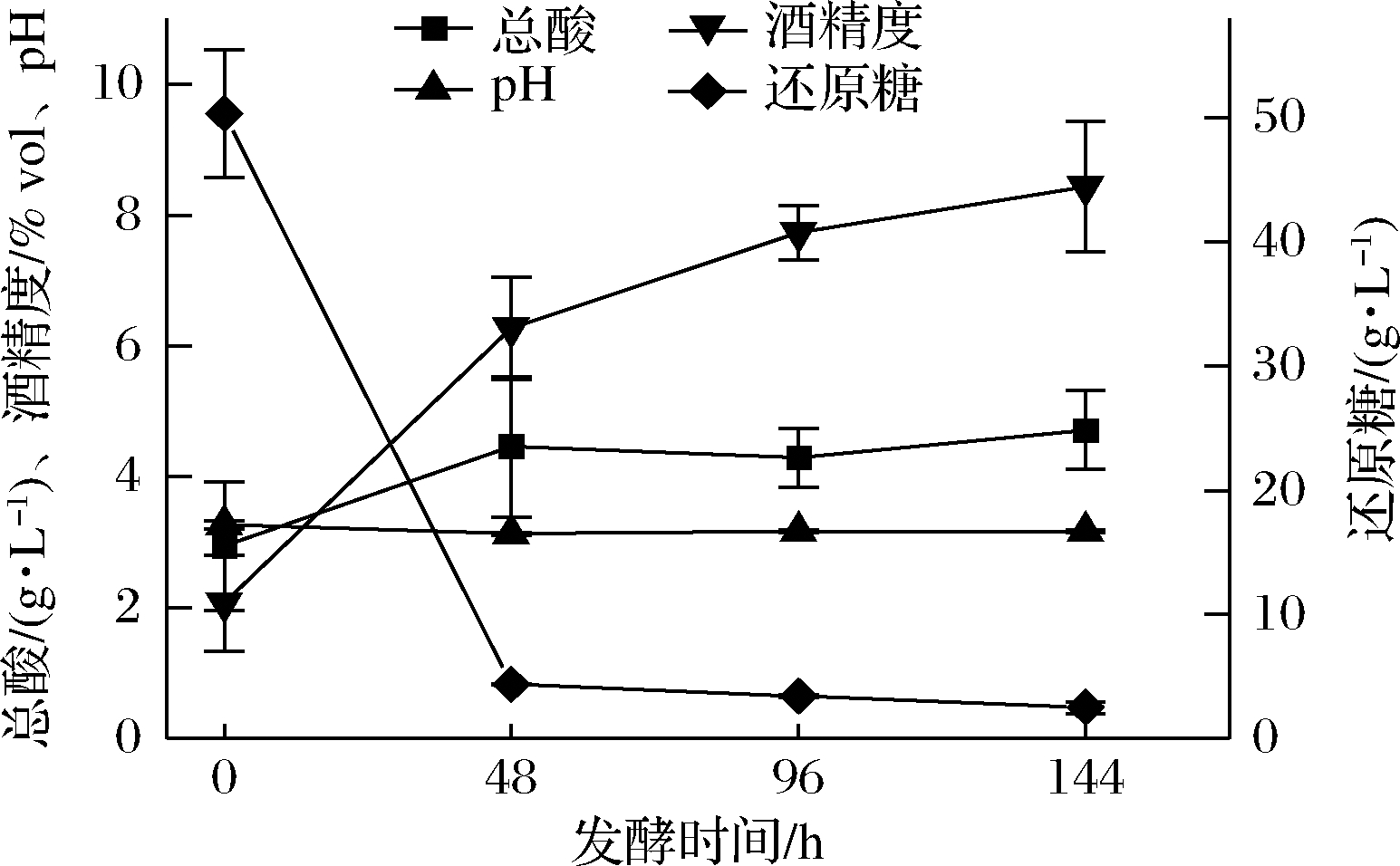
图1 食醋酒精发酵过程中理化指标的变化
Fig.1 Changes of physicochemical indexes during inegar alcohol fermentation process
2.2 食醋酒精发酵阶段有机酸与氨基酸的动态变化
在发酵过程中,制醋酒的有机酸质量浓度呈上升趋势(图2),144 h时达到(20.96±0.31)g/L。经检测得知,制醋酒中主要有机酸为乳酸和乙酸,与发酵黄酒一致[16],其在发酵过程中呈增长趋势,发酵144 h时分别达到(13.17±0.69)和(6.79±0.67)g/L,而其他有机酸质量浓度远低于传统发酵黄酒,这对制醋酒风味的丰富度具有一定影响。
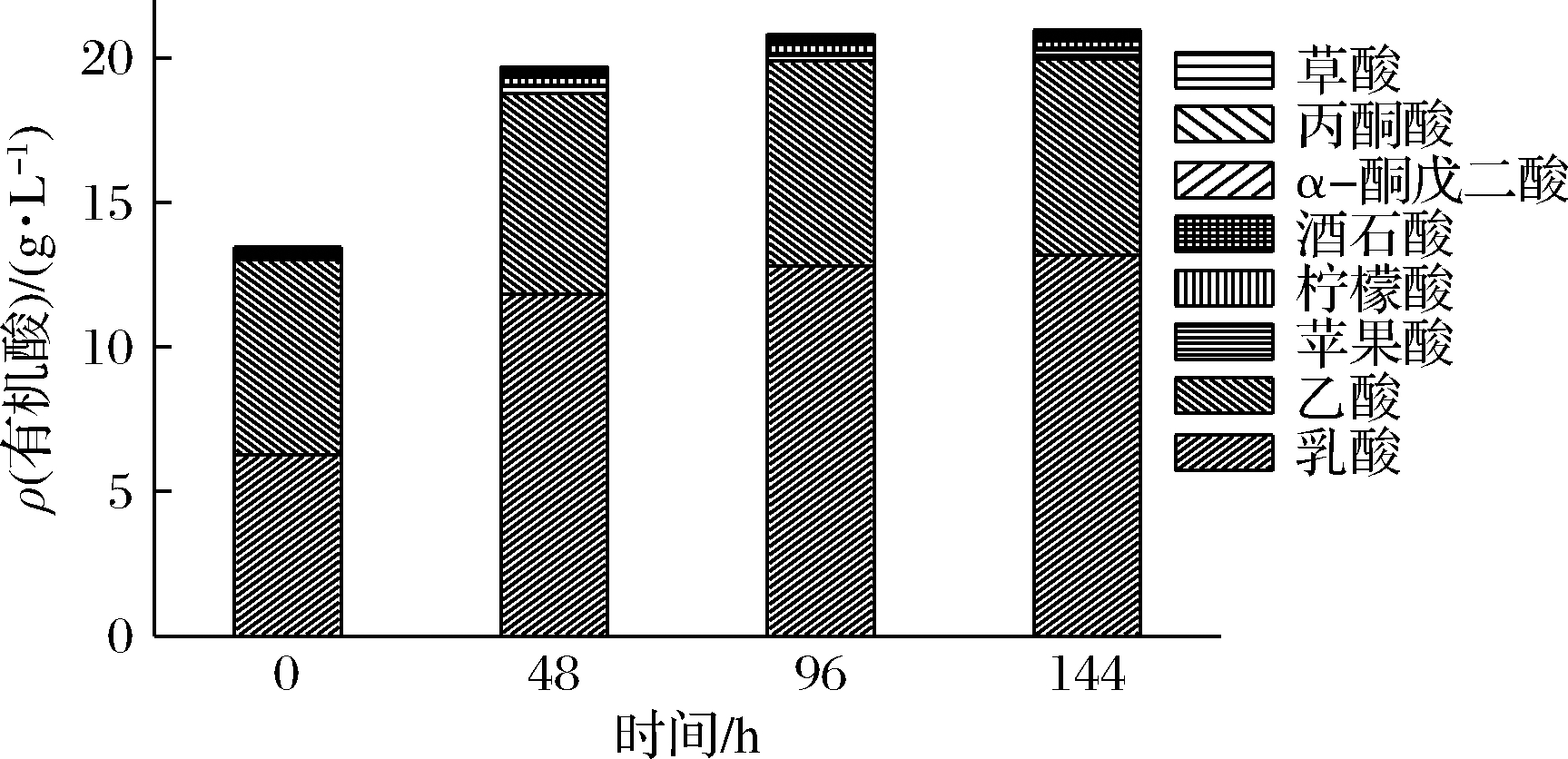
图2 食醋酒精发酵过程中有机酸质量浓度变化
Fig.2 Changes of organic acid concentration during inegar alcohol fermentation process
制醋酒发酵过程中氨基酸质量浓度变化如图3所示,共检测了17种氨基酸,其中包括6种甜味氨基酸,8种苦味氨基酸,2种鲜味氨基酸以及1种涩味氨基酸,其中制醋酒中甜味跟苦味氨基酸浓度最高,分别占据氨基酸总量18.36%和68.89%,然而虽酿制工艺与黄酒相似,但制醋酒与发酵黄酒中甜味与苦味氨基酸占比(31.22%、48.06%)差异较大。同时氨基酸总量在发酵过程中呈现上升趋势,到144 h时达到692.61 mg/L,但制醋酒中总氨基酸浓度远低于发酵黄酒[17]。有研究发现氨基酸主要来源于原料中蛋白质分解和微生物的代谢[18],食醋酒精发酵阶段氨基酸分布占比和浓度受微生物代谢的影响,因此需进一步分析食醋酒精发酵阶段微生群落结构。

图3 食醋酒精发酵过程中氨基酸质量浓度变化
Fig.3 Changes of amino acid concentration during inegar alcohol fermentation process
2.3 制醋酒发酵液及酒曲微生物群落结构的变化
2.3.1 发酵醪与酒曲中细菌群落结构分析
对采集自工厂的发酵醪液和酒曲样品进行测序,经测序,样品的Shannon指数随着测序深度的增加趋于平坦,说明尽管随着测序量的增加新的种系型可能会被发现,但是微生物的多样性已经不再随之发生变化,样品测序数量达到了分析的要求,可进行后续分析。分析发酵过程中细菌群落结构,如图4所示。

图4 发酵醪液及酒曲中真菌群落结构组成(丰度1%以上)
Fig.4 Bacteria community structure of fermentation mash and Jiuqu (abundance aboe 1%)
发酵144 h时,发酵醪中主要由戊糖乳杆菌(Lactobacillus pentosus,28.60%)、副干酪乳杆菌(Lactobacillus paracasei,19.99%)、德氏乳杆菌(Lactobacillus delbrueckii,13.93%)以及解淀粉乳杆菌(Lactobacillus amylolyticus,22.56%)组成,对比酒曲中细菌群落结构,其主要由地衣芽孢杆菌(Bacillus licheniformis,84.16%)组成,与发酵醪液差异较大。在发酵过程中,戊糖乳杆菌(L. pentosus)和柠檬酸明串珠菌(Leuconostoc citreum)在发酵过程中呈下降趋势,解淀粉乳酸杆菌(L.pentosus)、德氏乳杆菌(L.delbrueckii)呈上升趋势,副干酪乳杆菌(L. paracasei)呈现先上升后下降的趋势。发酵过程中,虽微生物分布占比略有差异,但发酵醪液中微生物均以戊糖乳杆菌(L. pentosus)、副干酪乳杆菌(L. paracasei)、柠檬酸明串珠菌(L. citrinum)、解淀粉乳酸杆菌(L. pentosus)和德氏乳杆菌(L. delbrueckii)为主导。
在发酵过程中形成了以乳酸菌为主导、群落结构简单的微生物群系,这可能是造成制醋酒中乳酸浓度较高及风味单薄的原因之一。虽有文献报道,明串珠菌具有一定的益生效果,能够代谢产生双乙酰、乙酸、乙醇等风味物质[19-20],但食醋酒精发酵过程中明串珠菌相对丰度较低,对于风味的影响较小。同时酒曲中地衣芽孢杆菌(B. licheniformis,84.16%)相对丰度最高,有高分泌碱性蛋白酶的能力,是工业酶生产中最重要的细菌之一[21],然而其却未能成为黄酒发酵醪中的优势物种,可能是由于地衣芽孢杆菌适宜于碱性环境下生长(pH 6.8~8.0)[22],而食醋酒精发酵阶段添加酒曲量较低且黄酒发酵醪的pH较低(3.17~3.27),使得酒曲中的地衣芽孢杆菌未能在发酵醪中成为优势菌种。虽芽孢杆菌未能在发酵醪液中成为优势菌,但其可分泌蛋白酶、淀粉酶等,发挥液化和糖化作用,并且可通过三羧酸循环产生有机酸,有助于提升酒曲乃至食醋的品质[23-24]。
2.3.2 发酵醪及酒曲中真菌群落结构分析
发酵醪及酒曲中真菌群落结构如图5所示,在种水平上,酿酒酵母(Saccharomyces cereisiae)在发酵醪和酒曲中均占据绝对优势。酒曲中酿酒酵母占比较高,相对丰度达到96.64%,可能与工厂制曲环境以及接触器具有关。除酿酒酵母以外,酒曲中具有糖化、液化能力的曲霉、根霉属占比较少,导致酒曲在发酵中起的糖化、液化作用十分有限,这也是工厂在食醋酒精发酵阶段主要利用液化酶和糖化酶进行淀粉酶解的原因之一。同时在发酵醪中,酿酒酵母相对丰

图5 发酵醪液及酒曲中真菌群落结构组成
Fig.5 Fungal community structure of fermentation mash and Jiuqu
度也最高,达到99%以上,发酵醪中酿酒酵母占绝对优势可能与食醋酒精发酵中利用酒曲以及纯种黄酒活性干酵母接种有关。
根据微生物检测结果可知,食醋酒精发酵过程中形成了以乳杆菌、明串珠菌和酿酒酵母为主导的微生物群系,这可影响发酵过程有机酸以及氨基酸的浓度与组成。有研究分析细菌、真菌与有机酸之间的关系发现,乳杆菌属、明串珠菌属是乳酸、乙酸、苹果酸、柠檬酸等主要有机酸的主要贡献者,且在真菌与有机酸模型的分析中发现,酵母菌属与有机酸的形成存在一定的相关性[25]。同时有研究对3株酿酒酵母发酵过程中游离氨基酸变化进行分析,发现3株酿酒酵母发酵液中均含有17种游离氨基酸,但游离氨基酸组成和浓度存在明显差异[26],即酿酒酵母可产生氨基酸但不同的酿酒酵母产生的氨基酸的浓度与种类不同,这可能也是造成制醋酒中氨基酸浓度、组成与传统黄酒差异较大的原因之一。同时也有研究通过宏基因组功能注释发现,酵母属涉及了葡萄糖降解、乳酸生成与代谢、乙酸生成、乙醇生成等的完整酶系、氨基酸、γ-氨基丁酸生成和降解、醇类、脂肪酸、酯类、酚类物质等物质代谢均于酵母属相关[27],即酿酒酵母在酒精发酵阶段对于葡萄糖、酒精、氨基酸、有机酸的代谢具有重大作用。由此可知,食醋酒精发酵中以乳杆菌、明串珠菌和酿酒酵母为主导的微生物群系对发酵过程理化指标以及非挥发性风味物质有机酸、氨基酸的浓度以及组成具有十分重要的作用。
3 结论
本研究对酒精发酵阶段制醋酒的理化指标及非挥发性风味物质进行分析,以研究酒精发酵阶段酿造机理进一步指导生产。酒精发酵结束时(144 h)酒精度在7%~9%ol,总氨基酸质量浓度为692.61 mg/L,较传统发酵黄酒低[16],可能是由于酒精发酵阶段采用的是黄酒的简化工艺,米水比低、发酵时间短、酵母接种量低,导致微生物群落结构差异进而造成指标较低。
通过分析食醋酒精发酵醪液中微生物发现,其构成主要为解淀粉芽孢杆菌(L. amylolyticus)、德氏乳杆菌(L. delbrueckii)、副干酪乳杆菌(L. paracasei)、戊糖乳杆菌(L. pentosus)、柠檬酸明串珠菌(L. citreum)及酿酒酵母(S. cereisiae),相对丰度>1%的仅有6种,微生物群落结构简单,且均有产酸特性,可大量产酸。同时酒曲中的细菌和真菌分别以地衣芽孢杆菌(B.licheniformis)和酿酒酵母(S. cereisiae)为主,酒曲中具有糖化、液化作用的霉菌占比极低(1%以下),其发挥的糖化、液化能力有限,这也是食醋酒精发酵过程中利用糖化、液化酶进行水解的原因之一。
本研究明确了食醋酒精发酵阶段以乳酸菌、酿酒酵母为主导,他们对于有机酸、氨基酸的质量浓度和组成具有较大的影响。在本研究基础上,可在食醋酒精发酵阶段选用性能优良的酵母,以调整有机酸、氨基酸质量浓度达到产品香气、口感的协调。同时研究发现,酒曲微生物结构简单、糖化和液化能力相对较弱,由此,可从食醋制曲阶段入手改良制曲工艺,丰富酒曲中微生物群落结构,增加酒曲液化、糖化力,使其逐渐取代酶制剂在食醋酿造中的使用。本研究分析食醋酒精发酵阶段非挥发性风味物质变化,并利用三代测序技术分析微生物群落结构组成并探讨其对于理化指标与非挥发性风味物质的影响,解析了食醋酒精发酵阶段酿造机理,可为改进食醋发酵工艺和调控食醋产品品质提供支持。
[1] LI S, LI P, FENG F, et al.Microbial diersity and their roles in the inegar fermentation process[J].Applied Microbiology and Biotechnology, 2015, 99(12):4 997-5 024.
[2] 王宗敏. 镇江香醋醋酸发酵阶段菌群结构变化与风味物质组成之间的相关性研究[D].无锡:江南大学, 2016.
WANG Z M.Correlation between structural shifts of microbiota and compositions of flaors during the stage of acetic acid fermentation of Zhenjiang aromatic inegar[D].Wuxi:Jiangnan Uniersity, 2016.
[3] LIU D R, ZHU Y, BEEFTINK R, et al.Chinese inegar and its solid-state fermentation process[J].Food Reiews International, 2004, 20(4):407-424.
[4] 许伟, 张晓君, 许泓瑜, 等.镇江香醋醋酸发酵过程中细菌群落组成分析[J].微生物学通报, 2007, 34(4):646-649.
XU W, ZHANG X J, XU H Y, et al.Analysis of bacterial communities in aerobic solid-fermentation culture of Zhenjiang Hengshun inegar[J].Microbiology, 2007, 34(4):646-649.
[5] 聂志强, 韩玥, 郑宇, 等.宏基因组学技术分析传统食醋发酵过程微生物多样性[J].食品科学, 2013, 34(15):198-203.
NIE Z Q, HAN Y, ZHENG Y, et al.Metagenomic analysis of microbial diersity in the traditional inegar fermentation process[J].Food Science, 2013, 34(15):198-203.
[6] 聂志强, 汪越男, 郑宇, 等.传统食醋酿造过程中微生物群落的多样性及功能研究进展[J].中国酿造, 2012, 31(7):1-6.
NIE Z Q, WANG Y N, ZHENG Y, et al.The diersity and functional feature of microflora in traditional inegar brewing process[J].China Brewing, 2012, 31(7):1-6.
[7] 孙宗保, 赵杰文, 邹小波, 等.镇江香醋特征香气成分加工过程中的变化和形成机理分析[J].中国食品学报, 2010, 10(3):120-127.
SUN Z B, ZHAO J W, ZOU X B, et al.Changes of characteristic aroma component in Zhenjiang fragrance inegar during processing and analysis of their formation mechanism[J].Journal of Chinese Institute of Food Science and Technology, 2010, 10(3):120-127.
[8] LU Z M, LIU N, WANG L J, et al.Elucidating and regulating the acetoin production role of microbial functional groups in multi species acetic acid fermentation[J].Applied and Enironmental Microbiology, 2016, 82(19):5 860-5 868.
[9] WANG Z M, LU Z M, SHI J S, et al.Exploring flaour-producing core microbiota in multi species solid-state fermentation of traditional Chinese inegar[J].Scientific Reports, 2016, 6:26818.
[10] WANG Z M, LU Z M, YU Y J, et al.Batch-to-batch uniformity of bacterial community succession and flaor formation in the fermentation of Zhenjiang aromatic inegar[J].Food Microbiology, 2015, 50:64-69.
[11] 张惟杰. 糖复合物生化研究技术[M].2版.杭州:浙江大学出版社, 1999.
ZHANG W J. Biochemical research technology of glycoconjugates[M]. Hangzhou: Zhejiang Uniersity Press, 1999.
[12] 余宁华, 陆震鸣, 许伟, 等.基于主成分分析的中国发酵食醋有机酸含量差异性分析[J].食品与发酵工业, 2010, 36(10):144-148.
YU N H, LU Z M, XU W, et al.Regional difference of organic acid contents in Chinese fermented inegar based on principal component analysis[J].Food and Fermentation Industries, 2010, 36(10):144-148.
[13] 薛景波. 黄酒接种生麦曲微生物群落结构及分离培养微生物的产酶、产香性质分析[D].无锡:江南大学, 2016.
XUE J B.Microbial community in Chinese rice wine inoculated raw wheat Qu and analysis of enzyme and flaour produced by isolated microbes[D].Wuxi:Jiangnan Uniersity, 2016.
[14] GOLDFARB K C, KARAOZ U, HANSON C A, et al.Differential growth responses of soil bacterial taxa to carbon substrates of arying chemical recalcitrance[J].Frontiers in Microbiology, 2011, 2:94.
[15] CAPORASO J G, KUCZYNSKI J, STOMBAUGH J, et al.QIIME allows analysis of high-throughput community sequencing data[J].Nature Methods, 2010, 7(5):335-336.
[16] 刘彩霞. 乳杆菌酸化循环浸米工艺降低黄酒生物胺的研究[D].无锡:江南大学, 2020.
LIU C X.Reducing biogenic amines in Huangjiu by recycling the Lactobacillus enhanced rice soaking water[D].Wuxi:Jiangnan Uniersity, 2020.
[17] 诸葛庆, 李博斌, 刘兴泉, 等.用离子色谱法分析研究黄酒中的氨基酸[J].酿酒科技, 2008(4):108-111.
ZHUGE Q, LI B B, LIU X Q, et al.Comparison study of amino acids in yellow rice wine by high-performance anion-exchange chromatography[J].Liquor-Making Science & Technology, 2008(4):108-111.
[18] 周建弟. 浅谈黄酒中的氨基酸及其含量的控制[J].酿酒科技, 2002(4):73-74.
ZHOU J D.Discussion on amino acid in yellow rice wine and controls on its content[J].Liquor-Making Science & Technology, 2002(4):73-74.
[19] 韩瑨, 刘振民, 郭本恒, 等.柠檬明串珠菌的研究进展[J].食品研究与开发, 2014, 35(16):126-131.
HAN J, LIU Z M, GUO B H, et al.Progress in study on Leuconostoc citreum[J].Food Research and Deelopment, 2014, 35(16):126-131.
[20] 史建波. 明串珠菌产葡聚糖、甘露醇和双乙酰的研究[D].天津:河北工业大学, 2011.
SHI J B.Study on production of dextran, mannitol, and diacetyl by Leuconostoc[D].Tianjin:Hebei Uniersity of Technology, 2011.
[21] 黄磊, 董自星, 金鹏, 等.地衣芽胞杆菌碱性蛋白酶嗜碱突变体的特征分析[J].食品与发酵工业, 2017, 43(6):34-40.
HUANG L, DONG Z X, JIN P, et al.Biochemical characterization of alkalophilic mutant of Bacillus licheniformis protease[J].Food and Fermentation Industries, 2017, 43(6):34-40.
[22] 刘海进. 地衣芽孢杆菌发酵豆粕的研究[D].合肥:安徽农业大学, 2011.
LIU H J.Study on fermentation soybean meal with Bacillus licheniformis[D].Hefei:Anhui Agricultural Uniersity, 2011.
[23] ZHENG X W, YAN Z, NOUT M J R, et al.Microbiota dynamics related to enironmental conditions during the fermentatie production of Fen-Daqu, a Chinese industrial fermentation starter[J].International Journal of Food Microbiology, 2014, 182-183:57-62.
[24] 王进龙. 山西老陈醋大曲中芽孢杆菌的分离鉴定及特性研究[D].太谷:山西农业大学, 2016.
WANG J L.Isolation and identification of Bacillus from Daqu of Shanxi mature inegar and research on character of strains[D].Taigu:Shanxi Agricultural Uniersity, 2016.
[25] 刘芸雅. 绍兴黄酒发酵中微生物群落结构及其对风味物质影响研究[D].无锡:江南大学, 2015.
LIU Y Y.Characterization of microflora and their functions on flaor compounds in Shaoxing rice wine[D].Wuxi:Jiangnan Uniersity, 2015.
[26] 裴芳艺, 薛迪, 马岩石, 等.3株酿酒酵母发酵过程中游离氨基酸含量变化分析[J].农学学报, 2021, 11(6):68-72.
PEI F Y, XUE D, MA Y S, et al.Free amino acids in 3 Saccharomyces cereisiae during fermentation culture:Content analysis[J].Journal of Agriculture, 2021, 11(6):68-72.
[27] 陈青柳. 绍兴机械化黄酒风味形成途径和功能微生物的研究[D].无锡:江南大学, 2018.
CHEN Q L.Study on the flaor formation and functional microorganism of Shaoxing mechanized Huangjiu[D].Wuxi:Jiangnan Uniersity, 2018.