流感病毒属于正黏病毒,人流感病毒中的甲型流感曾多次引发世界性大流行。目前,H1N1和H3N2是全球常见的甲型流感病毒,仍然威胁着人类健康[1]。根据“肺-肠轴”理论,肠道菌群对维持呼吸道的健康具有重要的调节作用,肠道微生物及其代谢产物可以调节宿主的免疫应答以抵抗病毒感染。例如,肠道微生物的组分对维持正常的Toll样受体先天信号至关重,肠内启动的Toll样受体信号可诱导肺部的免疫反应,而肠道菌群常见的代谢产物短链脂肪酸可通过血液运输到骨髓,促进造血作用刺激造血干细胞向抗炎环境分化,抗炎因子转移到呼吸道后抑制呼吸道的炎症反应[2]。已有研究表明,益生菌可以通过多种作用机制以辅助机体抵抗病毒的侵染,包括提高机体非特异性和特异性免疫反应[3]。宋翔等[4]验证了植物乳杆菌BLCC2-0125可同时增强黏膜免疫、细胞免疫及体液免疫,为机体在病毒感染早期提供保护。BOSCH等[5]研究发现植物乳杆菌CECT7315/7316与流感疫苗联用后,可增加流感特异性IgA和IgG。两歧双歧杆菌被证实具有调节体液免疫和细胞免疫的作用,可以平衡Th1/Th2免疫应答来抵抗流感病毒的感染[6]。本研究中,使用H3N2流感病毒侵染小鼠模型来探究益生菌对H3N2感染后机体免疫调控影响的异同以及其对肠道菌群结构的影响。
1 材料与方法
1.1 实验菌株与病毒
实验使用的菌株Bifidobacterium bifidum FXJCJ9M10(B.bifidum 1),FSDJN705(B.bifidum 2),Lactobacillus acidophilus JCM1132(L.acidophilus 1)、FFJND6L5(L.acidophilus 2),Bifidobacterium bree CCFM1025(B.bree 1)、CCFM1026(B.bree 2)均保藏于江南大学食品微生物保藏中心。所有菌株接种在mMRS(MRS培养基加入0.5 g/L L-半胱氨酸盐酸盐)培养基中,37 ℃厌氧培养24 h。使用梯度稀释和平板计数的方法计算菌悬液的活菌数,确保每只小鼠灌胃的活菌数为2.5×108 CFU/d。甲型流感病毒H3N2由禽流感重点实验室提供。
1.2 实验试剂和仪器设备
蛋白胨、牛肉膏、酵母粉、葡萄糖、K2HPO4、乙醚、浓硫酸、无水硫酸钠,国药集团化学试剂有限公司;EDTA-K2抗凝管,恒康医疗科技有限公司;利巴韦林,北京伊诺凯科技有限公司;增强型BCA蛋白定量检测试剂盒、蛋白酶抑制剂混合物(通用型,50×)、RIPA裂解液(强,无抑制剂)、苏木精-伊红(hematoxylin-eosin, H&E)染色液,上海碧云天生物技术有限公司;多聚甲醛,武汉赛维尔生物技术有限公司;IL-6、IFN-β、TNF-α、IL-1β、IL-10、IFN-γ酶联免疫吸附试验试剂盒,南京森贝伽生物技术有限公司;粪便Fast DNA提取试剂盒,美国MP Biomedicals公司;TIANgel Mini Purification Kit PCR产物纯化试剂盒,杭州倍沃医学科技有限公司;2×Taq master mix预混液,苏州康为世纪生物科技有限公司。
ST3100 pH计,奥豪斯仪器有限公司;ME3002E电子天平,梅特勒-托利多仪器有限公司;MX-S涡旋混匀仪,大龙兴创实验仪器(北京)股份公司;移液器,德国Eppendorf(艾本德)股份公司;DG250厌氧培养箱,英国Don Whitley Scientific 公司;SW-CJ-1FD超净工作台,苏州安泰空气技术有限公司;Micor21R高速冷冻离心机、Multiskan GO半自动酶标仪,美国Thermo Fisher Scientific公司;BC-500自动血液分析仪,深圳明瑞生物医药电子有限公司;C1000 Touch PCR热循环仪,美国Bio-Rad Laboratories公司;SCIENTZ-48高通量组织研磨器,宁波新芝生物科技股份有限公司;MB100-2A微孔板恒温振荡器,杭州奥盛仪器有限公司;PANNORMIC MIDI数字切片扫描仪,匈牙利3DHistech有限公司;MiSeq高通量测序平台,美国Illumina公司。
1.3 动物实验
雌性ICR小鼠(3~4周龄)购自浙江维通利华实验动物技术有限公司,动物实验方案及实验操作均由动物伦理委员会批准(No.20210415)。小鼠被随机分为空白组、模型组、药物阳性参照奥司他韦组和6个实验组(每组8只小鼠),并进行为期7 d的适应。在病毒感染前两周开始每天用灌胃的方式对小鼠进行菌悬液(实验组)或生理盐水(空白组、模型组和药物阳性参照奥司他韦组)处理,持续到小鼠牺牲。干预两周后,除空白组以外,所有组别的小鼠均采用鼻滴的方式感染H3N2病毒株,剂量为5倍50%致命剂量(5LD50)(图1)。药物阳性参照组在48 h内使用口服的奥司他韦治疗。在病毒感染后,每天称量小鼠体质量直至牺牲。

图1 动物实验时间轴
Fig.1 Time line of animal experiments
1.4 血常规检查
部分血液样本使用含有EDTA-K2抗凝管收集后,使用自动血液学分析仪,进行血细胞分析。剩余的血液离心后分离得到血清,保存在-80 ℃,用于后续细胞因子检测。
1.5 肺部损伤和病理分析
用0.8 mL无菌PBS进行3次肺泡灌洗,部分肺泡灌洗液(bronchoaleolar laage fluid,BALF)保存在4 ℃用于乳酸脱氢酶活性检测和总蛋白检测,剩余BALF存放于-80 ℃用于后续细胞因子检测。取左肺叶固定在福尔马林中,然后使用石蜡包埋,切成5 μm厚度后进行H&E染色。
1.6 细胞因子检测
血清、BALF和肺组织匀浆上清中的细胞因子:IL-6、IL-1β、TNF-α、IL-10、IFN-β、IFN-γ的表达水平利用ELISA试剂盒进行检测。
1.7 肠道菌群
牺牲前收集小鼠的粪便,使用Fast DNA SPIN提取试剂盒提取粪便中的DNA。PCR扩增3~4区域后,使用TIAN gel Mini Purification Kit 纯化PCR产物,经过浓度测定及文库构建后利用Illumina平台进行16S测序[7],然后分析肠道菌群多样性的变化以及使用线性判别分析(liner discriminant analysis effect size,LEfSe)的方法比较不同组别肠道微生物群落之间的差异。
1.8 数据分析
采用单因子方差分析和Fisher’s LSD test进行差异性分析。数据使用平均值±标准误差表示。P值<0.05认为具有显著性差异,与模型组相比,*表示P<0.05,**表示P<0.01,***表示P<0.001,****表示P<0.0001。 肠道微生物群的数据使用QIIME2 2019.7(https://iew.qiime2.org/)分析。
2 结果与分析
2.1 不同益生菌对H3N2感染小鼠体质量减轻和肺部损伤的影响
在H3N2感染后,模型组小鼠的体质量持续下降。益生菌和奥司他韦的治疗在不同程度上缓解了体质量下降的症状。其中,B.bifidum 2的作用效果最好,L.acidophilus 1和L.acidophilus 2对体质量下降的作用与奥司他韦相似(图2-a)。BALF中乳酸脱氢酶活性是细胞毒性指标,模型组小鼠在感染病毒后由于肺部出现损伤,导致BALF中乳酸脱氢酶活性与空白组相比显著增加。
尽管部分益生菌干预有助于降低乳酸脱氢酶的活性,但与模型组无显著性差异(图2-b)。此外,病毒感染造成的肺部损伤会导致组织液外渗,增加BALF中蛋白质含量。使用奥司他韦治疗后,BALF中的蛋白质的含量显著降低,说明肺部损伤得到有效缓解。B.bifidum 2、 B.bree 1和B.bree 2显著降低了BALF中的蛋白质含量,说明这3株益生菌可显著缓解小鼠的肺部损伤,其中,B.bifidum 2效果优于其他菌株(图2-c)。
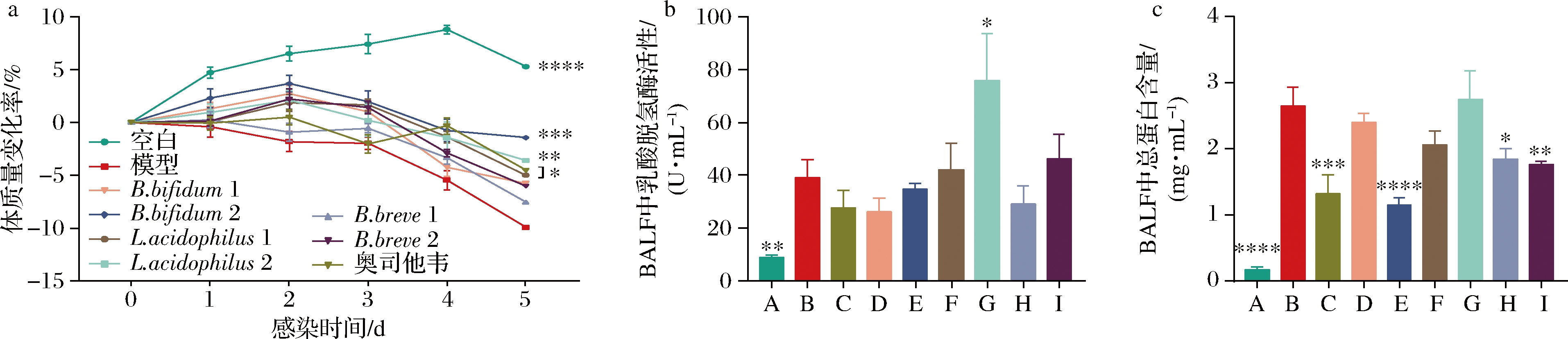
A-空白;B-模型;C-奥司他韦;D-B.bifidum 1;E-B.bifidum 2;F-L.acidophilus 1;G-L.acidophilus 2;H-B.bree 1;I-B.bree 2 a-H3N2病毒感染后5 d内小鼠体质量的变化率;b-小鼠BALF中乳酸脱氢酶活性;c-小鼠BALF中总蛋白含量
图2 益生菌对H3N2病毒感染后体质量减轻和肺部损伤的影响
Fig.2 Effects of probiotics on weight loss and lung damage after H3N2 irus infection
根据肺部病理切片可知,空白组小鼠肺部肺泡、气管周和血管周均无明显的炎症细胞聚集(图3-a),H3N2感染后,肺泡、气管周和血管周都出现了严重的炎症细胞浸润现象(图3-b)。B.bifidum 2(图3-e)、L.acidophilus 2(图3-g)和B.bree 1(图3-h)干预后,气管周和血管周基本不见炎症细胞浸润(黑色箭头),对肺部炎症的缓解效果优于同种菌的另一菌株。益生菌对H3N2流感病毒感染的缓解效果存在菌株差异,B.bifidum 2的作用效果优于其他益生菌。本研究的结果显示,益生菌的干预在一定程度上可以缓解流感病毒H3N2给机体造成的损伤并存在菌株差异性,其中B.bifidum 2的缓解效果最好。
2.2 不同益生菌对H3N2感染小鼠肺部免疫应答的影响
与空白组相比,模型组小鼠感染H3N2病毒后,小鼠肺部的炎症因子IFN-γ、TNF-α、IL-1β显著增加,而益生菌干预则有助于抑制炎症因子的表达(图4-b~图4-d)。所有益生菌干预组中,肺部的IL-1β和TNF-α水平均显著降低(图4-c、图4-d)。然而,只有B.bifidum 2组中IL-1β和TNF-α水平与空白组相似,其他益生菌干预使得这2种炎症因子水平低于空白组。另外,B.bifidum 2和L.acidophilus 2组小鼠肺部IFN-γ与模型组相比显著降低,恢复至与空白相当水平(图4-b)。除了奥司他韦和B.bifidum 1外,其余干预组均降低了肺部IL-6水平,B.bifidum 2、B.bree 1和B.bree 2作用效果最显著(图4-a)。

a-空白组;b-模型组;c-药物阳性参照奥司他韦组;d-B.bifidum 1组; e-B.bifidum 2组;f-L.acidophilus 1组;g-L.acidophilus 2组; h-B.bree 1组;i-B.bree 2组
图3 益生菌对H3N2流感病毒感染后肺部病理的影响
Fig.3 Effects of probiotics on lung pathology after H3N2 influenza irus infection
H3N2感染后,肺部的Ⅰ型干扰素IFN-β较空白组降低,而益生菌干预可以恢复肺部Ⅰ型干扰素的响应,其中L.acidophilus 2和B.bree 1效果最显著(图4-e)。此外,B.bifidum 2、L.acidophilus 2和B.bree 2显著降低了小鼠肺部IL-10水平(图4-f)。
综上,本研究中益生菌菌株具有抑制肺部炎症因子增加的作用,但不同益生菌的作用效果有显著的区别。B.bifidum 2有助于维持小鼠肺部先天免疫因子IL-1β和TNF-α的水平,尽管TNF-α和IL-1β通常被认为是炎症因子,但同时也是先天免疫抵抗病原体入侵的重要媒介,因此维持其正常水平对机体发挥先天免疫保护、抵抗病毒感染和减轻组织损伤非常关键[8-10]。
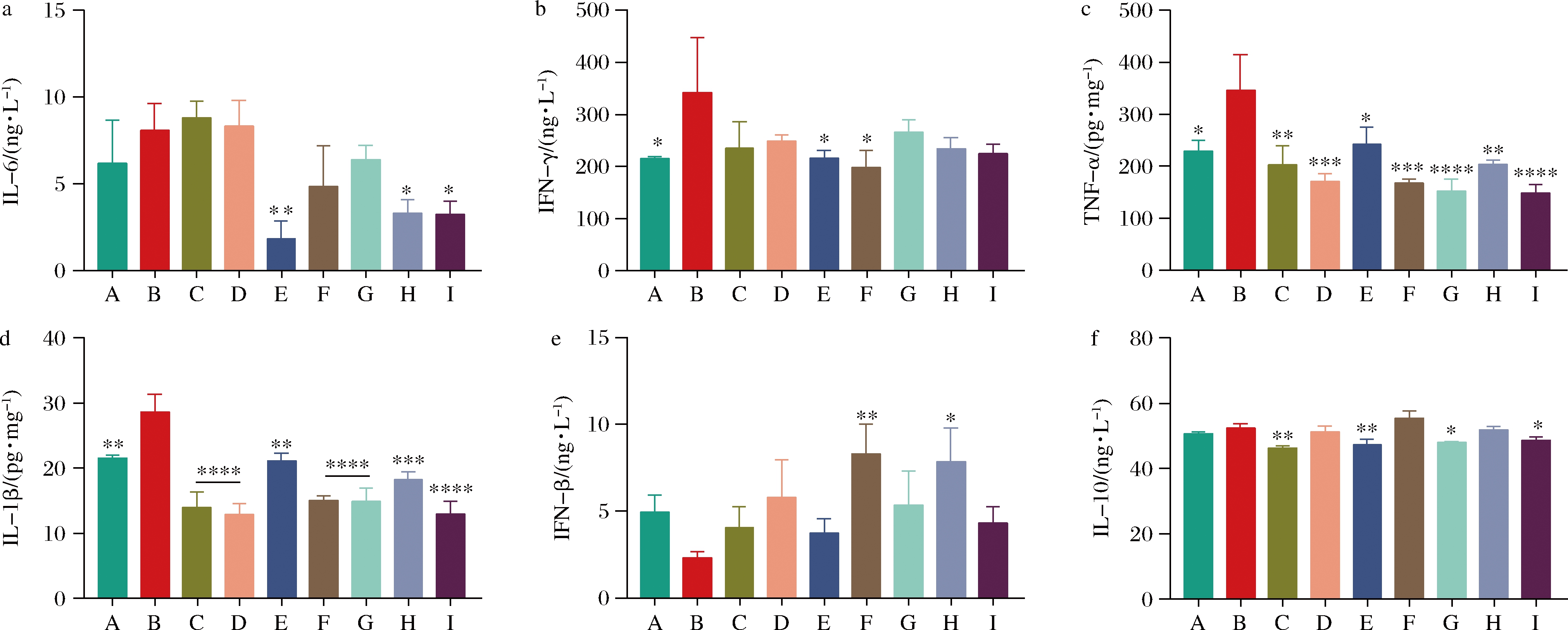
A-空白;B-模型;C-奥司他韦;D-B.bifidum 1;E-B.bifidum 2;F-L.acidophilus 1;G-L.acidophilus 2;H-B.bree 1;I-B.bree 2 a-BALF中IL-6水平;b-BALF中IFN-γ水平;c-肺组织匀浆中TNF-α水平;d-肺组织匀浆中IL-1β水平; e-BALF中IFN-β水平;f-BALF中IL-10水平
图4 益生菌对H3N2流感病毒感染后肺部免疫应答细胞因子水平的影响
Fig.4 Effect of probiotics on the leel of cytokines in lungs after H3N2 influenza irus infection
2.3 不同益生菌对H3N2感染小鼠系统免疫应答的影响
与空白组相比,模型组在H3N2感染后血液中的淋巴细胞占比显著降低(图5-a),而中性粒细胞和单核细胞的百分比显著增加(图5-b、图5-c),说明肺部感染引起了系统免疫响应。奥司他韦治疗后,淋巴细胞有明显的恢复,使用B.bifidum 1、B.bifidum 2和B.bree 2干预也具有恢复淋巴细胞水平的效果(图5-a)。此外,B.bifidum的干预显著降低中性粒细胞和单核细胞的水平,B.bree降低中性粒细胞水平,其中B.bree 1的干预部分恢复了血液中单核细胞的水平(图5-b、图5-c)。与前两者相比,L.acidophilus对血细胞的影响较小。
H3N2感染后,小鼠血清中IL-6水平显著增加,与上述系统免疫响应的结果一致。实验组中,除了L.acidophilus 2和B.bree 1外,其他菌株均能显著降低血清中IL-6水平,其中B.bifidum 1和L.acidophilus 1效果最显著(图5-d)。然而,H3N2感染却显著降低了血清中促炎因子IL-1β和TNF-α的水平(图5-e、图5-f),可能抑制了小鼠先天性免疫的响应[10]。在益生菌干预组中,除了B.bifidum 1,益生菌干预都增加了小鼠血清中的TNF-α水平。其中,B.bifidum 2血清中的TNF-α水平最高(图5-e)。此外,B.bifidum 2显著恢复了血清中IL-1β水平(图5-f)。结合肺部较高IL-1β和TNF-α表达水平,B.bifidum 2可能激活了机体的先天免疫响应以缓解H3N2感染。
模型组小鼠血清中IL-10水平相较于空白组没有变化,而B.bifidum 1、B.bifidum 2、L.acidophilus 2和B.bree 2均显著增加了IL-10水平(图5-g)。益生菌可以通过激活机体的免疫应答以缓解H3N2感染,除了增强先天免疫应答中促炎因子的响应外,益生菌还增加抗炎因子IL-10的水平,维持免疫反应的平衡,以减少抵抗病原体所引起的炎症反应对机体造成的损伤[11]。B.bifidum除了增加IL-10水平外,还增加了IFN-β在血清中的水平(图5-h),Ⅰ型干扰素响应是机体抵抗病毒感染的重要途径[12]。
2.4 不同益生菌对H3N2感染小鼠肠道菌群的影响
根据“肺-肠轴”理论,肠道微生物对维持呼吸道的健康起到关键作用[2]。α多样性指数eenness和Shannon显示,H3N2病毒感染后,肠道菌群的多样性增加,说明呼吸道病毒的感染影响了小鼠的肠道菌群。B.bifidum 2和L.acidophilus 2可以恢复α多样性指数(图6)。
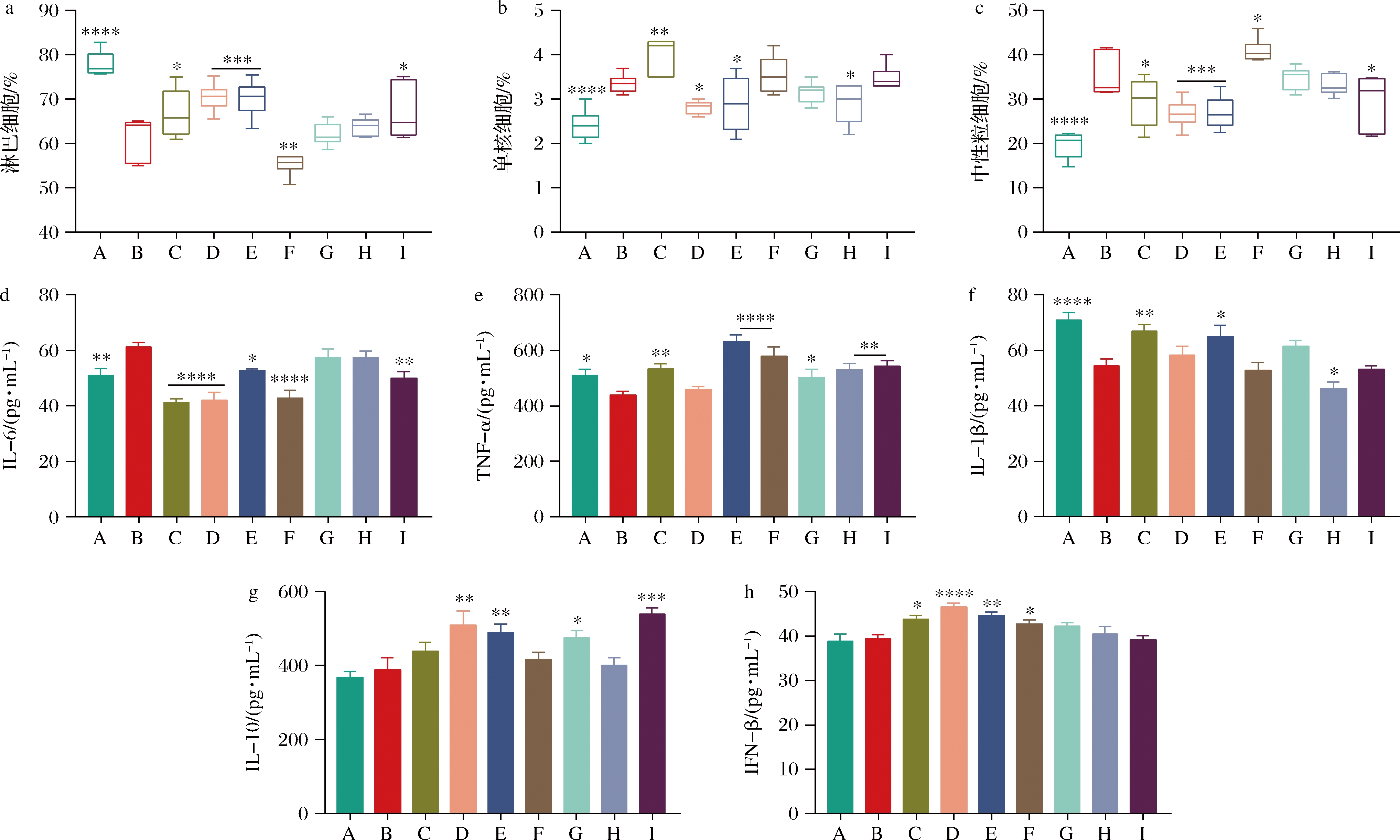
A-空白;B-模型;C-奥司他韦;D-B.bifidum 1;E-B.bifidum 2;F-L.acidophilus 1;G-L.acidophilus 2;H-B.bree 1;I-B.bree 2 a-淋巴细胞占比;b-单核细胞占比;c-中性粒细胞占比;d-血清中IL-6水平;e-血清中TNF-α水平; f-血清中IL-1β水平;g-血清中IL-10水平;h-血清中IFN-β水平
图5 益生菌对H3N2流感病毒感染后血液中免疫细胞和细胞因子的影响
Fig.5 Effects of probiotics on immuno cells and serum cytokines after H3N2 influenza irus infection
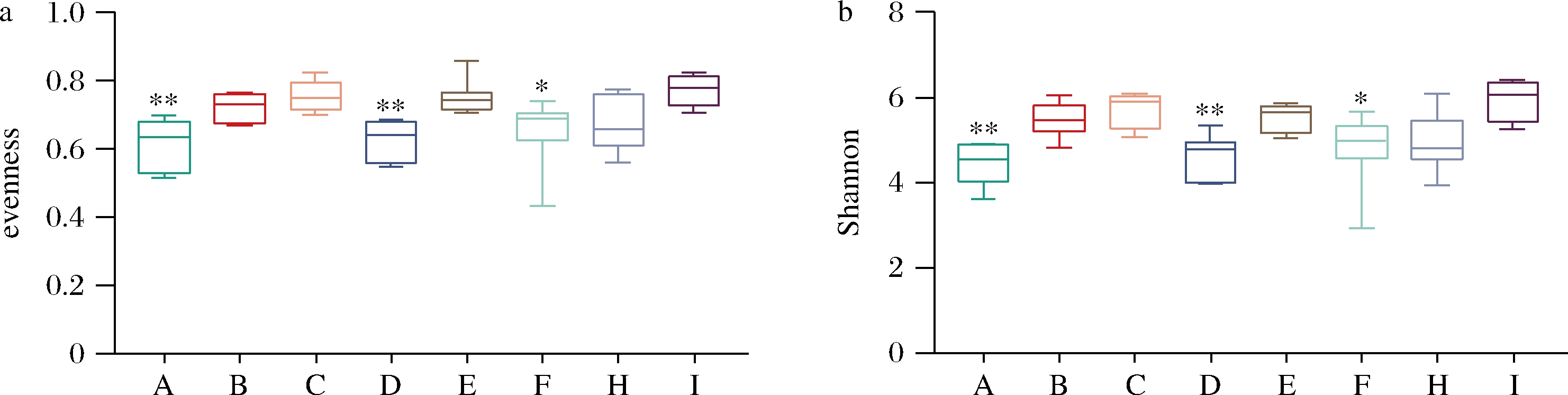
A-空白;B-模型;C-奥司他韦;D-B.bifidum 1;E-B.bifidum 2;F-L.acidophilus 1;G-L.acidophilus 2;H-B.bree 1;I-B.bree 2 a-eenness指数;b-Shannon指数
图6 益生菌对H3N2感染小鼠肠道菌群α多样性的影响
Fig.6 Effects of probiotics on α diersity in intestinal flora of H3N2 infected mice
利用LEfSe分析不同益生菌对肠道菌群组成的影响。与空白组相比,模型组小鼠肠道中Lachnospiraceae NK4A136 group,Ruminococcaceae UCG_014,Eubacterium coprostanoli和Roseburia等菌属丰度显著增加,Odoribacter和Jeotgalicoccus丰度减少(图7-a),与SENCIO等[13]研究的结果基本一致。毛螺菌科(Lachnospiraceae)和瘤胃菌科(Ruminococcaceae)是短链脂肪酸的生产者[14],流感病毒感染可能通过影响这类微生物的丰度来调节肠道中短链脂肪酸的水平。益生菌B.bifidum 1,L.acidophilus 2,B.bree 1和B.bree 2增加了肠道中Odoribacter 的相对丰度。所有益生菌的干预都增加了Tyzzerella和Candidatus Saccharimonas,除了B.bifidum 2和B.bree 2组只增加了前者(图7-b、图7-c)。Tyzzerella,Candidatus Saccharimonas和Odoribacter被认为与宿主免疫调节相关[15-17],因此,益生菌的通过增加肠道菌群中这些菌属的丰度,达到调节机体免疫的目的。
B.bifidum可以降低肠道中Eubacterium coprostanoligenes group和UBA 1819的相对丰度,其中B.bifidum 2还降低了Lachnospiraceae NK4A136 group,一定程度上恢复了肠道菌群的平衡。此外,B.bifidum 2特异地增加了肠道中的Allopreotella和Helicobacter,并减少了Akkermansia(图7-b、图7-c)。L.acidophilus也减少了Akkermansia丰度,其中L.acidophilus 1特异地增加了Rikenella和Helicobacter。其中,Akkermansia在呼吸道病毒感染中起到的作用尚不明确[18-19]。益生菌的干预降低其丰度,可能减少了Akkermansia对H3N2感染带来的负面影响。B.bifidum 2和L.acidophilus 1组中同时增加了Helicobacter丰度,被认为能有效保护小鼠免受哮喘中组织炎症的损伤,缓解炎症细胞浸润支气管肺泡[20]。L.acidophilus 2对肠道菌群结构的改变较大,增加了Staphylococcus,Eubacterium nodatum group,Corynebacterium1和Aerococcus spp.丰度(图7-d、图7-e)。B.bree 1 和B.bree 2则特异性地分别增加了Ruminococcaceae NK4A214 group和Dubosiella丰度(图7-f、图7-g)。综上,益生菌对肠道菌群组成的调节同时存在共性和菌株特异性。其中,对H3N2缓解效果最好的B.bifidum 2特异性地增加了Allopreotella相对丰度,Allopreotella有助于调节宿主的免疫应答和炎症反应[21-22],但其作用机制尚不清楚。
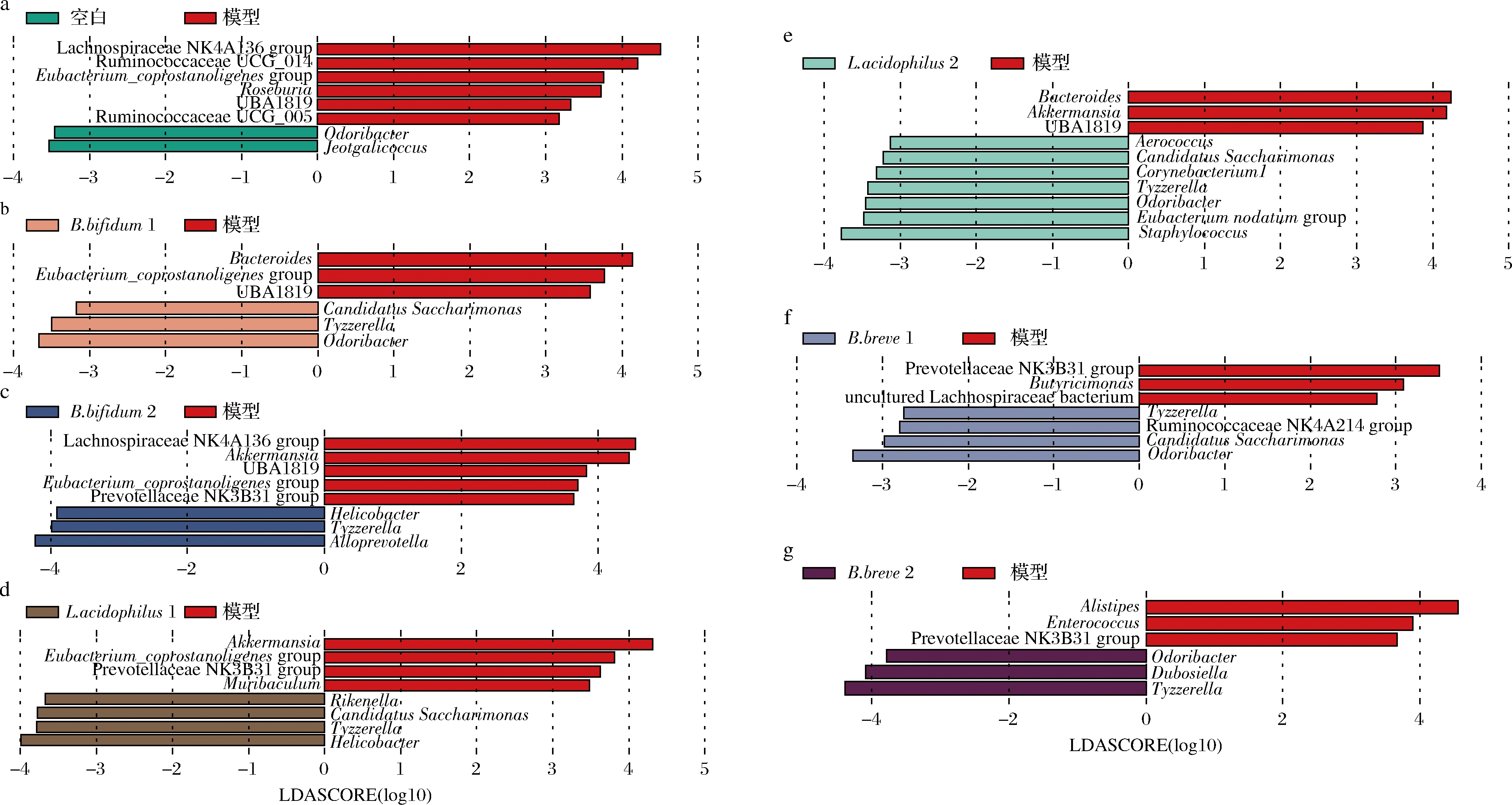
a-空白组与模型组LEfSe分析;b-B.bifidum 1组与模型组LEfSe分析;c-B.bifidum 2组与模型组LEfSe分析; d-L.acidophilus 1组与模型组LEfSe分析;e-L.acidophilus 2组与模型组LEfSe分析;f-B.bree 1组与模型组LEfSe分析; g-B.bree 2组与模型组LEfSe分析
图7 益生菌对H3N2流感病毒感染后小鼠肠道菌群组成的影响
Fig.7 Probiotics affect the composition of gut flora in mice after H3N2 influenza irus infection
3 结论
综上,不同益生菌对肠道菌群结构的调节作用存在菌株特异性,可能与其对小鼠系统免疫的调节作用的相关,从而造成对H3N2感染不同的缓解效果。本研究发现了益生菌对肠道菌群组成和宿主免疫系统的调节作用均存在差异,而肠道微生态对免疫系统作用的调节机制尚不明确,有待进一步研究。
[1] LI L, LIU Y N, WU P, et al.Influenza-associated excess respiratory mortality in China, 2010-15:A population-based study[J].The Lancet Public Health, 2019, 4(9):e473-e481.
[2] WYPYCH T P, WICKRAMASINGHE L C, MARSLAND B J.The influence of the microbiome on respiratory health[J].Nature Immunology, 2019, 20(10):1 279-1 290.
[3] 农绍汉, 孙云霞.一种益生菌组合对流感的防治进展[J].海南医学, 2021,32(2):254-257.
NONG S H, SUN Y X.Adances in the preention and treatment of influenza by a probiotic combination[J].Hainan Medical Journal, 2021, 32(2):254-257.
[4] 宋翔, 宁扬, 侯玉凤, 等.一株具有预防低致病性禽流感作用的植物乳杆菌BLCC2-0125应用研究[J/OL].中国动物传染病学报, 2022.https://doi.org/10.19958/j.cnki.cn31-2031/s.20210611.007.
SONG X, NING Y, HOU Y F, et al.Application of a strain of Lactobacillus plantarum Blcc2-0125 for preention of low pathogenic aian influenza[J/OL].Journal of China Animal Infectious Diseases, 2022.https://doi.org/10.19958/j.cnki.cn31-2031/s.20210611.007.
[5] BOSCH M, MÉNDEZ M, PÉREZ M, et al.Lactobacillus plantarum CECT7315 and CECT7316 stimulate immunoglobulin production after influenza accination in elderly[J].Nutricion Hospitalaria, 2012, 27(2):504-509.
[6] MAHOOTI M, ABDOLALIPOUR E, SALEHZADEH A, et al.Immunomodulatory and prophylactic effects of Bifidobacterium bifidum probiotic strain on influenza infection in mice[J].World Journal of Microbiology & Biotechnology, 2019, 35(6):91.
[7] CAPORASO J G, KUCZYNSKI J, STOMBAUGH J, et al.QIIME allows analysis of high-throughput community sequencing data[J].Nature Methods, 2010, 7(5):335-336.
[8] SEO S H, WEBSTER R G.Tumor necrosis factor alpha exerts powerful anti-influenza irus effects in lung epithelial cells[J].Journal of irology, 2002,76(3):1 071-1 076.
[9] DAMJANOIC D, DIANGAHI M, KUGATHASAN K, et al.Negatie regulation of lung inflammation and immunopathology by TNF-α during acute influenza infection[J].The American Journal of Pathology, 2011, 179(6):2 963-2 976.
[10] ROBINSON K M, CHOI S M, MCHUGH K J, et al.Influenza A exacerbates Staphylococcus aureus pneumonia by attenuating IL-1β production in mice[J].Journal of Immunology (Baltimore, Md.:1950), 2013, 191(10):5 153-5 159.
[11] TOMOSADA Y, CHIBA E, ZELAYA H, et al.Nasally administered Lactobacillus rhamnosus strains differentially modulate respiratory antiiral immune responses and induce protection against respiratory syncytial irus infection[J].BMC Immunology, 2013, 14:40.
[12] SADLER A J, WILLIAMS B R G.Interferon-inducible antiiral effectors[J].Nature Reiews Immunology, 2008, 8(7):559-568.
[13] SENCIO , BARTHELEMY A, TAARES L P, et al.Gut dysbiosis during influenza contributes to pulmonary pneumococcal superinfection through altered short-chain fatty acid production[J].Cell Reports, 2020, 30(9):2 934-2 947.
[14] 周张杰, 蒋海燕, 钟薏, 等.健脾固肠方通过提高短链脂肪酸产生菌的丰度减轻肠癌小鼠化疗后肠道炎症反应的机制探讨[J].中国中医基础医学杂志, 2020, 26(5):618-621;632.
ZHOU Z J, JIANG H Y, ZHONG Y, et al.Effect of jianpi guchang recipe on intestinal inflammatory response after chemotherapy in intestinal carcinoma mice by enhancing abundance of short-chain fatty acid producing bacteria[J].Chinese Journal of Basic Medicine in Traditional Chinese Medicine, 2020, 26(5):618-621;632.
[15] XING C S, WANG M J, AJIBADE A A, et al.Microbiota regulate innate immune signaling and protectie immunity against cancer[J].Cell Host & Microbe, 2021, 29(6):959-974.
[16] CHEN Y F, HSIEH A H, WANG L C, et al.Fecal microbiota changes in NZB/W F1 mice after induction of lupus disease[J].Scientific Reports, 2021, 11:22953.
[17] GRANT C , LOMAN B R, BAILEY M T, et al.Manipulations of the gut microbiome alter chemotherapy-induced inflammation and behaioral side effects in female mice[J].Brain, Behaior, and Immunity, 2021, 95:401-412.
[18] HU X T, ZHAO Y, YANG Y, et al.Akkermansia muciniphila improes host defense against influenza irus infection[J].Frontiers in Microbiology, 2021, 11:586476.
[19] ZHANG Q, HU J, FENG J W, et al.Influenza infection elicits an expansion of gut population of endogenous Bifidobacterium animalis which protects mice against infection[J].Genome Biology, 2020, 21(1):99.
[20] ARNOLD I C, DEHZAD N, REUTER S, et al. Helicobacter pylori infection preents allergic asthma in mouse models through the induction of regulatory T cells[J].The Journal of Clinical Inestigation, 2011, 121(8):3 088-3 093.
[21] GUO Y C, HUANG C L, LIU L Y, et al.Paneth cell ablation aggraates pancreatic and intestinal injuries in a rat model of acute necrotizing pancreatitis after normal and high-fat diet[J].Mediators of Inflammation, 2019, 2019:8474523.
[22] LI A L, NI W W, ZHANG Q M, et al.Effect of cinnamon essential oil on gut microbiota in the mouse model of dextran sodium sulfate-induced colitis[J].Microbiology and Immunology, 2020, 64(1):23-32.