皮肤是机体的生理屏障,保护机体免受病原体、化学或物理损伤,它也是直接暴露于紫外线辐射的器官[1]。紫外线中波(ultraiolet B,UB)主要作用于皮肤的表皮层和真皮浅层中的成纤维细胞,使结缔组织发生重建,胶原合成减少,造成皮肤损伤,甚至导致癌症[2-3]。其调控机制包括氧化应激、炎症反应、细胞凋亡等[4]。胶原蛋白是哺乳动物分布最为广泛的蛋白质之一,约占人体内总蛋白质含量的25%~30%,占人体皮肤蛋白质的71.2%[5],一旦缺乏胶原蛋白,皮肤会出现色斑、缺水、粗糙、皱纹加深等一系列老化现象[6],因此保护和补充真皮中的胶原蛋白对于美容护肤有重要意义。
目前,欧美、日韩等多个国家采用注射胶原蛋白的方法来修复面部问题,市场中大量的口服补充胶原蛋白类产品也层出不穷。胶原肽是一种将胶原蛋白经生物酶解精制后得到的由多种短肽组成的混合物。相对于胶原蛋白,胶原肽保证了优良营养特性的同时,还兼顾了更多的生物活性,如抗氧化、降血压、增强免疫作用等[7-9]。胶原肽对于皮肤的影响也受到了广泛关注,如口服摄入胶原肽可通过调节透明质酸的合成来缓解UB诱导的皮肤干燥[10],也可通过激活TGF-β/Smad途径抑制胶原蛋白的降解来促进光老化皮肤的修复[11]。2016年,日本京都大学和大阪市立大学共同研发了一种具有修复皮肤光损伤的物质:Nahlsgen,其有效成分是一种氨基酸衍生物即甲基羧氨基羧基丙基膦酸酯,是一种γ谷氨酰转肽酶抑制剂,具有促进人表皮角质形成细胞增殖和迁移,抑制紫外线诱导过氧化物的生成,减轻紫外线对皮肤成纤维细胞损伤的作用[12-13]。针对2种功能活性物质,本研究基于UB光损伤人皮肤成纤维细胞(human skin fibroblast,HSF)模型,主要评价胶原肽和Nahlsgen协同对光损伤皮肤细胞的保护能力及对胶原蛋白生成能力的影响,为胶原肽的进一步开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
Nahlsgen,TOABO公司;H-DMEM培养基,Hyclone公司;胎牛血清、青霉素链霉素溶液(双抗),四季青公司;胰蛋白酶、磷酸盐缓冲液(phosphate buffered saline,PBS),碧云天生物技术研究所;HSF,上海冠导生物工程公司;噻唑蓝(methyl thiazolyl tetrazolium,MTT)、二甲基亚砜(dimethyl sulfoxide,DMSO)、2′,7′二氢二氯荧光素二乙酸酯(2′, 7′-dichlorofluorescin diacetate,DCFH-DA),美国Sigma公司;羟脯氨酸试剂盒,南京建成生物技术有限公司;鳕鱼鱼皮,浙江东海岸实业有限公司;Collagen Type I and Elastin Rabbit Polyclonal antibody,Proteintech。
1.2 仪器与设备
恒温培养箱、BD C6流式细胞仪、PikoReal 96实时定量PCR仪,美国Thermo Fisher公司;酶标仪,美国Dynex公司;恒温水浴锅,苏州珀西瓦尔实验设备有限公司;ESCO AC2-6S1生物安全柜,新加坡艺思高科技有限公司;SH2B UB辐照仪,上海希格玛高技术有限公司;T100梯度PCR仪,Bio-Rad公司。
1.3 实验方法
1.3.1 胶原肽的制备及分子质量分布测定
胶原肽制备流程:
鳕鱼鱼皮清洗匀浆→预热调pH→复合酶酶解→95 ℃灭酶→浓缩→脱色→喷雾干燥
采用高效凝胶过滤色谱法测定上述胶原肽分子质量分布情况[14]。
1.3.2 UB诱导HSF损伤模型的建立
将生长状态良好的HSF密度调整为105个/mL,以100 μL/孔加入到96孔板中,于37 ℃、5% CO2恒温培养箱中培养24 h,待细胞单层贴壁后,弃去培养液,PBS清洗后,每孔加入50 μL PBS,空白组用锡箔纸包裹住,选取不同辐照剂量UB照射[15],照射完毕后扣掉PBS 溶液,DMEM不完全培养基继续孵育24 h,每组每孔加入100 μL MTT(0.5 mg/mL),4 h后加入100 μL DMSO于37 ℃摇床上振荡10 min,使结晶溶解,于490 nm处检查细胞的活性,用细胞存活率表示,以选取合适的UB辐照剂量,细胞存活率计算如公式(1)所示:
细胞存活率![]()
(1)
1.3.3 Nahlsgen和胶原肽对HSF的保护作用
选取合适的UB辐照剂量照射完成后加入含有Nahlsgen和胶原肽样品的DMEM不完全培养基孵育24 h,MTT法测其细胞存活率。
1.3.4 Nahlsgen和胶原肽对HSF氧化应激的影响
HSF以1.0×105个/mL密度接种6孔细胞培养板,每孔2 mL,放置37 ℃、5% CO2细胞培养箱中培养24 h。随后小心吸走6孔中的细胞上清液,经PBS清洗后,加入含有Nahlsgen或胶原肽样品的不完全培养基,孵育4 h。孵育完成后,倒出含有样品的培养液,PBS清洗,每孔加入0.5 mL PBS缓冲液覆盖底面,UB辐照完成后弃掉PBS,每孔加入终浓度为10 μmol/L的荧光染料DCFH-DA 1 mL,于37 ℃、5% CO2细胞培养箱中培养30 min,然后取出吸走上清液,用PBS小心清洗3次。消化,完全培养基终止,置于流式细胞仪测定其相对荧光值[16]。HSF内抗氧化能力以活性氧(reactie oxygen species,ROS)含量来表示,ROS含量计算如公式(2)所示:
ROS含量![]()
(2)
1.3.5 Nahlsgen和胶原肽对HSF羟脯氨酸含量的影响
将生长状态良好的HSF密度调整为105个/mL,从1 mL/孔加入到12孔板中,于37 ℃、5% CO2恒温培养箱中培养24 h,待细胞单层贴壁后,弃去培养液,PBS清洗后,换上含Nahlsgen或胶原肽的DMEM不完全培养基1 mL,继续孵育24 h,吸取细胞培养液,消化法测定羟脯氨酸的含量[17]。
1.3.6 Nahlsgen和胶原肽对I型前胶原蛋白和原弹性蛋白mRNA表达情况的影响
将生长状态良好的HSF密度调整为105个/mL,以3 mL/孔加入到6孔板中,于37 ℃、5% CO2恒温培养箱中培养24 h,待细胞单层贴壁后,弃去培养液,PBS清洗后,换上含Nahlsgen或胶原肽的DMEM不完全培养基1 mL,继续孵育24 h。Trizonal法提取细胞中的总RNA,紫外分光光度计测定A260/A280比值及RNA浓度,实时荧光定量PCR(quantitatie real-time PCR,qRT-PCR)检测mRNA 水平的表达。
表1 COLⅠA1和ELN引物序列
Table 1 Sequences of primers for target genes of amplified fragment

基因引物序列 5′-3′COLIA1正向引物GGACACAGAGGTTTCAGTGGT反向引物GCACCATCATTTCCACGAGCELN正向引物CGTGGCGAATGTAAACGTC反向引物TGAGCTGGAGAATCACGATG
1.3.7 Nahlsgen和胶原肽对I型胶原蛋白和弹性蛋白的蛋白表达情况的影响
培养及上样方法同1.3.6,用细胞刮刀刮下细胞,离心收集HSF,使用放射免疫沉淀分析(radio immunoprecipitation assay,RIPA)裂解液提取各组蛋白,提取完成后BCA法测定蛋白浓度,用于后续实验。
根据目的蛋白不同分子质量,配制10%/6%分离胶,5%浓缩胶,各样品取总蛋白上样电泳,浓缩胶电压80 、时间30 min,分离胶电压120 、时间60 min。电泳结束后,100 mA、时间90~180 min湿法转膜,PDF膜在使用之前用甲醇活化30 s。湿法转膜结束后,用50 g/L脱脂奶粉封闭,然后TBS with Tween-20(TBST)于室温摇床上洗膜3次,每次10 min,一抗4 ℃孵育过夜,继续用TBST洗膜3次,每次10 min,二抗孵育2 h,TBST洗膜,利用增强化学发光法(enhanced chemiluminescence,ECL)超敏显色液显色,凝胶成像仪拍照,采用机器自带软件进行灰度分析。
2 结果与讨论
2.1 胶原肽分子质量分布
由表2可知,本实验制备的胶原肽属于小分子肽段混合物,分子质量主要分布在1 000 Da以下,占93.59%,其中分子质量在140~500 Da占比最多,这部分主要是二肽、三肽,具有易吸收、低致敏、低渗透压等特点。
表2 胶原肽分子质量分布情况
Table 2 Molecular weight distributions of collagen protein hydrolysate
分子质量/Da>10 0005 000~10 0003 000~5 0001 000~3 000500~1 000150~500<150分布百分比/%0.000 00.000 50.037 56.370 233.038 155.721 04.830 5
2.2 UB诱导HSF损伤模型
本研究通过不同剂量UB照射HSF来建立皮肤光损伤模型。UB照射剂量对HSF存活率的影响见图1。UB照射剂量在60、70、80、100 mJ/cm2时,与空白组相比,HSF存活率没有显著变化,既不促进也不抑制细胞生长;当照射剂量为120 mJ/cm2时,抑制HSF的生长(P<0.05),照射剂量为160 mJ/cm2时极显著抑制细胞的生长(P<0.01),此时细胞生存率为85.87%。故选用160 mJ/cm2剂量诱导HSF损伤,进行后续评价实验。

图1 UB照射剂量对HSF存活率的影响
Fig.1 Effects of UB irradiation dose on the iability of HSF 注:*表示与对照相比差异显著(P<0.05), **表示差异极显著(P<0.01)(下同)
2.3 Nahlsgen和胶原肽对HSF的保护作用
由图2可知,在UB照射下,HSF生存率极显著降低,为85.87%,加入Nahlsgen后,基本恢复到正常水平,101.09%。经Nahlsgen和不同浓度胶原肽复配干预后发现,细胞生存率与胶原肽添加量呈负相关,胶原肽为50 μg/mL时细胞生存率最高(104.99%)。在UB照射后,仅添加胶原肽的情况下,细胞生存率随着胶原肽浓度的增加逐渐提高,由此可看出2种物质均能提高细胞的生存率。

图2 Nahlsgen和胶原肽对HSF存活率的影响
Fig.2 Effects of Nahlsgen and collagen protein hydrolysate on cell iability of UB-irradiated HSF
由图3可知,在UB照射下,ROS含量极显著升高,为142.92%,加入Nahlsgen后,与空白对照组相比,ROS含量极显著降低,132.79%。

图3 Nahlsgen和胶原肽对HSF中ROS含量的影响
Fig.3 Effects of Nahlsgen and collagen protein hydrolysate on ROS leels of UB-irradiated HSF
Nahlsgen和胶原肽复配加入后,胶原肽质量浓度为100 μg/mL时,ROS含量最低,为118.35%。UB照射后,在只添加胶原肽的情况下,ROS含量随着胶原肽浓度的升高逐渐降低,但是变化不明显,ROS含量最低为129.47%。由此可看出2种物质均能降低ROS含量,Nahlsgen和100 μg/mL胶原肽复配时能力最强。
HSF是人体皮肤真皮中的主体细胞成分,它与自身分泌的胶原、弹性纤维及基质成分一同构成了真皮主体。HSF数量的减少是引起皱纹产生的重要原因,且HSF具有趋化性和黏附性,对维持皮肤的弹性和韧性具有重要作用,所以HSF在皮肤老化过程中扮演着重要角色[18]。HSF体外增殖能力的评价是研究光老化的重要手段[19]。过量的ROS会引起机体组织细胞氧化应激反应,造成生物大分子物质损伤,甚至引起疾病,而机体为保持活性氧自由基平衡,就必须通过抗氧化防御体系及时清除过量的ROS自由基[20],清除ROS在缓解皮肤光老化过程中起着重要作用[21]。实验结果表明,Nahlsgen和胶原肽可以提高HSF的增殖率和降低ROS水平,可以起到抗光老化的作用。
2.4 Nahlsgen和胶原肽对HSF羟脯氨酸含量的影响
由图4可知,单独添加胶原肽、Nahlsgen和胶原肽复配加入后,随着胶原肽含量的增加,羟脯氨酸的含量随之增加;相同浓度的胶原肽,加入Nahlsgen后,羟脯氨酸含量比单独添加胶原肽高,由此可看出,Nahlsgen和胶原肽对羟脯氨酸含量的升高起到协同作用。

图4 Nahlsgen和胶原肽对HSF羟脯氨酸含量的影响
Fig.4 Effects of Nahlsgen and collagen protein hydrolysate on hydroxyproline content of HSF
羟脯氨酸是胶原蛋白中主要的氨基酸,其含量相对稳定,约占胶原蛋白12%~14%。因此,可通过测定组织中羟脯氨酸含量变化来检测胶原蛋白的合成能力。实验结果表明,Nahlsgen和胶原肽复配可以提高羟脯氨酸的含量。
2.5 Nahlsgen和胶原肽对I型前胶原蛋白和原弹性蛋白mRNA和蛋白水平的影响
由图5可知,单独添加Nahlsgen、Nahlsgen和100 μg/mL胶原肽复配加入后,I型前胶原蛋白、原弹性蛋白的mRNA水平极显著提高,由图6可知,Nahlsgen和200 μg/mL胶原肽复配加入后对原弹性蛋白的mRNA水平极显著提高,是对照组的4.77倍,Nahlsgen和胶原肽复配对于原弹性蛋白的RNA水平提高程度显著优于单独添加Nahlsgen。
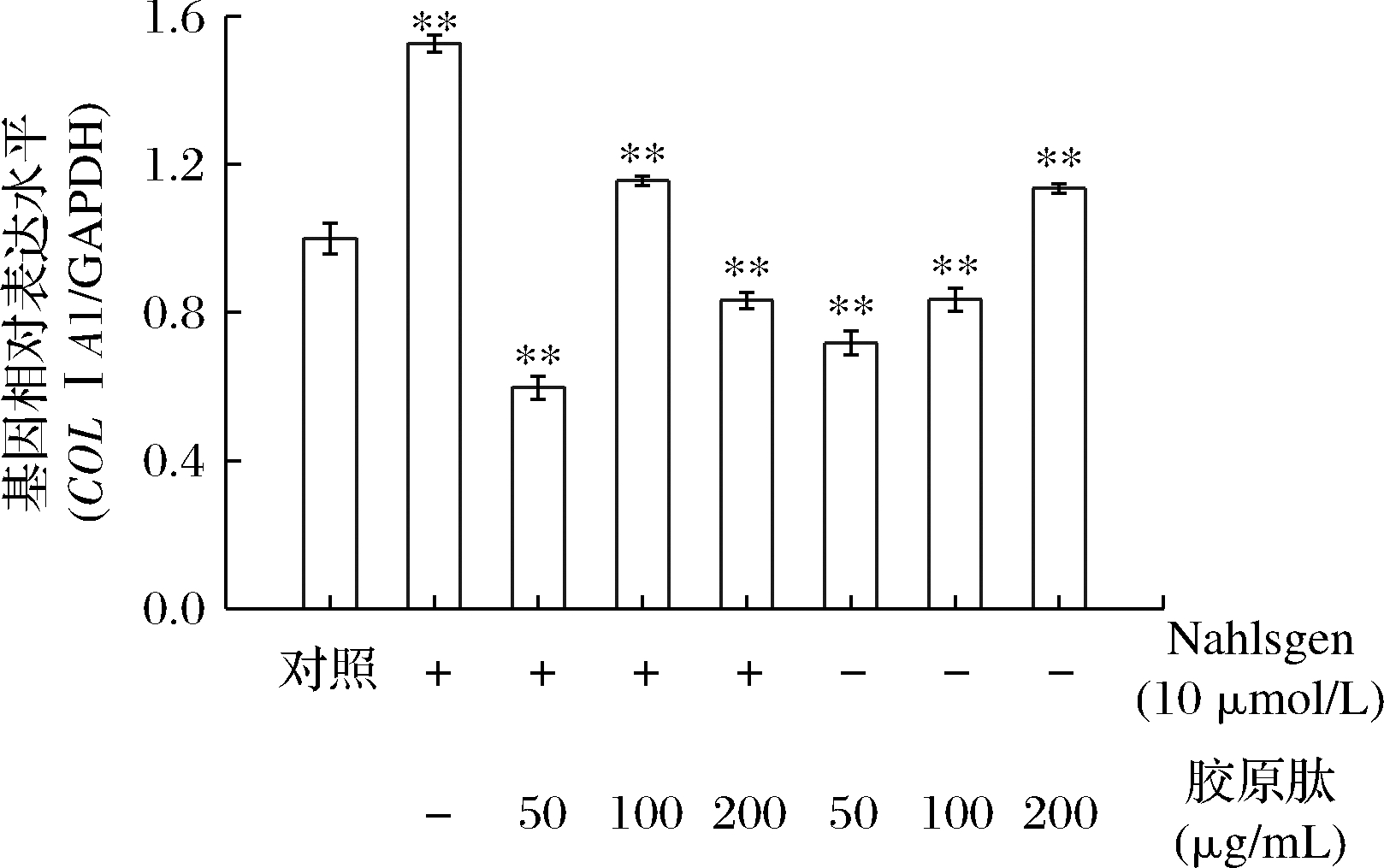
图5 Nahlsgen和胶原肽对HSF I型前胶原蛋白 mRNA表达的影响
Fig.5 Effects of Nahlsgen and collagen protein hydrolysate on the mRNA expression of COLⅠA1 in HSF

图6 Nahlsgen和胶原肽对HSF原弹性蛋白 mRNA表达的影响
Fig.6 Effects of Nahlsgen and collagen protein hydrolysate on the mRNA expression of ELN in HSF
HSF分泌的胶原主要以Ⅰ和Ⅲ型为主。其中正常成人皮肤以Ⅰ型胶原为主,胎儿皮肤主要由Ⅲ型胶原组成。胶原蛋白是皮肤中主要的蛋白质,不仅含量高,而且还与肌肤的健康程度、保水性和弹性有着密切的关系。随着年龄的增长,成纤维细胞合成胶原蛋白和弹性蛋白的能力越来越低,皮肤无法维持正常的形态和结构,出现粗糙、松弛、塌陷、皱纹等问题[22]。结果表明,Nahlsgen和胶原肽复配可以提高胶原蛋白和弹性蛋白的基因水平。由图7可知,单独添加Nahlsgen、Nahlsgen和中高浓度胶原肽复配后、单独添加胶原肽组可以促进HSF I型胶原蛋白的表达、Nahlsgen和胶原肽复配可以提高弹性蛋白的蛋白水平表达,结合基因表达水平结果,认为Nahlsgen和胶原肽复配可以很好促进I型胶原蛋白和弹性蛋白的表达,起到一定的护肤作用。

a-I型前胶原蛋白和原弹性蛋白的蛋白质印迹表达;b-Nahlsgen和胶原肽对HSF I型前胶原蛋白表达的影响; c-Nahlsgen和胶原肽对HSF原弹性蛋白表达的影响
图7 Nahlsgen和胶原肽对HSF I型胶原蛋白和弹性蛋白的蛋白水平影响
Fig.7 Effects of Nahlsgen and collagen protein hydrolysate on the proteinexpression of COL I and ELN in HSF
3 结论
随着年龄增长,皮肤逐渐发生退行性改变以及生理机能逐渐衰退的老化现象,主要分为内源性衰老和外源性老化,前者是自然衰老,后者主要由紫外线辐射导致皮肤老化,也称皮肤光老化。UB可作用于真皮浅层中的成纤维细胞,产生氧化应激、炎症反应等,引起皮肤粗糙、皱纹现象发生。为研究UB照射对皮肤氧化应激和胶原蛋白的影响,本文以不同剂量UB处理不同时间后的HSF细胞为研究对象,揭示经Nahlsgen和胶原肽分别及复配干预后,ROS水平、Ⅰ型胶原蛋白和弹性蛋白mRNA表达和蛋白水平的变化情况,探讨Nahlsgen和胶原肽最佳配伍方式。
本研究发现,经UB损伤后,HSF内产生大的ROS,并造成胶原蛋白的流逝,导致不可逆转的损伤,造成皮肤老化。利用Nahlsgen和胶原肽复配后可以提高成纤维细胞活性和降低氧化应激损伤,有效保护HSF抵抗UB带来的损伤。从羟脯氨酸含量、Ⅰ型前胶原蛋白和原弹性蛋白的mRNA表达水平、Ⅰ型胶原蛋白和弹性蛋白的蛋白表达结果可知,复配Nahlsgen和胶原肽可以促进Ⅰ型胶原蛋白和弹性蛋白的表达和合成,及时补充促进胶原蛋白合成,从而延缓皮肤细胞的衰老,增强皮肤的弹力,且复配的效果明显优于单独使用的效果,显著发挥抗皮肤光老化的作用。同时,本研究为开发安全有效的光保护剂奠定理论基础。
[1] 任静, 马良娟.Nrf2基因在紫外线氧化应激与光老化中的作用研究进展[J].实用皮肤病学杂志, 2018, 11(2):94-96;100.
REN J, MA L J.Research on the role of Nrf2 in photoaging[J].Journal of Practical Dermatology, 2018, 11(2):94-96;100
[2] LAN C C E, HUNG Y T, FANG A H, et al.Effects of irradiance on UA-induced skin aging[J].Journal of Dermatological Science, 2019, 94(1):220-228.
[3] LIU X M, ZHANG R Z, SHI H X, et al.Protectie effect of curcumin against ultraiolet A irradiation-induced photoaging in human dermal fibroblasts[J].Molecular Medicine Reports, 2018, 17(5):7 227-7 237.
[4] WU P Y, HUANG C C, CHU Y, et al.Alleiation of ultraiolet B-induced photodamage by Coffea arabica extract in human skin fibroblasts and hairless mouse skin[J].International Journal of Molecular Sciences, 2017, 18(4):782.
[5] 薛艳丽. 胶原蛋白与美容[J].中国实用医药, 2006, 1(9):84.
XUE Y L.Collagen and beauty[J].China Practical Medical, 2006, 1(9):84.
[6] 张浩玮, 胡竟一, 王岚.胶原蛋白在整形美容中的研究进展[J].科技视界, 2019(2):152-154.
ZHANG H W, HU J Y, WANG L.Research progress of collagen in cosmetic surgery[J].Science & Technology ision, 2019(2):152-154.
[7] 贾建萍, 鲁健章, 周彦钢, 等.不同来源胶原肽的抗氧化活性及吸湿保湿性能[J].食品科学, 2010, 31(21):169-172.
JIA J P, LU J Z, ZHOU Y G, et al.Antioxidant actiity, moisture-absorbing and moisture-retention properties of collagen peptides from different sources[J].Food Science, 2010, 31(21):169-172.
[8] 汪雨亭, 黄儒强, 王娟.鱼胶原蛋白酶解工艺及其活性肽抑制ACE酶的研究[J].食品工业科技, 2017, 38(17):17-23.
WANG Y T, HUANG R Q, WANG J.Study on enzymatic hydrolysis process of fish collagen and antihypertensie peptides of collagen[J].Science and Technology of Food Industry, 2017, 38(17):17-23.
[9] 李承威, 马淑霞, 王春敏, 等.胶原蛋白肽增强小鼠免疫力的实验研究[J].中国微生态学杂志, 2013, 25(4):387-389.
LI C W, MA S X, WANG C M, et al.Collagen peptide enhances immunity in mice[J].Chinese Journal of Microecology, 2013, 25(4):387-389.
[10] KANG M C, YUMNAM S, KIM S Y.Oral intake of collagen peptide attenuates ultraiolet B irradiation-induced skin dehydration in io by regulating hyaluronic acid synthesis[J].International Journal of Molecular Sciences, 2018, 19(11):3551.
[11] LIU Z H, LI Y Q, SONG H D, et al.Collagen peptides promote photoaging skin cell repair by actiating the TGF-β/Smad pathway and depressing collagen degradation[J].Food & Function, 2019, 10(9):6 121-6 134.
[12] KAMIYAMA A, NAKAJIMA M, HAN L Y, et al.Phosphonate-based irreersible inhibitors of human γ-glutamyl transpeptidase (GGT).GGsTop is a non-toxic and highly selectie inhibitor with critical electrostatic interaction with an actie-site residue Lys562 for enhanced inhibitory actiity[J].Bioorganic & Medicinal Chemistry, 2016, 24(21):5 340-5 352.
[13] WATANABE B, TABUCHI Y, WADA K, et al.Synthesis and ealuation of the inhibitory actiity of the four stereoisomers of the potent and selectie human γ-glutamyl transpeptidase inhibitor GGsTop[J].Bioorganic & Medicinal Chemistry Letters, 2017, 27(21):4 920-4 924.
[14] 刘文颖, 林峰, 金振涛, 等.玉米低聚肽的体外抗氧化作用[J].食品科学, 2011, 32(5):22-26.
LIU W Y, LIN F, JIN Z T, et al.Antioxidant effect of corn oligopeptides in itro[J].Food Science, 2011, 32(5):22-26.
[15] 张杰, 甘华, 刘瑾.UB诱导人皮肤成纤维细胞改变后β-catenin基因表达水平的研究[J].西部医学, 2019, 31(1):47-50.
ZHANG J, GAN H, LIU J.Study on the change of β-catenin in HSF with induced by UB[J].Medical Journal of West China, 2019, 31(1):47-50.
[16] 张瑞雪, 方磊, 刘艳, 等.三种果蔬发酵液抗氧化和免疫调节功能研究[J].粮油食品科技, 2019, 27(2):39-44.
ZHANG R X, FANG L, LIU Y, et al.Research on antioxidant and immunity regulation function of three kinds of fruit and egetable zymotic fluid[J].Science and Technology of Cereals, Oils and Foods, 2019, 27(2):39-44.
[17] 石宇, 李德如, 闫国富, 等.芦荟凝胶对人皮肤成纤维细胞增殖及胶原合成的影响[J].重庆医学, 2008, 37(12):1 271-1 273;1 264.
SHI Y, LI D R, YAN G F, et al.Effect of aloe gel on cell proliferation and synthesis of collage in cultured human skin fibroblast[J].Chongqing Medicine, 2008, 37(12):1 271-1273;1 264.
[18] DETERS A M, MEYER U, STINTZING F C.Time-dependent bioactiity of preparations from cactus pear (Opuntia ficus indica) and ice plant (Mesembryanthemum crystallinum) on human skin fibroblasts and keratinocytes[J].Journal of Ethnopharmacology, 2012, 142(2):438-444.
[19] SANTA-MAR A C, REILLA E, MIRAMONTES E, et al.Protection against free radicals (UB irradiation) of a water-soluble enzymatic extract from rice bran.Study using human keratinocyte monolayer and reconstructed human epidermis[J].Food and Chemical Toxicology, 2010, 48(1):83-88.
A C, REILLA E, MIRAMONTES E, et al.Protection against free radicals (UB irradiation) of a water-soluble enzymatic extract from rice bran.Study using human keratinocyte monolayer and reconstructed human epidermis[J].Food and Chemical Toxicology, 2010, 48(1):83-88.
[20] ZORO D B, FILBURN C R, KLOTZ L O, et al.Reactie oxygen species (ROS)-induced ROS release:A new phenomenon accompanying induction of the mitochondrial permeability transition in cardiac myocytes[J].The Journal of Experimental Medicine, 2000, 192(7):1 001-1 014.
[21] POLJ AK B, DAHMANE R G, GODI
AK B, DAHMANE R G, GODI A.Intrinsic skin aging:The role of oxidatie stress[J].Acta Dermatoenerologica Alpina, Pannonica, et Adriatica, 2012, 21(2):33-36.
A.Intrinsic skin aging:The role of oxidatie stress[J].Acta Dermatoenerologica Alpina, Pannonica, et Adriatica, 2012, 21(2):33-36.
[22] SANCHES SILEIRA J E, MYAKI PEDROSO D M.U light and skin aging[J].Reiews on Enironmental Health, 2014, 29(3):243-254.