异麦芽酮糖(isomaltulose),又称帕拉金糖,是一种功能性二糖。异麦芽酮糖作为蔗糖的同分异构体,与蔗糖有着相似的口感和物理性质。与蔗糖相比,异麦芽酮糖具有良好的酸稳定性、极低的吸湿性和较高的安全性,在食品中具有广阔的市场应用前景[1-3]。作为新型的甜味剂,异麦芽酮糖还具有甜度低(约为蔗糖甜度的50%)、易于吸收、非致龋齿性和低热量等优点,非常适合肥胖患者、糖尿病人和体育运动员等食用[4-5]。此外,本身为还原糖的异麦芽酮糖还可作为前体生产新型功能性食用糖醇[6]。鉴于其优良的特性,异麦芽酮糖也受到越来越多人的关注。
目前,异麦芽酮糖主要是利用蔗糖异构酶(sucrose isomerase, SIase, EC 5.4.99.11)异构催化蔗糖生成,催化作用如图1所示。然而,游离SIase在工业生产中存在产物的纯化分离难度大,不可回收再利用等缺点,酶固定化成为解决上述问题的手段之一。近年来,关于SIase固定化的研究已有少量报道。CONTESINI等[7]利用微胶囊包埋法和硅藻土吸附法将来源于Erwinia sp.的SIase进行固定化,所得2种固定化酶的酶活力回收率和操作稳定性均较差;为了提高固定化后的酶活力,WU等[8-9]采用ε-poly-L-lysine修饰的介孔TiO2和海绵作为载体固定化SIase,所得固定化酶的酶活力回收率分别为84.5%和93.2%;在此基础上,孟虹等[10]又制备了SIase-Cu2+纳米花固定化酶,在4 ℃保存15 d后仍能保留80%的初始活性,且循环使用6次后,仍剩余40%酶活性。表明固定化明显提高了SIase的操作稳定性和酶活力回收率,且固定化材料较为新颖,但由于生产成本较高,限制了工业化的大规模生产。因此,寻求成本经济、操作简单、酶活力回收率高且操作稳定性良好的SIase固定化方法受到越来越多的关注。
吸附固定化与交联固定化是酶固定化的常用方法。然而,单纯物理吸附所得固定化酶稳定性较差,酶易泄露,且随机的物理吸附无法控制载体表面酶的密度,易形成多层吸附继而对酶的催化活性造成不利影响[11];而直接通过交联得到的酶聚集体,大小无法控制,对于较大的交联聚集体,大量的酶被包裹在聚集体内部,不易与底物接触,造成酶催化活性降低,且聚集体的机械性能较差,实际应用受到限制[12]。因此在实际生产中常常将这2种方法结合使用,吸附-交联固定化可将酶的回收与固定化同时进行,适用于发酵液中酶的固定化,不仅提高了酶的构象稳定性和固定化酶的机械性能,还具有成本低廉、制备过程简单、酶结合牢固、适用于非特异性载体等优点。硅纳米粒子(silica nanoparticle, SNP)具有机械强度高、化学/热稳定性好、成本低、易获得、不与酶反应、比表面积大等特性,在酶的固定化领域应用广泛[13-14]。
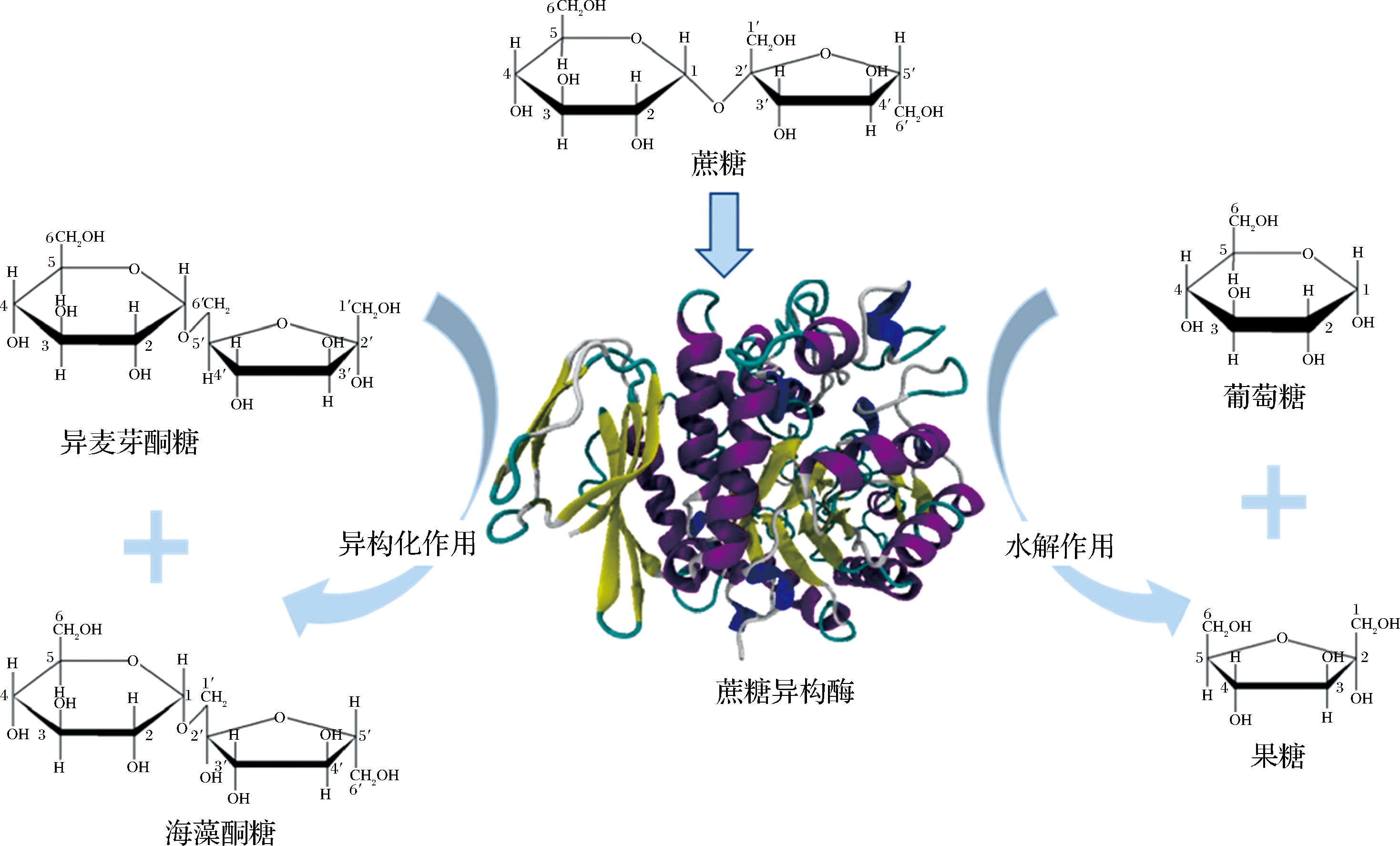
图1 蔗糖异构酶的水解作用和异构化作用的反应机理
Fig.1 Reaction mechanism of SIase-catalyzed hydrolysis and isomerization
本研究拟利用吸附-交联法对SIase进行固定化。首先采用硅纳米粒子为载体对SIase进行吸附,后用戊二醛(glutaraldehyde,GA)对吸附在硅纳米粒子周围的酶进行交联,优化蔗糖异构酶吸附-交联固定化条件,并对固定化酶的酶学性质(催化活性、热稳定性、pH耐受性和操作稳定性)进行探讨,以期得到高效的SIase固定化酶,为其工业化应用奠定基础。
1 材料与方法
1.1 材料与试剂
菌种:毕赤酵母(Pichia pastoris) GS115,本实验室保藏。
材料和试剂:硅纳米粒子(500 nm,实心球体),Aladdin;戊二醛(250 g/L)、NaCl、Na2HPO4、NaH2PO4,上海麦克林生化科技有限公司;蔗糖,上海源叶生物科技有限公司;酵母粉、蛋白胨、葡萄糖、YNB培养基、甘油、琼脂粉,北京索莱宝科技有限公司;甲醇、生物素, 赛默飞世尔科技公司。
1.2 仪器与设备
DYY-6D电泳仪,北京市六一仪器厂;HZS-H水浴恒温振荡器,哈尔滨东联电子有限公司;Mettler-Toledo电子天平,梅特勒-托利多(上海)仪器有限公司;Centrifuge 5418小型高速离心机、Heto Drywinner冷冻干燥机、MaxQ6000恒温调速摇床、Multiskan Spectrum酶标仪,赛默飞世尔科技(中国)有限公司;WP25AB台式电热恒温培养箱,天津市泰斯特仪器有限公司。
1.3 实验方法
1.3.1 蔗糖异构酶的制备
取适量保存于本实验室-80 ℃冰箱的毕赤酵母,采用三区划线法接种于YPD固体培养基(1%酵母粉,2%蛋白胨,2%葡萄糖,1.5%琼脂粉)上,于30 ℃恒温培养箱中倒置培养2 d,获得单菌落。将单菌落接种至5 mL的YPD液体培养基(1%酵母粉,2%蛋白胨,2%葡萄糖)中,30 ℃、220 r/min恒温培养24 h,转移至250 mL的BMGY培养基[1%酵母粉、2%蛋白胨、2%甘油、0.2%生物素、25 mL 10×YNB、磷酸盐缓冲液(1 mol/L,pH 6.0)]中传代培养16 h(30 ℃、220 r/min);3 000 r/min条件下离心5 min收集菌体,用BMMY培养基[1%酵母粉、2%蛋白胨、0.2%的生物素、25 mL 10×YNB、磷酸盐缓冲液(1 mol/L,pH 6.0)]清洗菌体2遍以除去甘油等物质。最后将菌体重悬于250 mL BMMY培养基中进行诱导培养,每天早晚各加入0.5%(体积分数)的甲醇,30 ℃、220 r/min培养5 d后,将发酵液于3 000 r/min、4 ℃条件下离心10 min,所得上清液即为SIase粗酶液,保存于4 ℃备用。利用十二烷基硫酸钠-聚丙烯酰氨凝胶电泳法(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)测定SIase的纯度。
1.3.2 酶活力测定
将400 μL含有蔗糖(250 g/L)的磷酸盐缓冲溶液(10 mmol/L,pH 6.0)和100 μL适当稀释的酶溶液在2 mL的EP管中充分混合,置于35 ℃水浴中反应10 min,后煮沸5 min以终止反应。利用3,5-二硝基水杨酸比色法(3,5-dinitrosalicylic acid,DNS)测定生成还原糖的量。1个酶活力单位是指1 min内催化蔗糖异构产生1 μmol异麦芽酮糖所需的酶量。固定化酶活力回收率按公式(1)计算:
酶活力回收率![]()
(1)
1.3.3 蔗糖异构酶的固定化
称取25 mg硅球,加入4 mL含一定酶活力的磷酸盐缓冲液(10 mmol/L,pH 6.0),于4 ℃振荡吸附一段时间,得到硅球吸附固定化酶(S-CLEAs);后加入适量戊二醛溶液进行交联,在4 ℃条件下振荡交联一段时间,离心收集固定化酶,用磷酸盐缓冲溶液反复洗涤以除去未交联的游离酶和戊二醛,得到硅球吸附交联固定化酶(S-CLEAs-GA)。
以固定化酶活力回收率为指标,分别研究酶添加量(5.2、6.9、8.6、10.4、12.1 U/mL)、吸附时间(2、3、4、5、6、7、8、9、10 h)、交联时间(1、2、3、4、5 h)和戊二醛添加量(0.5、0.6、0.8、0.9、1.0 g/L)对固定化效果的影响。
1.3.4 固定化酶的稳定性测定
1.3.4.1 温度对酶活性的影响
为考察温度对SIase固定化前后酶活性的影响,测定了各种酶制剂在不同温度下处理后的剩余酶活力。用10 mmol/L的磷酸盐缓冲液(pH 6.0)配制等浓度的游离和固定化酶溶液,并将各种酶制剂分别置于不同温度(25~55 ℃)的恒温水浴中处理30 min后,按照1.3.2中的酶活性测定方法,以蔗糖为底物在25 ℃条件下测定各酶制剂的剩余活性。
1.3.4.2 pH对酶活性的影响
为考察pH对SIase固定化前后酶活力的影响,测定了这种酶制剂在不同pH下处理后的剩余酶活力。具体如下:以不同pH的缓冲液[磷酸氢二钠-柠檬酸钠(pH 4.0、5.0),磷酸二氢钠-磷酸氢二钠(pH 6.0、7.0)和Tris-HCl(pH 8.0、9.0)]为溶剂,分别配制相同浓度的游离和固定化酶溶液,并将其置于25 ℃水浴摇床中处理2 h;按照1.3.2中的酶活性测定方法,以蔗糖为底物在25 ℃条件下测定各种酶制剂的剩余活性。
1.3.4.3 固定化酶的操作稳定性
取一定量的S-CLEAs和S-CLEAs-GA,配制成相同浓度的固定化酶溶液,在最适反应条件下以蔗糖为底物测定其活性。将反应溶液离心分离去上清液,用磷酸盐缓冲液(10 mmol/L, pH 6.0)反复洗涤,以除去未反应的底物和产物;随后将离心洗涤后的固定化酶重新分散于缓冲液中,加入新的底物进行下一次的反应,如此重复15次。连续测定固定化酶在循环多次后的剩余酶活力,将第一次使用时的酶活力定义为100%。
2 结果与分析
2.1 SIase游离酶的制备
发酵上清液的SDS-PAGE电泳分析如图2所示,在分子质量约为65 kDa处观察到明显的目的条带,说明发酵上清液中主要含有SIase。
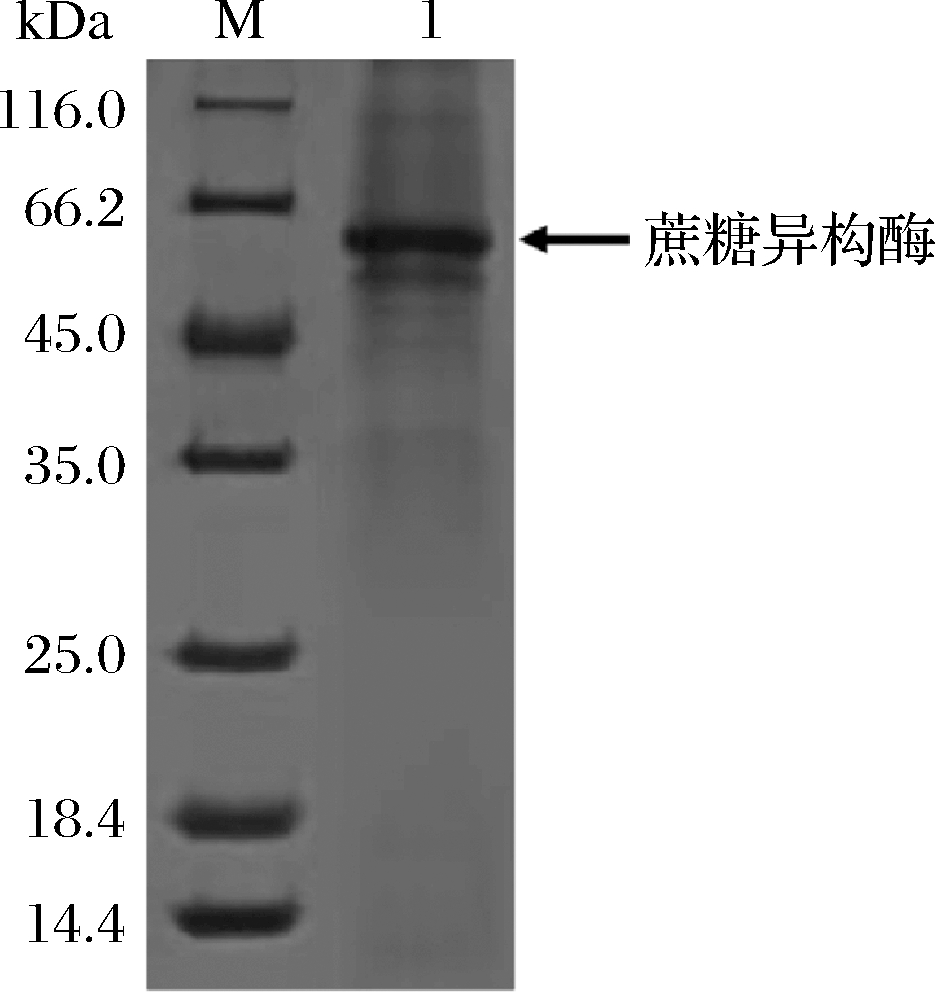
M-蛋白质标准;1-SIase发酵上清液
图2 蔗糖异构酶的SDS-PAGE分析
Fig.2 SDS-PAGE analysis of sucrose isomerase
2.2 固定化酶的制备与优化
在硅球质量浓度为6.25 mg/mL、4 ℃条件下,吸附足够长的时间,以考察不同酶加量对固定化酶活力回收率的影响,结果如图3所示。当酶加量为8.6 U/mL时,酶活力回收率达到最大,为51.7%。但继续提高酶加量,酶活力回收率却明显下降,这可能是由于大量酶沉淀在硅球表面导致聚集,即SIase在载体上形成多层吸附,导致了空间位阻效应,限制了底物的传质,从而催化活性降低[11]。因此,选取初始酶加量为8.6 U/mL。
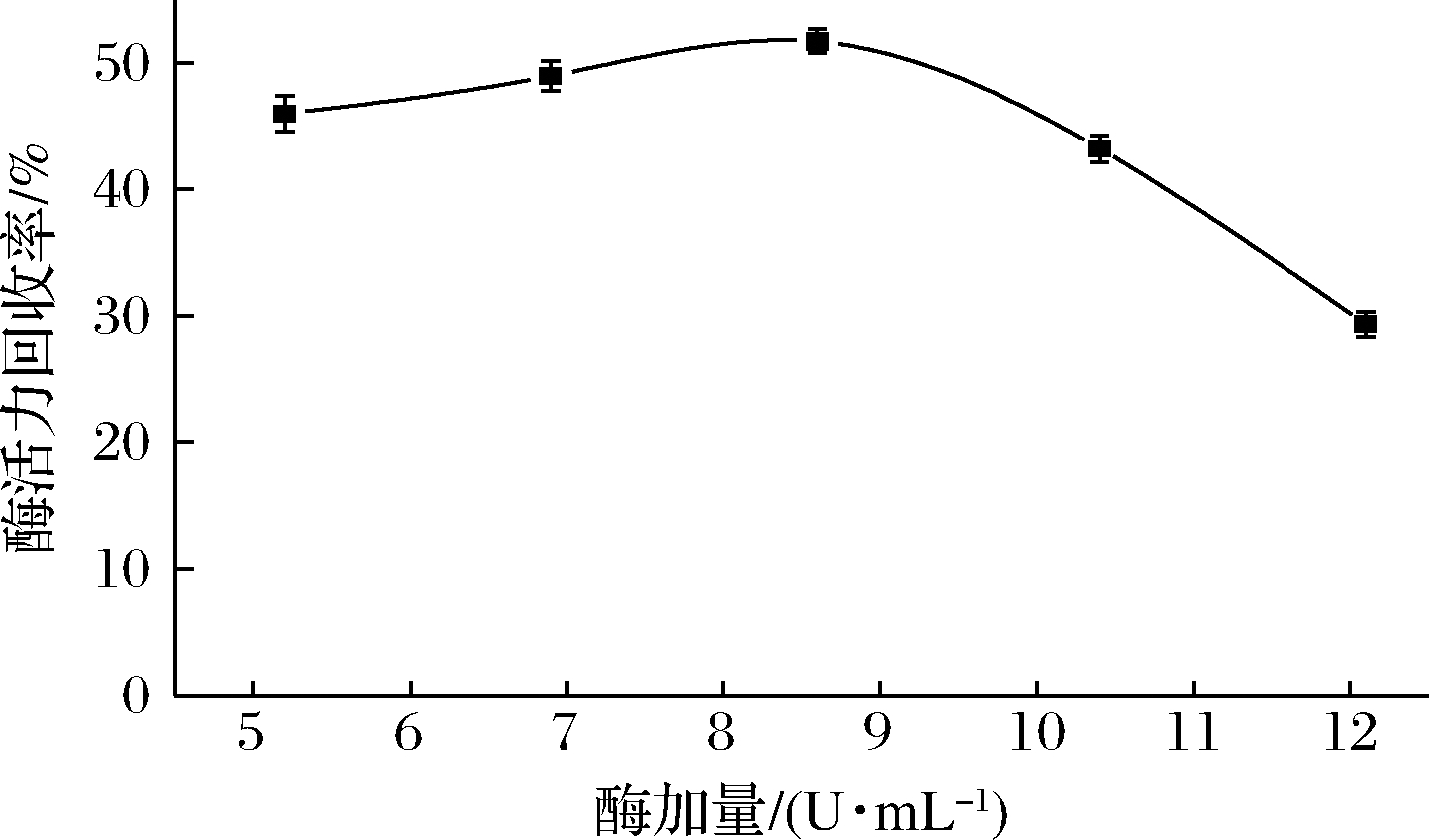
图3 酶加量对固定化酶活力回收率的影响
Fig.3 Effect of enzyme concentration on actiity recoery of immobilized enzyme
在硅球质量浓度为6.25 mg/mL、加酶量为8.6 U/mL、4 ℃的条件下,研究了吸附时间对固定化酶活力回收率的影响,结果见图4。随着吸附时间的延长,固定化酶的酶活力回收率先增加后降低,在吸附时间为5 h时,载体和酶的作用达到饱和,酶活力回收率达到最大值,为51.5%。当吸附时间大于5 h,酶活力回收率下降明显,这可能是由于酶自身稳定性的限制,酶失活的几率随吸附时间的延长而增加。因此确定吸附时间为5 h,且此时所得的硅球吸附固定化酶命名为S-CLEAs。
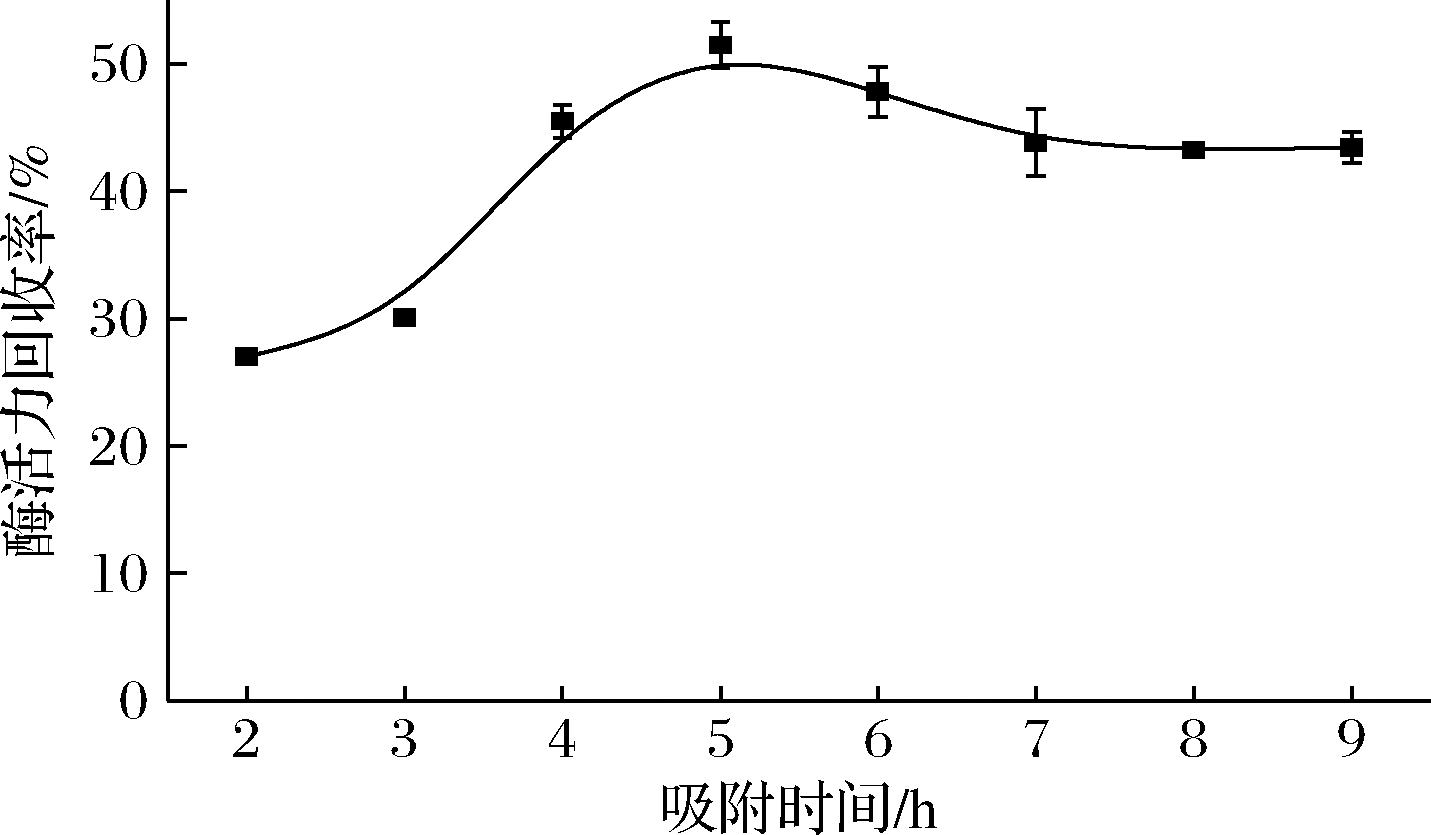
图4 吸附时间对固定化酶活力回收率的影响
Fig.4 Effect of adsorption time on actiity recoery of immobilized enzyme
在硅球质量浓度为6.25 mg/mL、加酶量为8.6 U/mL、吸附时间为5 h、4 ℃的条件下,研究了戊二醛添加量对固定化酶活力回收率的影响(图5)。戊二醛是酶固定化制备过程中最常用的交联剂。从图5可以看出,固定化酶活力回收率随着戊二醛添加量的增加先增大后减小,主要是因为戊二醛既可作为交联剂又是酶的变性剂[15]。当加入少量戊二醛时,酶因为在硅球表面不充分的交联而导致酶活力回收率较低,且在使用过程中酶易脱落,损失较多;继续提高戊二醛添加量后,酶活力回收率下降,这是由于过量的戊二醛造成了酶分子之间的过度交联,且将过多的酶交联在一起,影响了酶蛋白的活性[12];当戊二醛添加量为0.08%时,S-CLEAs-GA的酶活力回收率最高,达到44.9%。因此,S-CLEAs-GA的最适戊二醛添加量为0.08%。
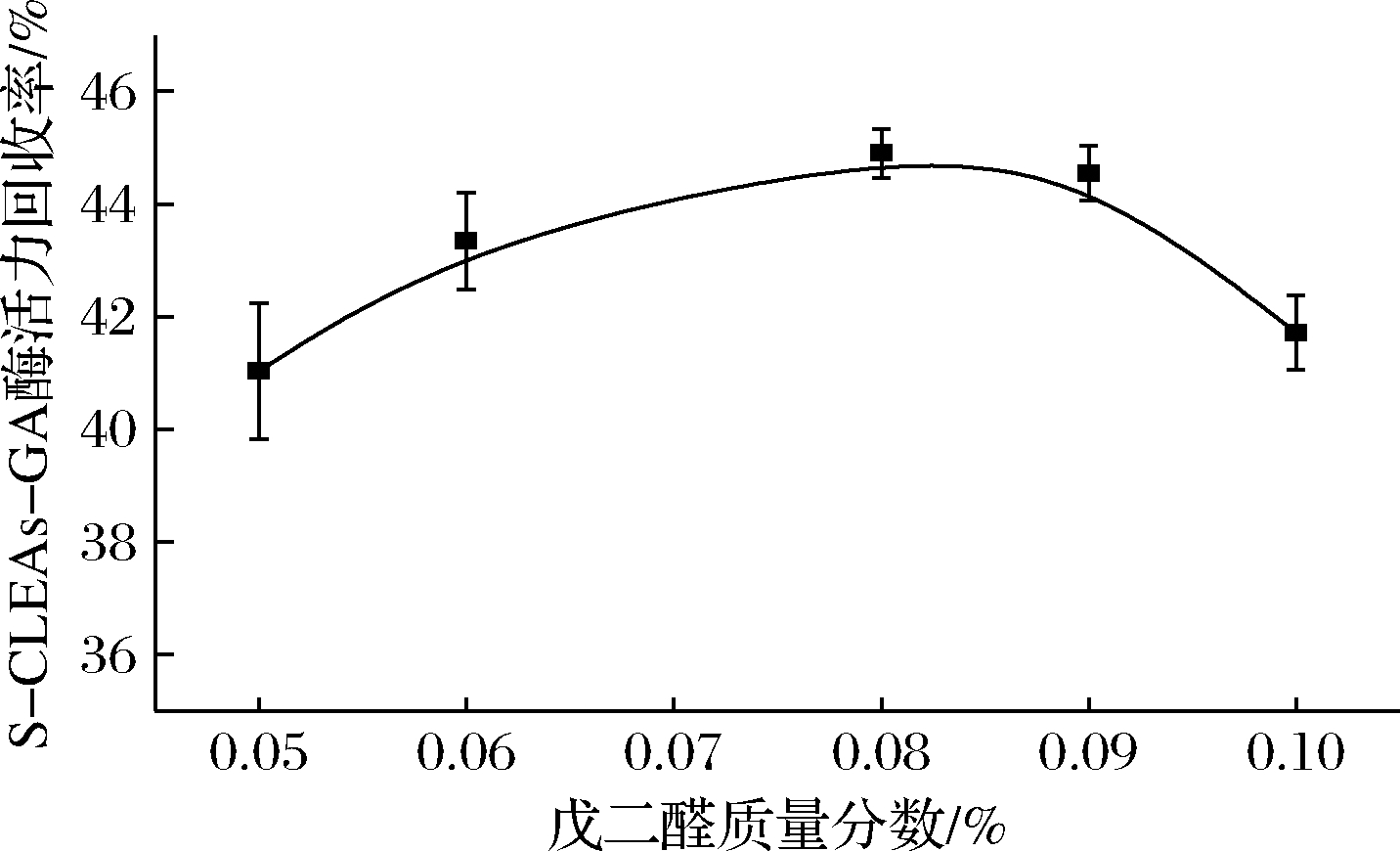
图5 戊二醛添加量对固定化酶活力回收率的影响
Fig.5 Effect of glutaraldehyde concentration on actiity recoery of immobilized enzyme
在硅球质量浓度为6.25 mg/mL、加酶量为8.6 U/mL、吸附时间为5 h、戊二醛添加量为0.08%、4 ℃的条件下,研究了交联时间对固定化酶活力回收率的影响,结果如图6所示。当交联时间为2 h时,酶活力回收率达到最高值,为44.2%。继续延长交联时间,酶活力回收率下降趋势明显。这可能是由于过长时间的交联,导致形成的固定化酶的网络结构太过紧密,使S-CLEAs-GA空间位阻变大,阻碍了酶与底物的接触,造成酶活力的下降[16]。因此,制备S-CLEAs-GA的最佳交联时间是2 h。
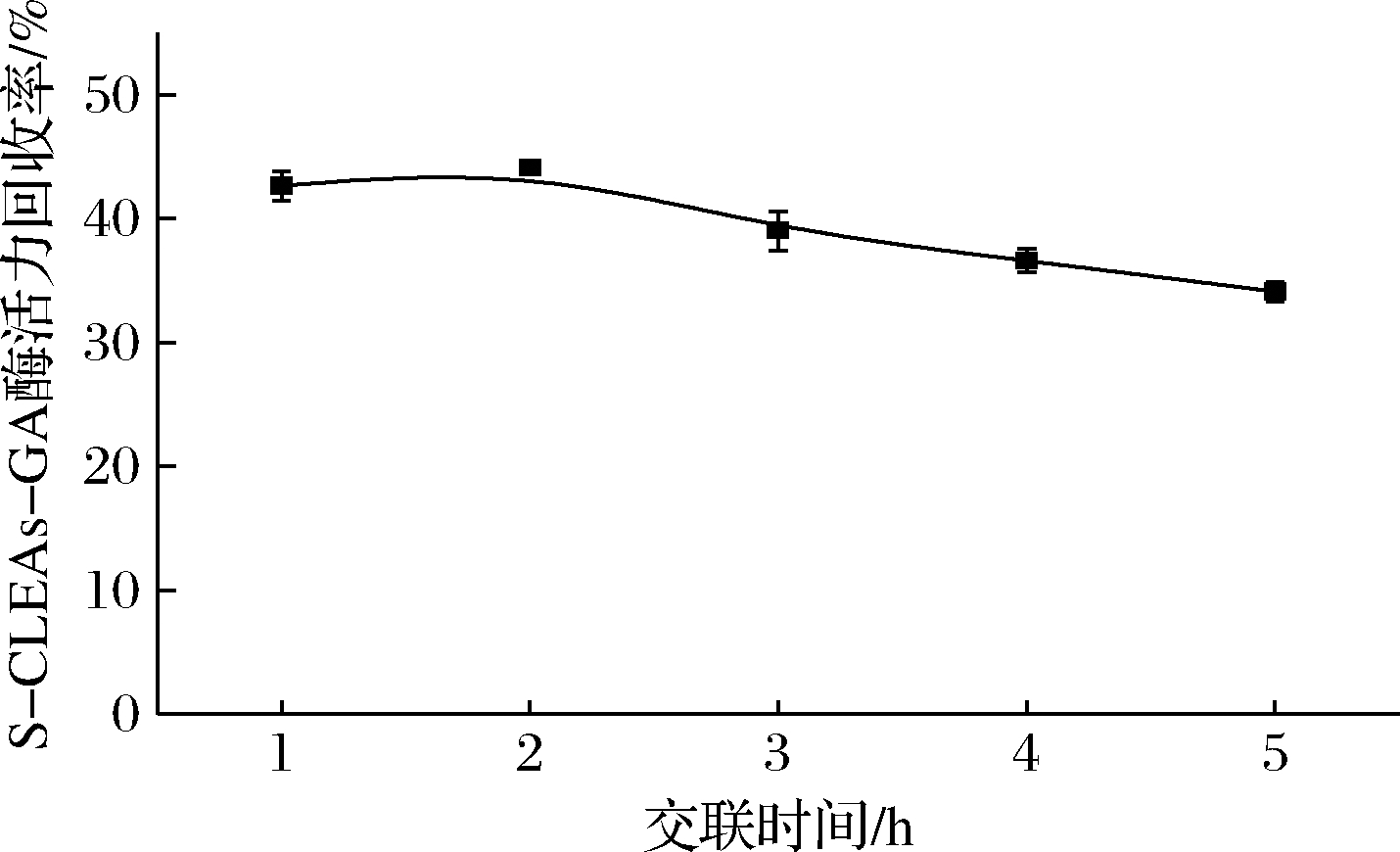
图6 交联时间对固定化酶活力回收率的影响
Fig.6 Effect of cross-linking time on actiity recoery of immobilized enzyme
采用吸附法和吸附-交联法对SIase进行固定化,并对其固定化条件进行了优化,确定最优的固定化条件为:加酶量为8.6 U/mL,吸附时间为5 h,戊二醛添加量为0.08%,交联时间为2 h。得到2种固定化酶,硅球吸附固定化酶(S-CLEAs)和硅球吸附-交联固定化酶(S-CLEAs-GA),酶活力回收率分别为51.2%和44.9%。
2.3 固定化酶的酶学特性
温度对游离酶和固定化酶活性的影响见图7。随着温度的上升,游离酶和固定化酶的活性也随之降低,且当处理温度较高时,酶制剂活性急剧下降,这可能是由于高温引起的酶的变性所致[17];但固定化酶在实验测定所有温度下均表现出较高的抗热应力稳定性。
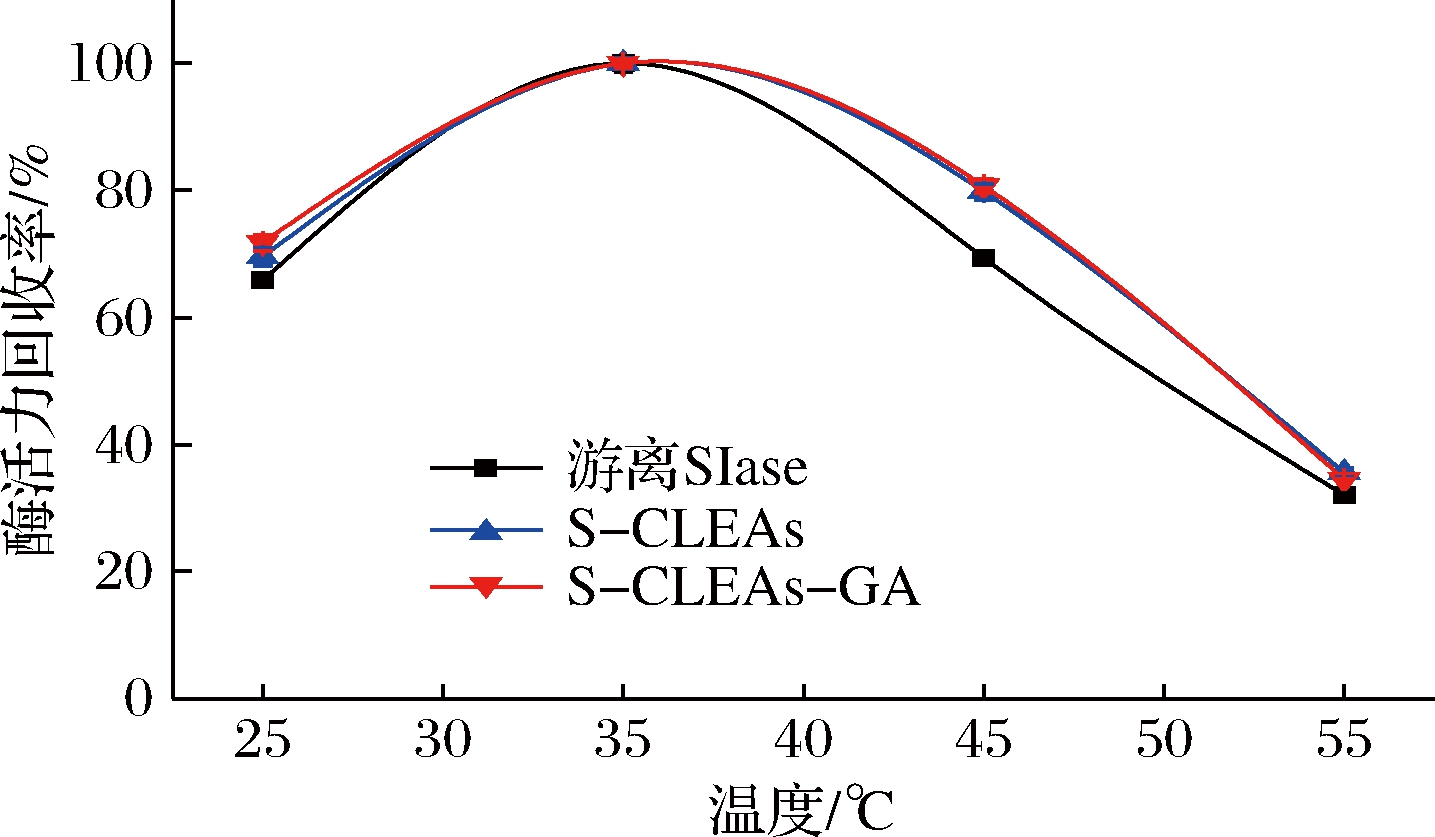
图7 温度对游离SIase和固定化酶活性的影响
Fig.7 Effect of temperature on the actiities of free SIase and immobilized enzyme
为了进一步研究固定化酶在极端pH条件下的耐受性,将各种酶样品置于不同pH缓冲溶液中处理并测定其剩余活性,结果如图8所示。可以看出,游离SIase受环境酸碱度变化的影响更大,且在酸性环境中活性下降的更为明显。在相同处理条件下,固定化酶的耐受性提高,尤其是在酸性环境中,说明SIase的固定化有利于稳定酶的结构[18]。
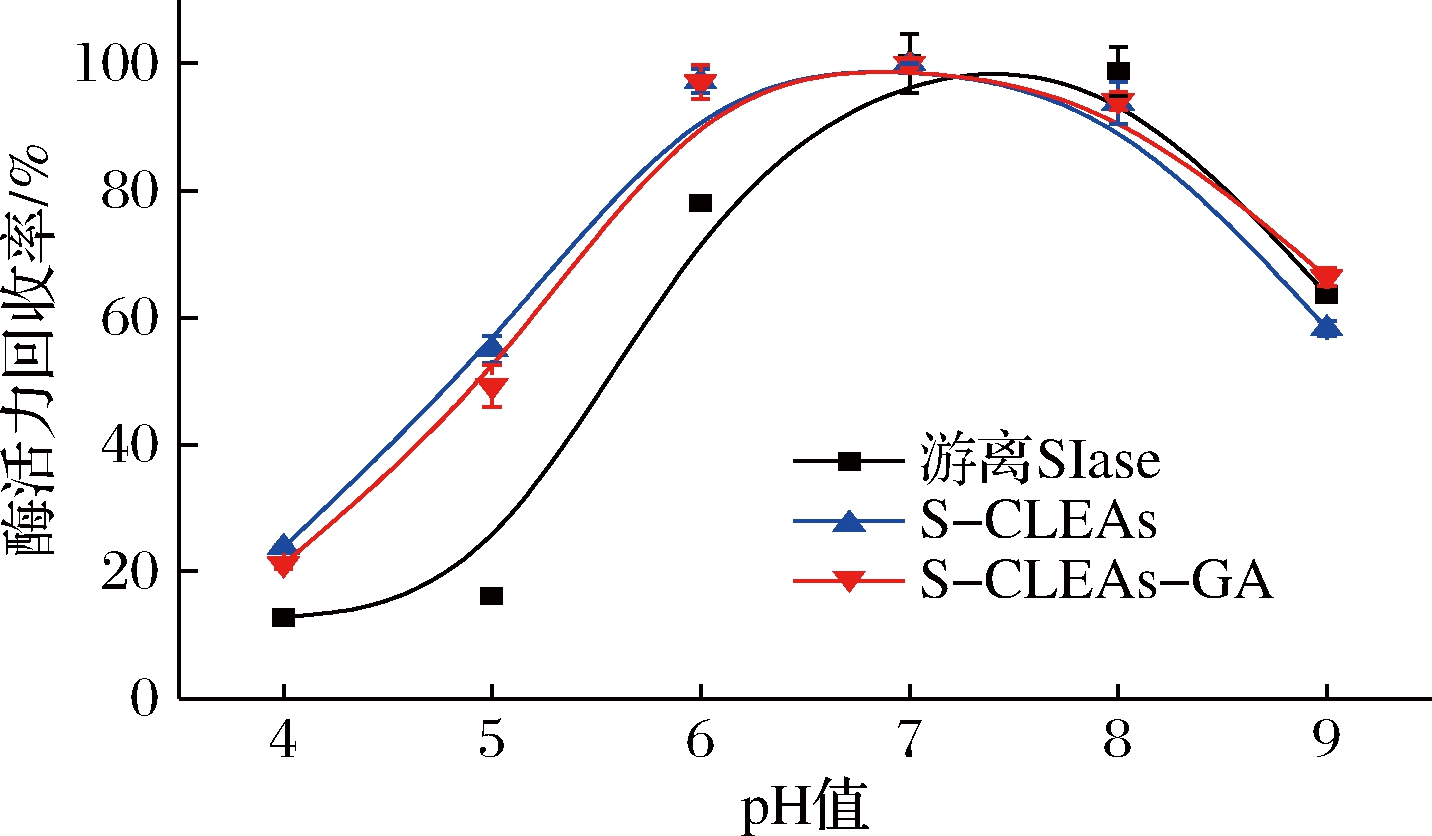
图8 pH对游离SIase和固定化酶活性的影响
Fig.8 Effect of pH on the actiities of free SIase and immobilized enzyme
稳定性实验结果表明,与游离酶相比,固定化酶表现出优异的热稳定性和pH耐受性。将SIase通过非共价键吸附固定在硅球表面(S-CLEAs),由于不涉及共价键的形成,很大程度地保留了酶分子结构的完整性,减少了因构象变化造成的活性损失[19-20]。而S-CLEAs-GA主要是酶分子间通过交联剂多点共价连接在硅球的周围,这样可增强酶的刚性、提高构象稳定性、防止酶的构象转变并保护酶结构不被破坏,增强了酶抵抗外界条件的能力[21-22]。但由于交联对酶分子构象的影响较大,与S-CLEAs(51.2%)相比,S-CLEAs-GA的酶活力回收率比较低(44.9%)。
2.4 固定化酶的操作稳定性
固定化酶的重复使用稳定性对其工业应用具有重要意义。以蔗糖为底物,分别考察了S-CLEAs和S-CLEAs-GA在连续使用15次后酶活力回收率的变化,结果见图9。可以看出,随着循环使用次数的增加,2种固定化酶的酶活力回收率都有所降低。循环使用15次后,S-CLEAs和S-CLEAs-GA的酶活力回收率分别为55.1%和77.9%。表明S-CLEAs-GA的操作稳定性明显优于S-CLEAs,主要是由于S-CLEAs在连续振荡、回收、洗涤、重复使用等频繁处理过程中,吸附在载体表面的酶脱落,引起整个反应体系中酶活力的降低[23]。而经戊二醛交联所得的S-CLEAs-GA面对这些操作时,可以很好地将酶保留在载体的表面。此外,在重复使用过程中酶的变性也是固定化酶活力损失的一个重要原因[24]。THMTURK等[25]将聚乙烯亚胺包裹在SNP表面,并以此为载体通过静电吸附固定化乙酰胆碱酯酶,所得固定化酶的酶活力回收率为91%,但在重复使用12次后,其相对活性就降到50%以下;随后,NGUYEN等[26]用活性炭颗粒吸附漆酶后所得固定化酶循环使用12次后,可保留初始活性的71%;本实验室前期制备的交联磷脂酶D聚集体,在最适条件下的酶活力回收率高达118.8%,但重复使用10次后,仅保留50.4%的初始活性[27]。这些结果都说明吸附-交联固定化所得的S-CLEAs-GA不仅具有较高的催化活性,且优异的操作稳定性使其在实际生产中具有更强的竞争力。
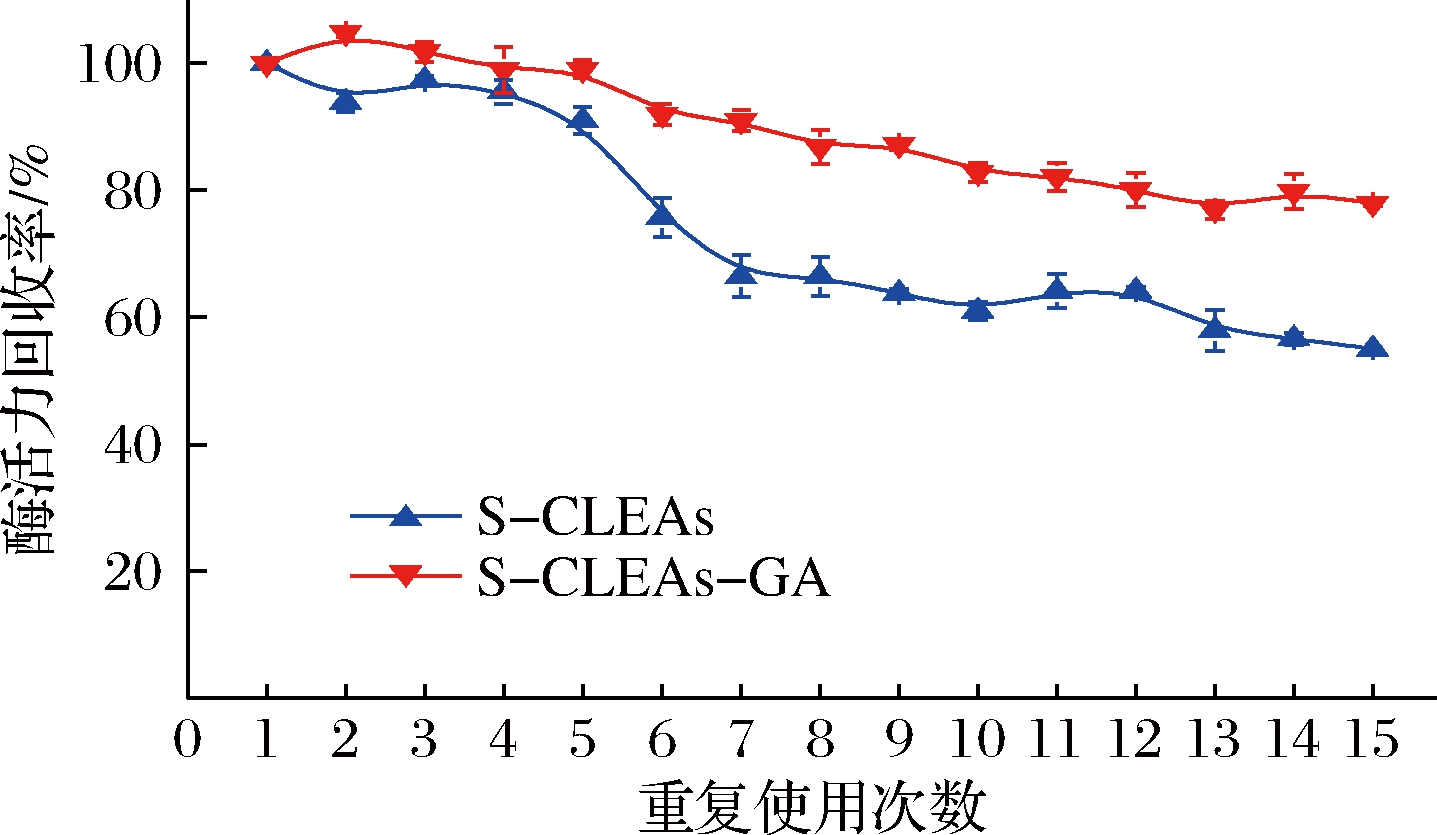
图9 固定化酶S-CLEAs和S-CLEAs-GA的重复使用性
Fig.9 Reusability of S-CLEAs and S-CLEAs-GA
3 结论
本文以硅纳米粒子为载体,戊二醛为交联剂,利用吸附法和吸附-交联法固定化蔗糖异构酶,得到S-CLEAs和S-CLEAs-GA两种固定化酶。在酶加量为8.6 U/mL、吸附时间为5 h时,S-CLEAs的最大酶活力回收率为51.2%;随后加入0.08%的戊二醛、交联2 h后,得到的S-CLEAs-GA的最大酶活力回收率为44.9%。固定化酶表现出优异的的热稳定性和pH耐受性,且S-CLEAs-GA的稳定性优于S-CLEAs。在重复使用15次后,S-CLEAs和S-CLEAs-GA仍然能够保持55%以上的初始酶活力。表明此方法得到的固定化酶拥有良好的酶活力回收率和操作稳定性,其性能远优于游离酶,具有良好的发展前景。
[1] LIU L N, BILAL M, LUO H Z, et al.Studies on biological production of isomaltulose using sucrose isomerase:Current status and future perspecties[J].Catalysis Letters, 2021, 151(7):1 868-1 881.
[2] SAWALE P D, SHENDURSE A M, MOHAN M S, et al.Isomaltulose (palatinose):An emerging carbohydrate[J].Food Bioscience, 2017, 18:46-52.
[3] 张艳苓. 异麦芽酮糖的研究与应用[J].轻工科技, 2013, 29(5):23-24;59.
ZHANG Y L.Study and application of isomaltulose[J].Light Industry Science and Technology, 2013, 29(5):23-24;59.
[4] DE GROOT E, SCHWEITZER L, THEIS S.Efficacy of isomaltulose compared to sucrose in modulating endothelial function in oerweight adults[J].Nutrients, 2020, 12(1):141.
[5] SHYAM S, RAMADAS A, CHANG S K.Isomaltulose:Recent eidence for health benefits[J].Journal of Functional Foods, 2018, 48:173-178.
[6] LINA B A R, JONKER D, KOZIANOWSKI G.Isomaltulose (Palatinose®):A reiew of biological and toxicological studies[J].Food and Chemical Toxicology, 2002, 40(10):1 375-1 381.
[7] CONTESINI F J, IBARGUREN C, GROSSO C R F, et al.Immobilization of glucosyltransferase from Erwinia sp.using two different techniques[J].Journal of Biotechnology, 2012, 158(3):137-143.
[8] WU L T, LIU Y, CHI B, et al.An innoatie method for immobilizing sucrose isomerase on ε-poly-L-lysine modified mesoporous TiO2[J].Food Chemistry, 2015, 187:182-188.
[9] WU L T, QIU J J, WU S S, et al.Bioinspired production of antibacterial sucrose isomerase-sponge for the synthesis of isomaltulose[J].Adanced Synthesis & Catalysis, 2016, 358(24):4 030-4 040.
[10] 孟虹, 赵怡, 李宪臻, 等.蔗糖异构酶PalⅠ-Cu2+纳米花固定化酶的制备及其结构、性能分析[J].中国生物制品学杂志, 2021, 34(3):286-289;293.
MENG H, ZHAO Y, LI X Z, et al.Preparation, structure and performance of sucrose isomerase PalⅠ-Cu2+ nanoflower as an immobilized enzyme[J].Chinese Journal of Biologicals, 2021, 34(3):286-289;293.
[11] ZHANG C Y, DONG X Y, GUO Z, et al.Remarkably enhanced actiity and substrate affinity of lipase coalently bonded on zwitterionic polymer-grafted silica nanoparticles[J].Journal of Colloid and Interface Science, 2018, 519:145-153.
[12] PERWEZ M, AHMED MAZUMDER J, SARDAR M.Preparation and characterization of reusable magnetic combi-CLEA of cellulase and hemicellulase[J].Enzyme and Microbial Technology, 2019, 131:109389.
[13] SIGURDARD TTIR S B, LEHMANN J, OTAR S, et al.Enzyme immobilization on inorganic surfaces for membrane reactor applications:Mass transfer challenges, enzyme leakage and reuse of materials[J].Adanced Synthesis & Catalysis, 2018, 360(14):2 578-2 607.
TTIR S B, LEHMANN J, OTAR S, et al.Enzyme immobilization on inorganic surfaces for membrane reactor applications:Mass transfer challenges, enzyme leakage and reuse of materials[J].Adanced Synthesis & Catalysis, 2018, 360(14):2 578-2 607.
[14] ALI S, ZAFAR W, SHAFIQ S, et al.Enzymes immobilization:An oeriew of techniques, support materials and its applications[J].International Journal of Scientific & Technology Research, 2017, 6(7):64-72.
[15] 叶芊芊, 谌凯, 张玲, 等.京尼平交联制备枯草杆菌碱性蛋白酶聚集体[J].现代食品科技, 2020, 36(8):95-101;152.
YE Q Q, CHEN K, ZHANG L, et al.Preparation of Bacillus subtilis alkaline protease aggregates by crosslinking with genepin[J].Modern Food Science and Technology, 2020, 36(8):95-101;152.
[16] 许超群, 万云宝, 张小龙, 等.吸附交联法固定化黑曲霉β-葡萄糖苷酶[J].中国酿造, 2016, 35(4):83-87.
XU C Q, WAN Y B, ZHANG X L, et al.Immobilization of β-glucosidase from Aspergillus niger by adsorption and crosslinking method[J].China Brewing, 2016, 35(4):83-87.
[17] YANG X Y, CHEN Y F, YAO S, et al.Preparation of immobilized lipase on magnetic nanoparticles dialdehyde starch[J].Carbohydrate Polymers, 2019, 218:324-332.
[18] NAWAWI N N, HASHIM Z, MANAS N H A, et al.A porous-cross linked enzyme aggregates of maltogenic amylase from Bacillus lehensis G1:Robust biocatalyst with improed stability and substrate diffusion[J].International Journal of Biological Macromolecules, 2020, 148:1 222-1 231.
[19] YE P, JIANG J, XU Z K.Adsorption and actiity of lipase from Candida rugosa on the chitosan-modified poly(acrylonitrile-co-maleic acid) membrane surface[J].Colloids and Surfaces B:Biointerfaces, 2007, 60(1):62-67.
[20] FILHO D G, SILA A G, GUIDINI C Z.Lipases:sources, immobilization methods, and industrial applications[J].Applied Microbiology and Biotechnology, 2019, 103(18):7 399-7 423.
[21] ESMAEILNEJAD-AHRANJANI P, KAZEMEINI M, SINGH G, et al.Study of molecular conformation and actiity-related properties of lipase immobilized onto core-shell structured polyacrylic acid-coated magnetic silica nanocomposite particles[J].Langmuir:the ACS Journal of Surfaces and Colloids, 2016, 32(13):3 242-3 252.
[22] URRUTIA P, ARRIETA R, ALAREZ L, et al.Immobilization of lipases in hydrophobic chitosan for selectie hydrolysis of fish oil:The impact of support functionalization on lipase actiity, selectiity and stability[J].International Journal of Biological Macromolecules, 2018, 108:674-686.
[23] CHEN N, ZHANG C Y, DONG X Y, et al.Fabrication and characterization of epoxylated zwitterionic copolymer-grafted silica nanoparticle as a new support for lipase immobilization[J].Chinese Journal of Chemical Engineering, 2020, 28(4):1 129-1 135.
[24] ZHANG C Y, LIU Y, SUN Y.Lipase immobilized to a short alkyl chain-containing zwitterionic polymer grafted on silica nanoparticles:Moderate actiation and significant increase of thermal stability[J].Biochemical Engineering Journal, 2019, 146:124-131.
[25] TUMTURK H, YÜKSEKDAG H.Acetylcholinesterase immobilized onto PEI-coated silica nanoparticles[J].Artificial Cells, Nanomedicine, and Biotechnology, 2016, 44(2):443-447.
[26] NGUYEN L N, HAI F I, DOSSETO A, et al.Continuous adsorption and biotransformation of micropollutants by granular actiated carbon-bound laccase in a packed-bed enzyme reactor[J].Bioresource Technology, 2016, 210:108-116.
[27] 陈宁, 延文星, 路福平, 等.磷脂酶D交联聚集体的制备及其酶学性能研究[J].食品与发酵工业, 2022, 48(5):1-7.
CHEN N, YAN W X, LU F P, et al.Preparation and characterization of cross-linked enzyme aggregates of phospholipase D[J].Food and Fermentation Industries, 2022, 48(5):1-7.