沙门氏菌和大肠杆菌均属于革兰氏阴性菌,是导致细菌性食物中毒的主要食源性病原菌,严重威胁着食品安全和全球公众健康,给全球经济尤其是食品工业造成巨大损失[1-3]。因此,必须采取相应措施控制食品工业中的沙门氏菌和大肠杆菌污染。
噬菌体被认为是控制微生物污染的有效抗菌剂,噬菌体制剂用于生物防治的研究也已被广泛关注[4-5]。噬菌体裂解细菌一般分为5个步骤,即吸附、侵入、复制、装配、释放,因此,吸附受体的特异性会决定噬菌体的裂解谱,导致当前多价噬菌体的数量及活性研究相对较少。而与噬菌体相比,内溶素是一种肽聚糖水解酶,能够特异性裂解细菌细胞壁的肽聚糖,肽聚糖具有高度的保守性,基于此,内溶素具有比噬菌体更广的裂解谱以及不易产生抗性的优势[6-8]。随着分子生物学技术的成熟,重组内溶素用于防治食品工业中微生物污染的研究持续受到关注[9],而当前大部分研究集中于革兰氏阳性菌噬菌体内溶素[10-11]。这是由于革兰氏阴性菌细胞壁外膜结构的复杂性会将内溶素阻隔在胞外,使其无法与目标底物肽聚糖结合[12-13]。从而导致革兰氏阴性菌噬菌体内溶素通常需要借助膜通透剂的协同作用才能与肽聚糖底物接触从而发挥抑制作用,使得该类内溶素的应用严重受阻[9, 14]。有研究指出,在内溶素末端添加阳离子膜穿透肽有助于内溶素穿过外膜结构与肽聚糖接触,从而使革兰氏阴性菌噬菌体内溶素具有外部裂解能力[15-17]。因此,借助基因工程技术对革兰氏阴性菌噬菌体内溶素进行修饰,可能有助于解决内溶素难以用于革兰氏阴性菌体外防控的短板。
多价噬菌体vB_SEqdws-315(Genbank Accession No.OK663600.1)是本实验室分离得到的一株以沙门氏菌和大肠杆菌为宿主的具有高效裂解活性的噬菌体,具有较为罕见的跨种属裂解能力,对其全基因组进行测序分析后发现其含有编码内溶素的开放式阅读框,内溶素基因(Genbank Accession No.UEW68667.1)全长456 bp,共编码151个氨基酸,该内溶素属于球形内溶素,包含Amidase_2结构域,为N-乙酰胞壁酸-L-丙氨酸酰胺酶,主要水解肽聚糖糖基和多肽之间的化学键。本研究尝试对该内溶素基因进行克隆表达,同时对其进行阳离子肽修饰,为革兰氏阴性菌噬菌体内溶素的独立应用提供解决策略。以沙门氏菌CMCC 50115为测试菌株,测定修饰内溶素对牛奶中沙门氏菌的杀菌效果,初步为利用内溶素食品工业中的防控革兰氏阴性菌污染提供参考基础。
1 材料与方法
1.1 菌株与试剂
烈性噬菌体vB_SEqdws-315由本实验室从污水中分离纯化得到;宿主菌为本实验室购买保存的沙门氏菌CMCC 50115(以下简称50115)与大肠杆菌K12,其他用于测定抗菌活性的菌株为沙门氏菌ATCC 14028、CMCC 50001、CMCC 50041、CMCC 50071、CMCC 50094、CMCC 50015以及大肠杆菌K80、O157·G2583、DH5α、BL21(DE3)。
LB肉汤、LB琼脂,青岛海博生物技术有限公司,液体、固体培养基按照所购培养基的说明配制;咪唑、卡那霉素、异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactoside,IPTG)、EDTA,索莱宝生物技术有限公司;所有其他试剂和化学品均为分析级试剂。
1.2 仪器与设备
Sigma 3K15型高速台式冷冻离心机,德国Sigma公司;L535R大容量低温台式离心机,湘仪仪器有限公司;step-oneplus PCR仪器,美国Life Technologies公司;DYCZ-24D电泳仪,北京六一仪器厂;MLS-3781-PC高压蒸汽灭菌锅,松下健康医疗器械株式会社;EHWY2102振荡培养箱,上海智城分析仪器公司;HH-B11-S电热恒温培养箱,上海跃进医疗器械厂;UH-12高压破碎机,上海永联生物科技有限公司;蛋白质电泳仪、SYSTEM GelDoc XR+凝胶成像系统,美国Bio-Rad公司。
1.3 实验方法
1.3.1 引物设计与合成
根据噬菌体vB_SEqdws-315内溶素基因序列设计引物(表1),在正反向引物端分别设计限制性内切酶EcoR V与Xho I的酶切位点,下划线部分分别为EcoR V与Xho I酶切位点,引物由上海生物工程公司合成。
表1 内溶素Lysin315引物设计
Table 1 Primer sequences of Lysin315

引物序列备注Lysin-FCCGGATATCATGAGTAAGGTACAATTCAAACAG上游引物Lysin-RCCGCTCGAGTTATCCCCAATCACTTGTTAC下游引物
1.3.2 PCR反应
以噬菌体vB_SEqdws-315基因组为模板,进行内溶素目的片段的PCR扩增。PCR条件如下:98 ℃ 预变性4 min后进入循环,98 ℃变性10 s,55 ℃复性15 s,72 ℃延伸50 s,共35个循环,终延伸5 min。扩增后的产物以0.8%琼脂糖凝胶电泳检测目的片段。
1.3.3 表达载体的构建
将目的片段与pET-30a空载体(含有卡那霉素抗性基因)进行限制性内切酶EcoR V与Xho I双酶切,酶切后经0.8%琼脂糖凝胶电泳检测。酶切后的目的片段与克隆表达载体pET-30a连接构成重组表达载体。重组载体转化至大肠杆菌DH5α感受态细胞,经含有卡那霉素的抗性平板筛选,提取阳性重组质粒DNA,送上海生物工程公司测序。
1.3.4 内溶素诱导表达与纯化
将验证无误的阳性重组质粒转化至大肠杆菌表达菌株BL21(DE3)后,获得了含有内溶素基因的重组大肠杆菌BL21-Lysin315,将其接种于50 mL的LB液体培养基(含有50 μg/mL卡那霉素),37 ℃ 150 r/min过夜培养。次日,按照1∶100的体积比将过夜培养的菌液加入到新鲜的LB液体培养基中(含有50 μg/mL卡那霉素),37 ℃ 150 r/min培养至OD600nm值大约为0.6,加入诱导剂IPTG至终浓度为3 mmol/L,25 ℃ 150 r/min诱导4 h后18 ℃ 150 r/min诱导过夜。诱导后将菌液离心,菌体沉淀充分复溶于结合缓冲液(50 mmol/L Na2 HPO4·12H2O,400 mmol/L NaCl,5%甘油,pH 8.0),用高压细胞破碎机将菌体破碎,离心去除不溶性细胞碎片。上清液过含有5 mL Ni SepharoseTM 6 Fast Flow填料的重力柱进行亲和层析。先用5倍柱体积的结合缓冲液以1 mL/min的速率平衡重力柱后装载样品,随后分别用20、40 mmol/L咪唑浓度的结合缓冲液冲洗重力柱以去除其他杂蛋白,最后用300 mmol/L咪唑浓度的结合缓冲液洗脱目的蛋白。收集每一步纯化产物进行SDS-PAGE检测。将目的蛋白使用透析袋充分透析24 h除去咪唑后离心取上清液进行脱盐处理,使用BCA试剂盒进行蛋白浓度定量,制备的重组内溶素命名为Lysin315,置于-80 ℃保存。
1.3.5 内溶素裂解谱测定
按照林洪等[18]报道的方法,作出部分修改后进行内溶素裂解谱的测定:分别挑取实验室保存的12株沙门氏菌与大肠杆菌单菌落于LB液体培养基中,37 ℃培养至对数期(约107 CFU/mL),菌体离心,用50 mmol/L EDTA复溶5 min,4 ℃、8 000 r/min条件下离心10 min,然后用无菌纯水洗涤两次后获得细菌沉淀,-80 ℃保存。测定裂解谱之前,将细菌沉淀用50 mmol/L Tris(pH 8.2,含0.1%Triton X-100)复溶。取100 μL细菌复溶液均匀涂布到LB琼脂培养基的表面。将无菌牛津杯(5 mm)放在平板的表面,取100 μL 500 μg/mL的内溶素Lysin315加入到每个牛津杯中。以加入Tris缓冲液的牛津杯为对照。将平板置于37 ℃环境中过夜。通过观察是否有抑菌圈形成来测定内溶素Lysin315的裂解谱。
1.3.6 内溶素裂解活性测定
将1.3.5制备的沙门氏菌50115细菌沉淀用50 mmol/L Tris(含0.1%Triton X-100, pH 8.2)充分复溶。各取100 μL复溶菌液于内溶素Lysin315中,内溶素Lysin315终质量浓度分别为1 000、500、250、125、60、30、15、0 μg/mL。在37 ℃环境下作用2 h后,梯度稀释样品对沙门氏菌50115的可培养细胞数进行统计并计算宿主菌存活率,如公式(1)所示:
宿主菌存活率![]()
(1)
1.3.7 阳离子肽修饰内溶素的克隆、表达与纯化
参照MA等[16]、NING等[19]的方法,作出部分修改后进行如下操作:在原始内溶素Lysin315序列末端添加5~15个阳离子氨基酸组成的短肽,对3种修饰后的内溶素进行诱导表达和纯化。噬菌体vB_SEqdws-315的基因组DNA被用作设计修饰内溶素(Lysin315-5aa,Lysin315-10aa和Lysin315-15aa)的克隆模板,设计引物并交由上海生物工程公司合成(表2),下划线部分分别为EcoR V与Xho I酶切位点。修饰内溶素同样在大肠杆菌BL21(DE3)中使用pET-30a载体和IPTG诱导表达。后续诱导表达和纯化操作同1.3.2~1.3.4,制备的修饰内溶素命名为Lysin315-5aa、Lysin315-10aa、Lysin315-15aa。
表2 修饰内溶素引物设计
Table 2 Primer sequences of chimeric lysins

引物序列备注Lysin-FCCGGATATCATGAGTAAGGTACAATTCAAACAG通用上游引物Lysin-5aa-RCCGCTCGAGTTATTTGCGTTTGCGTTTTCCCCAATCACTTGTTAC加入5个阳离子氨基酸Lysin-10aa-RCCGCTCGAGTTATTTTTTGCGTTTGCGTTTGCGTTTGCGTTTTCCCCAATCACTTGTTAC加入10个阳离子氨基酸Lysin-15aa-RCCGCTCGAGTTATTTGCGTTTGCGTTTGCGTTT-GCGTTTGCGTTTGCGTTTGCGTTTTCCCCAATCACTTGTTAC加入15个阳离子氨基酸
1.3.8 阳离子肽修饰内溶素裂解活性测定
参照NING等[19]的方法,作出部分修改后进行如下操作:挑取实验室保存的沙门氏菌50115与大肠杆菌K12单菌落于LB液体培养基中,37 ℃培养至对数期(约107 CFU/mL)。分别取100 μL对数期培养物(约107 CFU/mL),与Tris缓冲液和500 μg/mL的不同内溶素(Lysin315,Lysin315-5aa,Lysin315-10aa,Lysin315-15aa)在37 ℃环境中作用2 h。使用无菌PBS连续稀释处理过的细菌培养物,通过测定4种内溶素处理后的宿主可培养细胞数量以比较抗菌活性。
1.3.9 阳离子肽修饰内溶素裂解谱测定
按照LI等[20]报道的方法,作出部分修改后进行修饰内溶素的裂解谱测定:分别挑取实验室保存的沙门氏菌与大肠杆菌单菌落于LB液体培养基中,37 ℃培养至对数期(约107 CFU/mL)。取100 μL对数期细菌培养物均匀涂布到LB琼脂培养基的表面,将无菌牛津杯(5 mm)放在平板的表面。取100 μL 500 μg/mL的抗菌活性最强的修饰内溶素Lysin315-10aa加入到每个牛津杯中,以加入Tris缓冲液的牛津杯为对照。将平板置于37 ℃环境中过夜。通过观察是否有抑菌圈形成来测定修饰内溶素的裂解谱。
1.3.10 阳离子肽修饰内溶素在牛奶中的抗菌效果
将100 μL的106 CFU/mL的沙门氏菌50115和100 μL 500 μg/mL修饰内溶素Lysin315-10aa混合于4.8 mL的牛奶中。用等体积的Tris缓冲液代替修饰内溶素添加到对照组中。样品分别在4 ℃和25 ℃环境中孵育,于0、1、2 h取样并连续梯度稀释。采用平板计数法对样品中的沙门氏菌可培养细菌数进行定量并计算宿主菌存活率。
1.3.11 数据处理
数据分析和图表绘制分别使用Excel 2003和GraphPad Prism 7.0,利用标准方差分析数据,P<0.05为显著性差异,所有实验设置3个平行。
2 结果与分析
2.1 内溶素Lysin315诱导表达结果
重组内溶素表达条件为IPTG 3 mmol/L、25 ℃ 150 r/min诱导4 h后18 ℃ 150 r/min诱导过夜。纯化后的SDS-PAGE结果如图1所示,该条件下内溶素Lysin315呈现上清表达,表达纯度高。Lysin315分子质量接近25 kDa,分子质量大小与当前常见的球形内溶素一致(15~25 kDa)[21]。经透析、超滤等后处理后的蛋白质量浓度为6.02 mg/mL。
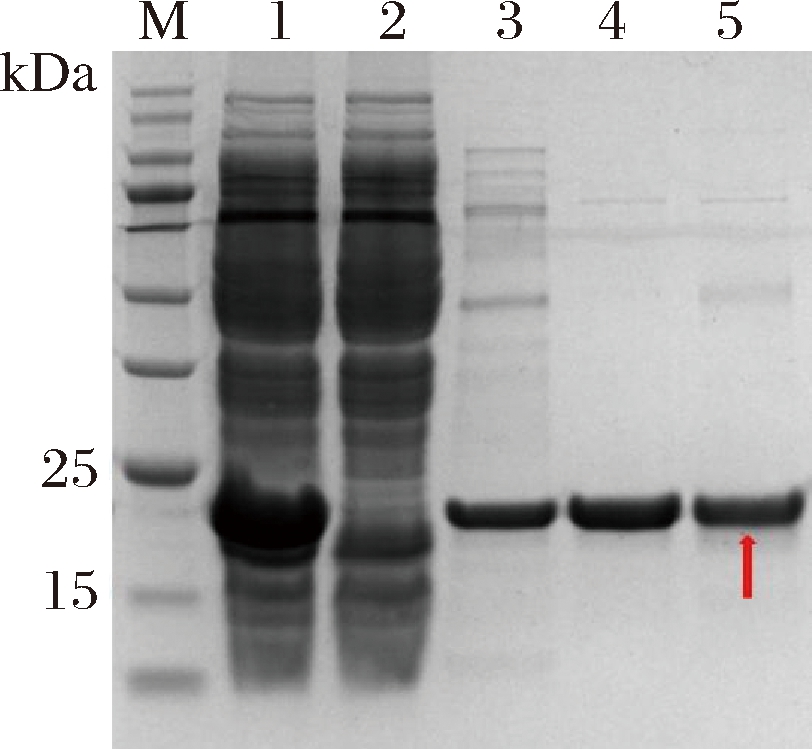
M-Marker;1-破碎后上清液;2-过柱流出液;3~5-20、 40、300 mmol/L咪唑洗脱液
图1 内溶素Lysin315的表达与纯化
Fig.1 Expression and purification of Lysin315
2.2 内溶素裂解活性的确定
本研究所使用的EDTA为常见的螯合剂,能够螯合吸附二价离子,破坏细菌外膜稳定性[18],从而帮助内溶素透过外膜结构与肽聚糖底物结合。内溶素Lysin315的裂解活性如图2所示,在膜通透剂EDTA的协助下,Lysin315在1 000 μg/mL质量浓度下可有效裂解浓度高达106 CFU/mL的沙门氏菌50115,裂解效率达到95%以上,而使用125 μg/mL就可清除50%以上的高浓度沙门氏菌50115。然而,内溶素Lysin315在无膜通透剂EDTA的协助下不能单独发挥裂解活性,该现象与大多数革兰氏阴性菌噬菌体内溶素一致[18, 22]。
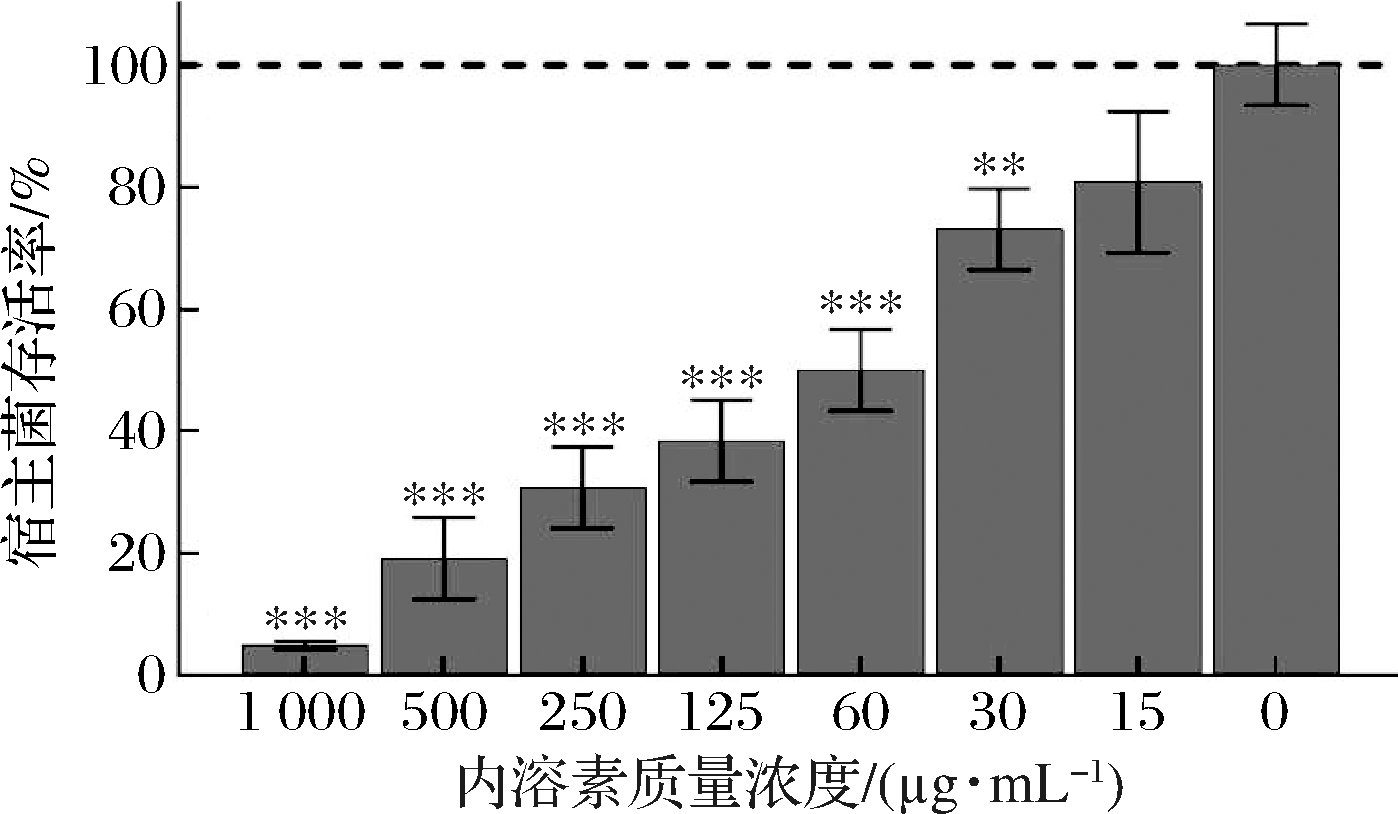
图2 不同浓度内溶素Lysin315裂解活性
Fig.2 Antibacterial activity of Lysin315 at different concentrations
注:***代表P<0.001;**代表P<0.01(下同)
2.3 阳离子肽修饰内溶素的构建及诱导表达结果
将具有5,10和15个氨基酸的阳离子肽加入到内溶素Lysin315的C端以构建3种阳离子肽修饰内溶素:Lysin315-5aa、Lysin315-10aa和Lysin315-15aa,修饰示意图如图3所示。阳离子氨基酸有赖氨酸、精氨酸和组氨酸3种,而赖氨酸(9.74)和精氨酸(10.76)的等电点(isoelectric point,pI)显著高于组氨酸(7.59)。在pH
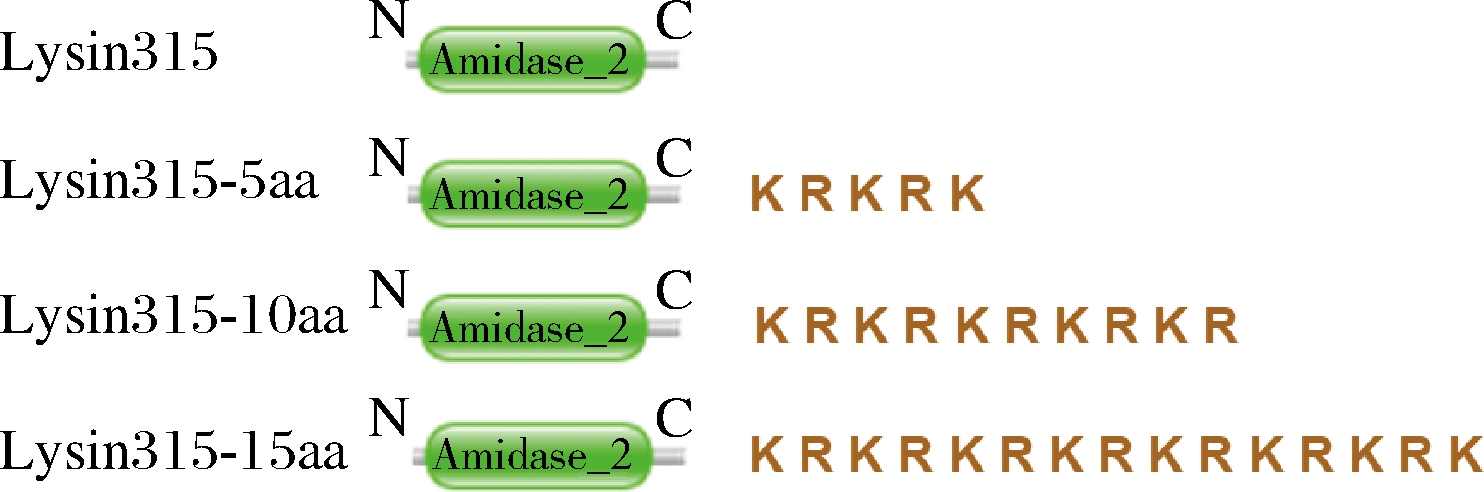
Amidase_2:内溶素结构域;K-赖氨酸;R-精氨酸; N-内溶素N端;C-内溶素C端
图3 修饰内溶素设计示意图
Fig.3 Design of chimeric lysins
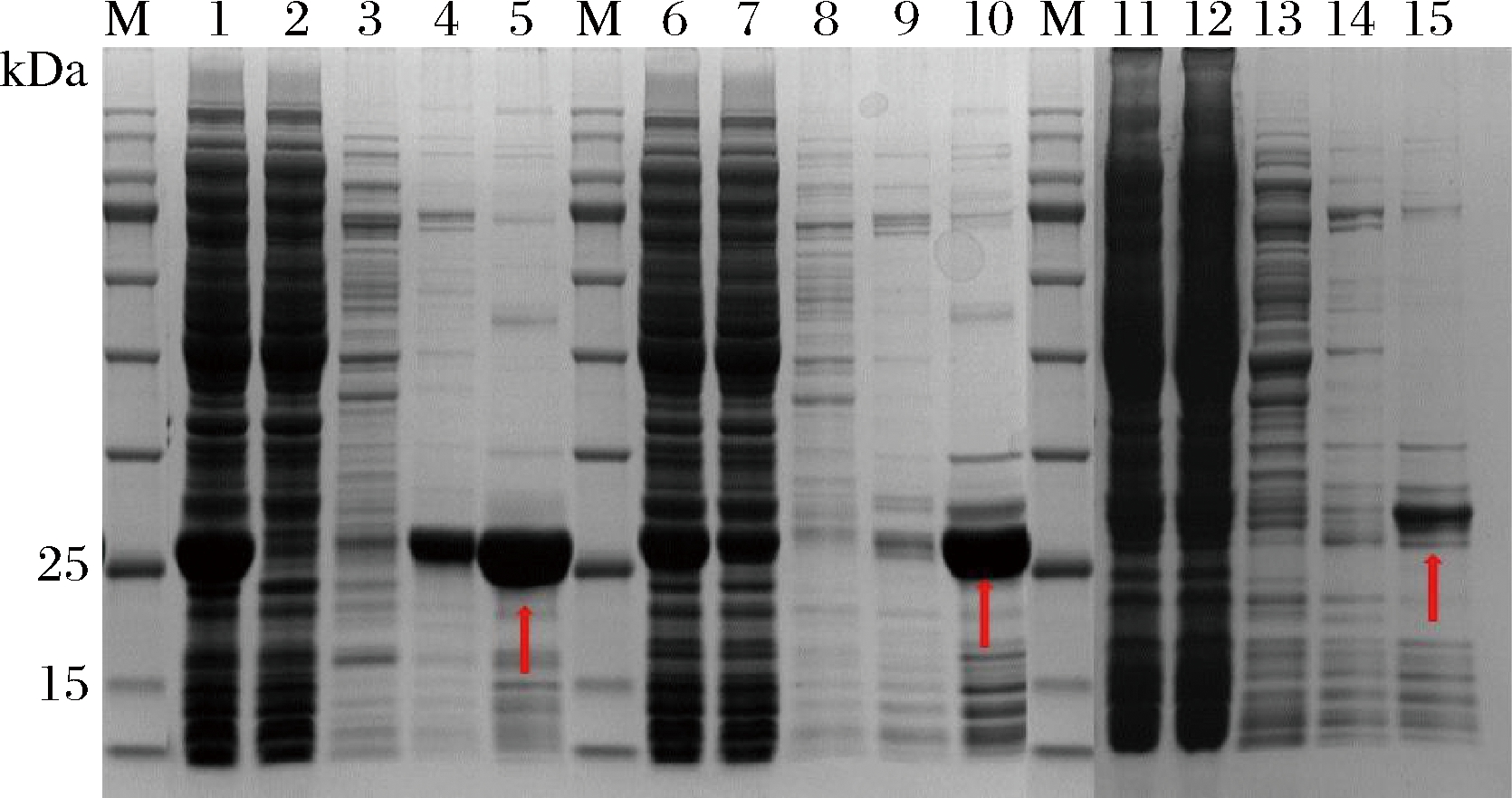
M-Marker;1-Lysin315-5aa破碎后上清液;2-Lysin315-5aa 过柱流出液;3~5-Lysin315-5aa 20、40、300 mmol/L咪唑洗脱液; 6-Lysin315-10aa破碎后上清液;7-Lysin315-10aa过柱流出液; 8~10-Lysin315-10aa 20、40、300 mmol/L咪唑洗脱液; 11-Lysin315-15aa破碎后上清液;12-Lysin315-15aa过柱流出液; 13~15-Lysin315-15aa 20、40、300 mmol/L咪唑洗脱液
图4 修饰内溶素的表达与纯化
Fig.4 Expression and purification of chimeric lysins
2.4 阳离子肽修饰内溶素抗菌活性测定
比较4种相同浓度内溶素的抗菌活性,结果如图5所示。用3种阳离子肽修饰内溶素Lysin315-5aa、Lysin315-10aa、Lysin315-15aa处理的沙门氏菌50115和大肠杆菌K12的可培养细胞数量明显低于对照组和未添加膜通透剂EDTA的Lysin315实验组。此外,由于未添加膜通透剂EDTA,原始内溶素Lysin315可培养细胞数量与对照组相比基本不变。3种阳离子肽修饰内溶素均可以使高浓度宿主菌可培养细胞数显著下降,独立实现体外抗菌。同时据此实验结果可知,4种内溶素的抗菌活性为Lysin315-10aa>Lysin315-15aa>Lysin315-5aa>Lysin315。有研究表明,阳离子氨基酸的添加会影响宿主菌的膜动力学和跨膜电位,从而导致内外膜通透性的变化,使得修饰后的内溶素可以顺利跨过膜结构发挥裂解作用,而且通常情况下,透过率会随着阳离子氨基酸的数量增加而增加[19]。但本实验中10个阳离子氨基酸修饰的重组内溶素Lysin315-10aa的活性最好,可能是过多阳离子氨基酸的添加影响了内溶素蛋白的折叠与空间结构,导致了内溶素酶活的下降。

图5 内溶素的裂解活性比较
Fig.5 Comparison of the lysin lytic activity
2.5 内溶素裂解谱测定
内溶素Lysin315与修饰内溶素Lysin315-10aa的裂解谱测定结果如表3所示,同时与前期研究测定的噬菌体vB_SEqdws-315的裂解谱进行比较。实验结果表明,Lysin315与Lysin315-10aa的裂解谱明显宽于vB_SEqdws-315,多价噬菌体vB_SEqdws-315虽具备跨谱裂解能力,但只能裂解2株沙门氏菌与3株大肠杆菌,而内溶素Lysin315与Lysin315-10aa可以裂解噬菌体vB_SEqdws-315无法裂解的其余2株大肠杆菌和5株沙门氏菌,该现象与副溶血弧菌噬菌体内溶素Lysqdvp001[23]等大多数内溶素裂解谱宽于噬菌体的实验结果一致。同时该结果证明,阳离子氨基酸的添加可以使修饰内溶素Lysin315-10aa突破不同宿主菌的外膜屏障。
表3 噬菌体vB_SEqdws-315、内溶素Lysin315 与修饰内溶素Lysin315-10aa的裂解谱
Table 3 Lytic spectrum of vB_SEqdws-315, Lysin315, and Lysin315-10aa

种属菌株vB_SEqdws-315Lysin315(添加EDTA)Lysin315-10aaSalmonellaATCC 14028-++SalmonellaCMCC 50001-++SalmonellaCMCC 50041-++SalmonellaCMCC 50071-++SalmonellaCMCC 50094-++SalmonellaCMCC 50015+++SalmonellaCMCC 50115+++Escherichia coliK12+++Escherichia coliK80-++Escherichia coliO157·G2583-++Escherichia coliDH5α+++Escherichia coliBL21(DE3)+++
注:“+”表示噬菌体/内溶素对该菌株有活性;“-”表示噬菌体/内溶素对该菌株无活性
2.6 阳离子肽修饰内溶素在牛奶中的抗菌效果
以沙门氏菌50115为指示菌株测定修饰内溶素Lysin315-10aa在牛奶中的抗菌效果,结果见图6,Lysin315-10aa在4 ℃和25 ℃条件下对牛奶中的高浓度沙门氏菌(106 CFU/mL)表现出显著的杀菌效果,2 h后可杀灭40%以上的沙门氏菌。但修饰内溶素Lysin315-10aa在牛奶中的抗菌效果稍弱于缓冲液环境,可能是由于牛奶食物基质结构和化学成分复杂,会对内溶素起到阻隔作用,导致其传播和裂解能力的减弱[24]。
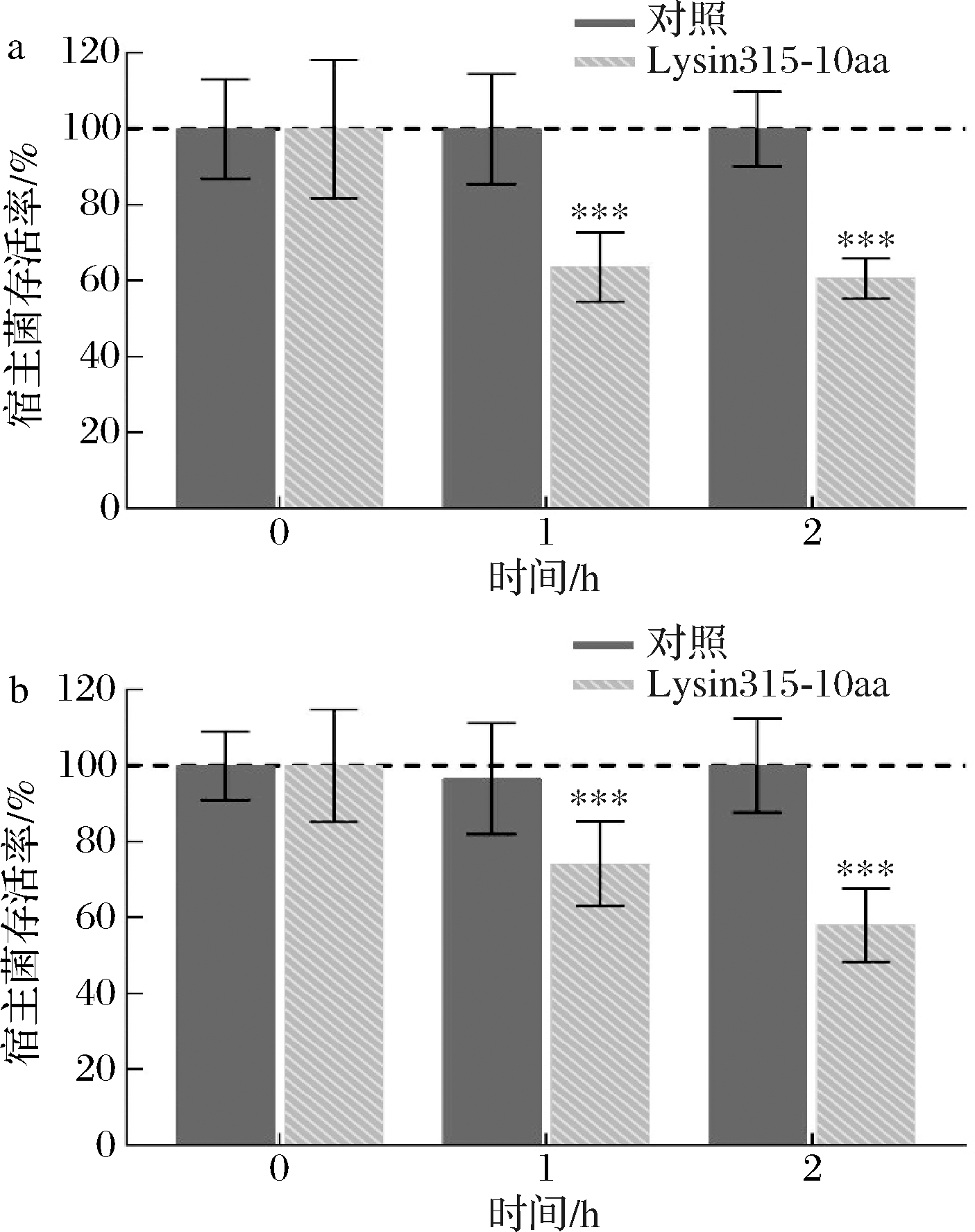
a-4 ℃牛奶中修饰内溶素Lysin315-10aa的抗菌效果; b-25 ℃牛奶中修饰内溶素Lysin315-10aa的抗菌效果
图6 牛奶中修饰内溶素Lysin315-10aa的抗菌效果
Fig.6 Antibacterial effects of lysin 315-10aa in milk
3 结论
综上所述,本实验所获得4种重组内溶素均能实现上清表达,分子质量接近25 kDa,且分子质量大小随着阳离子氨基酸数量的增加而有所增加,摇瓶表达量均高于1.0 mg/mL且表达纯度较高。基于革兰氏阴性菌多价噬菌体内溶素Lysin315基因设计的阳离子肽修饰内溶素Lysin315-5aa、Lysin315-10aa、Lysin315-15aa,能在不添加膜通透剂EDTA的情况下能够从胞外裂解高浓度的沙门氏菌与大肠杆菌,裂解谱宽于原多价噬菌体vB_SEqdws-315。修饰内溶素Lysin315-10aa在4 ℃和25 ℃条件下能有效杀灭牛奶中的高浓度(106 CFU/mL)沙门氏菌,表明基于Lysin315设计的阳离子肽修饰内溶素可能被用作有效的生物控制剂来对抗沙门氏菌和大肠杆菌在食品中的污染。这项研究扩展了革兰氏阴性菌噬菌体内溶素应用范围,初步为利用多价噬菌体内溶素防控食源性致病菌提供了参考基础。
[1] DEWEY-MATTIA D, MANIKONDA K, HALL A J, et al.Surveillance for Foodborne Disease Outbreaks-United States, 2009—2015[J].Morbidity and Mortality Weekly Report Surveillance Summaries, 2018,67(10):1-11.
[2] LI W, PIRES S M, LIU Z, et al.Surveillance of foodborne disease outbreaks in China, 2003—2017[J].Food Control, 2020, 118:107359.
[3] 史东灵, 解天慧, 石慧.噬菌体EC-p9和SM-p2内溶酶及穿孔素的特性及联合抑菌作用[J].食品与发酵工业, 2021, 47(24):7-12.
SHI D L, XIE T H, SHI H.Characteristics and combined bacteriostasis of endolysin and holin in phage EC-p9 and SM-p2[J].Food and Fermentation Industries, 2021, 47(24):7-12.
[4] GARC A P, MART
A P, MART NEZ B, OBESO J M, et al.Bacteriophages and their application in food safety[J].Letters in Applied Microbiology, 2008, 47(6):479-485.
NEZ B, OBESO J M, et al.Bacteriophages and their application in food safety[J].Letters in Applied Microbiology, 2008, 47(6):479-485.
[5] KIM J H, KIM H J, JUNG S J, et al.Characterization of Salmonella spp.-specific bacteriophages and their biocontrol application in chicken breast meat[J].Journal of Food Science, 2020, 85(3):526-534.
[6] GONDIL V S, HARJAI K, CHHIBBER S.Endolysins as emerging alternative therapeutic agents to counter drug-resistant infections[J].International Journal of Antimicrobial Agents, 2020, 55(2):105844.
[7] PASTAGIA M, SCHUCH R, FISCHETTI V A, et al.Lysins:The arrival of pathogen-directed anti-infectives[J].Journal of Medical Microbiology, 2013, 62(10):1 506-1 516.
[8] 解天慧, 石慧.大肠杆菌O157∶H7噬菌体EC-p9的内溶酶和穿孔素的特性预测及克隆表达[J].食品与发酵工业, 2021, 47(9):107-113.
XIE T H, SHI H.Characteristics prediction and expression of endolysin and holin from E.coli O157∶H7 phage EC-p9[J].Food and Fermentation Industries, 2021, 47(9):107-113.
[9] LOESSNER M J.Bacteriophage endolysins-current state of research and applications[J].Current Opinion in Microbiology, 2005, 8(4):480-487.
[10] SCHMELCHER M, LOESSNER M J.Bacteriophage endolysins - extending their application to tissues and the bloodstream[J].Current Opinion in Biotechnology, 2021, 68:51-59.
[11] SCHMELCHER M, DONOVAN D M, LOESSNER M J.Bacteriophage endolysins as novel antimicrobials[J].Future Microbiol, 2012, 7(10):1 147-1 171.
[12] YAN G M, YANG R J, FAN K J, et al.External lysis of Escherichia coli by a bacteriophage endolysin modified with hydrophobic amino acids[J].AMB Express, 2019, 9(1):106.
[13] LOOD R, WINER B Y, PELZEK A J, et al.Novel phage lysin capable of killing the multidrug-resistant gram-negative bacterium Acinetobacter baumannii in a mouse bacteremia model[J].Antimicrobial Agents and Chemotherapy, 2015, 59(4):1 983-1 991.
[14] BRIERS Y, VOLCKAERT G, CORNELISSEN A, et al.Muralytic activity and modular structure of the endolysins of Pseudomonas aeruginosa bacteriophages phiKZ and EL[J].Molecular Microbiology, 2007, 65(5):1 334-1 344.
[15] BRIERS Y, LAVIGNE R.Breaking barriers:Expansion of the use of endolysins as novel antibacterials against Gram-negative bacteria[J].Future Microbiology, 2015, 10(3):377-390.
[16] MA Q, GUO Z M, GAO C C, et al.Enhancement of the direct antimicrobial activity of Lysep3 cagainst Escherichia coli by inserting cationic peptides into its C terminus[J].Antonie Van Leeuwenhoek, 2017, 110(3):347-355.
[17] BRIERS Y, WALMAGH M, VAN PUYENBROECK V, et al.Engineered endolysin-based "Artilysins" to combat multidrug-resistant gram-negative pathogens[J].mBio, 2014, 5(4):e01379-e01314.
[18] 林洪, 李萌, 王静雪.沙门氏菌噬菌体STP4-a重组内溶素抑菌特性分析[J].食品科学, 2015, 36(5):104-108.
LIN H, LI M, WANG J X.Characterization of recombinant endolysin from a Salmonella- infecting bacteriophage STP4-a[J].Food Science, 2015, 36(5):104-108.
[19] NING H Q, CONG Y, LIN H, et al.Development of cationic peptide chimeric lysins based on phage lysin Lysqdvp001 and their antibacterial effects against Vibrio parahaemolyticus:A preliminary study[J].International Journal of Food Microbiology, 2021, 358:109396.
[20] LI Y Q, HAN Q, FENG J L, et al.Antibacterial characteristics and mechanisms of ε-poly-lysine against Escherichia coli and Staphylococcus aureus[J].Food Control, 2014, 43:22-27.
[21] RAHMAN M U, WANG W X, SUN Q Q, et al.Endolysin, a promising solution against antimicrobial resistance[J].Antibiotics (Basel), 2021, 10(11):1 277.
[22] 王伟宇, 林洪, 王静雪.副溶血弧菌噬菌体qdvp001重组内溶素诱导表达以及理化性质初步研究[J].食品工业科技, 2016, 37(16):205-209.
WANG W Y, LIN H, WANG J X.Characterization of recombinant endolysin from Vibrio parahaemolytics-infecting bacteriophage qdvp001[J].Science and Technology of Food Industry.2016, 37(16):205-209.
[23] NING H Q, LIN H, WANG J X.Synergistic effects of endolysin Lysqdvp001 and epsilon-poly-lysine in controlling Vibrio parahaemolyticus and its biofilms[J].International Journal of Food Microbiology, 2021, 343:109112.
[24] GUENTHER S, HERZIG O, FIESELER L, et al.Biocontrol of Salmonella typhimurium in RTE foods with the virulent bacteriophage FO1-E2[J].International Journal of Food Microbiology, 2012, 154(1-2):66-72.