马铃薯淀粉(native starch,NS)是主要的淀粉资源,原淀粉易老化、稳定性差、溶解性差等缺点限制了其商业应用,可通过氧化、酯化、醚化等化学方法改性[1],拓展其性质,以满足特定的应用需求。羧甲基淀粉(carboxymethyl starch,CMS)可溶于冷水,有良好的冻融稳定性和透明度,随着取代度(degree of substitution,DS)增加,其溶解性和冻融稳定性均显著提高,在工业上引起了极大的关注,被广泛应用于食品、制药、纺织和造纸等行业[2]。槲皮素是一种黄酮类化合物,其具有抗炎、抗病毒和抗氧化等多种生理和药理活性,在食品及医药领域应用广泛[3]。槲皮素的低水溶性限制了其在人体内的吸收,导致生物利用度降低[4]。有研究表明,淀粉可以作为槲皮素的有效传递载体,使槲皮素分布均匀并能提高其水溶性和生物利用度[5],其中淀粉的溶解性和装载量是关键性指标,成为功能性载体改性淀粉的研究热点。
原淀粉天然较差的孔隙结构(总孔隙面积和孔隙率较低)限制了其在吸附方面的应用。多孔淀粉(porous starch,PS)作为一种拥有大量孔洞的新型改性淀粉,增加了淀粉颗粒的比表面积,提高了其吸附性能[6]。JU等[7]采用玉米多孔淀粉对香精油进行微胶囊化(porous starch microcapsules-essential oils,PSM-EOs),使其具有优异的缓释抗菌效果。WANG等[8]制备多孔玉米淀粉对葡萄籽原花青素(grape seed proanthocyanidins,GSPs)进行吸附,结果表明这种淀粉可以作为一种理想的吸附剂来提高GSPs的利用率并保持其抗氧化活性。HU等[9]制备交联多孔淀粉(cross-linked porous starch,CPS)吸附制革废水中的六价铬,实验显示CPS对重金属离子铬和铅表现出优越的吸附性能。因此,与原淀粉相比,PS作为反应主体,不仅使反应客体与淀粉的接触面积增加,还能使比表面积进一步扩大,获得更高的DS和更大的负载量。
羧甲基化制备变性淀粉的报道较多,但淀粉多孔结构对羧甲基反应、样品性质的影响,以及应用效果的研究鲜见报道。本研究以马铃薯多孔淀粉为材料,通过羧甲基化改性,以获得更高取代度、溶解性和装载能力的材料,为载体淀粉材料的应用提供新选择。
1 材料与方法
1.1 材料与试剂
马铃薯原淀粉(BR)上海源叶试剂公司;氯乙酸钠(AR)上海麦克林生化科技有限公司;槲皮素(97%,质量分数)上海麦克林生化科技有限公司;D2O(纯度≥99.9%)剑桥同位素实验室;其他试剂均为分析纯。
1.2 仪器与设备
HCJ-4D恒温磁力搅拌水浴锅,常州市瑞华仪器制造有限公司;JSM-6701F冷场发射型扫描电子显微镜,日本电子光学公司;NEXUS-670傅立叶红外光谱仪,美国Thermo公司;AVance NEO 600MHz宽腔固体超导核磁共振波谱仪,布鲁克公司。
1.3 实验方法
1.3.1 马铃薯多孔淀粉的制备
参照BUDARIN等[10]的方法稍做修改:将15 g马铃薯原淀粉加入100 mL蒸馏水中,先于40 ℃水浴锅中搅拌(100 r/min)20 min,再升温至90 ℃继续搅拌1 h,然后4 ℃贮存72 h以获得淀粉凝胶。将切成方块(约1 cm×1 cm×1 cm)的凝胶浸入无水乙醇,重复5次,每次约1 h。将沉淀物于50 ℃干燥4 h,研磨过100目筛后备用。
1.3.2 羧甲基淀粉和羧甲基多孔淀粉(carboxymethyl porous starch,CMPS)的制备
参照ZHANG等[11]的方法并做适当修改:将2.0 g NS或PS分别分散在20 mL 90%异丙醇中,搅拌20 min以形成悬浮液。温度保持在30 ℃,加入0.98 g NaOH搅拌1 h,升温至40 ℃后加入一定量的氯乙酸钠(sodium chloroacetate,SMCA),反应3 h后离心得淀粉浆,然后悬浮在80%乙醇中,再用10%乙酸溶液将pH调至7.0,离心混合物用80%乙醇洗涤至滤液硝酸银氯化物测试为阴性。置于恒温干燥箱50 ℃干燥6 h,过100目筛制得CMS或CMPS备用。
1.3.3 取代度的测定
参照陈庆[12]的方法适当修改:称取一定量样品于核磁管中,加入D2O,超声30 s充分溶解并去除溶解氧对实验的影响,使用核磁共振波谱仪TXISz探针在25 ℃下扫描测定。
核磁共振氢谱(1H nuclear magnetic resonance,1H NMR)图谱(图3)中,5.69处峰为脱水葡萄糖单元(anhydro glucose unit, AGU)中H-1质子信号,3.85处为CMS接枝链—CH2COOH上的亚甲基质子信号峰(H-7)。由3.85处质子峰面积与5.69处质子峰面积关系计算样品DS,如公式(1)所示:
(1)
式中:Asignal为样品在3.85处的峰面积,Nsignal为样品在3.85处的质子数;AAGU为样品在5.69处的峰面积,NAGU为样品在5.69处的质子数。
1.3.4 扫描电镜(scanning electron microscope,SEM)分析
用导电胶将少量样品粉末粘在样品座上,将样品座置于离子溅射仪中镀金60 s后,用扫描电镜在不同放大倍数下观察样品粉末的形态特征。
1.3.5 傅里叶红外光谱(Fourier transform infrared spectroscopy,FT-IR)分析
样品的红外光谱测定采用溴化钾压片法。将适量溴化钾与1 mg干燥样品粉末混合均匀,碾磨至无颗粒感后压片处理,扫描波长为4 000~500 cm-1。
1.3.6 液态核磁分析(1H NMR)
用德国Bruker公司的型号为Ascend 600MHz/AVance NEO的核磁共振光谱仪进行表征,以D2O为溶剂。
制样方法:称取5~10 mg的待测样品置于核磁管中,然后加入D2O,溶解后测试。
1.3.7 X射线衍射分析(phase analysis of xray diffraction,XRD)
采用X射线衍射仪在5°~30°的扫描范围内测定样品的结晶结构。
1.3.8 N2-吸/脱附分析
利用Micromeritics ASAP 2020 M系统测得样品的N2-吸脱附等温线。利用非定域密度泛函理论得到孔径的尺寸分布曲线。依据Brunauer-Emmett-Teller(BET)多层吸附理论计算比表面积。
1.3.9 热重分析(thermogravimetric analysis,TGA)和微商热重分析(derivative thermogravimetry,DTG)
采用热重分析仪研究样品的热特性。氮气,升温速率10 ℃/min,温度为50~600 ℃。
1.3.10 吸附性能分析
1.3.10.1 复合物羧甲基淀粉吸附槲皮素(carboxymethyl starch@quercetin,CMS@Q)和羧甲基多孔淀粉吸附槲皮素(carboxymethyl porous starch@quercetin,CMPS@Q)的制备
以CMS吸附槲皮素评价其吸附性能,参照AHMAD等[13]的方法并做适当修改制备复合物(CMS@Q):槲皮素以10 mg/mL的质量浓度溶解在无水乙醇中,以V(溶解液)∶V(羧甲基淀粉)=1∶10滴加到羧甲基淀粉中,超声处理5 min使其体系分布均匀,在40 ℃下磁力搅拌1 h,样品真空冻干后在-20 ℃保存备用。
CMPS@Q的制备参照CMS@Q的制备。
1.3.10.2 标准曲线的绘制
参考刘维信等[14]的方法并做适当修改,准确称取槲皮素25.0 mg于250 mL容量瓶中,用无水乙醇溶解并稀释至刻度,得到100 mg/L的储备液。用储备液分别配制1~5 mg/L槲皮素标准溶液, 以无水乙醇为参比液分别测定其在360 nm处的吸光度,绘制质量浓度(C,mg/L)- 吸光度(A)标准曲线。
1.3.10.3 负载率的测定
根据AHMAD等[13]的方法适当修改:分别称取0.22 g CMS@Q和CMPS@Q加入10 mL蒸馏水中制成悬浮液,离心(3 000 r/min,5 min) 弃上清液,沉淀物重新悬浮在10 mL水中并超声30 min以从复合物中提取负载的槲皮素。悬浮液离心(5 000 r/min,10 min)后收集上清液。用紫外分光光度计测定上清液在360 nm处的吸光度,根据标准曲线确定槲皮素含量。
1.3.10.4 水溶性分析
将样品配成20 g/L的溶液,在沸水浴中持续搅拌30 min后迅速冷却至室温。离心(3 000 r/min,20 min)后取上清液于105 ℃干燥4 h,得到水溶物质的质量。溶解度计算如公式(2)所示:
溶解度![]()
(2)
1.3.11 统计分析
每组实验重复3次,数据用Origin 8及SPSS 25进行统计分析,结果用平均值±标准差表示。
2 结果与分析
2.1 羧甲基淀粉和羧甲基多孔淀粉取代度
在淀粉羧甲基化过程中NaOH为反应体系提供碱性环境,并活化淀粉使其变成具有反应活性的钠盐,促使醚化剂扩散渗透到淀粉颗粒结构中,加快反应速度[15]。PS结构中孔径和孔深度的增加提供了更大的比表面积[16],与醚化剂(SMCA)有更多的反应位点,能赋予醚化产物更大的取代度。本实验在淀粉质量浓度为100 g/L,醚化温度为40 ℃,醚化时间为3 h条件下分析不同SMCA水平处理的改性淀粉DS(表1)。当SMCA添加量为0.006 mol时,CMS的DS为0.19,相同制备条件下CMPS的DS为0.25。随着SMCA的增加,CMPS的DS也随之增加,SMCA添加量增加3倍时DS增加5.8倍,表明多孔处理能增加反应位点,促使反应更易发生,在SMCA改性葛根淀粉中也观察到相似的结果[17]。
2.2 SEM分析
NS、PS、CMPS及CMS的SEM显示在图1中。NS表面平滑规整,颗粒呈圆形或卵圆形,且没有可见的孔。多孔淀粉破坏了原淀粉的原有结构,表面出现丰富且均匀的孔,可提供更大的比表面积,释放更多的羟基基团与SMCA发生反应[18]。在醚化反应后,CMS表面粗糙颗粒破碎,出现向内塌陷的洞,CMPS颗粒表面凹凸不平,这表明在羧甲基化过程中,由于强碱作用,导致淀粉颗粒溶胀变形[15],多孔结构坍塌。SEM结果表明,醚化反应破坏了多孔淀粉颗粒的形态结构。
表1 羧甲基淀粉和羧甲基多孔淀粉的DS
Table 1 Degree of substitution of CMS and CMPS
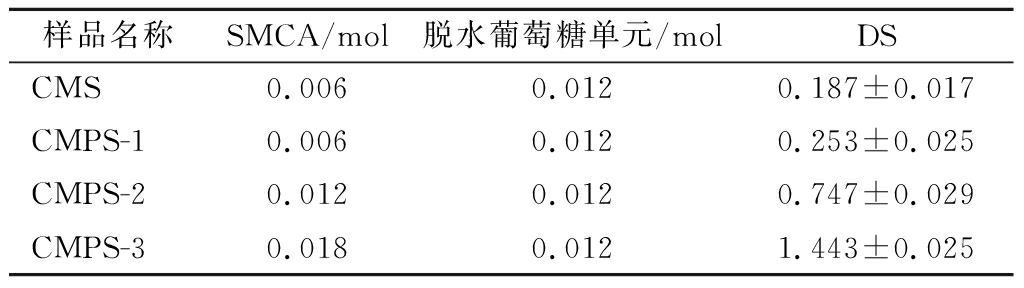
样品名称SMCA/mol脱水葡萄糖单元/molDSCMS0.0060.0120.187±0.017CMPS-10.0060.0120.253±0.025CMPS-20.0120.0120.747±0.029CMPS-30.0180.0121.443±0.025

a-马铃薯原淀粉;b-多孔淀粉;c-羧甲基淀粉;d-羧甲基多孔淀粉
图1 马铃薯原淀粉、多孔淀粉、羧甲基淀粉及羧甲基多孔淀粉的SEM(×5 000)图
Fig.1 SEM(×5 000) images of NS、PS、CMS and CMPS
2.3 FT-IR分析
马铃薯原淀粉、多孔淀粉、羧甲基淀粉和羧甲基多孔淀粉的FT-IR光谱如图2所示。由图2可以看出NS与PS出峰位置一致,是因为多孔化改性会影响氢键的位置和数量,但不会引入新的官能团[19]。与PS相比,CMPS观察到在3 428 cm-1处出现淀粉羟基的伸缩振动峰,在1 605、1 422、1 324 cm-1处出现羧酸盐的拉伸振动峰,说明淀粉分子上引入了羧甲基基团。这与LIU等[20]先前的研究一致,且3个峰的强度也随DS的增加而增加。由图2可以看出CMS与CMPS出峰位置一致,说明NS与SMCA间也成功形成了醚键。
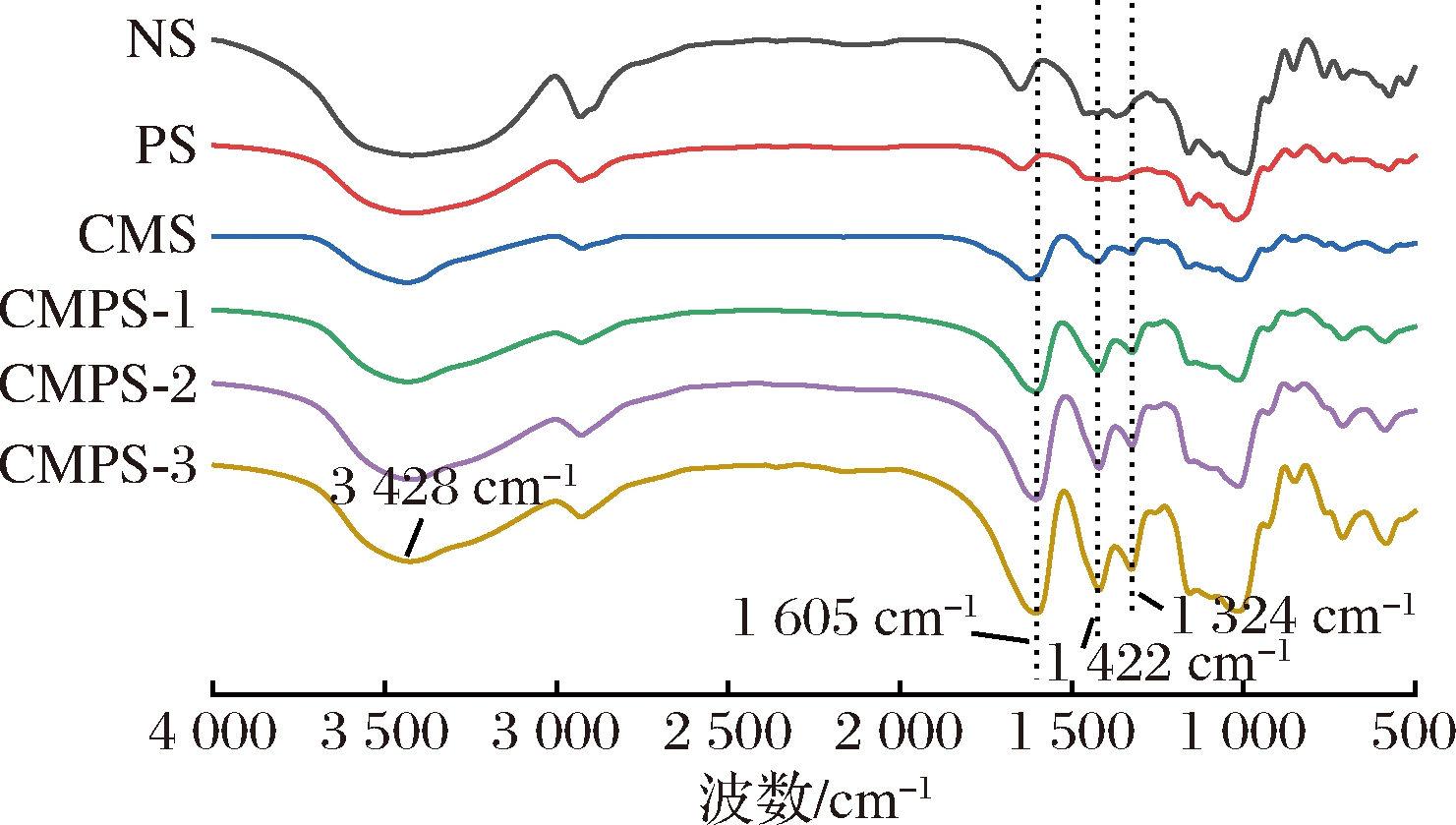
图2 马铃薯原淀粉、多孔淀粉、羧甲基淀粉和 羧甲基多孔淀粉的红外光谱图
Fig.2 FT-IR spectra of NS、PS、CMS and CMPS
2.4 液态核磁分析
对多孔淀粉、氯乙酸钠、羧甲基淀粉和羧甲基多孔淀粉进行1H NMR分析,4.7处出现的峰是溶剂峰(D2O)。如图3中的a所示,根据文献给出了多孔淀粉分子中氢原子的对应信号[21]。图3中的b中3.9处出现的峰是SMCA中亚甲基的质子峰(H-8)。由图3中可以看出CMS(图3中的c)与CMPS的出峰位置一致,图3中的d、e、f中3.85处出现的峰是CMPS中的质子峰(H-7),且峰强度随DS的增加而增加。结果表明,通过醚化反应成功形成了SMCA与PS之间的骨架连接。
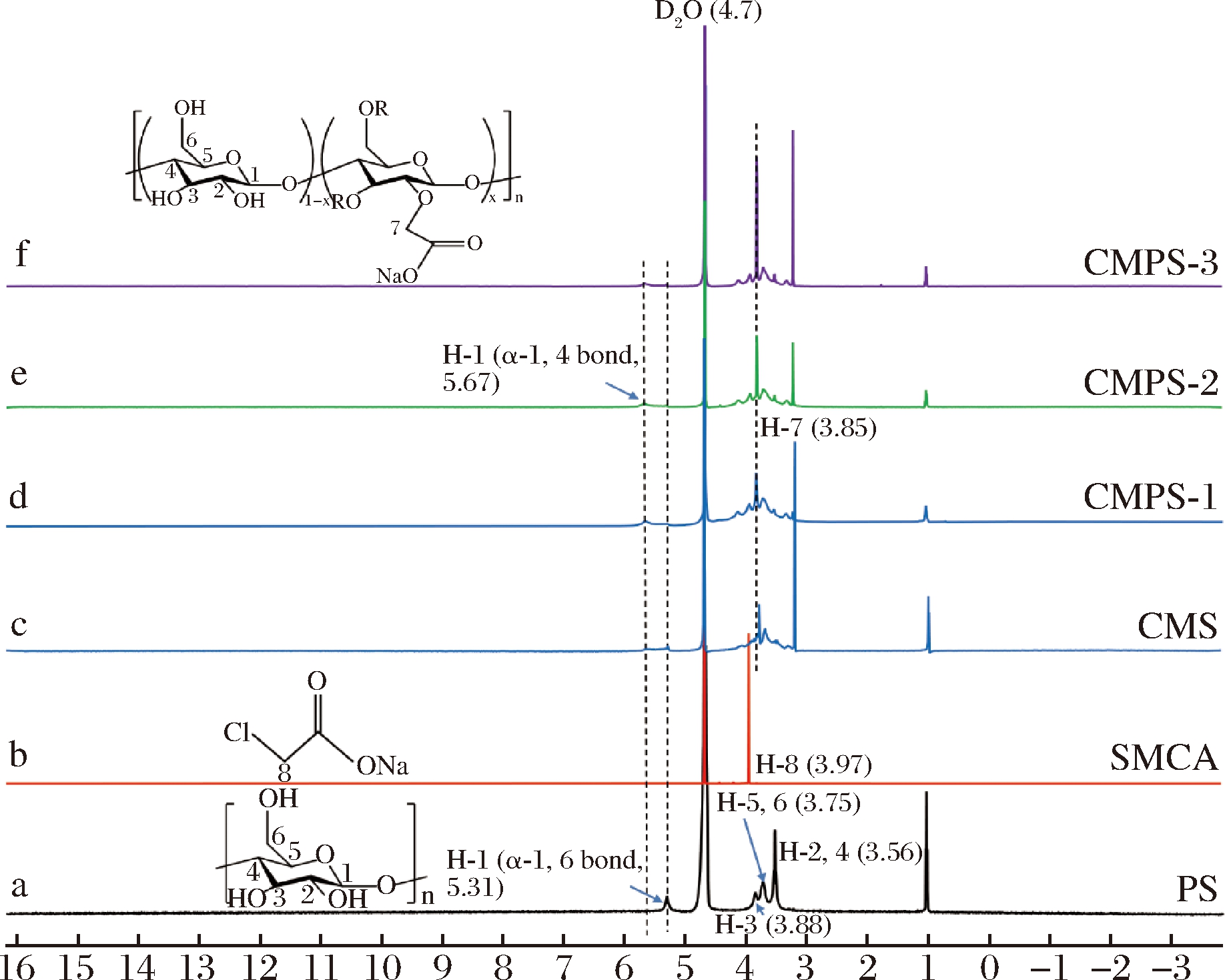
图3 多孔淀粉、氯乙酸钠、羧甲基淀粉和羧甲基 多孔淀粉的1H NMR谱图
Fig.3 1H NMR spectra of PS、SMCA、CMS and CMPS
2.5 XRD分析
NS、PS、CMS和CMPS的X射线衍射图如图4所示。NS显示出典型的B型衍射峰,分别在5.7°、15.2°、16.8°、22.8°处有其特征衍射峰。PS在制备过程中经过高温(90 ℃)糊化,使淀粉粒分子间的氢键断开,导致晶体结构消失,呈无定形物质的分散性宽峰[19]。羧甲基化过程使淀粉羟基内的分子间氢键断裂,导致结构的变化,CMS没有结晶形态,表明其具有无定形特征[22]。PS和CMPS之间的峰形几乎没有差异,CMS的峰形为弥散峰,未发生重结晶现象,这表明羧甲基化反应主要发生在淀粉的无定形区域,该结果与HE等[23]的研究一致。
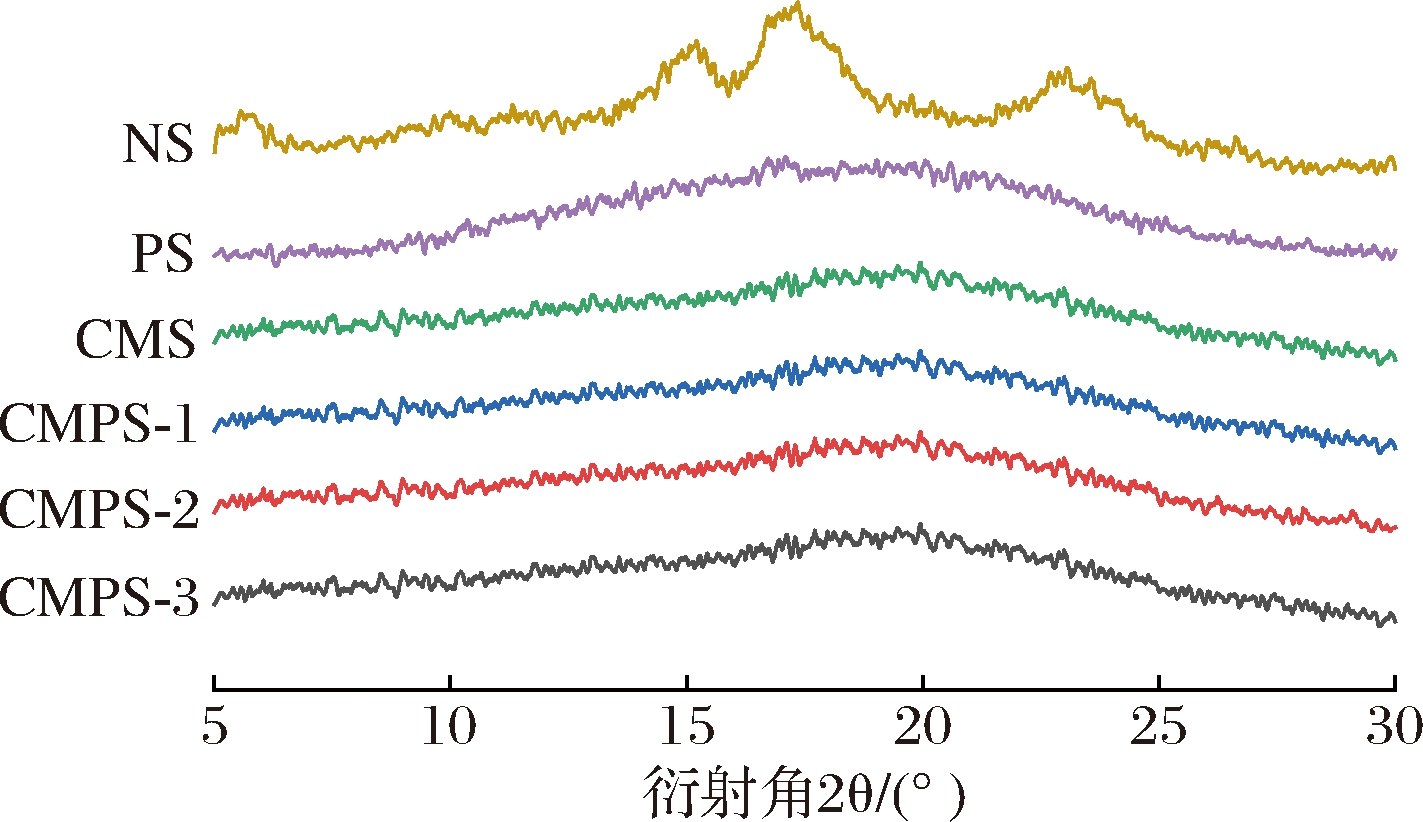
图4 马铃薯原淀粉、多孔淀粉、羧甲基淀粉和 羧甲基多孔淀粉的X射线衍射图谱
Fig.4 XRD profile of NS、PS、CMS and CMPS
2.6 N2-吸/脱附分析
国际纯粹与应用化学联合会根据孔径大小将孔隙分为三大类:微孔(<2 nm)、介孔(2~50 nm)、大孔(>50 nm)[24]。NS、PS、CMS和CMPS的BET表面积及孔径分布图如图5所示。利用BET模型计算出NS的比表面积仅为0.02 m2/g,而PS的比表面积高达42.88 m2/g,PS的平均孔径为16.94 nm,属于介孔材料。醚化反应制备的CMS的比表面积为0.87 m2/g,平均孔径为7.36 nm,CMPS的比表面积为12.06 m2/g,相较于PS降低了71.88%,但相较于CMS提高了88.81%,平均孔径为8.82 nm,较PS缩小了47.93%,较CMS提高了16.55%。CMPS比表面积较PS大幅降低,可能是由于在羧甲基化反应过程中,淀粉溶胀变形,部分孔洞坍塌造成[15],但较CMS有较高比表面积。CMPS平均孔径较PS更小,有文献表明适当减小孔径可以增强毛细作用力有助于更高的负载[25]。
2.7 热重分析
淀粉热特性TGA和DTG曲线如图6所示。如图6-a所示,所有样品的TGA曲线中观察到3个阶段的重量损失。第一阶段发生在120 ℃以下,由水蒸发引起的重量损失约7%;第二阶段发生在300 ℃以下,由于羟基缩合形成的水发生分解引起主要的重量损失;当温度达到500 ℃时,会导致碳化和灰分形成并释放CO2。在羧甲基化过程中会生成其他无机成分,所以羧甲基化样品的剩余质量高于PS[26]。此外,由图6-b可知,PS,CMS的最大热分解温度分别为338、295 ℃,3个样品的CMPS最大热分解温度分别为300、304、306 ℃,随DS增加,最大热分解温度升高。实验表明,CMPS的热稳定性随着DS的增加而增加,但羧甲基化降低了热降解的初始温度以及淀粉的热稳定性。
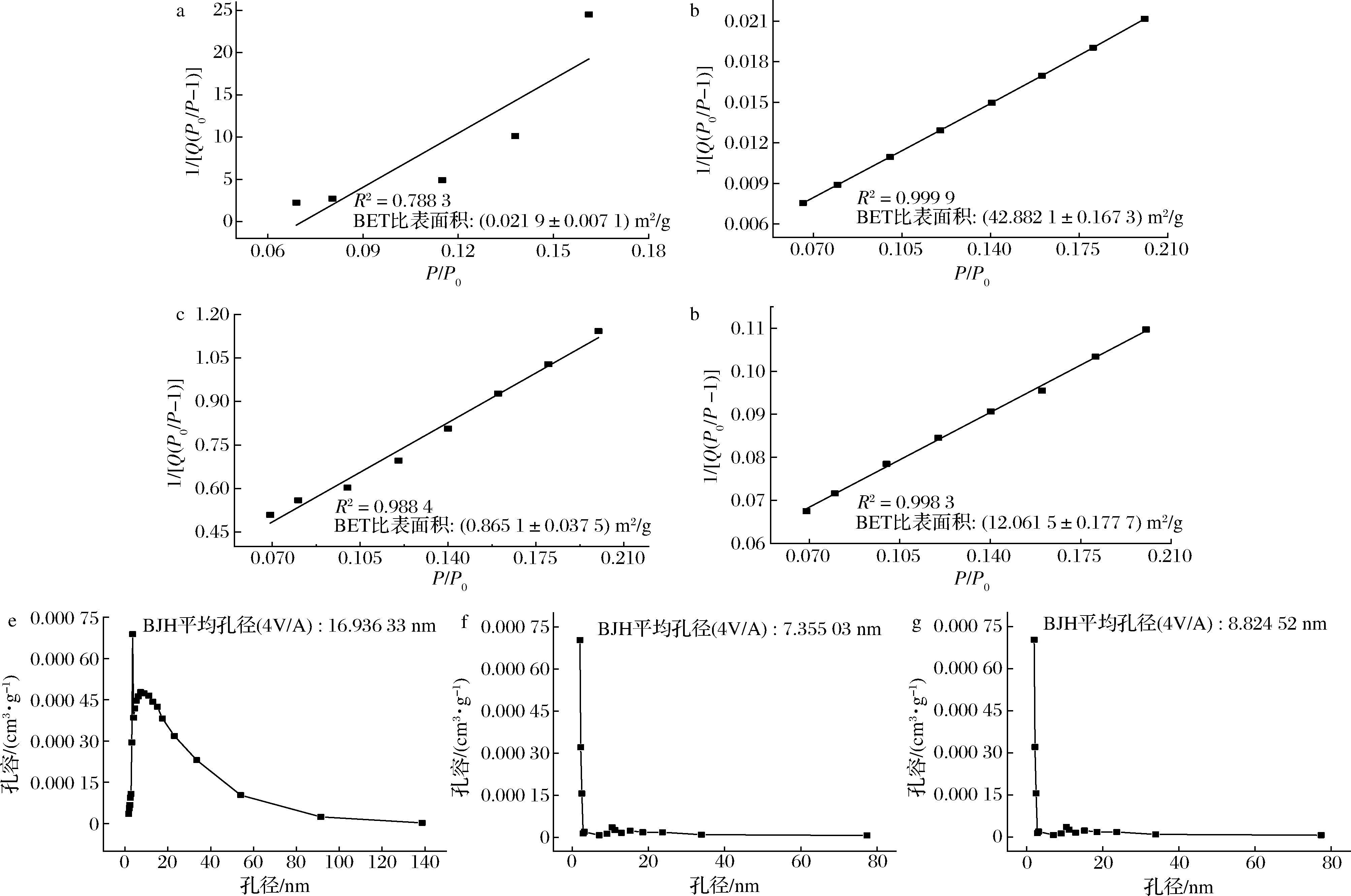
a-马铃薯原淀粉BET表面积图;b-多孔淀粉BET表面积图;c-羧甲基淀粉BET表面积图;d-羧甲基多孔淀粉BET表面积图; e-多孔淀粉孔径分布图;f-羧甲基淀粉孔径分布图;g-羧甲基多孔淀粉孔径分布图
图5 马铃薯原淀粉、多孔淀粉、羧甲基淀粉及羧甲基多孔淀粉的BET表面积及孔径分布图
Fig.5 BET surface area plots and pore diameter distribution of NS、PS、CMS and CMPS
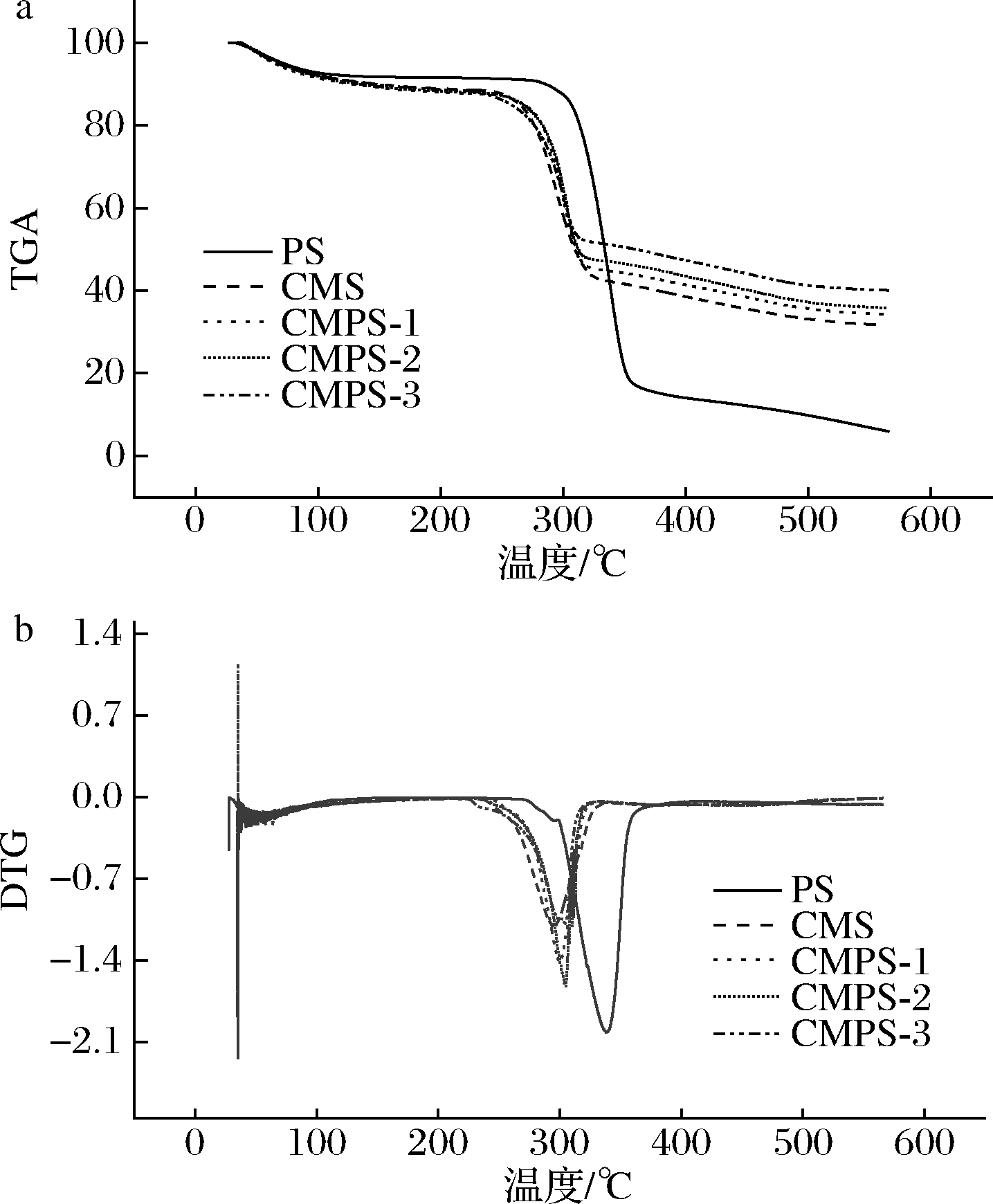
a-TGA曲线;b-DTG曲线
图6 多孔淀粉、羧甲基淀粉和羧甲基多孔淀粉的TGA和DTG曲线
Fig.6 TGA and DTG curves of PS、CMS and CMPS
2.8 吸附性结果分析
2.8.1 槲皮素标准曲线
将配制的1~5 mg/L的槲皮素溶液在360 nm处分别测定其吸光度,结果如图7所示。槲皮素溶液的线性方程为y = 0.046 3x+0.316 1,R2= 0.996 5>0.99,由标准曲线可知,槲皮素在1~5 mg/L具有良好的线性关系。
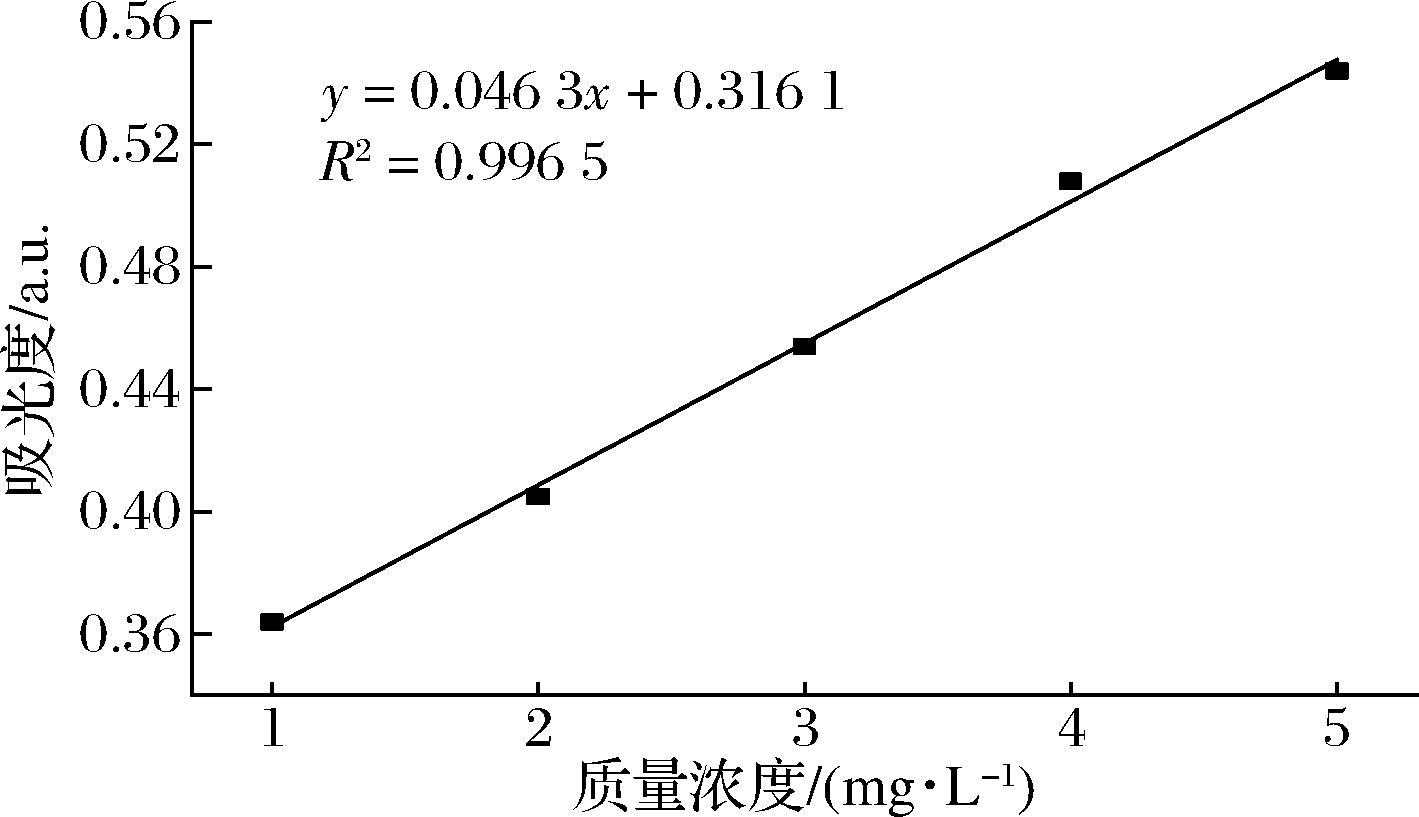
图7 槲皮素标准曲线
Fig.7 Standard curve of quercetin
2.8.2 负载率的测定
不同样品的负载率如图8所示,负载率表达了壁材将生物活性小分子保持在其中空结构内的保留能力。根据槲皮素标准曲线方程算出CMS@Q的负载率为(0.57±0.02)%,CMPS@Q的负载率为(13.71±0.18)%,较CMS@Q提高了95.84%。
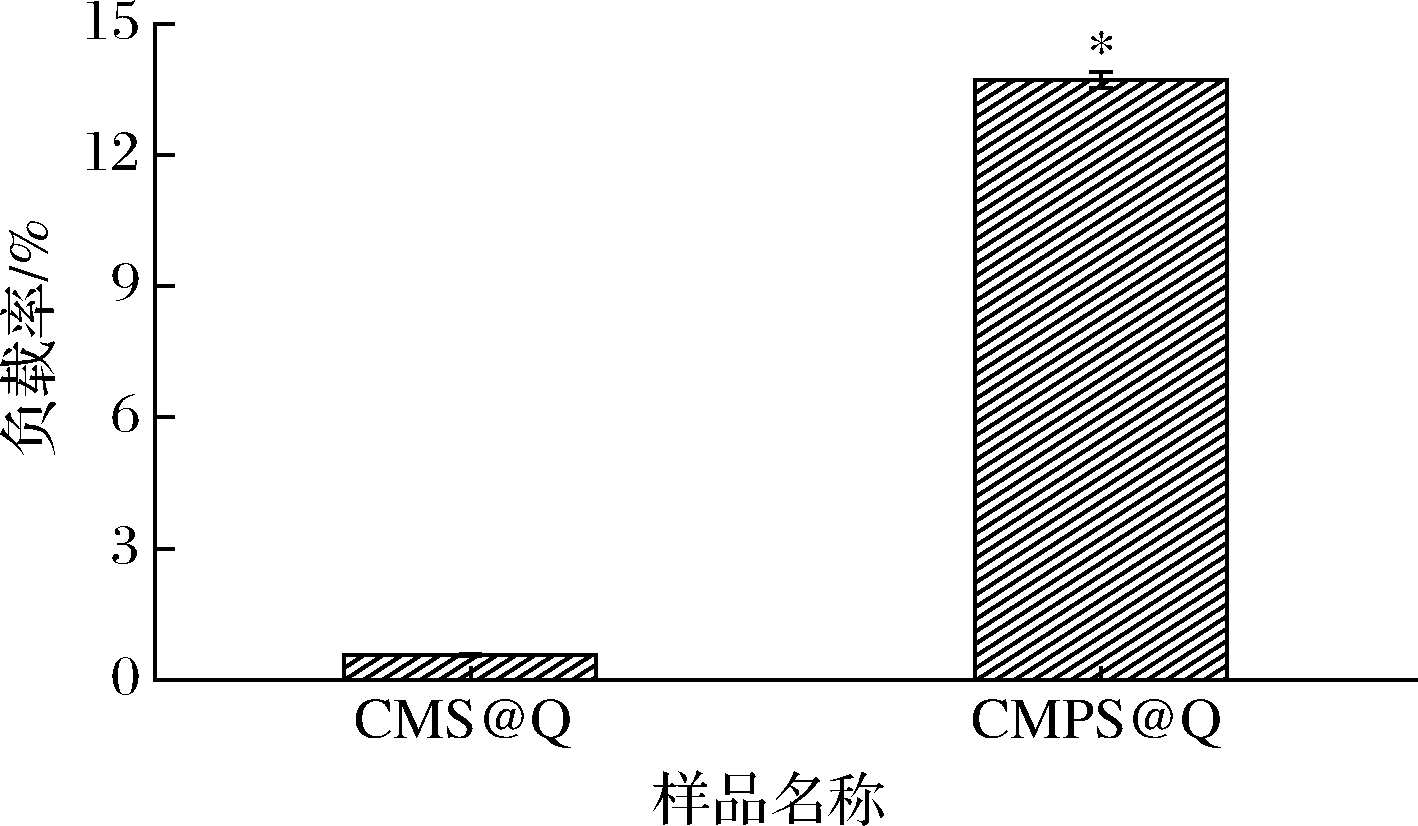
图8 羧甲基淀粉吸附槲皮素和羧甲基多孔淀粉 吸附槲皮素的负载率
Fig.8 Load factor of CMS@Q and CMPS@Q
注:*表示差异显著(P<0.05)
2.8.3 水溶性分析
不同样品的水溶性如图9所示,NS经过高温糊化,水溶性略微提升至2.67%,PS由于比表面积提高,亲水性基团暴露较多,水溶性得到改善,达到12.67%。CMS的水溶性为46.33%,CMPS的水溶性为67.67%,较CMS提高了46.06%。CMS@Q和CMPS@Q的水溶性分别为23.33%和34.00%,较纯槲皮素水溶性均得到了较大的提升,但CMPS@Q的水溶性较CMS@Q提高了45.74%。有研究表明通过提高溶解度可有效提升大多数低溶解度功能性成分的体内生物利用度[27]。本研究结果显示,CMPS作为可消化降解的载体,有望在食品和医药相关领域应用。
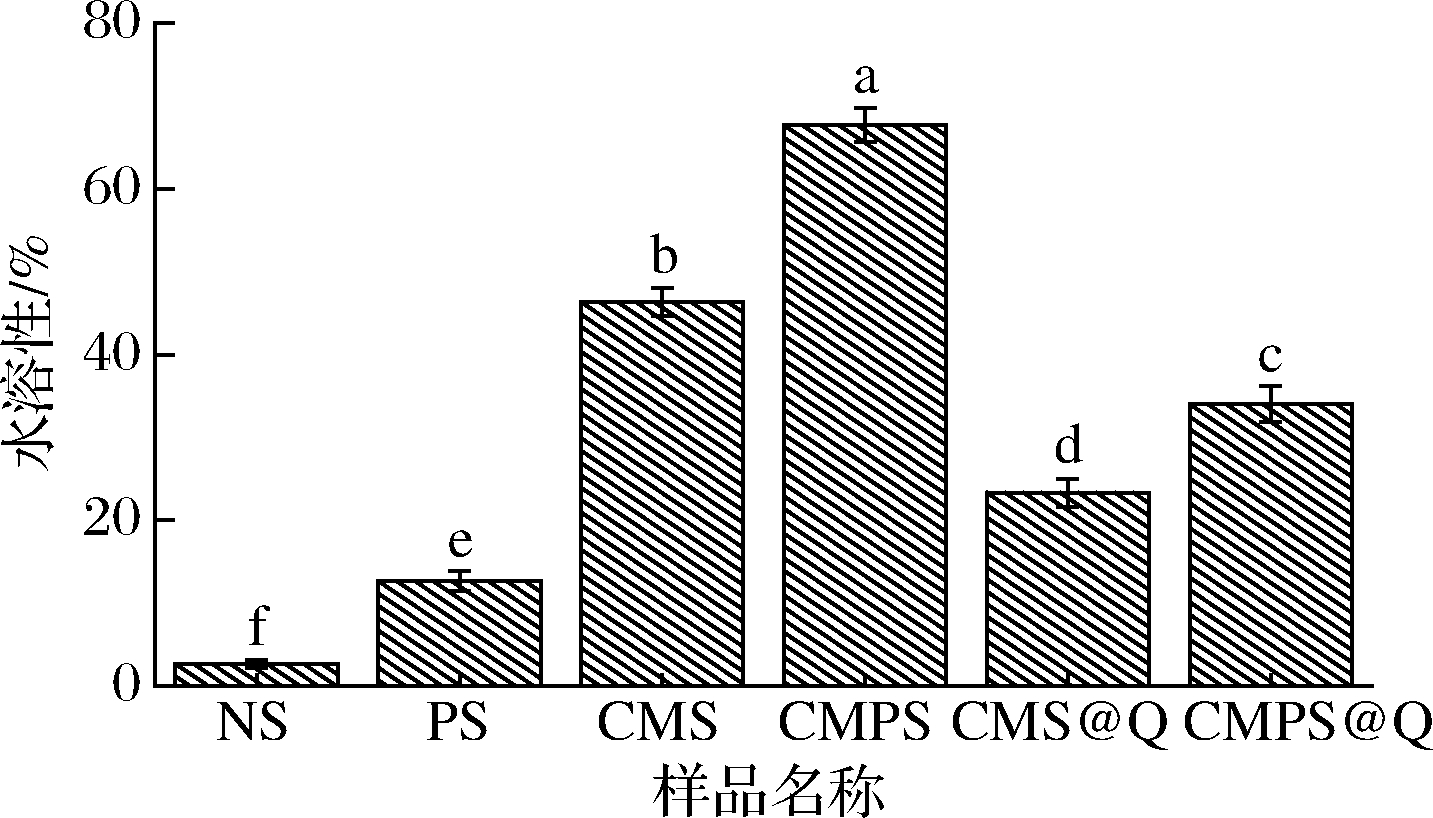
图9 马铃薯原淀粉、多孔淀粉、羧甲基淀粉、羧甲基 多孔淀粉、羧甲基淀粉吸附槲皮素和羧甲基多孔淀粉 吸附槲皮素的水溶性
Fig.9 Water solubility of NS、PS、CMS、CMPS、 CMS@Q and CMPS@Q
注:不同字母表示差异显著(P<0.05)
3 结论
实验制备的PS属于介孔材料,与原淀粉相比,其比表面积增加,暴露了更多反应位点,有效提高了与客体分子的接触,提升了反应效率,且随着反应客体浓度的增加,DS也随之增加,表明多孔处理有利于淀粉改性反应的发生。PS颗粒结构强度较弱,羧甲基化反应中受热溶胀,部分孔洞坍塌,比表面积和孔径均有所减小,但较原淀粉制备的CMS,比表面积仍然较大。反应中主客体分子间形成了醚键但并未形成新的结晶结构,CMPS与PS一样呈非晶无序状态,冷水可溶性显著提升,热稳定性有所降低。实验制备的CMPS具有较小的孔径、较好的比表面积和冷水溶解性,可作为生物活性物质的吸附剂和功能性载体,有望在食品、医药等相关领域作为可降解性生物载体材料应用。
[1] KAUR B, ARIFFIN F, BHAT R, et al.Progress in starch modification in the last decade[J].Food Hydrocolloids, 2012, 26(2):398-404.
[2] WILPISZEWSKA K, ANTOSIK A K, SPYCHAJ T.Novel hydrophilic carboxymethyl starch/montmorillonite nanocomposite films[J].Carbohydrate Polymers, 2015, 128:82-89.
[3] LIU J, WANG X C, YONG H M, et al.Preparation, characterization, digestibility and antioxidant activity of quercetin grafted Cynanchum auriculatum starch[J].International Journal of Biological Macromolecules, 2018, 114:130-136.
[4] 卢双彦, 张雅楠, 翟光喜.槲皮素纳米制剂研究进展[J].药物生物技术, 2019, 26(6):552-557.
LU S Y, ZHANG Y N, ZHAI G X.Development of the quercetin loaded nanoformulations[J].Pharmaceutical Biotechnology, 2019, 26(6):552-557.
[5] LIN J, TEO L M, LEONG L P, et al.In vitro bioaccessibility and bioavailability of quercetin from the quercetin-fortified bread products with reduced glycemic potential[J].Food Chemistry, 2019, 286:629-635.
[6] CHEN J H, WANG Y X, LIU J, et al.Preparation, characterization, physicochemical property and potential application of porous starch:A review[J].International Journal of Biological Macromolecules, 2020, 148:1 169-1 181.
[7] JU J, CHEN X Q, XIE Y F, et al.Simple microencapsulation of plant essential oil in porous starch granules:Adsorption kinetics and antibacterial activity evaluation[J].Journal of Food Processing and Preservation, 2019, 43(10):e14156.
[8] WANG H L, LYU J, JIANG S W, et al.Preparation and characterization of porous corn starch and its adsorption toward grape seed proanthocyanidins[J].Starch-Stärke, 2016, 68(11-12):1 254-1 263.
[9] HU J, TIAN T, XIAO Z B.Preparation of cross-linked porous starch and its adsorption for chromium (VI) in tannery wastewater[J].Polymers for Advanced Technologies, 2015, 26(10):1 259-1 266.
[10] BUDARIN V, CLARK J H, HARDY J J E, et al.Starbons:New starch-derived mesoporous carbonaceous materials with tunable properties[J].Angewandte Chemie International Edition, 2006, 45(23):3 782-3 786.
[11] ZHANG B, LI X M, XIE Q T, et al.Preparation and characterization of non-crystalline granular starch and corresponding carboxymethyl starch[J].International Journal of Biological Macromolecules, 2017, 103:656-662.
[12] 陈庆. 直链淀粉的羧化和多孔改性及其对氨和苯酚的吸附性能研究[D].杭州:浙江大学, 2017.
CHEN Q.Study on carboxylation, pore-forming of amylose and its ammonia and phenol adsorption properties[D].Hangzhou:Zhejiang University, 2017.
[13] AHMAD M, MUDGIL P, GANI A, et al.Nano-encapsulation of catechin in starch nanoparticles:Characterization, release behavior and bioactivity retention during simulated in-vitro digestion[J].Food Chemistry, 2019, 270:95-104.
[14] 刘维信, 冯希环, 蔡宋宋, 等.大葱槲皮素含量的测定[J].中国农学通报, 2008,24(3):266-269.
LIU W X, FENG X H, CAI S S, et al.Evaluation of quercetin content in Welsh onion[J].Chinese Agricultural Science Bulletin, 2008,24(3):266-269.
[15] 毕英慧. 羧甲基马铃薯淀粉的制备、反应动力学及性能研究[D].兰州:兰州大学, 2009.
BI Y H.Study on the preparation, reaction kinetics and properties of carboxymethyl potato starch[D].Lanzhou:Lanzhou University, 2009.
[16] 李海燕, 马云翔, 俞力月,等.辛烯基琥珀酸酐改性多孔淀粉结构表征[J].中国粮油学报, 2020, 35(6):70-75.
LI H Y, MA Y X, YU L Y, et al.Structure characterizatin of octenyl succinic anhydride modified porous starch[J].Journal of the Chinese Cereals and Oils Association, 2020, 35(6):70-75.
[17] WANG L F, PAN S Y, HU H, et al.Synthesis and properties of carboxymethyl kudzu root starch [J].Carbohydrate Polymers, 2010, 80(1):174-179.
[18] ZHANG B, CUI D P, LIU M Z, et al.Corn porous starch:Preparation, characterization and adsorption property[J].International Journal of Biological Macromolecules, 2012, 50(1):250-256.
[19] 苟丽娜, 马云翔, 王宇霞, 等.高比表面积阿魏酸多孔淀粉酯结构表征及体外消化特性[J].食品与发酵工业, 2021,47(22):76-83.
GOU L N, MA Y X, WANG Y X, et al.Structural characterization and in vitro digestibility of ferulic acid porous starch ester with high specific surface area[J].Food and Fermentation Industries, 2021,47(22):76-83.
[20] LIU Y, LU K Y, HU X T, et al.Structure, properties and potential applications of phytoglycogen and waxy starch subjected to carboxymethylation[J].Carbohydrate Polymers, 2020, 234:115908.
[21] NAMAZI H, FATHI F, DADKHAH A.Hydrophobically modified starch using long-chain fatty acids for preparation of nanosized starch particles[J].Scientia Iranica, 2011, 18(3):439-445.
[22] ZHOU M, SHI L, CHENG F, et al.High-efficient preparation of carboxymethyl starch via ball milling with limited solvent content[J].Starch - Stärke, 2018, 70(5-6):1700250.
[23] HE X, GONG X C, LI W F, et al.Preparation and characterization of amphiphilic composites made with double-modified (etherified and esterified) potato starches[J].Starch-Stärke, 2019, 71(9-10):1900089.
[24] SING, K S W.Reporting physisorption data for gas/solid systems with special reference to the determination of surface area and porosity (Recommendations 1984)[J].Pure and Applied Chemistry, 1985, 57(4), 603-619.
[25] UBEYITOGULLARI A, CIFTCI O N.Generating phytosterol nanoparticles in nanoporous bioaerogels via supercritical carbon dioxide impregnation:Effect of impregnation conditions[J].Journal of Food Engineering, 2017, 207:99-107.
[26] LI X, GAO W Y, HUANG L J, et al.Preparation and physicochemical properties of carboxymethyl Fritillaria ussuriensis Maxim.starches[J].Carbohydrate Polymers, 2010, 80(3):768-773.
[27] SUJKA M, PANKIEWICZ U, KOWALSKI R, et al.Porous starch and its application in drug delivery systems[J].Polymers in Medicine, 2018, 48(1):25-29.