食品加工和流通过程中易引入致病病原菌,大肠埃希菌(Escherichia coli)是典型的食源性革兰氏阴性菌,细胞结构具有典型性和代表性,是最常见的低感染剂量、高致病性肠道病原体,可引起腹泻和出血性结肠炎等消化道疾病,是食品公共卫生领域的严重威胁,常作为模式菌株进行研究。葡萄糖氧化供能是微生物普遍存在的能量代谢途径,也是脂肪与蛋白质等生物大分子的终极代谢途径。葡萄糖氧化代谢途径关键酶若受到抑制,能量生成会受到影响并影响菌体正常生长[1]。大肠埃希菌通过葡萄糖磷酸转运系统将葡萄糖转运到胞内生成磷酸葡萄糖[2],经糖酵解(embden-meyerhof-parnas,EMP)途径生成丙酮酸,EMP途径关键酶有己糖激酶(hexokinase,HK)、磷酸果糖激酶(phosphofructokinase,PFK)和丙酮酸激酶(pyruvate kinase,PK)。丙酮酸经丙酮酸脱氢酶系(pyruvate dehydrogenase complex,PDHC)脱羧脱氢生成乙酰CoA,再与草酰乙酸缩合生成柠檬酸进入三羧酸(tricarboxylic acid cycle,TCA)循环并完成葡萄糖彻底氧化,TCA途径关键酶有柠檬酸合成酶(citrate synthase,CS)、异柠檬酸脱氢酶(isocitric dehydrogenase,IDH)和α-酮戊二酸脱氢酶系(α-ketoglutaric dehydrogenase complex,α-KGDHC)[3]。ZHAO等[4]研究了月桂酸盐对大肠埃希菌细胞质膜结构和细胞质膜氧化损伤的膜损伤机理,陈旋等[5]和SHI等[6]分别研究了抗菌肽P7和烷基甘油酯对大肠埃希菌的非细胞质膜损伤机理。由于细胞膜作为抗菌靶点可解决现有抗生素难以彻底杀灭减速生长期与休眠期细菌这一关键问题,且细胞膜结构相对保守和快速杀菌效应使得细胞膜效应靶点具有天然优势[7];此外,由于细菌细胞膜组分与真核生物细胞膜组分的差异使得以细胞膜作为效应靶点具有更好细胞选择性,且不易产生耐药性[8],目前抑菌机理以细胞质膜靶点研究为主[9]。前期研究表明,金抗肽SIF4对大肠埃希菌有较好抑菌活性[4],但抑菌机理不明。课题组认为,虽然细胞膜是抗菌肽优选效应靶点,但基于能量代谢关键酶靶点的非细胞质膜损伤研究也同样具有重要意义,特别是基于细胞质膜/非细胞质膜损伤靶点的协同抑菌机理研究更具重要意义[10],试验研究了金抗肽SIF4对菌体糖酵解和三羧酸循环途径关键酶、细胞质膜氧化损伤和细胞内源活性氧自由基(reactive oxygen species,ROS)生成的影响,以期从细胞质膜/非细胞质膜损伤这一视角揭示SIF4对大肠埃希菌抑菌机理,为食源性大肠埃希菌生物防控提供理论支持。
1 材料与方法
1.1 材料
金抗肽SIF4,实验室制备;大肠埃希菌ATCC25922从菌种保藏中心获得;牛肉膏、胰蛋白胨,北京博星;磷酸烯醇式丙酮酸、丙酮酸、ATP、ADP、NADH、6-磷酸葡萄糖、6-磷酸果糖等,上海源叶;醛缩酶、乳酸脱氢酶、6-磷酸葡萄糖脱氢酶、PK、HK、PFK、4-羟乙基哌嗪乙磺酸、草酰乙酸、二硫双对硝基苯甲酸、硫代巴比妥酸等,Sigma;UV-2600紫外可见分光光度计,岛津;Infinite F200 pro多功能酶标仪,Tecan。
1.2 实验方法
1.2.1 金抗肽SIF4处理与粗酶液制备
将活化菌种接种至牛肉膏蛋白胨液体培养基,37 ℃,120 r/min培养至对数期(12 h),准确吸取5 mL 菌液接种至45 mL牛肉膏蛋白胨液体培养基,加入SIF4至终质量浓度为0、1/2、1和2 MIC[(最小抑菌浓度,minimum inhibitory concentration),MIC=0.4 mg/L],37 ℃,120 r/min培养12 h,间隔4 h取1 mL培养物,4 500 r/min离心10 min,收集菌体,用1%(体积分数) TritonX-100的PBS悬浮细胞并超声处理30 min(200 W,超声5 s,间隔9 s),4 ℃,12 000 r/min离心20 min,细胞破碎上清液即粗酶液,粗酶液蛋白质用Bradford法[11]测定。
1.2.2 糖酵解代谢途径关键酶活性测定
利用NADH和NADPH在340 nm处有光吸收并产生荧光,而NAD+和NADP+无此特性,用酶标仪测定荧光值并计算酶活力。
(1)HK活性测定:参考SKARLATOS等[12]方法并稍做修改。移取0.5 mL酶液加入2.0 mL的0.05 mol/L Tris-HCl缓冲液(pH 8.0,含100 mmol/L MgCl2,0.4 mmol/L NADP+,1.2 mmol/LATP,300 mmol/L葡萄糖),5 μg 6-磷酸脱氢酶,25 ℃反应5 min,以不添加ATP组为空白。
(2)PFK活性测定:参考KOTLARZ等[13]方法并稍做修改。移取0.5 mL酶液加入2.0 mL的0.05 mol/L Tris-HCl缓冲液[pH 8.0,含30 mmol/L MgCl2,60 mmol/L KCl,0.12 mmol/L NADPH,1.0 mmol/L ATP,0.2 mmol/L 磷酸烯醇式丙酮酸(phosphoenolpyruvate,PEP),1.0 mmol/L AMP,0.5 mmol/L 6-磷酸果糖],加丙酮酸激酶50 μg,20 U乳酸脱氢酶,以不添加6-磷酸果糖组为空白。
(3)PK活性测定:参考MILLAR等[14]方法并稍做修改。移取0.5 mL酶液加入2.0 mL的0.05 mol/L Tris-HCl缓冲液(pH 7.5,含1.2 mmol/L ADP,0.18 mmol/L NADH,150 mmol/L KCl,12 mmol/L MgCl2,1.1 mmol/L PEP),20 U乳酸脱氢酶,以不添加PEP组为空白。
1.2.3 TCA循环途径关键酶活性测定
(1)PDHC提取与测定:参考JENNER等[15]方法并稍做修改。取1 mL粗酶液加入1 mL酶提取液[pH 7.5,含80 mmol/L Na4P2O7,10 mmol/L K3PO4,0.3 mol/L甘露醇,10.0 g/L聚乙烯吡咯烷酮(polyvinylpyrrolidone,PVP),10.0 g/L牛血清白蛋白(bovine serum albumin,BSA),2 mmol/L EDTA,25 mmol/L Cys]中,2 000 r/min离心5 min,上清液15 000 r/min离心20 min,将沉淀重悬浮于1 mL TES缓冲液(10 mmol/L Tes-KOH,pH 7.5,0.3 mol/L甘露醇,1.0 g/L BSA),30 000 r/min离心45 min,上清液即为PDHC粗提液;取100 μL酶粗提液加入至2 mL酶反应液[pH 7.5,75 mmol/L HEPES-NaOH,10 mmol/L MgCl2,10 mmol/L NAD+,0.2 mmol/L CoA,2 mmol/L 焦磷酸硫胺素(thiamine pyrophosphate,TPP),10 mmol/L Cys],25 ℃保温15 min,加入20 mmol/L丙酮酸钠激发反应,测定340 nm光吸收值变化。
(2)CS提取与测定:参考JENNER等[15]和HIRAI等[16]方法并稍作修改。取1 mL粗酶液加入1 mL酶提取液[pH 7.3,含30 mmol/L HEPES-NaOH,10 mmol/L 二硫苏糖醇(dithiothreitol,DTT),1 mmol/L MgSO4,0.5 mmol/L EDTA,5.0 g/L BSA,5.0 g/L PVP,10 mmol/L Cys],匀浆2 min,4 ℃,10 000 r/min离心10 min,上清液即CS粗提液[15];取100 μL酶粗提液加入2 mL反应液(pH 9.0,含40 mmol/L Tris-HCl,0.1 mmol/L 二硫代二硝基苯甲酸,80 μmol/L 乙酰CoA),25 ℃保温15 min,加入20 mmol/L草酰乙酸激发反应,测定412 nm光吸收值变化。
(3)IDH提取与测定:参考JENNER等[15]方法并稍作修改。取1 mL粗酶液加入1 mL提取液(pH 6.9,含25 mmol/L HEPES-NaOH,1 mmol/L MgSO4,0.5 mmol/L EDTA,1 mmol/L DTT,25%甘油,2.5 g/L BSA,2.5 g/L PVP,0.1%(体积分数) TritonX-100,100 mmol/L柠檬酸钠),匀浆2 min,4 ℃,10 000 r/min离心10 min,上清液即IDH粗提液;取100 μL酶粗提液加入2 mL反应液[pH 7.6,含40 mmol/L Tris-HCl,10 mmol/L NAD+,10 mmol/L MnCl2,0.05%(体积分数)TritonX-100],25 ℃保温15 min,加入20 mmol/L异柠檬酸钠激发反应,测定340 nm光吸收值变化。
(4)α-KGDHC提取与测定:参考PEKOVICH等[17]方法并稍作修改。取1 mL粗酶液加入1 mL酶提取液[pH 7.5,含20 mmol/L Tris-HCl,1 mmol/L DTT,1 mmol/L EDTA,0.01%(体积分数)TritonX-100,0.2 g/L脱氧胆酸钠,0.2 mmol/L 苯甲基磺酰氟],匀浆2 min,4 ℃,10 000 r/min离心10 min,上清液即α-KGDHC粗提液;取100 μL酶粗提液加入2 mL反应液[pH 8.0,含50 mmol/L 3-吗啉丙磺酸,2 mmol/L MgCl2,1.2 mmol/L CaCl2,0.16 mmol/L CoA,10 mmol/L NAD+,0.5%(体积分数)TritonX-100,0.04 mmol/L鱼藤酮],25 ℃保温15 min,加入20 mmol/L α-酮戊二酸激发反应,测定340 nm光吸收值变化。
1.2.4 对细胞质膜氧化损伤的影响
取对数生长期菌种接种至牛肉膏蛋白胨液体培养基中,37 ℃,120 r/min培养至OD600=0.5(约5×107CFU/mL),加入SIF4至终质量浓度为0、1/2、1和2 MIC,继续培养12 h,间隔4 h取样1 mL培养物与硫代巴比妥酸(thiobarbituric acid,TBA)等体积混合,煮沸15 min后立即转入冰水浴中,室温条件下12 000 r/min离心10 min。取300 μL上清液分别测定450、532、600 nm光吸收值并计算丙二醛(malondialdehyde,MDA)含量[18],如公式(1)所示:
MDA/(nmol·mg-1 protein) =10×[6.45×(A532-A600)-0.56×A450]
(1)
1.2.5 对细胞内源ROS生成的影响
取对数生长期菌种接种至牛肉膏蛋白胨液体培养基中,37 ℃,120 r/min培养至OD600=0.5,加入SIF4至终质量浓度为0、1/2、1和2 MIC,继续培养12 h,间隔4 h取样1 mL培养物,6 500 r/min离心10 min,菌体沉淀用无菌PBS洗涤3次并重悬,向各组样液加入100 μL 10 μmol/L 2.7-二氯荧光黄双乙酸盐(2,7-dichlorodihydrofluorescein diacetate,DCFH-DA)溶液,37 ℃,120 r/min避光孵育1 h,测定488 nm处细胞悬液荧光强度以判定细胞内源ROS水平[19]。
2 结果与分析
2.1 对糖酵解途径关键酶活性的影响
2.1.1 对HK的影响
HK是糖酵解途径第1个关键酶,负责ATP磷酸基团转移至葡萄糖C6生成6-磷酸葡萄糖,需Mg2+或Mn2+参与。SIF4对HK活性的影响如图1所示。
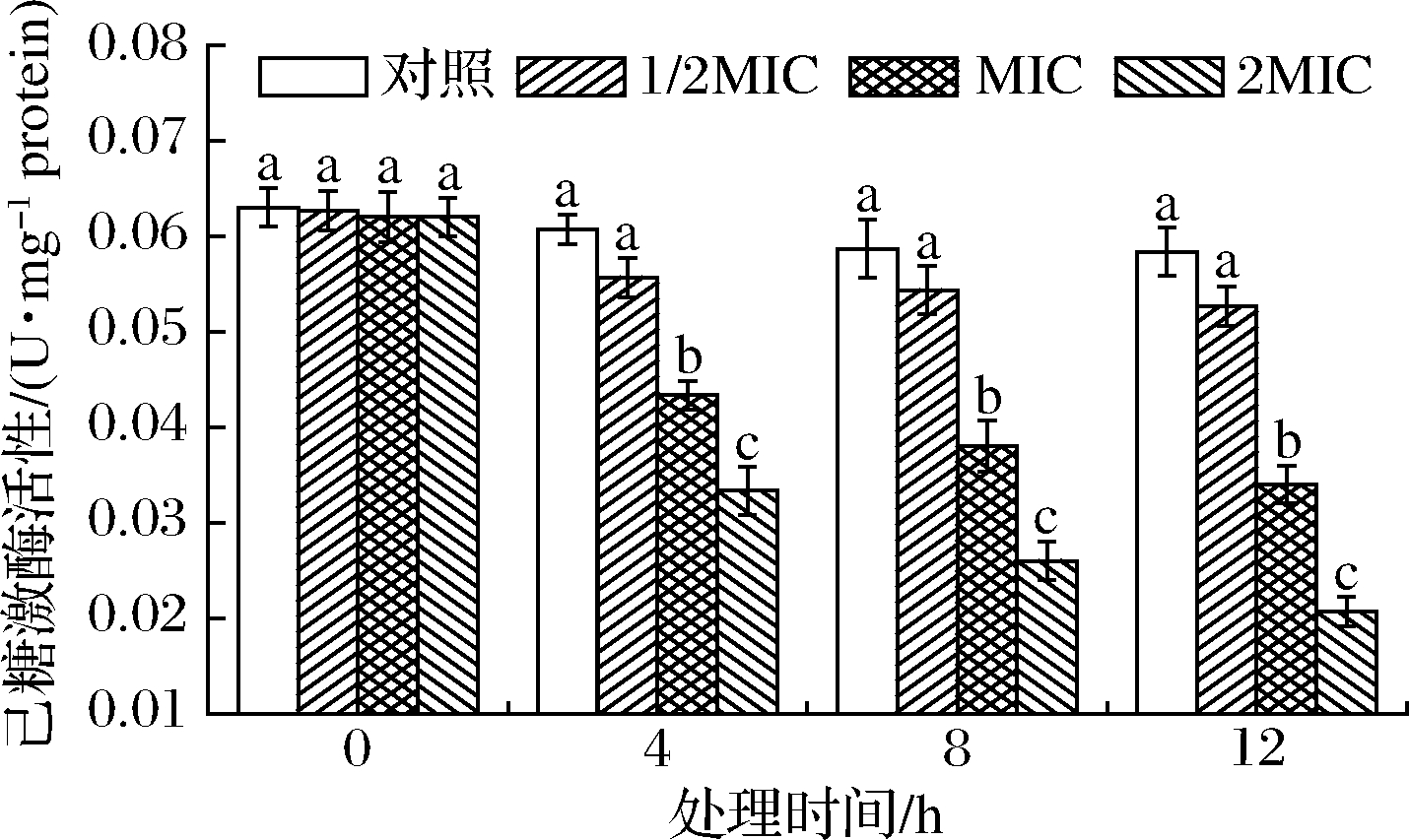
图1 SIF4对己糖激酶的影响
Fig.1 The effect of SIF4 on HK
注:不同小写字母表示差异显著(下同)
由图1可知,处理0~12 h时,1/2MIC组对HK活性影响不显著(P>0.05),随着SIF4处理剂量的增加,HK活性显著降低(P<0.05),特别是2MIC组,可能是由于HK为别构酶,SIF4对HK的别构抑制效应存在量效关系[20],SIF4可能通过与HK的别构亚基结合而影响酶活性,从而对EMP实施调控,与其他小分子物质对HK活性影响机制相似[21]。2MIC组处理4、8、12 h时,HK活性分别降至对照组的53.23%、41.94%和33.39%。
2.1.2 对PFK的影响
PFK负责催化6-磷酸果糖为1,6-二磷酸果糖,pfkA和pfkB基因可编码同工酶Ⅰ和Ⅱ,PFK I约占90%,是糖酵解途径第2个关键酶和标志酶[22]。SIF4对PFK的影响如图2所示。
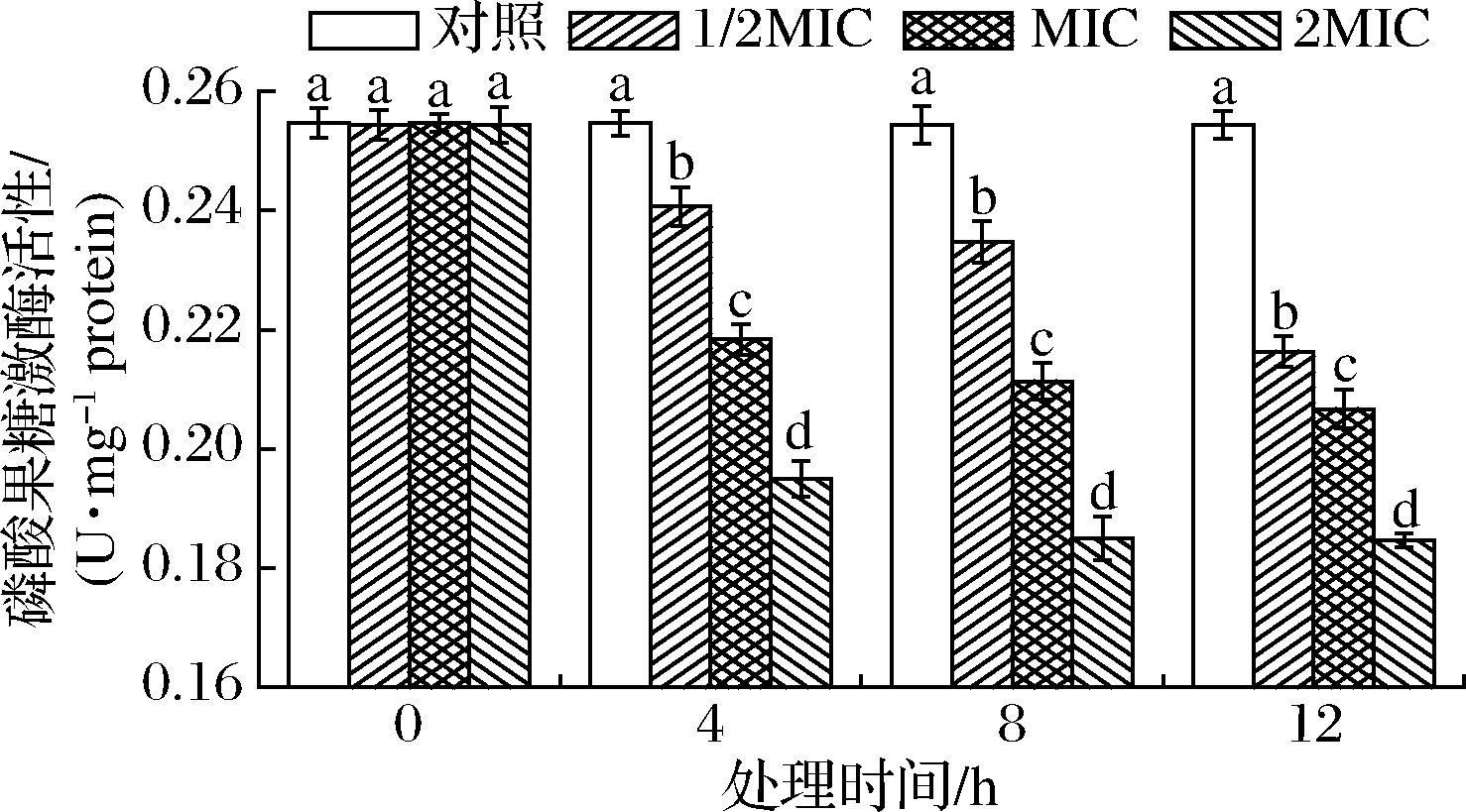
图2 SIF4对磷酸果糖激酶的影响
Fig.2 The effect of SIF4 on PFK
由图2可知,试验组与对照组PFK活性均存在显著差异(P<0.05)。SIF4处理剂量(x)与PFK活性(y)呈现负相关,1/2、1和2 MIC组线性回归方程分别为y=-0.003x+0.254 5(R2=0.948 2)、y=-0.003 8x+0.245 5(R2=0.704 6)和y=-0.005 5x+0.237 6(R2=0.574 7)。随着SIF4处理剂量增加,线性关系变差,特别是处理剂量较大时,SIF4在较短时间内就可对PFK实现较好抑制,如2MIC组处理4 h时,PFK活性降至对照组的76.68%,处理时间延长至8 h和12 h时,抑制活性仅分别增加3.93%和4.05%;PFK是由4个亚基组成的别构酶,亚基中除有6-磷酸果糖和ATP结合位点外,还存在几个与激活剂(或抑制剂)结合的别构位点,对PFK的抑制作用可能与小分子金抗肽SIF4可竞争性结合PFK亚基而发挥别构抑制效应有关[13]。
2.1.3 对PK的影响
PK负责催化PEP生成丙酮酸和ATP,是糖酵解最后一个关键酶,pykF和pykA基因可编码PK同工酶Ⅰ和Ⅱ,以PK I为主[23]。SIF4对PK活性的影响如图3所示。

图3 SIF4对丙酮酸激酶的影响
Fig.3 The effect of SIF4 on PK
由图3可知,试验组与对照组PK活性均存在显著差异(P<0.05),1/2MIC、MIC和2MIC组,SIF4处理时间(x)与PK活性(y)呈负相关关系,量效线性方程为y=-0.002x+0.181 4(R2=0.846 5)、y=-0.000 3x+0.176 5(R2=0.736 6)和y=-0.005 8x+0.175 0(R2= 0.849 4),特别是2MIC组,PK活性与处理时间呈良好线性关系,说明随着处理时间延长,SIF4对PK抑制活性呈增强趋势。2MIC组处理4、8、12 h时,PK活性分别降至对照组的75.26%、69.29%和61.31%;PK为别构酶,相对分子质量为228 kDa,除需要二价金属离子(Mg2+和Mn2+)外,还需一价金属离子(K+,Rb+,Cs+),特别是K+。SIF4对PK抑制作用可能是由于SIF4可竞争性结合到PK别构亚基中发挥别构抑制效应,SIF4结构中Fe2+对PK可能存在潜在抑制活性[24]。
2.2 对TCA循环关键代谢酶的影响
2.2.1 对PDHC的影响
PDHC催化丙酮酸氧化脱羧生成乙酰CoA,反应不可逆,是关键酶[25]。对PDHC影响如图4所示。
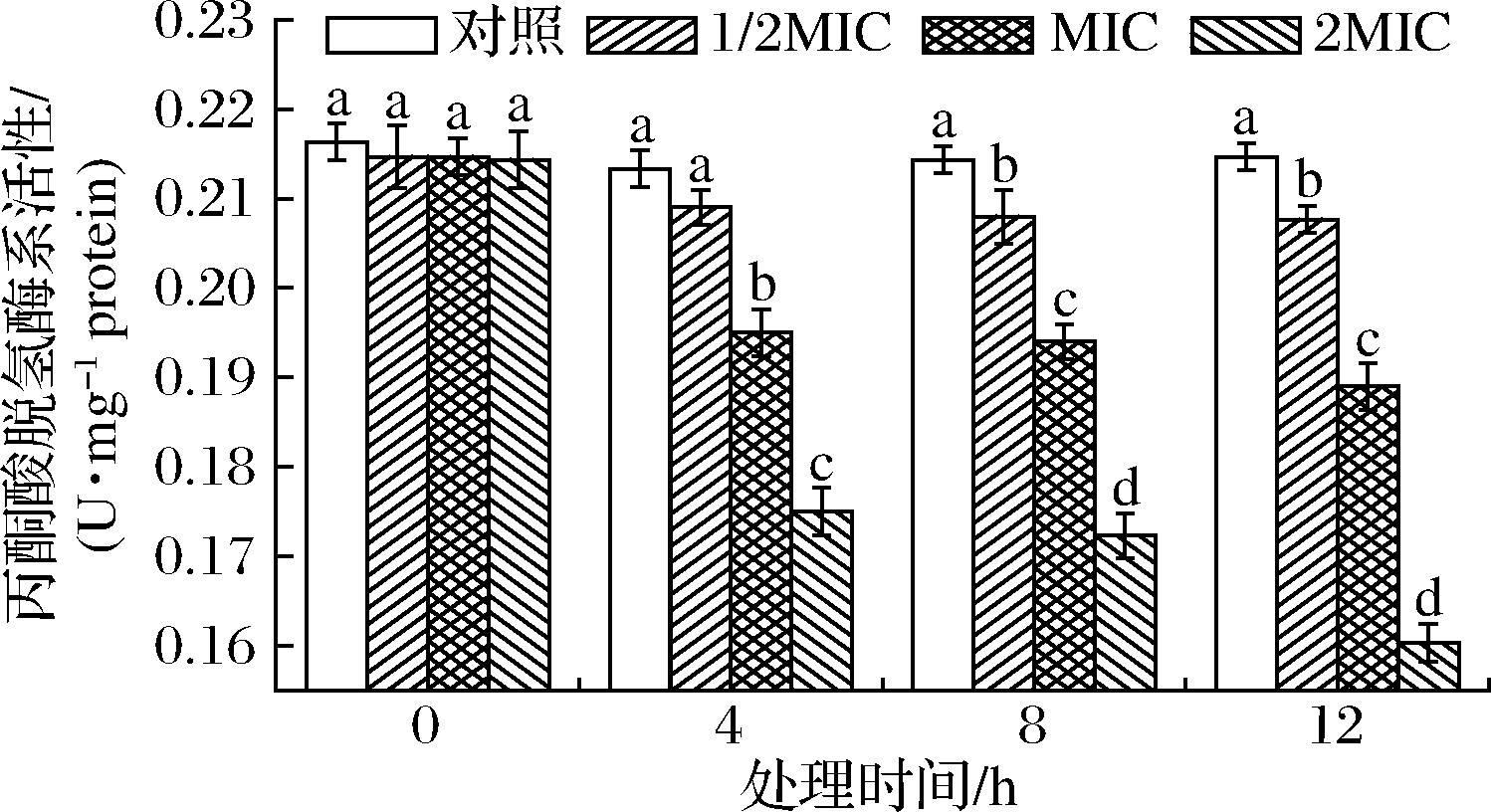
图4 SIF4对丙酮酸脱氢酶系的影响
Fig.4 The effect of SIF4 on PDHC
由图4可知,培养4 h时,1/2MIC组与对照组PDHC活性无差异显著(P>0.05),培养8~12 h时1/2MIC组与对照组有显著差异(P<0.05);MIC和2MIC组与对照组均有显著差异(P<0.05)。PDHC为多酶复合体,由3种酶[丙酮酸脱氢酶(E1)、二氢硫辛酸转乙酰酶(E2)、二氢硫辛酸脱氢酶(E3)]和6种辅助因子共同组成,PDHC有3个结构域,E1催化的反应最慢,催化的不可逆反应控制整个反应体系速率[25]。由于PDHC为多酶复合体,SIF4对PDHC的具体作用机理还需进一步确认。
2.2.2 对CS的影响
CS能催化乙酰CoA与草酰乙酸缩合生成柠檬酸,是TCA循环第1个关键限速酶[26]。SIF4对CS的影响如图5所示。
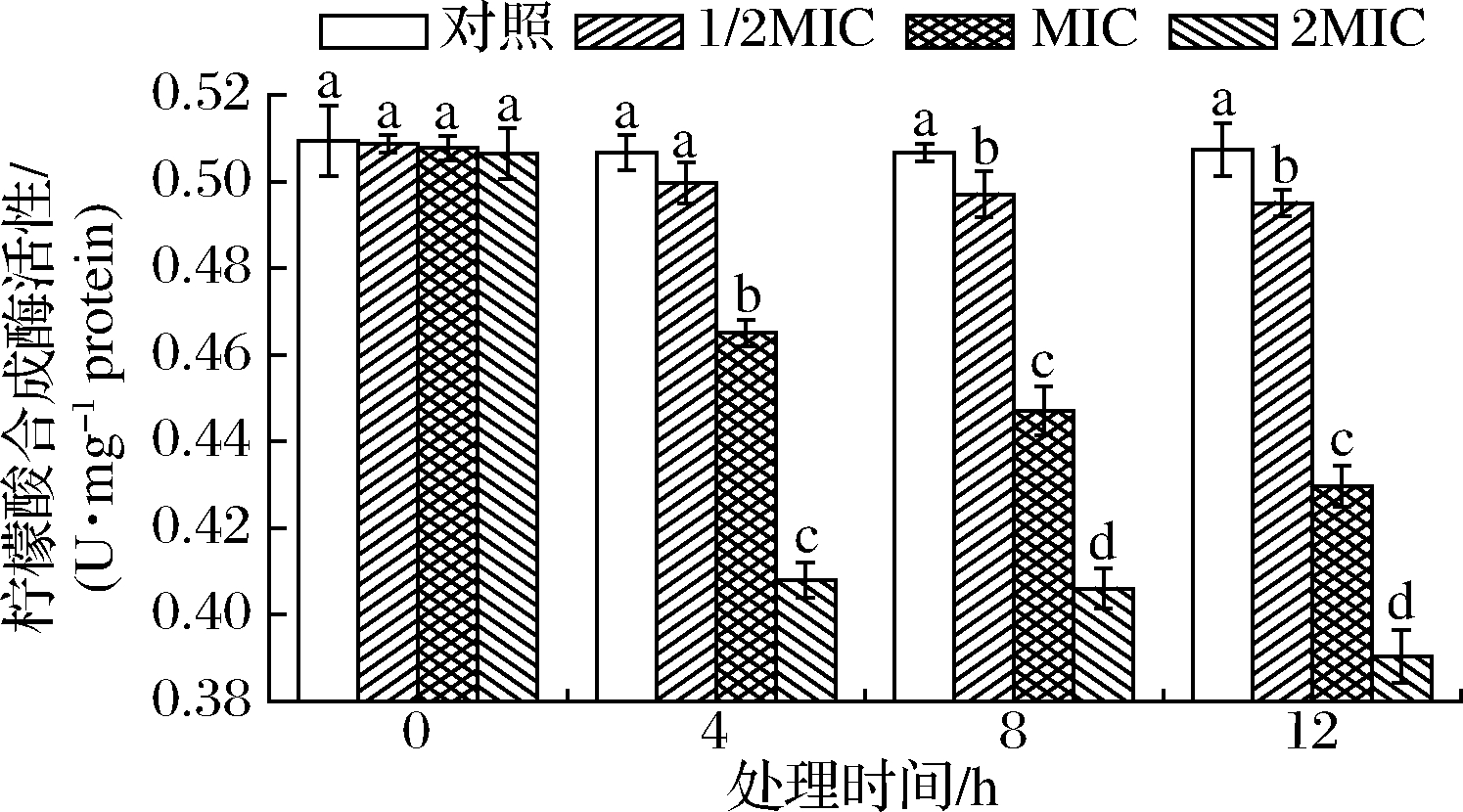
图5 SIF4对柠檬酸合成酶的影响
Fig.5 The effect of SIF4 on CS
由图5可知,培养4 h时,1/2MIC与对照组CS无显著差异(P>0.05),8~12 h时有显著性差异(P<0.05),说明1/2MIC组存在时间依耐,需作用一定时间后对CS的抑制才表现显著差异(P<0.05),而MIC、2MIC组均存在显著差异(P<0.05),说明金抗肽SIF4对CS的抑制存在时间或浓度依耐,低剂量组则需要处理一定时间后才表现良好的抑制活性,而高剂量组则在处理4 h就表现出显著抑制效应。因此,金抗肽SIF4应用于大肠埃希菌抑菌时,可适当将处理剂量提升到MIC或2MIC,以增强对食源性大肠埃希菌的抑制效果。
2.2.3 对IDH的影响
IDH能不可逆脱下异柠檬酸仲醇上的H而氧化为羰基并生成不稳定性中间产物草酰琥珀酸,与酶结合后快速脱羧生成α-酮戊二酸、NADH和CO2,是第2个关键酶[27]。SIF4对IDH影响如图6所示。
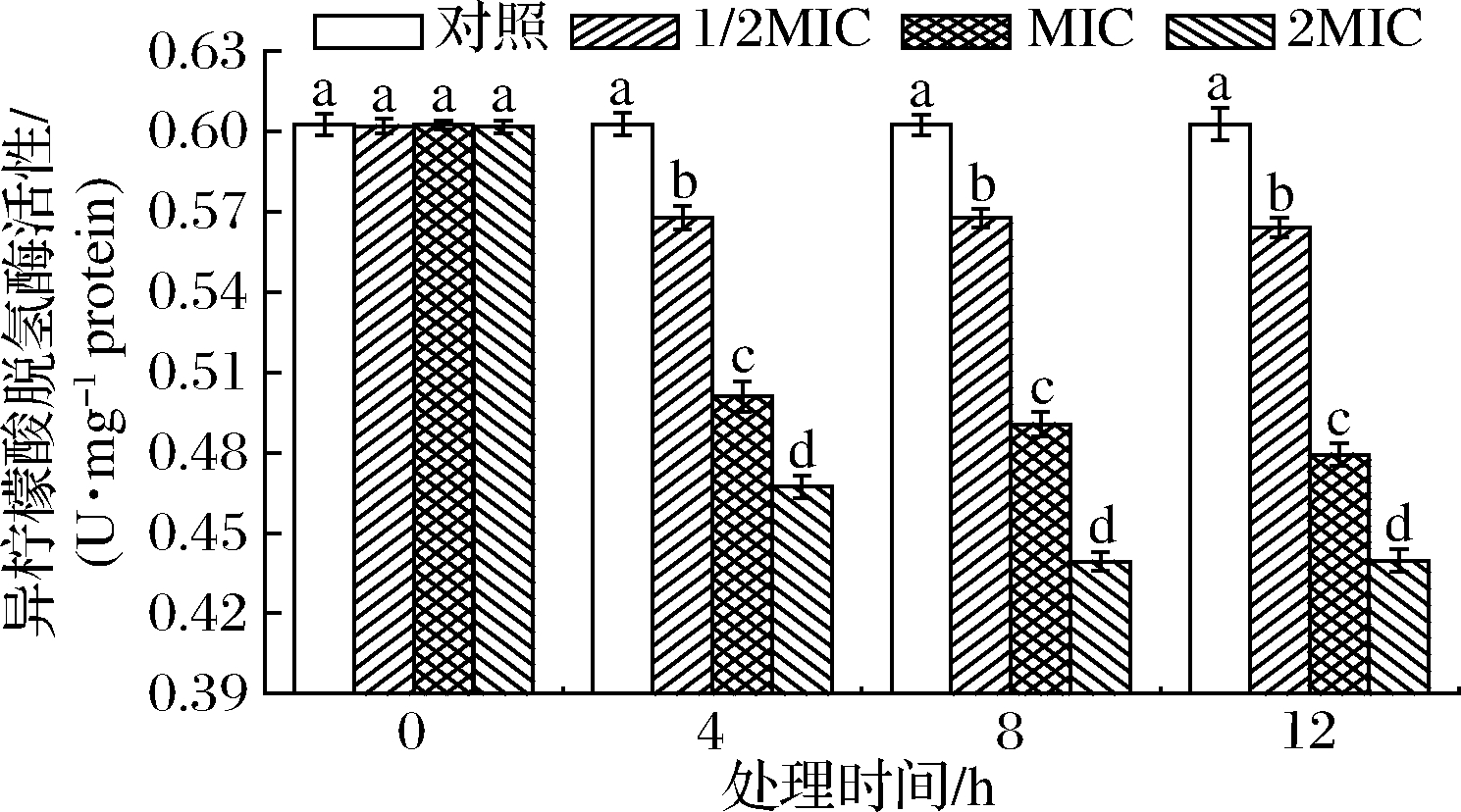
图6 SIF4对异柠檬酸脱氢酶的影响
Fig.6 The effect of SIF4 on IDH
由图6可知,各试验组与对照组IDH活性均存在显著差异(P<0.05),但与处理剂量和处理时间有正相关关系,处理12 h时,1/2MIC、MIC和2MIC组IDH活性分别为对照组的94.20%、79.58%和73.08%,处理剂量与处理时间存在协同增强作用。IDH有NAD-依耐型异柠檬酸脱氢酶(NAD+-dependent isocitrate dehydrogenase,NAD-IDH)和NADP-依耐型异柠檬酸脱氢酶(NADP-dependent isocitrate dehydrogenase,NADP-IDH)2种,催化产生的NADPH和NADH可起到抗氧化胁迫作用,有研究表明,IDH活性降低表明细胞受氧化应激损伤越大,对不利环境耐受性降低[27]。
2.2.4 对α-KGDHC的影响
α-KGDHC催化α-酮戊二酸氧化脱羧反应与PDHC催化机理相似,通过磷酸化/去磷酸化来调节复合酶系第一步反应速率以实现对整个催化效率的调控[28],SIF4对α-KGDHC的影响如图7所示。
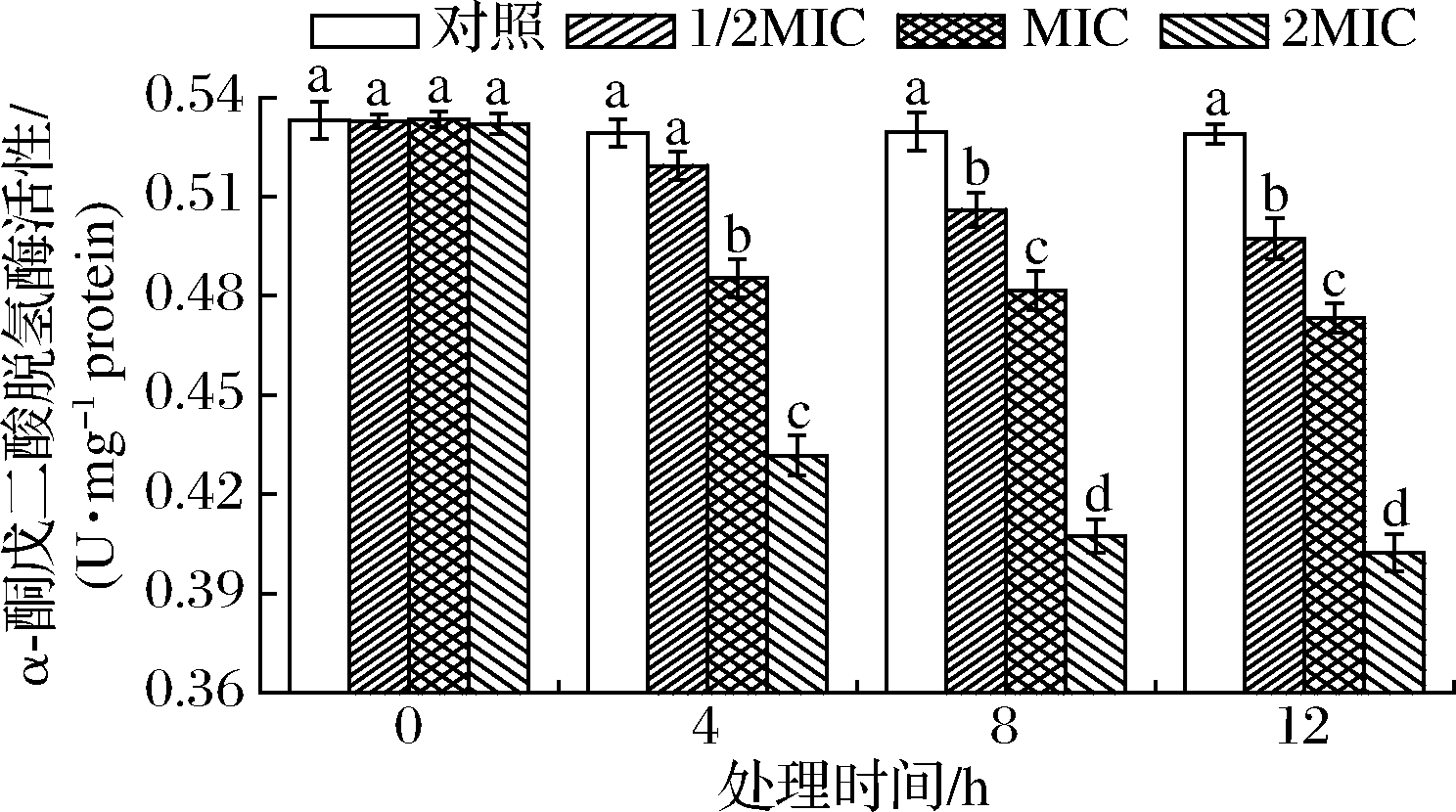
图7 SIF4对α-酮戊二酸脱氢酶系的影响
Fig.7 The effect of SIF4 on α-KGDHC
由图7可知,培养4 h时,1/2MIC组与对照组α-KGDHC 活性差异不显著(P>0.05),MIC和2MIC组与对照组有显著差异(P<0.05),而培养8~12 h,各试验组与对照组α-KGDHC活性均存在显著差异(P<0.05);研究还发现,各试验组α-KGDHC活性随处理剂量增加和处理时间延长呈明显降低趋势,存在协同增效效应[28]。有研究发现,胞内ROS体内代谢受NADPH所提供质子数量的影响,ROS积累会降低α-KGDH活性,过量ROS会引起菌体慢性缺氧,诱导菌体适应性调节并使α-KGDH基因表达增强,α-KGDHC是ROS主要靶酶,对氧化应激比较敏感,α-KGDH活性和细胞内源ROS可作为潜在的细胞氧化应激损伤重要的表征指标[29]。
2.2.5 对糖有氧氧化代谢途径抑制机理分析
以2MIC试验组为例,SIF4对大肠埃希菌糖代谢抑制活性如图8所示,
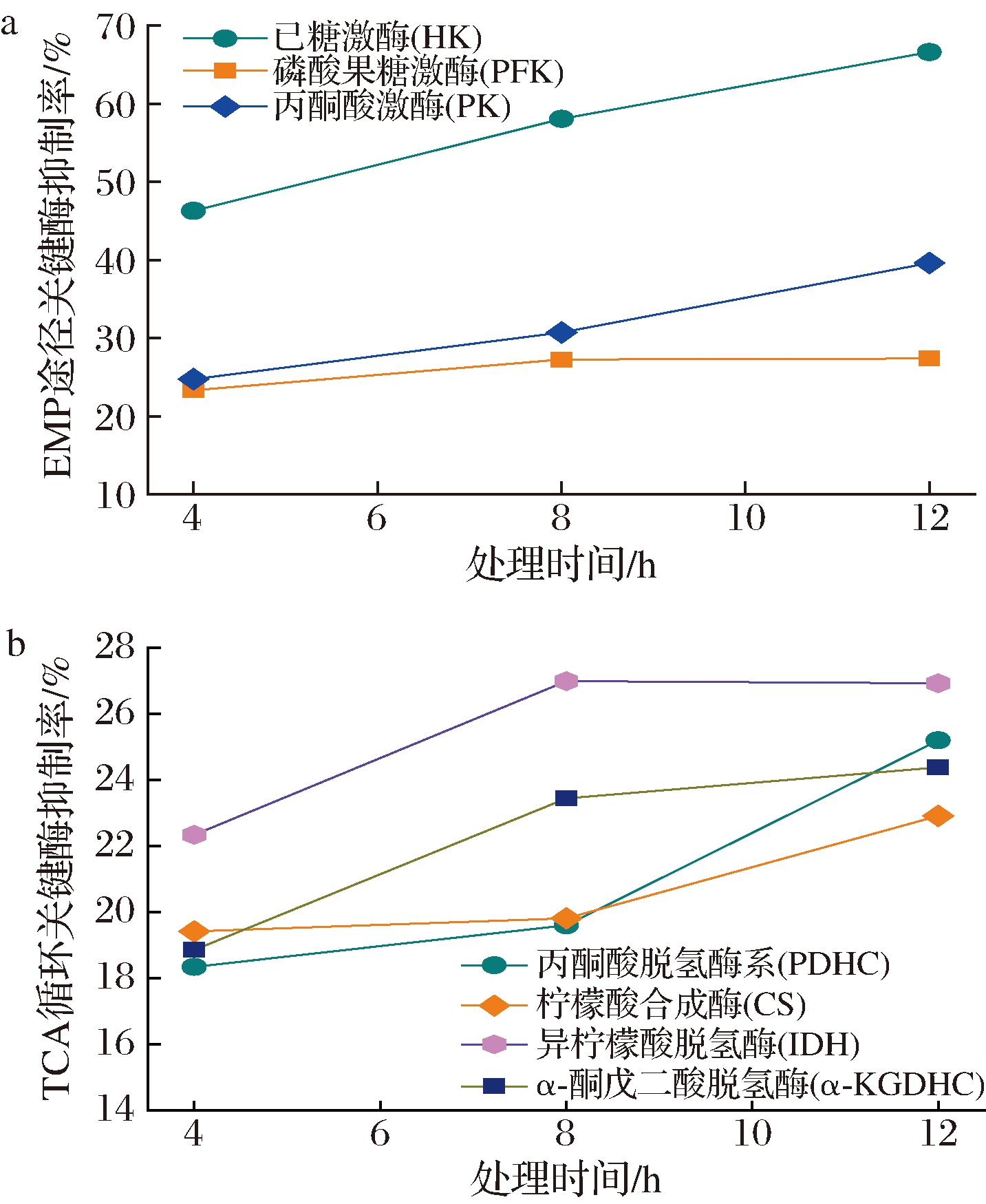
a-EMP;b-TCA
图8 SIF4对糖代谢关键酶活性的影响
Fig.8 The effect of SIF4 on glucose metabolism
由图8可知,EMP途径中,SIF4对HK抑制效率最高(66.61%),其次为PK(39.61%),PFK抑制率最低(27.37%),而TCA循环中,IDH抑制活性最高(26.99%,12 h),处理8 h时α-KGDHC抑制率为23.44%,处理12 h时PDHC抑制率为25.20%,表明SIF4主要通过抑制糖酵解途径中HK活性实现对大肠埃希菌的抑菌。总体来说,SIF4对EMP途径抑制效果要强于TCA循环,说明EMP途径是SIF4对大肠埃希菌的主要糖代谢抑制途径,EMP途径和TCA循环中其他葡萄糖氧化代谢关键酶也受到不同程度抑制,说明SIF4对大肠埃希菌抑制是全方位多角度的,这也可能是金抗肽SIF4表现良好抑菌活性的重要原因[29]。
2.3 对细胞质膜氧化损伤的影响
2.3.1 对细胞质膜脂质过氧化的影响
MDA是细胞质膜脂质过氧化氧化损伤主要产物,MDA累积能加速氧化损伤,常作为细胞质膜受损特征标志物[30]。SIF4对细胞质膜脂质过氧化损伤的影响如图9所示。

图9 SIF4对丙二醛含量的影响
Fig.9 The effect of SIF4 on MDA content
由图9可知,试验组与对照组MDA含量均存在显著差异(P<0.05),对照组MDA均保持在较低水平且无显著增加,说明对照组细胞质膜氧化损伤较少;研究发现,MDA含量与SIF4处理时间和剂量有关,同一处理剂量组间细胞质膜受损程度随处理时间延长而显著增长(P<0.05),而同一处理时间组间细胞质膜氧化损伤程度与处理剂量呈显著正相关(P<0.05),作用4、8、12 h,SIF4处理剂量(x)与MDA含量(y)有良好线性关系,分别为y=0.916 2x+0.159 6(R2=0.915 9)、y=1.248x+0.188(R2=0.893 9)和y=1.223 4x+0.241 8(R2=0.826 5)。有研究表明,微生物可改变细胞膜不饱和脂肪酸比例和含量来调整质膜流动性和抵御逆境,氧化应激可影响细胞质膜不饱和脂肪酸比例和含量以及膜流动性[31],推测SIF4对大肠埃希菌抑菌活性可能与氧化损伤导致细胞质膜不饱和脂肪酸比例、含量以及流动性有关[29],SIF4处理能增强细胞质膜氧化损伤,当大肠埃希菌细胞暴露在氧化应激环境时,膜内不饱和脂肪酸比例会明显下滑,推断细胞质膜中不饱和脂肪酸是SIF4细胞质膜损伤抑菌的重要效应靶点之一,与DENICH等[31]一致。
2.3.2 对细胞内源ROS生成的影响
细胞内源ROS在信号传导和维持菌体内环境稳态有重要作用,低水平ROS能驱动细胞产生氧化应激并刺激氧化应激基因表达特定功能蛋白或保护或修复细胞损伤,但过量ROS可通过降解和变形细胞生物大分子而破坏菌体结构或诱导细胞凋亡,被认为是细胞凋亡的初始因素[32]。DCFH-DA是一种本身无荧光的非标记性的氧化敏感荧光探针,可自由穿梭进入细胞并被胞内酯酶水解生成DCFH,DCFH不能自由穿梭透过细胞膜而被装载于胞内,受胞内ROS氧化可生成有绿色荧光二氯荧光素(dichlorofluorescein,DCF),荧光强度与内源ROS含量成正相关[33]。SIF4对细胞内源ROS生成影响如图10所示。
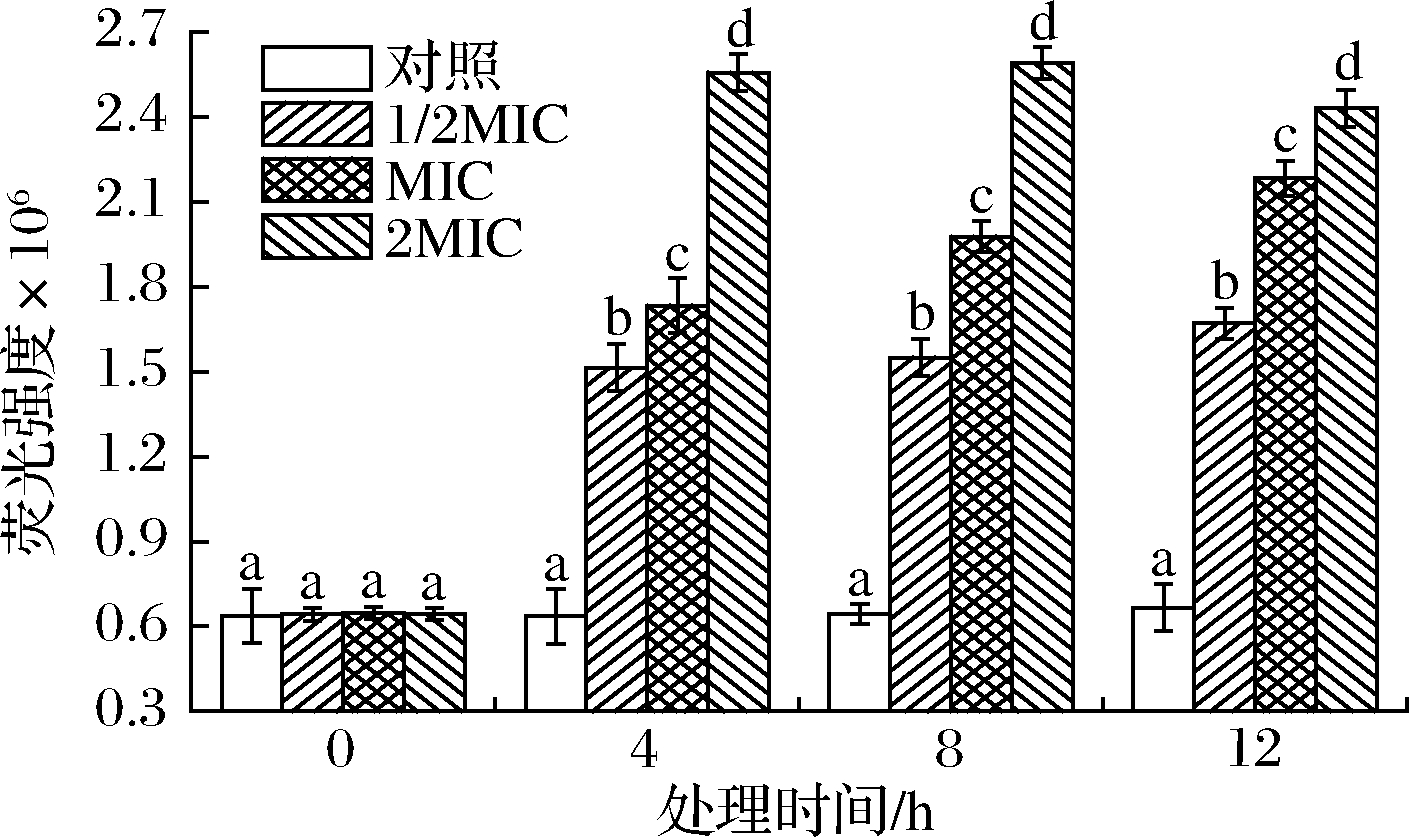
图10 SIF4对细胞内源ROS生成的影响
Fig.10 The effect of SIF4 on endogenous ROS
由图10可知,试验组与对照组内源ROS有显著性差异(P<0.05)。1/2MIC、2MIC组培养4~12 h时组内内源ROS产生增幅无显著性差异,但仍显著高于对照组(P<0.05),而MIC组在培养4~12 h时组间有显著性差异,呈显著递增趋势(P<0.05),可能是由于1/2MIC组处理剂量太低,对菌体氧化应激作用较弱,菌体氧化损伤应答不明显,而2MIC则可能是由于SIF4处理剂量较大,处理4 h时就已对菌体细胞质膜造成较为明显的氧化应激损伤,随后继续延长处理时间,氧化应激损伤产生的内源ROS增幅并不明显,表明菌体细胞质膜氧化损伤已基本接近受损上限[34],而MIC组胞内ROS增长与培养时间延长有明显关联,可能与MIC组处理剂量适中,对菌体细胞质膜的氧化损伤有时间依赖性,因此,菌体氧化应激损伤程度随处理时间延长而显著增强。有研究认为,菌体细胞质膜氧化损伤可诱导细胞产生过量ROS,造成氧化胁迫而破坏细胞膜结构完整性,并引发菌体细胞凋亡或程序性死亡[34],而金抗肽SIF4对菌体细胞膜氧化损伤也可能是其重要的抑菌生化机制。
3 结论与讨论
大肠埃希菌通过葡萄糖磷酸转运系统将葡萄糖转运到胞内并磷酸化生成6-磷酸葡萄糖,经EMP途径和TCA循环完成葡萄糖的彻底氧化并生成ATP和中间代谢产物,EMP途径和TCA循环是大肠埃希菌最重要的能量代谢途径,是菌体生命活动的能量基础,大肠埃希菌作为典型的革兰氏阴性食源性致病菌,系统研究金抗肽SIF4对其生物抑菌机理有助于理解金抗肽对其他食源性革兰氏阴性菌的抑菌机理。研究表明,金抗肽SIF4主要通过抑制糖酵解途径的已糖激酶这一关键酶实现抑菌,对三羧酸循环关键酶也有抑制活性,但对EMP途径抑制效果要强于TCA循环;金抗肽SIF4对菌体细胞质膜氧化损伤与处理剂量和处理时间有重要关联,且存在协同增强效应。研究发现,细胞质膜氧化损伤与胞内ROS有密切关联,而ROS生成与胞内还原型辅酶提供的氢质子数量有关[4],解析葡萄糖生物氧化与细胞质膜氧化应激对菌体的影响是解析金抗肽SIF4对大肠埃希菌抑菌机理的重要途径。HK、PFK和PK是EMP途径催化不可逆反应的关键酶,而PDHC、CS、IDH和α-KGDHC是TCA循环途径催化不可逆反应的关键酶,监测金抗肽SIF4对糖有氧代谢关键酶活性可揭示金抗肽SIF4对大肠埃希菌的非细胞质膜损伤机理;课题组前期研究发现,金抗肽SIF4可破坏菌体细胞膜结构,增强表面疏水性并降低表面zeta电位,造成细胞聚沉,但对细胞质膜氧化损伤机理尚不清晰,试验研究了金抗肽SIF4处理对细胞质膜氧化损伤特性标志物——MDA含量变化及胞内ROS生成的影响机理,以期解析金抗肽SIF4基于细胞质膜损伤的抑菌机理。通过研究基于细胞质膜/非细胞质膜损伤抑菌机理,为系统阐明金抗肽SIF4对大肠埃希菌的抑菌机理奠定理论基础。下一步拟研究SIF4对菌体胞内蛋白质与核酸合成影响机理、与基因组DNA作用机制和对DNA拓扑异构酶影响规律,可为阐明基于胞内物质代谢调控的非膜损伤抑菌机理提供进一步实验依据。
[1] GONZALEZ J E, LONG C P, ANTONIEWICZ M R.Comprehensive analysis of glucose and xylose metabolism in Escherichia coli under aerobic and anaerobic conditions by 13C metabolic flux analysis[J].Metabolic Engineering, 2017, 39:9-18.
[2] PLUMBRIDGE J.Expression of ptsG, the gene for the major glucose PTS transporter in Escherichia coli, is repressed by Mlc and induced by growth on glucose[J].Molecular Microbiology, 1998, 29(4):1 053-1 063.
[3] AKRAM M.Citric acid cycle and role of its intermediates in metabolism[J].Cell Biochemistry & Biophysics, 2014, 68(3):475-478.
[4] ZHAO D B,WANG S D, HU Y S, et al.Insight into the antibacterial activity of lauric arginate against Escherichia coli O157∶H7:membrane disruption and oxidative stress[J].LWT, 2022, 162:113449.
[5] 陈旋, 李莉蓉.抗菌肽P7抑制大肠杆菌的非膜作用机制[J].微生物学报, 2016, 56(11):1 737-1 745.
CHEN X, LI L R.Non-membrane mechanisms of antimicrobial peptide P7 against Escherichia coli[J].Acta Microbiologica Sinica, 2016, 56(11):1 737-1 745.
[6] SHI Y G, ZHANG R R, ZHU C M, et al.Antimicrobial mechanism of alkyl gallates against Escherichia coli and Staphylococcus aureus and its combined effect with electrospun nanofibers on Chinese Taihu icefish preservation[J].Food Chemistry, 2021, 346:128949.
[7] EPAND R M, WALKER C, EPAND R F, et al.Molecular mechanisms of membrane targeting antibiotics[J].Biochimica et Biophysica Acta (BBA)-Biomembranes, 2016, 1 858(5):980-987.
[8] HERZOG I M, FRIDMAN M.Design and synthesis of membrane-targeting antibiotics:From peptides-to aminosugar-based antimicrobial cationic amphiphiles[J].Medicinal Chemistry Communication, 2014, 5(8):1 014-1 026.
[9] LOHNER K, DEUTSCH G, SEVCSIK E, et al.N-Acylation of antimicrobial peptides causes different mode of cell membrane damage[J].Biophysical Journal, 2010, 98(3):218a.
[10] 肖怀秋, 李玉珍, 林亲录, 等.抗菌肽多靶点作用抑菌机理研究进展[J].食品与生物技术学报, 2022, 41(5):11-19.
XIAO H Q, LI Y Z, LIN Q L, et al.Advances in multiple targets mechanism of antimicrobial peptides[J].Journal of Food Science and Biotechnology, 2022, 41(5):11-19.
[11] BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry, 1976, 72(1-2):248-254.
[12] SKARLATOS P, DAHL M K.The glucose kinase of Bacillus subtilis[J].Journal of Bacteriology, 1998, 180(12):3 222-3 226.
[13] KOTLARZ D, GARREAU H, BUC H.Regulation of the amount and of the activity of phosphofructokinases and pyruvate kinases in Escherichia coli[J].Biochimica et Biophysica Acta (BBA)-General Subjects, 1975, 381(2):257-268.
[14] MILLAR A H, KNORPP C, LEAVER C J, et al.Plant mitochondrial pyruvate dehydrogenase complex:Purification and identification of catalytic components in potato[J].The Biochemical Journal, 1998, 334(3):571-576.
[15] JENNER H L, WINNING B M, MILLAR A.H, et al.NAD malic enzyme and the control of carbohydrate metabolism in potato tubers[J].Plant Physiology, 2001, 126(3):1 139-1 149.
[16] HIRAI M, UENO I.Development of citrus fruits:Fruit development and enzymatic changes in juice vesicle tissue[J].Plant & Cell Physiology, 1977, 18(4):791-799.
[17] PEKOVICH S R, MARTIN P R, SINGLETON C K.Thiamine pyrophosphate-requiring enzymes are altered during pyrithiamine-induced thiamine deficiency in cultured human lymphoblasts[J].The Journal of Nutrition, 1996, 126(7):1 791-1 798.
[18] CHEN J J, YU B P.Alterations in mitochondrial membrane fluidity by lipid peroxidation products[J].Free Radical Biology & Medicine, 1994, 17(5):411-418.
[19] NINGANAGOUDA S, RATHOD V, SINGH D, et al.Growth kinetics and mechanistic action of reactive oxygen species released by silver nanoparticles from Aspergillus niger on Escherichia coli[J].BioMed Research International, 2014(2014):753419.
[20] MENG X J, YU J D, ZHENG X M, et al.Regulations of small-molecules metabolites on hexokinase and pyruvate kinase in Aspergillus niger[J].Biotechnology Bulletin, 2021, 37(12):180.
[21] AMENDOLA C R, MAHAFFEY J P, PARKER S J, et al.KRAS4A directly regulates hexokinase 1[J].Nature, 2019, 576(7 787):482-486.
[22] FRAENKEL D G, KOTLARZ D, BUC H.Two fructose 6-phosphate kinase activities in Escherichia coli[J].Journal of Biological Chemistry, 1973, 248(13):4 865-4 866.
[23] PONCE E, FLORES N, MARTINEZ A, et al.Cloning of the two pyruvate kinase isoenzyme structural genes from Escherichia coli:The relative roles of these enzymes in pyruvate biosynthesis[J].Journal of Bacteriology, 1995, 177(19):5 719-5 722.
[24] MATTEVI A, BOLOGNESI M, VALENTINI G.The allosteric regulation of pyruvate kinase[J].FEBS Letters, 1996, 389(1):15-19.
[25] DE KOK A, HENGEVELD A F, MARTIN A, et al.The pyruvate dehydrogenase multi-enzyme complex from gram-negative bacteria[J].Biochimica et Biophysica Acta (BBA)-Protein Structure and Molecular Enzymology, 1998, 1 385(2):353-366.
[26] BOND D R, MESTER T, NESBØ C L, et al.Characterization of citrate synthase from Geobacter sulfurreducens and evidence for a family of citrate synthases similar to those of eukaryotes throughout the Geobacteraceae[J].Applied & Environmental Microbiology, 2005, 71(7):3 858-3 865.
[27] CUPP J R, MCALISTER H L.NAD(+)-dependent isocitrate dehydrogenase:Cloning, nucleotide sequence, and disruption of the IDH2 gene from Saccharomyces cerevisiae[J].Journal of Biological Chemistry, 1991, 266(33):22 199-22 205.
[28] SHIIO I, UJIGAWA T K.Presence and regulation of α-ketoglutarate dehydrogenase complex in a glutamate-producing bacterium, Brevibacterium flavum[J].Agricultural and Biological Chemistry, 1980, 44(8):1 897-1 904.
[29] 肖怀秋,李玉珍,林亲录,等.金属抗菌肽SIF4对大肠杆菌的抑菌机制研究[J]. 食品与发酵工业, 2022, 48(1): 111-116.
XIAO H Q, LI Y Z, LIN Q L, et al. Antimicrobial mechanism of metal antimicrobial peptide SIF4 against Escherichia coli[J] . Food and Fermentation Industries,2022,48(1) :111 - 116.
[30] AGUILAR DIAZ DE LEON J, BORGES C R.Evaluation of oxidative stress in biological samples using the thiobarbituric acid reactive substances assay[J].Journal of Visualized Experiments:JoVE, 2020.DOI:10.3791/61122.
[31] DENICH T J, BEAUDETTE L A, LEE H, et al.Effect of selected environmental and physico-chemical factors on bacterial cytoplasmic membranes[J].Journal of Microbiological Methods, 2003, 52(2):149-182.
[32] CABISCOL E, TAMARIT J, ROS J.Oxidative stress in bacteria and protein damage by reactive oxygen species[J].International Microbiology, 2000, 3(1):3-8.
[33] YU D L, ZHA Y Y, ZHONG Z, et al.Improved detection of reactive oxygen species by DCFH-DA:New insight into self-amplification of fluorescence signal by light irradiation[J].Sensors and Actuators B:Chemical, 2021, 339:129878.
[34] CHOI H, YANG Z L, WEISSHAAR J C.Single-cell, real-time detection of oxidative stress induced in Escherichia coli by the antimicrobial peptide CM15[J].Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(3):303-310.