香蕉广泛种植在热带、亚热带地区,成熟的香蕉果实甘糯,富含多种营养元素,并具有“快乐水果”之称。因其种植面积大、在世界水果贸易中占据着重要的地位[1]。香蕉中的碳水化合物、粗蛋白和热量都高于荔枝、菠萝、芒果、龙眼、橙子等水果,且在中医理论中,香蕉还具有降血压、通便、清热祛毒和抗衰老等功效,深受广大消费者的喜爱[2]。香蕉难以贮藏,容易受到外界湿度、温度等影响导致失去商用价值。真空冷冻干燥技术在芒果[3]、蓝莓[4]等果蔬加工中参与了实际应用并得到了较高的认可和评价。通过真空冷冻干燥技术将香蕉果肉加工成香蕉粉,可以最大程度地保留原有色泽、营养成分和风味,并具有易吸收、易溶解的特点[5]。降低香蕉果肉的含水率,并且改变了香蕉状态,既可以缓解不耐贮藏和包装的问题,还可以为人们生活带来便捷,具有极大的发展潜力。庄远红等[6]和何艾等[7]分别研究了真空冷冻干燥工艺对香蕉片和芭蕉片的品质影响,WANG等[8]采用真空带式干燥、冷冻干燥和风干3种不同的干燥方法对香蕉泥进行处理,采用统计分析系统评价香蕉粉主要挥发物的贡献。目前,关于香蕉切片经不同时间的真空冷冻干燥后研磨成粉,与新鲜香蕉品质和挥发性组分的差异比较的研究未见报道。
本研究以八成熟的新鲜香蕉为原料,切片后护色,在不同时长中真空冷冻干燥,研磨成香蕉粉,对新鲜香蕉和真空冷冻干燥24 h、33 h,将得到的香蕉粉三者进行品质分析。利用顶空固相微萃取(head space-solid phase micro-extraction, HS-SPME)结合气相色谱-质谱联用仪(gas chromatograph-mass spectrometer,GC-MS)测定3种不同香蕉样品的挥发性组分,分析不同处理方式的香蕉挥发性组分的分类、生鲜香蕉与干燥后香蕉粉的挥发性组分的差异。根据品质和挥发性组分的变化确定香蕉切片真空冷冻干燥的时间,为香蕉深加工的香气变化和香蕉粉代餐食品等的研制提供参考。
1 材料与方法
1.1 试剂与材料
香蕉,阳江市阳东区水果市场;DPPH,福州飞净生物科技有限公司;氯化钠分析纯,国药集团化学试剂有限公司;2-辛醇标准品(GC≥99.5%),上海源叶生物科技有限公司;正构烷烃混标(C7~C40,1 000 μg/mL),上海安谱实验科技股份有限公司;亚硝酸钠、硝酸铝,广州化学试剂厂。
1.2 仪器与设备
QP2020型GC-MS,日本岛津仪器有限公司;SH-Rxi-5Sil MS 气相色谱柱,岛津公司;75 μm CAR/PDMS萃取头、SPME手动进样器,美国Supelco公司;SPME专用衬管,岛津(上海)有限公司;90-2A磁力加热搅拌器,天津市赛得利斯实验分析仪器制造厂;SHT-060SD超声波清洗机,深圳市深华泰超声洗净设备有限公司;FA224电子天平,上海舜宇恒平科技仪器有限公司;DK-S24恒温水溶锅,上海精宏实验设备有限公司;A11分析研磨机,德国IKA公司;研磨料理机KD-607,中山市康典电器有限公司;I3紫外可见分光光度计,济南海能仪器有限公司;FBZ1002-UP-P超纯水机,青岛富勒姆科技有限公司;真空冷冻干燥机,宁波新芝生物科技有限公司。
1.3 实验方法
1.3.1 样品制备
香蕉粉加工工艺图如图1所示。
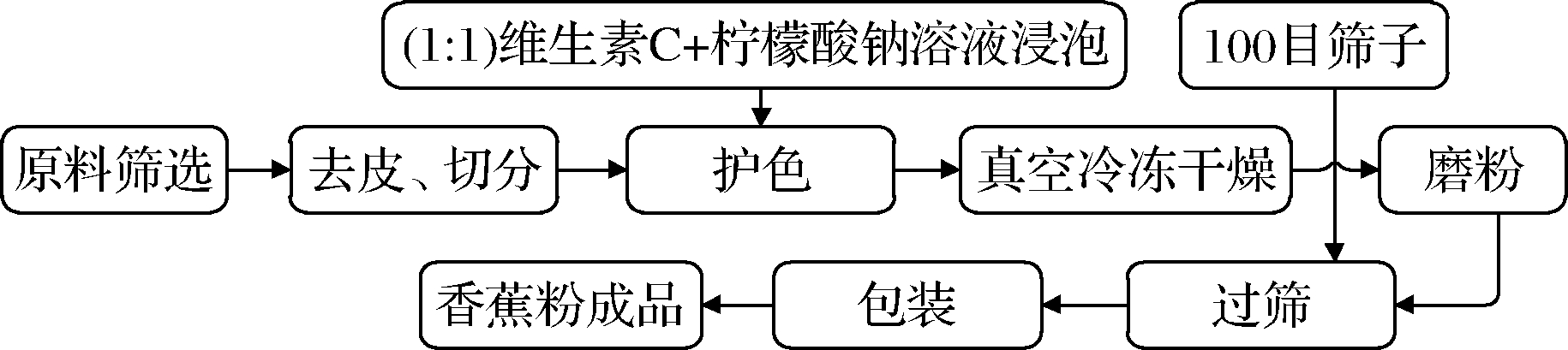
图1 香蕉粉加工流程图
Fig.1 Processing flow chart of banana powder
1.3.2 操作要点
原料筛选:由于不同成熟度的香蕉果实淀粉含量和所含挥发性组分的种类差异都较大,成熟后香蕉果实中维生素和果胶含量越低;膳食纤维和可溶性糖含量增高,果胶和糖含量是导致香蕉打粉时出现结块的主要根源,因此,选择长度15 cm无机械损伤、八成熟的香蕉做原料[9-10]。
去皮、切分:样品形状、大小会导致都会影响真空时间和口感,本研究借鉴焦丹[11]处理香蕉厚度的方法将香蕉片厚度控制在0.5 cm左右,这个厚度有利于护色和缩短干燥时间。
护色:黄华梅等[12]发现柠檬酸添加量≥0.4%时,可以有效抑制多酚氧化酶的活力,从而达到护色目的,本文借鉴该方法稍作改动进行护色处理。
干燥处理:将处理好的香蕉切片置于调配好的真空冷冻干燥机中,进行脱水处理。预实验发现当干燥时间少于24 h时香蕉片不容易粉碎,出现了粉团现象;当干燥时间久于33 h时,香蕉虽然可以呈较好的粉碎效果,但极易吸潮,难以保持颗粒状,并且当干燥时间>33 h时,成本增高,过长的干燥时间难以实现在工业中应用。结合预实验结果与成本考虑,干燥时间在24 h与33 h时制得的香蕉粉色泽和状态适中,成本相对较低。故本实验的香蕉片真空冷冻干燥时间确定为24 h、33 h两种。
磨粉和过筛:将香蕉干片放入高速打粉机中,打开高速打粉机开关,使打粉机高速运行至香蕉干片完全呈细小粉状颗粒,随后倒入100目不锈钢筛中,过筛完成后用铝箔袋包装,得香蕉粉成品。
1.3.3 理化指标的测定
1.3.3.1 样品制备
准确称取样品3 g于15 mL离心管中,准确加入80%(体积分数)甲醇溶液10 mL;50 ℃超声波提取20 min后取出,用混匀器充分2 min后转移到高速离心机中8 000 r/min收集上清液,重复2次;使用80%甲醇定容50.0 mL容量瓶中,在-80 ℃冰箱保存,待测。该提取液可用于总酚、DPPH抗氧化能力指标的测定。试验做3个平行测定。
1.3.3.2 含水率的测定
取称量瓶,放入烘箱中以100 ℃烘干(至恒重状态),置于干燥器中冷却,然后精准称量。取分析样品5~10 g放入称量瓶中准确称重,使样品平坦,然后将称量瓶放入烘箱中,先在65 ℃烘2 h至样品变脆,再以100 ℃烘2 h,取出后置于干燥器中冷却,称重后继续烘1 h。冷却称重,直至2次重量差不超过3 mg为止,生鲜样品由于黏度大,加入已恒重10 g石英砂在水浴搅拌,使其近干,再进行以上操作。
1.3.3.3 总酚的测定
参考陈蓬凤等[13]的方法测定,稍有改动。
准确吸取不同样品提取液0.5 mL于试管中,分别向试管加入0.5 mL福林酚溶液(体积比1∶10);手动摇荡试管15 s后加入1 mL 75 g/L的碳酸钠溶液和1 mL纯水,避光保存1 h,取出在725 nm处测定吸光度,同样方法以系列浓度梯度的没食子酸制得标准溶液,绘制标准曲线计算总酚浓度,得到样品总酚含量(μg/g)。
1.3.3.4 DPPH自由基清除率的测定
参照王定美等[14]和张岩等[15]的方法测定,有所改动。测定结果以清除率表示。各取0.3 mL 3种不同香蕉样品提取液加入到10 mL比色管中,然后向每管中加入3.7 mL 0.063 mmol/L的DPPH乙醇溶液,混匀常温避光,静置20 min,在517 nm下测定吸光度,以无水乙醇做空白对照。DPPH自由基清除率计算如公式(1)所示:
DPPH自由基清除率![]()
(1)
式中:A0为DPPH溶液与无水乙醇的吸光度;A1为样品与DPPH溶液的吸光度。
1.3.4 三种香蕉样品挥发性组分测定
1.3.4.1 挥发性组分的SPME萃取与测定
称取新鲜香蕉样品及真空冷冻干燥制备好的香蕉粉样品3 g于螺口样品瓶中,把磁力拌子置入样品瓶后准确加5 mL饱和氯化钠使香蕉样品充分溶解,分别加入5.0 μL质量浓度为0.99 mg/mL内标物2-辛醇,将样品瓶盖子旋紧避免挥发性组分流失导致测定结果偏差,样品瓶置于恒温40 ℃的磁力恒温搅拌器中水浴加热,推出萃取纤维头,顶空吸附40 min后,从样品瓶上拔出萃取针头,萃取的样品供GC-MS解析3 min后进行分析。
1.3.4.2 GC-MS定性和定量分析
色谱条件:SHIMADZU SH-Rxi-5 sil MS(30 m×250 μm×0.25 μm)毛细管色谱柱,载气为氦气,其他色谱条件进行比较筛选后确定。程序升温:初始温度40 ℃,保持1 min;以2 ℃/min的速率升至60 ℃;保持2 min,再以5 ℃/min的速率升至150 ℃,保持2 min,以10 ℃/min的速率升至180 ℃,保持1 min。载气为高纯氦(He),流速为1.0 mL/min;进样口温度220 ℃,不分流。质谱条件:EI电离源;电子能量70 eV,电压350 V,扫描范围m/z 35~400。
定性分析:原始数据导入MS-DIAL 4.70软件进行色谱峰解卷积[16]对齐等处理后,导入NIST 17质谱库进行组分搜索与鉴定,根据NIST 17质谱库中的正向匹配度(match factor,MF)、反向匹配度(reverse match factor,RMF)均≥800,同时参考未知组分的计算保留指数(retention index,RIact)与NIST 17质谱库的参考保留指数(RIref)接近原则,确定该组分名称。
定量分析:采用内标法进行半定量分析,内标物2-辛醇的质量浓度为0.99 mg/mL,加标体积为5.0 μL。
1.3.4.3 数据处理
WPS Office进行组分浓度计算,自动质谱退卷积定性系统[17]建立本实验的保留指数校正库,MS-DIAL 软件(V.4.70)进行原始质谱数据的预处理,SIMCA软件(V.14.1)进行正交偏最小二乘法判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA)分类,R语言(V.4.0.2)绘制火山图、韦恩图,Origin 2019b绘制品质含量图。
2 结果与分析
图2中生鲜香蕉(FR)样品,表面呈黄白色,质地完好,甘甜软糯,香味浓郁;真空冷冻干燥24 h(FD 24h)研制成香蕉粉后,色泽如面粉洁净、质地细腻,味道香甜,水溶后口感丝滑;真空冷冻干燥33 h(FD 33h)研制成香蕉粉后,色泽微黄,暗沉,质地粗糙,味道香甜,水溶后有结块现象。

图2 三种香蕉样品视图
Fig.2 Sample view of three kinds of bananas
2.1 三种不同香蕉样品水分和总酚的含量比较
水分是决定香蕉贮存的重要条件,降低水分活度(water activity,Aw)可以有效抑制微生物的生长,还可以降低香蕉中酶类的酶促反应。由表1可知,生鲜香蕉的样品含水率最高,随着真空冷冻干燥对香蕉样品干燥时间延长,其含水率降低,即水分活度越低。3种不同样品的含水率分别是FR(80.3%)>FD 24h(4.1%)>FD 33h(2.6%),三者具有显著的差异,干燥33 h的香蕉含水率最低,更耐贮藏。
总酚是果蔬中次代谢产物,和果蔬的色泽、品质抗逆性病有密切联系,并且影响着果蔬的贮存和营养价值[18]。没食子酸标准曲线方程为y=0.072 8x-0.001 8,R2=0.999 3,代入标准曲线计算香蕉样品的总酚含量。由表1可知,3种样品中生鲜香蕉样品的总酚含量最高,其次是干燥24 h后的香蕉样品,含量最低的是干燥33 h的香蕉样品,有可能是在采用真空冷冻干燥技术对香蕉样品干燥时,随着水分的流失,总酚随着干燥时间延长也有所损失,干燥时长对样品中的总酚含量有显著的影响。24 h干燥时间保留了生鲜香蕉大于70%的总酚物质,33 h干燥时间只保留了生鲜香蕉不超过13%的总酚物质,在保留总酚物质含量上,24 h干燥时间优于33 h干燥时间。
表1 三种不同香蕉样品水分和总酚的含量
Table 1 Contents of water and total phenol in three different banana samples
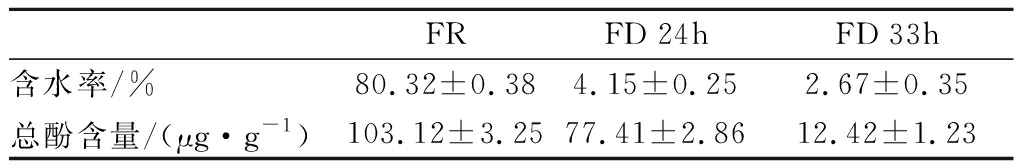
FRFD 24hFD 33h含水率/%80.32±0.384.15±0.252.67±0.35总酚含量/(μg·g-1)103.12±3.2577.41±2.8612.42±1.23
2.2 三种不同香蕉样品DPPH清除率比较
由图3可知,3种香蕉样品的DPPH自由基清除率的强弱顺序为:生鲜香蕉样品(58.81%)>干燥24 h香蕉粉(36.33%)>干燥33 h香蕉蕉粉(3.86%)。可见3种不同的样品之间的DPPH自由基清除能力相差极大,24 h干燥时间保留了生鲜香蕉大于60%的DPPH自由基清除能力,而33 h干燥时间的DPPH自由基清除能力下降到生鲜香蕉的7%以下,该值的变化趋势与含水率、总酚含量的规律一致,因此,DPPH自由基清除能力有可能和含水率有着密切关联,样品干燥时间越长,其DPPH清除能力的越弱[19],合适的干燥时间有利于保留香蕉粉的总酚等热敏性生物活性物质,维持较强的抗氧化能力。尽管24 h真空冷冻时间香蕉的干燥度没33 h高,但相对保留了更高的DPPH自由基清除能力,在香蕉粉的精深加工中需要考虑产品的贮藏时间与生物活性物质之间的平衡,因此,24 h的真空冷冻干燥时间处理相对更合适。
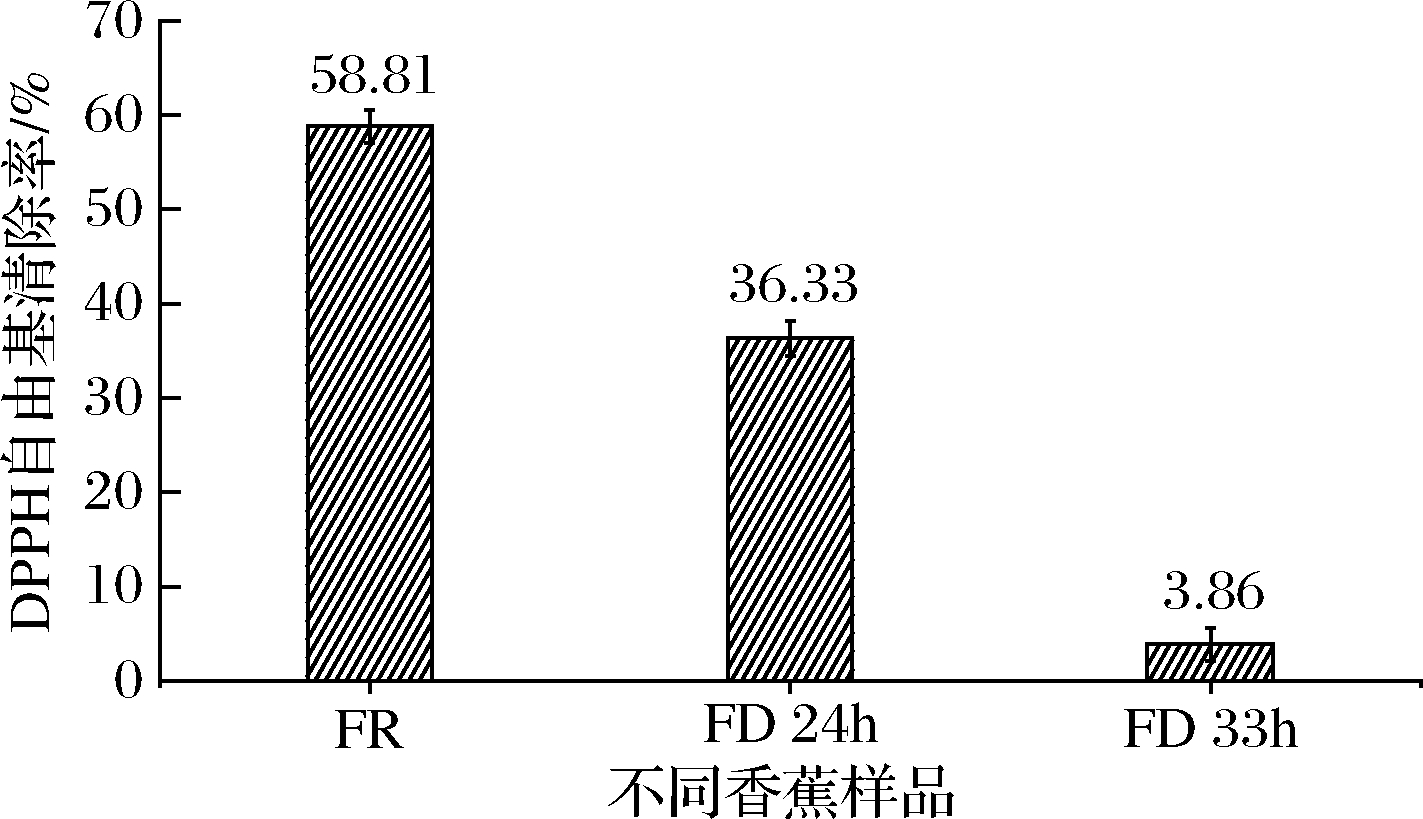
图3 不同香蕉样品DPPH自由基清除率
Fig.3 DPPH radical scavenging rate in different samples
2.3 三种不同香蕉样品挥发性组分分析
2.3.1 挥发性组分的定性与定量
通过顶空固相微萃取-气相色谱-质谱技术分别对FR、FD 24h和FD 33h样品挥发性组分进行测定,3种香蕉样品的总离子流图见图4-A,原始数据经MS-DIAL 4.70软件的峰对齐等处理,得到128个组分,导入NIST 17质谱数据库检索,正向匹配度、反向匹配度均≥800的组分共有64个,并以2-辛醇为内标计算得到各组分的相对含量。如表2所示,本实验的挥发性组分与前人报道的挥发性组分类似[20-21];64个组分中(下文提到的组分含量均指已鉴定组分,不含未鉴定组分),酯类有30个,酮类8个,醛类6个,醇类5个,其他类13个,酯类是香蕉挥发性组分的主要组分[22]。FR、FD 24h和FD 33h样品的总挥发性组分含量、主要类别含量分图4-B所示,3种样品的总挥发性组分含量分别是7 037.49、6 230.13(占FR的88.53%)、5 698.00 μg/kg(占FR的80.97%),其中酯类占总挥发性组分的比例分别为59.15%、38.19%、47.71%,酮类分别为10.05%、27.50%、35.05%,醛类分别为18.03%、1.84%、0.84%,因此生鲜香蕉的香气组分以酯类、醛类还有酮类为主,而冷冻干燥后的样品以酯类和酮类为主,醛类占比很低。总体而言,冷冻干燥处理能够在一定程度上保持生鲜样品的原有香味,但生鲜样品和冷冻干燥处理样品的挥发性组分的类别含量还是存在一些差异。由图4-B可知,FD 24h样品的其他类别含量明显高于FR样品和FD 33h样品,主要是因为FD 24h样品中的丁香酚含量相对很高,可能是该组分在24 h的干燥过程中得到了富集,但继续干燥至33 h过程中,又有部分该组分随着水汽被抽走。
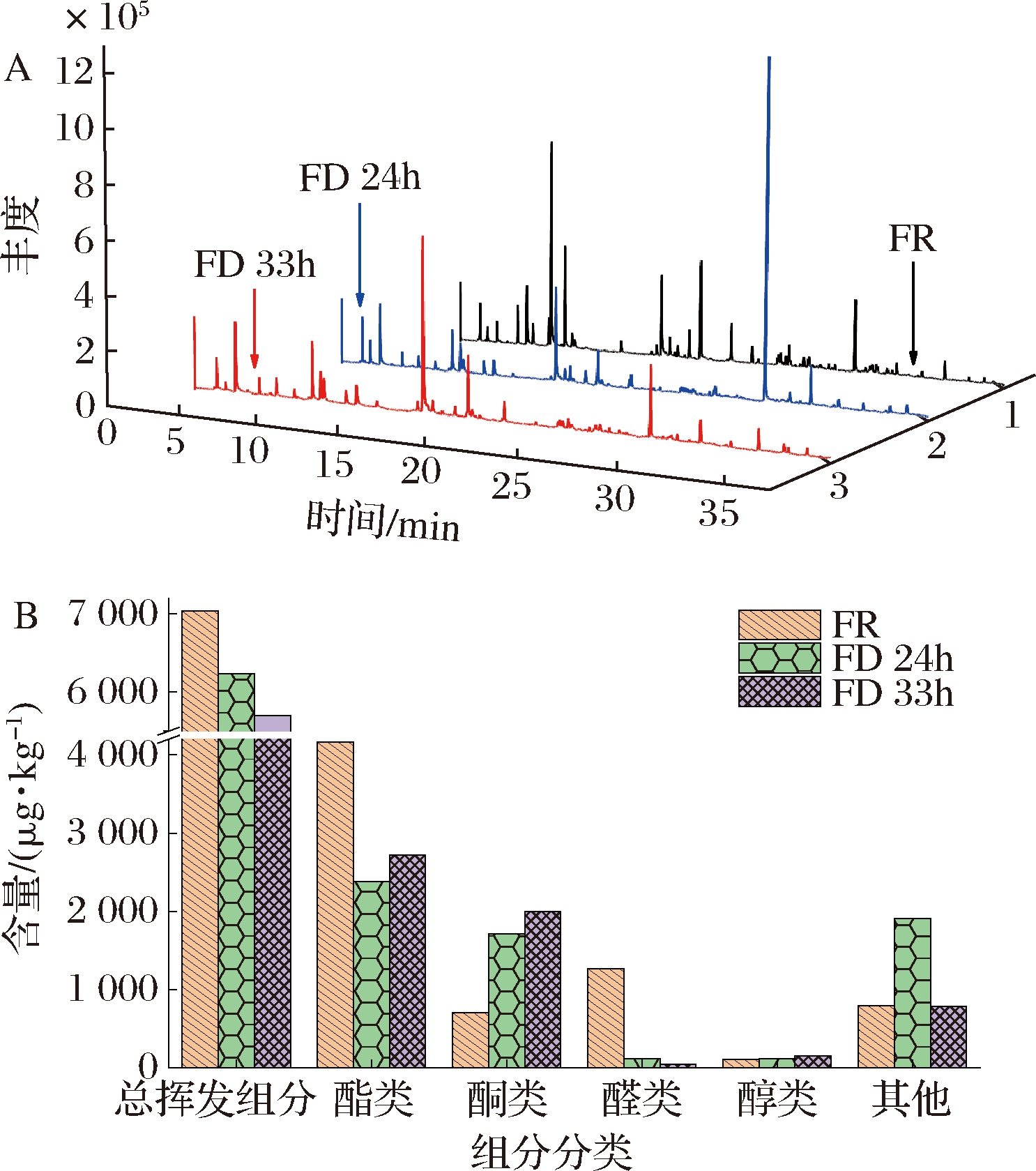
A-总离子流图;B-挥发性组分分类含量分布图
图4 不同香蕉样品总离子流图与挥发性组分 分类含量分布图
Fig.4 Total ion current diagram and volatile component content distribution diagram of different banana samples
表2 三种不同香蕉样品鉴定挥发性组分及含量
Table 2 Identified volatile components and contents of three different banana samples

组分号组分名称分子式CAS号保留指数RIRIrefRIactMFRMF相对含量/(μg· kg-1)FRFD 24hFD 33h72,3-丁二酮C4H6O2431-03-8595582.2795397537.59±0.7516.06±0.5615.86±0.528乙酸乙酯 C4H8O2141-78-6612587.27996996189.18±4.30325.64±9.68120.89±3.629异丁醇 C4H10O78-83-1625591.3982097514.45±0.327.98±0.2111.26±0.31112-戊酮C5H10O107-87-9685671.53996996291.76±7.83969.69±18.261 048.09±25.38132-戊醇 C5H12O6032-29-7703705.1591397521.60±0.6619.42±0.3519.93±0.7114乙酸丙酯C5H10O2109-60-4708713.438639829.71±0.836.58±0.1612.18±0.2115异戊醇C5H12O123-51-3736733.3492899313.99±0.4313.48±0.2820.82±0.4516乙酸异丁酯C6H12O2110-19-0771769.89991991356.47±11.04169.77±3.45237.20±4.87172-己酮C6H12O591-78-6790789.868779786.96±0.2815.76±0.3613.86±0.3518顺-3-己烯醛C6H10O6789-80-6800800.288309241.26±0.0410.31±0.289.46±0.3220己醛C6H12O66-25-1800801.36988991281.37±6.277.52±0.218.95±0.2821丁酸乙酯C6H12O2105-54-4802802.7691796523.71±0.4813.84±0.4118.07±0.5222乙酸丁酯C6H12O2123-86-4812813.09992995239.37±7.40139.13±3.24221.66±5.89241-甲基乙酸丁酯C7H14O2626-38-0849843.71990990261.42±5.21106.65±3.05125.44±3.84252-己烯醛C6H10O505-57-7851847.04985994924.32±17.390.13±0.000.06±0.0026反-2-己烯醛C6H10O6728-26-3854849.191398146.05±0.959.30±0.409.56±0.4227正己醇C6H14O111-27-3868867.8994398228.54±0.6226.93±0.5327.21±0.5928乙酸异戊酯C7H14O2123-92-2876873.81993993787.99±16.32351.40±7.28563.58±15.23312-庚酮C7H14O110-43-0891887.91983983189.27±6.86327.02±8.05334.18±9.25325-庚烯-2-酮C7H12O6714-00-7866893.04886910169.82±3.42196.12±5.21369.47±8.2435环戊酸乙烯酯C8H12O216523-06-1—919.928869250.01±0.00215.17±4.57196.72±6.21363-庚烯-2-酮C7H12O1119-44-4937931.399869860.22±0.00161.32±4.81190.10±3.8438丁酸异丁酯C8H16O2539-90-2955953.42987989125.27±3.7549.16±1.5290.35±2.82403,5-庚二烯-2-酮C7H10O18402-90-9—992.348509395.03±0.1413.31±0.4017.37±0.3241丁酸丁酯C8H16O2109-21-7995996.7897998987.12±2.7633.82±0.6483.96±2.5645乙酸己酯C8H16O2142-92-71 0111 015.4988988165.64±4.0692.43±1.85102.91±3.02474-己烯醇乙酯 C8H14O272 237-36-61 0201 022.8897399354.58±1.12165.36±3.5118.71±0.6548丁酸2-戊酯 C9H18O260 415-61-49701 027.6951994105.35±3.1528.57±0.7139.64±1.0549乙酸二甲基戊基乙酯C9H16O2——1 037.2983190033.78±1.098.58±0.2510.31±0.2850苯乙醛C8H8O122-78-11 0451 043.239489897.14±0.2575.66±2.5715.46±0.25511-甲基乙酸己酯C9H18O25921-82-41 0451 044.12871879284.09±6.23116.94±2.59104.33±2.95522,7-辛二醇C8H14O23578-51-0—1 058.468388806.19±0.1817.17±0.2620.88±0.5353丁酸异戊酯C9H18O2106-27-41 0561 060.22983983711.23±14.12252.07±6.86442.93±8.6854顺-5-辛烯-1-醇C8H16O64275-73-61 0741 065.7893696411.10±0.2422.71±0.5330.14±0.64572-壬酮C9H18O821-55-61 0921 091.568469886.50±0.1714.17±0.278.37±0.27582-甲基丁酸-3-甲基丁酯C10H20O227 625-35-01 1011 099.690097013.71±0.312.38±0.074.73±0.1259壬醛C9H18O124-19-61 1041 103.839629918.67±0.2911.44±0.344.10±0.1160异戊酸异戊酯C10H20O2659-70-11 1041 106.59984991269.39±5.6797.86±2.94133.34±3.2164戊烯酸甲基庚酯C13H24O2—1 4111 155.3381086523.38±0.5117.80±0.5216.78±0.3566并环戊二烯C8H126491-93-6—1 189.4187491135.74±0.7924.19±0.8126.43±0.8867丁酸己酯C10H20O22639-63-61 1921 191.8395897346.78±0.9825.24±0.7933.14±0.9868顺-3-辛烯-1-醇乙酸酯C12H22O269668-83-31 1951 195.9688388858.01±1.1522.24±0.6227.19±0.6469丁酸-4-己烯酯C10H18O2——1199.5689597413.10±0.2733.13±0.737.88±0.30721,2-环氧十六烷C16H32O7320-37-81 2061 205.5180287443.19±0.7618.71±0.5658.48±1.2373乙酸环己基乙酯C10H18O221722-83-81 2331 206.2790693140.87±0.9510.44±0.1917.25±0.5674丁酸-1-甲基已酯C11H22O239026-94-31 1971 211.4293294074.62±2.3119.23±0.3821.48±0.6576反-丁酸-2-甲基环己酯C11H20O215287-80-6—1 212.1281486529.93±0.519.32±0.317.81±0.16812-甲基丁酸己酯C11H22O210032-13-01 2441 242.5292498233.99±0.6113.71±0.3513.28±0.2882己酸异戊酯C11H22O22198-61-01 2521 250.6396297155.41±1.0526.89±0.6816.45±0.3885异丙烯基环己基甲醇C10H18O18479-64-61 2911 260.0583088914.42±0.298.39±0.3522.27±0.439311-(1-乙基丙基)二十一烷C26H5455282-11-6—1 300.8985090111.31±0.3010.00±0.268.32±0.2197丁香酚C10H12O2501-19-91 3751 350.77993993366.43±8.261 472.34±25.38325.86±10.26981-辛烯-3-丁酸酯C12H22O216491-54-6—1 375.0383790421.49±0.619.30±0.388.75±0.34102异丙烯基环己基甲乙酯C12H20O289116-19-81 4191 389.5389792030.31±0.858.32±0.3314.65±0.52104甲基丁香酚C11H14O293-15-21 4021 397.6797097340.39±1.1314.68±0.526.02±0.15105十四烷C14H30629-59-41 4001 400.7990097329.14±0.5926.80±0.6218.31±0.311086-乙基-4-庚烯基戊酸酯C13H24O21215128-07-61 4381 433.9384896816.72±0.458.50±0.217.07±0.19110反-2-甲氧基-4-(1-丙烯基苯酚)C10H12O25932-68-31 4541 444.1199199269.54±1.68171.83±4.12128.09±2.48113异丁香酚甲醚C11H14O293-16-31 4921 491.883791210.30±0.2612.42±0.287.63±0.26114十五烷C15H32629-62-91 5001 500.8194997828.06±0.7933.29±0.7625.34±0.67115榄香素C12H16O3487-11-61 5541 549.01966968106.98±2.9547.80±1.2492.85±3.021164-烯丙基-2,6-二甲氧基苯酚C11H14O36627-88-91 6081 593.459639711.83±0.0511.63±0.3832.94±0.68117十六烷C16H34544-76-31 6001 600.5195698319.98±0.4824.64±0.8221.79±0.54118三甲氧基丙烯基苯C12H16O35273-85-81 6541 627.6492796525.70±0.3838.40±0.8629.89±0.77
注:表中的“组分号”指在128个组分中的序号;“—”表示该组分在NIST 17质谱库中没有相应的CAS号或参考保留指数
2.3.2 OPLS-DA分类与差异挥发性组分分析
将鉴定的64个组分的峰面积导入SIMCA 14.1软件中进行OPLS-DA分析。如图5所示,FR、FD 24h和FD 33h三种样品的挥发性组分在OPLS-DA中很好区分出3个区域,说明尽管真空冷冻干燥处理是一种非热式干燥加工方法,对热敏性组分保存较好,但其仍然对香蕉挥发性组分含量和种类有影响,进而影响产品香气,并且其处理时间长短对香气也有影响。

图5 三种不同香蕉样品OPLS-DA分析
Fig.5 OPLS-DA analysis of three different banana samples
对3种香蕉样品挥发性组分再次在SIMCA 14.1软件两两分别建立OPLS-DA模型,得到FR组与FD24 h组(Ⅰ组)、FR组与FD 33h组(Ⅱ组)、FD 24h组与FD 33h组(Ⅲ组)的倍数变化(fold change,FC)和T检验的P值,以|log2FC|>1且P<0.05筛选出两组间的差异组分,通过火山图直观显示差异组分的分布情况,其中图6-A是FR组与FD 24h组的组分差异情况(显著下调26个、显著上调15个,无显著变化23个);图6-B是FR组与FD 33h组的组分差异情况(显著下调21个,显著上调10个,无显著变化33个),图6-C是FD 24h组与FD 33h组的组分差异情况(显著下调6个,显著上调4个,无显著变化54个)。由图6可知,FR样品与FD样品的差异明显,其中FR样品与FD 24h样品的挥发性组分有41个差异组分,FR样品与FD 33h样品有31个差异组分;FD处理的2种样品的挥发性组分差异小,只有10个显著差异组分。结合表1分析,相对于FR组,无论是FD 24h组还是FD 33h组,最大差异的4个组分均为20号(己醛)、25号(2-己烯醛)和35号(环戊酸乙烯酯)、36号(3-庚烯-2-酮),前两个是下调,后两个是上调。

A-FR组与FD 24h组;B-FR组与FD 33h组; C-FD 24h组与FD 33h组
图6 差异挥发性组分火山图
Fig.6 Volcano plots of volatile components from three different banana samples
图7是Ⅰ组、Ⅱ组和Ⅲ组的差异组分的韦恩图。由图7可知,Ⅰ组特有的差异组分有9个[乙酸异丁酯、2-己酮、1-甲基乙酸丁酯、乙酸异戊酯、丁酸异丁酯、丁酸异戊酯、2-壬酮、(E)-2-甲氧基-4-(1-丙烯基苯酚)、榄香素],Ⅱ组特有的差异组分有3个(5-庚烯-2-酮、壬醛、6-乙基-4-庚烯基戊酸酯),Ⅲ组特有的差异组分有2个(乙酸乙酯、异丙烯基环己基甲醇),Ⅰ组与Ⅱ组的共同差异组分有24个,Ⅰ组、Ⅱ组和Ⅲ组共同的差异组分有4个(4-己烯醇乙酯、苯乙醛、甲基丁香酚、4-烯丙基-2,6-二甲氧基苯酚)。
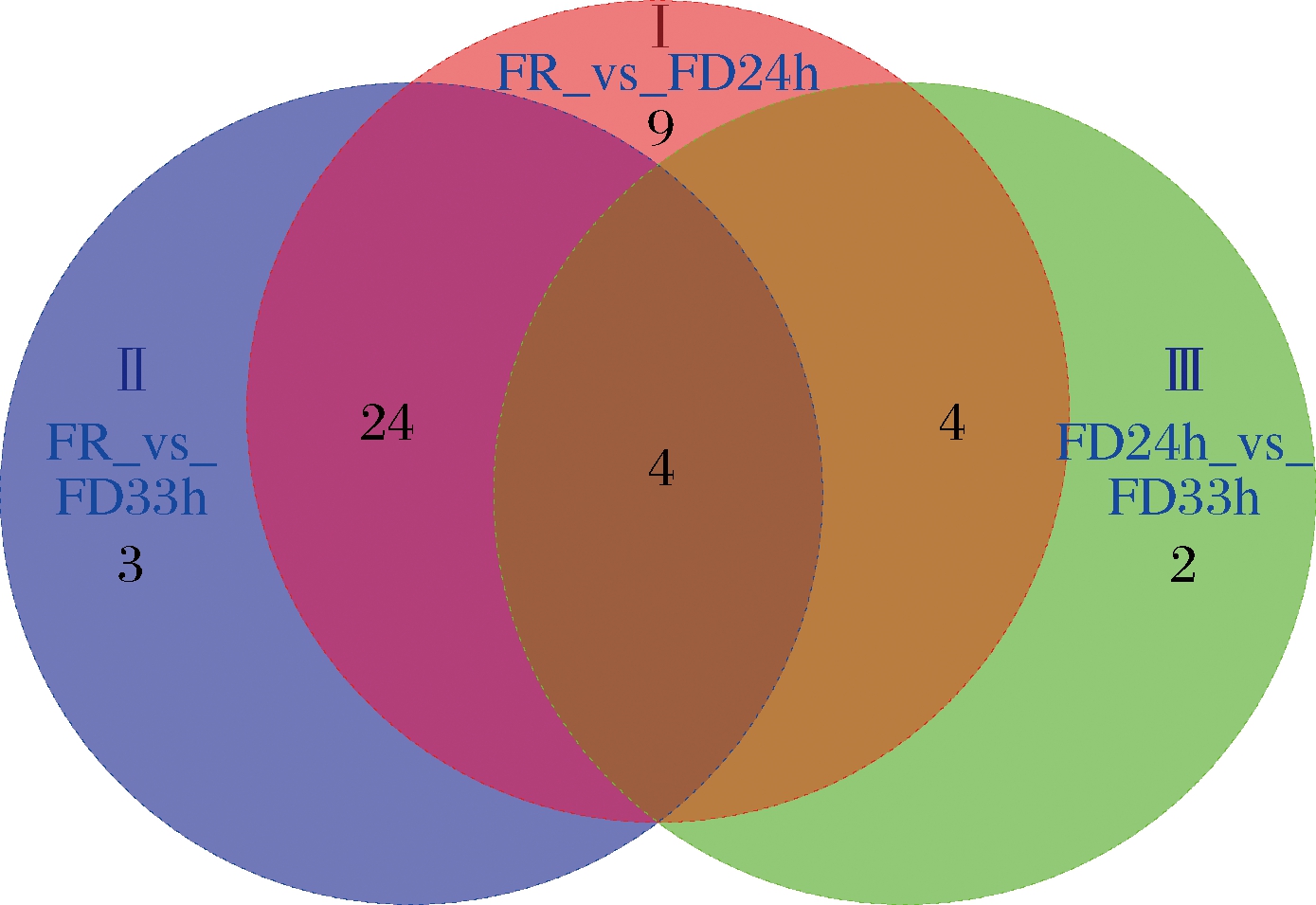
图7 差异性组分的韦恩图
Fig.7 Venn diagram of differential components
3 结论
本研究探索了生鲜香蕉和不同真空冷冻干燥时间的香蕉的品质和挥发性组分的差异。生鲜香蕉、真空冷冻干燥时间24 h和33 h的香蕉粉3种香蕉样品的含水率、总酚含量、DPPH自由基清除率有类似的下降趋势,香蕉片真空冷冻干燥24 h的品质保持优于33 h。GC-MS测定后共鉴定出3种样品果肉64个挥发性组分,生鲜香蕉的香气组分以酯类、醛类还有酮类为主,而冷冻干燥后的样品以酯类和酮类为主,醛类占比很低。3种香蕉样品的挥发性组分均有差异,其中生鲜香蕉与2种真空冷冻干燥样品的差异较大,2种真空冷冻干燥样品的差异小;真空冷冻干燥处理的2组样品与生鲜香蕉有共同的最大差异的4个组分为己醛、2-己烯醛、环戊酸乙烯酯、3-庚烯-2-酮;3种样品两两比较,共有的差异组分有4个(4-己烯醇乙酯、苯乙醛、甲基丁香酚、4-烯丙基-2,6-二甲氧基苯酚)。可见,尽管真空冷冻干燥技术是一种先进的非热加工技术,但采用该技术处理干燥生鲜香蕉片后,与生鲜香蕉的挥发性组分还是存在较大差异,这些差异有可能是由于加工过程中损失或浓缩导致,有待进一步研究。而真空冷冻干燥时间对挥发性组分的损失影响较大,从而影响了香蕉粉的香气组分,综合考虑香蕉粉的耐贮性、品质和香气,对于0.5 cm厚度的香蕉片采用真空冷冻干燥时间为24 h更合适,结果可为研制香蕉粉代餐食品提供参考。
[1] 孙健, 何雪梅, 唐雅园, 等.香蕉加工研究进展[J].热带作物学报, 2020,41(10):2 022-2 033.
SUN J, HE X M, TANG Y Y, et al.Research progress of banana processing[J].Chinese Journal of Tropical Crops, 2020, 41 (10):2 022-2 033.
[2] 张宏康, 林小可, 李蔼琪, 等.香蕉加工研究进展[J].食品研究与开发, 2017,38(12):201-206.
ZHANG H K, LIN X K, LI A Q, et al.Research advances on the processing of banana[J].Food Research and Development, 2017,38(12):201-206.
[3] 姜唯唯, 刘刚, 张晓喻, 等.微波真空冷冻干燥对芒果干制品品质特性的影响[J].食品科学, 2012,33(18):49-52.
JIANG W W, LIU G, ZHANG X Y, et al.Effect of microwave vacuum freeze drying on the quality of dried mango[J].Food Science, 2012, 33(18):49-52.
[4] 李珂昕, 蔡敬民, 胡勇, 等.干燥方法对蓝莓果粉品质的影响[J].中国南方果树, 2019, 48(6):98-102.
LI K X, CAI J M, HU Y, et al.Effects of different drying methods on quality of blueberry fruit powder[J].South China Fruits, 2019,48(6):98-102.
[5] 赖长鸿, 王忠合, 王军, 等.香蕉成熟度对香蕉粉中营养成分及功能特性的影响[J].食品科技, 2016,41(7):92-96.
LAI C H, WANG Z H, WANG J, et al.Effect of maturities on nutritional components and functional properties of banana powder[J].Food Science and Technology, 2016,41(7):92-96.
[6] 庄远红, 刘静娜, 钟文娟, 等.真空冷冻干燥香蕉片的工艺研究[J].漳州师范学院学报(自然科学版), 2011,24(1):87-92.
ZHUANG Y H, LIU J N, ZHONG W J, et al.Study on process of banana-slice under vacuum freeze- drying[J].Journal of Zhangzhou Normal University(Natural Science), 2011,24(1):87-92.
[7] 何艾, 谢辉, 窦志浩, 等.芭蕉片的真空冷冻干燥工艺[J].食品工业, 2012,33(9):1-4.
HE A, XIE H, DOU Z H, et al.Vacuum freeze-drying processing of Musa basjoo Sieb.Et zucc slice[J].The Food Industry, 2012, 33(9):1-4.
[8] WANG J, LI Y Z, CHEN R R, et al.Comparison of volatiles of banana powder dehydrated by vacuum belt drying, freeze-drying and air-drying[J].Food Chemistry, 2007,104(4):1 516-1 521.
[9] 毕玉. 成熟度对香蕉粉理化性质及其淀粉消化性和精细结构的影响[D].无锡:江南大学, 2018.
BI Y.Effect of ripening on physicochemical properties, starch digestibility and starch fine structure of banana flour[D].Wuxi:Jiangnan University, 2018.
[10] 蒋盈盈, 卿志星.基于GC-MS技术分析香蕉成熟前后香味物质变化[J].热带农业科学, 2020,40(11):102-106.
JIANG Y Y, QING Z X.Analysis of the volatile components of unripe and ripe banana fruit by GC-MS[J].Chinese Journal of Tropical Agriculture, 2020,40(11):102-106.
[11] 焦丹. 果蔬干燥品质试验研究[D].西安:陕西科技大学, 2017.
JIAO D.Experimental study on drying quality of fruit and vegetable[D].Xi′an:Shaanxi University of Science and Technology, 2017.
[12] 黄华梅, 杨昌鹏, 陈智理, 等.香蕉果酒褐变抑制研究[J].安徽农业科学, 2011, 39 (21):13 091-13 093.
HUANG H M, YANG C P, CHEN Z L, et al.Study on the inhibition method of banana wine browning[J].Journal of Anhui Agricultural Sciences, 2011, 39 (21):13 091-13 093.
[13] 陈蓬凤, 梅新, 黄师荣, 等.不同品种薯尖的总酚、总黄酮含量及抗氧化活性比较[J].现代食品科技, 2021,37(3):132-138;15.
CHEN P F, MEI X, HUANG S R, et al.Comparison of the total phenolics, total flavonoids and antioxidant activities in potato tips of different varieties[J].Modern Food Science and Technology, 2021,37(3):132-138;15.
[14] 王定美, 陈新富, 麦力文, 等.木薯叶抗氧化能力与总黄酮含量及其关系研究[J].食品研究与开发, 2021,42(2):37-43.
WANG D M, CHEN X F, MAI L W, et al.Study on the relationship between antioxidant capacity and total flavonoids contents of cassava leaves[J].Food Research and Development, 2021, 42(2):37-43.
[15] 张岩, 邹琴艳, 吴帅, 等.不同石榴品种果实不同部位酚类物质含量和抗氧化能力比较[J].农学学报, 2020,10(12):57-67.
ZHANG Y, ZOU Q Y, WU S, et al.Comparison of phenolic content and antioxidant capacity in fruit parts of different pomegranate varieties[J].Journal of Agriculture, 2020,10(12):57-67.
[16] TSUGAWA H, CAJKA T, KIND T, et al.MS-DIAL:Data-independent MS/MS deconvolution for comprehensive metabolome analysis[J].Nature Methods, 2015,12(6):523-526.
[17] BUSZEWSKA-FORAJTA M, BUJAK R, YUMBA-MPANGA A, et al.GC/MS technique and AMDIS software application in identification of hydrophobic compounds of grasshoppers' abdominal secretion (Chorthippus spp.)[J].Journal of Pharmaceutical and Biomedical Analysis, 2015,102:331-339.
[18] 蒋彤, 吕新林, 凌华山, 等.南酸枣皮果酒的化学成分和体外生物活性研究[J].食品研究与开发, 2021,42(3):1-7.
JIANG T, LYU X L, LING H S, et al.Chemical components and in vitro biological activities of Choerospondias axillaris fruit peel wine[J].Food Research and Development, 2021,42(3):1-7.
[19] 王晨慧, 李春扬, 张晓磊, 等.山药酒中甾醇含量测定及清除DPPH自由基活性研究[J].中国酿造, 2020,39(11):62-65.
WANG C H, LI C Y, ZHANG X L, et al.Determination of sterol content and elimination of DPPH free radical activity of yam alcoholic drinks[J].China Brewing, 2020,39(11):62-65.
[20] 张文灿, 林莹, 刘小玲, 等.香蕉全果实果汁香气成分分析[J].食品与发酵工业, 2010, 36(3):133-140.
ZHANG W C, LIN Y, LIU X L, et al.Analysis of aroma components of whole banana juice[J].Food and Fermentation Industries, 2010, 36(3):133-140.
[21] 申建梅, 曾玲, 胡黎明, 等.香蕉果实挥发物的化学成分比较分析[J].环境昆虫学报, 2011,33(2):277-281.
SHEN J M, ZENG L, HU L M, et al.Comparative analysis of volatile components of banana[J].Journal of Environmental Entomology, 2011, 33(2):277-281.
[22] 朱孝扬, 李秋棉, 罗均, 等.粉蕉后熟过程中香气品质变化及其关键基因表达特性[J].食品科学, 2019,40(17):96-103.
ZHU X Y, LI Q M, LUO J, et al.Evolution of aroma components and key gene expression during postharvest ripening of banana (Musa ABB pisang awak) [J].Food Science, 2019,40(17):96-103.