每年青稞酒制造厂会产生大量酒糟,青稞酒糟(highland barley fermentation spent,HBFS)的蛋白质质量较高,研究青稞酒糟中的蛋白质是实现青稞酒糟合理化利用的基础,同时能有效缓解环境污染,减少酒糟的丢弃浪费,节约大量资源。
青稞酒糟粗蛋白是制备青稞酒糟多肽[1]的主要原料,干酒糟中含有大量蛋白质,蛋白质的含量为14.3%~21.8%[2]。目前酒糟中蛋白质的提取方法主要有醇碱法[3]、碱法[4]和酶法[5]。醇碱法、碱法主要是利用碱提酸沉的原理,将酒糟蛋白溶解到稀碱溶液中,再将溶液pH降低至蛋白质等电点,使酒糟蛋白沉淀析出;而酶法则是利用酶破坏细胞壁结构,通过提高蛋白质在提取溶剂中的溶解度,提高粗蛋白的得率。
有学者[6]通过从咖啡残渣发酵物中提取蛋白,再通过胃蛋白酶和胰蛋白酶进行消化得到水解肽,这实验充分表明酒糟中也含有一定的多肽;国外学者发现多肽类物质具有一定抗氧化作用[7],也能治疗由酒精引起的炎症[8],从啤酒麦糟(brewers′ spent grain,BSG)中提取出具有良好抗氧化性的酚酸,能有效进行高血压管理[9],同时也有学者通过对蒸馏废谷物(distiller′s spent grain,DSG)的研究发现发酵后的谷物蛋白质对血管紧张素转化酶(angiotensin converting enzyme,ACE)[10]、葡萄糖和淀粉酶活性[11]具有抑制作用。这些也为青稞酒糟多肽的研究提供了参考。
目前国内对于青稞酒糟多肽的提取工艺及其功能性研究较少,本实验旨在为进一步利用HBFS提供理论参考,使HBFS各组分得到合理的资源化利用。
1 材料与方法
1.1 材料与试剂
HBFS,青海西宁天佑德青稞酒厂;碱性蛋白酶(200 U/mg)、木瓜蛋白酶(800 U/mg)、复合蛋白酶(120 U/mg)、动物蛋白酶(100 000 U/g)、风味蛋白酶(20 U/mg)、中性蛋白酶(100 U/mg),源叶生物;牛血清蛋白V,北京索莱宝科技有限公司。
1.2 仪器与设备
ESJ110-413电子分析天平,沈阳龙腾电子有限公司;DGX-9073B电热鼓风干燥机,上海南荣实验室设备有限公司;G555-9真空冷冻干燥机,基因有限公司;H/T16MM台式高速离心机、LR-10M高速冷冻离心机,湖南赫西仪器装备有限公司;HJ-4A数显恒温多头磁力搅拌器,峥嵘仪器;pHS-3C精密pH计,上海佑科仪器仪表有限公司;HH-6数显恒温水浴锅,常州市金坛友联仪器研究所;SHB-III循环水式多用真空泵,郑州长城科工贸有限公司;AKTApure 25M蛋白层析系统,江苏汉邦科技有限公司;UV-1780双光束紫外可见分光光度计,苏州岛津仪器有限公司。
1.3 实验方法
1.3.1 青稞酒糟蛋白质的提取[12]
(1)醇碱法:取一定量新鲜酒糟粉末,加入醇碱混合液[V(95%乙醇)∶V(0.5 mol/L NaOH)=1∶2],固液比1∶40,搅拌240 min。离心后取上清液,使用1 mol/L盐酸调节滤液pH至4.7,静置沉淀后离心,得到粗蛋白沉淀,加水调节至中性,取滤液,放入离心机离心,得到粗蛋白沉淀,冷冻干燥。
(2)碱法:取一定量新鲜酒糟粉末,加入0.5 mol/L NaOH,固液比1∶35,搅拌240 min。离心后取上清液,使用1 mol/L盐酸调节滤液pH至5.2,静置沉淀。放入离心机离心,得到粗蛋白沉淀,加水调节至中性,取滤液,放入离心机离心,得到粗蛋白沉淀,冷冻干燥。
(3)酸法:取一定量新鲜酒糟粉末,加入盐酸、乙醇溶液、0.25%亚硫酸钠,固液比1∶10(g∶mL),搅拌240 min。离心后取上清液,真空减压浓缩,静置沉淀。放入离心机离心,得到粗蛋白沉淀,加水洗涤,取滤液,放入离心机离心,得到蛋白沉淀,冷冻干燥。
1.3.2 青稞酒糟蛋白质含量的测定
根据福林酚法测定蛋白质含量,取2 mg青稞酒糟蛋白粉溶于10 mL蒸馏水中,得到200 μg/mL的蛋白溶液,吸取1 mL蛋白溶液,加入5 mL福林酚试剂甲混匀,于20~25 ℃保温10 min,再吸取0.5 mL福林酚,立即摇匀,于20~25 ℃保温20 min,然后于500 nm处比色。以1 mL蒸馏水代替蛋白溶液做空白参照。
1.3.3 青稞酒糟蛋白定性定量分析
向蛋白溶液中加入2%脱氧胆酸钠(sodium deoxycholate,SDC)溶液,95 ℃煮10 min,超声探头超声10 min对蛋白进行变性。按50∶1加入Trypsin胰蛋白酶,37 ℃孵育振荡过夜酶切。加入三氯乙酸(trifluoroacetic acid,TFA)终止酶切,调节溶液pH值在6.0左右,12 000×g离心15 min,使用SDB小柱进行除盐。除盐后的肽段溶液经离心浓缩仪抽干后,冻存于-20 ℃等待上机检测。
使用Q Exactive Plus液质联用系统进行质谱分析。利用纳升流速的液相UltiMate 3000 RSLCnano系统分离样品。肽段样品经过上样缓冲液溶解,由自动进样器吸入后结合至C18捕获柱(3 μm,120 Å,100 μm×20 mm),接着被洗脱至分析柱(2 μm,120 Å,75 μm×150 mm)进行分离。利用2个流动相(流动相A:3%二甲基亚砜和0.1%甲酸水溶液,流动相B:3%二甲基亚砜和0.1%甲酸乙腈溶液)建立分析梯度。液相的流速设置为300 mL/min。质谱DDA模式分析时,每个扫描循环中包含1个MS全扫描(R=70 K,AGC=3e6,max IT=20 ms,扫描范围=350~1 800 m/z),以及随后的15个MS/MS扫描(R=17.5 K,AGC=2e5,max IT=100 ms)。HCD碰撞能量设置为28。四级杆的筛选窗口设置为1.6 Da。离子重复采集的动态排除时间设置为35 s。
1.3.4 青稞酒糟蛋白质的纯化[13]
采用AKTA pure蛋白核酸纯化仪和5 mL的HiTrap DEAE FF离子交换层析柱进行蛋白纯化,整个纯化过程流速控制在2 mL/min。取3 mg不同方法提取的青稞酒糟蛋白粉溶于10 mL PBS缓冲液中,放入离心机离心后,取上清液。纯化过程如下:
(1)柱平衡及上样。用5个柱体积的PBS缓冲液(0.2 mol/L,pH 7.0)平衡离子交换柱,以5 mL/min的流速将青稞酒糟粗蛋白泵入。
(2)清洗杂质蛋白。用5个柱体积的PBS缓冲液充分冲洗,除去未结合蛋白。
(3)梯度洗脱。设置30%、50%和80% 3种梯度依次洗脱20个柱体积,洗下目标蛋白并进行收集。
(4)泵洗及卸层析柱。用2 mol/L NaCl将未完全洗脱的蛋白质冲洗下来。
1.3.5 青稞酒糟多肽的制备
酶解前水洗除杂:取10 g青稞酒糟蛋白粉,按1∶6(g∶mL)的比例加水,在60 ℃的水浴锅中恒温振荡30 min后,离心。
酶解[14]:取1 g青稞酒糟蛋白,加入30 mL蒸馏水,用1 mol/L NaOH溶液调节pH,添加适量酶,水解240 min,于90 ℃水浴锅中灭活15 min,离心(4 000 r/min,15 min),取上清液,冻干。不同种类蛋白酶酶解条件如表1所示。
表1 不同蛋白酶最适pH值、温度及酶活力
Table 1 The optimum pH,temperature and enzyme activity of different proteases
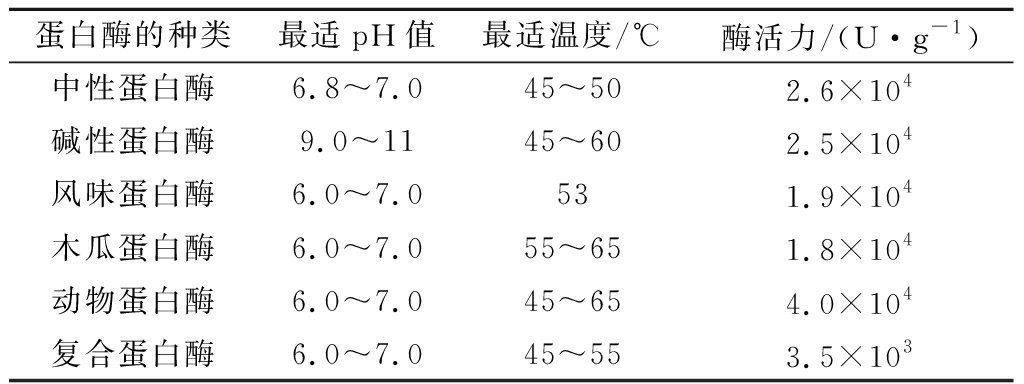
蛋白酶的种类最适pH值最适温度/℃酶活力/(U·g-1)中性蛋白酶6.8~7.045~502.6×104碱性蛋白酶9.0~1145~602.5×104风味蛋白酶6.0~7.0531.9×104木瓜蛋白酶6.0~7.055~651.8×104动物蛋白酶6.0~7.045~654.0×104复合蛋白酶6.0~7.045~553.5×103
1.3.6 青稞酒糟多肽水解度的测定
采用甲醛滴定法[15]测定。
1.3.7 青稞酒糟多肽对乙醇脱氢酶(alcohol dehydrogenase,ADH)的激活效果
参考王培宇[16]的实验方法进行检测。
1.3.8 青稞酒糟多肽的体外抗氧化实验
1.3.8.1 对DPPH自由基的清除效果
参考曹磊等[17]的实验方法稍作修改,进行检测。
1.3.8.2 对羟自由基(·OH)的清除效果
参考郭辉等[18]的实验方法,进行检测。
1.3.8.3 对超氧阴离子自由基![]() 的清除效果
的清除效果
参考马吉瑶等[19]的实验方法,进行检测。
1.4 数据统计与分析
采用IBM SPSS statistics 24软件中的方差分析法进行显著性分析,以P<0.05表示差异显著,绘图软件选用OriginPro软件。
2 结果与分析
2.1 青稞酒糟蛋白质的提取
以牛血清蛋白为标品,得到线性方程y=0.001 4x+0.007 2,R2=0.991 9,线性关系良好,根据标曲计算蛋白含量。
由图1可知,通过醇碱法提取HBFS中的蛋白得率高于碱法和酸法,其中醇碱法得率是酸法的2倍左右。结果与侯梦媛[20]实验结果(7.091%,纯度95.20%)大体一致,但也存在略微差异,主要原因应该是酸法提取时加入大量强酸溶液,导致蛋白质水解,使蛋白质得率降低。周红等[21]研究表明,不同品种青稞中粗蛋白含量平均值为13.32%,变幅为12.19%~14.07%,其中Z523青稞蛋白质含量最高为14.07%;李倩[22]研究表明,青稞酒糟蛋白中粗蛋白含量为23.57%,经过对比说明青稞在酿造过程中,蛋白质含量升高,这与侯梦媛[20]的研究结果相符,酒糟在酿造过程中四大种类蛋白质清蛋白、谷蛋白、醇溶蛋白和球蛋白的含量均呈上升趋势。
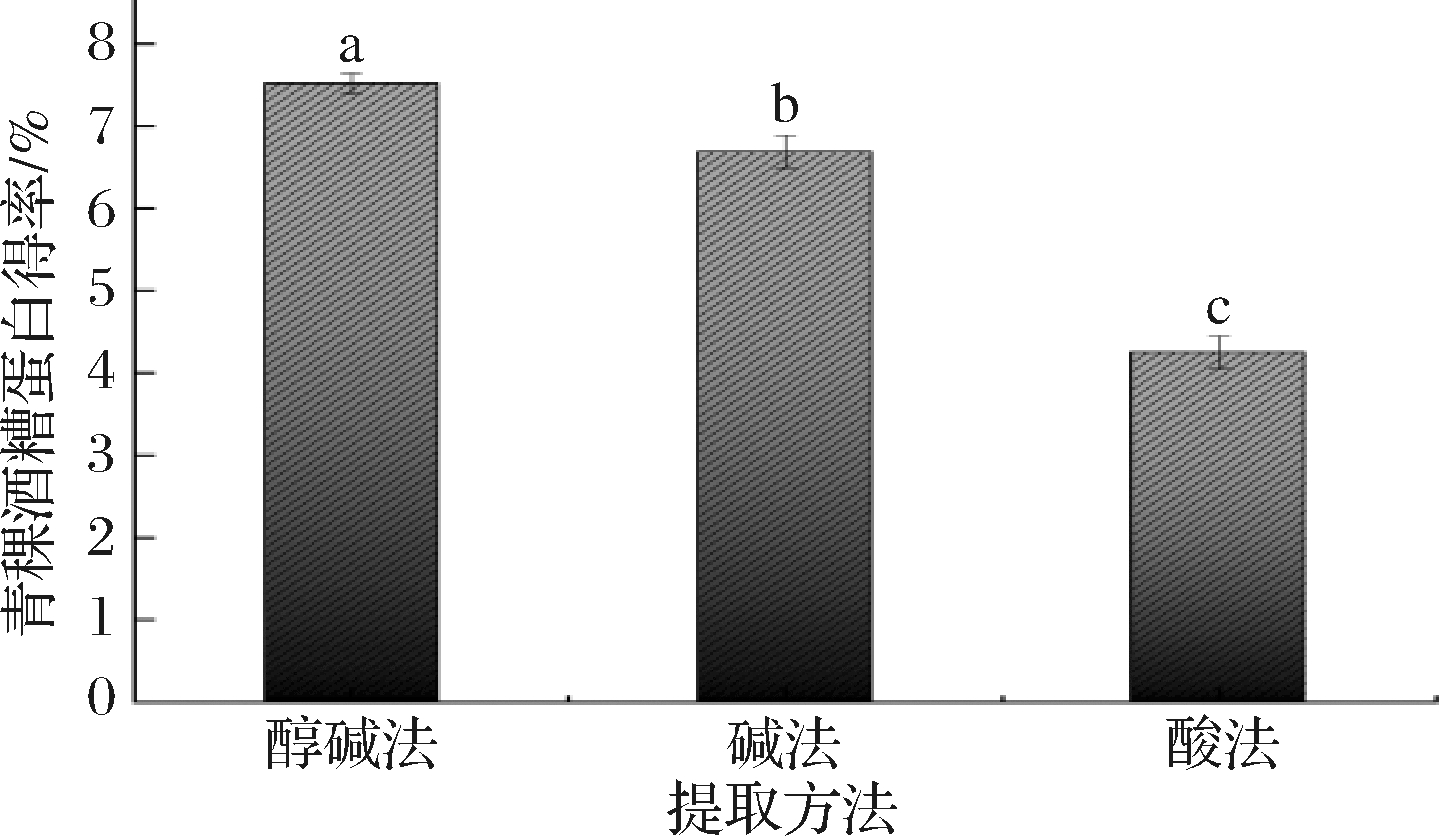
图1 不同提取方法对青稞酒糟蛋白得率的影响
Fig.1 Effect on different extraction methods on protein yield
注:不同小写字母表示差异显著(下同)
2.2 青稞酒糟多肽的制备
2.2.1 不同种类酶对青稞酒糟蛋白质的酶解影响
由表2可知,在各个酶最适条件下,碱性蛋白酶水解液的水解度最高,达到10.61%,这与其他文献所述内容是一致的。不同种类酶对青稞酒糟蛋白的酶解结果差异较大,主要考虑是酶解使用的青稞酒糟蛋白是醇碱法提取的,而碱性蛋白酶的最适作用条件是碱性环境,更有利于碱性蛋白酶作用于酶切位点,亮氨酸、异亮氨酸、缬氨酸终端[23]。因此碱性蛋白酶酶解产物水解程度更高。
表2 不同种类酶对青稞酒糟蛋白的酶解效果
Table 2 The enzymatic hydrolysis effect of different kinds of enzymes
酶动物蛋白酶风味蛋白酶中性蛋白酶碱性蛋白酶复合蛋白酶木瓜蛋白酶水解度/%4.71±0.14d9.67±0.15b5.3±0.19c10.61±0.15a4.12±0.10e2.94±0.10f
注:不同小写字母表示差异显著(P<0.05)
2.2.2 青稞酒糟多肽对ADH的激活影响
由图2可知,青稞酒糟多肽具有较强的ADH激活率,这充分表明青稞酒糟多肽有助于稳定的产生NAD+,从而抑制血醇浓度升高,具有较好的醒酒效果。同时由图2中可以看出碱性蛋白酶和风味蛋白酶的醒酒活性优于其他种类水解酶,原因可能是这两类蛋白酶酶解产物的水解度更高,酶解产物中含有更多低分子质量多肽。与郭辉等[18]相对分子质量小的多肽对ADH起主要的激活效果的结论相符。李萌[24]通过动物实验进一步验证绿豆多肽对ADH活性的影响,当绿豆多肽质量浓度为0.8 g/mL时,对ADH活性激活效果明显,尤其是分子质量为5 000 Da的绿豆多肽对ADH的激活效果优于高分子质量绿豆多肽。宁庆鹏[25]研究表明,花生粕多肽酶解浓度为81.78%时,对ADH的激活率20.14%,当花生粕多肽的分子质量在1 000~3 000 Da时,具有最优的激活效果,低分子质量多肽是激活ADH的最有效成分。
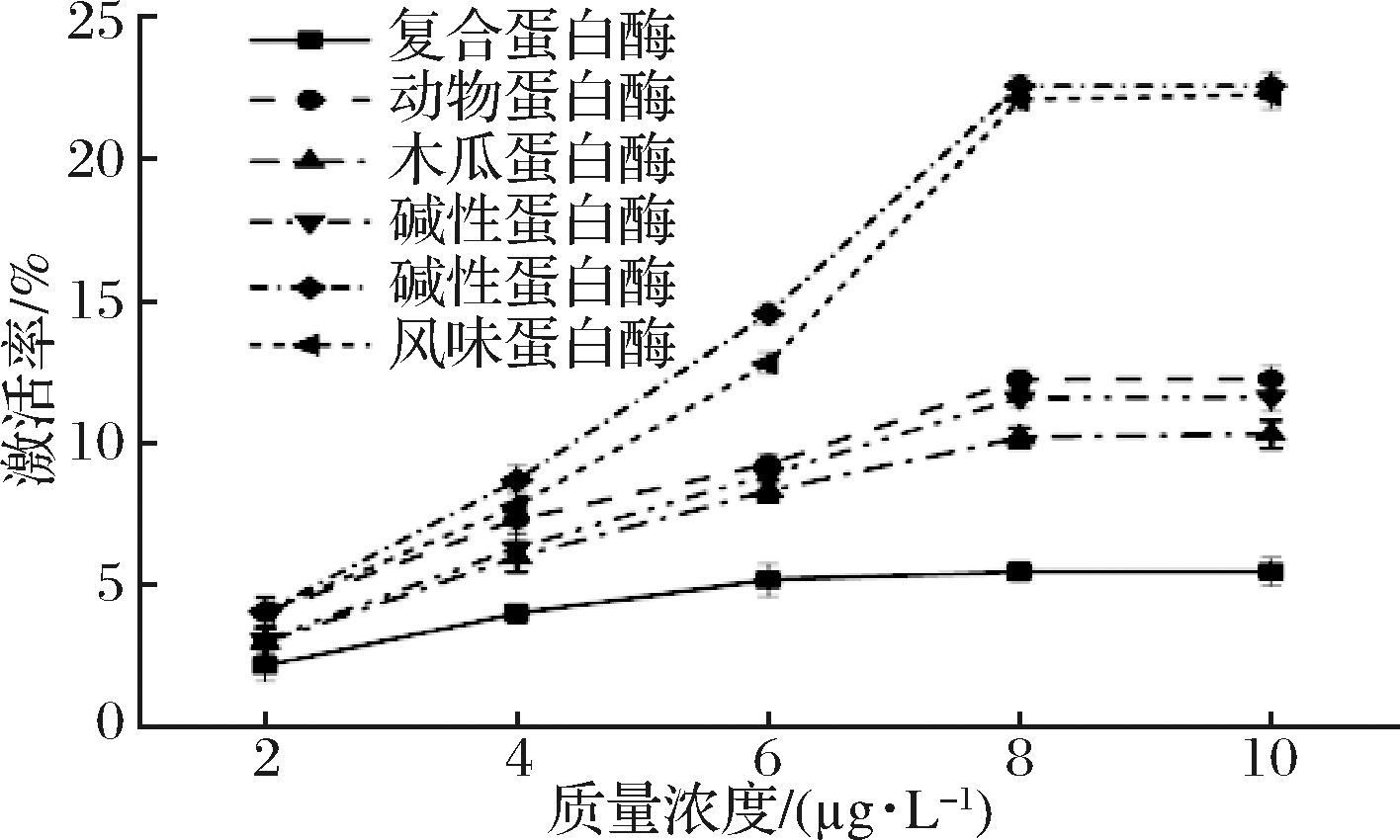
图2 不同种类蛋白酶酶解的青稞酒糟多肽对ADH的激活效果
Fig.2 Activation effect of polypeptides hydrolyzed by different kinds of proteases on ADH
2.3 青稞酒糟蛋白定性定量分析
对比图3-a、3-b、3-c中峰值出现的位置均是在50%梯度洗脱时,这表明3种不同方法提取的主要蛋白种类相同,而三者峰值出现时间不同,可以考虑为3种提取方法得到的蛋白溶液pH存在差异,导致蛋白质与DEAE离子交换层析柱的结合力不同,其中醇碱法中蛋白与DEAE层析柱间结合力强于酸法和碱法提取的蛋白,因此醇碱法峰值出现最晚。

a-纯化醇碱法提取的青稞酒糟蛋白;b-纯化碱法提取的青稞酒糟蛋白;c-纯化酸法提取的青稞酒糟蛋白
图3 纯化不同方法提取的青稞酒糟蛋白
Fig.3 Purification of barley lees protein extracted by different methods
同时由图4可以看出,通过AKTA pure蛋白纯化仪纯化后的青稞酒糟蛋白的纯度得到明显的提升,纯化后的酒糟蛋白纯度远优于纯化前。
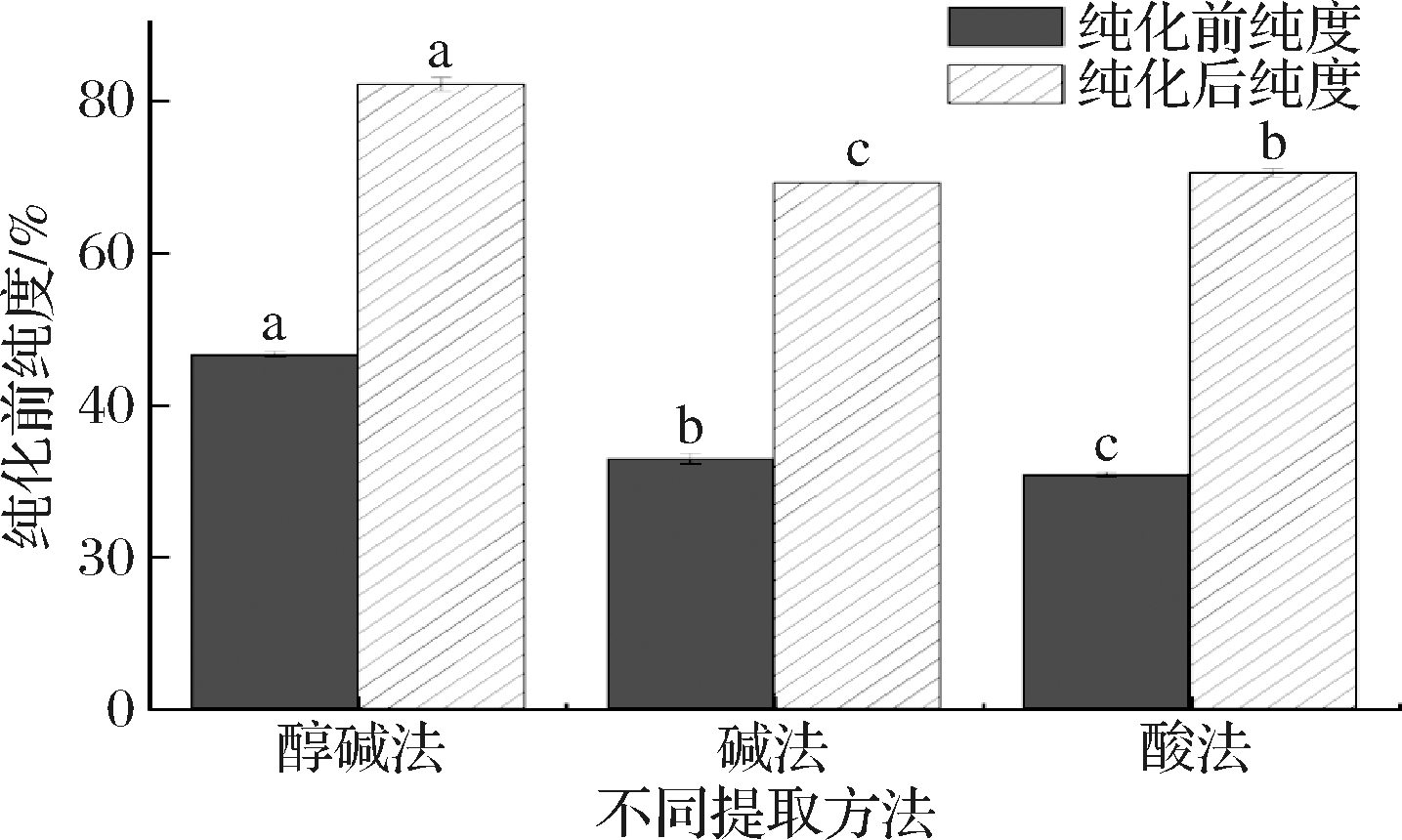
图4 纯化前后青稞酒糟蛋白的纯度对比
Fig.4 Comparison of protein purity before and after purification
对纯化后蛋白样品经质谱检测,共鉴定到29个蛋白的38个肽段,其中29个蛋白获得准确定量信息。通过比较醇碱法和碱法2种不同方法提取的蛋白质,筛选出11种差异蛋白,将各个样本的相对定量值取对数(log2x),使其符合正态分布,结果如图5所示。

图5 蛋白定量信息总览
Fig.5 Overview of protein quantification information
由表3可知,物质运输、代谢途径、生物合成、生物调节等是11种差异蛋白比较集中的15个生物学途径。其中物质运输、代谢途径、生物合成和生物调节类蛋白质数量较多,分别占所有差异蛋白的10.34%、10.34%和6.90%。根据GO功能富集分析显示,青稞酒糟蛋白在有机物代谢、NADH再生、对氧化应激的反应、转移酶活性、碳水化合物运输和代谢、RNA加工和翻译后修饰、囊泡运输(图6-a)方面最为丰富。具有胞内细胞器(intracellular organelle)、核糖核蛋白复合物(ribonucleoprotein complex)、催化络合物(catalytic complex)等是差异蛋白主要的10种细胞组分,其中胞内细胞器、核糖核蛋白复合物和催化络合物分别占51.43%、11.43%和8.57%(图6-b)。富集到有机环化合物(organic cyclic compound binding)、离子结合(lon binding)、染色质结合(chromatin binding)、超氧化物歧化酶活性(superoxide dismutase activity)和转录调节因子(transciption regulator activity)5种主要执行的分子功能(图6-c),其中有机环化合物占42.86%,离子结合占21.43%,染色质结合占14.29%,超氧化物歧化酶活性14.29%,转录调节因子占7.14%。图7为最显著的15条代谢通路分析结果,显示差异基因主要与微生物代谢、过氧化物酶体、氧化磷酸化和次生代谢物的生物合成有关。
表3 差异蛋白
Table 3 Differential proteins

蛋白ID蛋白名称蛋白质功能A0A287HHJ1未知蛋白铁离子结合;单氧酶活性氧化酶活性;结合或减少分子氧P0CQ5160 S核糖体蛋白L44核糖体的结构成分;对抗生素的反应;对环氧化物的反应P83684超氧化物歧化酶破坏通常在细胞内产生、对生物系统有毒的激进分子;催化2H++2·O-2=H2O2+O2P404872-(3-氨基-3-卡博西丙基)希斯蒂丁合成酶子单元1这种蛋白质参与多肽-二甲酰胺生物合成,这是蛋白质修饰的一部分Q9UUH0未知蛋白水激光活动;GPI锚生物合成过程Q4 WLW5非溴化肽合成酶fmqA乙酰载体活动;韧带活性;磷酸盐结合;富米奎纳佐林C生物合成过程;非溴化肽生物合成过程;发病机制;二次代谢过程A0A287HVA4NUC153含域蛋白rRNA处理M0UM50含PUM-HD域的蛋白质RNA绑定Q06704内质和肌素同源蛋白1高尔基体到血浆膜蛋白运输;对内质性视状动脉压力的反应;囊泡介质运输Q99382SRP独立靶向蛋白2蛋白质运输;真空蛋白加工P0CR53预mRNA拼接因子SLU7参与前mRNA拼接;与金属离子结合

a-青稞酒糟蛋白参与的生物学过程;b-青稞酒糟蛋白所处的细胞组分;c-青稞酒糟蛋白执行的分子功能
图6 GO注释
Fig.6 GO annotation
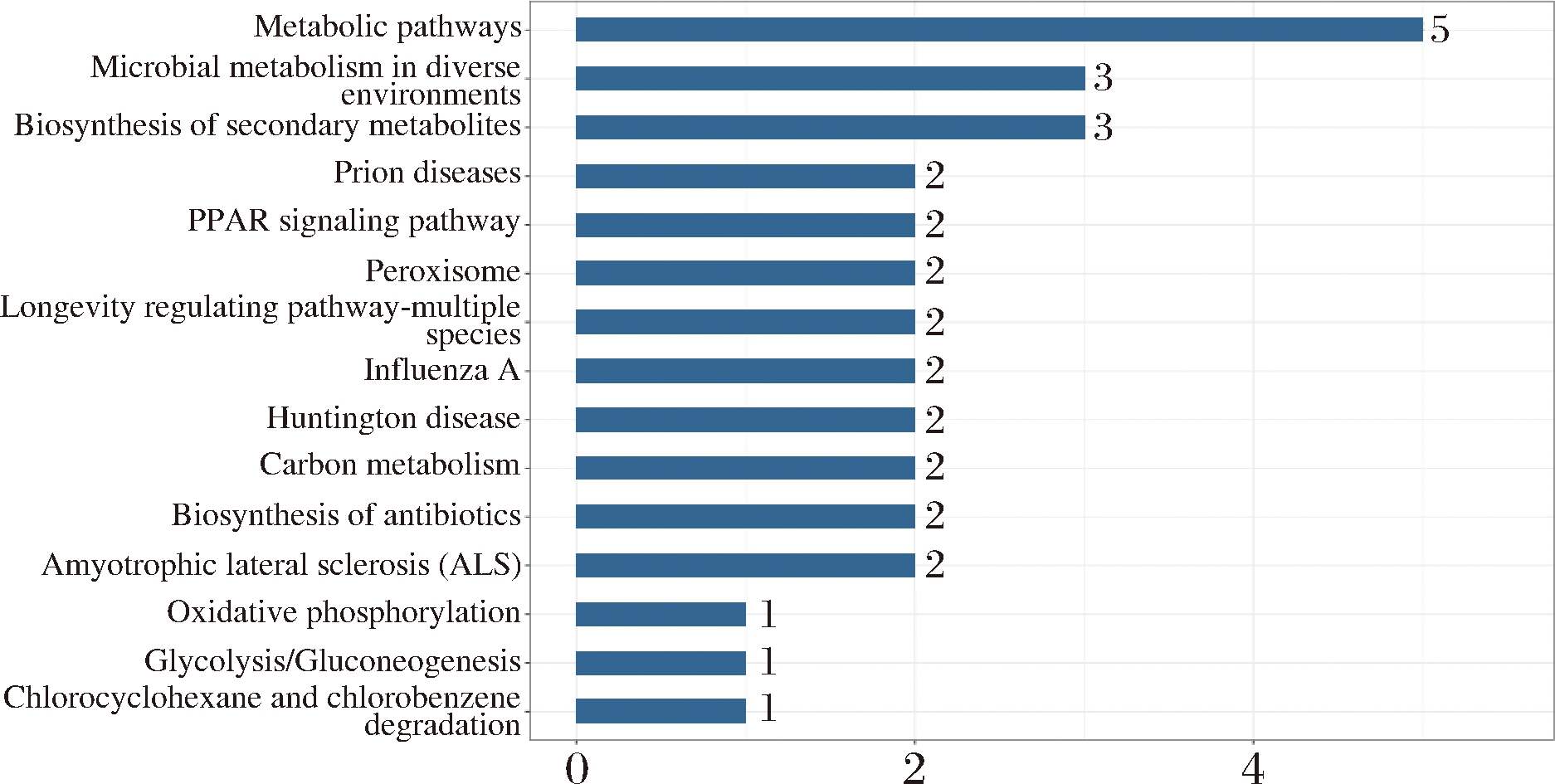
图7 KEGG通路分析
Fig.7 KEGG pathway analysis
2.4 青稞酒糟多肽的体外抗氧化试验
2.4.1 对DPPH自由基的清除效果
由图8可知,青稞酒糟多肽对DPPH自由基有良好的清除效果,同时青稞酒糟多肽对DPPH自由基的清除效果随浓度增大逐渐增强,在青稞酒糟多肽质量浓度为21 μg/L处趋于稳定,此时青稞酒糟多肽对DPPH自由基的清除效果达(70.76±1.35)%。这说明DPPH自由基中的不成对电子数量减少,导致溶液在517 nm处的吸光值降低,猜测可能是青稞酒糟多肽能捕捉DPPH自由基中的单电子,但青稞酒糟多肽对DPPH自由基具体的清除机理仍需进一步研究。
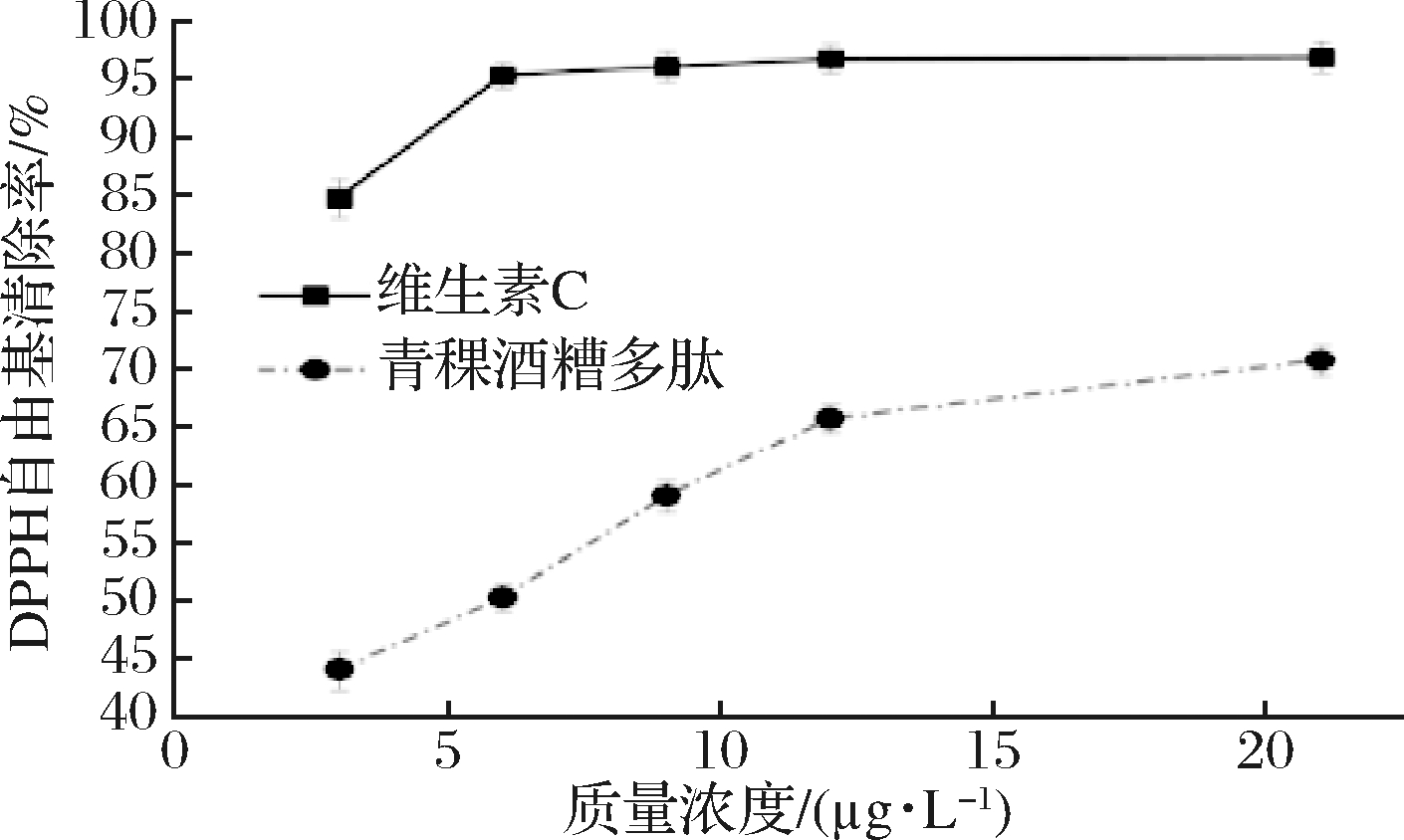
图8 不同浓度青稞酒糟多肽对DPPH自由基的清除效果
Fig.8 DPPH scavenging effects of peptides at different concentrations
2.4.2 对·OH的清除效果
由图9可知,青稞酒糟多肽对·OH有一定的清除效果,当青稞酒糟多肽质量浓度为21 μg/L时,青稞酒糟多肽对DPPH自由基的清除效果达(52.05±2.09)%,说明青稞酒糟多肽可以通过减少·OH的生成量,减少于510 nm处有特殊吸光度的2,3-二羟基苯甲酸的生成,同时青稞酒糟多肽对·OH的清除效果随浓度变化较小,可能是清除效果受到多肽溶液中较多盐离子以及其他杂质的影响。
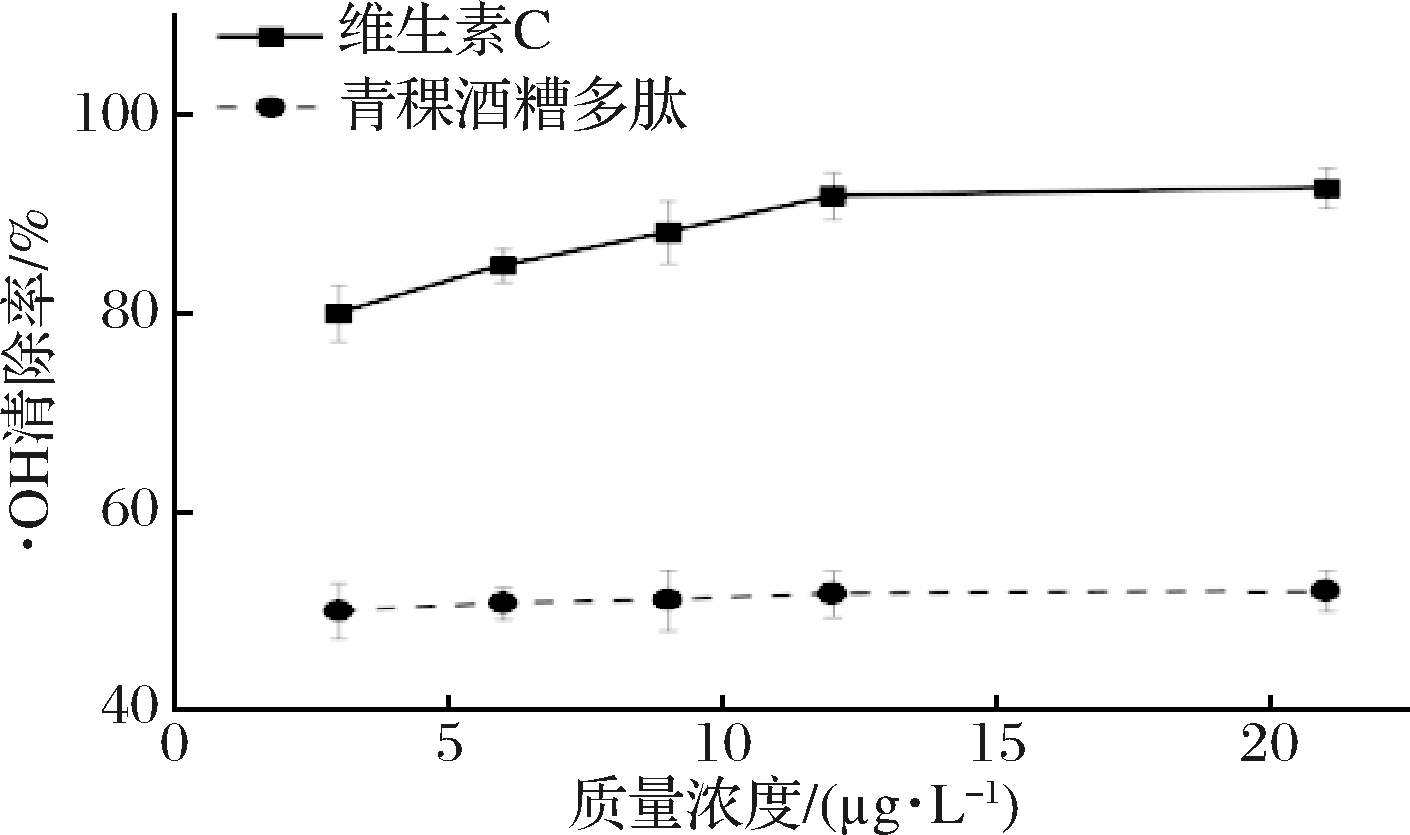
图9 不同浓度青稞酒糟多肽对·OH的清除效果
Fig.9 ·OH scavenging effects of peptides at different concentrations
2.4.3 对![]() 的清除效果
的清除效果
由图10可知,青稞酒糟多肽对![]() 有一定的清除效果,同时青稞酒糟多肽对
有一定的清除效果,同时青稞酒糟多肽对![]() 的清除效果随浓度增大逐渐提高,当青稞酒糟多肽质量浓度为21 μg/L时,对
的清除效果随浓度增大逐渐提高,当青稞酒糟多肽质量浓度为21 μg/L时,对![]() 的清除效果为(55.88±1.99)%,这说明青稞酒糟多肽作为
的清除效果为(55.88±1.99)%,这说明青稞酒糟多肽作为![]() 清除剂,加入后能够迅速与
清除剂,加入后能够迅速与![]() 反应,阻止有色中间产物的积累,导致溶液在320 nm处的吸光值降低。
反应,阻止有色中间产物的积累,导致溶液在320 nm处的吸光值降低。
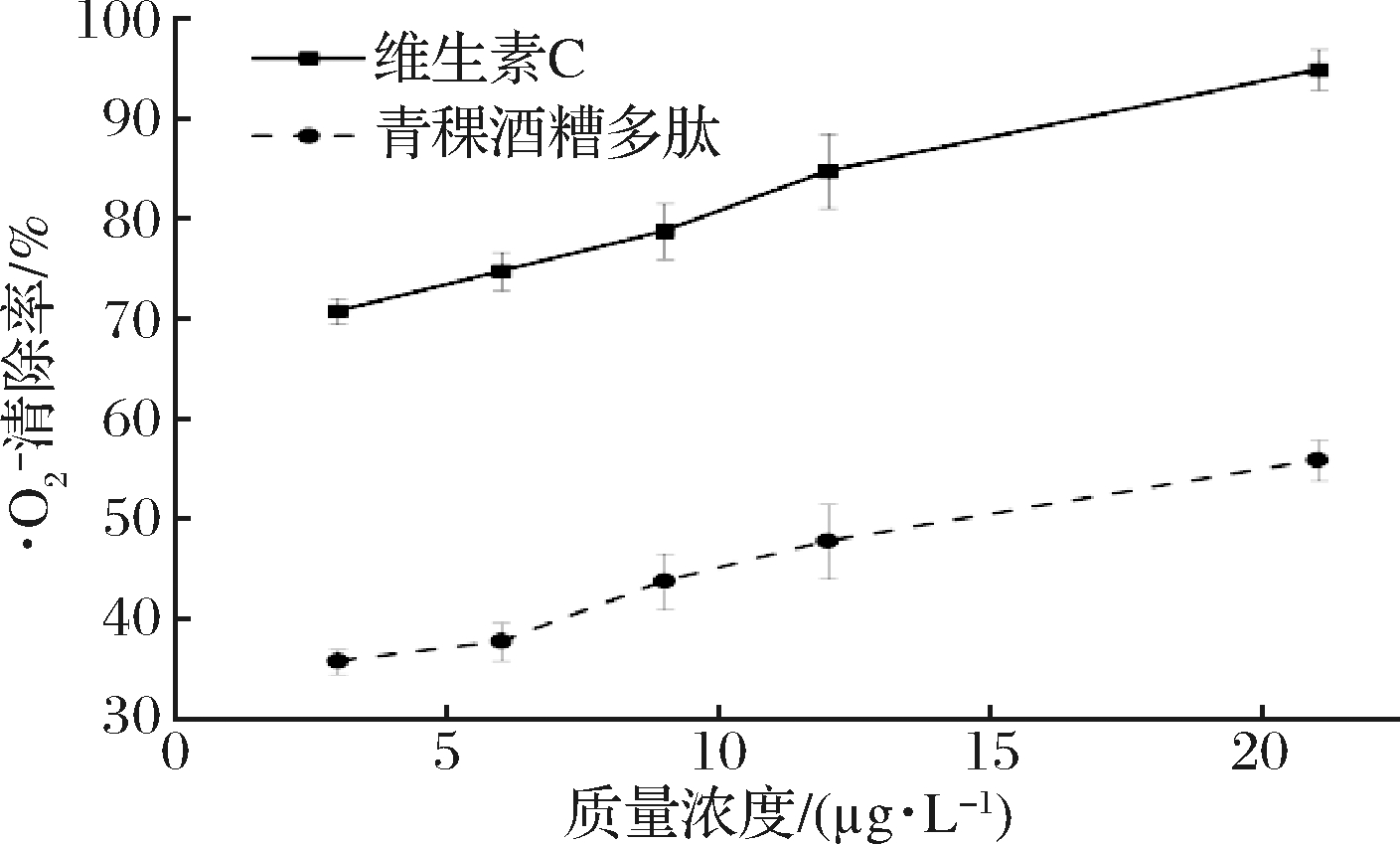
图10 不同浓度青稞酒糟多肽对![]() 的清除效果
的清除效果 ![]() scavenging effects of peptides at different concentrations
scavenging effects of peptides at different concentrations
3 结论
实验结果表明醇碱法提取青稞酒糟蛋白的得率和纯度高于其他2种方法,醇碱法提取青稞酒糟蛋白的得率为(7.52±0.12)%,纯度为(46.64±0.37)%,因此可以看出,不同的提取方法会影响蛋白质得率和纯度,醇碱法更适合青稞酒糟蛋白的提取。
利用AKTA pure蛋白纯化仪对青稞酒糟蛋白进行蛋白纯化,再利用Q Exactive Plus液质联用系统对青稞酒糟蛋白进行定性和定量分析。最后检索Uniprot数据库对结果进行分析,其中共有29个蛋白获得准确定量信息,共检索出11种差异蛋白,再基于GO注释和KEGG富集分析,得出物质运输、代谢途径、生物合成、生物调节等是11种差异蛋白质比较集中的15个生物学途径,5种细胞组分以及5种分子功能,其中与物质运输、代谢途径、生物合成和生物调节类有关的蛋白质数量较多,分别占所有差异蛋白的10.34%、10.34%和6.90%。GO功能富集分析显示,差异蛋白基因主要富集在有机物代谢、NADH再生、对氧化应激的反应、转移酶活性、碳水化合物运输和代谢、RNA加工和翻译后修饰、囊泡运输。参与RNA加工和翻译后修饰的P28003、P50138蛋白在富集分析中表现出最低的p值,差异蛋白主要与微生物代谢、过氧化物酶体、氧化磷酸化、次生代谢物的生物合成有关,不同的提取方法显著改变了差异基因在过氧化物酶体、氧化磷酸化方面的代谢通路。
再进一步检测青稞酒糟蛋白多肽对ADH激活的影响,结果显示,青稞酒糟多肽对ADH活性具有较强的激活效果,且多肽的激活效果随浓度升高而增加。利用碱性蛋白酶和风味蛋白酶酶解的多肽醒酒效果高于其他4种酶酶解的多肽,利用碱性蛋白酶酶解青稞酒糟蛋白,得到水解度最高的多肽溶液对ADH的活性具有最优的激活效果,当碱性蛋白酶酶解的多肽浓度10 mg/mL时,对ADH的激活效果最优为(22.58±0.53)%。进一步检测不同浓度青稞酒糟多肽对DPPH自由基、·OH和![]() 的清除效果,实验结果表明清除效果随浓度增大而提高,最佳浓度为21 μg/L。当青稞酒糟多肽浓度为21 μg/L时,对DPPH自由基的清除率为(70.76±1.35)%,对·OH的清除率为(52.05±2.09)%,对
的清除效果,实验结果表明清除效果随浓度增大而提高,最佳浓度为21 μg/L。当青稞酒糟多肽浓度为21 μg/L时,对DPPH自由基的清除率为(70.76±1.35)%,对·OH的清除率为(52.05±2.09)%,对![]() 的清除率为(55.88±1.99)%。
的清除率为(55.88±1.99)%。
[1] 李倩, 裴朝曦, 王之盛, 等.不同类型酒糟营养成分组成差异的比较研究[J].动物营养学报, 2018, 30(6):2 369-2 376.
LI Q, PEI Z X, WANG Z S, et al.Comparative study on nutrients compositions of different types of distillers′ grains[J].Chinese Journal of Animal Nutrition, 2018, 30(6):2 369-2 376.
[2] PENG L, KONG X Y, WANG Z M, et al.Baijiu vinasse as a new source of bioactive peptides with antioxidant and anti-inflammatory activity[J].Food Chemistry, 2021, 339:128159.
[3] 黄迪宇. 青稞酒糟饮料的制备及稳定性研究[D].无锡:江南大学, 2017.
HUANG D Y.Studies on the preparation and stability highland barley draff beverage[D].Wuxi:Jiangnan University, 2017.
[4] 高泽汝, 刘昆仑, 陈复生.碱法提取玉米胚芽蛋白的条件优化[J].食品工业, 2020, 41(10):5-8.
GAO Z R, LIU K L, CHEN F S.Optimization of extraction conditions for corn germ protein by alkali method[J].Food Industry, 2020, 41(10):5-8.
[5] 吴兴雨, 曹阔, 孙丰梅.小米谷糠蛋白提取的研究进展[J].粮食加工, 2020, 45(2):69-73.
WU X Y, CAO K, SUN F M.Research progress on extraction of millet bran protein[J].Grain Processing, 2020, 45(2):69-73.
[6] RAM REZ K, PINEDA-HIDALGO K V, ROCH
REZ K, PINEDA-HIDALGO K V, ROCH N-MEDINA J J, et al.Fermentation of spent coffee grounds by Bacillus clausii induces release of potentially bioactive peptides[J].LWT, 2021, 138:110685.
N-MEDINA J J, et al.Fermentation of spent coffee grounds by Bacillus clausii induces release of potentially bioactive peptides[J].LWT, 2021, 138:110685.
[7] SU C F, CHEN Y F, TSAI Y J, et al.Antioxidant activity of linear and star-shaped polypeptides modified with dopamine and glutathione[J].European Polymer Journal, 2021, 152:110497.
[8] CUESTA C M, IBA EZ F, LOPEZ-HIDALGO R, et al.A targeted polypeptide-based nanoconjugate as a nanotherapeutic for alcohol-induced neuroinflammation[J].Nanomedicine:Nanotechnology, Biology and Medicine, 2021, 34:102376.
EZ F, LOPEZ-HIDALGO R, et al.A targeted polypeptide-based nanoconjugate as a nanotherapeutic for alcohol-induced neuroinflammation[J].Nanomedicine:Nanotechnology, Biology and Medicine, 2021, 34:102376.
[9] CONNOLLY A, CERME O M, ALASHI A M, et al.Generation of phenolic-rich extracts from brewers′ spent grain and characterisation of their in vitro and in vivo activities[J].Innovative Food Science & Emerging Technologies, 2021, 68:102617.
O M, ALASHI A M, et al.Generation of phenolic-rich extracts from brewers′ spent grain and characterisation of their in vitro and in vivo activities[J].Innovative Food Science & Emerging Technologies, 2021, 68:102617.
[10] WEI D, FAN W L, XU Y, et al.Identification of water-soluble peptides in distilled spent grain and its angiotensin converting enzyme (ACE) inhibitory activity based on UPLC-Q-TOF-MS and proteomics analysis[J].Food Chemistry, 2021, 353:129521.
[11] QIAO H R, BI X J, ZHANG Y Y, et al.Enzymic polypeptide antioxidant activity and inhibitory activity on α-glucosidase and α-amylase from Paeonia ostii cake[J].Industrial Crops and Products, 2020, 146:112158.
[12] 姜福佳. 酒糟中活性成分的提取及其活性的研究[D].长春:吉林大学, 2009.
JIANG F J.Extraction of bioactive components from grain stillage and and study on their activity[D].Changchun:Jilin University, 2009.
[13] 杜瑶瑶, 刘玲玲, 王鉴, 等.用AKTA explorer 10蛋白纯化系统分离纯化家蚕类免疫球蛋白[J].蚕业科学, 2013, 39(4):732-738.
DU Y Y, LIU L L, WANG J, et al.Separation and purification of Bombyx mori hemolin with KTA explorer 10 protein purification system[J].Science of Sericulture, 2013, 39(4):732-738.
[14] 魏冬. 白酒糟中ACE抑制肽的鉴定与活性探究[D].无锡:江南大学, 2020.
WEI D.Identification andactivity of ACE inhibitory peptidesin distilled spent grain[D].Wuxi:Jiangnan University, 2020.
[15] 田田. 黑豆多肽的制备及体外醒酒活性的研究[D].长春:长春工业大学, 2014.
TIAN T.Preparation and anti-alcoholism activity in vitro of black bean polypeptide[D].Changchun:Changchun University of Technology, 2014.
[16] 王培宇. 南瓜籽多肽制备及其抗衰老作用研究[D].无锡:江南大学, 2020.
WANG P Y.Study on preparation of pumpkin seed peptides and their anti-aging effect[D].Wuxi:Jiangnan University, 2020.
[17] 曹磊, 宋玉, 陶澍, 等.不同处理对糙米发芽后酚类含量及其抗氧化活性影响[J].食品研究与开发, 2021, 42(9):138-143.
CAO L, SONG Y, TAO S, et al.Effects of different treatments on phenolic content and antioxidant activities of brown rice by germination[J].Food Research and Development, 2021, 42(9):138-143.
[18] 郭辉, 何慧, 韩樱, 等.玉米肽对小鼠酒后肝脏乙醇脱氢酶活力的影响及醒酒机理[J].食品科学, 2011, 32(11):265-269.
GUO H, HE H, HAN Y, et al.Effect of corn peptides on alcohol dehydrogenase activity in live of mice after drinking and its anti-alcohol mechanism[J].Food Science, 2011, 32(11):265-269.
[19] 马吉瑶, 郑程远, 郭成宇.小米中抗氧化活性成分的研究进展[J].农产品加工, 2021,(7):80-83.
MA J Y, ZHENG C Y, GUO C Y.Research progress on antioxidant active components of millet[J].Farm Products Processing, 2021,(7):80-83.
[20] 侯梦媛. 白酒酒糟中醇溶蛋白的研究与应用[D].无锡:江南大学, 2020.
HOU M Y.Study and application of prolamin from distiller′s grains of baijiu[D].Wuxi:Jiangnan University, 2020.
[21] 周红, 张杰, 张文刚, 等.青海黑青稞营养及活性成分分析与评价[J].核农学报, 2021, 35(7):1 609-1 618.
ZHOU H, ZHANG J, ZHANG W G, et al.Analysis and evaluation of the nutritional quality and active components of Qinghai black highland barley[J].Journal of Nuclear Agricultural Sciences, 2021, 35(7):1 609-1 618.
[22] 李倩. 不同类型酒糟营养成分组成差异及瘤胃发酵特性的研究[D].雅安:四川农业大学, 2017.
LI Q.Study on nutrients compositions and ruminal fermentation characteristics of different types distillers′ grains[D].Ya′an:Sichuan Agricultural University, 2017.
[23] 姜云松. 白酒酒糟中功能性多肽的提取纯化鉴定及活性测定[D].北京:北京工商大学, 2020.
JIANG Y S.Extraction, purification, identification and activities determination of functional peptides from Baijiu Jiuzao[D].Beijing:Beijing University of Technology and Industry, 2020.
[24] 李萌. 酶法制备绿豆多肽及其对乙醇脱氢酶活性影响研究[D].长春:吉林农业大学, 2015.
LI M.Research on the preparation of mung bean polypeptide by enzyme technology and its effect on the activity of alcohol dehydrogenase[D].Changchun:Jilin Agricultural University, 2015.
[25] 宁庆鹏. 花生粕功能多肽的研究[D].太原:山西大学, 2016.
NING Q P.Function of peanut meal peptide research[D].Taiyuan:Shanxi University, 2016.