L-半胱氨酸(L-cysteine)是一种重要的含硫化合物,属于非必需氨基酸,在大多数生物中,L-半胱氨酸是细胞代谢所需还原硫的唯一来源[1]。L-半胱氨酸除了参与细胞代谢外,在医药,食品和化妆品行业也有重要作用[2-4]。目前主要通过提取法和化学合成法生产L-半胱氨酸[5-7]。然而,这些方法存在过程复杂、产率低等问题[8]。微生物发酵法具有绿色、安全和环保等优点[9],其经济和环境效益也受到越来越多研究者的关注。目前,微生物发酵生产L-半胱氨酸的研究主要集中于大肠杆菌(Escherichia coli),文献报道大肠杆菌生产L-半胱氨酸的最高产量为8.34 g/L[10]。与大肠杆菌相比,谷氨酸棒杆菌(Corynebacterium glutamicum)不产内毒素,是食品及药物管理局(Food and Drug Administration,FDA)认可的生产食品和药品安全的(Generally Recognized as Safe,GRAS)微生物[11],但谷氨酸棒杆菌产L-半胱氨酸的研究相对较少[12-14]。
在谷氨酸棒杆菌和大肠杆菌中,合成L-半胱氨酸的前体均为L-丝氨酸。与大肠杆菌不同的是谷氨酸棒杆菌具有直接的硫化途径,而不是通过生物合成L-甲硫氨酸的转硫途径[15]。L-半胱氨酸的合成代谢途径如图1所示,前体L-丝氨酸在L-丝氨酸O-乙酰基转移酶(L-serine O-acetyltransferase,SAT,编码基因cysE)催化下生成O-乙酰基-L-丝氨酸(O-acetyl-L-serine,OAS),然后在OAS巯基化酶-A(OAS sulfhydrylase-A,OASS-A,编码基因cysK)催化下得到L-半胱氨酸。SAT的酶活力受到L-半胱氨酸的反馈抑制,该反应也是L-半胱氨酸合成的关键限速步骤[16-17]。目前在谷氨酸棒杆菌和大肠杆菌中主要采用以下策略提高L-半胱氨酸的产量[18-20]:(1)增强L-半胱氨酸生物合成;(2)弱化L-半胱氨酸降解途径;(3)加强表达L-半胱氨酸转运蛋白。WEI等[18]利用代谢工程策略构建了产L-半胱氨酸的谷氨酸棒杆菌,L-半胱氨酸产量为947.9 mg/L,是目前报道的谷氨酸棒杆菌产L-半胱氨酸的最高产量;然而仍存在产量较低的问题,推测前体L-丝氨酸水平可能是限制L-半胱氨酸生物合成的重要因素。
本课题组前期通过代谢工程改造获得了一株产L-丝氨酸30.57 g/L的谷氨酸棒杆菌A36[21],本文以高产L-丝氨酸的谷氨酸棒杆菌A36为出发菌株,通过加强表达L-半胱氨酸生物合成途径关键酶,敲除L-半胱氨酸降解途径关键酶弱化L-半胱氨酸的降解,强化L-半胱氨酸转运以及优化硫源这4个策略来提高L-半胱氨酸的产量,为L-半胱氨酸高效生物合成奠定基础。
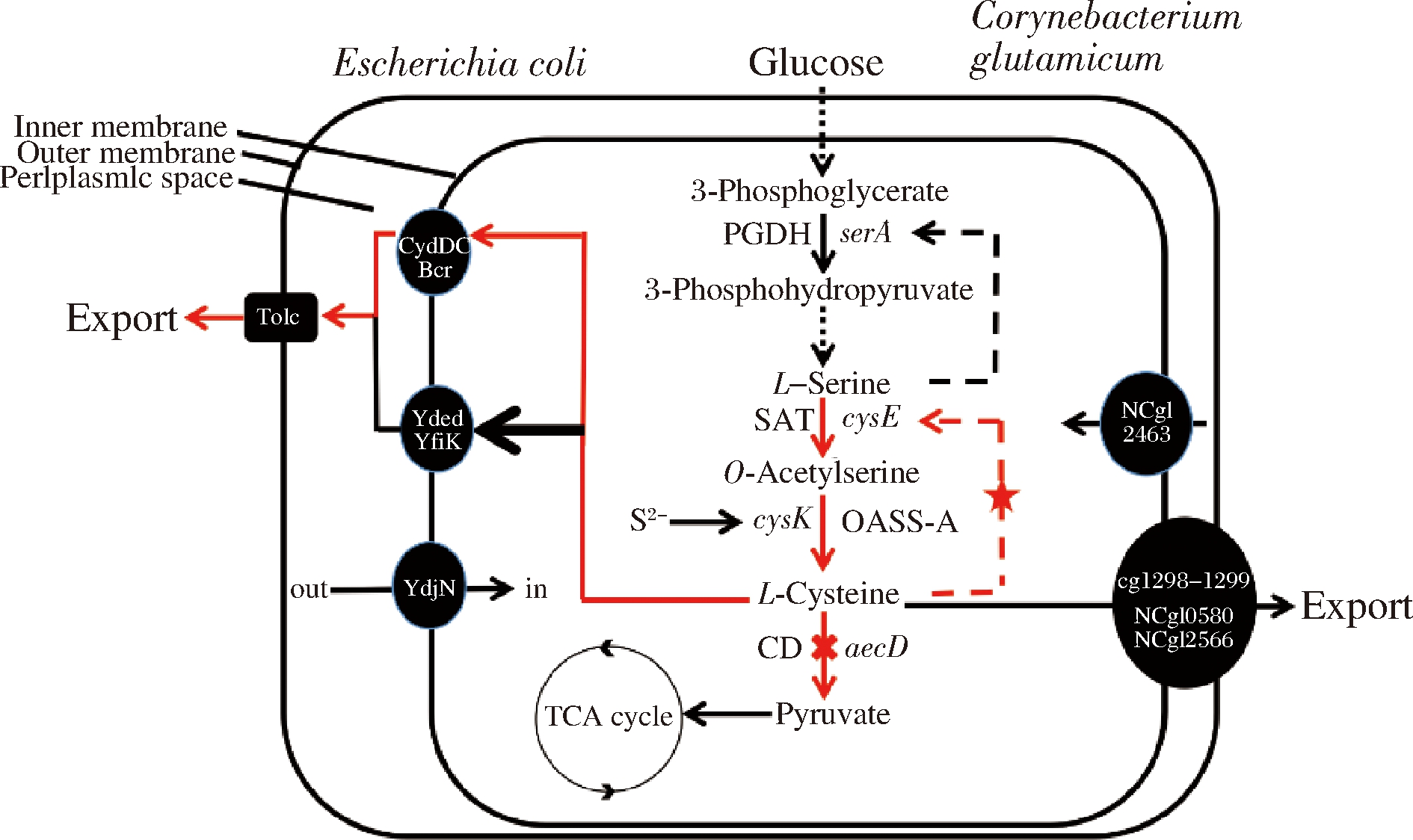
图1 L-半胱氨酸在大肠杆菌和谷氨酸棒杆菌中的生物合成途径
Fig.1 L-cysteine biosynthesis pathway in Escherichia coli and Corynebacterium glutamicum
注:红色虚线表示本研究中执行的代谢工程步骤; 红色“X”表示目标基因的缺失;红色五星表示反馈抑制的脱敏
1 材料与方法
1.1 材料
1.1.1 菌株、质粒以及主要试剂
本文所用菌株与质粒如表1所示。细菌基因组DNA提取试剂盒、质粒DNA提取试剂盒和DNA胶回收试剂盒,生工生物工程(上海)股份有限公司;EcoR I、Xba I和Hind Ⅲ等限制性内切核酸酶,宝日医生物技术(北京)有限公司。其他试剂,国药集团化学试剂有限公司。
表1 本文涉及的相关菌株和质粒
Table 1 Strains and plasmids used in this study
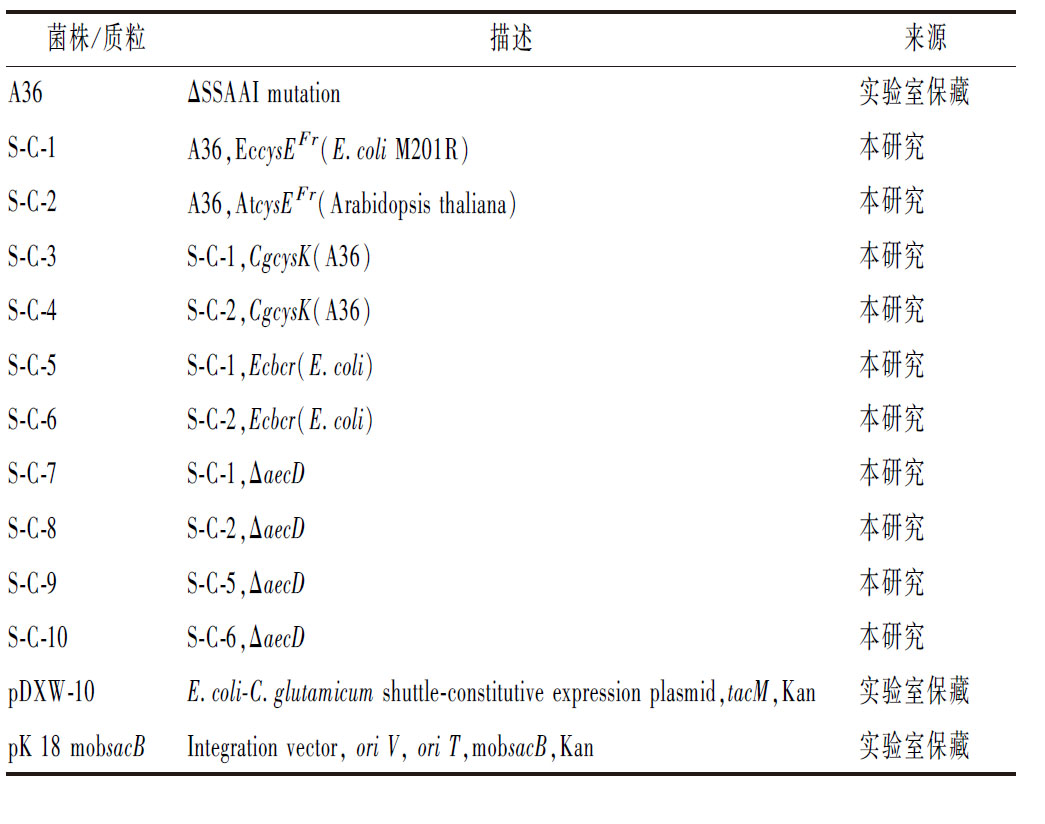
菌株/质粒描述来源A36ΔSSAAI mutation实验室保藏S-C-1A36,EccysEFr(E.coli M201R)本研究S-C-2A36,AtcysEFr(Arabidopsis thaliana)本研究S-C-3S-C-1,CgcysK(A36)本研究S-C-4S-C-2,CgcysK(A36)本研究S-C-5S-C-1,Ecbcr(E.coli)本研究S-C-6S-C-2,Ecbcr(E.coli)本研究S-C-7S-C-1,ΔaecD本研究S-C-8S-C-2,ΔaecD本研究S-C-9S-C-5,ΔaecD本研究S-C-10S-C-6,ΔaecD本研究pDXW-10E.coli-C.glutamicum shuttle-constitutive expression plasmid,tacM,Kan实验室保藏pK 18 mobsacBIntegration vector, ori V, ori T,mobsacB,Kan实验室保藏
1.1.2 培养基
LB培养基(g/L):蛋白胨10,酵母粉5,NaCl 10(固体培养基,琼脂粉20)。
种子培养基(g/L):脑心浸液37,葡萄糖20,(NH4)2SO4 10,MgSO4·7H2O 0.5,K2HPO4 0.2,NaH2PO4 0.3。
发酵培养基(g/L):葡萄糖 50,玉米浆 25,(NH4)2SO4 15,KH2PO4 0.8,K2HPO4 1.2,MgSO4 0.5,MnSO40.01,FeSO4 0.01,维生素B1 1,维生素B6 6,生物素0.2,CaCO3 20。发酵罐培养基采用氨水和磷酸替换CaCO3。
1.2 实验方法
1.2.1 质粒的构建
组成型加强表达质粒的构建:质粒pDXW-10是大肠杆菌和谷氨酸棒杆菌穿梭型质粒,为组成型表达质粒,可用于外源基因的高效表达,其携带tacM强启动子与Kan抗性标记。以加强表达cysEFr为例,由天霖生物科技(上海)有限公司合成cysEFr基因,cysEFr分别为来自大肠杆菌MG1655的解除反馈抑制的EccysEFr(M201R)以及来自拟南芥的AtcysEFr,目的基因经EcoR I和Bgl Ⅱ双酶切后与线性化的质粒pDXW-10连接,构建组成型加强表达质粒。
敲除质粒的构建:aecD基因利用敲除质粒pK 18 mobsacB-ΔaecD进行敲除。以A36基因组为模板,利用同源重组软件设计引物aecD-1/aecD-2和aecD-3/aecD-4,扩增上下游片段。采用EcoR I和Xba I双酶切敲除质粒pK 18 mobsacB,再将上下游同源片段与线性化质粒pK 18 mobsacB连接,构建敲除质粒pK 18 mobsacB-ΔaecD。
1.2.2 发酵方法
摇瓶发酵:吸取适量菌液,于种子平板上三区划线,30 ℃培养3 d,然后挑取单菌落在平板上密集划线,培养3 d。刮取1环菌落接种至20 mL种子液体培养基中,培养12~16 h。待种子液OD562=20~25,按照4%的接种量接种至25 mL发酵培养基中,30 ℃,120 r/min 往复式摇床培养48 h,每隔12 h取样,测定生物量及L-半胱氨酸产量。
5 L发酵罐发酵:取6 mL种子液接种至100 mL种子培养基中,30 ℃,120 r/min往复式摇床培养24 h,待种子液OD562值到达对数生长期,以10%的接种量接种至发酵罐中,在发酵24 h时添加12 g/L的Na2S2O3。在发酵过程中,采用50%氨水和50%磷酸调节pH,使pH保持在7左右,通过自动调节转速和通气量使溶氧(dissolved oxygen,DO)控制在10%左右,每隔12 h取样,测定生物量及L-半胱氨酸产量。
1.2.3 分析方法
生物量的测定:采用紫外分光光度计测定。首先将发酵液振荡混匀,吸取适量发酵液,加入1 mol/L盐酸溶液稀释至适当倍数,利用紫外分光光度计于562nm处测定生物量。
L-半胱氨酸的测定:采用HPLC方法测定发酵液中L-半胱氨酸的含量[22]。
糖的测定:采用西尔曼生物传感器测定发酵液中糖的含量。
2 结果与分析
2.1 强化合成途径对L-半胱氨酸生产的影响
2.1.1 强化合成途径重组菌株的构建
由于SAT是谷氨酸棒杆菌合成L-半胱氨酸重要的限速酶,该酶受到产物L-半胱氨酸的反馈抑制;如要提高L-半胱氨酸的产量,就需解除L-半胱氨酸引起的反馈抑制。目前主要采用以下两种方法获得对反馈抑制不敏感的SAT:(1)通过定点诱变或随机诱变改造SAT;(2)利用高等植物中对反馈抑制不敏感的天然SAT。因此本文选择来自大肠杆菌的cysEFr(M201R),降低L-半胱氨酸反馈抑制的敏感性,使其在谷氨酸棒杆菌中外源表达。另外选择来自拟南芥对反馈抑制不敏感的天然SAT在谷氨酸棒杆菌中进行外源表达。采用1.2.1 方法构建组成型加强表达质粒,选择不同来源的L-半胱氨酸关键酶cysEFr(大肠杆菌EccysEFr和拟南芥AtcysEFr),将目的片段与质粒pDXW-10相连接,构建了质粒pDXW-10-EccysEFr和pDXW-10-AtcysEFr。
在谷氨酸棒杆菌中,OAS在由cysK编码的OAS巯基化酶-A的催化作用下生成L-半胱氨酸,这是L-半胱氨酸合成途径的第二个关键酶,因此在加强表达cysEFr的质粒 pDXW-10-EccysEFr和pDXW-10-AtcysEFr中分别串联表达来源出发菌株A36中的cysK,构建了质粒pDXW-10-EccysEFr-cysK和pDXW-10-AtcysEFr-cysK。将质粒pDXW-10-EccysEFr、pDXW-10-AtcysEFr、pDXW-10-EccysEFr-cysK和pDXW-10-AtcysEFr-cysK电转化A36感受态细胞,挑选转化子,PCR验证质粒是否构建成功,验证结果如图2-a所示,EccysEFr和AtcysEFr基因长度分别为822 bp和945 bp,cysK基因长度为936 bp,PCR条带大小相符;经测序验证序列正确无突变,表明重组菌株S-C-1、S-C-2、S-C-3和S-C-4构建成功。
2.1.2 强化合成途径重组菌株的发酵评价
重组菌株的发酵结果如图2-b所示,S-C-1和S-C-2菌株分别产115.8 mg/L和105.8 mg/L,而出发菌株A36不产L-半胱氨酸。菌株S-C-3和S-C-4 L-半胱氨酸的产量分别为95.2 mg/L和36.5 mg/L,与仅表达L-半胱氨酸关键酶cysEFr的菌株S-C-1和S-C-2菌株相比,L-半胱氨酸产量分别下降17.8%和65.5%,说明串联表达cysK并不利于L-半胱氨酸的积累,推测宿主菌株中cysK编码的OASS-A具有一定活性,自身可以维持L-半胱氨酸合成途径畅通,加强表达反而增加菌株负担,不利于重组菌株产L-半胱氨酸。由于加强表达cysK不利于L-半胱氨酸的积累,因此后续研究在菌株S-C-1和S-C-2中进行。
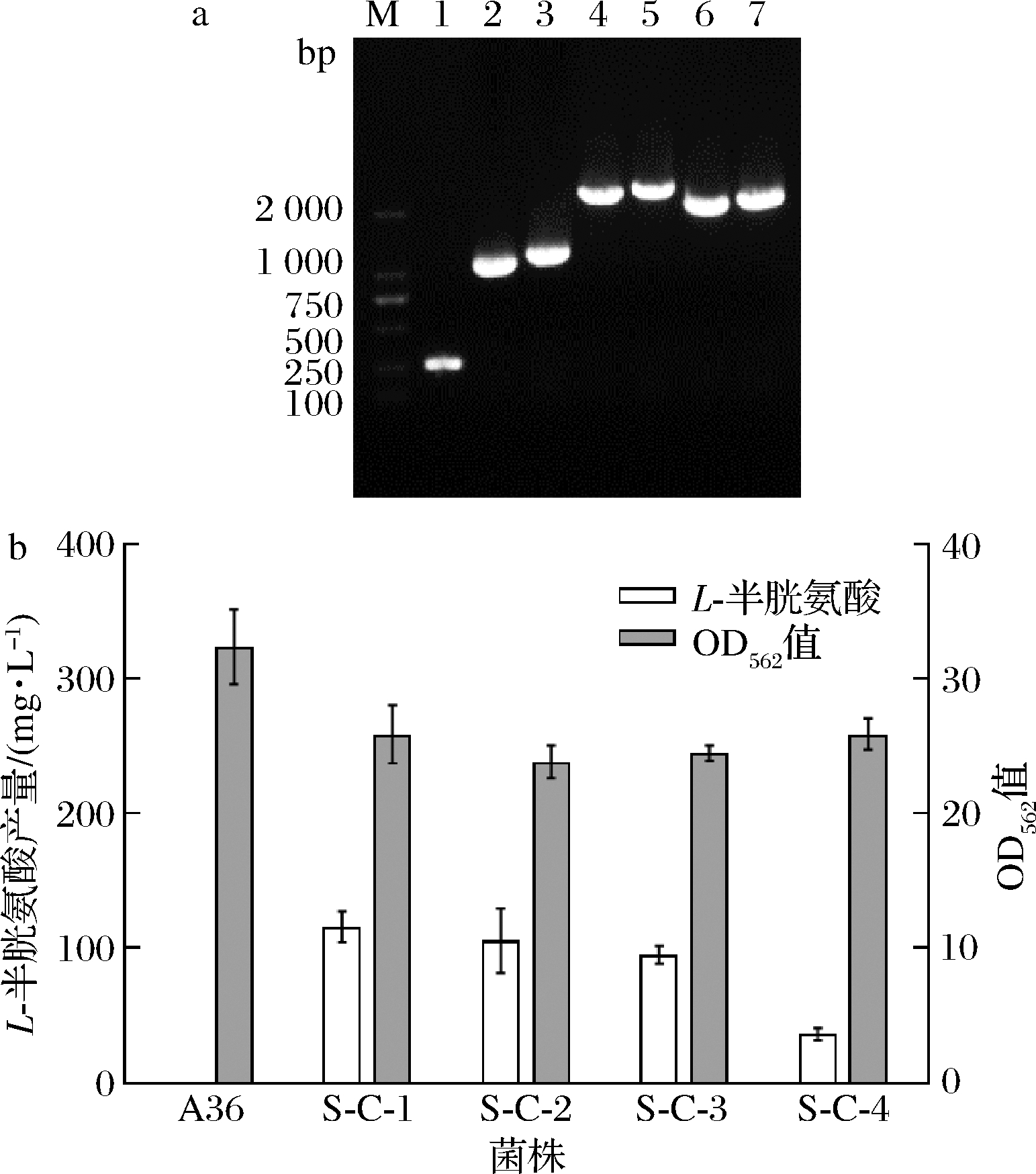
M-DNA Marker;1-原始菌株的PCR产物;2、3-cysEFr基因的PCR产物; 4、5-cysEFr-cysK基因的PCR产物;6、7-cysEFr-bcr基因的PCR产物 a-菌株S-C-1、S-C-2、S-C-3、S-C-4、S-C-5、S-C-6的PCR验证电泳图谱; b-菌株A36、S-C-1、S-C-2、S-C-3、S-C-4的发酵结果
图2 加强表达合成途径对L-半胱氨酸生产的影响
Fig.2 The effect of enhanced expression synthesis pathway on L-cysteine production
2.2 强化转运系统对L-半胱氨酸生产的影响
2.2.1 强化转运途径重组菌株的构建
胞内积累过多的L-半胱氨酸会对菌株产生毒性,强化L-半胱氨酸转运系统可以促进产物外排,减少L-半胱氨酸对X菌株的毒性,从而提高L-半胱氨酸的产量。因此在S-C-1(加强表达EccysEFr)和S-C-2(加强表达AtcysEFr)两个重组菌株中串联表达L-半胱氨酸转运蛋白Bcr,构建了重组菌株S-C-5和S-C-6。菌株构建的验证结果如图2-a所示,bcr基因长度为1 194 bp,条带大小相符;经测序验证序列正确,表明重组菌株S-C-5和S-C-6构建成功。
2.2.2 强化转运途径重组菌株的发酵评价
重组菌株S-C-5和S-C-6的发酵结果如图3所示,重组菌S-C-5和S-C-6 L-半胱氨酸产量分别为253.3 mg/L和216.7 mg/L,与菌株S-C-1和S-C-2相比分别提高了1.2倍和1.0倍。结果表明,加强表达L-半胱氨酸转运可以将更多的L-半胱氨酸运输出胞外,显著提高谷氨酸棒杆菌L-半胱氨酸的产量。
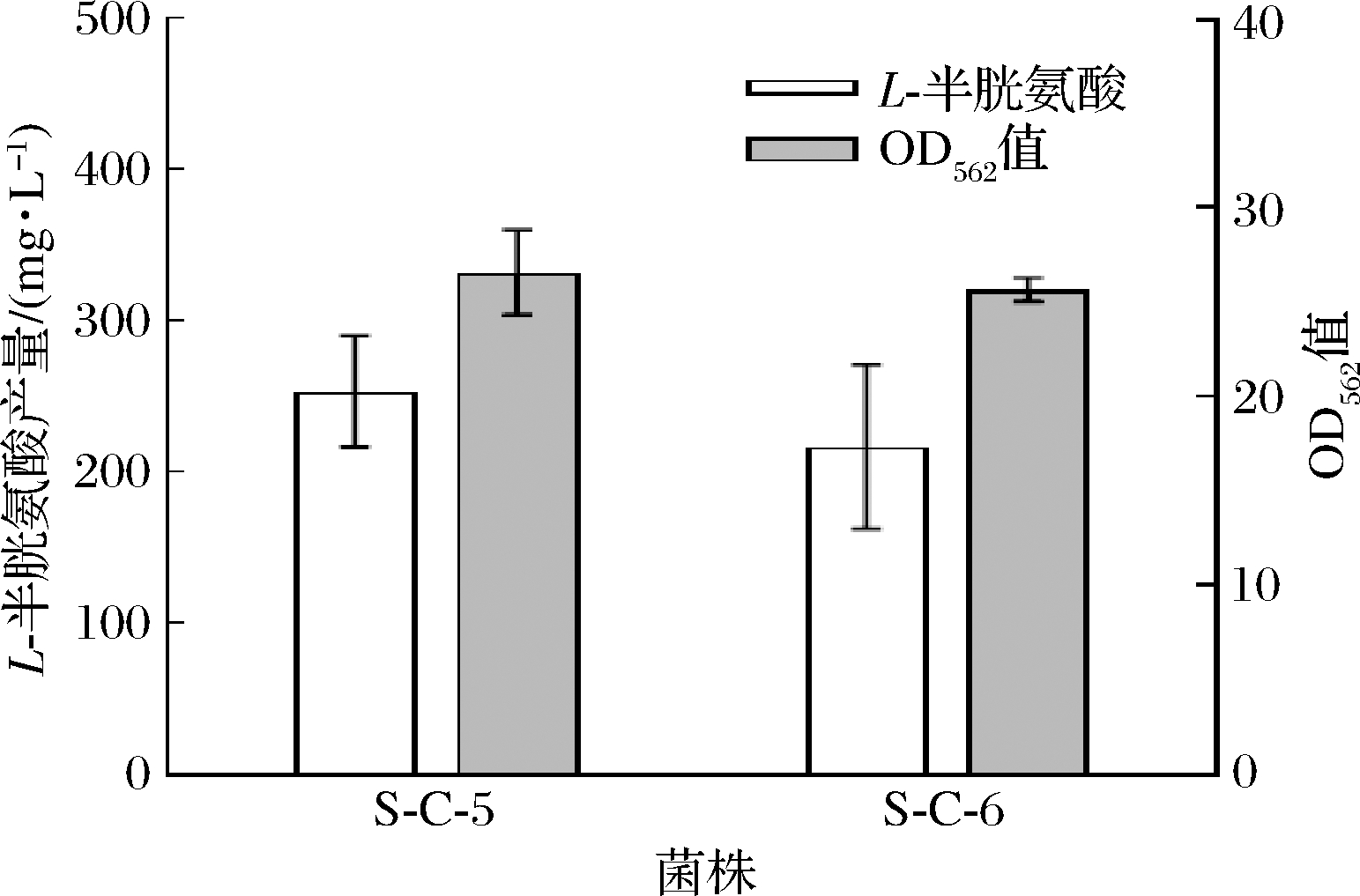
图3 菌株S-C-5和S-C-6的发酵结果
Fig.3 The fermentation of strain S-C-5 and S-C-6
2.3 弱化降解途径对L-半胱氨酸生产的影响
2.3.1 弱化降解途径重组菌株的构建
弱化产物降解是进一步提高氨基酸产量的有效方法。L-半胱氨酸的降解主要由L-半胱氨酸脱硫酶(cysteine desulfurase,CD)催化。本文在加强表达合成途径的菌株S-C-1,S-C-2基础上敲除aecD弱化L-半胱氨酸降解。采用1.2.1中的方法构建基因敲除质粒pK 18 mobsacB-ΔaecD,将构建质粒pK 18 mobsacB-ΔaecD电转到A36感受态细胞中,在含Kan的平板上涂布,进行一次同源重组,然后挑选正确的转化子涂布于10%的蔗糖培养基进行二次重组,挑选转化子进行PCR验证,验证如图4-a所示,出发菌株的条带大小约2 000 bp左右,敲除重组菌株的条带大小为1 000 bp左右,表明敲除菌株A36-ΔaecD构建成功。将质粒pDXW-10-EccysEFr、pDXW-10-AtcysEFr、pDXW-10-EccysEFr-bcr和pDXW-10-AtcysEFr-bcr电转化A36-ΔaecD感受态细胞,于30 ℃培养,进行菌落PCR验证,验证结果如图4-b所示,表明重组菌株S-C-7、S-C-8、S-C-9和S-C-10构建成功。
2.3.2 弱化降解途径重组菌株的发酵评价
重组菌株的发酵结果如图4-c所示,与S-C-1(115.8 mg/L)和S-C-2(105.8 mg/L)相比,菌株S-C-7和S-C-8 L-半胱氨酸的产量分别提高了1.5倍和1.0倍,说明敲除基因aecD后,可以使更多的碳流流向产物L-半胱氨酸。与S-C-7(286.7 mg/L)和S-C-8(236.7 mg/L)相比,菌株S-C-9和S-C-10的L-半胱氨酸产量并没有提高,甚至S-C-9还下降29.1%,这与WEI等[18]通过代谢改造构建的菌株CYS-13不同,强化L-半胱氨酸合成和转运同时减少其降解并没有进一步提高L-半胱氨酸产量,分析原因可能是采用的底盘细胞不同,文献中采用的底盘细胞为谷氨酸棒杆菌ATCC13032,本文采用的是一株高产L-丝氨酸的谷氨酸棒杆菌A36,底盘细胞对L-半胱氨酸的耐受能力存在差异。为进一步提高L-半胱氨酸的产量,选择构建的重组菌株中产量最高的S-C-7(图5)进行硫源的优化。
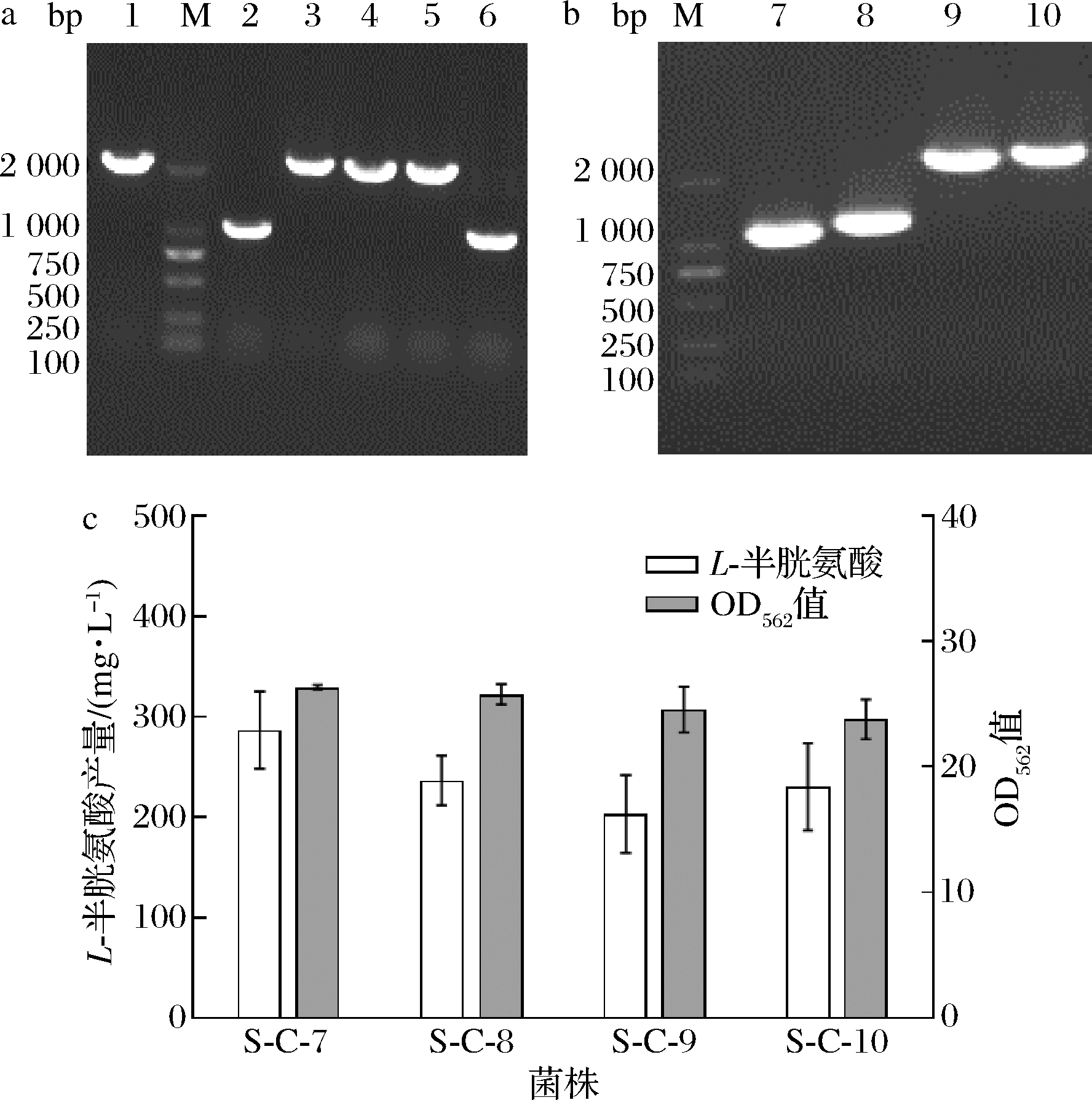
M-DNA Marker;1-A36原始菌的PCR产物;2、6-敲除成功aecD 基因后的PCR产物;3~5-未敲除成功aecD基因后的PCR产物; 7、8-cysEFr基因的PCR产物;9、10-cysEFr-bcr基因的PCR产物 a-aecD基因敲除后的PCR验证电泳图谱;b-菌株S-C-7、S-C-8、S-C-9、 S-C-10的PCR验证电泳图谱;c-菌株S-C-7、S-C-8、S-C-9、S-C-10 的发酵结果
图4 弱化降解途径对L-半胱氨酸生产的影响
Fig.4 The effect of weakening degradation pathway on L-cysteine production
2.4 硫源对重组菌株发酵的影响
2.4.1 不同硫源对重组菌株发酵的影响
L-半胱氨酸是含硫氨基酸,硫源的供给对提高L-半胱氨酸的产量至关重要。首先考察不同的硫源对L-半胱氨酸生产的影响,分别外源添加10 g/L的Na2S2O3、Na2S、Na2SO4和NaHS,以不添加硫源作为对照,发酵结果如图6-a所示,添加不同的硫源均会影响重组菌株的生长和产L-半胱氨酸,其中添加Na2S和NaHS导致重组菌株不再生长。添加Na2S2O3和Na2SO4会在一定程度上抑制重组菌株生长,与对照相比,生物量分别下降18.1%和23.6%,同时L-半胱氨酸的产量均有提高,当以Na2S2O3为硫源时,L-半胱氨酸产量最高,为461.5 mg/L,因此后续选择Na2S2O3作为硫源。
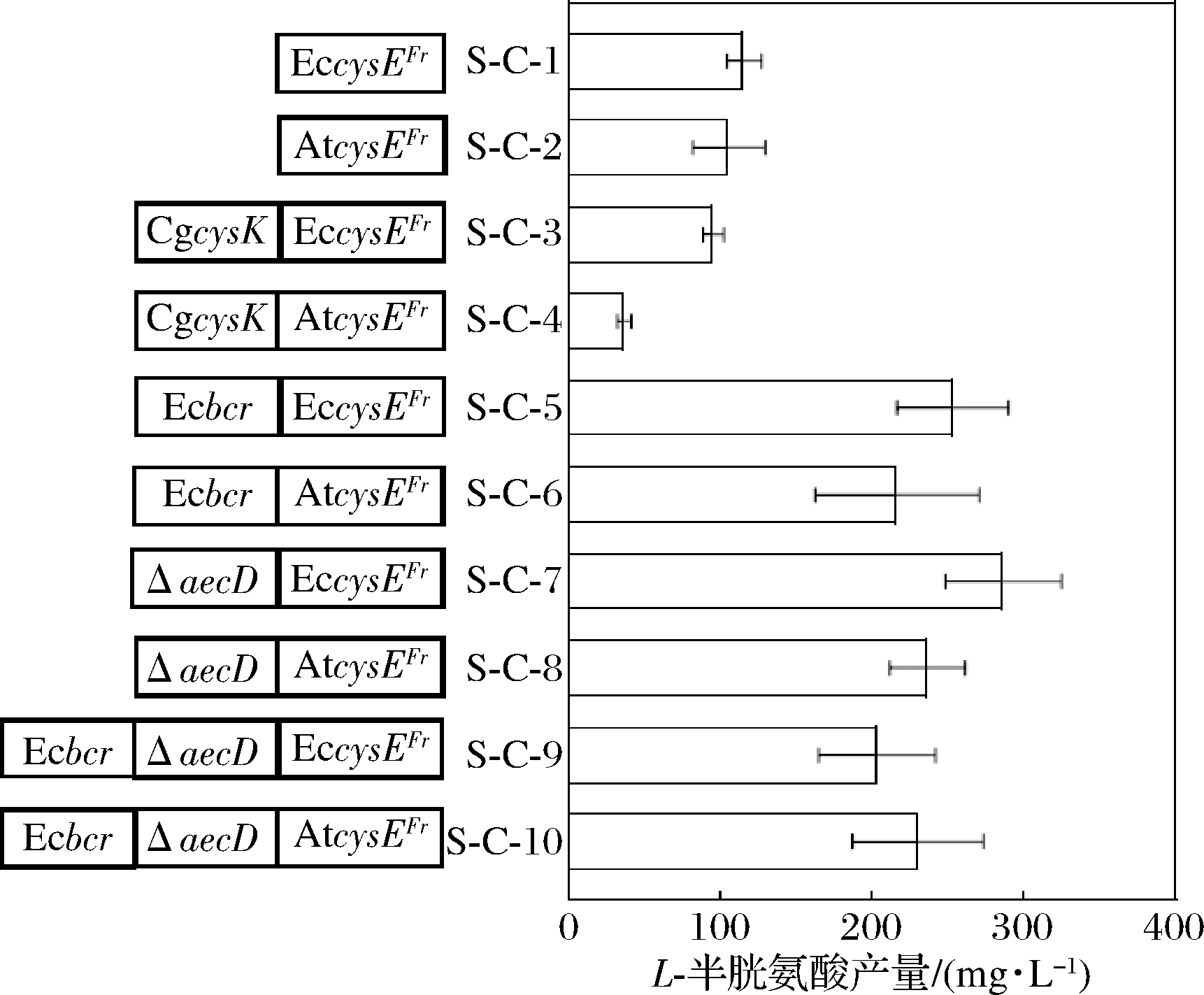
图5 本文构建的重组菌株L-半胱氨酸的产量
Fig.5 The production of L-cysteine of the recombinant strain constructed
2.4.2 不同浓度 Na2S2O3对重组菌株发酵的影响
进一步考察Na2S2O3质量浓度(4、6、8、10、12、14、20、30 g/L)对重组菌株生长及产L-半胱氨酸的影响,结果如图6-b所示,随着Na2S2O3浓度的增加,L-半胱氨酸产量逐渐增加,当Na2S2O3质量浓度为12 g/L,L-半胱氨酸产量达到最大,为476.0 mg/L,此后再提高Na2S2O3的浓度,L-半胱氨酸产量不再变化,故选择12 g/L 作为Na2S2O3的最佳浓度。
2.4.3 不同时间添加Na2S2O3对重组菌株发酵的影响
考察不同时间(0、12、24、36 h)添加Na2S2O3对重组菌株生长及产L-半胱氨酸的影响,结果如图6-c所示,在第24 h时添加Na2S2O3,L-半胱氨酸产量达到581.6 mg/L,相对于0 h 添加Na2S2O3,提高了22.2%,说明在菌株生长24 h 时再添加Na2S2O3对重组菌株生长抑制减弱。

a-不同硫源对S-C-7发酵的影响;b-不同浓度Na2S2O3对S-C-7发酵的影响;c-不同时间添加Na2S2O3对S-C-7发酵的影响
图6 优化硫源对S-C-7发酵的影响
Fig.6 The effect of optimizing sulfur source on S-C-7 fermentation
2.5 重组菌株5 L发酵罐发酵评价
进一步考察重组菌株S-C-7在5 L发酵罐中的发酵性能,从图7可以看出,发酵48 h L-半胱氨酸的产量达到最高,为1.2 g/L,在发酵48 h时发酵液中糖基本消耗完全。与摇瓶条件下的最高产量相比,菌株S-C-7在5 L发酵罐上L-半胱氨酸的产量提高了1.1倍。我们进一步研究显示,在摇瓶条件下,当L-半胱氨酸超过0.5 g/L,即对A36菌株产生毒性(数据未展示),后续可以考虑采用适应性进化来提高底盘细胞A36对L-半胱氨酸的耐受性,从而进一步提高L-半胱氨酸的产量。
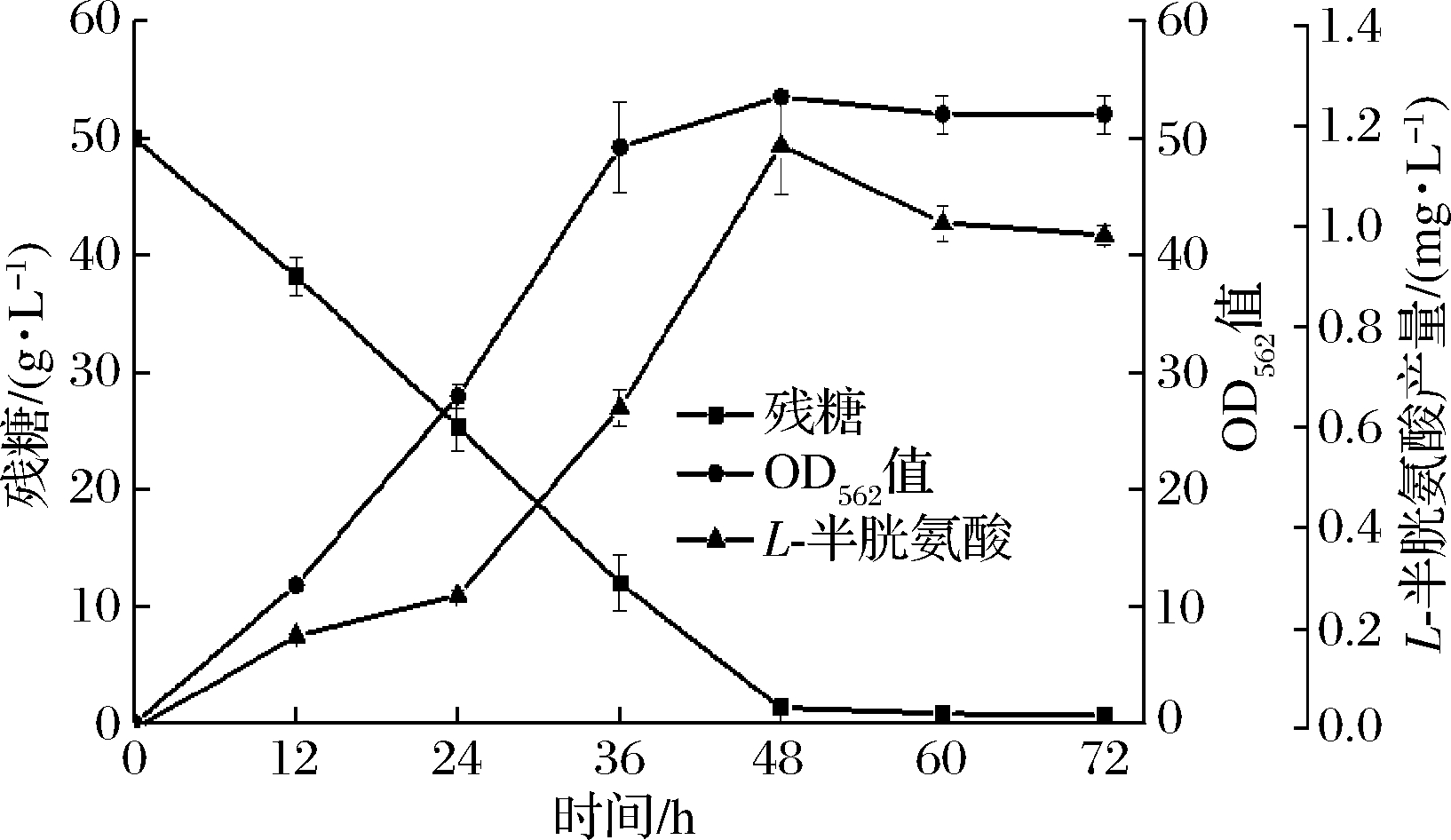
图7 重组菌株S-C-7在5 L发酵罐发酵过程曲线
Fig.7 The fermentation curve of recombinant strain S-C-7 in 5 L bioreactor
3 结论
本文以实验室保藏的一株高产L-丝氨酸的谷氨酸棒杆菌A36为出发菌株,通过解除L-半胱氨酸对cysE的反馈抑制,增强L-丝氨酸O-乙酰基转移酶和OAS巯基化酶-A的表达,强化L-半胱氨酸的转运系统,并且弱化了L-半胱氨酸的降解,成功构建产L-半胱氨酸的重组菌株;其中菌株S-C-7的 L-半胱氨酸产量最高,为286.7 mg/L;进一步对重组菌株S-C-7进行硫源的优化,发现在发酵24 h时添加12 g/L的Na2S2O3,菌株S-C-7的L-半胱氨酸达到581.6 mg/L,较优化前提高了1.0倍。最后在5 L发酵罐对菌株S-C-7进行发酵评价,L-半胱氨酸产量达到1.2 g/L,是目前报道的谷氨酸棒杆菌产L-半胱氨酸的最高产量。
[1] DUAN J, ZHANG Q, ZHAO H, et al.Cloning, expression, characterization and application of atcA, atcB and atcC from Pseudomonas sp. for the production of L-cysteine[J].Biotechnology Letters, 2012, 34(6):1 101-1 106.
[2] TAKAGI H, OHTSU I.L-cysteine metabolism and fermentation in microorganisms[J].Advances in Biochemical Engineering/Biotechnology, 2017, 159:129-151.
[3] CALZETTA L, MATERA M G, ROGLIANI P, et al.Multifaceted activity of N-acetyl-L-cysteine in chronic obstructive pulmonary disease[J].Expert Review of Respiratory Medicine, 2018, 12(8):693-708.
[4] YIN J, REN, W K, YANG G, et al.L-cysteine metabolism and its nutritional implications[J].Molecular Nutrition and Food Research, 2016, 60(1):134-146.
[5] WENDISCH, VOIKER F.Metabolic engineering advances and prospects for amino acid production[J].Metabolic Engineering, 2020, 58:17-34.
[6] YOKOTA A, IKEDA M.Amino Acid Fermentation[M].Japan:Springer, 2017.
[7] POPA C N, POPESCU S, BEREHOIU R.Assessment of the E 920 additive (L-cysteine) in relation to some problems of modern food industry[J].Scientific Papers Series:Management, Economic Engineering in Agriculture and Rural Development, 2013, 13:413-418.
[8] WADA M, TAKAGI H.Metabolic pathways and biotechnological production of L-cysteine[J].Applied Microbiology and Biotechnology, 2006, 73(1):48-54.
[9] 朱加粉, 陈紫薇, 张晓梅, 等.调控NADH/NAD+对重组谷氨酸棒杆菌产L-丝氨酸的影响[J].食品与发酵工业, 2017, 43(6):54-59.
ZHU J F, CHEN Z W, ZHANG X M, et al.Effects of regulating NADH/NAD+ on L-serine production by recombinant Corynebacterium glutamicum[J].Food and Fermentation Industries, 2017, 43(6):54-59.
[10] LIU H, HOU Y H, WANG Y, et al.Fitness of chassis cells and metabolic pathways for L-cysteine overproduction in Escherichia coli[J].Journal of Agricultural and Food Chemistry, 2020, 68(50):14 928-14 937.
[11] 张伟. 谷氨酸棒杆菌外源蛋白分泌表达系统的开发及其应用研究[D].无锡:江南大学, 2019.
ZHANG W.Development and application of exogenous protein secretion and expression system of Corynebacterium glutamicum[D].Wuxi:Jiangnan University, 2019.
[12] 刘川. 谷氨酸棒状杆菌半胱氨酸转运蛋白的鉴定与特性研究以及半胱氨酸单细触物传感器的构建与应用[D].天津:天津科技大学, 2018.
LIU C.Identification and characterization of cysteine transporter in Corynebacterium glutamicum and construction and application of cysteine single-cell sensor[D].Tianjin:Tianjin University of Science and Technology, 2018.
[13] KISHINO M, KONDOH M, HIRASAWA T.Enhanced L-cysteine production by overexpressing potential L-cysteine exporter genes in an L-cysteine-producing recombinant strain of Corynebacterium glutamicum[J].Bioscience Biotechnology and Biochemistry, 2019, 83(12):2 390-2 393.
[14] JOO Y C, HYEON J E, HAN S O.Metabolic design of Corynebacterium glutamicum for production of L-cysteine with consideration of sulfur-supplemented animal feed[J].Journal of Agricultural and Food Chemistry, 2017, 65(23):4 698-4 707.
[15] LEE H S, HWANG B J.Methionine biosynthesis and its regulation in Corynebacterium glutamicum:Parallel pathways of transsulfuration and direct sulfhydrylation[J].Applied Microbiology and Biotechnology, 2003, 62(5-6):459-467.
[16] 贾慧慧, 李晓静, 陈涛,等.微生物发酵法生产L-丝氨酸及L-半胱氨酸研究进展[J].中国生物工程杂志, 2014, 34(5):100-106.
JIA H H, LI X J, CHEN T,et al.The research progress of microbial production of L-serine and L-cysteine[J].China Biotechnology, 2014, 34(5):100-106.
[17] TAKUMI K, ZIYATDINOV M K, SAMSONOV V, et al.Fermentative production of cysteine by Pantoea ananatis[J].Applied and Environmental Microbiology, 2017, 83(5):e02502-e02516.
[18] WEI L, WANG H, XU N, et al.Metabolic engineering of Corynebacterium glutamicum for L-cysteine production[J].Applied Microbiology and Biotechnology, 2019, 103(3):1 325-1 338.
[19] KAWA Y, OHTSU I, TAKUMI K, et al.Enhancement of L-cysteine production by disruption of yciW in Escherichia coli[J].Journal of Bioscience and Bioengineering, 2015, 119(2):176-179.
[20] MA M L, LIU T, WU H Y, et al.Enzymatic synthesis of L-cysteine by Escherichia coli whole-cell biocatalyst[C].International Conference on Applied Biotechnology, 2018.
[21] ZHANG X, ZHANG X M, XU G Q, et al.Integration of ARTP mutagenesis with biosensor-mediated high-throughput screening to improve L-serine yield in Corynebacterium glutamicum[J].Applied Microbiology and Biotechnology, 2018, 102(14):5 939-5 951.
[22] ZHU Q J, ZHANG X M, LUO Y C, et al.L-Serine overproduction with minimization of by-product synthesis by engineered Corynebacterium glutamicum[J].Applied Microbiology and Biotechnology, 2015, 99(4):1 665-1 673.