鲣鱼俗称炸弹鱼,分布于太平洋、印度洋、大西洋热带和亚热带海域,是金枪鱼围网渔业的主要目标鱼种[1],也是世界上重要的海洋食物资源,占金枪鱼产量的70%以上[2]。鲣鱼鱼肉的氨基酸种类丰富,易于人体吸收,且富含二十二碳六烯酸(docosahexaenoic acid,DHA)和二十碳五烯酸(eicosapntemacnioc acid,EPA)等多不饱和脂肪酸。深加工后的鲣鱼味道鲜美,可制成柴鱼、罐头以及生鱼片,便于消费者食用,开发前景比较乐观[3]。
生物胺是一类含氮的低分子质量有机化合物的总称,常见的生物胺一共有8种,大概可以分成3种类型:脂肪族生物胺(精胺、亚精胺、尸胺、腐胺),芳香族生物胺(苯乙胺、酪胺)和杂环胺(色胺、组胺)[4]。生物胺不仅是生成荷尔蒙、核酸、蛋白质等的前体物质,也是生成致癌物质和亚硝基化合物的前体物质[5]。研究发现,生物胺存在于各种食品当中,如水产品、肉类食品、发酵食品[6]等。食物中含有过量的生物胺,人体摄入后会产生不适,如头痛、高血压、发烧、皮疹、呕吐等[7-8]。近年来,鱼类食品因生物胺含量超标而导致的中毒事件时有发生[9],所以各个国家相继规定了生物胺的检测标准。美国规定水产品中组胺及酪胺最高限量分别为50 mg/kg和100 mg/kg[10],新西兰和澳大利亚规定水产品中组胺最大限量为200 mg/kg[11],我国在GB 2733—2015《食品安全国家标准 鲜、冻动物性水产品》中规定,青皮红肉鱼类组胺含量不超过400 mg/kg,其他水产品不超过200 mg/kg。上海市食品药品监督管理局发布的DB31/2004—2012《食品安全地方标准 发酵肉制品》中规定组胺的含量不得超过100 mg/kg。
目前用于检测生物胺的技术种类多样,例如:高效液相色谱技术、液相色谱-串联质谱技术(LC-MS)、离子色谱技术、毛细管电泳技术、电化学生物传感器技术等[12-14]。近几年LC-MS逐渐应用于检测领域,该技术可以鉴别和测定各种类型的农、兽药及生物毒素等残留物[15]。超高效液相色谱-串联质谱(ultrahigh performance liquid chromatography-tandem mass spectrometry, UPLC-MS/MS)技术较LC-MS技术分析时间更短、准确度和灵敏度更高。UPLC-MS/MS在多反应监测(multiple reaction monitoring, MRM)模式下具有很高的灵敏度,可以消除定量分析中基质效应的影响[16-17],因此适用于复杂样品的定量分析[18]。本研究优化了萃取试剂的种类及检测条件,建立了基于UPLC-MS/MS法检测8种生物胺的方法,并考察了其在鲣鱼样品中生物胺检测的应用。
1 材料与方法
1.1 材料与试剂
9种生物胺的标准品(组胺、尸胺、腐胺、酪胺、色胺、苯乙胺、精胺和亚精胺和1,7-二氨基庚烷,纯度≥98%),美国Sigma-Aldrich公司;甲醇(质谱纯),美国Thermon Fisher公司;乙腈(色谱纯)、甲酸(色谱纯)、二氯甲烷,麦克林生化科技公司;0.22 μm一次性针头过滤器,上海阿拉丁生化科技股份有限公司;PRiME HLB 固相萃取柱(100 mg)、C18固相萃取柱(100 mg),美国Waters公司;N-丙基乙二胺(primary secondary amine,PSA)吸附剂、石墨化碳黑(graphitized carbon black,GCB)吸附剂,CNW科技有限公司。
实验所用鲣鱼均来自广东省沿海城市渔市场。
1.2 仪器与设备
TQ-S Micro超高效液相色谱串联质谱仪,美国Waters公司;TDZ5-WS离心机,长沙湘仪仪器有限公司;JJ324BF型电子天平,双杰测试仪器厂;CEBO-24高通量组织研磨仪,上海测博生物有限公司;Milli-Q 超纯水系统,美国Millipore公司;氮吹仪,力辰科技有限公司;IKA T50均质机,德国IKA公司。
1.3 实验方法
1.3.1 色谱条件
色谱柱:ACQUITY UPLC BEH C18色谱柱(100 mm×2.1 mm,1.7 μm),柱温35 ℃,进样量2 μL,流速0.3 mL/min,流动相A:0.5%的甲酸水,流动相B:甲醇。流动相洗脱梯度(A相):0.0~1.5 min,95%;1.5~2.0 min,95%~55%;2.0~3.0 min,55%~2%;3.0~6.0 min,2%~95%。
1.3.2 质谱条件
离子源:电喷雾离子源,电喷雾正离子(electrospray ionization, ESI+)模式;干燥气温度:400 ℃;干燥气体流量:1 000 L/h;毛细管电压:3 000 V;锥孔气体流量:50 L/h;扫描模式:MRM;9种目标化合物的MRM参数见表1。
表1 MRM模式下9种生物胺的质谱参数
Table 1 Mass spectrometry parameters of 9 biogenic amines in MRM mode
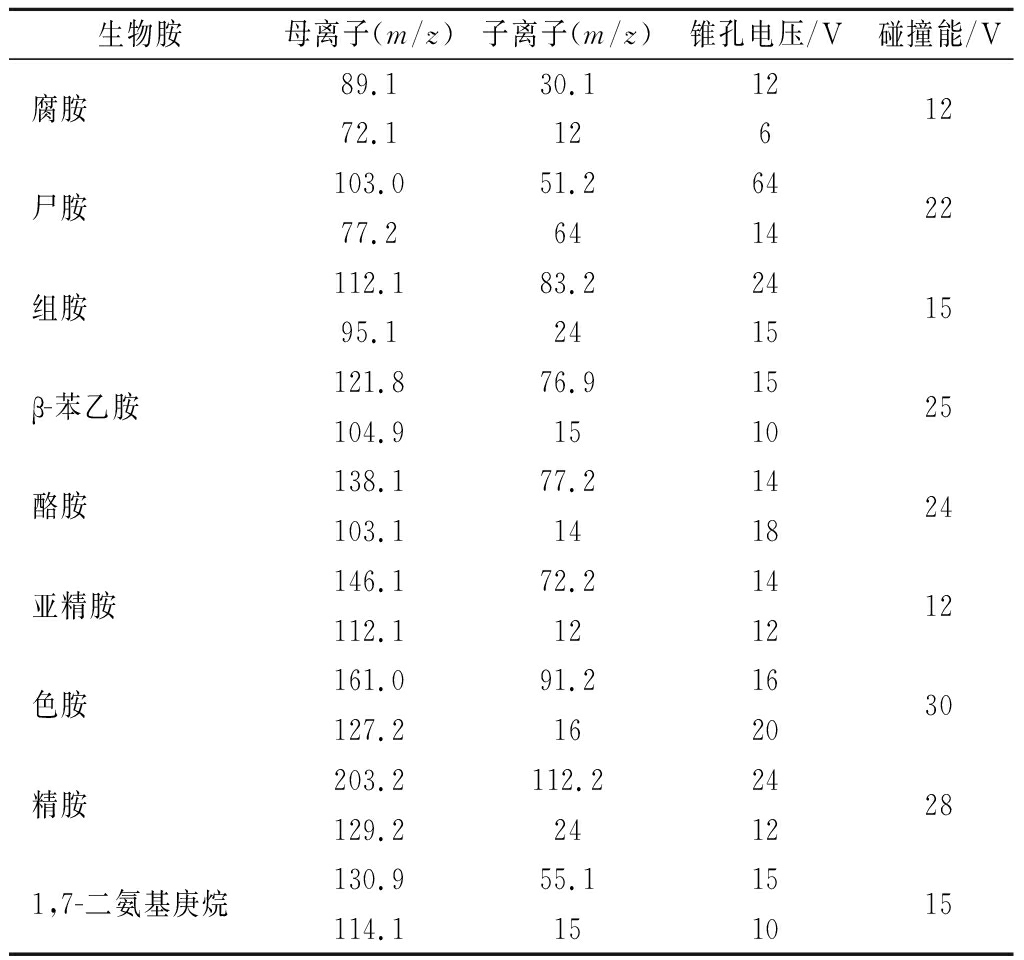
生物胺母离子(m/z)子离子(m/z)锥孔电压/V碰撞能/V腐胺89.130.1121272.1126尸胺103.051.2642277.26414组胺112.183.2241595.12415β-苯乙胺121.876.91525104.91510酪胺138.177.21424103.11418亚精胺146.172.21412112.11212色胺161.091.21630127.21620精胺203.2112.22428129.224121,7-二氨基庚烷130.955.11515114.11510
1.3.3 标准品的配制
准确称取8种生物胺标准品(组胺、尸胺、腐胺、酪胺、色胺、苯乙胺、精胺和亚精胺),每种标准品称取0.01 g,将8种标准品混合放入10 mL的容量瓶中,用超纯水溶解标准品并定容到10 mL,配制成1 000 mg/L 的混合标液,置于-20 ℃冰箱中贮藏。将内标物1,7-二氨基庚烷用超纯水稀释成1 000 mg/L,放于-20 ℃冰箱储存。混合标准液和内标液根据实验需求的浓度现用现配。
1.3.4 样品前处理
1.3.4.1 提取
50 mL的离心管中放入2颗钢珠和2 g搅碎的鱼肉,加入5 mL的0.2%酸化乙腈溶液和100 μL质量浓度为10 mg/L的内标液,置于高通量组织研磨仪提取10 min,取出后以4 000 r/min转速离心10 min,取上清液于试管中。重复以上操作,将2次上清液合并后进行氮吹。
1.3.4.2 提取液的选择
提取溶剂的选择,一方面影响分析方法的回收率,另一方面有助于较少基体的影响。相关文献一般采用盐酸、高氯酸、三氯乙酸、乙腈或乙酸乙酯等溶剂为提取剂,考虑到强酸溶液如果没有完全净化,进入质谱会腐蚀仪器,将含有强酸的提取液去除掉。叶磊海等[19]对比了乙腈、0.2%酸化乙腈、乙腈混合乙酸乙酯体积比(1∶1)的提取效果,发现0.2%酸化乙腈有更好沉淀蛋白的效果。本实验对比同一样品分别用0.2%酸化乙腈和0.2%酸化甲醇提取生物胺的结果,结果发现0.2%酸化乙腈整体效果更好,所以本实验选择0.2%酸化乙腈作为样品的提取液。
1.3.4.3 净化
将吹至尽干的样品用1 mL的流动相进行复溶,加入3 mL的二氯甲烷,涡旋1 min后以10 000 r/min转速离心10 min,取上清液过0.22 μm的滤膜,上机进行检测。
固相萃取净化:C18固相萃取柱,甲醇活化小柱,加入2 mL提取液,用2 mL的40%甲醇溶液将生物胺洗脱下来,收集洗脱液,过滤后上机。PRiME HLB固相萃取柱,直接将2 mL提取液过柱,收集过滤后上机。PAS和GCB为填料,分别称取100 mg的填料物质于10 mL离心管,加入2 mL提取液,涡旋1 min,放入离心机以10 000 r/min转速离心5 min后取上清液,上机进行检测。
1.4 数据处理
图谱采集及原始数据处理用Waters MassLynx软件完成,采用Excel 2019软件处理试验数据并绘图,实验数据统计分析使用IBM SPSS Statistics 25软件。
2 结果与分析
2.1 标准品分析结果
根据母离子和子离子的参考值,使用质谱调谐,优化质谱检测参数。用建立好的UPLC-MS/MS方法检测质量浓度为10 mg/L的生物胺混合标准液,由图1看出8种生物胺标准品在MRM模式下的峰形良好,不同离子通道可将8种生物胺分开进行分析。

a-精胺; b-色胺; c-亚精胺; d-酪胺; e-β-苯乙胺; f-组胺; g-尸胺; h-腐胺
图1 八种生物胺标准品的色谱分析图
Fig.1 Chromatographic analysis chart of 8 kinds of biogenic amines standards
2.2 样品净化条件的优化
4种前处理的结果,如图2所示。鉴于样品提取液中含有大量蛋白和脂肪,净化的目的是除去提取液中的蛋白质、脂肪等多种杂质,本文选择使用C18固相萃取柱、PRiME HLB固相萃取柱、PSA填料和GCB填料4种净化材料以及二氯甲烷对样品进行前处理。实验结果表明,GCB填料可以吸附内标物质,造成数据分析的误差,所以GCB填料的实验结果不放入对比图。前处理使用PRiME HLB固相萃取柱和PSA填料的回收率相对较低,前处理使用二氯甲烷和C18固相萃取柱的回收率相对较好,2种方法的回收率分别为109%和86%。C18固相萃取柱对脂类、色素、芳香族化学成分有明显的吸附作用[20],对生物胺也有一定的吸附作用。通过比较,无论是实际净化步骤的复杂程度,还是保留效果和回收率,二氯甲烷净化效果优于其他4种萃取柱和填料。鲣鱼体内脂肪含量低,含有丰富的蛋白质,蛋白质最高可达26.1%[21]。乙腈提取液可以沉淀样品中大部分的蛋白质,在复溶后的样品中加入二氯甲烷,可以有效地除去蛋白质、脂质等杂质。
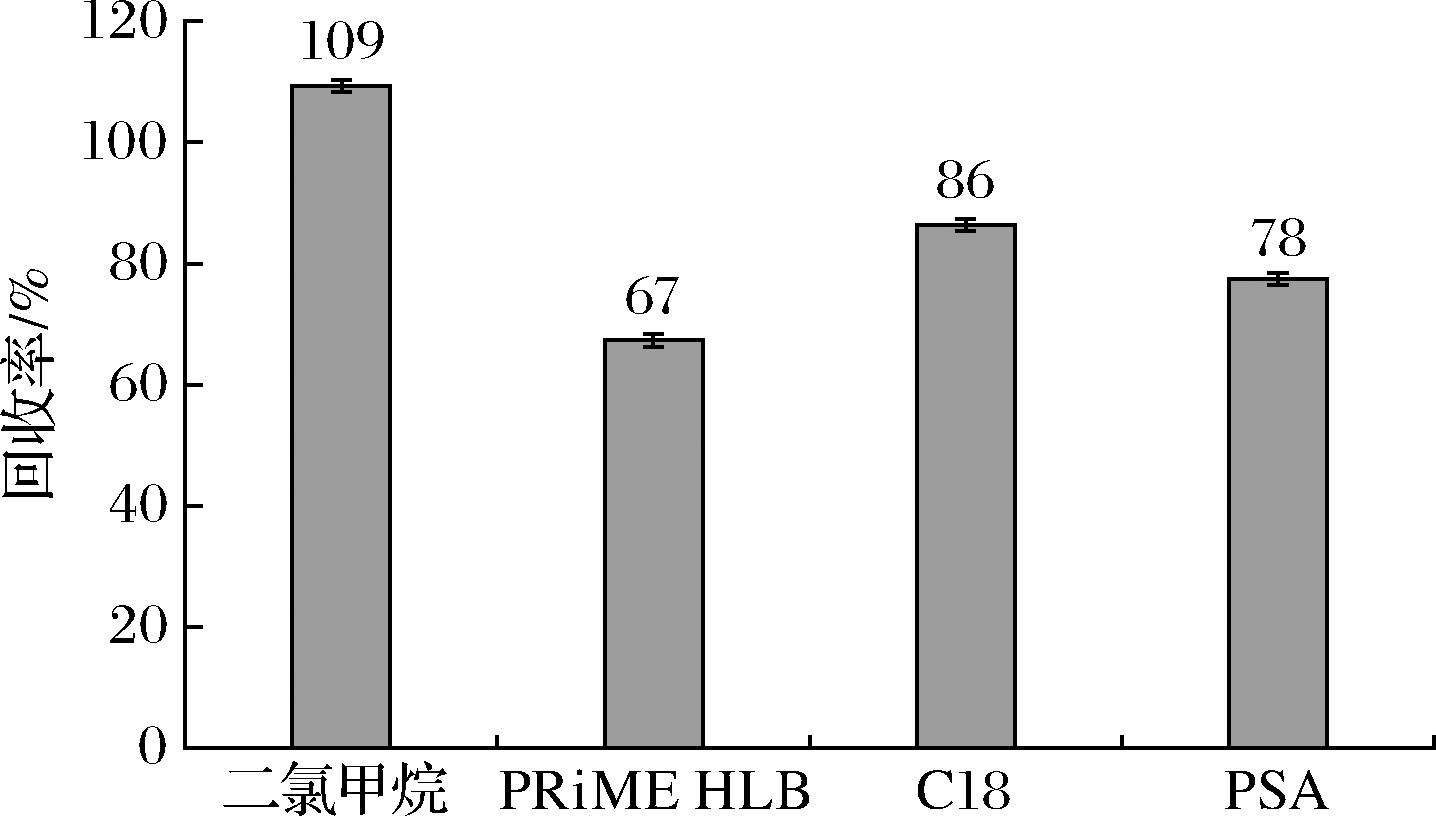
图2 四种不同前处理方法的组胺回收率对比图
Fig.2 Comparison chart of histamine recovery rates of 4 different pretreatment methods
2.3 方法验证
2.3.1 检出限、定量限、精密度和标准曲线
基质效应在质谱检测中普遍存在,在动物源性食品中的检测更为明显[22],本试验使用鲣鱼的基质样品溶液作为底液,添加少量不同浓度的标准溶液,对8种生物胺建立标准曲线并确定检出限(limit of detection,LOD)和定量限(limit of quantitation,LOQ),以此来消除基质效应对检测结果的影响。按照1.3.4的步骤提取基质样品溶液,800 μL基质样品溶液中加入100 μL标准品溶液和100 μL内标溶液,混合均匀后过0.22 μm滤膜,上机进行检测。根据前期检测结果可知,在低浓度时精胺和亚精胺的响应值较其他6种生物胺低,需适当提高这2种生物胺的线性范围,精胺和亚精胺的线性范围是1~20 mg/L,色胺、酪胺、β-苯乙胺、组胺、尸胺和腐胺的线性范围是0.5~10 mg/L。
8种生物胺在基质样品溶液中的检出限、定量限、标准曲线结果如表2所示,8种生物胺的线性回归方程相关系数R在0.995 6~0.999 6,说明生物胺在基质样品溶液中线性关系良好,以3倍信噪比(S/N=3)和10倍信噪比(S/N=10)作为LOD和LOQ,计算出相应方法的检出限和定量限,8种生物胺的LOD为75~150 μg/kg,LOQ为250~500 μg/kg。连续对2 mg/L 的生物胺混合标准溶液进样6次,分析平行结果,8种生物胺标准品的相对标准偏差(relative standard deviation,RSD)值为1.2%~6.5%,说明UPLC-MS/MS仪器的精密度良好。
表2 八种生物胺在基质样品溶液中的标准曲线、检出限和定量限
Table 2 Standard curve, LOD and LOQ of 8 biogenic amines in matrix sample solution
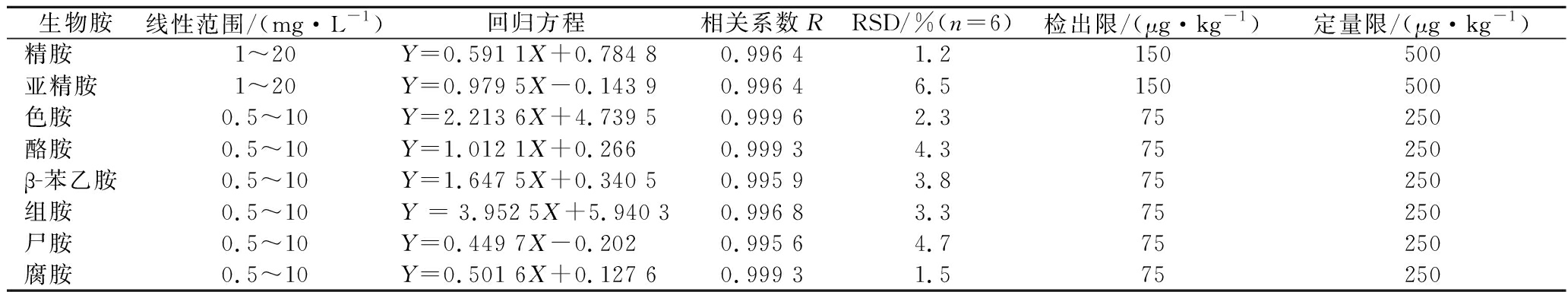
生物胺线性范围/(mg·L-1)回归方程相关系数RRSD/%(n=6)检出限/(μg·kg-1)定量限/(μg·kg-1)精胺1~20Y=0.591 1X+0.784 80.996 41.2150500亚精胺1~20Y=0.979 5X-0.143 90.996 46.5150500色胺0.5~10Y=2.213 6X+4.739 50.999 62.375250酪胺0.5~10Y=1.012 1X+0.2660.999 34.375250β-苯乙胺0.5~10Y=1.647 5X+0.340 50.995 93.875250组胺0.5~10Y = 3.952 5X+5.940 30.996 83.375250尸胺0.5~10Y=0.449 7X-0.2020.995 64.775250腐胺0.5~10Y=0.501 6X+0.127 60.999 31.575250
2.3.2 加标回收试验
将生物胺标准液进行稀释,随后分别取100 μL加入2 g样品中,按照建立好UPLC-MS/MS方法检测加标样品生物胺含量,做6组平行试验,计算3个加标水平的回收率和RSD,结果如表3所示。8种生物胺的平均加标回收率为82%~113%,RSD为2.3%~9.7%。
表3 八种生物胺的加标回收结果
Table 3 Standard addition recovery results of 8 biogenic amines

生物胺加标量/(μg·kg-1)回收率/%RSD/%(n=6)5001046.7精胺1 0001137.92 000943.1500879.7亚精胺1 000988.62 0001048.3250965.4色胺5001012.31 0001023.4250996.6酪胺500943.31 0001083.1250827.7β-苯乙胺5001075.21 000986.12501124.1组胺500883.31 000922.52501128.6尸胺500915.71 000992.4250875.9腐胺500833.91 000923.2
2.4 样品的结果分析
取同一条新鲜鲣鱼的赤身(背中部)部位,25 ℃条件下贮藏,设置3个重复,每隔12 h检测样品中生物胺的含量,观察样品3 d内生物胺含量的变化。在72 h的贮藏时间内,酪胺、组胺、β-苯乙胺、腐胺和尸胺有一定变化,精胺、亚精胺和色胺变化不明显。酪胺、组胺、β-苯乙胺、腐胺和尸胺5种生物胺的含量变化如图3所示,由图3可知,在25 ℃存放条件下,组胺变化最为明显,从12~24 h,组胺含量从302.1 mg/kg迅速上升到668.1 mg/kg,明显超过我国所规定的最大限。在25 ℃ 存放12 h后检测出酪胺的含量为44.1 mg/kg,到72 h其含量上升到168.6 mg/kg,苯乙胺存放24 h后开始检测出,从6.0 mg/kg上升到13.3 mg/kg,腐胺在贮藏24 h后检测出,从16.0 mg/kg上升到80.8 mg/kg,尸胺的含量在贮藏结束时达到351.2 mg/kg。
8种生物胺中组胺和酪胺的毒性最大[23],腐胺、尸胺还可通过抑制生物胺分解酶的活性,可增加组胺和酪胺的含量和毒性[24],应严格控制这4种生物胺的在水产品中的含量。水产品的腐败变质与微生物有着密切联系,其体内的氨基酸与体外游离的氨基酸被氨基酸脱羧酶作用生成生物胺,这些酶由产胺菌生成,所以生物胺与水产品的新鲜度有内在关联[25]。研究结果表明,鲣鱼作为红肉鱼类,贮藏不当情况下,很容易造成组胺超标现象,食品企业多用鲣鱼加工成罐头制品,为了保障产品安全,加工之前有必要检测鲣鱼中生物胺的含量。

图3 在25 ℃贮藏条件下酪胺、苯乙胺、腐胺、组胺和尸胺的 含量变化
Fig.3 Changes in the content of tyramine, β-phenylethylamine, putrescine, histamine and cadaverine under storage conditions of 25 ℃
3 结论
本文建立了同时检测8种生物胺的UPLC-MS/MS方法,用C18色谱柱进行分离,在正离子MRM模式下进行分析,6 min内可以分析出8种生物胺的检测结果,标准品的相关系数R值在0.995 6~0.999 6,该方法的LOD为75~150 μg/kg,LOQ为250~500 μg/kg。在加标实验中(n=6),样品的平均回收率在82%~113%,RSD在2.3%~9.7%。用建立好的UPLC-MS/MS方法检测鲣鱼样品,样品在25 ℃贮藏72 h后,组胺含量达到668.1 mg/kg,酪胺含量达到168.6 mg/kg,腐胺含量达到80.8 mg/kg,尸胺含量达到351.2 mg/kg,说明鲣鱼腐败变质程度和生物胺的含量呈正相关。本方法分析时间短,在6 min内可以检测出样品中生物胺含量,且样品前处理无需衍生化处理,可对检测生物胺进行快速准确的定性和定量,操作简单、回收率良好大大提高了样品检测效率。
[1] 李鹏, 许柳雄, 周成, 等.中西太平洋金枪鱼围网自由鱼群渔场重心变动及其与南方涛动指数的关系[J].南方水产科学, 2020, 16(2):70-76.
LI P, XU L X, ZHOU C, et al.Variation of fishing ground gravity of tuna free-swimming school caught by purse seiner in Western and Central Pacific Ocean and its relationship with Southern Oscillation Index[J].South China Fisheries Science, 2020, 16(2):70-76.
[2] KOLODY D, HOYLE S.Evaluation of tag mixing assumptions in western Pacific Ocean skipjack tuna stock assessment models[J].Fisheries Research, 2015, 163:127-140.
[3] 童铃, 金毅, 徐坤华, 等.3种鲣鱼背部肌肉的营养成分分析及评价[J].南方水产科学, 2014,10(5):51-59.
TONG L, JIN Y, XU K H, et al.Analysis of nutritional components in back muscle of skipjacks[J].South China Fisheries Science, 2014,10(5):51-59.
[4] SANTOS M H S.Biogenic amines:Their importance in foods[J].International Journal of Food Microbiology, 1996, 29(2-3):213-231.
[5] 张凤杰, 薛洁, 王异静, 等.黄酒中生物胺的形成及其影响因素[J].食品与发酵工业, 2013, 39(2):62-68.
ZHANG F J, XUE J, WANG Y J, et al.Study on biogenic amines formation and influencing factors in Chinese rice wine[J].Food and Fermentation Industries, 2013, 39(2):62-68.
[6] 刘亚楠,李欢,陈剑,等.水产品生物胺检测技术研究进展[J].食品科学, 2021, 42(15):269-277.
LIU Y N, LI H, CHEN J, et al.Progress in detection techniques for biogenic amines in aquatic products[J].Food Science, 2021, 42(15):269-277.
[7] 杨春婷, 赵晓娟, 白卫东.肉类中的生物胺形成及其在肉类新鲜度评价中的应用研究进展[J].肉类研究, 2017, 31(1):55-59.
YANG C T, ZHAO X J, BAI W D.Formation of biogenic amines during meat storage and their application in assessment of meat freshness[J].Meat Research, 2017, 31(1):55-59.
[8] DEL RIO B, REDRUELLO B, LINARES D M, et al.The biogenic amines putrescine and cadaverine show in vitro cytotoxicity at concentrations that can be found in foods[J].Scientific Reports, 2019, 9:120.
[9] MERCOGLIANO R, SANTONICOLA S.Scombroid fish poisoning:Factors influencing the production of histamine in tuna supply chain.A review[J].LWT-Food Science & Technology, 2019, 114:108374.
[10] ZOUMAS-MORSE C, ROCK C L, QUINTANA E L, et al.Development of a polyamine database for assessing dietary intake[J].Journal of the American Dietetic Association, 2007, 107(6):1 024-1 027.
[11] PRESTER L.Biogenic amines in fish, fish products and shellfish:A review[J].Food Additives & Contaminants.Part A:Chemistry, Analysis, Control, Exposure & Risk Assessment, 2011, 28(11):1 547-1 560.
[12] 邓建朝, 李少丽, 杨贤庆, 等.金枪鱼中生物胺的防控技术与检测技术的研究发展[J].食品与发酵工业, 2019, 45(24):262-268.
DENG J C, LI S L, YANG X Q, et al.Research and development of prevention and control technology of bioamine and its detection technology in tuna[J].Food and Fermentation Industries, 2019, 45(24):262-268.
[13] PALERMO C, MUSCARELLA M, NARDIELLO D, et al.A multiresidual method based on ion-exchange chromatography with conductivity detection for the determination of biogenic amines in food and beverages[J].Analytical & Bioanalytical Chemistry, 2013, 405(2-3):1 015-1 023.
[14] HE L L, XU Z Q, HIROKAWA T, et al.Simultaneous determination of aliphatic, aromatic and heterocyclic biogenic amines without derivatization by capillary electrophoresis and application in beer analysis[J].Journal of Chromatography A, 2017, 1 482:109-114.
[15] 张燕, 何祥, 江海波, 等.高效液相色谱与液质联用技术在有机化工生产中的应用[J].化工设计通讯, 2020, 46(10):142-143.
ZHANG Y, HE X, JIANG H B, et al.Application of HPLC and LC-MS in organic chemical production[J].Chemical Engineering Design Communications, 2020, 46(10):142-143.
[16] ZHANG H W, YU M, JIA H M, et al.Comprehensive identification of potential antioxidant components in the aerial parts of Polygonum chinense L.var.hispidum using ultra high performance liquid chromatography coupled with quadrupole time-of-flight mass spectrometry[J].Journal of Separation Science, 2020, 43(12):2 380-2 392.
[17] CHU C, ZHANG H, MAO H, et al.Simultaneous determination of seven compounds in Chinese patent medicines Chenxiangqu by matrix solid-phase dispersion coupled with ultra-high performance liquid chromatography/quadrupole time-of-flight mass spectrometry[J].Journal of Separation Science, 2020, 43(14):2 869-2 879.
[18] ZHAO Y Y, LU H L, WANG Q, et al.Rapid qualitative profiling and quantitative analysis of phenolics in Ribes meyeri leaves and their antioxidant and antidiabetic activities by HPLC-QTOF-MS/MS and UHPLC-MS/MS[J].Journal of Separation Science, 2021, 44(7):1 404-1 420.
[19] 叶磊海, 裘均陶, 钟世欢, 等.基于PriME净化的高效液相色谱-串联质谱法检测水产品中9种生物胺[J].食品工业科技, 2019, 40(9):253-257;263.
YE L H, QIU J T, ZHONG S H, et al.Determination of 9 kinds of biological amines in aquatic products by high performance liquid chromatography-tandem mass spectrometry based on PriME solid phase extraction[J].Science and Technology of Food Industry, 2019, 40(9):253-257;263.
[20] XIAN Y P, DONG H, WU Y L, et al.QuEChERS-based purification method coupled to ultrahigh performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS) to determine six quaternary ammonium compounds (QACs) in dairy products[J].Food Chemistry, 2016, 212:96-103.
[21] 孙丽.金枪鱼肉在蒸煮过程中品质特性变化的研究[D].无锡:江南大学, 2009.
SUN L.Study on quality changes of tuna during steam cooking processes[D].Wuxi:Jiangnan University, 2009.
[22] 方志娟, 李晓芹, 丁洪流, 等.UPLC-MS/MS法测定动物源性食品中16种非甾体消炎药残留量[J].安徽农业科学, 2021, 49(21):211-214;217.
FANG Z J, LI X Q, DING H L, et al.Determination of 16 non-steroidal anti-inflammatory veterinary drugs residues in animal-origin foods by UPLC-MS/MS[J].Journal of Anhui Agricultural Sciences, 2021, 49(21):211-214;217.
[23] 王光强, 俞剑燊, 胡健, 等.食品中生物胺的研究进展[J].食品科学, 2016, 37(1):269-278.
WANG G Q, YU J S, HU J, et al.Progress in research on biogenic amines in foods[J].Food Science, 2016, 37(1):269-278.
[24] HERN NDEZ-ORTE P, LAPE
NDEZ-ORTE P, LAPE A A C, PE
A A C, PE A-GALLEGO A, et al.Biogenic amine determination in wine fermented in oak barrels:Factors affecting formation[J].Food Research International, 2008, 41(7):697-706.
A-GALLEGO A, et al.Biogenic amine determination in wine fermented in oak barrels:Factors affecting formation[J].Food Research International, 2008, 41(7):697-706.
[25] 杨姗姗, 王晓雯, 林翠苹.水产品中生物胺的研究进展[J].青岛农业大学学报(自然科学版), 2021, 38(1):65-73.
YANG S S, WANG X W, LIN C P.Research progress of biogenic amines in aquatic products[J].Journal of Qingdao Agricultural University (Natural Science), 2021, 38(1):65-73.