牦牛被誉为“高原之舟”,生活在严寒高原地区,是我国草原畜牧业的支柱[1]。独特的生存环境使牦牛肉具有肉质鲜美,高蛋白及低热量、含多种氨基酸和多种矿物质元素等特点,被称为天然绿色有机食品,受到国内外广泛关注[2]。肉类的品质主要包括嫩度、肉色、多汁性和风味等[3],而肉色是消费者用以判断鲜肉货架期和可接受性的最常用标准,也是影响其购买意向的重要因素之一[4]。
鲜亮的樱桃色被认为是肉质优良的标志,消费者通常将其与新鲜和健康联系起来。在销售、贮藏过程中鲜肉的颜色极易变为暗红、苍白或暗绿色,这些肉色通常被消费者认为不健康而被拒绝[5]。动物屠宰放血后,肌红蛋白(myoglobin,Mb)在无氧环境条件下常以脱氧肌红蛋白(deoxymyoglobin,DeoMb)状态存在,使肉呈紫红色;而在氧充足条件下,DeoMb与氧结合形成氧合肌红蛋白(oxymyoglobin,OMb),使肉呈鲜红色。这2种状态的Mb被氧化后形成高铁肌红蛋白(metmyoglobin,MMb)使肉呈棕褐色,MMb的积累导致了肉色的劣变[6],而肌肉细胞中MetMbR可将其还原成Mb,起到稳定肉色的作用。活体动物中不同部位肌肉具有特定的解剖位置和生理功能,由于肌纤维类型[慢速氧化型(I型)、快速氧化型(IIa型)、中间型(IIx型)和快速酵解型(IIb型)]不同而导致肌肉化学组成和新陈代谢具有差异性,故不同部位肉的宰后生化特性和肉色稳定性存在一定差异[7]。原因在于肌纤维类型不同,Mb含量具有较大的差异,Mb在氧化型肌纤维中含量较高,因此氧化型Ⅰ、Ⅱa型肌纤维含量高的肌肉肉色鲜红,肉品质较好;而酵解型Ⅱb型肌纤维含量高的肌肉颜色苍白,肉品质较低[8]。辛建增[9]研究指出羊背最长肌、半膜肌和腰大肌的肉色在成熟过程中存在一定差异。RYU等[10]研究发现,猪肉肉色与I型和Ⅱa型肌纤维所占比例呈正相关,而与IIb型肌纤维所占比例呈负相关。目前,关于肌肉部位、肌纤维类型与肌肉品质之间研究主要集中在其对肌肉嫩度的影响。而关于不同部位及肌纤维类型对川西北牦牛肉成熟过程中肌肉色泽和肉色稳定性影响尚未见报道,且牦牛不同部位肉的肉色变化与肉色稳定性和pH之间的关系尚不清楚。因此,为充分了解成熟过程中川西北牦牛不同部位肉、肌纤维类型与肉色形成之间潜在关系,有必要进行相关研究。
本研究以川西北麦洼牦牛背阔肌、背最长肌和半腱肌为研究对象,测定分析不同部位牦牛肉在宰后成熟过程中色泽、肉色稳定性评价指标、pH值及不同部位上述指标之间的相互关系,确定不同部位牦牛肉在宰后成熟过程中其肉色稳定性的变化情况及与肌纤维类型之间的潜在关系,以期为提高不同部位肉的加工适宜性和稳定肉色品质提供可靠依据。
1 材料与方法
1.1 材料与试剂
材料:选取产自四川省红原县同一牧场,平均年龄3.5岁、生长发育良好、体重约(300±50) kg的公牦牛4头。屠宰后立即从胴体上取下牦牛背阔肌、背最长肌和半腱肌各约1.2 kg。试剂:磷酸二氢钠、磷酸氢二钠、氯化钠、氢氧化钠、浓盐酸等,均为分析纯,成都市科龙化工试剂厂;MR ELISA检测试剂盒,上海酶联生物科技有限公司。
1.2 仪器与设备
PL303电子天平,梅特勒-托利多仪器(上海)有限公司;Thermo Scientific Revco ULT-1786-6V超低温冰箱,美国赛默飞科技公司;MP511 Lab pH计,上海三信仪表厂;UV2100紫外可见分光光度计,上海尤尼柯仪器有限公司;Centrifuge 5804 R高速冷冻离心机,德国Eppendorf公司;CR-400便携式色差仪,日本Konica Minolta公司;FSH-2A可调高速组织匀浆机,金坛市华城海龙实验仪器厂;Rayto RT-6100酶标仪,济南骏驰生物科技有限公司;pH STAR胴体肌肉pH值直测仪,德国Ingenieurhuro R.Matthaus公司。
1.3 试验方法
1.3.1 样品处理
立即分别取3个部位宰后30 min内的肉样(称重约60 g)各4份作为0 h样本,快速剔除表面脂肪和结缔组织后,置于液氮中备用。将剩余3个部位肉样切成体积大小均匀且每块重量约60 g各12份,置于4 ℃条件下成熟,时间点分别设置为6、12、24、72、120、168 h,并在相应成熟时间点对肉色、MetMbR活性、pH值等指标进行测定。
1.3.2 指标测定方法
1.3.2.1 肉色
在相应的成熟时间点取样,采用已经进行白板校正的色差仪测定肉色,每个肉样取3个不同的点测定其L*值、a*值和b*值,取其平均值。并计算H*,如公式(1)所示:
(1)
1.3.2.2 Mb氧化状态
参照KRZYWICKI[11]的方法,略做修改。将留取备用的待测肉样从-80 ℃冰箱中取出,用少量生理盐水冲洗,并用滤纸吸干多余水分,立即将肉样切碎。取肉样10 g,加入0.04 mol/L、pH 6.8的磷酸盐缓冲液20 mL,匀浆25 s。匀浆液在4 ℃条件下静置1 h后,在3 300 r/min条件下离心30 min。用滤纸过滤所取上清液并用上述缓冲液定容至25 mL,测定波长分别为525、545、565、572 nm处样品的吸光度。总肌红蛋白(total myoglobin,TMb)、OMb、MMb、计算如公式(2)、公式(3)、公式(4)所示:
TMb/(mg·g-1)=-0.166A572+0.086A565+0.088A545+0.099A525
(2)
OMb/%=(0.882R1-1.267R2+0.809R3-0.361)×100
(3)
MMb/%=(-2.514R1+0.777R2+0.800R3+1.098)×100
(4)
式中:R1、R2、R3分别是吸光率比值A572/A525、A565/A525、A545/A525
1.3.2.3 MetMbR活性
取肉样约1.0 g,放入预冷的离心管中,按照1∶9(g∶mL)加入9 mL的冷冻磷酸盐缓冲溶液(0.01 mmol/L,pH 7.2~7.4),在12 000 r/min条件下冰浴匀浆。然后4 ℃、6 000 r/min冷冻离心20 min,取上清液备用。具体操作参照牛MR ELISA检测试剂盒的说明书。
1.3.2.4 pH值
使用胴体pH计测定。取各样品3个不同位置点进行测定,计算并取其平均值。
1.4 数据处理分析
数据均取3次重复测定的平均值并用平均值±标准差表示。利用SPSS 20.0对数据进行统计分析获得平均值和标准差,采用Duncan多重比较进行显著性方差分析,显著性水平P<0.05。作图采用Microsoft 2016 Excel软件。
2 结果与分析
2.1 不同部位牦牛肉成熟期间色泽的变化
肌纤维类型的组成直接影响着肌肉颜色。由表1可知,3个部位的L*值随着成熟时间的延长呈先上升后下降趋势,背阔肌L*值在72 h达到最大值,背最长肌和半腱肌的L*值在120 h达到最大,此变化与陈景宜等[12]研究结果相一致。背阔肌L*值在6 h和24 h显著高于其他2个部位肉(P<0.05),而在其他时间点,三者的L*值无显著性差异。L*值表示亮度,L*值越大表示肌肉亮度越高[13],说明背阔肌的亮度在这2个时间点显著高于其他部位肉。
表1 不同部位牦牛肉成熟期间肉色的变化
Table 1 Changes of meat color in different parts of yak meat during postmortem aging
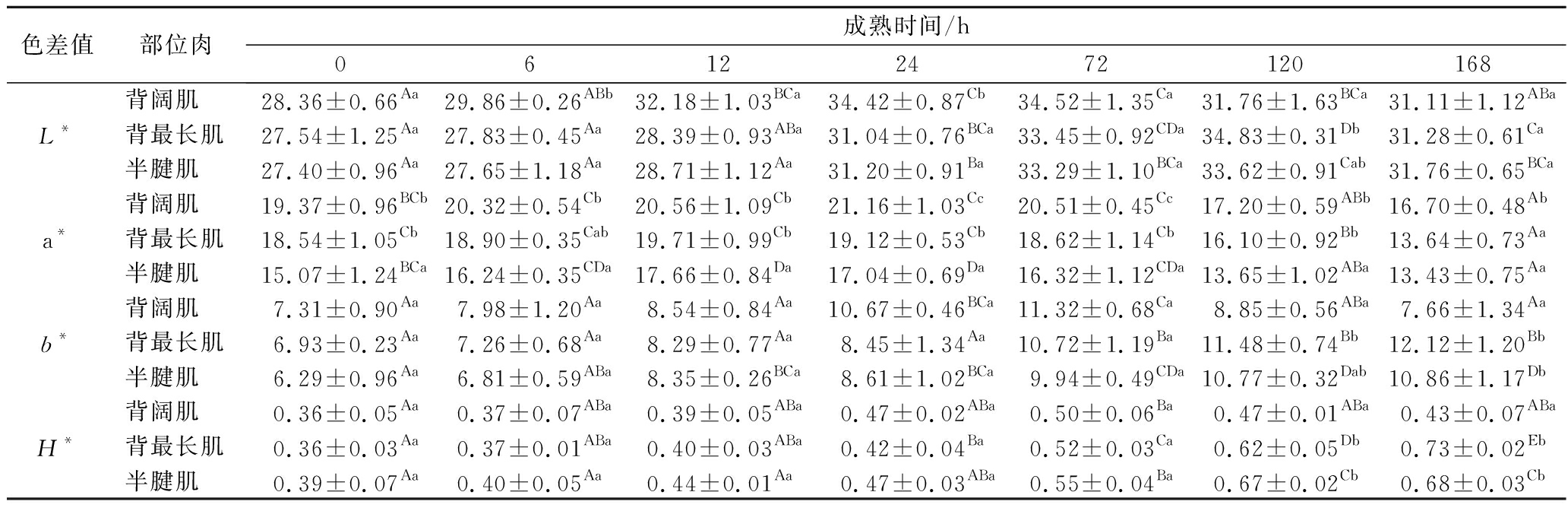
色差值部位肉成熟时间/h06122472120168背阔肌28.36±0.66Aa29.86±0.26ABb32.18±1.03BCa34.42±0.87Cb34.52±1.35Ca31.76±1.63BCa31.11±1.12ABaL*背最长肌27.54±1.25Aa27.83±0.45Aa28.39±0.93ABa31.04±0.76BCa33.45±0.92CDa34.83±0.31Db31.28±0.61Ca半腱肌27.40±0.96Aa27.65±1.18Aa28.71±1.12Aa31.20±0.91Ba33.29±1.10BCa33.62±0.91Cab31.76±0.65BCa背阔肌19.37±0.96BCb20.32±0.54Cb20.56±1.09Cb21.16±1.03Cc20.51±0.45Cc17.20±0.59ABb16.70±0.48Aba*背最长肌18.54±1.05Cb18.90±0.35Cab19.71±0.99Cb19.12±0.53Cb18.62±1.14Cb16.10±0.92Bb13.64±0.73Aa半腱肌15.07±1.24BCa16.24±0.35CDa17.66±0.84Da17.04±0.69Da16.32±1.12CDa13.65±1.02ABa13.43±0.75Aa背阔肌7.31±0.90Aa7.98±1.20Aa8.54±0.84Aa10.67±0.46BCa11.32±0.68Ca8.85±0.56ABa7.66±1.34Aab*背最长肌6.93±0.23Aa7.26±0.68Aa8.29±0.77Aa8.45±1.34Aa10.72±1.19Ba11.48±0.74Bb12.12±1.20Bb半腱肌6.29±0.96Aa6.81±0.59ABa8.35±0.26BCa8.61±1.02BCa9.94±0.49CDa10.77±0.32Dab10.86±1.17Db背阔肌0.36±0.05Aa0.37±0.07ABa0.39±0.05ABa0.47±0.02ABa0.50±0.06Ba0.47±0.01ABa0.43±0.07ABaH*背最长肌0.36±0.03Aa0.37±0.01ABa0.40±0.03ABa0.42±0.04Ba0.52±0.03Ca0.62±0.05Db0.73±0.02Eb半腱肌0.39±0.07Aa0.40±0.05Aa0.44±0.01Aa0.47±0.03ABa0.55±0.04Ba0.67±0.02Cb0.68±0.03Cb
注:大写字母表示不同成熟时间同一肌肉类型的差异性,小写字母表示相同成熟时间不同肌肉类型的差异性;不同字母表示差异显著(P<0.05);相同字母表示差异不显著(P>0.05)
成熟过程中,3个部位肉a*值均呈先上升后下降趋势,背阔肌a*值在24 h达到最大值而背最长肌和半腱肌的a*值则在12 h达到最大。原因在于宰后初期Mb与O2结合形成了鲜红色的OMb,使a*值逐渐增大;随着成熟时间的延长,OMb进一步与O2接触生成暗褐色的MMb,导致a*值逐渐下降。6~168 h,背阔肌a*值均显著高于半腱肌(P<0.05),除24~72 h和168 h外,背阔肌a*值均与背最长肌无显著差异,说明3种肌肉中背阔肌拥有更高的a*值,原因可能是不同部位肌肉能量代谢所导致pH变化及所含Mb含量及其氧化状态不同,以及肌纤维微观结构蛋白质种类和变化情况的不同,也就是受到肌纤维类型的影响。背最长肌中的酵解型肌纤维含量高(Ⅱa、Ⅱb),Ⅱb型肌纤维比例与肌肉的收缩和糖酵解代谢有关;背阔肌主要以Ⅰ型肌纤维为主,与氧化代谢有关,属于氧化型肌纤维,所含有的Mb含量高,肌肉较红;半腱肌所含Ⅱa/Ⅱb比例和Ⅱb型含量高于背阔肌,肌肉颜色显苍白,肉色评分较低,本研究结果与文献报道[9, 14-17]均吻合。
整个成熟过程中,背最长肌和半腱肌的b*值均呈逐渐上升变化,背阔肌的b*值则呈先上升后下降变化并在72 h达到最大值为11.32。随着成熟时间延长,肌肉与O2充分接触,使肌肉内脂肪被氧化,从而导致b*值增大[18]。成熟末期(120~168 h),背阔肌的b*值显著低于另外2个部位肉(P<0.05);除此之外,3个部位肉的b*值之间无显著差异。由表1可知,3个部位肉H*值的变化同b*值相类似。成熟末期(120~168 h),背阔肌的H*值显著低于另外2个部位肉(P<0.05);除此之外,3个部位肉的H*值之间无显著差异。综上所述,背阔肌和背最长肌的肉色略优于半腱肌。
2.2 不同部位牦牛肉成熟期间Mb氧化状态的变化
图1表征了3个部位肉在成熟过程中Mb氧化状态和比例变化情况。由图1-a可知,3个部位肉的TMb含量均呈下降趋势,此变化趋势与杨巧能等[19]研究结果相一致。168 h与6 h相比,3种肌肉的TMb含量分别显著下降32.07%、33.67%、29.69%(P<0.05)。以上结果主要是由于宰后肌肉在成熟过程中Mb氧化所导致,而脂肪的氧化是促使Mb氧化的原因之一,成熟期间脂肪的氧化会产生大量自由基和次级氧化产物,促进了Mb的氧化。其中,自由基通过夺取Mb血红素辅基中+2价铁离子的电子,从而促使其氧化[20],且肌肉中脂类含量、分布与肌纤维类型也有关,氧化型肌纤维可能含有更高的脂质含量和氧化程度[21]。在各成熟时间点,3个部位肉的TMb含量均差异不显著,但从整体变化情况看,背阔肌和背最长肌的TMb含量均高于半腱肌,并在6~120 h较为明显,而背阔肌和背最长肌之间没有明显规律性差异;不同部位TMb含量下降速率不同,可能是由于各部位肌肉保水性不同,在成熟过程中肌肉表面会出现不同程度的渗水,导致存在于肌浆中的水溶性Mb随汁液的流失而减少[12]。
由图1-b可知,3个部位肉的OMb相对含量整体均呈显著下降变化(P<0.05),原因在于肌肉在成熟过程中未隔绝O2,DeoMb快速与O2结合形成OMb,而随着时间的延长,OMb进一步与O2接触被氧化成MMb。宰后初期(6 h),牦牛肉中的Mb主要以OMb形式存在,3个部位的OMb相对含量分别为58.46%、59.13%和56.46%;宰后末期(168 h),3个部位肉的OMb相对含量分别下降至33.14%、35.19%和31.08%,相比于6 h分别下降了43.31%、40.48%和44.95%,且三者的降幅依次为背最长肌<背阔肌<半腱肌。同时,24 h时,背阔肌和背最长肌的OMb相对含量之间无显著差异但均显著高于半腱肌(P<0.05);并在宰后末期(168 h),背最长肌OMb相对含量显著高于半腱肌(P<0.05)但与背阔肌之间无显著差异,造成上述结果的原因可能是部位和肌纤维类型的不同导致肌肉内能量代谢和Mb的氧化程度和速率也不尽相同,拥有氧化型肌纤维更多的背阔肌中OMb相对含量整体高于半腱肌。
由图1-c可知,3个部位肉的MMb相对含量整体均随着成熟时间的延长呈显著上升趋势(P<0.05)。宰后初期(6 h),3个部位肉的MMb相对含量分别为9.84%、11.06%和12.35%,且无显著性差异;宰后末期(168 h),3个部位肉的MMb相对含量分别上升至38.14%、45.23%和49.77%,相比于初始值分别显著升高了287%、309%和338%,原因主要是脂类氧化的次级代谢产物,可能会使OMb的血红素基团暴露易氧化,产生的自由基进一步加剧了MMb的积累[22],从而导致MMb的相对含量逐渐升高,且三者的涨幅顺序依次为背阔肌<背最长肌<半腱肌,说明背阔肌和背最长肌中Mb的氧化速率低于半腱肌,此变化规律与肌肉的a*值和H*值相一致。

a-TMb;b-OMb;c-MMb
图1 不同部位牦牛肉成熟期间Mb氧化状态的变化
Fig.1 Changes of Mb forms in different parts of yak meat during postmortem aging
注:大写字母表示不同成熟时间同一肌肉类型的差异性,小写字母表示相同成熟时间不同肌肉类型的差异性;不同字母表示差异显著(P<0.05); 相同字母表示差异不显著(P>0.05)(下同)
2.3 不同部位牦牛肉成熟期间MetMbR活性的变化
肉的色泽指标和肉色稳定性指标(MMb还原能力或MetMbR活性)是评价肉色的主要指标。肉中MMb的还原不是靠单一的化学物质或化学反应,而是通过线粒体中复杂的生化反应来实现。MetMbR系统的还原能力与Mb自动氧化,以及肌间脂肪发生脂质氧化等的综合作用决定着肉色稳定性,研究也指出肉色稳定性与肌肉部位高度一致。快缩纤维和慢缩纤维中,线粒体的分布方式和呼吸作用等均存在较大差异[17]。其中,酶促、非酶促和电子链传递,三者可独立或选择性联合发生作用[23-24];同时,肌内竞争性或非竞争性耗氧,两方面作用是影响MMb还原的主要途径[25]。如图2所示,成熟过程中,3个部位肉的MetMbR活性均呈显著下降变化(P<0.05)。宰后168 h与6 h相比,3种肌肉的MetMbR活性分别下降了40.92%、42.96%和46.97%。MetMbR表示的是将MMb还原为OMb或者DeoMb的能力,其活性越高表示肌肉抑制MMb生成的能力越强,肌肉在成熟过程中的肉色稳定性越高。整个成熟过程中,背最长肌和背阔肌的MetMbR均高于半腱肌,但均无显著性差异。由此可知,成熟期间背最长肌和背阔肌的肉色稳定性优于半腱肌,此结果与3个部位肉MMb的积累情况相吻合。

图2 不同部位牦牛肉成熟期间MetMbR活性的变化
Fig.2 Changes of MetMbR activity in different parts of yak meat during postmortem aging
2.4 不同部位牦牛肉成熟期间pH的变化
肌肉的pH值与肌肉色泽稳定性之间存在密切联系,Mb在酸性条件下更容易发生自动氧化,更有利于MMb的累积[9, 26],所以在提取Mb时,选择的缓冲液pH值往往在8.0~8.5[26],然而不同部位肌肉之间可能存在一定差异。由图3可知,3个部位肉的pH值均随着成熟时间的延长呈先下降后保持相对稳定趋势。成熟早期(0~24 h),pH值的下降速率较显著(P<0.05),而24 h后,pH值的下降速率变缓慢(P>0.05),且背阔肌和背最长肌在宰后168 h时的pH值略有上升,原因是动物宰后肌肉在无氧的条件下进行糖酵解产生乳酸会导致pH值下降,且肌酸和ATP分解产生的磷酸也是加剧pH值下降的另一原因;而随着成熟时间的延长,Ca2+从肌质网中释放出来并且激活钙激活酶,作用于肌间蛋白质使其分解一些碱性物质导致肉的pH值升高[27]。0~12 h,背最长肌pH值均显著低于背阔肌(P<0.05),原因可能是背最长肌与背阔肌相较而言,含有的酵解型肌纤维含量高(Ⅱa、Ⅱb),肌肉的收缩速度较快且糖酵解代谢较强,而背阔肌主要以 Ⅰ 型肌纤维为主,属于氧化型肌纤维,糖酵解能力和程度弱于背最长肌;且在0~12 h时间段,半腱肌与上述2种肌肉的pH值均无显著性差异。而在成熟中后期(24~168 h),3个部位肉的pH值均无显著性差异。pH值是肉成熟过程中促进肉质形成的关键核心指标,过高或过低的pH值均会导致劣质肉的生成[28]。通常认为,宰后45 min pH值小于5.8时,宰后肌肉更容易形成白肌肉(pale soft exudative,PSE),而宰后24 h pH值大于6.0时,肌肉更容易形成黑干肉(dark,firm and dry,DFD)[29],本试验结果显示以上3种部位肉均属于正常的生理肉。
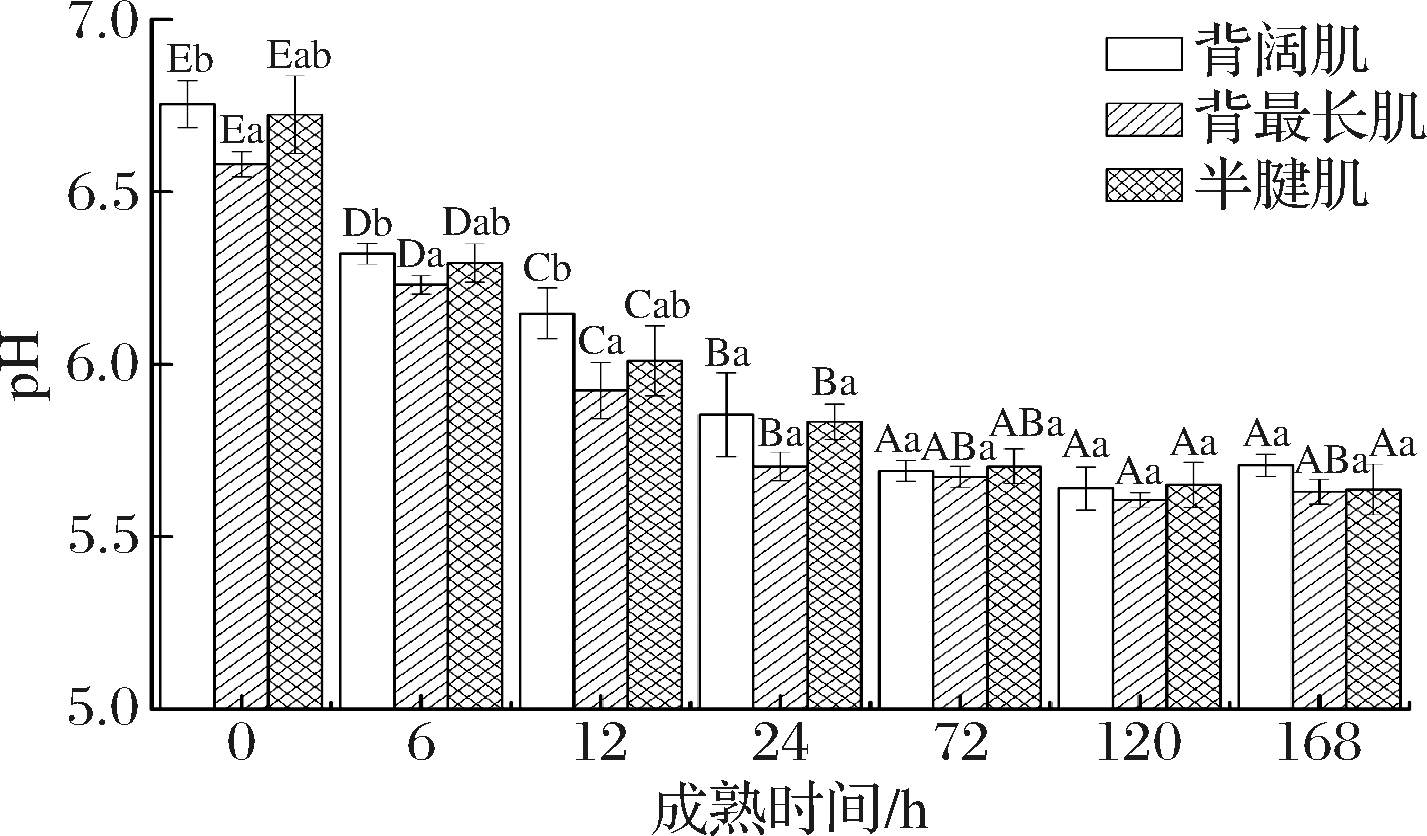
图3 不同部位牦牛肉成熟期间pH的变化
Fig.3 Changes of pH in different parts of yak meat during postmortem aging
2.5 不同部位牦牛肉肉色指标相关性分析
由表2~表4可知,3个部位色泽指标和肉色稳定性指标与pH值之间存在一定相关性。L*值与a*值、b*值、H*值之间呈正相关性,并与其他指标间呈负相关性,但差异不显著;OMb与TMb、MMb、pH值之间呈极显著正相关性(P<0.01),而与MMb呈极显著负相关性(P<0.01),说明OMb减少的同时,TMb含量也降低,肌肉MMb还原能力减弱,肌肉肉色稳定性下降,同时因糖酵解作用所致pH值得逐渐下降并对OMb的氧化可能产生促进作用,相关机制有待进一步研究。同时,背最长肌和半腱肌中色泽指标和肉色稳定性指标与pH值之间相关性变化相一致,但与背阔肌略有差异,表现为L*值与a*值之间呈负相关性,与MMb相对含量呈显著正相关性(P<0.05),b*值与a*值、MetMbR活性之间呈极显著负相关性,而与MMb相对含量之间呈极显著负相关性(P<0.01),造成不同部位肉色指标之间关系存在差异的原因可能是3个部位运动程度不同,所含肌纤维种类不同,肌肉内能量代谢、线粒体内生化反应及肌肉氧化还原能力等不同。综上所述,部位和肌纤维类型对川西北牦牛肉成熟过程中肌肉色泽及肉色稳定性存在显著影响,可根据各部位肉色情况积极探索合适的加工烹饪方式,有效维持肌肉色泽品质。
表2 背阔肌成熟期间肉色指标相关性分析
Table 2 Correlation analysis between meat color indexes of yak latissimus dorsi meat during postmortem aging

指标L*a*b*H*OMbTMbMMbMetMbRpHL*1a*0.3071b*0.550*0.2361H*0.333-0.3000.851**1OMb-0.1590.619**-0.047-0.3711TMb-0.0290.623**-0.130-0.481*0.851**1MMb-0.050-0.800**-0.0840.348-0.942**-0.841**1MetM-bR-0.0300.621**0.091-0.2400.893**0.781**-0.900**1pH-0.3930.463-0.260-0.439*0.901**0.728**-0.811**0.778**1
注:*表示显著相关(P<0.05),**表示极显著相关(P<0.01)(下同)
表3 背最长肌成熟期间肉色指标相关性分析
Table 3 Correlation analysis between meat color indexes of yak longissimus dorsi meat during postmortem aging

指标L*a*b*H*OMbTMbMMbMetMbRpHL*1a*-0.3291b*0.700**-0.676**1H*0.575*-0.880**0.941**1OMb-0.728**0.784**-0.865**-0.903**1TMb-0.621**0.667**-0.792**-0.810**0.807**1MMb0.557*-0.903**0.832**0.946**-0.899**-0.817**1MetMbR-0.507*0.843**-0.844**-0.926**0.886**0.763**-0.939**1pH-0.727**0.495*-0.741**-0.698**0.835**0.712**-0.719**0.784**1
表4 半腱肌成熟期间肉色指标相关性分析
Table 4 Correlation analysis between meat color indexes of yak semitendinosus meat during postmortem aging
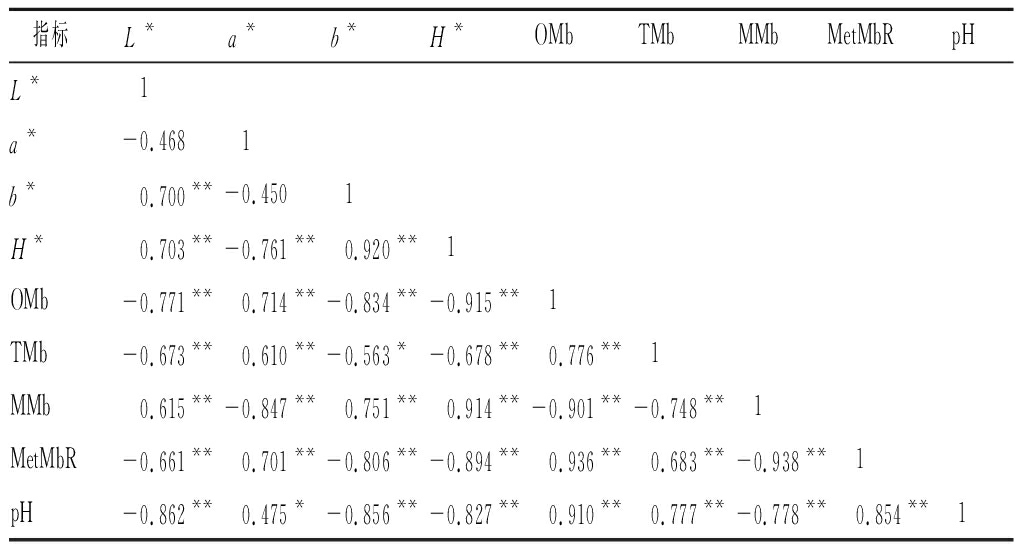
指标L*a*b*H*OMbTMbMMbMetMbRpHL*1a*-0.4681b*0.700**-0.4501H*0.703**-0.761**0.920**1OMb-0.771**0.714**-0.834**-0.915**1TMb-0.673**0.610**-0.563*-0.678**0.776**1MMb0.615**-0.847**0.751**0.914**-0.901**-0.748**1MetMbR-0.661**0.701**-0.806**-0.894**0.936**0.683**-0.938**1pH-0.862**0.475*-0.856**-0.827**0.910**0.777**-0.778**0.854**1
3 结论
成熟过程中,牦牛背阔肌、背最长肌和半腱肌的L*值、a*值随着成熟时间的延长呈先上升后下降趋势,背最长肌和半腱肌的b*值均呈逐渐上升趋势,背阔肌的b*值则呈先上升后下降变化;3个部位肉的TMb含量、OMb相对含量和MetMbR活性整体均呈显著下降趋势(P<0.05),而MMb相对含量整体均呈显著上升趋势(P<0.05);3个部位肉的pH值均随着成熟时间的延长呈先下降后保持相对稳定变化,并且背最长肌和半腱肌中色泽指标和肉色稳定性指标与pH值之间相关性变化相一致,但与背阔肌略有差异。
综上所述,部位和肌纤维类型对川西北牦牛肉成熟过程中肌肉色泽及肉色稳定性存在显著影响,宰后成熟过程中背阔肌和背最长肌的肉色稳定性优于半腱肌,而背最长肌与背阔肌肉色的稳定性差异不明显,由此可根据各部位肉色情况积极探索合适的加工烹饪方式,以有效维持肌肉色泽品质。
[1] 杨斌, 陈峰, 魏彦杰, 等.牦牛肉加工与发展现状[J].肉类研究, 2010, 24(6):3-5.
YANG B, CHEN F, WEI Y J, et al.The present development and processing situation of yak[J].Meat Research, 2010, 24(6):3-5.
[2] 贾青. 细胞凋亡酶-3及其抑制剂对宰后牦牛肉品质变化的影响[D].兰州:甘肃农业大学, 2016.
JIA Q.Influence of caspases-3 and the inhibitors on yak meat quality changes[D].Lanzhou:Gansu Agricultural University, 2016.
[3] WANG L L, HAN L, MA X L, et al.Effect of mitochondrial apoptotic activation through the mitochondrial membrane permeability transition pore on yak meat tenderness during postmortem aging [J].Food Chemistry, 2017, 234:323-331.
[4] DJOUAB A, AÏDER M.Study of the protective effect of electro activated whey permeate on lipid oxidation and color in refrigerated minced beef meat[J].ACS Food Science and Technology, 2021, 1(5):899-907.
[5] KIM Y H B, DE FRANDSEN M, ROSENVOLD K.Effect of ageing prior to freezing on color stability of ovine longissimus muscle[J].Meat Science, 2011, 88(3):332-337.
[6] SUMAN S P, JOSEPH P.Myoglobin chemistry and meat color[J].Annual Review of Food Science and Technology, 2013, 4(1):79-99.
[7] 董笑含. AMPK活性调节对宰后不同温度处理及不同部位牛肉能量代谢的影响[D].泰安:山东农业大学, 2017.
Dong X H.Effects of AMPK activity regulation on energy metabolism of postmortem beef in different muscle with different temperature treatments[D].Tai′an:Shandong Agriculture University, 2017.
[8] 任列娇, 赵素梅, 胡洪, 等.肌纤维类型及其对猪肉品质影响的研究进展[J].云南农业大学学报, 2010, 25(1):124-131.
REN L J, ZHAO S M, HU H, et al.Surveys of myofiber types and porcine meat quality[J].Journal of Yunnan Agricultural University, 2010, 25(1):124-131.
[9] 辛建增. 糖酵解脱氢酶对宰后羊肉色泽稳定性的影响[D].兰州:甘肃农业大学, 2017.
XIN J Z.The effect of dehydrogenase enzymes activity in glycolysis on the color stability of mutton during postmortem[D].Lanzhou:Gansu Agricultural University, 2017.
[10] RYU Y C, KIM B C.The relationship between muscle fiber characteristics, postmortem metabolic rate, and meat quality of pig longissimus dorsi muscle[J].Meat Science, 2005, 71(2):351-357.
[11] KRZYWICKI K.The determination of haem pigments in meat[J].Meat Science, 1982, 7(1):29-36.
[12] 陈景宜, 牛力, 黄明, 等.影响牛肉肉色稳定性的主要生化因子[J].中国农业科学, 2012, 45(16):3 363-3 372.
CHEN J Y, NIU L, HUANG M, et al.Major bio-factors affecting beef color stability[J].Scientia Agricultura Sinica, 2012, 45(16):3 363-3 372.
[13] KIM Y H B, FRANDSEN M, ROSENVOLD K. Effect of ageing prior to freezing on colour stability of ovine longissimus muscle[J]. Meat Science, 2011, 88(3):332-337.
[14] 王莉. 牦牛肉肌纤维类型组成及其代谢酶活力差异对宰后肉嫩度的影响[D].兰州:甘肃农业大学, 2017.
WANG L.The effect of muscle fiber types and their differences in metabolic enzymes activity on postmortem tenderness of yak meat[D].Lanzhou:Gansu Agricultural University, 2016.
[15] CANTO A C V C S, COSTA-LIMA B R C, SUMAN S P, et al.Color attributes and oxidative stability of longissimus lumborum and psoas major muscles from Nellore bulls[J].Meat Science, 2016, 121:19-26.
[16] JOSEPH P, SUMAN S P, RENTFROW G, et al.Proteomics of muscle-specific beef color stability[J].Journal of Agricultural and Food Chemistry, 2012, 60(12):3 196-3 203.
[17] 罗嘉, 蒲强, 朱砺.猪的肌肉纤维类型与肉质研究[J].猪业科学, 2014, 31(2):118-119.
LUO J, PU Q, ZHU L.Study on muscle fiber types and meat quality of pigs[J].Swine Industry Science, 2014, 31(2):118-119.
[18] 周楠. 育肥渤海公驴肌肉组织学特性以及理化性状的研究[D].保定:河北农业大学, 2014.
ZHOU N.Study on the histological and physicochemical characteristics of muscle in fattening bohai meal donkey[D].Baoding:Hebei Agricultural University, 2014.
[19] 杨巧能, 梁琪, 文鹏程, 等.宰后成熟时间对不同年龄牦牛肉用品质的影响[J].食品科学, 2015, 36(18):237-241.
YANG Q N, LIANG Q, WEN P C, et al.Influence of postmortem aging time on meat quality of yaks at different ages[J].Food Science, 2015, 36(18):237-241.
[20] RAMANATHAN R, SUMAN S P, FAUSTMAN C.Biomolecular interactions governing fresh meat color in post-mortem skeletal muscle:A review[J].Journal of Agricultural and Food Chemistry, 2020, 68(46):12 779-12 787.
[21] VALIN C, TOURAILLE C, VIGNERON P, et al.Prediction of lamb meat quality traits based on muscle biopsy fibre typing[J].Meat Science, 1982, 6(4):257-263.
[22] 张蒙蒙, 罗欣, 张一敏, 等.钙盐对肉与肉制品肉色的影响及其机理研究进展[J].食品科学, 2019, 40(23):327-333.
ZHANG M M, LUO X, ZHANG Y M, et al.A review of recent research on the effect and underlying mechanism of calcium salts on meat color[J].Food Science, 2019, 40(23):327-333.
[23] BELSKIE K M, VAN BUITEN C B, RAMANATHAN R, et al.Reverse electron transport effects on NADH formation and metmyoglobin reduction[J].Meat Science, 2015, 105:89-92.
[24] GAO X G, XIE L, WANG Z Y, et al.Effect of postmortem time on the metmyoglobin reductase activity, oxygen consumption, and colour stability of different lamb muscles[J].European Food Research and Technology, 2013, 236(4):579-587.
[25] WU S, LUO X, YANG X Y, et al.Understanding the development of color and color stability of dark cutting beef based on mitochondrial proteomics[J].Meat Science, 2020, 163:108046.
[26] AMSA. Guidelines for meat color evaluation[C]. Manhattan: Proceedings of the 44th annual reciprocal meat conference, 1991:1-17.
[27] WEISLEDER N, MA J J.Altered Ca2+ sparks in aging skeletal and cardiac muscle[J].Ageing Research Reviews, 2008, 7(3):177-188.
[28] 尹靖东. 动物肌肉生物学与肉品科学[M].北京:中国农业大学出版社, 2011:164-183.
YIN J D.Animal Muscle Biology and Meat Science[M].Beijing:China Agricultural University Press, 2011:164-183.
[29] 李泽. AMPK活性对宰后羊肉能量代谢和肉质的影响及其机理研究[D].呼和浩特:内蒙古农业大学, 2010.
LI Z.Effect of AMPK activity on energy metabolism and meat quality of postmortem lamb and its mechanism research[D].Hohhot:Inner Mongolia Agricultural University, 2010.