醋糟是食醋生产过程中的主要废弃物,主要成分为木质纤维素、粗蛋白质、糖类以及微量的脂类物质,属于食品加工行业废弃物[1]。醋糟具有产量大、酸性大、含水率高等特点,我国醋糟年产量高达300万t,且仍以7%的速度增长,若处理不当会导致严重的环境问题[2]。现阶段醋糟常规的处理方式有焚烧、填埋、堆肥、饲料化、培养基质等,处理能力有限,经济效益不高,且容易造成二次污染等问题[3]。厌氧消化是醋糟等有机废弃物综合处理的有效方式之一,能够将糖类、纤维素、蛋白质和脂肪等结构复杂的大分子物质转化成沼气,在规模化处理同时,实现资源化利用[4]。周冠男等[5]在中温条件下将醋糟与猪粪、鸡粪混合厌氧发酵,醋糟与猪粪、鸡粪挥发性固体(volatile solid, VS)质量比均为1∶3条件下,累积甲烷(CH4)产量分别为286.51、312.57 mL/g VS。但醋糟中木质纤维素高度复杂和稳定的交联结构,导致厌氧消化水解速率受限。为了提高木质纤维素的利用效率,通常采用酸碱浸泡、水热处理等手段对醋糟进行预处理。WANG等[6]采用10种不同方式对醋糟进行预处理,显示经碱性H2O2预处理醋糟CH4产率提升51.7%。师杨蕾等[7]采用H2O2对醋糟进行预处理,H2O2含量、温度和预处理时间分别为4%、40 ℃和12 h条件下,累积CH4产量达302.0 mL/g,较未预处理组提升了54.4%。在实际处理过程中,预处理技术存在成本高,难以规模化应用。因此,如何构建高效的厌氧消化体系,强化醋糟中木质纤维素水解,全面解析厌氧消化过程中微生物群落结构及演替规律成为研究热点。
本研究采用全混式反应器构建醋糟高固态连续式厌氧消化体系,逐步提高系统有机负荷(organic loading rate, OLR)[2.01~7.11 g/(L·d)],驯化出高效的木质纤维素降解菌群,强化系统厌氧消化功能。通过分析产CH4性能和中间代谢产物,掌握不同OLR条件下醋糟降解及转化规律。同时采用高通量测序技术对发酵体系的微生物群落结构及演替规律进行解析,为掌握醋糟厌氧降解过程及其微生物群落多样性奠定基础,对醋糟厌氧消化工程化应用具有现实意义。
1 材料与方法
1.1 底物与接种物
厌氧发酵底物醋糟取自江苏镇江某食醋生产企业,主要包含稻壳类填充物和酿醋原料残渣。接种物取自实验室餐厨垃圾厌氧反应器,底物和接种物主要参数如表1所示。
表1 底物和接种物性质
Table 1 Characteristics of substrates and inoculum
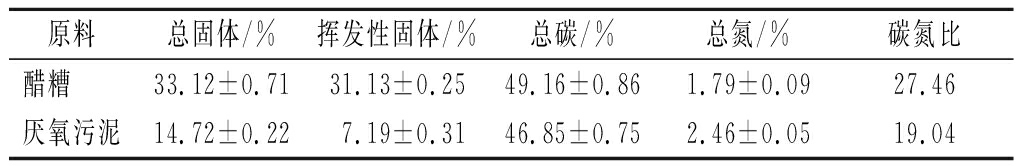
原料总固体/%挥发性固体/%总碳/%总氮/%碳氮比醋糟 33.12±0.7131.13±0.2549.16±0.861.79±0.0927.46厌氧污泥14.72±0.227.19±0.3146.85±0.752.46±0.0519.04
1.2 试验装置
试验装置为自制卧式反应器,容积为10 L,有效容积为8 L,通过电伴热保持温度在(37±1) ℃,搅拌电机、温度探头、电加热系统、气体流量计、回流泵等均通过控制系统进行调控。醋糟从反应器顶部进料口加入到反应器中,经发酵反应后沼渣从反应器底部出料口取出,沼渣经板框压滤固液分离后,沼液部分回流至卧式反应器中(图1)。发酵产生的沼气经气体收集装置收集后进行成分分析。

图1 试验装置图
Fig.1 Diagram of experimental equipment
1.3 试验设计
试验开始前向反应器装入接种污泥至工作体积并进行预培养,以去除所有残留底物。反应器总运行时间为170 d,通过逐步提高卧式反应器负荷的方式将整个试验分为5个阶段,分别为1~15 d、16~45 d、46~75 d、76~130 d、131~170 d,用编号I~V表述,对应物料OLR(以VS计)分别为2.01、3.98、5.16、6.06、7.11 g/(L·d),物料停留时间分别为160、80、65、55、40 d。反应器运行期间,定时取样检测,通过指标分析反应器运行状态,提供负荷提升依据,整个运行过程系统含固率保持在15%左右。
1.4 指标分析
总固体(total solid,TS)、VS和总氨氮(total ammonia nitrogen, TAN)采用标准方法分析[8];总碳、总氮通过元素分析仪(Vario MICRO cube,德国Elementar)进行测定;挥发性脂肪酸(volatile fatty acids, VFAs)采用气相色谱(GC-2010 plus,岛津)进行测定;沼气成分采用便携红外沼气分析仪(GAS-BOARD 3200L,武汉四方)进行测定;收集厌氧反应器每个OLR结束时的样品,贮存于-80 ℃ 以备后续DNA提取和微生物群落分析。根据操作说明使用Powersoil® DNA提取试剂盒(MoBio,美国)提取DNA。分别使用细菌通用引物对338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)、古菌通用引物对524F10extF(5′-TGYCAGCCGCCGCGGTAA-3′)和Arch958RmodR(5′-YCCGGCGTTGAVTCCAATT-3′)扩增16S rRNA基因,构建扩增文库。在MiSeq平台(Illumina公司,美国)进行测序,按照HU等[9]所述进行原始序列分析处理。
2 结果与分析
2.1 厌氧消化产气性能分析
CH4产量是厌氧发酵的一个重要指标,反映当前发酵条件下物料的产CH4性能[10]。整个试验阶段反应器沼气产量、CH4产量和CH4体积分数如图2所示。从整体上看,阶段I~V沼气产量和CH4产量均出现先下降后升高再降低的过程,在阶段IV中CH4产量和沼气产量均达到最大值。5个阶段稳定的沼气产量分别为453、396、371、423、366 mL/g VS,对应的CH4产量分别为251、205、199、226、182 mL/g VS,CH4的体积分数基本维持在44.17%~59.39%。李倩等[11]研究不同OLR条件下醋糟厌氧消化,单位质量底物沼气和CH4产量均与本结果基本一致。分阶段来看,在调整OLR初期,负荷提升对系统造成一定的冲击,系统产甲烷性能受到影响,沼气产量和CH4产量均出现突然降低的现象,随着反应的进行,产CH4性能逐渐恢复至稳定状态。第Ⅱ~Ⅳ阶段运行至沼气产量稳定所需的时间分别为5、9、24 d,表明随着OLR的提升,系统所需的适应期逐渐增加。在阶段Ⅱ中沼气产量和CH4产量出现较大波动,23~26 d CH4产量从420 mL/g VS迅速降低至287 mL/g VS,及时调整沼液回流比,使体系中产甲烷菌活性得以快速恢复[12]。第V阶段OLR提升至7.11 g/(L·d)时,沼气产量和CH4产量均低于阶段IV,且随着反应器运行并未上升,说明该状态下产甲烷性能受到抑制,OLR已超出发酵体系处理极限。戴小虎等[13]研究不同OLR对醋糟厌氧消化性能影响,当OLR>3.56 g/(L·d)时,反应体系出现明显酸化,产CH4活性被严重抑制。CHEN等[14]研究OLR对醋渣厌氧消化过程稳定性及微生物群落组成的影响,研究表明最适OLR为2.0 g/(L·d),当OLR升高至2.5 g/(L·d)会导致厌氧消化过程出现不可逆抑制。本研究利用全混卧式反应器处理醋糟,在高OLR条件下,沼气产量和CH4产率分别达423、226 mL/g,均优于上述研究。

图2 产甲烷性能变化情况
Fig.2 Variations of methane characteristics during methane production performance experiment
2.2 系统稳定性分析
VFAs和TAN是厌氧发酵过程重要的中间产物,VFAs也是产甲烷菌利用的重要底物,当系统VFAs质量浓度过量累积时,产甲烷菌活性受到抑制,对系统稳定性产生影响。整个运行过程系统TAN和VFAs质量浓度如图3所示。TAN质量浓度在1.53~2.99 g/L波动,整体呈现第Ⅰ和Ⅱ阶段高于其他阶段,在前30 d TAN质量浓度维持在较高水平,在第25天达到最大值2.99 g/L。VFAs质量浓度在阶段I~IV均呈现出先上升后下降,最后保持稳定的趋势。增加系统OLR初期时,一方面体系内有机物水解酸化,快速产生有机酸,另一方面,OLR提升导致产甲烷菌活性降低,VFAs产生累积[15]。VFAs质量浓度在前27 d持续上升,最高达11.41 g/L。有研究表明,发酵体系内VFAs质量浓度超过10 g/L时,会导致pH降低,产甲烷菌活性受到抑制[16]。为避免系统进一步恶化,及时调整沼液回流比从100%降至75%,以消除氨氮的持续积累,降低系统TAN和VFAs质量浓度,解除抑制现象。系统稳定运行后VFAs质量浓度基本维持在9 g/L左右,未发生酸抑制现象。随着OLR提升至7.11 g/(L·d),VFAs质量浓度在8.94~13.47 g/L产生明显波动,系统稳定性被破坏,产甲烷菌不能稳定利用VFAs,导致VFAs质量浓度波动,CH4产率降低等现象。

图3 TAN和VFAs浓度变化
Fig.3 Changes in TAN and VFAs concentrations
2.3 微生物群落多样性分析
2.3.1 微生物群落多样性
为了解醋糟厌氧消化微生物群落结构,采用高通量测序技术解析不同OLR条件下的反应体系。细菌和古菌丰富度多样性指数如表2所示,所有样品Coverage指数均>99%,表明测序深度基本可反映样品中绝大多数细菌和古菌的真实情况。分析代表微生物丰富度的Chao1和Ace指数可知,阶段I~IV细菌群落丰富度随着OLR增加出现先下降后上升的过程,阶段IV样品中Chao1和Ace指数最高,说明群落丰富度最高。相对细菌而言,古菌丰度较低,同时随着反应进行系统古菌丰度逐渐降低。分析表征微生物多样性的Shannon和Simpson指数可知,在前4个阶段细菌群落多样性同样经历先下降后上升的过程,反应器运行过程中操作参数的优化使得与醋糟降解相关的微生物得到保留和增殖,而与醋糟降解无关的微生物则被淘汰。古菌多样性与细菌呈现基本相同的趋势。在厌氧发酵体系中,微生物群落多样性越高,产沼气性能越好[17]。然而,过高的OLR引起了阶段V微生物群落多样性的显著降低,底物水解效率降低,产沼气性能变差,这与2.1研究结果一致。
表2 细菌和古菌多样性分析结果
Table 2 Diversity analysis of bacterial and archaeal communities
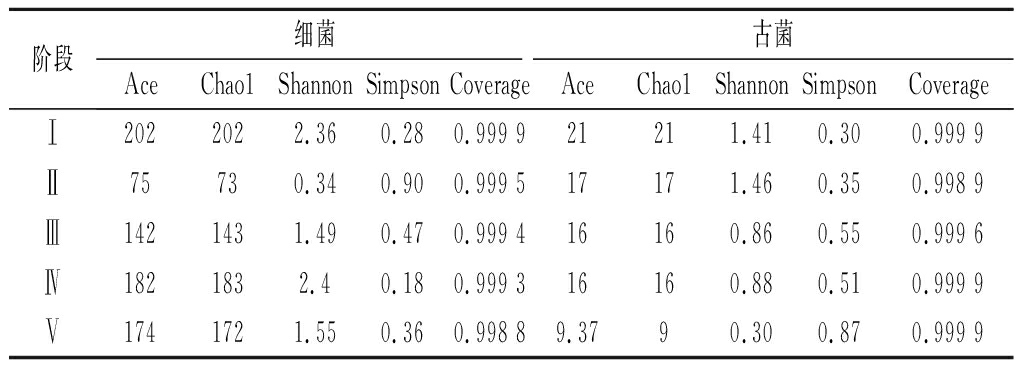
阶段细菌古菌AceChao1ShannonSimpsonCoverageAceChao1ShannonSimpsonCoverageⅠ2022022.360.280.999 921211.410.300.999 9Ⅱ75730.340.900.999 517171.460.350.998 9Ⅲ1421431.490.470.999 416160.860.550.999 6Ⅳ1821832.40.180.999 316160.880.510.999 9Ⅴ1741721.550.360.998 89.3790.300.870.999 9
2.3.2 细菌群落结构变化
厌氧消化水解过程是通过多种微生物共同完成,而富含木质纤维素的醋糟产CH4性能高度依赖于水解过程,因此,系统细菌群落的组成及相对丰度将在水解代谢过程中起到决定性作用。各运行阶段细菌在门和属水平上的群落结构如图4所示。图4-a显示在门分类水平上,系统中细菌主要是拟杆菌门Bacteroidetes,45.6%~95.5%)和厚壁菌门(Firmicutes,4.38%~53.1%),Firmicutes是水解酸化阶段的主要菌群,能够对醋糟等有机物进行水解;Bacteroidetes是富氮底物厌氧发酵的关键菌,能够加速分解醋糟中不易降解的有机物[18]。整个运行阶段这2种细菌相对丰度之和均达98%以上,但不同运行阶段Bacteroidetes和Firmicutes相对丰度占比有一定差异。阶段Ⅱ中Firmicutes相对丰度仅为4.38%,可能是由于大量的沼液回流使体系中TAN和VFAs浓度升高,系统群落结构发生变化,Firmicutes相对丰度迅速降低,导致水解过程受阻,厌氧消化受到抑制,系统CH4产量降低。随着及时调整回流比,阶段Ⅲ中Firmicutes相对丰度上升至27.8%,系统产CH4性能恢复。阶段IV中Bacteroidetes和Firmicutes相对丰度最均衡,分别为45.6%和53.1%,此阶段2种菌群协同作用,醋糟水解过程和产CH4性能最佳。

a-门水平细菌多样性;b-属水平细菌多样性
图4 细菌在门和属水平上群落结构
Fig.4 Analysis of bacterial at the phylum and genus levels
图4-b显示在属水平上主要有Proteiniphilum属(31.6%~92.6%)、MBA03_norank属(0.29%~31.0%)、Sedimentibacter属(1.03%~16.96%)、Petrimonas属(0.07%~13.21%)和Caldicoprobacter属(0.25%~12.15%)。各阶段群落结构差异较大,不同细菌属的相对丰度变化明显,整个运行阶段上述5种菌属相对丰度总和分别为72.72%、96.41%、87.07%、81.65%和88.67%。除Proteiniphilum外,其余细菌均与木质纤维素的代谢有关,Proteiniphilum能将蛋白质水解为氨基酸,并将氨基酸降解为VFAs和![]() 系统运行前期木质纤维素代谢效率还未提升,主要针对底物中蛋白质进行降解,为产CH4过程提供主要碳源,导致Proteiniphilum成为第Ⅱ阶段的优势菌种,相对丰度高达92.56%。MBA03_norank属能够分泌解毒酶,缓解由木质纤维素降解引起的产物抑制[20];Sedimentibacter属能够消除木质素对半纤维素和纤维素屏蔽作用[21];Petrimonas属和Caldicoprobacter属可将碳水化合物代谢成寡糖和单糖,确保纤维素和半纤维素的有效降解,为产CH4阶段提供丰富的碳源。这4种菌属均与木质纤维素代谢有关,印证了醋糟厌氧消化效率与木质纤维素水解过程密切相关[22]。随着OLR提升,与纤维素降解有关的4种菌属逐步富集,相对丰度从第I阶段的23.09%提升至第IV阶段的50.04%,并且在第IV阶段水解菌属相对丰度分布均匀,有利于形成各种代谢途径促进底物高效水解,表现出最高的CH4产率。由于OLR进一步增大,第V阶段细菌群落结构发生改变,Proteiniphilum和MBA03_norank属相对丰度迅速上升,以应对系统的负荷冲击。
系统运行前期木质纤维素代谢效率还未提升,主要针对底物中蛋白质进行降解,为产CH4过程提供主要碳源,导致Proteiniphilum成为第Ⅱ阶段的优势菌种,相对丰度高达92.56%。MBA03_norank属能够分泌解毒酶,缓解由木质纤维素降解引起的产物抑制[20];Sedimentibacter属能够消除木质素对半纤维素和纤维素屏蔽作用[21];Petrimonas属和Caldicoprobacter属可将碳水化合物代谢成寡糖和单糖,确保纤维素和半纤维素的有效降解,为产CH4阶段提供丰富的碳源。这4种菌属均与木质纤维素代谢有关,印证了醋糟厌氧消化效率与木质纤维素水解过程密切相关[22]。随着OLR提升,与纤维素降解有关的4种菌属逐步富集,相对丰度从第I阶段的23.09%提升至第IV阶段的50.04%,并且在第IV阶段水解菌属相对丰度分布均匀,有利于形成各种代谢途径促进底物高效水解,表现出最高的CH4产率。由于OLR进一步增大,第V阶段细菌群落结构发生改变,Proteiniphilum和MBA03_norank属相对丰度迅速上升,以应对系统的负荷冲击。
2.3.3 古菌群落结构变化
不同阶段古菌在门水平和属水平的群落结构如图5所示。由图5-a可知,与细菌相比,古菌在门水平上的群落结构比较单一,广古菌门(Euryarchaeota)占绝对优势,5个阶段相对丰度分别为99.5%、95.8%、99.7%、99.9%和99.9%,只有第Ⅱ阶段深古菌门(Bathyarchaeota)相对丰度为4.15%。由图5-b可知,不同阶段古菌在属水平差异明显,但甲烷杆菌属(Methanobacterium,54.28%~93.23%)和甲烷八叠球菌属(Methanosarcina,6.28%~31.90%)构成主要优势菌属。5个阶段Methanobacterium和Methanosarcina相对丰度之和分别为96.55%、76.10%、95.06%、98.20%和99.51%。Methanosarcina是已知为数不多的全能型古菌,具有多样化的代谢途径,可利用乙酸、甲基化合物、H2、CO2等作为代谢底物,与厌氧发酵CH4产量有直接关系[23-24]。整个反应过程中在第IV阶段Methanosarcina相对丰度最大,表现出更好的产甲烷性能,随着OLR提升至7.11 g/(L·d)时,达到系统处理极限,Methanosarcina相对丰度下降,产甲烷过程受阻。ZHANG等[25]研究餐厨垃圾、牛粪和玉米秸秆共消化过程中协同作用与微生物群落特征之间的关系,Methanosarcina多样性和相对丰度最高达14.6%,维持了多样化的产CH4途径。因此,在厌氧发酵OLR提升的过程中,Methanosarcina能够有效弥补古菌群对环境的敏感性,维持多种代谢途径,使系统能够在高负荷状态下稳定运行。另外,在第Ⅱ阶段古菌群落结构多样性最丰富,除了Methanobacterium和Methanosarcina,还存在甲烷囊菌属Methanoculleus(7.11%)、Thermoplasmatales_Incertae_Sedis_uncultured(6.39%)、第七产甲烷古菌属Methanomassiliicoccus(5.50%)和Bathyarchaeota_norank(4.14%)。这些古菌属相对丰度明显高于其他阶段,其对第Ⅱ阶段出现的高![]() 具有更好的适应性,虽Bathyarchaeota_norank具体分类尚不明确,但其属于深古菌门,具有潜在的降解蛋白质特性,从而能够印证第Ⅱ阶段
具有更好的适应性,虽Bathyarchaeota_norank具体分类尚不明确,但其属于深古菌门,具有潜在的降解蛋白质特性,从而能够印证第Ⅱ阶段![]() 浓度快速累积现象。
浓度快速累积现象。

a-门水平古菌多样性;b-属水平古菌多样性
图5 古菌在门和属水平上群落结构
Fig.5 Analysis of archaeal diversities at the phylum and genus levels
不同OLR条件下系统古菌群落结构发生一定变化,但是不管在门水平还是属水平上,古菌群落差异度明显要低于细菌群落差异度。按照氢营养型产CH4途径(Methanobacterium、Methanoculleus)和混合营养型产CH4途径(Methanosarcina、Methanomassiliicoccus、Bathyarchaeota_norank)对古菌属进行分类,具体分布情况如图6所示。整个运行过程氢营养型古菌属均占主导,相对丰度分别为66.0%、61.38%、71.11%、66.64%和93.50%,在前4个阶段,氢营养型古菌属和混合营养型古菌属相对丰度保持稳定,相对丰度比例基本维持在2∶1,多样的产CH4途径表明醋糟各类型水解产物均能够被有效利用。随着OLR提升,第V阶段氢营养型古菌属相对丰度快速提升,混合营养型古菌属相对丰度降低至6.46%,此时氢营养型产CH4途径占绝对主导,混合营养型产CH4途径受阻,影响脂肪酸的转化和代谢,这也是影响第V阶段CH4产率下降的重要因素。

图6 各阶段不同代谢途径古菌属分布情况
Fig.6 Distribution of archaea genus in different metabolic pathways
3 结论
(1)全混式固态厌氧消化体系能够对醋糟进行高效处理,OLR为6.06 g/(L·d)条件下表现出最佳的消化性能,沼气产量和CH4产率分别达423、226 mL/g VS,进一步提升运行负荷,超出处理极限,系统产气性能降低。
(2)整个运行过程中TAN质量浓度呈先上升后下降趋势,稳定运行阶段VFAs质量浓度基本维持在9 g/L左右,系统未发生酸抑制现象。在25 d左右时,TAN和VFAs质量浓度达到最大值分别为2.99、11.41 g/L,产甲烷活性受到抑制,及时调整沼液回流比,系统快速恢复。
(3)细菌门水平上主要以拟杆菌门(Bacteroidetes,45.6%~95.5%)和厚壁菌门(Firmicutes,4.38%~53.1%)为主,4种与木质纤维素代谢有关的菌属相对丰度从第I阶段的23.09%提升至第IV阶段的50.04%,有利于形成各种代谢途径促进底物高效水解,表现出最佳产气性能。
(4)氢营养型产甲烷途径在醋糟固态厌氧发酵体系内占主导,前4个阶段,氢营养型古菌属和混合营养型古菌属相对丰度比例基本维持在2∶1,各类型水解产物均能被体系中多样的产CH4途径利用。
[1] FENG J Y, ZHANG J Y, ZHANG J F, et al.Enhanced methane production of vinegar residue by response surface methodology (RSM)[J].AMB Express, 2017, 7(1):89.
[2] 李倩, 许之扬, 阮文权.黄孢原毛平革菌后处理深度提升醋糟产甲烷潜力[J].浙江农业学报, 2020, 32(5):904-911.
LI Q, XU Z Y, RUAN W Q.Improvement of methane production potential by post-treatment of vinegar residue with Phanerochaete chrysosporium[J].Acta Agriculturae Zhejiangensis, 2020, 32(5):904-911.
[3] SHEN J, ZHAO C, LIU G Q, et al.Enhancing the performance on anaerobic digestion of vinegar residue by sodium hydroxide pretreatment[J].Waste and Biomass Valorization, 2017,8(4):1 119-1 126.
[4] 张梅娟, 钱朋智, 董力青, 等.农产品副产物半纤维素水解糖的分离纯化及单糖组成分析[J].食品与发酵工业, 2020, 46(20):72-77.
ZHANG M J, QIAN P Z, DONG L Q, et al.Isolation, purification and monosaccharide composition analysis of hydrolysis sugar from hemicellulose of agricultural processing by-products[J].Food and Fermentation Industries, 2020, 46(20):72-77.
[5] 周冠男, 陈琳, 郑涛, 等.醋糟与猪粪、鸡粪不同配比的厌氧共消化产气潜力研究[J].农业环境科学学报, 2019, 38(6):1 357-1 364.
ZHOU G N, CHEN L, ZHENG T, et al.Potential of anaerobic co-digestion of vinegar residue with different ratios of pig and chicken manure[J].Journal of Agro-Environment Science, 2019, 38(6):1 357-1 364.
[6] WANG L G, FENG J Y, CAI F F, et al.Anaerobic digestion and lignocellulosic compositions alteration of industrial vinegar residue after different pretreatments[J].Environmental Technology & Innovation, 2021, 24:109141.
[7] 师杨蕾, 蔡凡凡, 宁志芳, 等.碱性过氧化氢预处理对醋渣厌氧消化性能的影响[J].北京化工大学学报(自然科学版), 2020, 47(1):1-7.
SHI Y L, CAI F F, NING Z F, et al.Impact of alkaline hydrogen peroxide pretreatment on the anaerobic digestion of vinegar residues[J].Journal of Beijing University of Chemical Technology (Natural Science Edition), 2020, 47(1):1-7.
[8] 国家环境保护总局. 水和废水监测分析方法[M].北京:中国环境科学出版社, 2002.
State Environmental Protection Administration of China.Water and Wastewater Monitoring and Analysis Methods [M].Beijing:China Environmental Science Press, 2002.
[9] HU X L, DU H, REN C, et al.Illuminating anaerobic microbial community and cooccurrence patterns across a quality gradient in Chinese liquor fermentation pit muds[J].Applied and Environmental Microbiology, 2016, 82(8):2 506-2 515.
[10] CAI Y F, WANG J G, ZHAO Y B, et al.A new perspective of using sequential extraction:To predict the deficiency of trace elements during anaerobic digestion[J].Water Research, 2018, 140:335-343.
[11] 李倩, 许之扬, 周云龙, 等.瘤胃微生物强化醋糟厌氧消化及其机制[J].环境科学研究, 2020, 33(10):2 370-2 377.
LI Q, XU Z Y, ZHOU Y L, et al.Bio-augmented anaerobic digestion of vinegar residue by rumen microbes and its mechanisms[J].Research of Environmental Sciences, 2020, 33(10):2 370-2 377.
[12] WANG Z J, XU F Q, LI Y B.Effects of total ammonia nitrogen concentration on solid-state anaerobic digestion of corn stover[J].Bioresource Technology, 2013, 144:281-287.
[13] 戴晓虎, 于春晓, 李宁, 等.有机负荷对醋糟厌氧消化系统启动的影响[J].环境科学, 2017, 38(3):1 144-1 150.
DAI X H, YU C X, LI N, et al.Effects of organic loading rate on startup performance of anaerobic digestion with vinegar residues[J].Environmental Science, 2017, 38(3):1 144-1 150.
[14] CHEN L, ZHOU G N, ZHENG T, et al.Effect of the organic loading rates increase on process stability and microbial community composition during the anaerobic digestion of fresh vinegar residue[J].Waste and Biomass Valorization, 2021, 12(10):5 505-5 516.
[15] 赵明星, 高常卉, 李娟, 等.餐厨垃圾厌氧干发酵制氢及其强化研究[J].食品与发酵工业, 2021, 47(22):157-161.
ZHAO M X, GAO C H, LI J, et al.Hydrogen generation from food waste by anaerobic dry fermentation and its enhancement technology[J].Food and Fermentation Industries, 2021, 47(22):157-161.
[16] 蒋滔, 韦秀丽, 肖璐, 等.玉米秸秆固态和液态厌氧发酵产气性能与微生物种类比较研究[J].农业工程学报, 2020, 36(3):227-235.
JIANG T, WEI X L, XIAO L, et al.Comparison of biogas production and microbial species of corn straw in solid-state anaerobic digestion (SS-AD) and liquid anaerobic digestion (L-AD)[J].Transactions of the Chinese Society of Agricultural Engineering, 2020, 36(3):227-235.
[17] 李丹妮, 高文萱, 张克强, 等.分层接种对猪粪厌氧干发酵产气性能及微生物群落结构的影响[J].农业工程学报, 2021, 37(1):251-258.
LI D N, GAO W X, ZHANG K Q, et al.Influences of layer inoculation on biogas production and microbial community in solid-state anaerobic fermentation of pig manure[J].Transactions of the Chinese Society of Agricultural Engineering, 2021, 37(1):251-258.
[18] WANG Y Y, LI G X, CHI M H, et al.Effects of co-digestion of cucumber residues to corn stover and pig manure ratio on methane production in solid state anaerobic digestion[J].Bioresource Technology, 2018, 250:328-336.
[19] HAMEED S A, RIFFAT R, LI B Q, et al.Microbial population dynamics in temperature-phased anaerobic digestion of municipal wastewater sludge[J].Journal of Chemical Technology and Biotechnology, 2019, 94(6):1 816-1 831.
[20] TEIXEIRA F L, SILVA D N D S, PAUER H, et al.The role of BmoR, a MarR family regulator, in the survival of Bacteroides fragilis during oxidative stress[J].International Journal of Medical Microbiology, 2013, 303(8):443-448.
[21] HUANG Y, HOU X L, LIU S T, et al.Correspondence analysis of bio-refractory compounds degradation and microbiological community distribution in anaerobic filter for coking wastewater treatment[J].Chemical Engineering Journal, 2016, 304:864-872.
[22] ZHOU Y L, XU Z Y, ZHAO M X, et al.Construction and evaluation of efficient solid-state anaerobic digestion system via vinegar residue[J].International Biodeterioration & Biodegradation, 2018, 133:142-150.
[23] ZHOU J J, HOLMES D E, TANG H Y, et al.Correlation of key physiological properties of methanosarcina isolates with environment of origin[J].Applied and Environmental Microbiology, 2021, 87(13):e0073121.
[24] ZHI S L, LI Q, YANG F X, et al.How methane yield, crucial parameters and microbial communities respond to the stimulating effect of antibiotics during high solid anaerobic digestion[J].Bioresource Technology, 2019, 283:286-296.
[25] ZHANG W L, WANG X, XING W L, et al.Links between synergistic effects and microbial community characteristics of anaerobic co-digestion of food waste, cattle manure and corn straw[J].Bioresource Technology, 2021, 329:124919.