中国毛虾(Acetes chinensis),也叫毛虾,小白虾,是一种高营养价值的海洋低值虾类。据统计,我国2020年毛虾捕捞量达36.7万t,占虾捕捞量的30.45%,位列第一[1]。新鲜毛虾含水量达80%以上,体小皮薄,不易加工,大多制作成虾皮、虾酱以及用于饲料生产,产品加工方法单一,附加值低。
呈味肽通常是由氨基酸合成或酶水解产生,分子质量<3 000 Da,呈现出酸味、咸味、苦味、甜味和鲜味[2]。以水产动物蛋白为原料,采用酶水解技术使蛋白质降解为具有呈味特性的短肽和氨基酸,是近年来研究的热点[3]。张典[4]使用复合酶酶解牡蛎,得到酶解液进行鉴定,发现具有鲜味肽和酸味肽,将鉴定出的肽段合成并加入食盐溶液中起到鲜味增强作用。国内曹文红等[5]最早使用蛋白酶对毛虾进行酶解,并对酶解液血管紧张素转换酶(angiotensin I-converting enzyme,ACE)抑制活性和抗氧化性进行研究。毛虾酶解的研究主要集中在生物活性肽生产、水解工艺的优化等,利用毛虾制备呈味肽研究甚少。毛虾水解后产生的小分子肽和游离氨基酸,赋予酶解液一定的风味,因此可作为制备天然调味品的理想基料。
酶法制备蛋白水解液具有较明显的苦味,从而影响了酶解产物被进一步加工和开发多肽产品。据文献报道,蛋白酶解液之所以产生苦味,是由于蛋白质经水解埋藏在其内部的疏水性氨基酸暴露,与味蕾接触产生苦味[6]。目前蛋白水解物中不良性风味的脱除方法主要有选择性分离法、掩盖法和酶解法等[7],其中膜分离属于选择性分离法。膜分离技术操作方便,污染小,耗能小,不仅可以去除酶解液中的大分子和无机盐[8],还能达到除杂、脱色和脱苦的作用,在活性肽分离纯化方面广泛应用。熊文飞等[9]利用500 u纳滤膜将杏鲍菇酶解液中氨基酸、核苷酸等呈味物质与苦味肽分离,脱苦效果良好。汪涛等[10]以扇贝边为原料,使用几种蛋白酶酶解,所得酶解液经过超滤透过和反渗透截留,浓缩液苦味、腥味减少,海鲜风味提升。
为提高毛虾的利用率,本文使用酶法水解中国毛虾,并对膜分离制备毛虾多肽的工艺进行研究。采用电子舌对毛虾酶解液和膜分离组分的滋味进行评价,结合感官分析对膜分离得到的不同组分的苦味进行分析。以期为中国毛虾多肽的风味提升提供技术支持,同时为制备风味良好的高值营养食品提供技术参考。
1 材料与方法
1.1 材料与试剂
中国毛虾,购自浙江舟山,冷冻运输回实验室,-20 ℃冷冻保存。
碱性蛋白酶(60 000 U/g),天津诺奥有限公司;盐酸、H2SO4、1-苯胺基-8-萘磺酸、柠檬酸钠、Na2HPO4·12H2O、NaH2PO4·H2O、K2SO4、CuSO4·5H2O(化学纯),中国国药集团。
1.2 仪器与设备
800Y 304不锈钢粉碎机,欧橡;HJ-4A恒温多头磁力搅拌器,江苏科析仪器;LYNX 4 000高速冷冻离心机,美国Thermo Fisher;ASTREE电子舌,法国Alpha MOS;CHRIST ALPHA1-2真空冷冻干燥机,德国Marin Christ;RNM-18G多功能膜实验设备,杭州瑞纳膜;KJELTEC 8400全自动凯氏定氮仪,苏州福斯赛诺分析仪器。
1.3 实验方法
1.3.1 基本营养成分测定和氨基酸组分测定
水分、灰分、粗蛋白、脂肪含量测定参照GB 5009.3~6—2016。总糖含量测定参照硫酸-苯酚比色法[11]。氨基酸组分测定参照GB 5009.124—2016。
1.3.2 中国毛虾酶解液的制备及膜分离
毛虾解冻后,用粉碎机打成虾糜,按照前期酶解工艺优化条件,以1∶4(g∶mL)的料液比,添加1%(质量分数)碱性蛋白酶,55 ℃酶解3 h,90 ℃ 15 min灭酶,得到毛虾酶解液。同时以未加酶组为对照组。
15 L毛虾酶解液先使用尼龙膜去除虾渣。分别经过0.2 μm陶瓷膜、3 000 Da超滤膜、150 Da纳滤膜多级膜分离过滤,得到相应的透过液和截留液,取样进行分析。具体膜分离具体参数见表1。膜分离工艺流程如图1所示。
表1 膜分离运行工艺参数
Table 1 Membrane separation process parameters
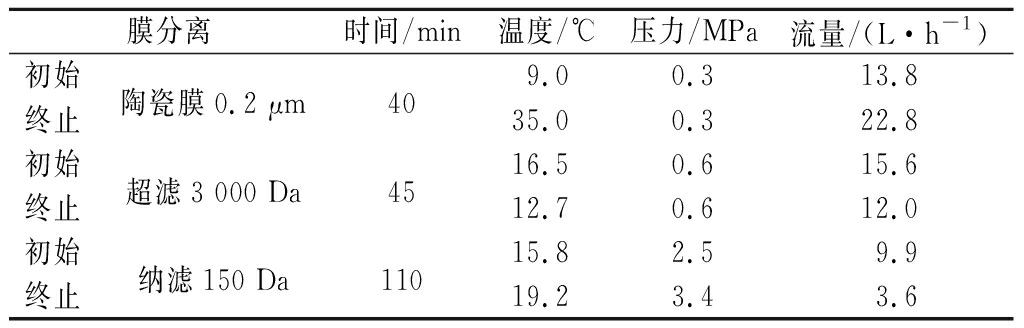
膜分离时间/min温度/℃压力/MPa流量/(L·h-1)初始陶瓷膜0.2 μm409.00.313.8终止35.00.322.8初始超滤3 000 Da4516.50.615.6终止12.70.612.0初始纳滤150 Da11015.82.59.9终止19.23.43.6
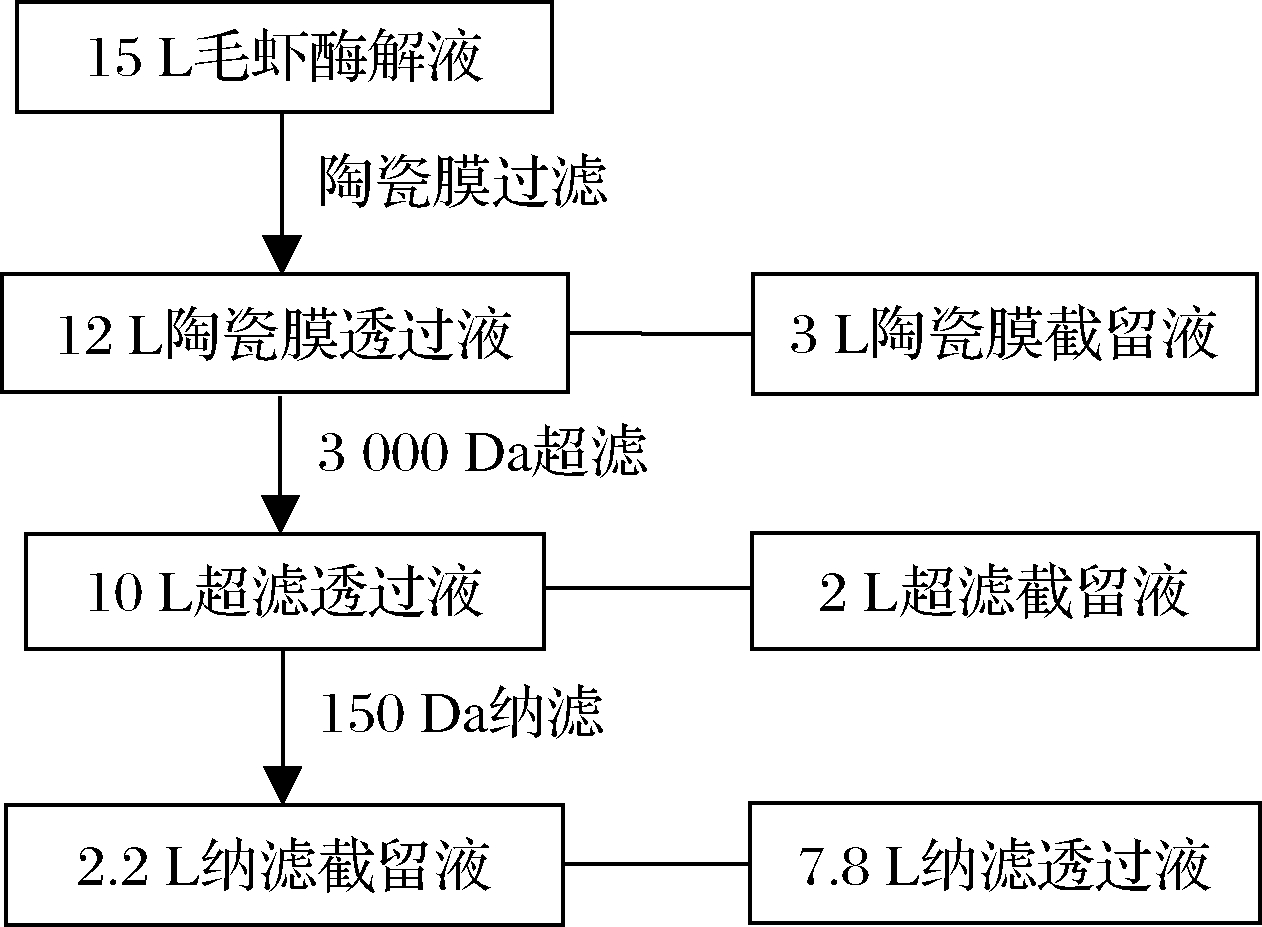
图1 中国毛虾酶解液的膜分离工艺
Fig.1 Membrane separation process of Acetes chinensis hydrolysate
1.3.3 固形物回收率
参照程缘等[12]的方法计算膜过滤后滤过液的固形物回收率,以此检验膜的通透性能。如公式(1)所示:
固形物回收率![]()
(1)
式中:C0,膜过滤前糖度,°Bx;V0,膜过滤前酶解液体积,L;C1,滤过液糖度,°Bx;V1,滤过液体积,L。
1.3.4 多肽含量测定
采用三氯乙酸(trichloroacetic acid,TCA)-双缩脲法测定[13]。以5% TCA配制标准多肽溶液,并取3 mL,加入3 mL 0.1 g/mL NaOH溶液以及1 mL 0.01 g/mL CuSO4溶液,混匀后静置10 min,在540 nm处吸光值。以多肽的质量浓度为横坐标X(mg/mL),吸光值为纵坐标Y,制作标准曲线。制得标准曲线方程为y=0.053 7x,R2=0.996。
1.3.5 滋味分析
参照邴芳玲等[14]的方法,利用Astree电子舌系统对样品检测,此系统包括AHS、CTS、NMS、CPS、ANS、SCS、PKS,其中 AHS、CTS、NMS分别代表酸味、咸味、鲜味,其他都是通用。取相同质量浓度的酶解液20 mL,水浴加热到50 ℃,进行电子舌测定,每个样品重复测定7次,数据采集时间为180 s,以超纯水为清洗溶液清洗20 s。仪器软件取第120 s测量值的响应信号作为稳定数据区域的输出值,取最后3次测量的响应值作为统计分析的原始数据,取平均值进行分析。
1.3.6 疏水性测定
参考WANG等[15]的方法,用荧光分光光度计RF-5301PC荧光探针测定蛋白水解物表面疏水值。将各组分冻干粉用0.01 mol/L、pH 6.5 Na2HPO4-NaH2PO4缓冲液稀释至0.2、0.4、0.6、0.8、1.0 mg/mL,取2 mL上述溶液,加入10 μL ANS,混匀。激发波长390 nm、发射波长470 nm。以多肽的质量浓度为横坐标X(mg/mL),表面疏水值为纵坐标Y,对浓度进行线性回归分析y=kx+b, 以斜率k作为表面疏水性指数。
1.3.7 苦味感官评价
苦味评分标准参考乐彩虹等[16]的方法稍作修改:将咖啡因配成质量分数分别为0%、0.025%、0.05%、0.10%、0.20%、0.30%的溶液,其对应的苦味程度和评分值如表2所示。按此评分标准,选取20名经专业培训后的同学(10男 10女)品尝酶解液的苦味,并与标准液比较进行评分,根据标准品浓度对应的分值对样品进行对照打分(0~10分),取平均值表示苦味分值。
表2 苦味感官评分表
Table 2 The table of bitter taste sensory score

咖啡因质量分数/%感官描述苦味评分/分0无苦味00.025略有苦味20.05苦味较弱40.10苦味一般60.20苦味较重80.30苦味极重10
1.4 统计分析
所有实验平行3次进行。数据由Orign 9.0软件绘制。采用SPSS 20.0版软件进行单因素方差分析,数据采用平均值±标准差来表示。
2 结果与分析
2.1 中国毛虾基本营养成分
中国毛虾基本营养成分如表3所示,可见中国毛虾粗蛋白含量高、脂肪和总糖含量低,含有一定的灰分。中国毛虾蛋白质的氨基酸组成如表4所示,可以看出中国毛虾的氨基酸种类比较齐全。中国毛虾蛋白的必需氨基酸(essential amino acid,EAA)/总氨基酸(amino acid,AA)为0.39,EAA/非必需氨基酸(nonessential amino acid,NEAA)为0.63,可见中国毛虾是一种较为理想的蛋白质来源。含量居前两位的是谷氨酸和天冬氨酸,含量分别为(8.31±0.38)g/100g和,为(5.56±0.23)g/100g,精氨酸含量次之,为(5.32±0.22)g/100g。
不同的氨基酸与滋味密切相关。游离谷氨酸、天冬氨酸和由谷氨酸、天冬氨酸和亲水性氨基酸残基组成的小分子肽具有强烈的鲜味。苏氨酸、丝氨酸、甘氨酸和丙氨酸具有甜味[17]。疏水氨基酸及其组成的肽段具有苦味。如缬氨酸、亮氨酸、异亮氨酸、蛋氨酸、苯丙氨酸、组氨酸等,若疏水基团位于肽链C端会使苦味增强。毛虾蛋白氨基酸组成中鲜味、甜味和苦味氨基酸占总氨基酸含量分别为24%、22%和28%,可见中国毛虾蛋白酶解后会释放游离氨基酸和小分子肽,使酶解液具有鲜味、甜味,也会产生苦味。
表3 中国毛虾基本营养成分 单位:g/100g
Table 3 Essential nutrients of Acetes chinensis

成分湿基干基水分 81.20±0.31-粗蛋白14.26±0.0475.85±0.19粗脂肪0.81±0.044.30±0.19灰分 3.19±0.0216.95±0.11总糖 0.19±0.001.03±0.02
注:-表示水分干基无法检测
表4 中国毛虾蛋白质的氨基酸组成 单位:g/100g
Table 4 Amino acid composition of Acetes chinensis protein
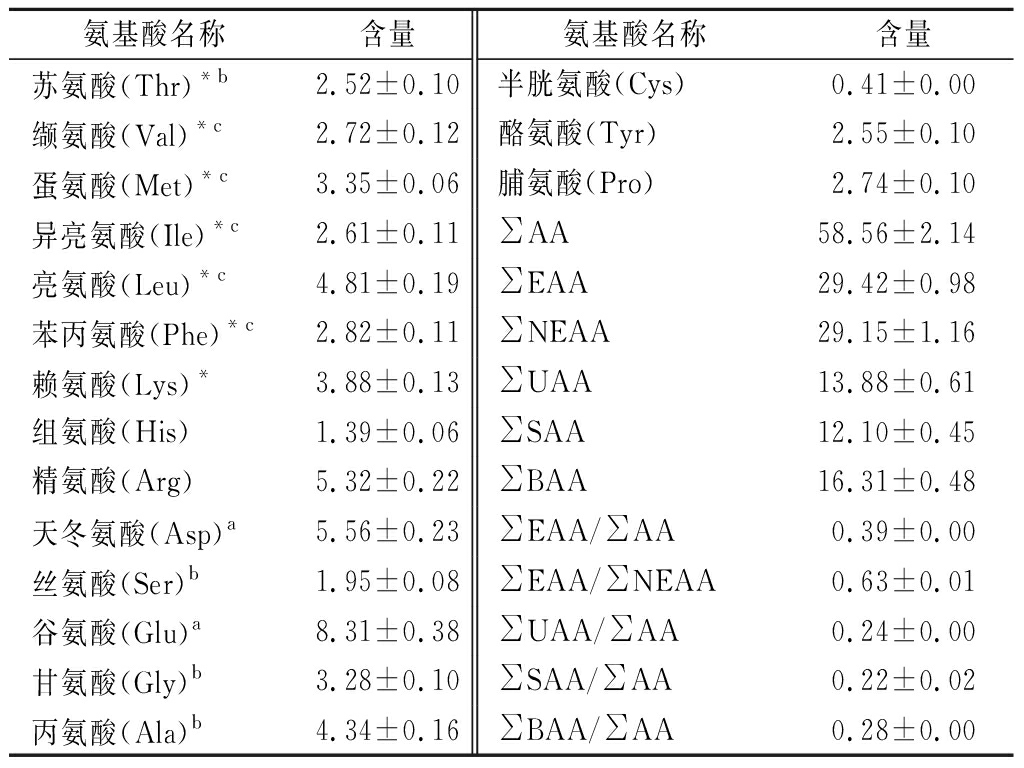
氨基酸名称含量氨基酸名称含量苏氨酸(Thr)*b2.52±0.10半胱氨酸(Cys)0.41±0.00缬氨酸(Val)*c2.72±0.12酪氨酸(Tyr)2.55±0.10蛋氨酸(Met)*c3.35±0.06脯氨酸(Pro)2.74±0.10异亮氨酸(Ile)*c2.61±0.11∑AA58.56±2.14亮氨酸(Leu)*c4.81±0.19∑EAA29.42±0.98苯丙氨酸(Phe)*c2.82±0.11∑NEAA29.15±1.16赖氨酸(Lys)*3.88±0.13∑UAA13.88±0.61组氨酸(His)1.39±0.06∑SAA12.10±0.45精氨酸(Arg)5.32±0.22∑BAA16.31±0.48天冬氨酸(Asp)a5.56±0.23∑EAA/∑AA0.39±0.00丝氨酸(Ser)b1.95±0.08∑EAA/∑NEAA0.63±0.01谷氨酸(Glu)a8.31±0.38∑UAA/∑AA0.24±0.00甘氨酸(Gly)b3.28±0.10∑SAA/∑AA0.22±0.02丙氨酸(Ala)b4.34±0.16∑BAA/∑AA0.28±0.00
注:*表示必需氨基酸;a表示鲜味氨基酸(umami amino acid,UAA);b表示甜味氨基酸(sweet amino acid,SAA);c表示苦味氨基酸(bitter amino acid,BAA)
2.2 膜分离制备毛虾多肽
中国毛虾经过酶解后,产生不同分子质量的多肽和氨基酸。膜分离可以去除大分子不溶物,同时截留相应的毛虾多肽。糖度即表示固形物含量,各组分经过膜处理后固形物和颜色的变化如表5和图2所示。原毛虾酶解液经陶瓷膜过滤后,颜色澄清,呈现棕红色,固形物回收率为(68.09±1.56)%,固形物回收率下降较多,说明去除了大量酶解后的不溶性物质。经过超滤膜3 000 Da过滤后,颜色变为浅黄色,固形物回收率为(56.74±0.90)%,超滤膜对色素有去除效果,截留组分固形物较少,说明超滤分子质量<3 000 Da 透过液组分大多是由小分子多肽和氨基酸组成。经纳滤膜150 Da过滤后得到的截留组分,体积1.8 L,体积浓缩比(volume concentration ratio,VCR)为6.67,固形物回收率为(51.06±1.34)%,截留液出现浑浊状态,表明纳滤浓缩效果良好。纳滤处理前后,纳滤截留液>150 Da的固形物保留了90%,说明较好的保留了毛虾酶解液多肽组分。纳滤透过液颜色变为无色,固形物含量较少。与张晓瑜等[18]用陶瓷膜微滤马氏珠母贝肉酶解液结论所得陶瓷膜过滤能改善酶解液的色值和澄清度一致。
最后得到纳滤截留液和原酶解液经喷雾干燥后,进行毛虾多肽含量和理化指标测定,纳滤截留液的多肽含量[(70.75±0.35) g/100g]及总氮含量[(13.95±0.05) g/100g]与原酶解液比都略有提升。纳滤截留液的灰分为(2.67±0.02) g/100g,与毛虾原料相比,大大降低,且其水分和游离氨基酸含量分别为(5.28±0.02) g/100g和(14.64±0.27) g/100g,均达到GB/T 22729—2008《海洋鱼低聚肽粉》的标准。毛虾水解后产生较多的游离氨基酸,推测毛虾多肽粉具有较高鲜味,后续对毛虾多肽粉的滋味进行电子舌分析。
表5 膜分离组分固形物含量和理化分析
Table 5 Solid content and physicochemical analysis of membrane separation components
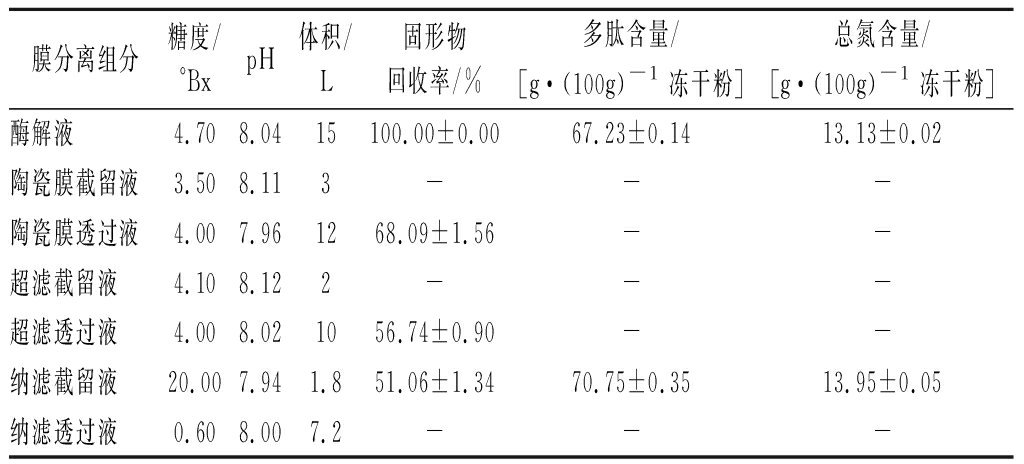
膜分离组分糖度/°BxpH体积/L固形物回收率/%多肽含量/[g·(100g)-1冻干粉]总氮含量/[g·(100g)-1冻干粉]酶解液4.708.0415100.00±0.0067.23±0.1413.13±0.02陶瓷膜截留液3.508.113---陶瓷膜透过液4.007.961268.09±1.56--超滤截留液4.108.122---超滤透过液4.008.021056.74±0.90--纳滤截留液20.007.941.851.06±1.3470.75±0.3513.95±0.05纳滤透过液0.608.007.2---
注:-表示未检测

图2 不同组分膜过滤液
Fig.2 Different components of membrane filtrate
注:从左到右依次为纳滤透过液、纳滤截留液、超滤透过液、 超滤截留液、陶瓷膜透过液和陶瓷膜截留液
2.3 中国毛虾酶解液电子舌滋味分析
电子舌是一种简便、快捷且新颖的滋味分析检测技术,目前受到了广泛关注和研究[14,19]。为直观表达中国毛虾酶解液的滋味变化,将电子舌检测结果根据强度值进行分析,结果见图3。
由图3可知,与不加酶对照组相比,毛虾酶解液的酸度和鲜度增加,酸度推测是与谷氨酸、天冬氨酸的含量增加有关。鲜味主要由于酶解液中鲜味游离氨基酸或鲜味肽所致。咸味下降,说明毛虾酶解液整体的滋味发生变化。
膜分离各组分的滋味变化比较明显,鲜味响应值由原酶解液6.7提高至纳滤截留液9.9,而咸味响应值从6.1下降到4.2,可见膜分离改变毛虾酶解液组成。咸味与氨基酸的种类和组成有关[20],另外膜分离技术具有脱盐的作用[8,21],这与之前测定灰分含量下降结果一致。与超滤截留液相比,纳滤150 Da去除氨基酸等小分子后的截留液鲜味增加依然非常明显,推测鲜味与小分子肽有关,研究发现Gly-Asp、Ala-Glu、Glu-Leu等小分子肽均具有鲜味[22]。因此对纳滤截留液的多肽鉴定可能发现新的滋味肽。
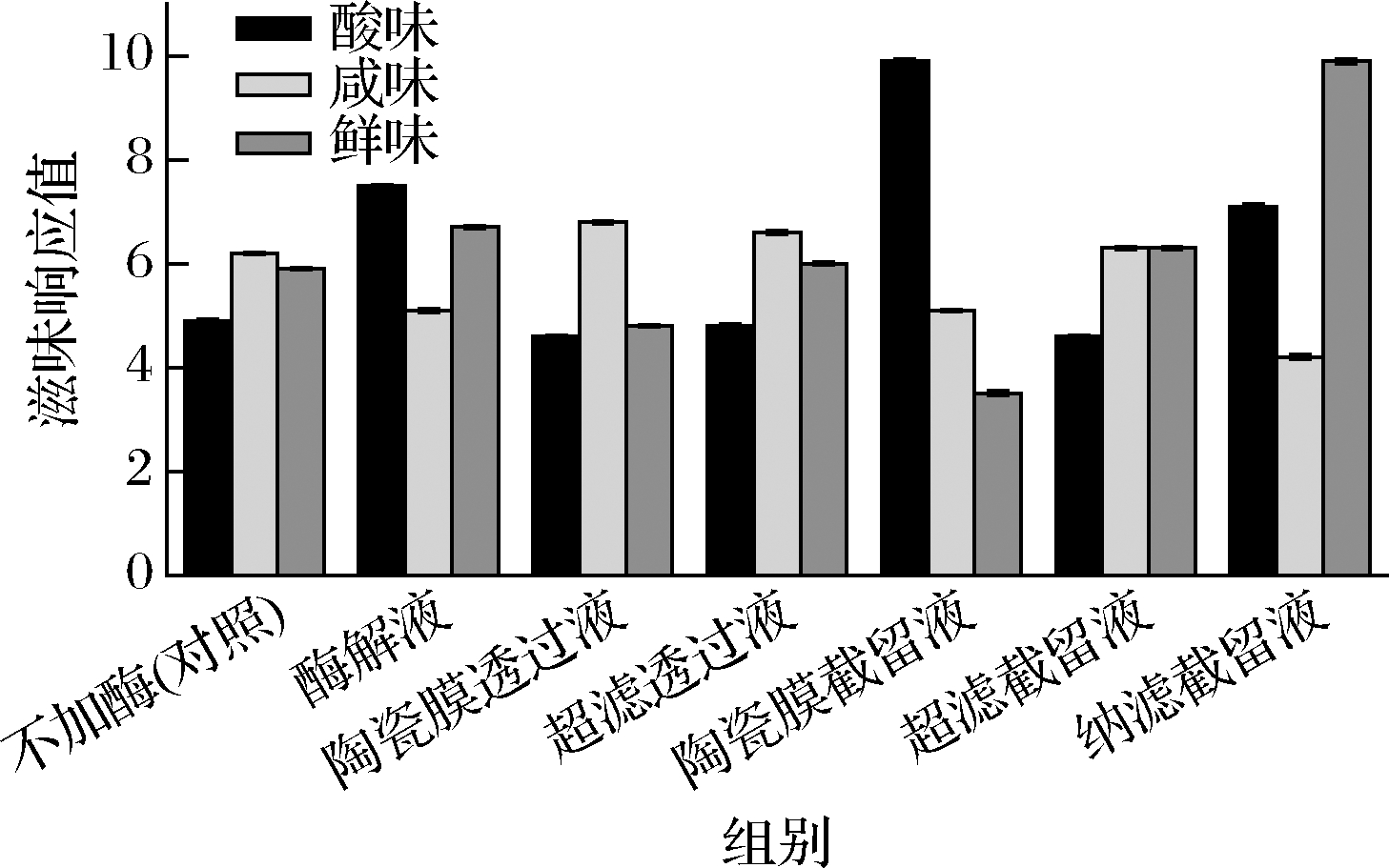
图3 中国毛虾酶解液和膜分离组成电子舌分析
Fig.3 E-tongue value of Acetes chinensis hydrolysate and membrane separation fractions
2.4 膜分离组分的疏水性和苦味分析
在蛋白质酶解过程中,蛋白质分子内部的疏水基团暴露,疏水性升高,随着酶解的进行,表面疏水性下降,主要是由于更多的亲水氨基酸暴露于表面[23]。水解物的苦味主要由原先包裹在蛋白质内部的疏水性片段水解而被暴露出来,与人体苦味受体结合而被感知,因此疏水性与苦味有着重要关联。疏水性指数越大,苦味越强[24]。
由表6可知,经膜处理后的酶解液疏水性指数明显下降。陶瓷膜截留液的分子质量最大,疏水性指数最大,纳滤透过液的分子质量最小,疏水性指数最小,每种膜处理后截留液比相应的透过液分子质量大,疏水性指数大于相应的透过液,说明蛋白质分子质量大小影响疏水性。程缘等[12]研究发现随着超滤的进行,其中分子质量> 10 kDa组分的表面疏水性最大(P<0.05),而分子质量3~10 kDa的组分有所下降。分子质量>10 kDa和<3 kDa的组分疏水性均有所增大,本研究结果与之相似。
由于电子舌无法判别苦味信息,因此对样品苦味进行感官评价。由表6可知,毛虾酶解液苦味一般、膜过滤后陶瓷膜截留液苦味极重。纳滤截留液样品的苦味比酶解液增加,纳滤透过液苦味评分最低,完全没有苦味。说明疏水性与苦味感官有一定的关系。由烷基侧链和芳香性侧链组成的疏水性氨基酸造成了苦味肽的苦味,苦味肽中至少含有一个疏水性氨基酸。另外疏水性氨基酸在肽链的位置也与苦味有关,疏水性氨基酸残基在多肽两侧,则苦味增强[25]。解铭[24]对鳕鱼酶解液进行疏水性测定,得到疏水性指数最大和最小值分别为250和60,苦味强度跟随疏水性指数增大而增大,本文疏水性指数均小于解铭的研究结果。进一步表明毛虾酶解多肽具有较好的滋味和较弱的苦味,有一定应用价值。
表6 膜分离组分酶解液的疏水性指数
Table 6 Hydrophobicity index of hydrolysate of membrane separation components
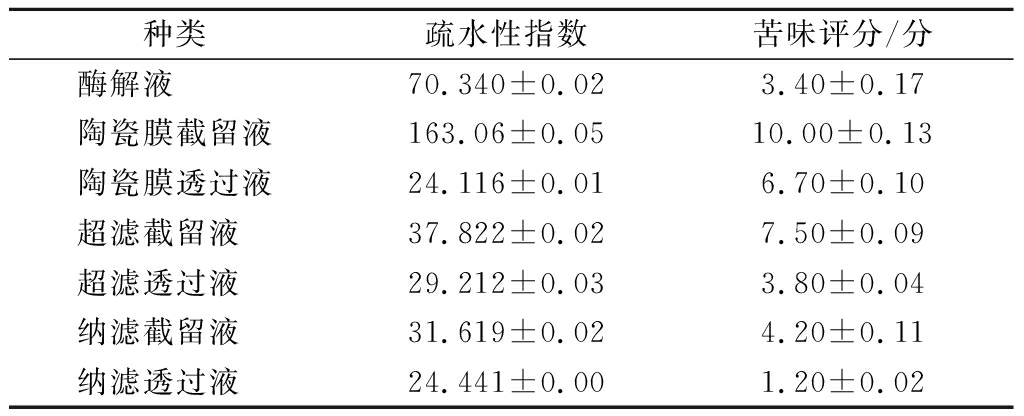
种类疏水性指数苦味评分/分酶解液 70.340±0.023.40±0.17陶瓷膜截留液163.06±0.0510.00±0.13陶瓷膜透过液24.116±0.016.70±0.10超滤截留液 37.822±0.027.50±0.09超滤透过液 29.212±0.033.80±0.04纳滤截留液 31.619±0.024.20±0.11纳滤透过液 24.441±0.001.20±0.02
3 结论
本研究对中国毛虾的基本营养成分及氨基酸组成进行测定,其粗蛋白含量较高为(75.85±0.19) g/100g(干基),且富含多种呈味氨基酸,其鲜味、甜味和苦味氨基酸分别占总氨基酸含量的(24±0.00)%、(22±0.02)%和(28±0.00)%。使用酶法制备中国毛虾酶解液,并利用多级膜分离系统制备毛虾多肽粉,发现毛虾酶解后鲜味和酸味强度增加,咸味下降;膜分离得到酶解液的鲜味提升明显,咸味降低。膜分离组分的疏水性指数明显降低。膜分离能够高效制备获得较好滋味的毛虾多肽粉,为工业化生产毛虾多肽,提高毛虾资源利用率和产品附加值提供参考。本文后续将对毛虾纳滤组分中的小分子肽进行分离鉴定,以期为风味肽的研究开发奠定理论基础。
[1] 农业农村部渔业渔政管理局. 中国渔业统计年鉴[M].北京:中国农业出版社, 2021.
Fisheries Administration, Ministry of Agriculture and Rural Affairs.China Fishery Statistics Yearbook[M].Beijing:China Agriculture Press, 2021.
[2] 汪少芸. 功能肽的加工技术与活性评价[M].北京:科学出版社, 2019.
WANG S Y.Processing Technology and Activity Evaluation of Functional Peptides[M].Beijing:Science Press, 2019.
[3] 徐永霞, 曲诗瑶, 李涛, 等.不同蛋白酶对蓝蛤酶解液风味特性的影响[J].食品科学, 2021, 42(4):190-196.
XU Y X, QU S Y, LI T, et al.Effects of different proteases on the flavor characteristics of Aloididae aloidi muscle hydrolysates[J].Food Science, 2021, 42(4):190-196.
[4] 张典. 牡蛎酶解液的呈味特性及其重金属去除工艺的研究[D].广州:华南理工大学, 2019.
ZHANG D.Study on oyster enzymatic hydrolysate′s taste characteristics and heavy metal removal technology[D].Guangzhou:South China University of Technology, 2019.
[5] 曹文红, 章超桦, 谌素华, 等.中国毛虾营养成分分析与评价[J].福建水产, 2001,23(1):8-14.
CAO W H, ZHANG C H, CHEN S H, et al.Analysis and evaluation of nutrients of Acetes chinensis[J].Journal of Fujian Fisheries, 2001,23(1):8-14.
[6] 范巍巍. 鳕鱼骨蛋白酶解过程中苦味形成机制及其控制方法研究[D].大连:大连工业大学, 2018.
FAN W W.Mechanism of bitterness formation and control methods of protein hydrolysis of cod bone[D].Dalian:Dalian Polytechnic University, 2018.
[7] CHO M J.Characterization of bitter peptides from soy protein hydrolysates[D].Columbia:University of Missouri-Columbia,2000.
[8] 何泽贺, 贾丽娜.膜分离技术在食品加工中的应用[J].农产品加工, 2017(7):67-68.
HE Z H, JIA L N.Application of membrane separation technology in food processing[J].Aem Roducts Rocessing, 2017(7):67-68.
[9] 熊文飞, 陈日春, 唐胜春, 等.杏鲍菇酶解液膜分离脱苦工艺的研究[J].食品工业科技, 2012, 33(22):287-291.
XIONG W F, CHEN R C, TANG S C, et al.Study on membrane separation debittering process of the Pleurotus eryngii enzymolysis liquid[J].Science and Technology of Food Industry, 2012, 33(22):287-291.
[10] 汪涛, 曾庆祝.利用贝类废弃物制造水解动物蛋白[J].青岛海洋大学学报(自然科学版), 2003, 33(3):361-365.
WANG T, ZENG Q Z.Producing of hydrolyzed animal protein from waste from scallop processing[J].Journal of Ocean University of Qingdao, 2003, 33(3):361-365.
[11] 李燕, 蒋霞云, 王晓辉.生物化学实验[M].北京:高等教育出版社, 2015.
LI Y, JIANG X Y, WANG X H.Biochemical Experiments[M].Beijing:Higher Education Press, 2015.
[12] 程缘, 赵英, 迟玉杰, 等.脱盐、超滤处理卵白蛋白源ACE抑制肽及其理化性质的研究[J].现代食品科技, 2015, 31(10):203-209.
CHENG Y, ZHAO Y, CHI Y J, et al.Study on the desalination and ultrafiltration treatment of angiotensin converting enzyme (ACE) inhibitory peptides derived from ovalbumin and their physicochemical properties[J].Modern Food Science and Technology, 2015, 31(10):203-209.
[13] 鲁伟, 任国谱, 宋俊梅.蛋白水解液中多肽含量的测定方法[J].食品科学, 2005, 26(7):169-171.
LU W, REN G P, SONG J M.Determination of content of peptides in protein hydrolysates[J].Food Science, 2005, 26(7):169-171.
[14] 邴芳玲, 冯涛, 杨焱, 等.食用菌鲜味味觉定性定量方法的电子舌研究[J].现代食品科技, 2016, 32(8):317-321.
BING F L, FENG T, YANG Y, et al.Quantification of the umami taste of edible fungi using electronic tongue [J].Modern Food Science and Technology, 2016, 32(8):317-321.
[15] WANG Y, WANG Z, HANDA C, et al.Effects of ultrasound pre-treatment on the structure of β-conglycinin and glycinin and the antioxidant activity of their hydrolysates[J].Food Chemistry, 2017, 218:165-172.
[16] 乐彩虹, 陶宁萍, 徐逍.暗纹东方鲀鱼皮胶原蛋白肽脱苦前后苦味物质的变化[J].食品与发酵工业, 2021, 47(4):87-95.
LE C H, TAO N P, XU X.Changes of bitter substances of collagen peptide in Takifugu obscurus skin before and after debittering[J].Food and Fermentation Industries, 2021, 47(4):87-95.
[17] LI X, LIU Y, WANG Y, et al.Combined ultrasound and heat pretreatment improve the enzymatic hydrolysis of clam (Aloididae aloidi) and the flavor of hydrolysates[J].Innovative Food Science & Emerging Technologies, 2021, 67:102596.
[18] 张晓瑜, 杨萍, 洪鹏志, 等.陶瓷膜微滤对马氏珠母贝肉酶解液理化特性的影响[J].食品工业科技, 2015, 36(22):97-99;104.
ZHANG X Y, YANG P, HONG P Z, et al.Effects of micro-filtration by ceramic membrane on physicochemical properties of enzymatic hydrolysates of Pinctada martensii meat[J].Science and Technology of Food Industry, 2015, 36(22):97-99;104.
[19] WANG H,SUN H.Potential use of electronic tongue coupled with chemometrics analysis for early detection of the spoilage of Zygosaccharomyces rouxii in apple juice[J].Food Chemistry, 2019, 290:152-158.
[20] 黄文垒, 毕继才, 闫寒.咸味肽研究进展[J].食品工业, 2020, 41(10):261-264.
HUANG W L, BI J C, YAN H.Advances in salty peptides[J].The Food Industry, 2020, 41(10):261-264.
[21] 王晓杰, 曲悦, 刘晓兰, 等.玉米肽的纳滤脱盐工艺及脱盐产物抗氧化活性[J].食品科学, 2021, 42(5):39-45.
WANG X J, QU Y, LIU X L, et al.Corn peptide:Desalting by nanofiltration and antioxidant activity[J].Food Science, 2021, 42(5):39-45.
[22] 张波. 呈味肽研究技术进展[J].现代食品, 2020, 2(4):61-63.
ZHANG B.Research progress on flavor peptides[J].Modern Food, 2020, 2(4):61-63.
[23] YARNPAKDEE S, BENJAKUL S, KRISTINSSON H G, et al.Antioxidant and sensory properties of protein hydrolysate derived from Nile tilapia (Oreochromis niloticus) by one-and two-step hydrolysis[J].Journal of Food Science & Technology, 2015, 52(6):3 336-3 349.
[24] 解铭. 鳕鱼肉酶解液中苦味肽的分离纯化及脱苦方法研究[D].青岛:中国海洋大学, 2015.
XIE M.Separation and purification of bitter peptides and debittering methods in hydrolysates of cod fish[D].Qingdao:Ocean University of China, 2015.
[25] MATOBA T, HATA T.Relationship between bitterness of peptides and their chemical structures[J].Agricultural Biotechnology Chemistry, 2014, 36(8):1 423-1 431.