纳米纤维素是纤维素经过机械、化学或生物方法使其在某一维度具有纳米尺寸,主要分为纤维素纳米纤丝(cellulose nanofibrils,CNF)、纤维素纳米晶(cellulose nanocrystals,CNC)和细菌纳米纤维素(bacterial nanocellulose,BNC)。纳米纤维素因其独特的纳米结构、高机械强度、高纵横比、生物相容性、可降解以及无毒性等特点,在食品、医药和复合材料等领域具有巨大应用前景[1-2]。
Pickering乳液采用固体颗粒代替表面活性剂稳定乳液,具有稳定性好、可调控、环境相容性好和抗奥氏熟化等特点,广泛应用于化妆品、医药和食品等领域[3]。稳定Pickering乳液的固体颗粒主要包括蛋白基、多糖基纳米颗粒和无机纳米粒子等[4-5],其中多糖基纳米颗粒如纳米纤维素由于其稳定性好、独特的纳米结构、天然两亲性和生物相容性等特点,受到广泛关注[6]。但由于纳米纤维素相对较高的亲水性,通过疏水改性或与其他物质协同改善其稳定Pickering乳液性能研究较为广泛。而疏水改性涉及到较多化学试剂的使用,不利于食品级乳液的开发,通过与蛋白、多糖等生物大分子协同稳定Pickering乳液具有更好的生物相容性和功能性,具有重要研究意义[7]。食品乳化体系通常是多种天然表面活性分子共存和互作的体系,研究多种物质协同稳定的Pickering乳液对于其实际应用具有重要意义。
明胶是动物胶原蛋白部分水解得到的肽和蛋白质的混合物,易于获得且生产成本低,具有良好的乳化性和生物相容性,可作为良好的Pickering稳定剂开发利用。已报道的去溶剂法构建明胶纳米颗粒,步骤繁琐且涉及到戊二醛、丙酮等化学试剂的使用,限制了其在食品体系中的应用[8]。而近年来通过明胶与其他物质协同稳定乳液受到广泛关注,例如明胶和明胶纳米颗粒[9]、明胶和酪蛋白酸钠[10]、明胶和表面活性剂[11]、明胶和多酚[12]、明胶和BNC[13]等。通过不同物质间在界面吸附填充或参与连续相网络结构的加强,乳液稳定性得到明显改善。本研究以微晶纤维素(microcrystalline cellulose,MCC)为原料,通过硫酸水解法制备CNC并进一步通过高碘酸钠氧化获得二醛纳米纤维素(dialdehyde cellulose nanocrystals,DACNC),基于Schiff碱反应设计构建明胶和DACNC协同稳定Pickering乳液。考察明胶和DACNC的添加顺序和DACNC质量浓度对乳液外观、微观结构和流变特性的影响,同时对明胶/DACNC协同稳定乳液的环境稳定性(温度、pH和离子强度)进行评估。
1 材料与方法
1.1 原料与试剂
MCC,上海源叶生物科技有限公司;B型明胶(来源于猪皮),美国Sigma-Aldrich公司;大豆油,九三集团;硫酸、氯化钠、氢氧化钠、溴酚蓝和盐酸羟胺,成都市科隆化学品有限公司;高碘酸钠,天津市科密欧化学试剂有限公司;乙二醇,广东光华科技股份有限公司;盐酸,重庆川东化工有限公司;所有试剂均为分析纯。
1.2 仪器与设备
Ntegra Platform原子力显微镜,俄罗斯NT-MDT公司;PE 20实验室酸度计,上海梅特勒-托利多仪器有限公司;Heraeus Multifuge X3R台式高速冷冻离心机,美国赛默飞世尔科技公司;BX 53光学显微镜,日本OLYMPUS公司;Spectrum 100红外光谱仪,美国PerkinElmer公司;ZEN 3690激光粒度仪、Mastersizer 3000激光粒度分析仪,英国Malvern公司;XHF-DY高速分散器,宁波新芝有限公司;MCR302流变仪,奥地利安东帕公司;DTG-60A差热热重同步热分析仪,日本岛津公司;FD-1-50真空冷冻干燥机,北京博益康实验仪器有限公司。
1.3 CNC的制备
称取10 g MCC,按料液比1∶20(g∶mL)分散在64%(质量分数)的硫酸溶液中,45 ℃下水浴搅拌1 h,然后加入10倍体积蒸馏水终止反应。将反应物进行反复离心(4 000 r/min,10 min)和蒸馏水洗涤,直至上层液体为半透明乳白色悬浮液,收集悬浮液在蒸馏水中透析3 d,取部分冷冻干燥备用。
1.4 DACNC的制备
取200 mL CNC悬浮液,加入2 g NaIO4,在45 ℃水浴中避光反应5 h,然后加入4 mL乙二醇,继续水浴反应1 h以除去未反应的NaIO4,收集产物并透析3 d,得到DACNC悬浮液。采用盐酸羟胺-肟化酸碱滴定法测定DACNC中的醛基含量[14]。
1.5 结构表征
1.5.1 红外光谱(Fourier transform infrared spectroscopy,FTIR)
取适量MCC、CNC和DACNC干燥粉末放入压片模具中,采用溴化钾压片法制样。扫描范围为4 000~400 cm-1,分辨率为4 cm-1,扫描次数为32 次/s。
1.5.2 粒径分布和Zeta电位测定
将CNC和DACNC悬浮液(0.5 g/L)用马尔文激光粒度仪测定粒径尺寸和Zeta电位。
1.5.3 原子力显微镜(atomic force microscope,AFM)
吸取5 μL CNC和DACNC悬浮液(0.2 g/L)滴在新鲜剥离的云母片上,室温干燥5 h制样。
1.5.4 热稳定性分析(thermogravimetric analysis,TGA)
准确称取10 mg干燥的MCC、CNC或DACNC样品进行热失重分析。测试温度为30~500 ℃,升温速率为10 ℃/min,在氮气氛围下进行测定。
1.6 稳定Pickering乳液研究
1.6.1 Pickering乳液制备
固定油相体积占比50%和均质条件(10 000 r/min,2 min),考察明胶和DACNC添加顺序对乳液稳定的影响,具体如下:(1)明胶单独稳定乳液(G/Oil):3 mL 10 g/L明胶溶液+3 mL大豆油;(2)DACNC单独稳定乳液(DACNC/Oil):3 mL 5 g/L DACNC悬浮液;(3)明胶/DACNC稳定乳液(G/Oil/DACNC):1.5 mL 10 g/L明胶溶液+3 mL大豆油(均质10 000 r/min, 1 min)+ 1.5 mL 5 g/L DACNC悬浮液(均质10 000 r/min, 1 min);(4)DACNC/明胶稳定乳液(DACNC/Oil/G):1.5 mL 5 g/L DACNC悬浮液+3 mL大豆油(均质10 000 r/min, 1 min)+ 1.5 mL 10 g/L明胶溶液(均质10 000 r/min, 1 min);(5)明胶+DACNC稳定乳液(G+DACNC/Oil):(1.5 mL 5 g/L DACNC悬浮液+1.5 mL 1%明胶溶液)+3 mL大豆油。
1.6.2 乳液微观结构
利用光学显微镜观察乳液的微观结构。吸取20 μL 乳液滴在载玻片上,放置在显微镜下进行观察。
1.6.3 乳液粒径测定
利用马尔文激光粒度仪测定乳液液滴的大小。设定分散相折射率和吸附率分别为1.460和0.001,连续相折射率为1.330。将样品适当稀释后,测定体积平均粒径D4,3。
1.6.4 流变学特性
使用流变仪在25 ℃下对乳液的流变性能进行测定。在1%的固定应变下,0.1~100 rad/s内进行频率扫描,记录存储模量(G′)和损耗模量(G″)。在0.01~100 s-1剪切速率内进行剪切扫描,以确定样品的表观黏度随剪切速率的变化。
1.6.5 DACNC质量浓度对乳液稳定性的影响
固定明胶质量浓度10 g/L和油相体积占比50%,按照预先混合明胶和DACNC方式制备乳液,考察不同DACNC质量浓度(0、2、5和10 g/L)对乳液粒径、微观形态和流变性能的影响。
1.6.6 乳液稳定性分析
以10 g/L明胶和5 g/L DACNC,油相体积占比50%制备乳液。分析乳液在不同pH(3、5、7、9、11)、温度(4、30、50、70 ℃)和离子强度(0、50、100、200 mmol/L)下的环境稳定性,对乳液外观和微观形态进行记录。
2 结果与分析
2.1 FTIR分析
MCC、CNC以及DACNC的FTIR图谱如图1所示。所有样品都出现了纤维素有关的特征吸收峰,其中位于3 300 cm-1附近是O—H伸缩振动吸收峰,2 900 cm-1附近的属于吡喃葡萄糖环的C—H振动吸收峰[15]。MCC经过酸水解后形成的CNC的FTIR图谱未发生明显变化,表明纤维素的主体结构未遭到破坏,但部分纤维素特征峰的强度由于酸水解造成的氧化反应而发生变化[16-17]。CNC经过高碘酸钠氧化后,获得的DACNC在1 735 cm-1处出现一个新的吸收峰,属于醛基氧化形成的C![]() O吸收峰[18];此外,DACNC中位于885 cm-1的半缩醛振动吸收峰和790 cm-1处的属于醛基上的C—H吸收峰强度明显增加,也证明CNC氧化反应形成DACNC[14]。DACNC的醛基含量为2.4 mmol/g。
O吸收峰[18];此外,DACNC中位于885 cm-1的半缩醛振动吸收峰和790 cm-1处的属于醛基上的C—H吸收峰强度明显增加,也证明CNC氧化反应形成DACNC[14]。DACNC的醛基含量为2.4 mmol/g。

图1 MCC、CNC和DACNC的FTIR图谱
Fig.1 FTIR spectra of MCC, CNC and DACNC
2.2 形貌、粒径和电位分析
图2-A为CNC和DACNC的AFM图。CNC和DACNC均呈短棒状,通过Nano Measurer软件显示CNC和DACNC的平均长度分别为175、132 nm。DACNC的长度较CNC明显减小,这主要是纤维素大分子链中的部分β-1-4-糖苷键在氧化过程中裂解造成,这与已报道的类似研究结果一致[14,19]。如图2-B所示,通过粒径分布获得的CNC和DACNC的平均粒径为233 mm和189 nm,且呈现单峰分布。如图2-C所示,CNC和DACNC的Zeta电位分别为(-46.8±1.6) mV和(-40.6±2.2) mV。DACNC的表面负电荷基团在氧化过程中有一定的损失,但仍然具有较好的稳定性。

A-AFM图;B-粒径分布;C-Zeta电位值
图2 CNC和DACNC的AFM图、粒径分布和Zeta电位值
Fig.2 AFM images, particle sizes distribution and Zeta-potentials of CNC and DACNC
2.3 热稳定性分析
图3-A和图3-B分别是MCC、CNC和DACNC的热重(thermogravimetry,TG)和微商热重(derivative thermogravimetry,DTG)曲线。如图3-A所示,所有样品的热降解大致可分为3个阶段。第一阶段在30~100 ℃,主要是样品中残余水分蒸发;第二阶段在150~350 ℃,主要是由于纤维素的热降解造成的,包括糖苷键的分解、脱水,以及最后形成残碳化合物;继续升温发生第三阶段热降解,主要是第一次降解过程中产生的物质发生的二次热解[20]。升温至500 ℃时,MCC、CNC和DACNC的残余质量分别为5.31%、31.88%和30.37%,CNC和DACNC的残余质量较MCC显著增加,这是由于纳米纤维素中硫酸化无定形和结晶区域在降解过程中具有阻燃剂作用造成的[21]。由图3-B所示,MCC、CNC和DACNC的失重峰对应的温度分别为330、200和260 ℃,说明DACNC和CNC的热稳定性较MCC变差,主要是因为在硫酸水解引入磺酸根基团,使其分解活化能降低,因此降低了纤维素晶体的热稳定性[21]。而DACNC的初始降解温度较CNC高,这主要是醛基之间形成的半缩醛键造成的,从而提高了DACNC的热稳定性。

A-TG曲线;B-DTG曲线
图3 MCC、CNC及DACNC的TG和DTG曲线
Fig.3 TG and DTG curves of MCC, CNC and DACNC
2.4 明胶/DACNC协同稳定Pickering乳液研究
2.4.1 明胶和DACNC的添加顺序对Pickering乳液稳定性影响
图4为单独明胶、DACNC稳定乳液和明胶/DACNC不同添加顺序稳定乳液的外观(第1~7天)和光学显微镜图(第1天)。从外观上看,单独明胶和DACNC都能稳定乳液,但是底部出现更明显和浑浊的水层,这是一些细小液滴和未吸附颗粒造成的。DACNC和明胶添加顺序会影响其共同稳定乳液效果。DACNC的加入使得乳液层体积和稳定性增加,这可能是由于DACNC与明胶发生Schiff碱反应[22],改善了乳液中的连续性网络结构和乳液界面机械强度。明胶和DACNC预混合后再进行乳化操作,乳液的析水层最少。在4 ℃下贮存7 d后,所有乳液外观均无变化,但单独明胶稳定乳液的析水现象更为明显,这与DACNC增加了连续相的网络结构,使乳液的絮凝稳定性增加有关。所有乳液粒径无明显差异,说明明胶主导界面吸附,固定了液滴粒径大小,而DACNC主要加强界面层和连续相的网络结构[23]。后续所有乳液制备均采用DACNC和明胶预混合后再进行乳化操作。

图4 单独明胶、DACNC以及不同明胶和DACNC添加顺序 制备的乳液外观(第1-7天)和光镜图(第1天)
Fig.4 The appearance (1-7 d) and light micrographs (1 d) of the emulsions stabilzied by gelatin, DACNC and different gelatin/DACNC addition sequence
注:乳液外观样品从左至右分别为明胶单独稳定乳液(G/Oil)、DACNC 单独稳定乳液(DACNC/Oil)、DACNC/明胶稳定乳液(DACNC/Oil/G)、 明胶/DACNC稳定乳液(G/Oil/DACNC)、明胶+DACNC 稳定乳液(G+DACNC/Oil)
2.4.2 DACNC质量浓度对乳液粒径及稳定性的影响
图5为明胶和不同质量浓度DACNC悬浮液协同稳定的乳液光镜、粒径分布(第1天)以及乳液外观图片(第1~7天)。随着DACNC质量浓度增加,析水层减少,且液滴平均尺寸逐渐增加且液滴形态更为均匀。随着DACNC质量浓度从0增加到10 g/L,乳液液滴的平均粒径从68 μm增加到195 μm。由于明胶和DACNC之间的Schiff碱反应导致液滴之间形成界面交联结构,液滴在一定程度上能够聚集形成大的液滴簇和凝胶网络结构[23]。此外,高浓度的DACNC也会与明胶形成界面竞争吸附,导致乳液粒径增大。由于乳液内部交联网络结构的形成,当前制备的乳液具有较好的贮藏稳定性。

图5 不同DACNC质量浓度和明胶稳定乳液的光镜、粒径分布(第1天)以及乳液外观(第1~7天)
Fig.5 Light micrographs and droplets size distribution (1 d) as well as the appearance diagrams (1-7 d) of emulsions stabilzied by gelatin and different DACNC mass concentrations
注:乳液外观样品从左至右为DACNC质量浓度分别为0、2、5和10 g/L的乳液
2.4.3 Pickering乳液流变学分析
图6为DACNC质量浓度对乳液流变学特性的影响。如图6-A所示。乳液黏度均随剪切速率增加而降低,呈现剪切稀化现象;随着DACNC质量浓度的增加,乳液的黏度明显增加,表明DACNC增强了乳液体系的网络结构[23]。这与DACNC自身的黏度增强效应和Schiff碱反应发生有关。如图6-B所示,在低频率下(0.1~10 rad/s),所有乳液的储能模量(G′)明显高于其损耗模量(G″),同时乳液模量随DACNC质量浓度的增加而增加,乳液交联网络结构增强。在高频率下(>10 rad/s),明胶优异的乳化性能使乳液结构均一和稳定,而少量的DACNC添加会影响明胶的界面吸附排列和乳液内部网络结构不均一,使其高频率下乳液结构破坏。更多的DACNC导致乳液连续相网络结构增强和Schiff碱交联反应增强,乳液稳定性也相应增加。
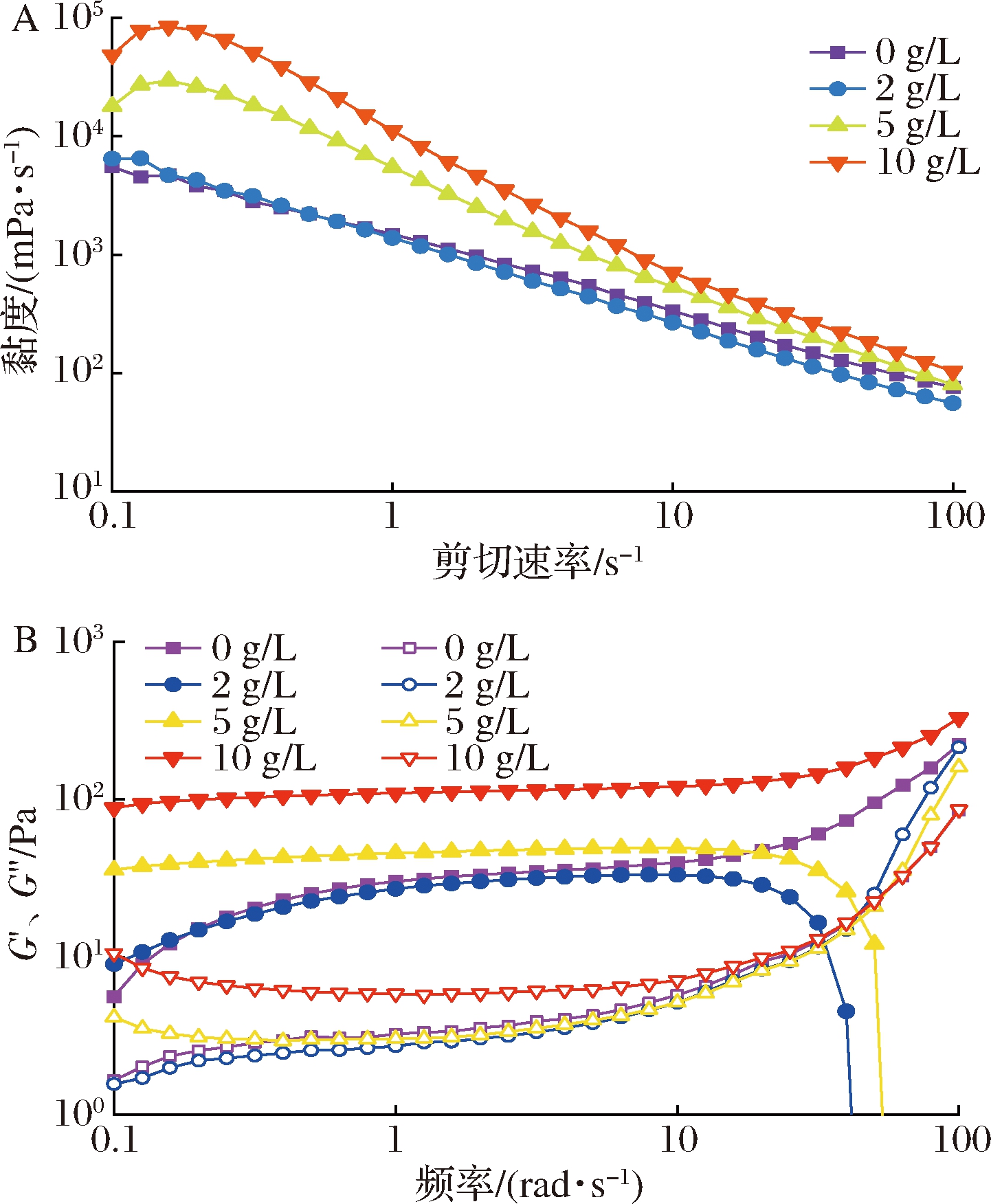
A-乳液的动态黏度;B-乳液储能模量G′和损耗模量G″
图6 不同DACNC质量浓度和明胶稳定乳液的动态黏度与 储能模量G′和损耗模量G″
Fig.6 Dynamic viscosity, storage modulus G′ and loss modulus G″ of emulsions stabilzied by gelatin and different DACNC concentrations
2.4.4 pH对Pickering乳液稳定性影响
图7为固定明胶质量浓度10 g/L和DACNC质量浓度5 g/L以及油相体积占比50%的乳液在不同pH下的外观(第1~7天)和光镜图片(第1天)。乳液在pH 3~11内都能形成外观稳定的乳液,随pH增加乳液析水现象减弱,这与在酸性条件下的电荷屏蔽有关,导致液滴之间的静电排斥作用降低而倾向于聚结[24]。随着pH增加,乳液稳定性增加,尤其是在pH 5时乳液液滴分布更紧密和均一。B型明胶等电点为4.8~5.1[11],有研究报道明胶乳液在pH 3和pH 5时由于蛋白质聚集导致乳液无法稳定[25]。而在pH 5 时DACNC/明胶乳液具有较好的稳定性,这与Schiff碱反应和DACNC在连续相形成乳液交联网络结构有关,对于加强明胶乳液在酸性及等电点附近稳定性具有重要意义。

图7 不同pH下明胶/DACNC稳定乳液的外观 (第1~7天)和光镜图(第1天)
Fig.7 The appearance (1-7 d) and light micrographs (1 d) of the emulsions stabilized by gelatin/DACNC at different pH values
2.4.5 温度对Pickering乳液稳定性影响
图8为固定明胶质量浓度10 g/L和DACNC质量浓度5 g/L以及油相体积占比50%的乳液在不同温度处理1 h后的乳液外观(第1~7天)和光镜图片(第1天)。所有温度下处理后的乳液都具有较好的贮藏稳定性,随着温度升高,乳液析水层降低。低温下的乳液具有较好的粒径分布和致密性,主要依靠明胶优异的乳化性能和DACNC对连续相网络增强作用。随着温度增加,Schiff碱反应增强,形成相互连接的液滴簇网络结构,此时由于乳液网络扩充而增加了乳液层体积,析水现象相对减弱。

图8 不同温度处理后明胶/DACNC稳定乳液的外观 (第1~7天)和光镜图(第1天)
Fig.8 The appearance (1-7 d) and light micrographs (1 d) of the emulsions stabilized by gelatin/DACNC at different temperatures
注:图中乳液样品从左至右分别为4、30、50、70 ℃处理1 h 后的乳液外观
2.4.6 离子强度对Pickering乳液稳定性影响
图9为固定明胶质量浓度10 g/L和DACNC质量浓度5 g/L以及油相体积比例50%的乳液在不同离子强度下的外观(第1~7天)和光镜图片(第1天)。当NaCl浓度为0 mmol/L时,乳液稳定性相对较差,析水层浑浊且乳化层存在絮凝现象,这与DACNC的静电排斥阻碍其在界面和乳液网络构建中的作用有关。随着NaCl浓度增加,颗粒间的静电排斥效应降低,其在界面处的吸附、排列程度增加,界面和网络结构增强[24]。但离子强度过大(200 mmol/L)使液滴表面电荷屏蔽,影响了液滴间的排斥稳定和诱导液滴聚结,乳液稳定性降低[26]。

图9 不同离子强度下明胶/DACNC稳定乳液的外观 (第1~7天)和光镜图(第1天)
Fig.9 The appearance (1-7 d) and light micrographs (1 d) of the emulsions stabilized by gelatin/DACNC at different ionic strengthens
注:图中乳液样品从左至右分别为离子强度0、50、100和200 mmol/L 的乳液外观
3 结论
本研究以MCC为原料通过硫酸水解法制备CNC,进一步利用高碘酸钠氧化获得DACNC。CNC和DACNC较MCC的初始降解温度更低,但高温下分解残余质量增加。由于氧化过程中纤维素大分子链中的部分β-1-4-糖苷键断裂,DACNC的长度较CNC降低。明胶和DACNC协同稳定Pickering乳液受到明胶和DACNC的添加顺序、DACNC质量浓度以及外界环境(pH、离子浓度和温度)的影响。DACNC和明胶预混合后再进行乳液制备具有更好的协同稳定乳液效果。由于DACNC表面的醛基与明胶表面的氨基发生Schiff碱反应,导致乳液界面强度和连续相中网络结构的增强,乳液流变性和稳定性获得明显改善。随着DACNC质量浓度的增加,乳液液滴尺寸逐渐增加,乳液黏度和模量相应增加,形成一定的液滴簇和凝胶网络结构,乳液的稳定性增加。此外,明胶/DACNC协同稳定的乳液具有较好的pH、离子强度和热稳定性,能够解决单独明胶和CNC稳定的Pickering乳液环境稳定性较差的瓶颈问题。
[1] 张欢, 戴宏杰, 陈媛, 等.纳米纤维素的制备及其在Pickering乳液中的应用研究进展[J].食品研究与开发, 2020, 41(15):173-181.
ZHANG H, DAI H J, CHEN Y, et al.Research progress in nanocellulose preparation and its application in Pickering emulsions[J].Food Research and Development, 2020, 41(15):173-181.
[2] 陈媛, 张欢, 余永, 等.纤维素纳米晶稳定Pickering乳液及其环境响应性研究进展[J].食品与发酵工业, 2020, 46(24):234-241.
CHEN Y, ZHANG H, YU Y, et al.Research progress of cellulose nanocrystals stabilized Pickering emulsion and its environmental responsiveness[J].Food and Fermentation Industries, 2020, 46(24):234-241.
[3] LOW L E, SIVA S P, HO Y K, et al.Recent advances of characterization techniques for the formation, physical properties and stability of Pickering emulsion[J].Advances in Colloid and Interface Science, 2020, 277:102117.
[4] SARKAR A, DICKINSON E.Sustainable food-grade Pickering emulsions stabilized by plant-based particles[J].Current Opinion in Colloid & Interface Science, 2020, 49:69-81.
[5] 刘兴丽, 赵双丽, 肖乃勇, 等.马铃薯蛋白微凝胶对皮克林乳液乳化特性的影响[J].轻工学报, 2019, 34(5):1-9.
LIU X L, ZHAO S L, XIAO N Y, et al.Effect of potato protein microgel on emulsifying properties of Pickering emulsion[J].Journal of Zhengzhou University of Light Industry(Natural Science Edition), 2019, 34(5):1-9.
[6] LI Q, WU Y L, FANG R X, et al.Application of nanocellulose as particle stabilizer in food Pickering emulsion:Scope, merits and challenges[J].Trends in Food Science & Technology, 2021, 110:573-583.
[7] DAI H J, WU J H, ZHANG H, et al.Recent advances on cellulose nanocrystals for Pickering emulsions:Development and challenge[J].Trends in Food Science & Technology, 2020, 102:16-29.
[8] FENG X, DAI H J, MA L, et al.Food-grade gelatin nanoparticles:Preparation, characterization, and preliminary application for stabilizing Pickering emulsions[J].Foods, 2019, 8(10):479.
[9] TAN H, TU Z, JIA H Q, et al.Hierarchical porous protein scaffold templated from high internal phase emulsion costabilized by gelatin and gelatin nanoparticles[J].Langmuir, 2018, 34(16):4 820-4 829.
[10] ZHAO M, HUANG X, ZHANG H, et al.Probiotic encapsulation in water-in-water emulsion via heteroprotein complex coacervation of type—A gelatin/sodium caseinate[J].Food Hydrocolloids, 2020, 105(2):105790.
[11] ZHANG T, DING M Z, TAO N P, et al.Effects of surfactant type and preparation pH on the droplets and emulsion forms of fish oil-loaded gelatin/surfactant-stabilized emulsions[J].LWT-Food Science and Technology, 2020, 117:108654.
[12] PAN H B, XU X L, QIAN Z Q, et al.Xanthan gum-assisted fabrication of stable emulsion-based oleogel structured with gelatin and proanthocyanidins[J].Food Hydrocolloids, 2021, 115:106596.
[13] RAZAVI M S, GOLMOHAMMADI A, NEMATOLLAHZADEH A, et al.Preparation of cinnamon essential oil emulsion by bacterial cellulose nanocrystals and fish gelatin[J].Food Hydrocolloids, 2020, 109:106111.
[14] LEE H, YOU J, JIN H J, et al.Chemical and physical reinforcement behavior of dialdehyde nanocellulose in PVA composite film:A comparison of nanofiber and nanocrystal[J].Carbohydrate Polymers, 2020, 232:115771.
[15] MA J Z, WANG T T, YU S, et al.Preparation and application of dialdehyde nanocellulose reinforced jatropha oil based polymer emulsions as leather fatliquors[J].Cellulose, 2021, 28(8):331-346.
[16] NIU F G, LI M Y, HUANG Q, et al.The characteristic and dispersion stability of nanocellulose produced by mixed acid hydrolysis and ultrasonic assistance[J].Carbohydrate Polymers, 2017, 165:197-204.
[17] 范佳莹, 李则灵, 朱霞建, 等.柚皮纳米纤维素的制备工艺优化及形态特征[J].食品与发酵工业, 2019, 45(20):202-208.
FAN J Y, LI Z L, ZHU X J, et al.Process optimization and morphological characterization of pomelo nano-cellulose[J].Food and Fermentation Industries, 2019, 45(20):202-208.
[18] MUNSTER L, VICHA J, KLOFAC J, et al.Stability and aging of solubilized dialdehyde cellulose[J].Cellulose, 2017, 24(7):2 753-2 766.
[19] YANG H, CHEN D Z, VAN DE VEN T G M.Preparation and characterization of sterically stabilized nanocrystalline cellulose obtained by periodate oxidation of cellulose fibers[J].Cellulose, 2015, 22(3):1 743-1 752.
[20] MADIVOLI E S, KARERU P G, GACHANJA A N, et al.Synthesis and characterization of dialdehyde cellulose nanofibers from O.sativa husks[J].SN Applied Sciences, 2019, 1(7):723.
[21] DAI H J, OU S Y, HUANG Y, et al.Utilization of pineapple peel for production of nanocellulose and film application[J].Cellulose, 2018, 25(3):1 743-1 756.
[22] KWAK H W, LEE H, PARK S, et al.Chemical and physical reinforcement of hydrophilic gelatin film with di-aldehyde nanocellulose[J].International Journal of Biological Macromolecules, 2020, 146:332-342.
[23] WU X, LI X Y, YANG L K, et al.Stability enhanced Pickering emulsions based on gelatin and dialdehyde starch nanoparticles as simple strategy for structuring liquid oils[J].Food and Bioprocess Technology, 2021, 14(2):1 600-1 610.
[24] DU LE H, LOVEDAY S M, SINGH H, et al.Pickering emulsions stabilised by hydrophobically modified cellulose nanocrystals:Responsiveness to pH and ionic strength[J].Food Hydrocolloids, 2020, 99:105344.
[25] DING M Z, ZHANG T, ZHANG H, et al.Gelatin-stabilized traditional emulsions:Emulsion forms, droplets, and storage stability[J].Food Science and Human Wellness, 2020, 9(4):320-327.
[26] LIU L L, HU Z, SUI X F, et al.Effect of counterion choice on the stability of cellulose nanocrystal Pickering emulsions[J].Industrial & Engineering Chemistry Research, 2018, 57(21):7 169-7 180.