茉莉酸(3-氧-2-2′-顺-戊烯基-环戊烷-1-乙酸),及其衍生物统称为茉莉素,茉莉素于第16届国际植物生长会议被接受为一类新的植物激素[1],属于一类重要的脂质激素,在植物生物合成、代谢、信号转导和响应生物和非生物胁迫中发挥着重要作用[2]。茉莉素早期从素馨花的香精油中发现,被大量用在香水工业;之后人们在植物病原真菌的培养滤液中提取到茉莉酸,发现其对植物生长有调节作用。茉莉素在农业及医药行业中有广阔应用前景[3-4],目前植物提取法和化学合成法制备茉莉酸都具有一定的局限性,难以满足全球对茉莉酸类化合物的需求,因此微生物发酵产茉莉酸受到研究者的关注。
早在1968年有报道可可毛色二孢菌Lasiodiplodia theobromae S22L静态培养13 d,产约500 mg/L茉莉酸[5]。之后通过筛选新菌株、优化发酵条件,L.theobromae 715静态发酵产茉莉酸可达到1 200 mg/L[6];分离于向日葵的L.theobromae 2334静态发酵12 d可产1 250 mg/L茉莉酸[7]。然而Diplodia gossypina ATCC 10936在130 L发酵罐搅拌转速150 r/min的条件下,茉莉酸产量只有146 mg/L[8]。静态条件更有利于茉莉酸的生成,茉莉酸产量随搅拌速率升高而降低[9-10],这使得规模化发酵存在困难。目前茉莉酸的合成机制研究多集中于植物,对于真菌合成茉莉酸的研究较少。我们前期筛选到1株产茉莉酸的L.iranensis CCTCC M2017288[11],本文通过比较菌株在静态和振荡2种培养条件下发酵的差异,基于非靶向代谢组学,阐释发酵条件对菌株合成茉莉酸的影响,为真菌茉莉酸合成代谢机制、及优化真菌发酵产茉莉酸工艺的研究提供参考。
1 材料与方法
1.1 菌株与培养基
伊朗毛色二孢菌(L.iranensis CCTCC M2017288),分离于腐烂的玉蕊根,保藏于本实验室。培养基同文献[11]。
1.2 试剂与仪器
茉莉酸标准品,一飞生物科技有限公司;其他试剂均购自国药试剂有限公司。
SW-CJ-1FD超净工作台,苏州安泰空气技术有限公司;PHS-3E自动pH计,上海仪电科学仪器股份有限公司;HYL-C恒温摇床,太仓市强乐实验设备有限公司;SPX-150-B恒温生化培养箱,上海博泰实验设备有限公司;S-10生物传感器分析仪,深圳西尔曼科技有限公司;Waters2487高效液相色谱仪,美国waters公司;UHPLC-Q Exactive HF-X超高效液相色谱串联傅里叶变换质谱仪,美国赛默飞世尔科技有限公司。
1.3 培养方法
种子液制备:用接种铲取1铲(约1 cm3)PDA斜面培养基上培养7 d的新鲜菌种接种至PDB培养基中,置摇床220 r/min、28 ℃培养48 h得到种子液,种子液按5%(体积分数)接种到发酵培养基中。
静态培养:将装有75 mL发酵培养基的250 mL锥形瓶置于28 ℃恒温生化培养箱,静态发酵9 d。分别于发酵第3、5、7、9天取样用以参数分析。
振荡培养:将装有75 mL发酵培养基的250 mL锥形瓶置于28 ℃恒温摇床,摇床转速为120 r/min,振荡发酵9 d。取样同上。
1.4 分析方法
发酵液参数分析:茉莉酸定量方法同文献[12];采用干重法测定每个锥形瓶中生物量;分别用生物传感器分析仪和间苯二酚分光光度法测定发酵液中葡萄糖和果糖浓度;用pH计测定发酵液pH。
UPLC-MS/MS分析,仪器设置方法同文献[13-14]。
1.5 数据处理
采用单因素方差分析(ANOVA;P<0.05)和t检验评估实验中的统计学差异。利用OriginPro 2021绘制点线图。原始质谱数据导入代谢组学处理软件ProgenesisQI(WatersCorporation, Milford, USA)进行基线过滤、峰识别、积分等处理,其后采用该软件进行特征峰搜库鉴定,将MS和MS/MS质谱信息与代谢数据库进行匹配,MS质量误差设置为<10-6,同时根据二级质谱匹配得分鉴定代谢物。正交偏最小二乘判别分析(orthogonal partial least-squares discrimination analysis, OPLS-DA)、聚类分析及热图绘制均借助R语言完成[15]。
2 结果与分析
2.1 静态与振荡培养对L.iranensis发酵产茉莉酸的影响
在发酵过程中,观察到2种条件下菌体外形差异显著。静态培养条件下,L.iranensis于发酵第3天在发酵液表面形成一层白色的菌膜;随后,菌膜增长至一定厚度后基本不再变化,内部颜色向黄褐色转变。振荡培养条件下,菌体呈现出白色、团状(图1)。跟踪测定2种培养条件下的发酵参数,发现发酵液茉莉酸浓度差异显著(图2-a):静态条件下,茉莉酸浓度于第3~5天快速升高,随后缓慢升高至800.91 mg/L,7 d后开始少量减小;而振荡条件下茉莉酸浓度缓慢升高,发酵9 d仅152.09 mg/L。振荡条件下,菌体生物量的增长快于静态,发酵3 d达到10.00 g/L,而静态培养仅为5.13 g/L。培养5 d后,两者的差距减少但前者始终大于后者(图2-b)。振荡培养的糖消耗速率更快,培养3 d总糖几乎被耗尽,而静态培养7 d总糖才被耗尽(图2-c)。两者的发酵液pH变化也不同,初始pH相同为5.48,培养3 d后振荡培养的pH在6.50上下波动,而静态培养中pH逐渐从5.37 升高至7.96(图2-d)。这些参数变化的差异说明菌株在2种培养条件下的代谢特征不同。
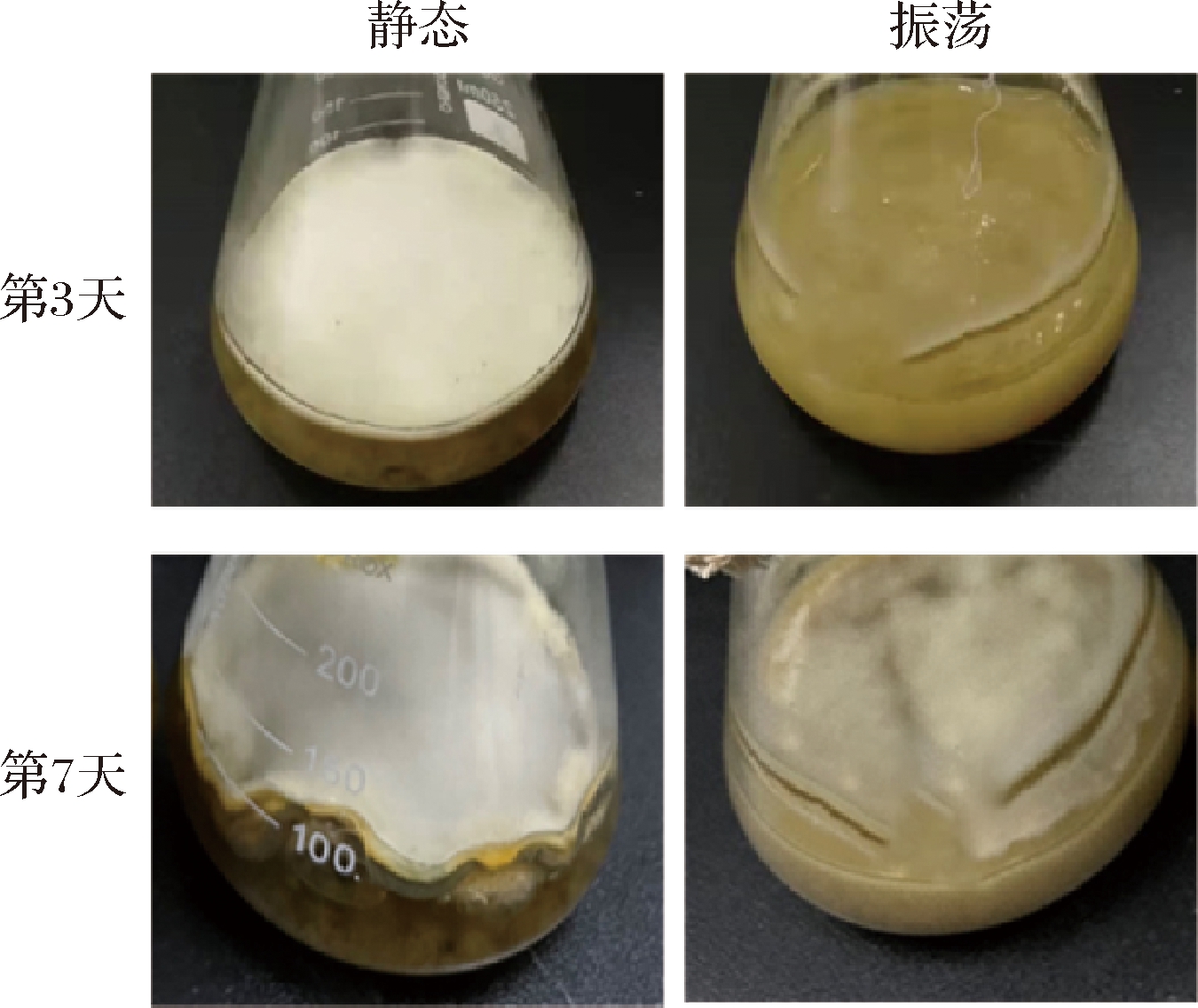
图1 L.iranensis在静态与振荡培养下的外观差异
Fig.1 The appearance difference of L.iranensis under static and shaking culture
L.iranensis在振荡条件下茉莉酸产量远低于静态条件,这一现象与DHANDHUKIA等[9]和ENG等[10]的报道一致。静态环境更有利于某些真菌的代谢活性物质合成,这种现象在灵芝Ganoderma lucidum中也存在。如G.lucicum CGMCC5.616在液体静态培养下单体灵芝酸的含量是振荡培养下的6~25倍[16];液体浅层静态培养G.lucidum CGMCC5.26产灵芝三萜的产量是摇瓶培养的2.10倍[17]。为解析静态条件下目标化合物的高产机制,组学技术是常用的手段。
2.2 差异代谢物的筛选与分析
采用非靶向代谢组学手段,鉴定两者发酵过程中4个时间点(3、5、7、9 d)发酵液中代谢物并分析其变化规律。共检测到1 484个代谢物,为了实现高水平的组间分离和鉴别出引入差异的代谢物,对2种条件下代谢物进行了有监督的OPLS-DA。得到的R2Y和Q2Y分别是0.997和0.862,表明模型拟合度良好。进一步采用置换检验来验证模型的预测能力和鲁棒性,经过200次排列,得到的R2和Q2值分别是0.71和-0.20(图3-a),模型的Q2为-0.20表明模型可靠。根据t检验得到的P值、OPLS-DA模型计算出的变量重要性投影(variable importance in the projection,VIP)值和代谢物浓度倍数值(fold change,FC)(代谢物静态条件下相对浓度/振荡条件下相对浓度,4个时间点平均值),绘制火山图以展示代谢物丰度差异(图3-b)。
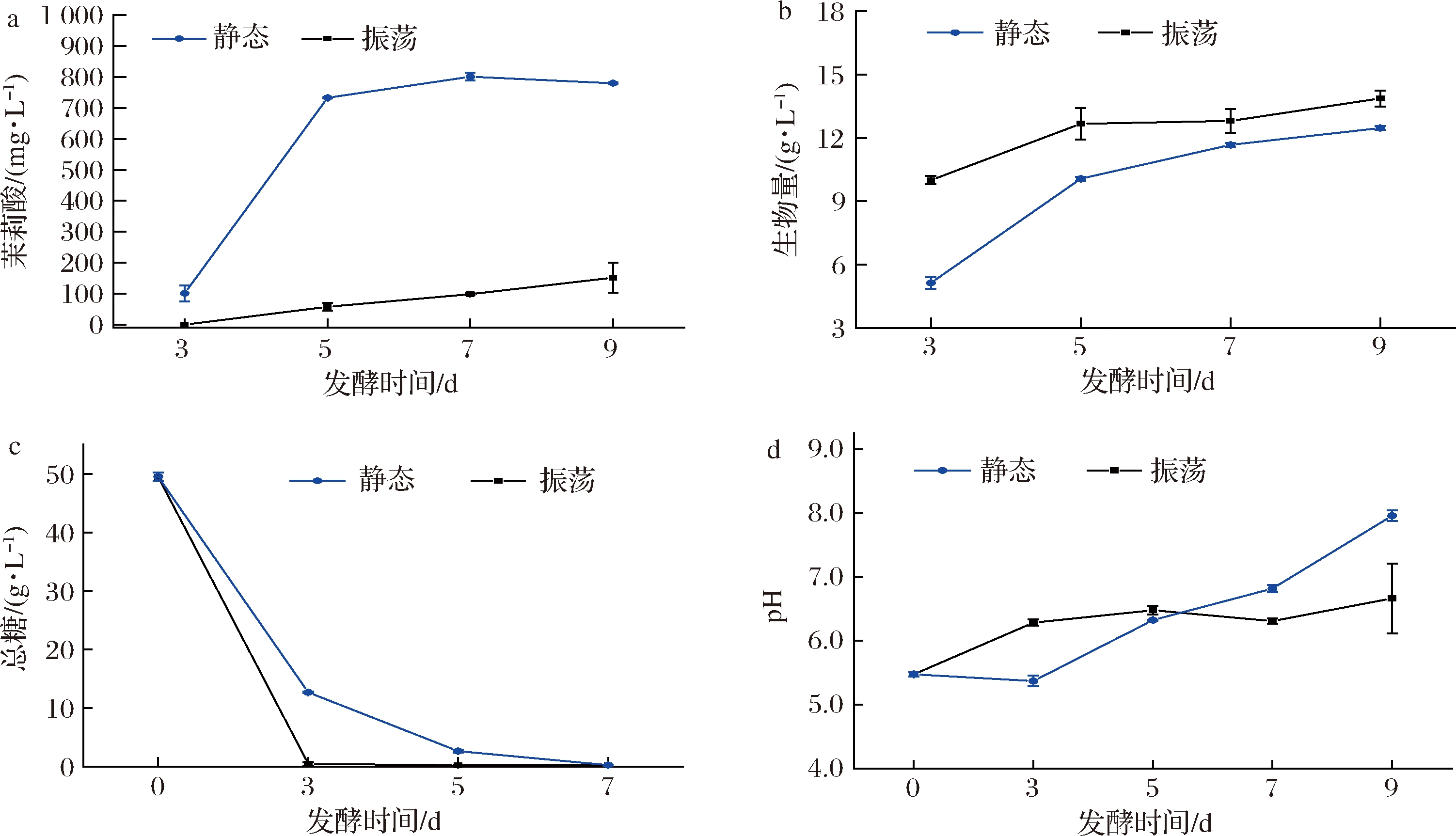
a-茉莉酸质量浓度;b-生物量;c-总糖;d-发酵液pH
图2 静态和振荡条件下的发酵曲线
Fig.2 Fermentation curve under static and shaking culture
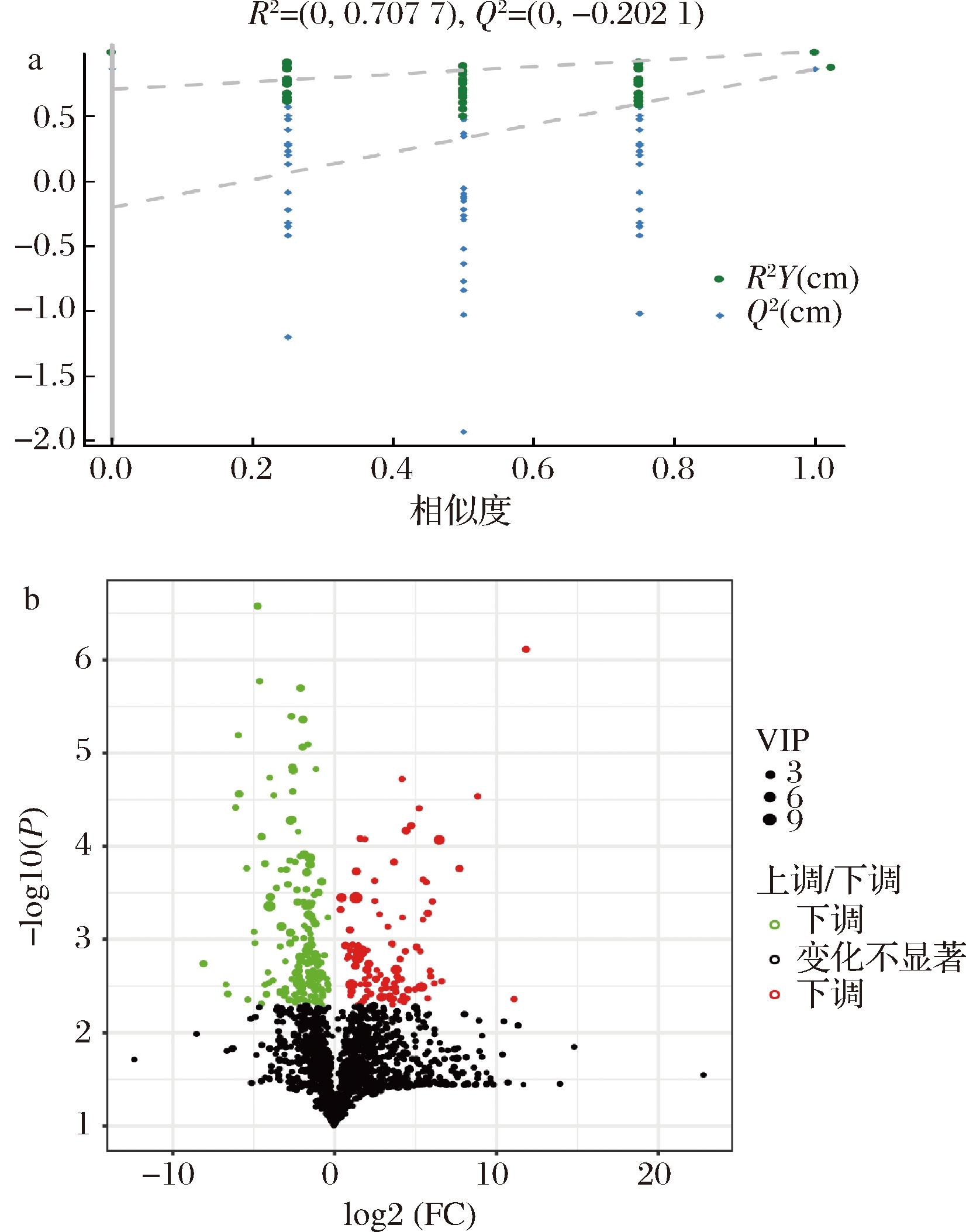
a-置换检验;b-代谢物的丰度差异火山图
图3 静态和振荡条件下代谢物的多元统计分析
Fig.3 Multivariate statistical analysis of metabolites under static and shaking culture
采用普遍接受的标准即VIP>1和P<0.05[18-19],筛选出2种发酵条件下的共77个差异代谢物。取代谢物丰度log转化值并绘制差异代谢物聚类热图(图4),可以直观地看出各差异代谢物相对浓度随发酵时间变化趋势。
聚类分析将差异代谢物表达模式细分为5小类(聚类树左侧颜色),可概括为两大类。其中一类是静态条件相较于振荡条件下调,即代谢物相对浓度前者低于后者,共有48个代谢物。这48个下调代谢物中,20个富集到了KEGG代谢途径,如表1所示。下调差异代谢物数量最多的代谢途径是氨基酸代谢,其次是核苷酸代谢。其中半乳糖醇、2-(4-羟基苯基)乙醇、S-腺苷-L-高半胱氨酸、甲基丙二酸、鸟苷、腺嘌呤、胆碱甘油磷酸、L-色氨酸、(3S,4R,5S,6S)-6-甲氧烷-2,3,4,5-醇、L-酪氨酸、苯乙烯、亚精胺、L-苯丙氨酸和4-(2-氨基苯基)-2,4-二氧代丁酸下调较显著。另一类上调共29个代谢物是静态条件下相对浓度更高,有6个富集到了KEGG代谢途径,如表2所示。其中茉莉酸、N-乙酰-D-半乳糖胺上调显著。
在振荡条件下,菌体氨基酸代谢非常活跃,并且嘌呤类物质浓度更高。氨基酸代谢在细胞内的代谢流向主要是两个方面,一是合成机体自身所需的蛋白质、多肽及其他含氮物质,二是分解成α-酮酸、胺类及二氧化碳。α-酮酸可以转变成糖、脂类或再合成某些非必需氨基酸,也可以经过三羧酸循环氧化释放能量。菌体生长繁殖及维持代谢活动离不开蛋白质和能量,嘌呤类物质是遗传物质的组成成分。振荡条件下,菌体摄取的营养物质更多地流向这些初级代谢途径,这可能影响茉莉酸合成前体物质的积累,造成流向茉莉酸合成这一次级代谢途径[7]的通量减少。
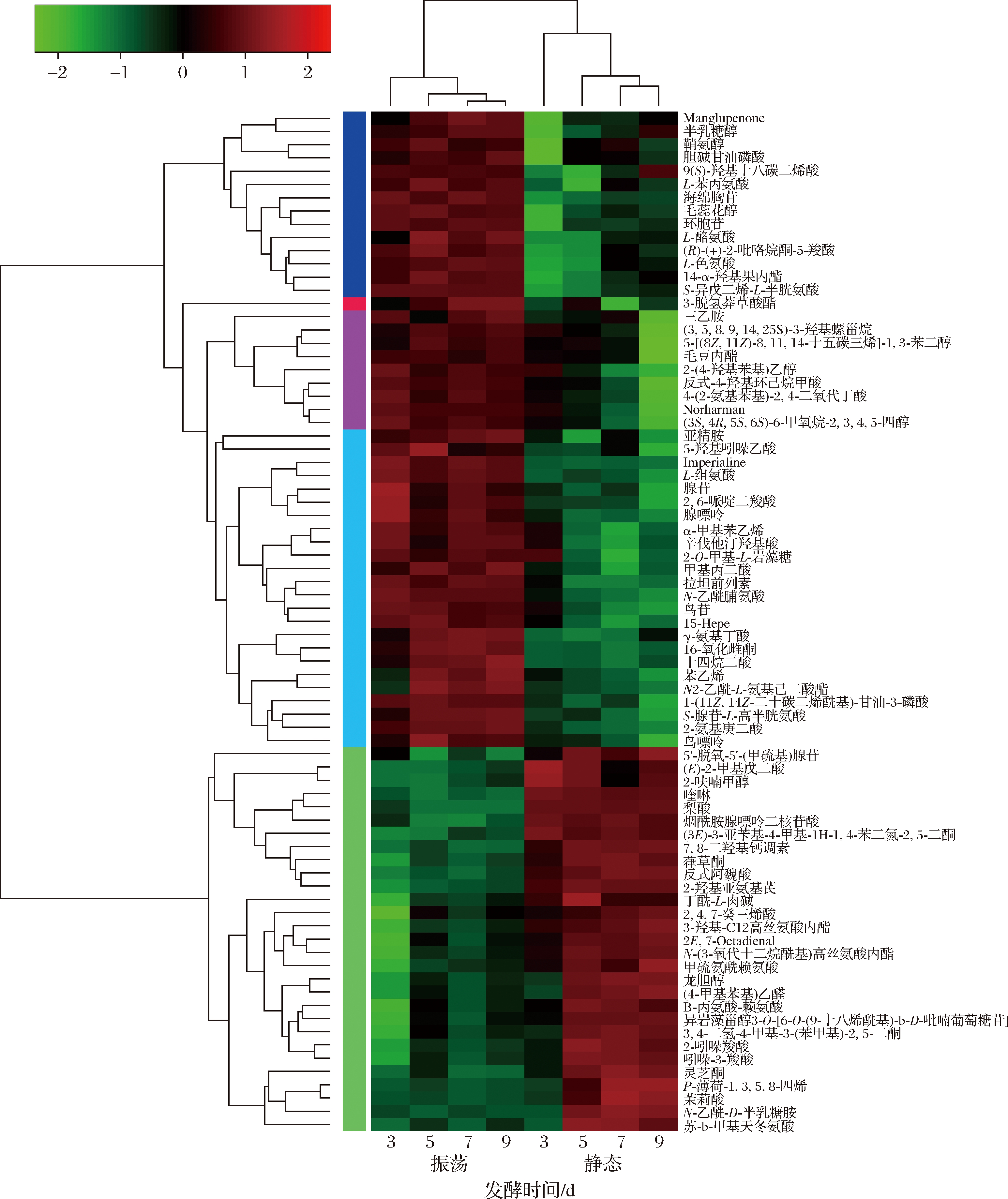
图4 差异代谢物相对浓度变化热图
Fig.4 Heatmap of change in the relative concentration of differential metabolites
2.3 脂质代谢途径的差异
差异代谢物中共有2个化合物匹配到脂质代谢途径,分别是9(S)-羟基十八碳二烯酸和茉莉酸。通过KEGG富集分析,9(S)-羟基十八碳二烯酸属于亚油酸代谢途径(Ko00591),而茉莉酸属于α-亚麻酸代谢途径(Ko00592)。对这2条代谢途径中检测到的所有化合物进行时间维度上的比较,用不同颜色表示代谢物静态条件与振荡条件下丰度的比值,如图5所示。在2种培养条件下,菌体亚油酸代谢和α-亚麻酸代谢存在明显差异。在α-亚麻酸代谢中,静态条件下茉莉酸相对含量高,而代谢支路3-己烯醇和愈伤酸含量相对低。而亚油酸代谢中,静态条件下9(S)-羟基十八碳二烯酸、13(S)-氢过氧十八碳二烯酸和9,10,13-三羟基十八碳烯酸的相对含量总体偏低。
在植物中α-亚麻酸经脂氧合酶催化转变为13-氢过氧亚麻酸[13(S)-hydroperoxyoctadec-atrienoic acid,13-HPOT],13-HPOT经丙二烯氧化物合成酶(allene oxide synthase,AOS)和丙二烯氧化物环化酶(allene oxide cyclase,AOC)两步反应变为12-氧-植物二烯酸(12-oxo-phytodienoic acid,OPDA),OPDA经一次还原反应和三轮β-氧化转变为茉莉酸[20]。
表1 下调差异代谢物的具体信息
Table 1 Specific information of down-regulated differential metabolites
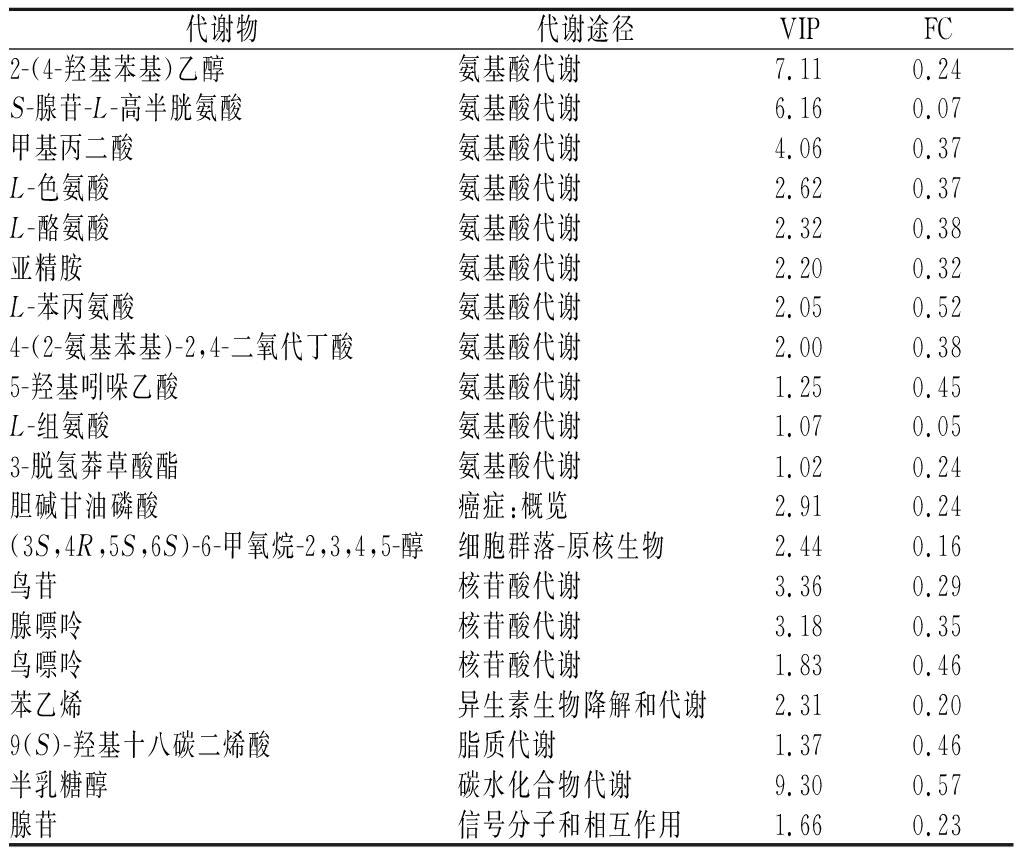
代谢物代谢途径VIPFC2-(4-羟基苯基)乙醇氨基酸代谢7.110.24S-腺苷-L-高半胱氨酸氨基酸代谢6.160.07甲基丙二酸氨基酸代谢4.060.37L-色氨酸氨基酸代谢2.620.37L-酪氨酸氨基酸代谢2.320.38亚精胺氨基酸代谢2.200.32L-苯丙氨酸氨基酸代谢2.050.524-(2-氨基苯基)-2,4-二氧代丁酸氨基酸代谢2.000.385-羟基吲哚乙酸氨基酸代谢1.250.45L-组氨酸氨基酸代谢1.070.053-脱氢莽草酸酯氨基酸代谢1.020.24胆碱甘油磷酸癌症:概览2.910.24(3S,4R,5S,6S)-6-甲氧烷-2,3,4,5-醇细胞群落-原核生物2.440.16鸟苷核苷酸代谢3.360.29腺嘌呤核苷酸代谢3.180.35鸟嘌呤核苷酸代谢1.830.46苯乙烯异生素生物降解和代谢2.310.209(S)-羟基十八碳二烯酸脂质代谢1.370.46半乳糖醇碳水化合物代谢9.300.57腺苷信号分子和相互作用1.660.23
表2 上调差异代谢物的具体信息
Table 2 Specific information of up-regulated differential metabolites

代谢物代谢途径VIPFC5'-脱氧-5'-(甲硫基)腺苷氨基酸代谢1.832.92反式阿魏酸其他次级代谢物的生物合成1.1213.27茉莉酸脂质代谢6.152.23N-乙酰-D-半乳糖胺碳水化合物代谢4.8743.942-羟基亚氨基芪异生素生物降解和代谢1.3027.822-呋喃甲醇异生素生物降解和代谢1.041.35
我们在真菌发酵液中检测到同属于该代谢途径的愈伤酸和3-己烯醇。根据图5-b,愈伤酸、3-己烯醇与茉莉酸竞争前体13-HPOT,是茉莉酸合成的副产物。相较于振荡条件,静态条件下流向茉莉酸的通量在发酵周期内占据优势,流向愈伤酸和3-己烯醇的通量在发酵后期处于劣势。

a-亚油酸代谢途径;b-α-亚麻酸代谢途径
图5 脂质代谢途径局部图
Fig.5 Partial diagram of lipid metabolism
3 结论
本研究通过静态与振荡条件下的发酵实验,比较了L.iranensis产茉莉酸过程参数以及代谢谱的差异。通过对发酵参数追踪分析,发现振荡环境显著改变了L.iranensis的代谢特征,且振荡环境不利于茉莉酸的产生。代谢组学分析共鉴定出77个差异代谢物,其中48个下调,29个上调。振荡条件下,菌体摄取的营养物质更多地流向氨基酸代谢和核苷酸代谢,而流向茉莉酸合成的通量相对减少,且茉莉酸合成中间体还被愈伤酸、3-己烯醇支路竞争,这可能是其茉莉酸产量低的原因。控制发酵过程菌体的生长,减少代谢支路通量,可能是提高真菌在振荡条件下茉莉酸产量的有效策略。
[1] 白玉, 杜甫佑, 刘虎威.植物激素检测技术研究进展[J].生命科学, 2010, 22(1):36-44.
BAI Y, DU F Y, LIU H W.Recent development in determination of plant hormones[J].Chinese Bulletin of Life Sciences, 2010, 22(1):36-44.
[2] 黎家, 李传友.新中国成立70年来植物激素研究进展[J].中国科学(生命科学), 2019, 49(10):1 227-1 281.
LI J, LI C Y.Seventy-year major research progress in plant hormones by Chinese scholars[J].Science in China(Series C), 2019, 49(10):1 227-1 281.
[3] TONG Q S, JIANG G S, ZHENG L D, et al.Methyl jasmonate downregulates expression of proliferating cell nuclear antigen and induces apoptosis in human neuroblastoma cell lines[J].Anti-Cancer Drugs, 2008, 19(6):573-581.
[4] GHASEMI P A, SAJJADI S E, PARANG K.A review (research and patents) on jasmonic acid and its derivatives[J].Archiv Der Pharmazie, 2014, 347(4):229-239.
[5] BODEN R, FUJIOKA F, HANNA M.Preparation of jasmonic acid: 1286266[P].1968-10-22.
[6] ALTUNA B, KLIBANSKY M, ALMEIDA G, et al.Jasmonic acid detection as a new plant growth regulator in strains of Botryodiplodia theobromae[J].Revista Sobre los Derivados de la Cana de Azucar, 1996, 30:16-21.
[7] ENG F, HAROTH S, FEUSSNER K, et al.Optimized jasmonic acid production by Lasiodiplodia theobromae reveals formation of valuable plant secondary metabolites[J].PLoS One, 2016, 11(12):e0167627.
[8] FARBOOD M I, BLOCKER R W, MCLEAN L B, et al.Bioprocess for the high-yield production of food flavor-acceptable jasmonic acid and methyl jasmonate:US6333180B1[P].2001-12-25.
[9] DHANDHUKIA P C, THAKKAR V R.Standardization of growth and fermentation criteria of Lasiodiplodia theobromae for production of jasmonic acid[J].African Journal of Biotechnology, 2010, 6(6):707-712.
[10] ENG F, GUTIéRREZ R M, FAVELA T E.Culture conditions for jasmonic acid and biomass production by Botryodiplodia theobromae in submerged fermentation[J].Process Biochemistry, 1998, 33(7):715-720.
[11] 董文华, 郑璞, 陈鹏程, 等.一株毛色二孢菌发酵产茉莉酸[J].食品与发酵工业, 2018, 44(3):22-29.
DONG W H, ZHENG P, CHEN P C, et al.Production of jasmonic acid by a strain Lasiodiplodia iranensis[J].Food and Fermentation Industries, 2018, 44(3):22-29.
[12] 董文华. Lasiodiplodia iranensis发酵产茉莉酸的研究[D].无锡:江南大学, 2018.
DONG W H.Study on fermentative production of jasmonic acid produced by Lasiodiplodia iranensis[D].Wuxi:Jiangnan University, 2018.
[13] ZOU W, SHE J, TOLSTIKOV V.A comprehensive workflow of mass spectrometry-based untargeted metabolomics in cancer metabolic biomarker discovery using human plasma and urine[J].Metabolites, 2013, 3(3):787-819.
[14] WANG Y, LIU F, LI P, et al.An improved pseudotargeted metabolomics approach using multiple ion monitoring with time-staggered ion lists based on ultra-high performance liquid chromatography/quadrupole time-of-flight mass spectrometry[J].Analytica Chimica Acta, 2016, 927:82-88.
[15] CHONG J, XIA J.MetaboAnalystR:An R package for flexible and reproducible analysis of metabolomics data[J].Bioinformatics, 2018, 34(24):4 313-4 314.
[16] 徐军伟. 灵芝细胞在液体静置培养和振荡培养中单体灵芝酸的生产及差异表达基因的鉴定[D].上海:华东理工大学, 2009.
XU J W.Production of individual ganoderic acids and identification of differentially expressed genes in liquid static and shaking cultures of Ganoderma lucidum[D].Shanghai:East China University of Science and Technology, 2009.
[17] 王琼. 基于组学技术的灵芝三萜和多糖高产机制解析[D].无锡:江南大学, 2020.
WANG Q.Analysis of triterpenoid and polysaccharide high yield mechanism in Ganoderma lucidum based on omics technology[D].Wuxi:Jiangnan University, 2020.
[18] MA C, LI X, ZHENG C, et al.Comparison of characteristic components in tea-leaves fermented by Aspergillus pallidofulvus PT-3, Aspergillus sesamicola PT-4 and Penicillium manginii PT-5 using LC-MS metabolomics and HPLC analysis[J].Food Chemistry, 2021, 350:129228.
[19] SUN X D, LYU G Z, LUAN Y S, et al.Metabolomic study of the soybean pastes fermented by the single species Penicillium glabrum GQ1-3 and Aspergillus oryzae HGPA20[J].Food Chemistry, 2019, 295:622-629.
[20] SCHALLER A, STINTZI A.Enzymes in jasmonate biosynthesis-structure, function, regulation[J].Phytochemistry, 2009, 70(13-14):1 532-1 538.