水产品富含蛋白质、不饱和脂肪酸和多种人体必需的微量元素,深受大众的喜爱。水产品中重金属残留超标事件频频发生。2021年,国家及各省市市场监管局的抽检数据显示,在包括北京、上海、深圳在内的绝大多数省市均出现食品中重金属离子超标的现象,涉及多个大型生鲜购买平台,最高超标可达8倍。由于重金属具有生物蓄积性[1],会通过食物链直接或间接地进入人体内,从而对人体造成严重伤害[2]。其中,重金属Cd(Ⅱ)是水产品中极为典型的重金属污染物之一,检出率高,毒性强,即使在很低的暴露浓度下也会对人体肝脏、肾脏等造成损伤[3]。因此,实现水产品中镉的快速检测十分迫切。
由于食品基质的复杂性,食品中重金属离子的前处理技术在其快速检测中起着关键性作用,但前处理方法在目前的研究中很容易被弱化[4-5]。目前,食品中重金属的前处理方法主要有湿法消解、微波消解、压力罐消解等[6-9]。这几种前处理方法所需时间最长可达12 h,并且需要用到高浓度的酸,对环境污染极为严重,且与食品安全速测方法的兼容性极差,无法满足快检需求。因此建立水产品中重金属离子快速、高效且绿色的前处理方法十分必要。
研究表明,超声辅助酶提取法可通过酶解作用,破环重金属与食品组分的结合,同时利用超声波的空化效应、机械效应和热效应,促进酶作用酶解底物,实现酶解的加速[10-11],进而大大缩短提取时间,是一种绿色高效的前处理方法。YILMAZ等[12],CHENG等[13],QIN等[14]基于双频超声波装置辅助酶解的方式实现了对青葱中的痕量锰,草药样品中的砷,大米样品中镉的有效提取。BERMEJO-BARRERA等[15]和PE A-FARFAL等[16]使用双频超声辅助酶解法提取了贻贝样品中的多种重金属元素。但由于水产样品基质较为复杂,目前报道的双频超声辅助酶解通常只针对特定水产品(如贻贝)进行,不具有普适性,更换水产样品后,其提取方法可能无法实现对重金属离子的有效提取。因此建立水产品及制品中重金属离子的普适提取方法十分必要。
A-FARFAL等[16]使用双频超声辅助酶解法提取了贻贝样品中的多种重金属元素。但由于水产样品基质较为复杂,目前报道的双频超声辅助酶解通常只针对特定水产品(如贻贝)进行,不具有普适性,更换水产样品后,其提取方法可能无法实现对重金属离子的有效提取。因此建立水产品及制品中重金属离子的普适提取方法十分必要。
本研究在建立了牡蛎中重金属Cd(Ⅱ)双频超声辅助酶解方法的基础上,仅通过对超声功率的优化,建立了具有一定普适性的水产品中重金属Cd(Ⅱ)提取方法,可实现对蟹肉、鱿鱼、带鱼、皮皮虾和虾滑等常见水产品及其制品中重金属Cd(Ⅱ)的提取,以期为多种水产品中重金属Cd(Ⅱ)的提取分析提供一种绿色高效的提取测定方法。
1 材料与方法
1.1 材料与试剂
牡蛎标准物质(GBW10025),北京伟业计量技术研究院(中国北京);镉标液,国家钢铁材料测试中心钢铁研究总院;风味蛋白酶,中国庞博生物工程有限公司;胰蛋白酶、吗啉乙磺酸一水合物(2-morpholinoethanesulfonic acid monohydrate,MES)、磷酸二氢铵,上海麦克林生化科技有限公司;带鱼、鱿鱼丝、蟹肉、皮皮虾、虾滑,上海海鲜市场。
1.2 仪器与设备
SavantAA型原子吸收光谱仪(atomic absorption spectrometer,AAs),澳大利亚GBC科学仪器公司;MARS6型高通量密闭微波消解仪,美国CEM公司;JY92-IIDN型超声细胞粉碎仪,宁波山达生物科技有限公司;L18-Y68S型九阳真空破壁机,九阳股份有限公司;KQ-700DE型数控超声波清洗机,昆山市超声仪器有限公司。AAs的工作条件见表1。
表1 AAs工作条件
Table 1 Operating conditions of AAs
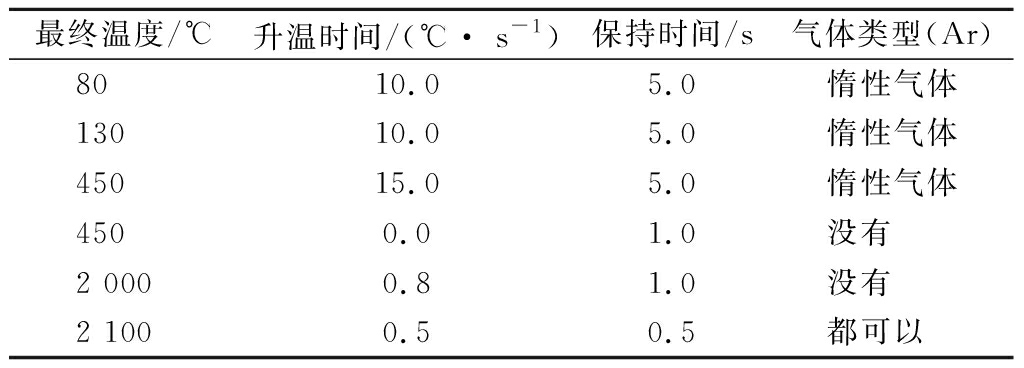
最终温度/℃升温时间/(℃· s-1)保持时间/s气体类型(Ar)8010.05.0惰性气体13010.05.0惰性气体45015.05.0惰性气体4500.01.0没有 2 0000.81.0没有 2 1000.50.5都可以
1.3 实验方法
1.3.1 样品前处理
实验中所使用的水产品原材料均通过真空破壁机粉碎后过80目筛,保存待用。
1.3.2 双频超声辅助酶解提取法
双频超声辅助酶解提取水产品中重金属Cd(Ⅱ)方法如下:称取0.6 g样品粉末或匀浆于10 mL离心管中,加入缓冲溶液,再加入适量的风味蛋白酶(5.5×104 U/g)和胰蛋白酶(1.7×105 U/g),涡旋振荡30 s使其混合均匀,然后于37 ℃的超声仪中水浴超声6 min,在12 000 r/min的条件下离心10 min,取其上清液,用孔径为0.45 μm的水系混合滤膜进行过滤。再用1%HNO3溶液进行倍数稀释,并进行空白实验,所有实验进行3次重复。
为验证本方法的可靠性,同时采用国标法规定的水产品及其制品中重金属Cd(Ⅱ)的提取方法进行对照,方法如下:称取0.6 g水产品样品于消解管中,向其中加入适量的HNO3,参考GB 5009.15—2014《食品安全国家标准 食品中镉的测定》中第一法的微波消解法进行消解,并进行空白实验,实验一式三份。其中重金属Cd(Ⅱ)提取率计算如公式(1)~公式(4)所示:
(1)
T2=w1×稀释倍数
(2)
(3)
T3=w2×稀释倍数
(4)
式中:Q1,酶解法重金属Cd(Ⅱ)提取率,%;T2,酶解上清液中重金属Cd(Ⅱ)总含量,mg/kg;T1,水产品中重金属Cd(Ⅱ)总含量,mg/kg;w1,样品超声酶解后AAs测得上清稀释液重金属Cd(Ⅱ)含量,mg/kg;Q2,微波消解法重金属Cd(Ⅱ)提取率,%;T3,样品微波消解法测得重金属Cd(Ⅱ)总含量,mg/kg;w2,样品微波消解后石墨炉原子吸收光谱仪测得上清稀释液重金属Cd(Ⅱ)含量,mg/kg。
1.3.3 石墨炉原子吸收光谱法测定Cd(Ⅱ)
采用石墨炉原子吸收光谱法通过自动进样器(PAL3000)将10 μL样品和4 μL基体改进剂(10 g/L NH4H2PO4)注入石墨管中,以进行分析。使用镉空心阴极灯作为Cd(Ⅱ)测定时的辐射源,其灯电流为3.0 mA,波长为283.3 nm,狭缝宽度为0.5 nm,氩气输出压力为0.30 MPa左右。
2 结果与分析
2.1 实验条件优化
本研究采用双频超声辅助酶解法提取水产品及其制品中的重金属Cd(Ⅱ)。由于缓冲溶液的种类、蛋白酶酶量、pH值、料液比和超声条件对重金属Cd(Ⅱ)的提取会产生不同的影响,所以实验研究了样品在不同提取条件下的提取效率,并使用传统的微波消解法作为对照,从而确定出了重金属Cd(Ⅱ)提取的最佳条件。
2.1.1 超声模式优化
超声波可基于空化效应显著加快酶解过程,因此首先研究了超声模式对水产品及其制品中重金属Cd(Ⅱ)提取率的影响。结果如图1所示,在单独使用超声探头、单独使用超声水浴以及联合使用超声探头和超声水浴(双频超声)3种模式下,使用双频超声模式时,重金属Cd(Ⅱ)的提取率最高可达82.63%。表明双频超声模式最适合用于牡蛎样品中重金属Cd(Ⅱ)的有效提取。这可能是由于双频超声要比单频超声具有更宽的频率范围,因此可以拥有更好的空化效果,这种空化效果可能促进了超声能量传输,破坏了细胞结构促进更多的重金属Cd(Ⅱ)释放到溶液中[17]。
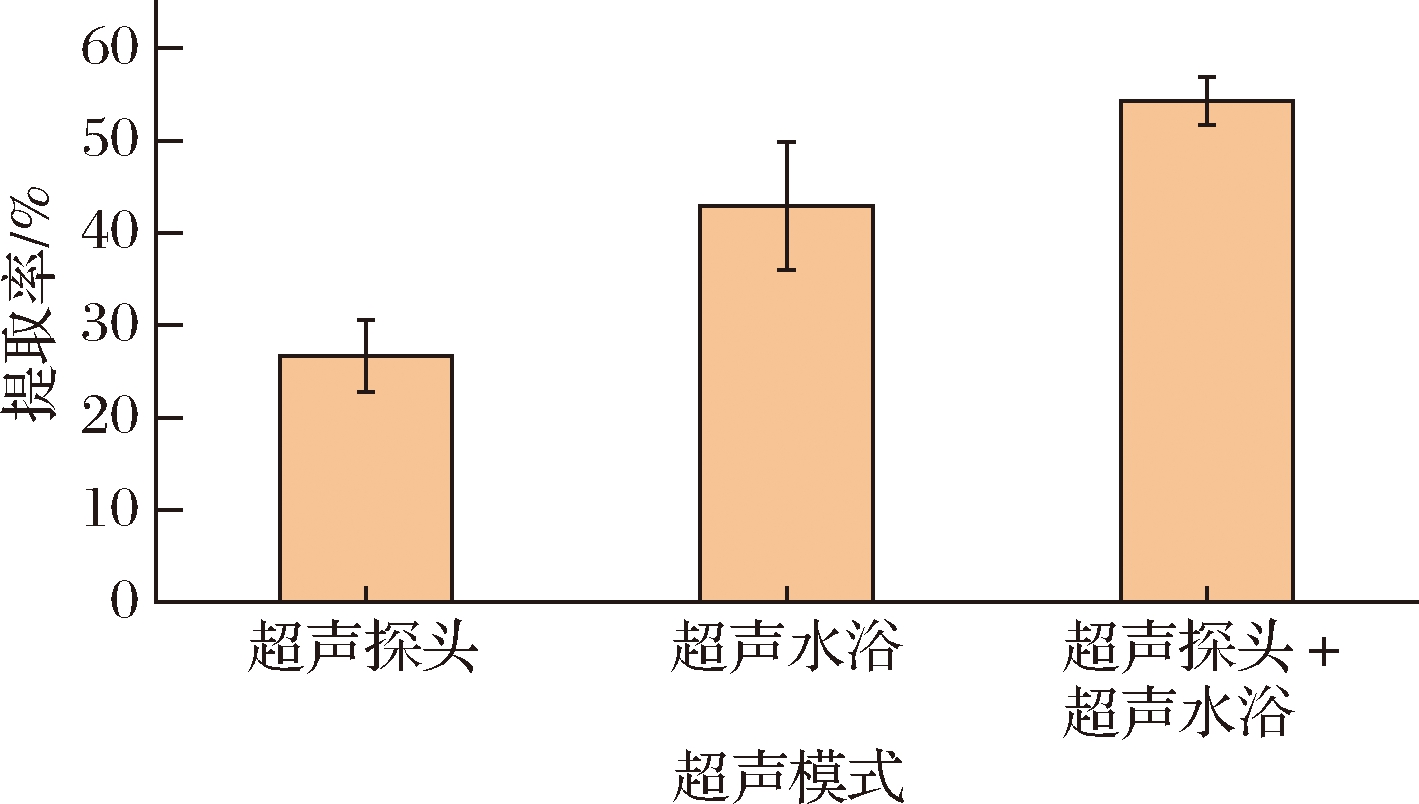
图1 超声模式对牡蛎中Cd(Ⅱ)提取率的影响
Fig.1 Influence of ultrasonic mode on oncadmium(Ⅱ) extraction rate from oyster
2.1.2 缓冲溶液种类优化
缓冲溶液具有维持溶液体系pH值相对稳定的性能,使得pH值在一定的范围内不因稀释或外加少量的酸或碱而发生显著变化,这对于酶活性的发挥具有重要作用。本研究对PB、HEPES、MES、Tris 4种缓冲溶液进行筛选,结果如图2所示,在其他实验条件保持固定的情况下,与其他3种缓冲溶液相比,使用Tris缓冲作为本研究的缓冲溶液时,牡蛎中重金属Cd(Ⅱ)的提取率可以达到65.13%,具有最佳提取效果。
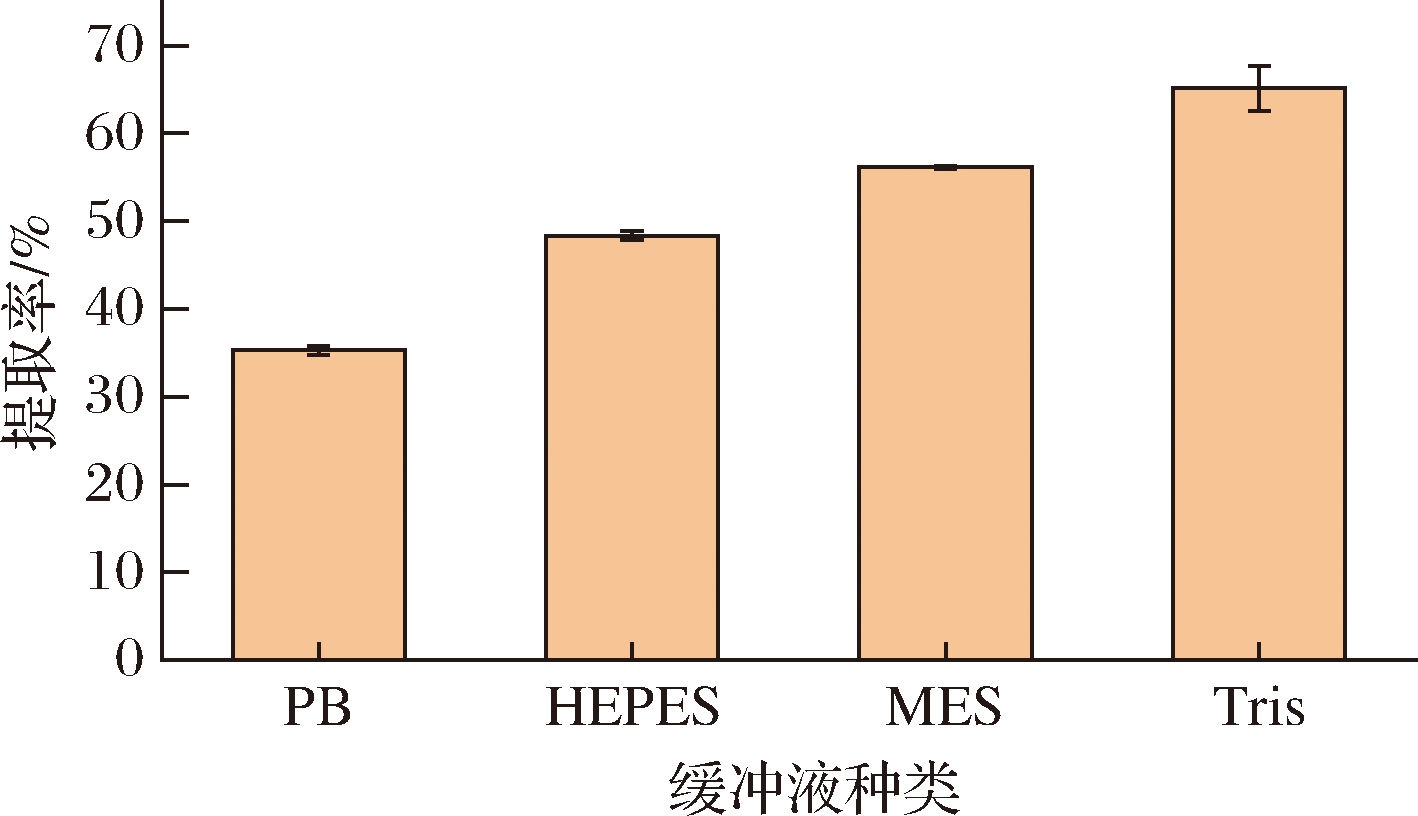
图2 缓冲溶液种类对牡蛎中Cd(Ⅱ)提取率的影响
Fig.2 Influence of buffer solution types on cadmium (Ⅱ) extraction rate from oyster
2.1.3 酶配方优化
牡蛎样品中蛋白质含量丰富,而且重金属Cd(Ⅱ)主要是和蛋白质上的巯基进行结合[18-19]。风味蛋白酶与胰蛋白酶的复配可以有效破坏重金属Cd(Ⅱ)与蛋白质之间的配位结合,使得重金属Cd(Ⅱ)从蛋白质上释放。因此选用蛋白酶对牡蛎中的蛋白质进行水解破坏其结构,促使重金属从蛋白质上更好地解离下来。固定胰蛋白酶的添加量为0.3 g,改变风味蛋白酶的添加量,以实际提取率与重金属Cd(Ⅱ)理论提取率(100%)的差值最小为优化指标。随着风味蛋白酶酶量的增加,实际提取率与重金属Cd(Ⅱ)理论提取率的差值呈现出先降低后增加的趋势。结果如图3所示,当风味蛋白酶的添加量为0.7 g时,重金属Cd(Ⅱ)的提取率最高,为98.16%,其与理论提取率的差值最小,为1.84%。这可能是由于蛋白酶酶量不足时,底物与酶不能完全结合,蛋白酶酶量过多时,则会抑制底物的水解。因此,本实验选用的酶配方为0.3 g胰蛋白酶与0.7 g风味蛋白酶的复配。
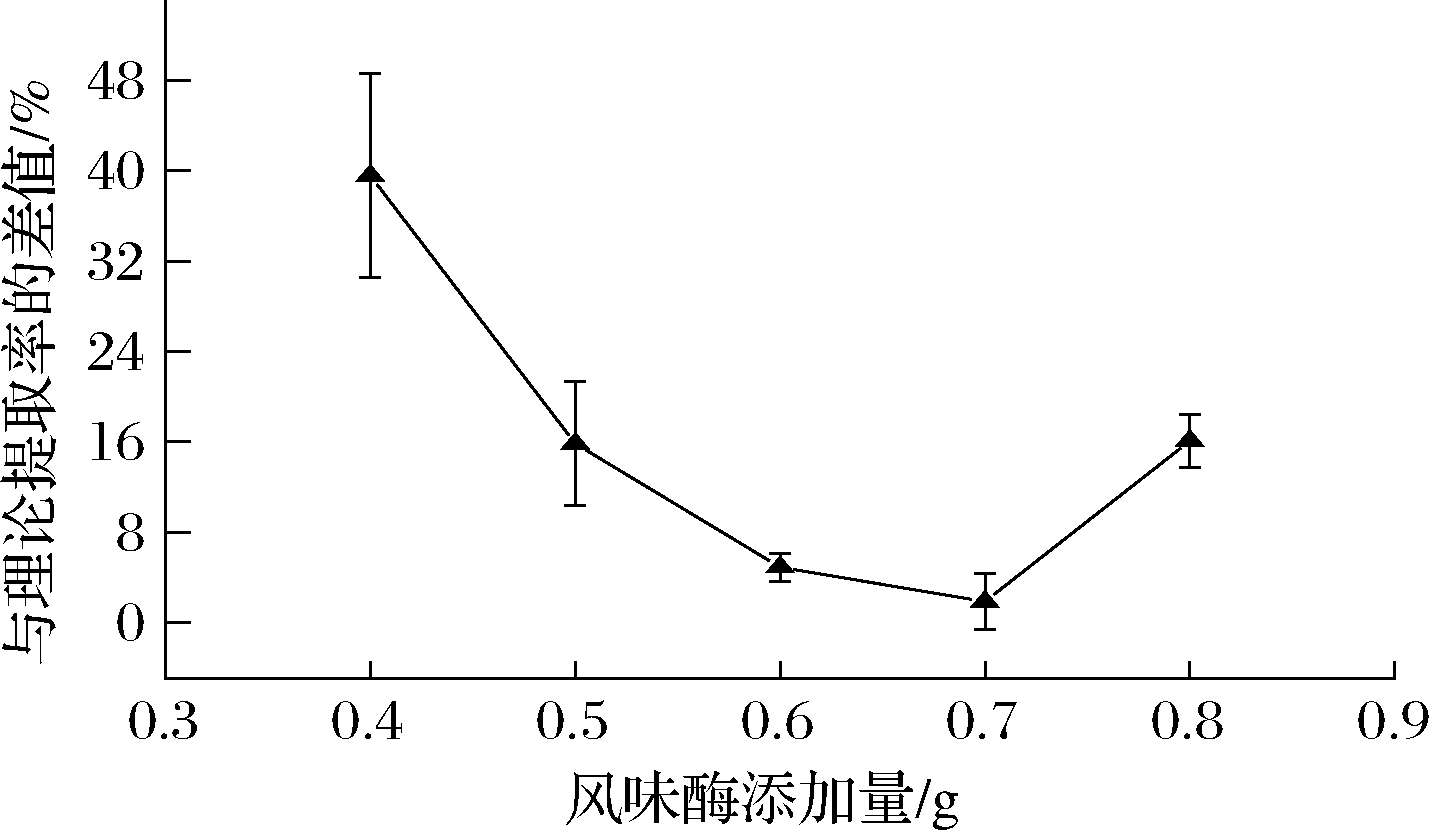
图3 酶配方对牡蛎中Cd(Ⅱ)提取率的影响
Fig.3 Influence of enzyme formulation on cadmium(Ⅱ) extraction rate from oyster
2.1.4 pH值优化
酶的生物活性受到提取剂pH值的影响较大,不适合的pH值会使酶变性失活[20]。在综合考虑风味蛋白酶和胰蛋白酶的最适pH值后,按照1.3.2的实验方法,考察了所用缓冲溶液的pH值为6.0、6.5、7.0、7.5、8.0时牡蛎中重金属Cd(Ⅱ)的提取率。结果如图4所示,当pH值为7.0时,重金属Cd(Ⅱ)的提取率达到103.2%,与理论提取率的差值最小,仅为3.2%。因此本实验选用7.0作为溶液的pH值。
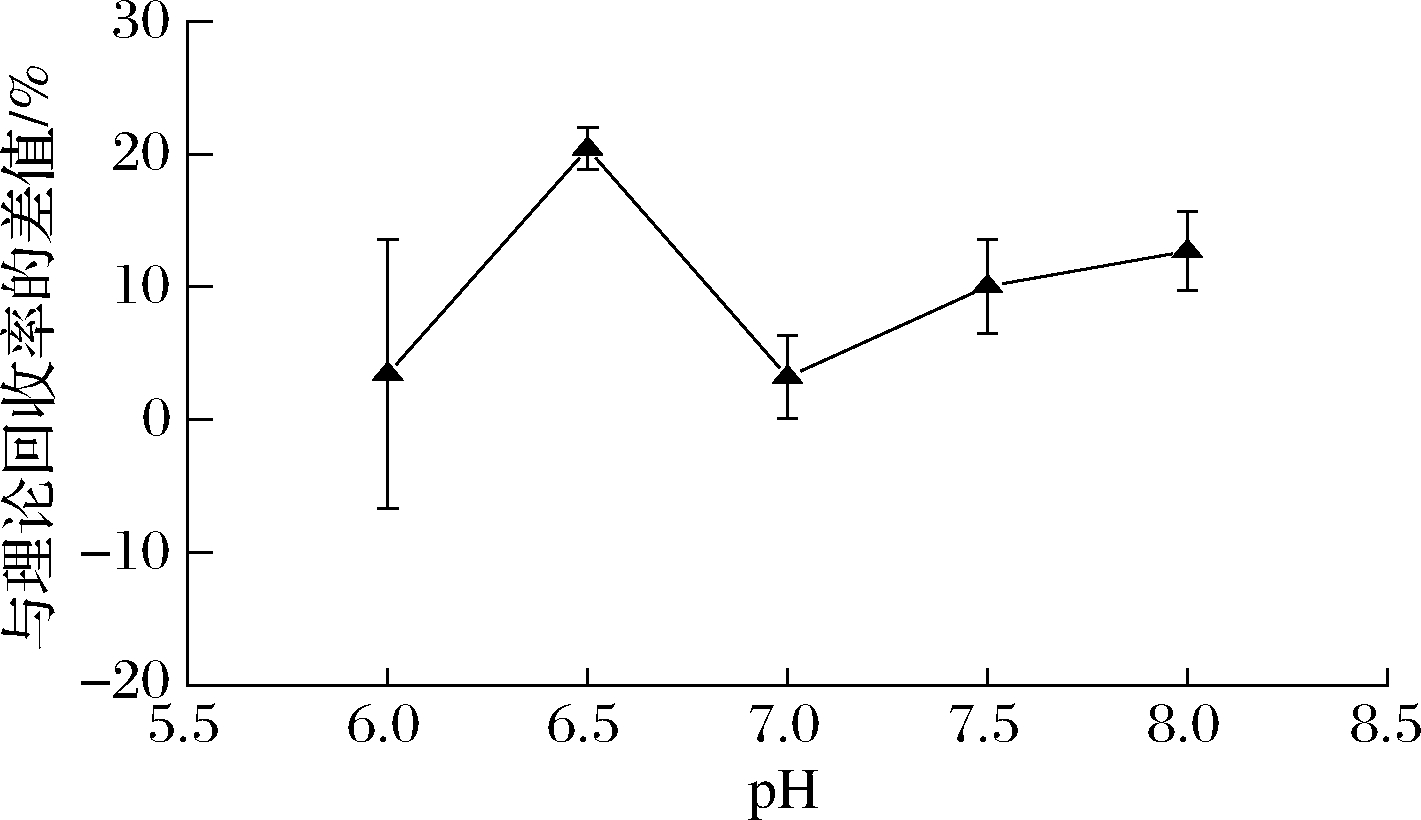
图4 pH值对牡蛎中Cd(Ⅱ)提取率的影响
Fig.4 Influence of pH on cadmium(Ⅱ) extraction rate from oyster
2.1.5 料液比优化
样品和酶在溶液中的分散性会影响牡蛎中镉的提取率,因此本研究考察了不同料液比(1∶3、1∶4、1∶5、1∶6、1∶7,g∶mL)对牡蛎中重金属Cd(Ⅱ)的提取率的影响。结果如图5所示,当料液比为1∶5(g∶mL)时,重金属Cd(Ⅱ)提取率为104.76%,与理论提取率的差值最小,仅为4.76%。这可能是由于料液比过低时,样品和酶在溶液中的分散性较差,不利于复合酶酶解作用的发挥;料液比过高时,蛋白酶被稀释,酶活性下降,不利于重金属Cd(Ⅱ)的提取。因此,本研究选在1∶5(g∶mL)的料液比下开展实验。
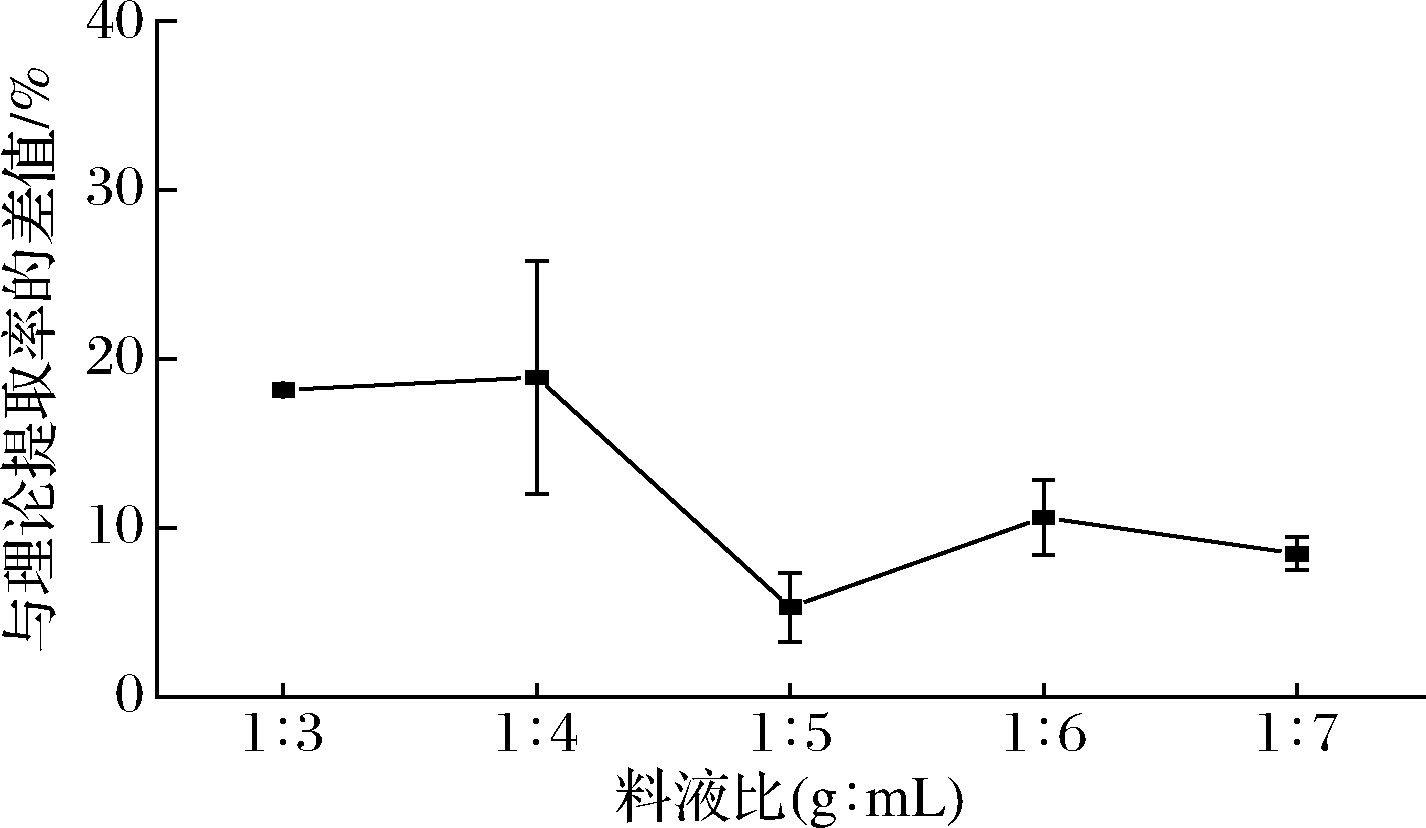
图5 料液比对牡蛎中Cd(Ⅱ)提取率的影响
Fig.5 Influence of solid-liquid ratio on cadmium(Ⅱ) extraction rate from oyster
对牡蛎样品的超声模式、缓冲种类、酶量、pH值以及料液比进行优化,实验的结果表明,牡蛎样品的最佳提取条件为:缓冲溶液为Tris溶液,0.7 g风味蛋白酶与0.3 g胰蛋白酶为复合酶配方,pH值为7,料液比为1∶5(g∶mL),此时重金属Cd(Ⅱ)的提取率可以达到104.76%。
2.2 水产品及其制品中重金属Cd(Ⅱ)的普适性提取条件
除牡蛎外,蟹肉、带鱼、鱿鱼丝、皮皮虾和虾滑也常出现重金属镉超标的情况,且被广泛食用,因此本研究以这5种具有代表性的水产品及其制品为例,进行水产品及其制品中重金属Cd(Ⅱ)的普适性提取条件研究。利用镉标液对上述5种样品进行加标,混匀后置于室温下静置30 min,在上述最佳提取条件的基础上,考察不同的超声探头功率(10%、15%、20%、25%、30%)对5种样品中重金属Cd(Ⅱ)提取率的影响。
2.2.1 超声功率对蟹肉中重金属Cd(Ⅱ)提取率的影响
取0.6 g Cd(Ⅱ)加标的蟹肉样品于离心管中,在仅改变超声功率不改变其他实验条件的情况下,计算样品的提取率和与理论提取率的差值。在上述最优实验条件下,研究超声探头的不同功率对蟹肉样品中重金属Cd(Ⅱ)提取率的影响。结果如图6所示,当超声功率为25%时,蟹肉样品中重金属Cd(Ⅱ)的提取率最高,为100.39%,与理论提取率的差值仅为0.39%。说明,在上述最优提取条件下,仅需将超声探头功率调至25%即可实现对蟹肉中重金属Cd(Ⅱ)的有效提取。
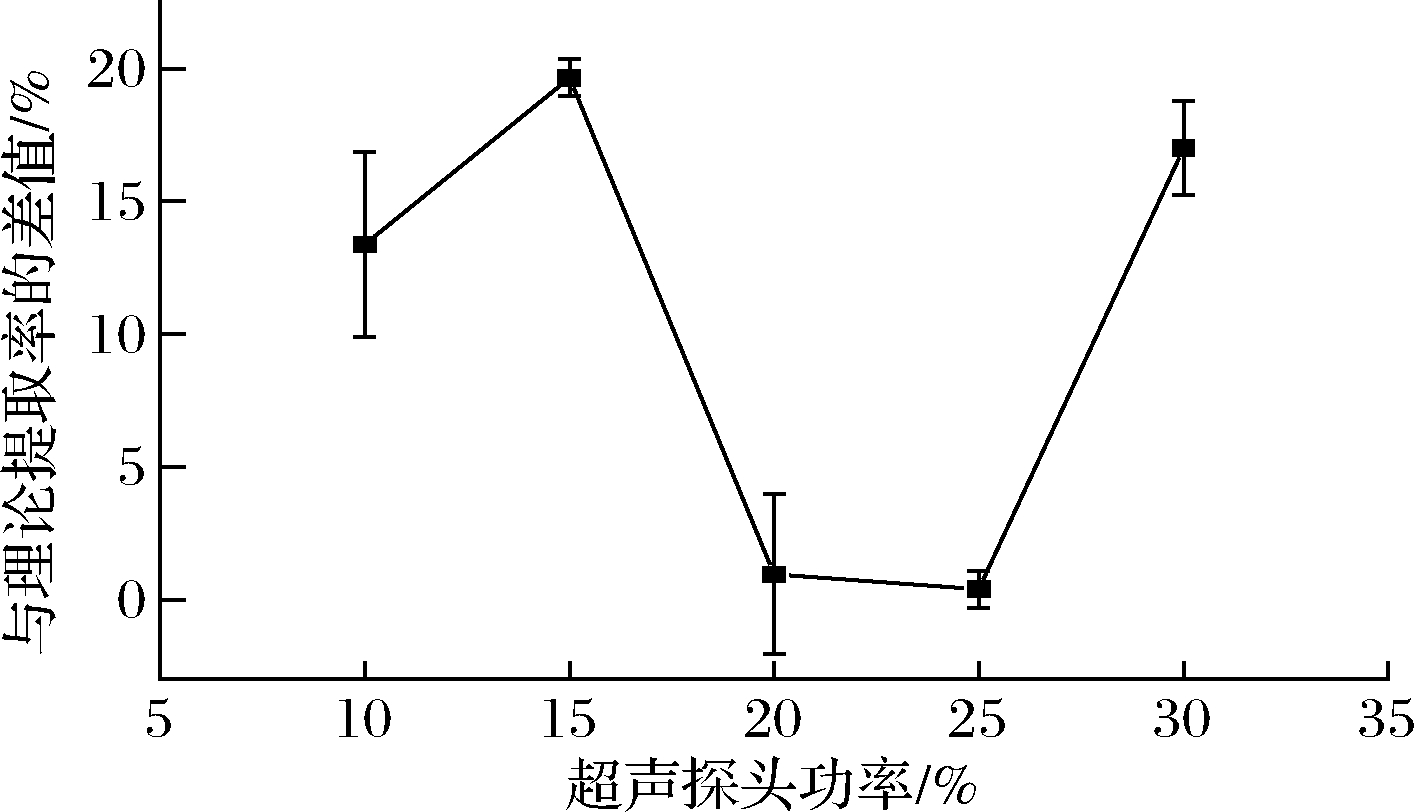
图6 超声探头功率对蟹肉中Cd(Ⅱ)提取率的影响
Fig.6 Influence of ultrasonic power on cadmium(Ⅱ) extraction rate in crab meat
2.2.2 超声功率对带鱼中重金属Cd(Ⅱ)提取率的影响
取0.6 g Cd(Ⅱ)加标的带鱼样品于离心管中,在上述最优实验条件下,研究超声探头的不同功率对带鱼样品中重金属Cd(Ⅱ)提取率的影响。结果如图7所示,当超声功率为30%时,带鱼样品中重金属Cd(Ⅱ)的提取率最高,为84.51%,与理论提取率的差值为15.49%。说明,在上述最优提取条件下,仅需将超声探头功率调至25%即可实现对带鱼中重金属Cd(Ⅱ)的有效提取。
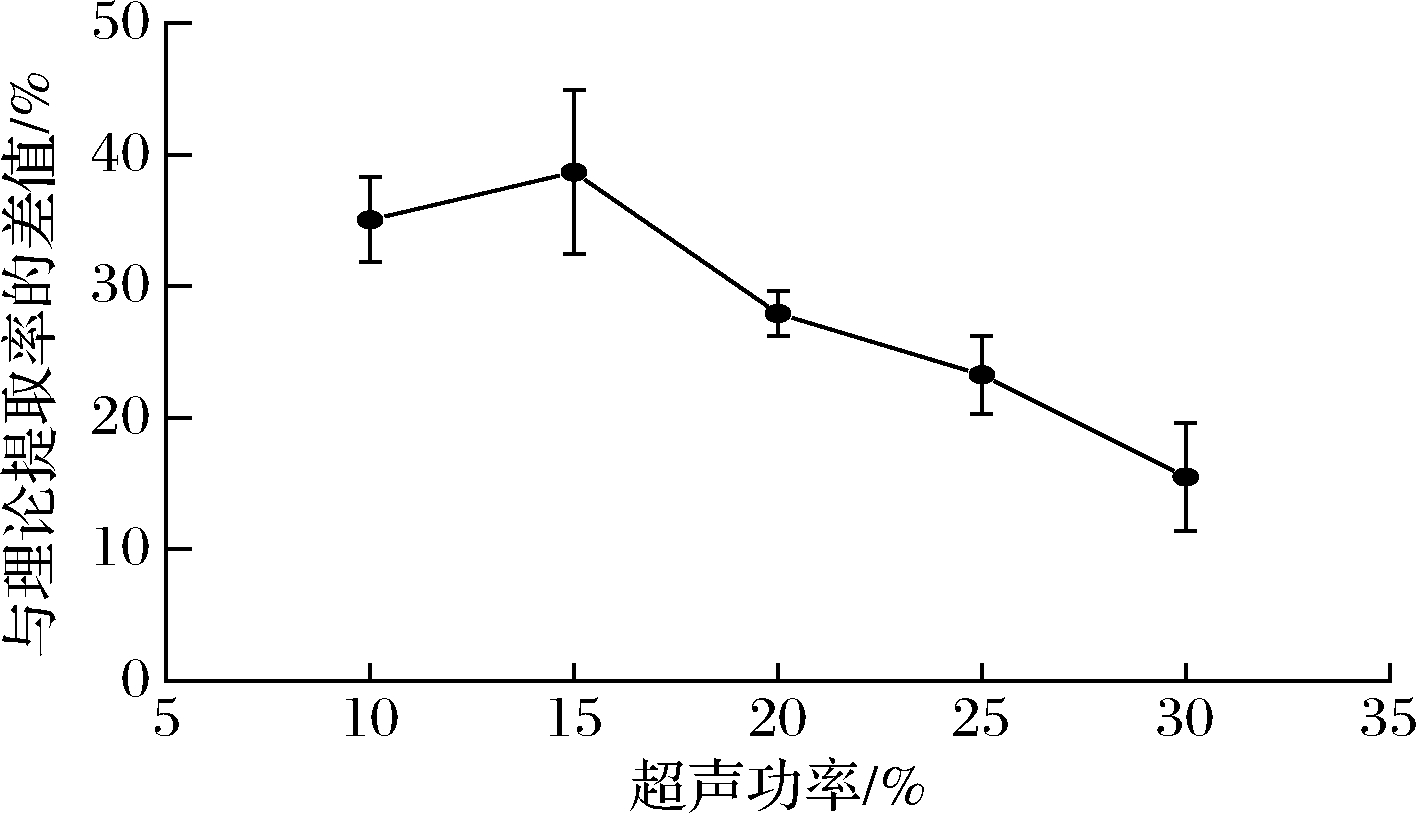
图7 超声探头功率对带鱼中Cd(Ⅱ)提取率的影响
Fig.7 Influence of ultrasonic power on cadmium(Ⅱ) extraction rate from hairtail
2.2.3 超声功率对鱿鱼丝中重金属Cd(Ⅱ)提取率的影响
取0.6 g Cd(Ⅱ)加标的鱿鱼丝样品于离心管中,在上述最优实验条件下,研究超声探头的不同功率对鱿鱼丝样品中重金属Cd(Ⅱ)提取率的影响。结果如图8所示,当超声功率为15%时,鱿鱼丝样品中重金属Cd(Ⅱ)的提取率最高,为75.66%,与理论提取率的差值为24.34%。说明,在上述最优提取条件下,仅需将超声探头功率调至15%即可实现对鱿鱼丝中重金属Cd(Ⅱ)的有效提取。

图8 超声探头功率对鱿鱼丝中Cd(Ⅱ)提取率的影响
Fig.8 Influence of ultrasonic power on cadmium(Ⅱ) extraction rate from squid silk
2.2.4 超声功率对皮皮虾中重金属Cd(Ⅱ)提取率的影响
取0.6 g Cd(Ⅱ)加标的皮皮虾样品于离心管中,在上述最优实验条件下,研究超声探头的不同功率对皮皮虾样品中重金属Cd(Ⅱ)提取率的影响。结果如图9所示,当超声功率为10%时,皮皮虾样品中重金属Cd(Ⅱ)的提取率最高,为93.18%,与理论提取率的差值为6.82%。说明,在上述最优提取条件下,仅需将超声探头功率调至10%即可实现对皮皮虾中重金属Cd(Ⅱ)的有效提取。
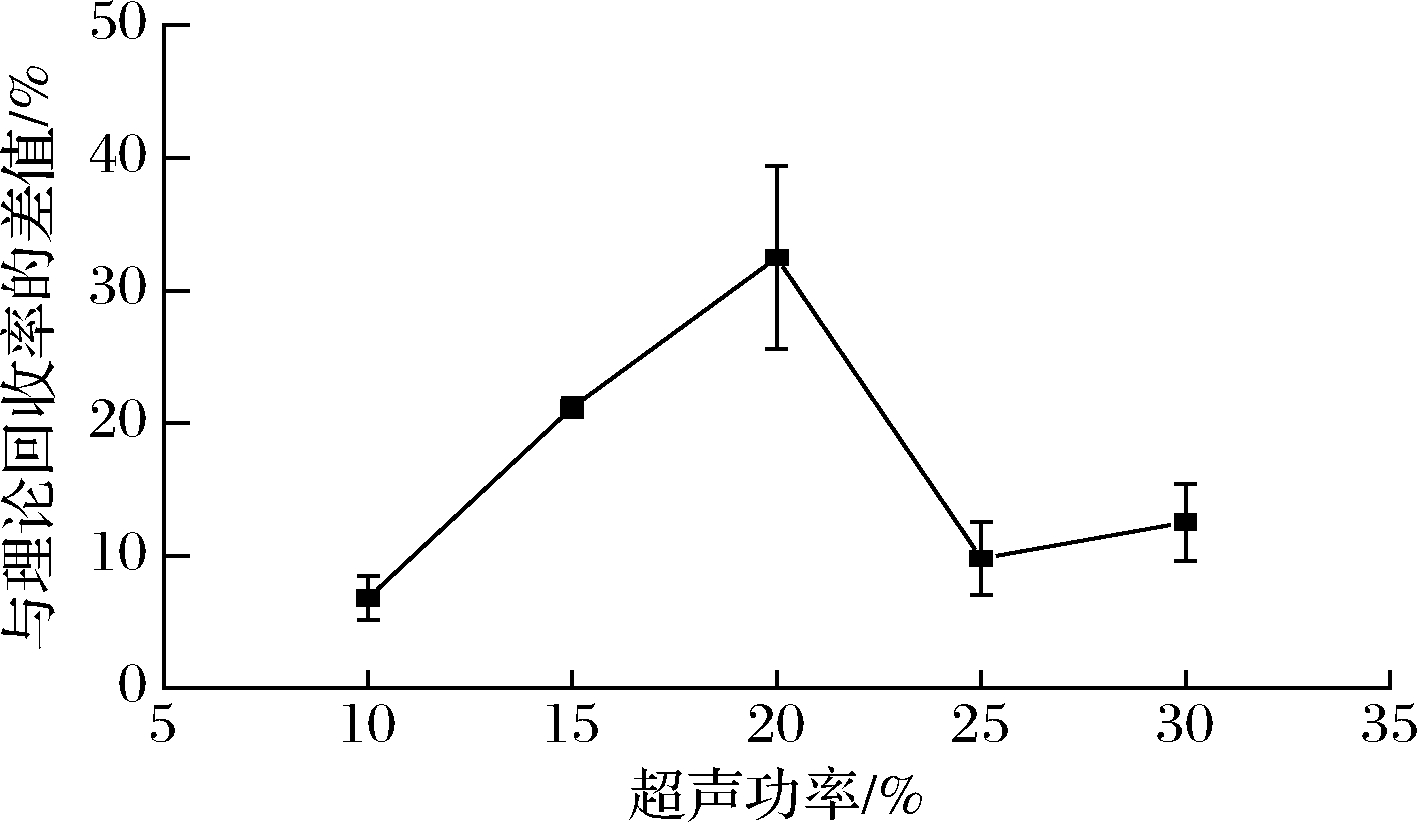
图9 超声探头功率对皮皮虾中Cd(Ⅱ)提取率的影响
Fig.9 Influence of ultrasonic power on cadmium(Ⅱ) extraction rate from shrimps
2.2.5 超声功率对虾滑中重金属Cd(Ⅱ)提取率的影响
取0.6 g Cd(Ⅱ)加标的虾滑样品于离心管中,在上述最优实验条件下,研究超声探头的不同功率对虾滑样品中重金属Cd(Ⅱ)提取率的影响。结果如图10所示,当超声功率为10%时,虾滑样品中重金属Cd(Ⅱ)的提取率最高,为94.97%,与理论提取率的差值为5.03%。说明,在上述最优提取条件下,仅需将超声探头功率调至10%即可实现对虾滑中重金属Cd(Ⅱ)的有效提取。
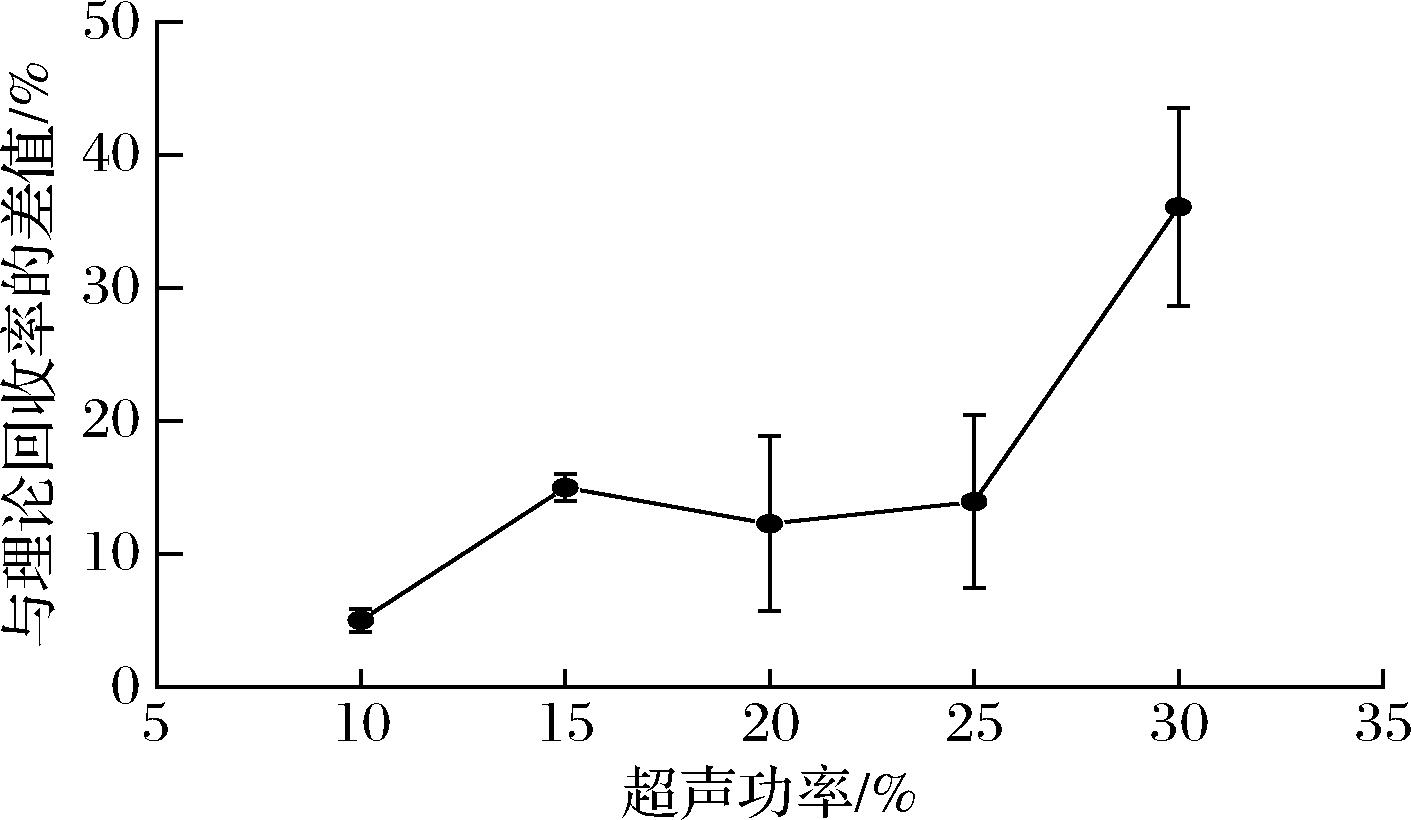
图10 超声探头功率对虾滑中Cd(Ⅱ)提取率的影响
Fig.10 Influence of ultrasonic power on cadmium(Ⅱ) extraction rate in shrimp slippage
2.3 水产品及其制品中重金属Cd(Ⅱ)的测定
采用优化好的前处理及检测方法,对市售的水产品及其制品(牡蛎,蟹肉,带鱼,鱿鱼丝,皮皮虾以及虾滑)中的重金属Cd(Ⅱ)进行测定。并与微波消解法的测定值相比较,结果如表2所示。结果显示,水产品牡蛎,蟹肉,带鱼,鱿鱼丝,皮皮虾以及虾滑重金属Cd(Ⅱ)提取率均在75%~110%。相较传统的微波消解法,双频超声辅助酶提取水产品中重金属的前处理方法用酸量少、耗时短且反应过程温和,测定结果准确可靠,用于水产品及其制品中重金属Cd(Ⅱ)的提取具有一定的普适性。
表2 水产样品测定结果(n=3)
Table 2 Determination results of aquatic samples (n=3)
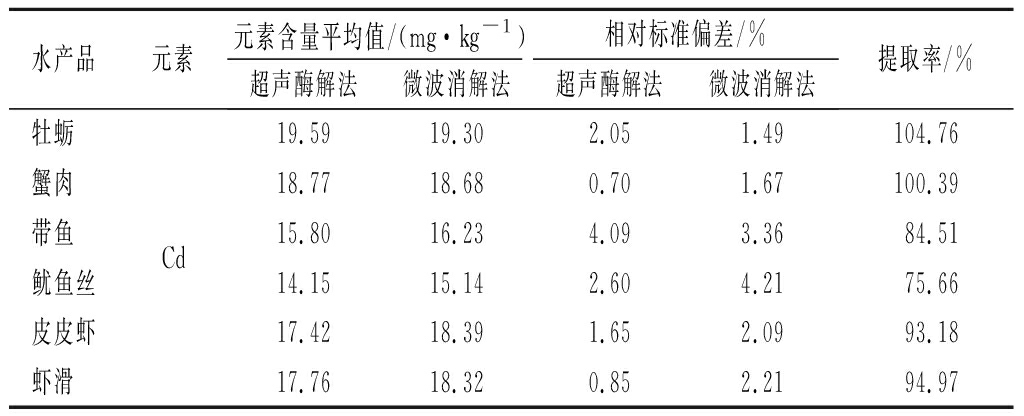
水产品元素元素含量平均值/(mg·kg-1)相对标准偏差/%超声酶解法微波消解法超声酶解法微波消解法提取率/%牡蛎 19.5919.302.051.49104.76蟹肉 18.7718.680.701.67100.39带鱼 Cd15.8016.234.093.3684.51鱿鱼丝14.1515.142.604.2175.66皮皮虾17.4218.391.652.0993.18虾滑 17.7618.320.852.2194.97
3 结论
通过研究不同超声模式,缓冲溶液,酶配方,pH值以及料液比对牡蛎样品中重金属Cd(Ⅱ)的提取率的影响,得到牡蛎中重金属Cd(Ⅱ)的最佳提取条件:以Tris作为缓冲溶液,以0.7 g风味蛋白酶与0.3 g胰蛋白酶为复合酶配方,pH值为7,料液比为1∶5(g∶mL),可在6 min内实现对牡蛎中重金属Cd(Ⅱ)的高效提取,其提取率可达104.76%。在上述最佳提取条件下,仅需改变超声功率即可获得水产品及其制品中重金属Cd(Ⅱ)的普适提取方法,实现了对蟹肉,带鱼,鱿鱼丝,皮皮虾和虾滑中重金属Cd(Ⅱ)的有效提取,其提取率可达75%~110%。与传统的微波消解法相比,该方法借助超声波的空化效应、热效应辅助酶水解,大大缩短了提取时间,同时采用的溶液pH为中性,环境友好且与速测方法具有良好的兼容性,在水产品及其制品中重金属前处理及快速检测领域应用前景十分广阔。
[1] SUHANI I, SAHAB S, SRIVASTAVA V, et al.Impact of cadmium pollution on food safety and human health[J].Current Opinion in Toxicology, 2021, 27:1-7.
[2] 彭加喜, 徐向荣, 刘金铃, 等.红海湾海产品体内重金属水平及人体暴露风险评估[J].生态科学, 2014, 33(5):825-831.
PENG J X, XU X R, LIU J L, et al.Heavy metal levels in seafood from Honghai bay and its human dietary exposure assessment[J].Ecological Science, 2014, 33(5):825-831.
[3] XIANG G Q, WEN S P, WU X Y, et al.Selective cloud point extraction for the determination of cadmium in food samples by flame atomic absorption spectrometry[J].Food Chemistry, 2012, 132(1):532-536.
[4] 李琴, 杨璐, 徐得, 等.镉离子选择性电极法测定食品中的镉含量[J].食品工业, 2019, 40(6):305-307.
LI Q, YANG L, XU D, et al.Determination of cadmium content in food by cadmium ion selective electrode[J].Food Industry, 2019, 40(6):305-307.
[5] 巨力佩. 农产品中铅,镉快速检测方法的研究[J].冶金管理, 2020(3):44;46.
JU L P.Study on rapid determinating of lead and cadmium in agricultural products[J].China Steel Focus, 2020(3):44;46.
[6] 刀艳梅, 樊仙, 邓军, 等.压力罐一次消解、原子荧光法同步测定甘蔗汁中砷和汞含量[J].中国糖料, 2018, 40(1):25-26.
DAO Y M, FAN X, DENG J, et al.Simultaneous determination of arsenic and mercury in sugarcane juice by pressure tank digesting and atomic fluorescence spectrometry[J].Sugar Crops of China, 2018, 40(1):25-26.
[7] 胡曙光, 苏祖俭, 黄伟雄, 等.食品中重金属元素痕量分析消解技术的进展与应用[J].食品安全质量检测学报, 2014,5(5):1 270-1 278.
HU S G, SU Z J, HUANG W X, et al.Progress and application in the digestion technology of trace heavy metal elements determination in food[J].Journal of Food Safety and Quality, 2014,5(5):1 270-1 278.
[8] 袁嫣昊, 胡曙光, 苏祖俭, 等.食品中重金属检测快速前处理技术研究进展[J].食品安全质量检测学报, 2019, 10(14):4 483-4 491.
YUAN Y H, HU S G, SU Z J, et al.Research progress on rapid pretreatment of heavy metals detection in food[J].Journal of Food Safety and Quality, 2019, 10(14):4 483-4 491.
[9] 张江义, 王小菊, 李国敏.微波消解-电感耦合等离子体质谱法同时测定食品中的主、微量元素[J].分析化学, 2014(11):1 706-1 709.
ZHANG J Y, WANG X J, LI G M.Simultaneous determination of trace elements and major elements in food by ICP-MS using microwave digestion for sample preparation[J].Chinese Journal of Analytical Chemistry, 2014(11):1 706-1 709.
[10] UMEGO E C, HE R H, REN W B, et al.Ultrasonic-assisted enzymolysis:Principle and applications[J].Process Biochemistry, 2021, 100:59-68.
[11] VALE G, RIAL-OTERO R, MOTA A, et al.Ultrasonic-assisted enzymatic digestion (USAED) for total elemental determination and elemental speciation:A tutorial[J].Talanta, 2008, 75(4):872-884.
[12] YILMAZ E, SOYLAK M.Innovative, simple and green ultrasound assisted-enzyme based hydrolytic microextraction method for manganese at trace levels in food samples[J].Talanta, 2017, 174:605-609.
[13] CHENG L, YANG X N, SHI M T, et al.Rapid extraction of arsenic species from traditional Chinese herbal by dual-frequency ultrasound-assisted enzymatic digestion prior to spectral analysis[J].Journal of Chromatography A, 2020, 1 619:460915.
[14] QIN L M, YANG X N, LENG D, et al.Dual-frequency ultrasound assisted-enzyme digestion coupled with atomic fluorescence spectrometry as a green and efficient tool for cadmium detection in rice flour samples[J].Talanta, 2018, 188:308-315.
[15] BERMEJO-BARRERA P, FERN NDEZ-NOCELO S, MOREDA-PI
NDEZ-NOCELO S, MOREDA-PI EIRO A, et al.Usefulness of enzymatic hydrolysis procedures based on the use of pronase E as sample pre-treatment for multi-element determination in biological materials[J].Journal of Analytical Atomic Spectrometry, 1999, 14(12):1 893-1 900.
EIRO A, et al.Usefulness of enzymatic hydrolysis procedures based on the use of pronase E as sample pre-treatment for multi-element determination in biological materials[J].Journal of Analytical Atomic Spectrometry, 1999, 14(12):1 893-1 900.
[16] PE A-FARFAL C, MOREDA-PI
A-FARFAL C, MOREDA-PI EIRO A, BERMEJO-BARRERA A, et al.Ultrasound bath-assisted enzymatic hydrolysis procedures as sample pretreatment for the multielement determination in mussels by inductively coupled plasma atomic emission spectrometry[J].Analytical Chemistry, 2004, 76(13):3 541-3 547.
EIRO A, BERMEJO-BARRERA A, et al.Ultrasound bath-assisted enzymatic hydrolysis procedures as sample pretreatment for the multielement determination in mussels by inductively coupled plasma atomic emission spectrometry[J].Analytical Chemistry, 2004, 76(13):3 541-3 547.
[17] FU L P, ZHANG G C, GE J J, et al.Study on dual-frequency ultrasounds assisted surfactant extraction of oil sands[J].Fuel Processing Technology, 2017, 167:146-152.
[18] AJSUVAKOVA O P, TINKOV A A, ASCHNER M, et al.Sulfhydryl groups as targets of mercury toxicity[J].Coordination Chemistry Reviews, 2020, 417:213343.
[19] YANG H Z, WANG L, HE Y J, et al.Analysis of spectrometry and thermodynamics of the metallothionein in freshwater crab Sinopotamon henanense for its binding ability with different metals[J].Chemosphere, 2020, 246:125670.
[20] 程贤, 毕良武, 赵振东, 等.酶辅助提取技术在天然产物提取中的应用研究进展[J].生物质化学工程, 2016, 50(3):71-76.
CHENG X, BI L W, ZHAO Z D, et al.Advances of enzyme-assisted technology in extraction of natural products[J].Biomass Chemical Engineering, 2016, 50(3):71-76.