开菲尔(Kefir)起源于俄罗斯北高加索地区,是一种酸性、黏性、低酒精含量的乳制品饮料,被称为“发酵牛奶中的香槟”和“奇怪的”发酵牛奶[1]。开菲尔是由开菲尔粒(Kefir grains)发酵而成的,开菲尔粒是含有乳酸菌、醋酸菌和酵母菌的复杂微生物共生混合物,为直径1~15 mm的凝胶状浅黄色或白色颗粒[2]。发酵过程中,酵母菌可产生少量的CO2,使开菲尔在普通酸奶产品中的味道和风味显著不同。
开菲尔胞外多糖(Kefiran)含有大约等量的D-葡萄糖和D-半乳糖,是一种黏合剂,起到固定微生物的作用,与各种微生物形成了开菲尔粒结构的骨架[3],并保护开菲尔粒免受外部微生物的危害。其还具有抗肿瘤、抗氧化、抗炎、减少血清胆固醇水平和调节肠道免疫系统[4]等功能特性。开菲尔胞外多糖作为一种具有生物活性的新型多糖,引起了食品研究人员的广泛关注,目前其已应用于食品和制药行业[5]。
目前有关开菲尔胞外多糖的报道主要是从开菲尔粒中提取并进行研究,而鲜少有对开菲尔发酵乳中的多糖进行研究。故本实验分别对开菲尔粒中胞外多糖(Kefiran-G)和开菲尔发酵乳中胞外多糖(Kefiran)进行提取,并对提取条件进行优化。对比分析了2种多糖的结构、絮凝活性、乳化性和抗氧化活性,为开菲尔胞外多糖的进一步开发利用提供必要的研究基础。
1 材料与方法
1.1 材料与试剂
开菲尔粒,锡林郭勒盟牧民家庭;脱脂乳粉,丹麦Arla Foods乳品公司;抗坏血酸,深圳乐芙生物科技有限公司;2,2′-联氮双(3-乙基苯并噻唑啉-6-磺酸)[2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid), ABTS],上海翌圣生物科技有限公司;正十六烷、溴化钾(光谱纯),上海麦克林生化科技有限公司;其他所用试剂均为国产分析纯。
1.2 仪器与设备
T6-新世纪紫外-可见分光光度仪,北京普析通用仪器有限责任公司;HC-2T18R型冷冻高速离心机,日本Hitachi公司;DW-86L338A型冻干机(-80 ℃),青岛海尔特种电器有限公司;TM4000扫描电镜,日本株式会社日立高新技术那珂事业所;IRAffinity-1傅里叶变换红外光谱仪,日本岛津公司。
1.3 实验方法
1.3.1 培养条件
开菲尔粒用无菌生理盐水冲洗后以5%的接种量接种于无菌冷却的脱脂乳培养基中,并取在28 ℃下连续培养至pH稳定后的开菲尔粒及开菲尔发酵液为实验原料。
1.3.2 培养基的配制
脱脂乳培养基:将脱脂乳粉与蒸馏水以料液比1∶10(g∶mL)制成脱脂乳培养基,110 ℃灭菌10 min。
1.3.3 开菲尔发酵乳中Kefiran的提取工艺
单因素试验:向上清液中加入95%乙醇,体积分别为上清液体积的1、2、3、4、5倍;乙醇体积分数分别为75%、80%、85%、90%、95%、100%和醇沉时间为6、12、18、24、30、36、42 h的条件下进行提取。
正交试验:在单因素试验的基础上,以提取率为指标,乙醇体积、乙醇体积分数和醇沉时间为3个因素进行L9(33)正交试验。提取率按公式(1)计算:
提取率![]()
(1)
式中:ρ,从标准曲线中计算出提取液中多糖的量,mg/mL;m,同体积发酵液冻干后的质量,g;V,Kefiran提取液总体积,mL。
开菲尔发酵乳中Kefiran的提取工艺如下:
发酵液取上清液10 mL→旋转蒸发→乙醇沉淀(4 ℃)→离心(10 000 r/min,30 min)→沉淀复溶→sevag法除蛋白质→旋蒸除有机溶剂→透析12 h(4 ℃)→冷冻干燥
1.3.4 开菲尔粒中Kefiran-G的提取工艺
单因素试验:料液比为1∶5、1∶10、1∶20、1∶40、1∶80(g∶mL),提取温度为60、70、80、90、100 ℃和提取时间为15、30、60、120、240 min的条件下进行提取。开菲尔粒中Kefiran-G的提取工艺如下:
取开菲尔粒1 g→水浴加热→离心(9 200 r/min,15 min,4 ℃)→加入预冷无水乙醇,醇沉24 h(-20 ℃)→离心(10 000 r/min,20 min,4 ℃)→沉淀复溶→sevag法除蛋白质→旋蒸除有机溶剂→透析12 h(4 ℃)→冷冻干燥
正交试验:在单因素试验的基础上,以提取率为指标,料液比、提取温度和提取时间为3个因素进行L9(33)正交试验。提取率计算如公式(2)所示:
提取率![]()
(2)
式中:ρ,从标准曲线中计算出提取液中多糖的量,mg/mL;m,开菲尔粒的质量,g;V,Kefiran-G提取液总体积,mL。
1.3.5 结构测定
1.3.5.1 微观结构测定
将样品用导电双面胶带固定在样品台上,吹掉多余的粉末,用扫描电镜观察胞外多糖的表面结构。
1.3.5.2 红外光谱测定
将样品与溴化钾按1∶100(质量比)的比例研磨使其混合均匀,压片成薄片。于4 000~400 cm-1下扫描,扫描64次,分辨率为4 cm-1。
1.3.6 理化性质测定
1.3.6.1 乳化性测定
参照WANG等[6]的方法,取0.5 mg冻干Kefiran、Kefiran-G、黄原胶和瓜尔豆胶,分别溶于0.5 mL去离子水中,水浴煮沸20 min,冷却至室温后加入磷酸盐缓冲溶液调节至2 mL,加入0.5 mL十六烷,涡旋10 min后立即在波长540 nm处读取溶液的吸光度,记为A0。每个溶液样品按顺序室温孵育30、60和90 min,并记录在540 nm处的吸光度At。样品的乳化能力计算如公式(3)所示:
乳化活性![]()
(3)
式中:A0,0 min时的吸光度;At,分别在30、60和90 min时的吸光度。
1.3.6.2 絮凝活性测定
参照HAN等[7]的方法并略有修改。取2 g/L高岭土悬浮液100 mL和1 mL质量分数1%CaCl2混合,在混合液中加入2 mL不同质量浓度(0.4~0.9 mg/mL)的Kefiran、Kefiran-G、黄原胶和瓜尔豆胶,涡旋振荡3 min后于室温下静置10 min,测量在550 nm处的吸光度。絮凝活性计算如公式(4)所示:
絮凝活性![]()
(4)
式中:A,样品悬浮液吸光度;A0,空白对照组吸光度。
1.3.7 抗氧化特性测定·OH清除能力参照文献[8]的方法;总还原力的测定参照文献[9]的方法;ABTS阳离子自由基清除能力的测定参照文献[10]的方法。
1.4 数据处理及分析
用Excel 2010、Origin 2019b和SPSS 26进行作图与数据分析。实验结果均以平均值±标准差表示,采用单因素方差分析法进行显著性差异分析,当P<0.05时,表示差异显著。
2 结果与分析
2.1 培养时间对开菲尔发酵乳pH和Kefiran产量的影响
由图1可知,随发酵时间的延长,开菲尔发酵乳的pH值和Kefiran产量出现明显的变化。脱脂乳培养基的初始pH值为6.58,接种开菲尔粒后,pH值在发酵过程中呈下降趋势,在0~36 h内pH值下降较快,40~84 h下降速度减缓,84 h后pH值达到3.6,基本趋于平稳。
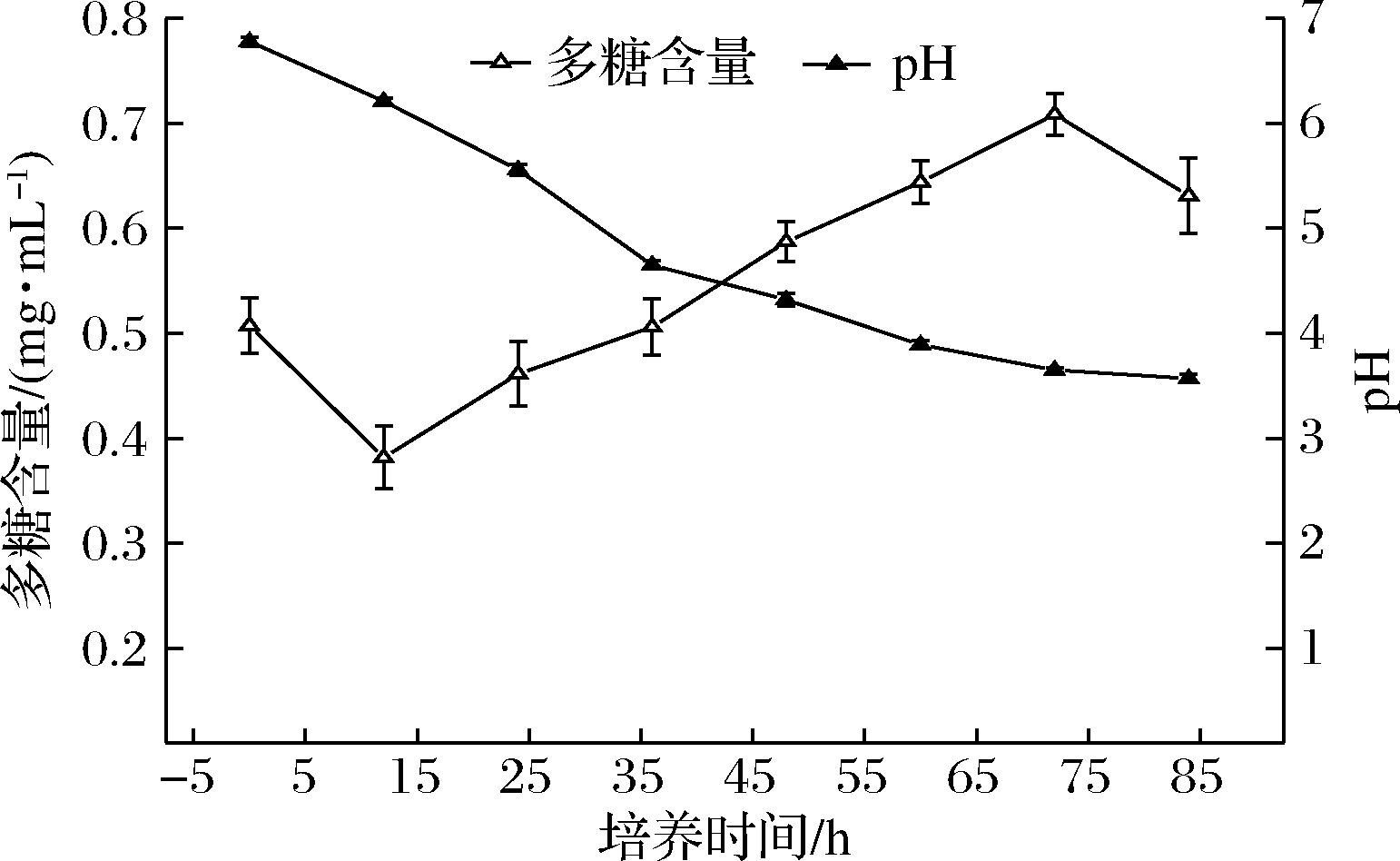
图1 开菲尔发酵过程中pH 值和Kefiran含量的变化
Fig.1 Changes of pH value and Kefiran content during Kefir fermentation
此外,在发酵过程中Kefiran含量在0.5~0.7 mg/mL波动。Kefiran的含量在发酵初期略有减少,可能是由于微生物生长过程需要消耗糖类物质。从第12 h开始Kefiran含量开始增加,微生物在生长过程中为避免酸类物质对其的抑制作用,会产生更多Kefiran以保护自身。Kefiran含量在72 h后下降,可能是由于多糖水解酶将其水解所致[11]。开菲尔发酵72 h时,pH值为3.65,并且此时Kefiran的含量最大,故将发酵72 h判定为发酵终点,在此时进行Kefiran的提取。
2.2 Kefiran提取工艺的优化
2.2.1 单因素试验
以乙醇体积分数、醇沉时间、乙醇体积作为影响因素,以Kefiran提取率作为衡量指标进行单因素实验对Kefiran进行提取,3个因素均对Kefiran的提取率有显著影响(P<0.05)。最终确定Kefiran最优单因素提取工艺为乙醇体积分数为95%,醇沉24 h,乙醇体积为2倍。此条件下得到的Kefiran提取率达到最高值分别为(2.25±0.33)%,(2.25±0.22)%,(2.79±0.19)%。单因素结果如图2所示。

a-乙醇体积分数;b-醇沉时间;c-乙醇体积
图2 乙醇体积分数、醇沉时间、乙醇体积对Kefiran提取率的影响
Fig.2 Effects of ethanol concentration, ethanol precipitation time and ethanol volume on the extraction yield of Kefiran
注:不同小写字母表示同一样品不同浓度间具有显著差异(P<0.05)
2.2.2 正交试验
提取Kefiran的正交设计因素水平表及正交试验结果分别见表1与表2。由表可知,3个因素的主次顺序为A>C>B。从9组处理中找出最优水平组合为第9组,即A3B3C2,且提取率达到4.38%,而正交优化最佳水平组合为A3B2C3,提取率达(4.05±0.08)%。
表1 L9(33)正交设计因素水平表
Table 1 Factors and levels table of orthogonal test
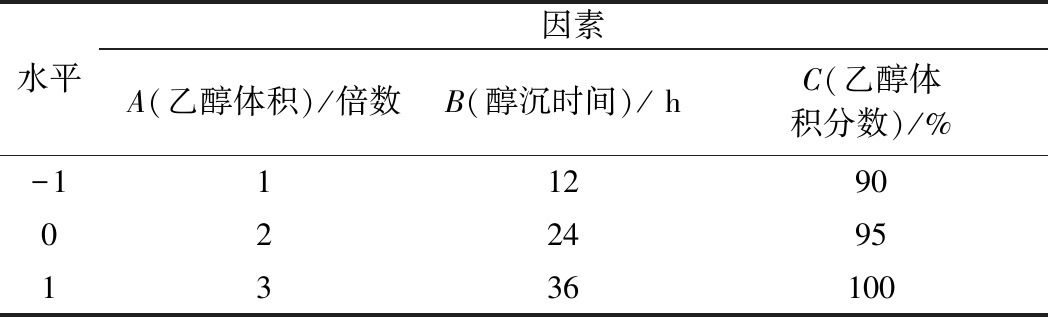
水平因素A(乙醇体积)/倍数B(醇沉时间)/ hC(乙醇体积分数)/%-1112900224951336100
表2 正交试验结果
Table 2 Results of orthogonal experiment
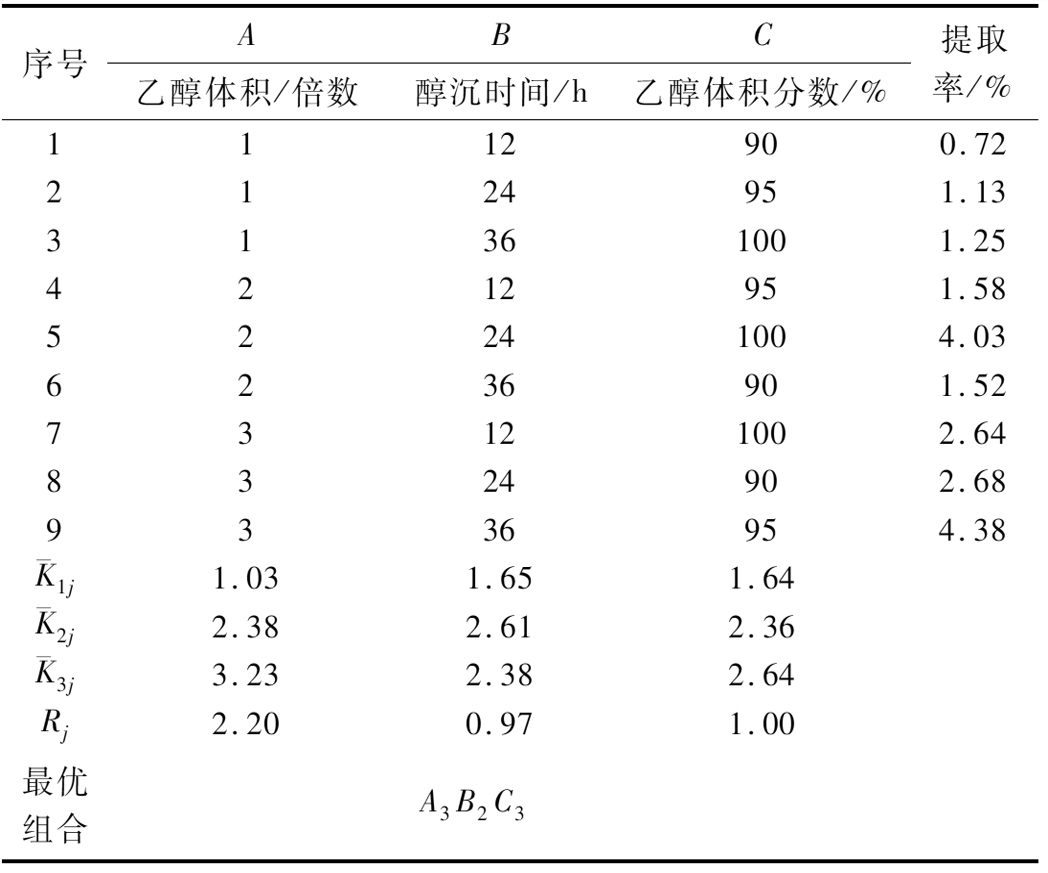
序号ABC乙醇体积/倍数醇沉时间/h乙醇体积分数/%提取率/%1112900.722124951.1331361001.254212951.5852241004.036236901.5273121002.648324902.689336954.38K1j1.03 1.65 1.64 K2j2.38 2.61 2.36 K3j3.23 2.38 2.64 Rj2.20 0.97 1.00 最优组合A3B2C3
经过验证,第9组处理的提取率优于正交优化水平组合,得到最佳工艺条件为:乙醇体积3倍、乙醇体积分数95%、醇沉时间36 h。
2.3 Kefiran-G提取工艺的优化
2.3.1 单因素试验
以料液比、提取时间和提取温度作为影响因素,以Kefiran-G提取率作为衡量指标进行单因素实验对Kefiran-G进行提取,3个因素均对Kefiran-G的提取率有显著影响(P<0.05)。最终确定的Kefiran-G最优单因素提取工艺为料液比1∶10,提取时间60 min,提取温度90 ℃。此条件下得到的Kefiran-G提取率达到最高值分别为(8.71±0.42)%,(5.14±0.29)%,(6.71±0.58)%。单因素结果如图3所示。

a-料液比;b-提取时间;c-提取温度
图3 料液比、提取时间、提取温度对Kefiran-G提取率的影响
Fig.3 Effects of solid-liquid radio, extraction time and extraction temperature on the extraction yield of Kefiran-G
2.3.2 正交试验
提取Kefiran-G的正交设计因素水平表及正交试验结果分别见表3与表4。
表3 L9(33)正交设计因素水平表
Table 3 Factors and levels table of orthogonal test
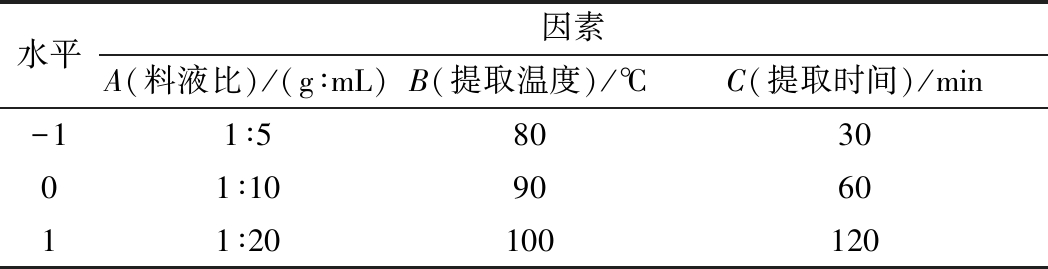
水平因素A(料液比)/(g∶mL)B(提取温度)/℃C(提取时间)/min-11∶5803001∶10906011∶20100120
表4 正交试验结果
Table 4 Results of orthogonal experiment

序号ABC料液比/(g∶mL)提取温度/℃提取时间/min提取率/%11∶580303.0821∶590604.2831∶51001205.1041∶1080603.8551∶10901204.7361∶10100303.4871∶20801203.7381∶2090303.9591∶20100604.40K1j41.5335.5234.98K2j40.1643.1641.74K3j40.2543.2645.22Rj1.377.7410.24最优组合A1B3C3
由表4可知,3个因素的主次关系为C>B>A。正交实验结果表明,各因素不同水平的最佳配比为A1B3C3。即提取时间120 min、提取温度100 ℃、料液比1∶5(g∶mL),提取率为(5.10± 0.38)%。此条件下得到的Kefiran-G提取率最高。
2.4 红外光谱分析
傅里叶变换-红外光谱法(Fourier transform infrared spectroscopy,FT-IR)是检测胞外聚合物结构和功能基团的常见方法。Kefiran和Kefiran-G的红外光谱如图4所示,两者均在3 600~3 310 cm-1附近表现出强烈的宽拉伸峰,这是由于—OH伸缩振动引起的[12],这个峰为糖类物质的特征峰;Kefiran和Kefiran-G在2 981~2 850 cm-1处分别有2个弱伸缩峰,这是由于多糖中C—H的伸缩振动造成的,分别对应于甲基和亚甲基[13];根据WANG等[14]的研究结果,1 700~1 775 cm-1附近未见峰,这表明Kefiran和Kefiran-G中不存在葡萄糖醛酸、二酰基酯;1 652 cm-1附近的峰可能是蛋白质酰胺I带的C![]() O伸缩振动吸收峰[15],推测多糖中含有少量结合蛋白,这与WANG等[14]的研究结果一致;1 381 cm-1处的峰是羧基中C
O伸缩振动吸收峰[15],推测多糖中含有少量结合蛋白,这与WANG等[14]的研究结果一致;1 381 cm-1处的峰是羧基中C![]() O的对称伸缩振动峰[16],证明了羧基的存在;1 066 cm-1处的峰是C—O键的伸缩振动峰,其来源可能为C—O—H,或是糖环中的C—O—C,也有可能为缩醛键[17]。此外,光谱显示存在羧基和羟基,这是絮凝过程的首选基团。由于邻乙酰酯的存在,在1 240 cm-1附近有1个额外的峰[15]。
O的对称伸缩振动峰[16],证明了羧基的存在;1 066 cm-1处的峰是C—O键的伸缩振动峰,其来源可能为C—O—H,或是糖环中的C—O—C,也有可能为缩醛键[17]。此外,光谱显示存在羧基和羟基,这是絮凝过程的首选基团。由于邻乙酰酯的存在,在1 240 cm-1附近有1个额外的峰[15]。

图4 Kefiran和Kefiran-G的红外光谱图
Fig.4 Infrared spectra of Kefiran and Kefiran-G
2.5 扫描电子显微镜
Kefiran和Kefiran-G的三维微观结构存在明显差异(图5),发酵乳中Kefiran表面光滑具有薄膜特点,结构疏松,间或呈网状结构;开菲尔粒中Kefiran-G的表面结构紧致光滑,也具有薄膜特点且边缘为不规则的枝状结构。有研究表明,紧致光滑的表面结构和枝状结构对于改善各种食品的流变特性至关重要[18]。而Kefiran-G的枝状结构末端有许多大小形状相似的球形结构黏附其上,发现其外观神似于神经元突触,猜想其具有捕获菌种、蛋白质及其他物质的能力,进而形成开菲尔粒,后期可由此对开菲尔粒的成粒机制做进一步研究。

a-Kefiran;b-Kefiran-G
图5 Kefiran和Kefiran-G的微观结构
Fig.5 Microstructure of Kefiran and Kefiran-G
2.6 乳化性分析
据MANNINA等[19]的研究可知,微生物多糖和植物胶具有乳化作用,如瓜尔豆胶和黄原胶等,特别是微生物源的黄原胶,因其具有较高的乳化活性而在食品工业中得到了广泛的应用。多糖的乳化能力可以用多糖在溶液中保持乳状液状态的时间长短评判。本文将Kefiran、Kefiran-G与黄原胶、瓜尔豆胶商品多糖进行了比较。结果表明(表5),Kefiran在30和60 min时的乳化保留率分别为56.42%和51.68%。Kefiran-G在30和60 min时的乳化保留率分别为57.17%和48.26%。瓜尔豆胶的乳化保留率分别为41.66%和30.31%,黄原胶乳化保留率分别为46.52%和40.11%。Kefiran和Kefiran-G的乳化活性高于瓜尔豆胶,略高于黄原胶。由于Kefiran和Kefiran-G是由具有公认为安全(Generally Recognized As Safe,GRAS)分类的菌株产生的,因此,Kefiran和Kefiran-G可作为乳化剂应用于食品行业,而Kefiran的乳化活性在30~60 min内仅下降4.74%,说明Kefiran在溶液中保持乳状液状态的时间较长,因此具有比Kefiran-G更好的乳化稳定性。
表5 Kefiran的乳化活性
Table 5 Emulsifying activity of Kefiran

乳化剂孵化时间/minOD540乳化活性/%标准样品00.25±0.011100.00±0.000300.10±0.00741.76±0.011 600.09±0.00834.86±0.014 900.08±0.00831.89±0.015瓜尔豆胶00.51±0.008100.00±0.000300.21±0.00841.66±0.007600.16±0.00830.31±0.008900.15±0.00630.12±0.005黄原胶00.47±0.010100.00±0.000300.21±0.00946.52±0.008600.19±0.00640.11±0.004900.17±0.00636.06±0.005Kefiran00.32±0.008100.00±0.000300.18±0.00756.42±0.006600.16±0.00751.68±0.008900.15±0.00948.84±0.015Kefiran-G00.82±0.011100.00±0.000300.47±0.00757.17±0.001600.39±0.00948.26±0.005900.35±0.01142.66±0.006
2.7 絮凝分析
生物絮凝剂是微生物生长过程中产生的,是安全、可生物降解的。WANG等[3]从新疆开菲尔粒中分离到1株产胞外多糖的肠膜明串珠菌XR1,其胞外多糖与黄原胶和瓜尔豆胶相比具有良好的絮凝性能。所以选取黄原胶和瓜尔豆胶为对照,比较不同来源开菲尔胞外多糖的絮凝活性。图6显示,4种样品的絮凝活性均呈现出相同的变化趋势,即絮凝活性随着多糖浓度的增加而增加,到达最高净化点后开始下降。这可能是由于只有絮凝剂周围的颗粒才能参与絮凝反应,因此过量的絮凝剂被吸附而导致颗粒不稳定[7]。本研究确定了Kefiran、Kefiran-G、黄原胶和瓜尔豆胶的最佳絮凝质量浓度分别为0.6、0.7、0.5、0.6 mg/mL。其中Kefiran-G在质量浓度0.4~0.9 mg/mL絮凝活性均较高,Kefiran-G的絮凝活性高于瓜尔豆胶和黄原胶,但Kefiran的絮凝活性低于瓜尔豆胶和黄原胶。Kefiran-G的絮凝活性显著高于Kefiran,其原因可能是由于两者的微观结构不同,从图5可看到,与Kefiran的相比,Kefiran-G的枝状末端突起较明显,增大了与其他物质接触的表面积,有利于其吸附大分子物质,进而具有较好的絮凝性能。由于Kefiran-G有很高的絮凝活性且表面带有很多活性基团,其结构中丰富的羟基、羧基、糖苷键等活性基团又可以提供大量的吸附位[20]。LIN等[21]研究了膳食纤维的吸附作用,因其分子表面带有很多活性基团,可吸附螯合胆固醇、胆汁酸以及肠道内的有毒物质(内源性毒素)、化学药品和有毒医药品(外源性毒素)等有机化合物。由此可推断Kefiran-G可能也具有这些功能,后续可对此进行研究。
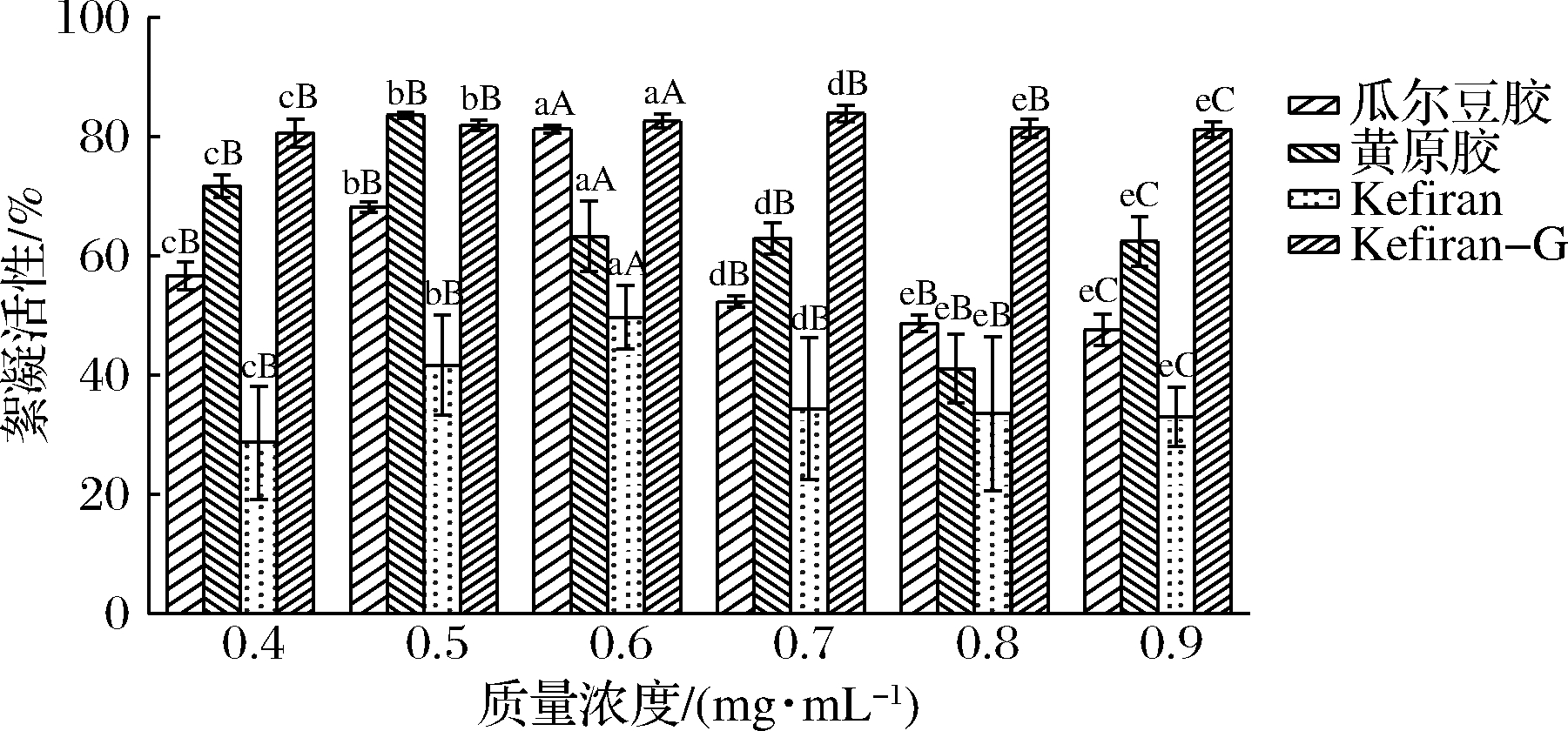
图6 Kefiran、Kefiran-G、黄原胶和瓜尔豆胶的絮凝活性
Fig.6 Flocculating capacity of Kefiran, Kefiran-G,xanthan gum and guar gum
2.8 抗氧化活性
由图7可知,3种抗氧化能力均随Kefiran和Kefiran-G浓度的增加而增加,但Kefiran和Kefiran-G的抗氧化能力有所不同。
在多糖质量浓度为1~9 mg/mL时,Kefiran的·OH清除能力高于Kefiran-G,当质量浓度达7 mg/mL时,Kefiran的·OH清除能力显著高于Kefiran-G(P<0.05),但均低于抗坏血酸。当质量浓度达9 mg/mL时,Kefiran与Kefiran-G的·OH清除率分别为(48.81±1.75)%和(23.38±1.43)%。多糖中的羧基能够络合金属离子如Fe2+等,从而抑制生成·OH,而多糖中的羟基和羧基又可作为氢供体,提供氢原子与·OH反应从而清除·OH。
总还原力是评价样品抗氧化活性的重要指标,还原能力测定通过铁氰化钾还原方法测量抗氧化剂的给电子能力[22]。在质量浓度5~40 mg/mL,Kefiran的总还原力高于Kefiran-G,在质量浓度为40 mg/mL时,两者的总还原力分别达到(0.15±0.02)和(0.12±0.01)(图7-b)。
ABTS阳离子自由基是带正电荷的自由基,其清除主要原理是电子的转移[23]。当多糖的质量浓度为1~9 mg/mL,Kefiran的ABTS阳离子自由基清除率高于Kefiran-G。当质量浓度在3~5 mg/mL时,Kefiran的ABTS阳离子自由基清除率高于抗坏血酸。当质量浓度为9 mg/mL时,Kefiran与Kefiran-G的ABTS阳离子自由基清除率分别为(81.44±0.80)%和(38.34±2.53)%。

a-·OH清除活性;b-总还原力;c-ABTS阳离子自由基清除活性
图7 不同来源开菲尔胞外多糖对·OH清除活性、总还原力、ABTS阳离子自由基清除活性的影响
Fig.7 Effects of different sources on the hydroxyl radical scavenging activity, reducing power,ABTS radical scavenging activity of Kefiran
注:小写字母表示不同组间同一样品之间的显著性差异(P<0.05);大写字母表示不同样品同一组内的显著性差异(P<0.05)
结合所有抗氧化结果可知,Kefiran的抗氧化活性强于Kefiran-G,原因是由于2种胞外多糖在结构上存在差异,还可能是由于2种多糖的提取方式存在不同,提取Kefiran-G是采用了水浴加热的方式,高温可能破坏多糖结构从而影响多糖的生物活性。
3 结论
开菲尔胞外多糖是1种具有不同生物学和功能性质的益生菌胞外多糖,引起了众多研究者的关注。过去的研究主要集中于开菲尔粒中Kefiran-G的结构表征及其丰富的功能特性。本研究对比了2种原料提取的开菲尔胞外多糖在结构、理化特性及抗氧化活性上的差异。结果表明,开菲尔粒中的胞外多糖(Kefiran-G)的含量及提取率均优于开菲尔发酵乳中的胞外多糖(Kefiran),且Kefiran-G因其边缘的枝状结构以及枝状结构末端黏附的球状结构,具有良好的乳化活性和絮凝活性;Kefiran相较Kefiran-G具有良好的抗氧化活性。后期通过结构测定,进一步研究2种来源胞外多糖的构效关系,为开菲尔胞外多糖更好地用于食品和医药工业提供一定的数据基础。
[1] ROSA D D, DIAS M M S, GRZE KOWIAK
KOWIAK  M, et al.Milk Kefir:Nutritional, microbiological and health benefits[J].Nutrition Research Reviews, 2017, 30(1):82-96.
M, et al.Milk Kefir:Nutritional, microbiological and health benefits[J].Nutrition Research Reviews, 2017, 30(1):82-96.
[2] CHEN Z N, LIU T, YE T, et al.Effect of lactic acid bacteria and yeasts on the structure and fermentation properties of Tibetan kefir grains[J].International Dairy Journal, 2021, 114:104943.
[3] WANG L, GU Y C, ZHENG X Y, et al.Analysis of physicochemical properties of exopolysaccharide from Leuconostoc mesenteroides strain XR1 and its application in fermented milk[J].LWT, 2021, 146:111449.
[4] SABATINO M A, CARF PAVIA F, RIGOGLIUSO S, et al.Development of injectable and durable kefiran hydro-alcoholic gels[J].International Journal of Biological Macromolecules, 2020, 149:309-319.
PAVIA F, RIGOGLIUSO S, et al.Development of injectable and durable kefiran hydro-alcoholic gels[J].International Journal of Biological Macromolecules, 2020, 149:309-319.
[5] GHARAGHANI M, MOUSAVI M, KHODAIYAN F, et al.Octenyl succinylation of kefiran:Preparation, characterization and functional properties[J].International Journal of Biological Macromolecules, 2021, 166:1 197-1 209.
[6] WANG Y P, AHMED Z, FENG W, et al.Physicochemical properties of exopolysaccharide produced by Lactobacillus kefiranofaciens ZW3 isolated from Tibet kefir[J].International Journal of Biological Macromolecules, 2008, 43(3):283-288.
[7] HAN P P, SUN Y, WU X Y, et al.Emulsifying, flocculating, and physicochemical properties of exopolysaccharide produced by cyanobacterium Nostoc flagelliforme[J].Applied Biochemistry and Biotechnology, 2014, 172(1):36-49.
[8] VON STASZEWSKI M, PILOSOF A M R, JAGUS R J.Antioxidant and antimicrobial performance of different Argentinean green tea varieties as affected by whey proteins[J].Food Chemistry, 2011, 125(1):186-192.
[9] HAFSA J, SMACH M A, SOBEH M, et al.Antioxidant activity improvement of apples juice supplemented with chitosan-galactose Maillard reaction products[J].Molecules (Basel, Switzerland), 2019, 24(24):4557.
[10] KARIMI S, GHANBARZADEH B, ROUFEGARINEJAD L, et al.Polysaccharide extracted from Althaea officinalis L.root:New studies of structural, rheological and antioxidant properties[J].Carbohydrate Research, 2021, 510:108438.
[11] ZAJ EK K, KOLAR M, GOR
EK K, KOLAR M, GOR EK A.Characterisation of the exopolysaccharide kefiran produced by lactic acid bacteria entrapped within natural kefir grains[J].International Journal of Dairy Technology, 2011, 64(4):544-548.
EK A.Characterisation of the exopolysaccharide kefiran produced by lactic acid bacteria entrapped within natural kefir grains[J].International Journal of Dairy Technology, 2011, 64(4):544-548.
[12] SATHIYANARAYANAN G, KIRAN G S, SELVIN J.Synthesis of silver nanoparticles by polysaccharide bioflocculant produced from marine Bacillus subtilis MSBN17[J].Colloids and Surfaces B:Biointerfaces, 2013, 102:13-20.
[13] BLAND N L M, ISLAN G A, CASTRO G R, et al.Kefiran-alginate gel microspheres for oral delivery of ciprofloxacin[J].Colloids and Surfaces B:Biointerfaces, 2016, 145:706-715.
N L M, ISLAN G A, CASTRO G R, et al.Kefiran-alginate gel microspheres for oral delivery of ciprofloxacin[J].Colloids and Surfaces B:Biointerfaces, 2016, 145:706-715.
[14] WANG M, BI J.Modification of characteristics of kefiran by changing the carbon source of Lactobacillus kefiranofaciens[J].Journal of the Science of Food and Agriculture, 2008, 88(5):763-769.
[15] HAXAIRE K, MARÉCHAL Y, MILAS M, et al.Hydration of polysaccharide hyaluronan observed by IR spectrometry.I.Preliminary experiments and band assignments[J].Biopolymers, 2003, 72(1):10-20.
[16] WU Y, CUI S W, TANG J, et al.Preparation, partial characterization and bioactivity of water-soluble polysaccharides from boat-fruited Sterculia seeds[J].Carbohydrate Polymers, 2007, 70(4):437-443.
[17] WANG Y P, LI C, LIU P, et al.Physical characterization of exopolysaccharide produced by Lactobacillus plantarum KF5 isolated from Tibet Kefir[J].Carbohydrate Polymers, 2010, 82(3):895-903.
[18] HAN Y Z, LIU E Q, LIU L S, et al.Rheological, emulsifying and thermostability properties of two exopolysaccharides produced by Bacillus amyloliquefaciens LPL061[J].Carbohydrate Polymers, 2015, 115:230-237.
[19] MANNINA P, SEGALE L, GIOVANNELLI L, et al.Self-emulsifying excipient platform for improving technological properties of alginate-hydroxypropylcellulose pellets[J].International Journal of Pharmaceutics, 2016, 499(1-2):74-80.
[20] 申博玲. 南极海冰细菌Pseudoalteromonas sp.Bsi20310胞外多糖的助凝和吸附性能研究[D].济南:山东大学, 2010.
SHEN B L.Coagulation enhancement and adsorption properties of exopolysaccharide secreted by Antarctica Sea-ice bacterium Pseudoalteromonas sp.Bsi20310[D].Jinan:Shandong University, 2010.
[21] LIN D R, LONG X M, HUANG Y C, et al.Effects of microbial fermentation and microwave treatment on the composition, structural characteristics, and functional properties of modified okara dietary fiber[J].LWT, 2020, 123:109059.
[22] LI C, CHEN S L, SHA J, et al.Extraction and purification of total flavonoids from Eupatorium lindleyanum DC.and evaluation of their antioxidant and enzyme inhibitory activities[J].Food Science & Nutrition, 2021, 9(5):2 349-2 363.
[23] CAO M, WANG S L, GAO Y M, et al.Study on physicochemical properties and antioxidant activity of polysaccharides from Desmodesmus armatus[J].Journal of Food Biochemistry, 2020, 44(7):e13243.