干酪水分含量高,营养价值丰富,在贮藏期间表面易受霉菌、酵母菌和细菌的污染,影响其物理、感官和化学特性,降低干酪的质量[1]。目前干酪采用的聚乙烯、聚酰胺等包装材料是不可生物降解和不可食用的,会导致严重的生态问题,在这种情况下,以生物聚合物(如多糖)、天然脂质等为主要材料,辅以天然来源(抗菌肽、纳他霉素和溶菌酶等)的抑菌剂制备的可食性抑菌膜成为了新活性包装材料的替代来源[2]。DIVSALAR等[3]研究表明,使用负载乳酸链球菌素的纤维素-壳聚糖-氧化锌纳米复合膜对干酪进行涂膜处理,可以抑制干酪表面微生物的生长。
壳聚糖是一种阳离子多糖,从甲壳类或真菌中获得。由于其良好的成膜性能和可生物降解性,被广泛应用于食品包装材料,将其与抑菌成分复配可提高抑菌膜的抗菌活性[4]。明胶是胶原的部分水解产物,具有良好的生物相容性和可降解性,但明胶膜具有较差的机械性能。抗菌肽是一类由乳酸菌分泌的对腐败菌或病原菌具有抑制活性的多肽,具有良好的生物安全性及抑真菌活性,可抑制腐败真菌的生长和延长食品的货架期[5]。有关乳酸菌源抗菌肽和多糖复配对干酪保鲜的研究尚未见报道。本课题组通过前期的大量工作,从内蒙古传统发酵食品中分离筛选出1株具优良特性的乳杆菌,其分泌的抗真菌肽对工业常见致腐或致病性酵母、霉菌具有良好的杀菌活性,具有广谱抗真菌特性且物理性质稳定[6]。因此,本研究制备壳聚糖-明胶复合膜,并添加抗菌肽制备抑菌膜,以提高其机械性能及抑菌效果。通过研究抑菌膜对干酪贮藏期间品质的影响,揭示其对干酪的保鲜效果,为可食性干酪包装材料进一步开发提供理论参考。
1 材料与方法
1.1 材料与设备
再制干酪(水分含量55.25%),市售;壳聚糖(脱乙酰度>95%),北京酷来搏科技有限公司;明胶(冻力250 g,食品级),浙江一诺生物科技有限公司;丙三醇(含量≥99.0%)、冰乙酸,天津市鑫铂特化工有限公司;MRS肉汤、葡萄糖、酵母提取粉、大豆蛋白胨、孟加拉红选择培养基,广州环凯生物试剂有限公司;葡聚糖凝胶G-100,北京索莱宝科技有限公司。
白假丝酵母(Candida albicans)、大肠杆菌(Escherichia coli)ATCC 11775-3、金黄色葡萄球菌(Staphylococcus aureus)CMCC 26003-3,中国普通微生物菌种保藏管理中心;乳杆菌ALCA-4,分离自内蒙古传统发酵食品,于本实验室保存。
26 mm×50 cm凝胶过滤色谱柱,北京瑞达恒辉科技发展有限公司;MYP11-2A磁力搅拌器,上海梅颖浦仪器仪表制造有限公司;DHG-9240A鼓风干燥箱、GHP-9080恒温培养箱,上海一恒科技仪器有限公司;XLW-EC拉伸强度仪,济南兰光机电技术有限公司;Konica CR-10分光测色仪,日本柯尼卡美能达光电股份有限公司;TA-XT plus质构仪,英国SMS公司。
1.2 抗菌肽粉的制备
将4.0%(体积分数)乳酸菌在MRS培养基中置于37 ℃恒温培养箱培养24 h,发酵液通过6 000×g离心20 min,所得上清液抽滤过0.22 μm滤膜,将滤液质量浓度调节为50 μg/mL作为上样样品,参照赵洁[7]的方法,使用凝胶过滤色谱柱对抗菌肽进行初步纯化,以白假丝酵母菌作为指示菌株,测定其抑菌活性。将有抑菌性的粗提液收集,用5 kDa超滤离心管浓缩(4 000×g,30 min),经冷冻干燥处理获得抗菌肽粉,备用。
1.3 壳聚糖复合膜制备
根据前期单因素试验分析可知,壳聚糖、明胶及甘油的体积分数对壳聚糖复合膜的性能影响较大。因此,本试验在单因素试验的基础上,对影响壳聚糖复合膜成膜工艺效果的因素进行正交试验,优化成膜工艺条件。所选因素水平见表1。
表1 L9(34)正交试验因素水平表
Table 1 L9(34) Orthogonal test factors and levels
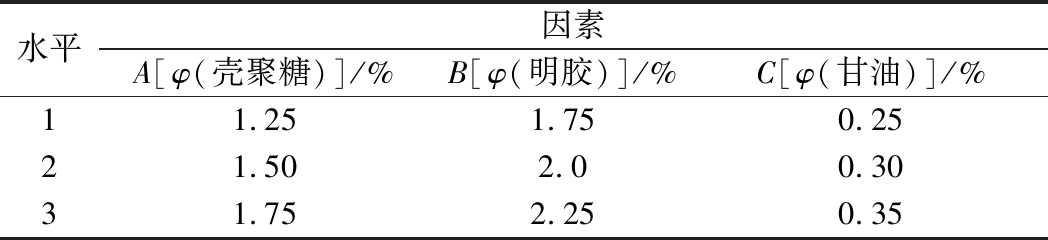
水平因素A[φ(壳聚糖)]/%B[φ(明胶)]/%C[φ(甘油)]/%11.251.750.2521.502.00.3031.752.250.35
1.4 最小抑菌浓度(minimal inhibitory concentration,MIC)
以白假丝酵母菌作为指示菌,采用二倍稀释法[8]对抑菌膜液的最小抑菌浓度进行测定。
1.5 抑菌膜制备
选取浓度为2×MIC抗菌肽添加到壳聚糖复合膜液中,制备抗菌肽抑菌复合膜液。于60 ℃用磁力搅拌器搅拌1 h,静置 30 min,不断搅拌至膜液完全溶解,形成均匀、透明的膜液,在室温下静置脱泡后制得复合膜液。取复合膜液倒入干燥玻璃模具中,在50 ℃条件下置于鼓风干燥箱,冷却后将干燥复合膜揭下,置于相对湿度约65%的恒温恒湿箱中,25 ℃平衡至少48 h,备用。
1.6 抑菌膜特性研究
1.6.1 抗菌活性测定
采用双层琼脂平板扩散法测定复合膜的抑菌性。在酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)培养基表面均匀涂布100 μL培养至对数期的指示菌菌悬液(白假丝酵母菌、金黄色葡萄球菌和大肠杆菌菌悬液)(约106 CFU/mL),维持15 min后,将200 μL膜液打入涂布菌液的固体培养基的牛津孔内。置于30 ℃恒温培养箱中培养24 h,测定抑菌圈直径。
1.6.2 机械性能测定
参照GB/T 1040.3—2006《塑料 拉伸性能的测定 第3部分:薄塑和薄片的试验条件》,采用拉伸强度仪进行测试。夹具间距50 mm,拉伸速度50 mm/min。每组膜样重复测定3次,取平均值。
1.7 复合膜对干酪保鲜效果评价
在无菌条件将干酪切片(1.5 mm×20 mm×23 mm),在紫外线下照射10 min进行表面杀菌处理[9]。用制备好的抑菌膜进行包装,然后置于(25±1)℃贮藏。未加入抗菌肽的壳聚糖复合膜作为阴性对照,每组处理3个样取平均值。每2 d取样1次,测定指标。
1.7.1 指标测定
1.7.1.1 水分含量
参照GB 5009.3—2016《食品安全国家标准 食品中水分的测定 直接干燥法》测定。每组样品平行测定3次取平均值。
1.7.1.2 色度
采用分光测色仪测定贮藏过程中抑菌膜包装干酪样品的L*(亮度)、b*(蓝-黄)值。测定之前,先使用标准白板校正,重复3次,求平均值。
1.7.1.3 质构特性
采用质构仪测定。测定时,测前、测中及测后速度均为 1.00 mm/s,下压距离为 10 mm,间隔时间10 s,压缩百分比为 75%,触发力0.005 kg,探头类型为P/36 R。每组样品重复测定3次,求平均值。
1.7.1.4 菌落总数
参照GB 4789.2—2016 《食品安全国家标准 食品微生物学检验 菌落总数测定》进行测定。
1.7.1.5 霉菌、酵母菌总数
参照GB 4789.15—2016 《食品安全国家标准 食品微生物学检验 霉菌和酵母计数》进行测定。
1.8 数据处理
采用SPSS 19.0软件对数据进行Duncan单因素方差分析,当P<0.05时,表示具有显著性差异。并采用Origin Pro 2019软件作图。
2 结果与分析
2.1 正交试验优化壳聚糖复合膜的成膜工艺
前期单因素试验研究表明,对膜的机械性能影响较大的因素为壳聚糖浓度、明胶浓度和甘油浓度,且其浓度分别为1.5%、2.0%、0.3%时机械性能较好。在此基础上设计L9(34)正交试验,测定其机械性能,结果如表2所示。
表2 壳聚糖复合膜成膜工艺正交试验设计及结果
Table 2 Design and results of orthogonal test design of chitosan composite film
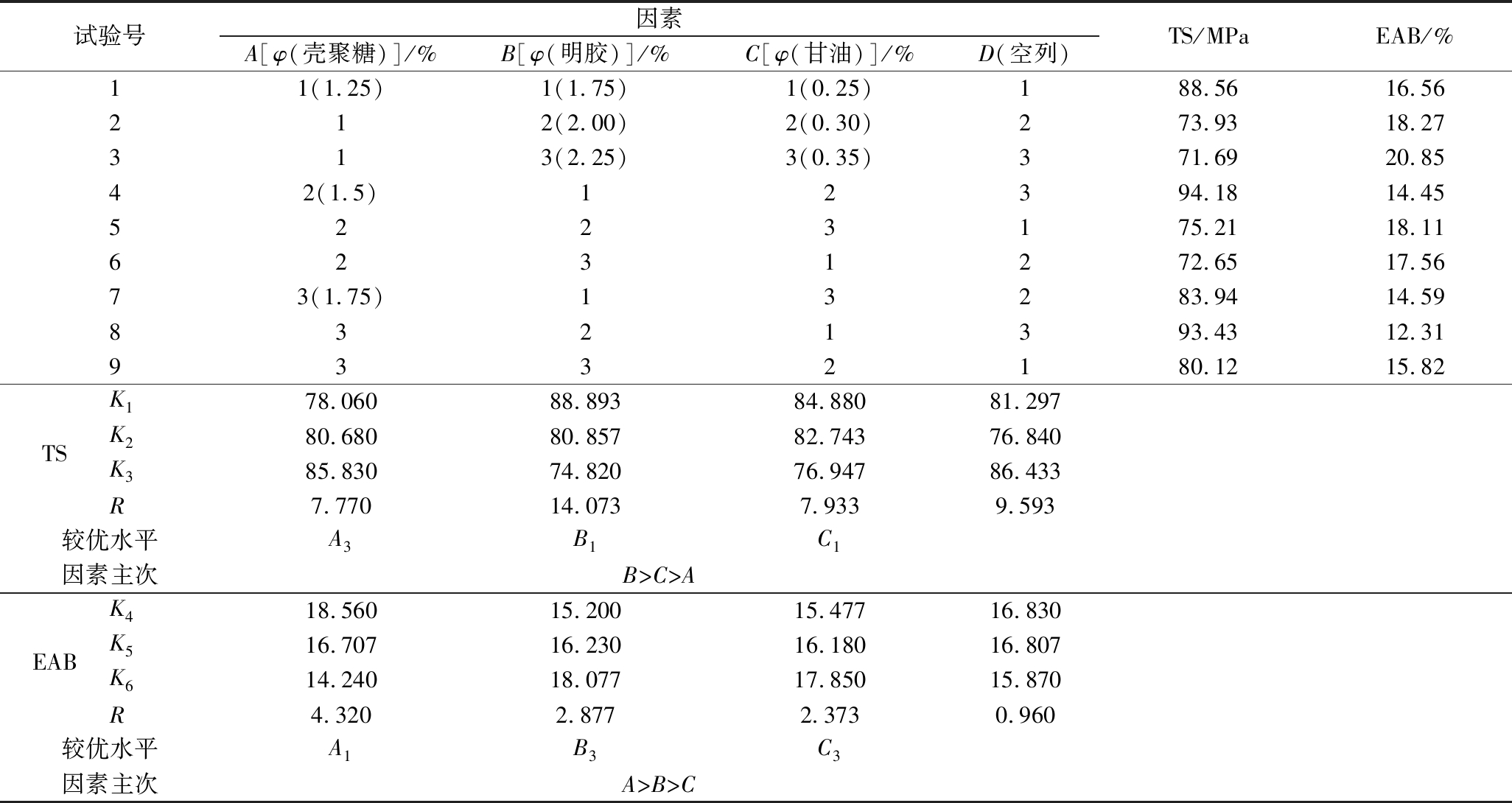
试验号因素A[φ(壳聚糖)]/%B[φ(明胶)]/%C[φ(甘油)]/%D(空列)TS/MPaEAB/%11(1.25)1(1.75)1(0.25)188.5616.56212(2.00)2(0.30)273.9318.27313(2.25)3(0.35)371.6920.8542(1.5)12394.1814.455223175.2118.116231272.6517.5673(1.75)13283.9414.598321393.4312.319332180.1215.82TSK178.06088.89384.88081.297K280.68080.85782.74376.840K385.83074.82076.94786.433R7.77014.0737.9339.593 较优水平A3B1C1 因素主次B>C>AEABK418.56015.20015.47716.830K516.70716.23016.18016.807K614.24018.07717.85015.870R4.3202.8772.3730.960 较优水平A1B3C3 因素主次A>B>C
注:TS,拉伸强度(tensile strength);EAB,断裂伸长率(elongation break)
从表2极差(R)分析结果可以看出,以拉伸强度为考察指标,可以确定各因素对复合膜性能影响的主次顺序分别为:RB>RC>RA,即明胶含量对复合膜的拉伸强度影响最大,最大极差为14.073,甘油含量影响性能次之,影响性能最小的是壳聚糖含量;此时较优组合为A3B1C1,即φ(壳聚糖)为1.75%,φ(明胶)为1.75%,φ(甘油)为0.25%。
以断裂伸长率为考察指标,影响复合膜性能的各因素主次顺序为RA>RB>RC,即壳聚糖含量对复合膜的断裂伸长率影响最大,最大极差为4.320,明胶含量影响性能次之,影响性能最小的是甘油含量;此时较优组合为A1B3C3,即φ(壳聚糖)为1.25%,φ(明胶)为2.25%,φ(甘油)为0.35%。
不同的考察指标中,对复合膜性能的各影响因素的主次顺序各有不同。比较R值大小可知,B对拉伸强度的影响更为显著,因此选取拉伸强度中B因素的较优水平为1.75%;对于断裂伸长率这个评价指标,A的影响最显著,因此选取断裂伸长率中A因素的较优水平为1.25%。对于拉伸强度来说,φ(甘油)=0.25%,而对于断裂伸长率而言,φ(甘油)=0.35%,发现甘油体积分数在两个评价指标中各不相同,因此选取中间值0.3%。综上考虑得出最优成膜工艺组合为A1B1C2。
极差分析结合方差分析得出,试验的较优条件为A1B1C2,即φ(壳聚糖)1.25%,φ(明胶)1.75%,φ(甘油)0.3%。以此条件制备的复合膜的性能拉伸强度为(70.69±0.50) MPa、断裂伸长率为(12.69±0.12)%。方差分析结果如表3和表4所示。F检验结果表明,壳聚糖、明胶和甘油含量对壳聚糖复合膜的机械性能的影响均有显著性差异(P<0.05)。
表3 拉伸强度方差分析表
Table 3 Variance analysis of the tensile strength
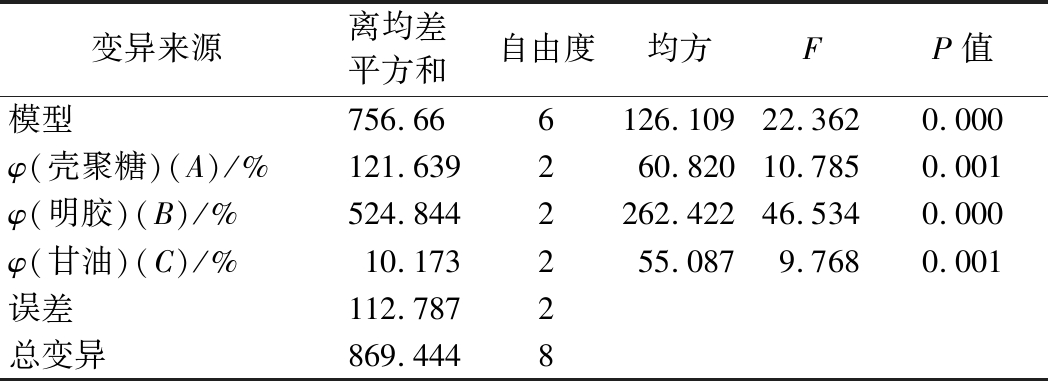
变异来源离均差平方和自由度均方FP值模型756.666126.10922.3620.000φ(壳聚糖)(A)/%121.639260.82010.7850.001φ(明胶)(B)/%524.8442262.42246.5340.000φ(甘油)(C)/%10.173255.0879.7680.001误差112.7872总变异869.4448
注:P<0.05,表示差异显著(下同)
表4 断裂伸长率方差分析表
Table 4 Variance analysis of elongation at break

变异来源离均差平方和自由度均方FP值模型149.533624.92258.6610.000φ(壳聚糖)(A)/%84.545242.27399.4990.001φ(明胶)(B)/%38.239219.11945.0020.000φ(甘油)(C)/%26.749213.37431.4800.001误差8.4972总变异158.0308
2.2 抑菌膜最小抑菌浓度测定
采用二倍稀释法在96孔板上测定抑菌膜对白假丝酵母菌的MIC。30 ℃培养24 h后,在膜液质量浓度≥160 mg/mL的孔中没有观察到孔板中长出白色菌丝,因此,最小抑菌质量浓度为160 mg/mL。
2.3 抑菌膜的特性研究
2.3.1 抑菌膜的抑菌活性
在复合膜液中加入2×MIC抗菌肽制备抑菌膜,以白假丝酵母菌、金黄色葡萄球菌和大肠杆菌作为指示菌研究了其抑菌效果。由表5可知,与复合膜相比,抑菌膜具有良好的抑菌活性,且抑菌效果具有显著性差异(P<0.05)。段星星等[10]将抗菌肽添加至明胶中制备可食性抑菌薄膜并研究其抑菌作用,结果也发现加入抗菌肽后薄膜的抑菌效果明显增强。
表5 抑菌膜的抗菌活性
Table 5 Antimicrobial activity of antimicrobial peptides films
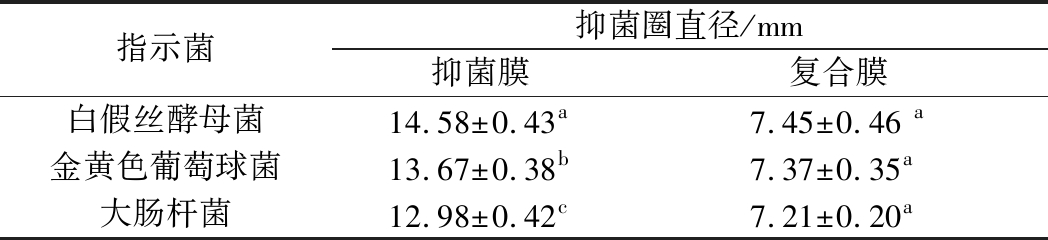
指示菌抑菌圈直径/mm抑菌膜复合膜白假丝酵母菌14.58±0.43a7.45±0.46 a金黄色葡萄球菌13.67±0.38b7.37±0.35a大肠杆菌12.98±0.42c7.21±0.20a
注:同一列中含有不同字母的表示差异显著(P<0.05)(下同)
2.3.2 抑菌膜的机械性能
与复合膜相比,加入2×MIC抗菌肽后膜的拉伸强度和断裂伸长率增大(表6)。根据前期红外光谱分析表明,随着抗菌肽的添加,抑菌膜中含有亲水性氨基酸残基和羟基,使其保水性增加。BAGDE 等[11]以玉米淀粉为原料,添加细菌素作为抗菌增强添加剂来制备抗菌膜,结果表明细菌素的加入显著提高了淀粉膜的拉伸强度和抑菌活性。
表6 抗菌肽对抑菌膜机械性能的影响
Table 6 Antimicrobial peptides on mechanical properties of antimicrobial films
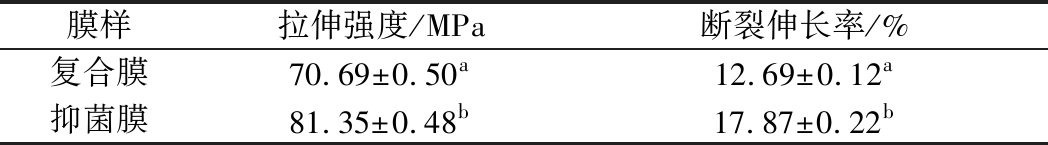
膜样拉伸强度/MPa断裂伸长率/%复合膜70.69±0.50a12.69±0.12a抑菌膜81.35±0.48b17.87±0.22b
2.4 抑菌膜包装对干酪品质指标的影响
2.4.1 干酪贮藏期间水分含量的变化
干酪贮藏期间,水分损失与贮藏环境的水分相对湿度有关,还与包装材料对水分的渗透性、包装的完整性、密封性、贮藏温度和包装方式有关[12]。定期分别测定不同包装干酪的水分含量。由图1可以看出,2组包装的干酪在贮藏前期水分含量上升,7 d到达最高,然后开始下降。复合膜处理组水分下降的幅度较抑菌膜组小,有显著性的差异(P<0.05)。贮藏过程中水分的散失主要是微生物活动所需和水分透过包装材料蒸发流失引起的[13]。抑菌膜组相对于复合膜组水分下降得较快,说明抑菌膜的隔水性较差。在贮藏15 d时,抑菌膜包装干酪的水分含量由最初的(55.25±2.59)%降至(32.89±1.64)%,下降了22.36%。因此,在后期试验中应充分考虑抑菌膜的隔水性能,以防止水分的散失。
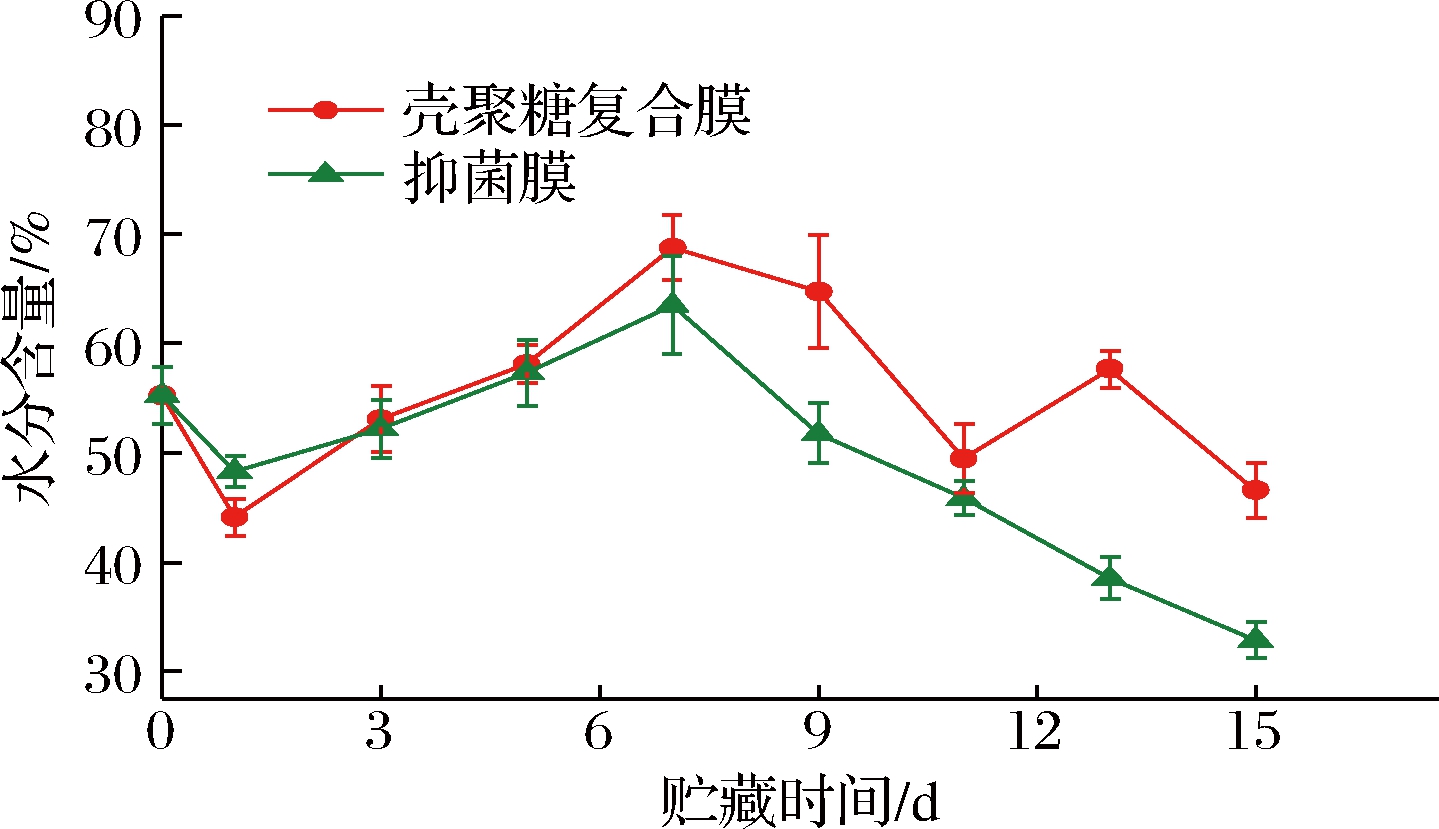
图1 不同膜包装对干酪水分含量的影响
Fig.1 Effect of different film packaging on water content of cheese
2.4.2 干酪贮藏期间色泽的变化
颜色是评价干酪质量的重要参数。L*值反映干酪颜色变化,L*值越大,表示褐变程度越轻,样品越接近白色[13]。如图2-a所示,2种膜处理组的L*值都随着时间的延长而降低,这是因为随着时间的增加,干酪表面微生物逐渐开始生长繁殖,从而会导致L*的下降[14]。而抑菌膜组下降速度较慢,说明其表面微生物生长较慢。b*值的微小变化是评价干酪没有发生氧化褐变的良好指标[15]。如图2-b所示,复合膜处理组的b*值先增大后减小,这可能是由于干酪表面脂肪大量析出。贮藏9 d后,干酪的b*值开始降低,可能是由于干酪表面的霉菌等腐败菌开始生长。而抑菌膜处理组随着时间的增加,先降低后缓慢增加。在贮藏第11天时,抑菌膜的b*值高达17.9±0.57,可能是随着贮藏时间的延长,抗菌肽通过扩散作用与干酪表面接触或者释放到干酪中,使其表面呈现黄色。而由于抑菌膜具有较强的抗菌作用,抑制了干酪表面有害微生物的生长,使其后期b*值增加。LU等[16]采用静电自组装制备的亚麻籽胶-壳聚糖抑菌膜用于蒙古干酪的保鲜时,干酪的L*值随着时间的推移而降低,而b*值先降低后增加,这与本研究结果一致。
2.4.3 干酪贮藏期间质构特性的变化
干酪的质地不仅是影响消费者购买的重要参数,而且也反映了其微观结构[17]。硬度一般反映干酪表面蛋白质网络结构的稳定性,咀嚼性反映食物被咀嚼到吞咽状态所需要的能量,咀嚼性用黏聚力、硬度和弹性的乘积表示,为咀嚼固体食物所需的能量,咀嚼性反应干酪对咀嚼的持续抵抗性[18]。由图3-a可知,在整个贮藏过程中,2组干酪的硬度均有显著提高(P<0.05)。在贮藏11 d时,抑菌膜组的上升趋势最为显著(P<0.05),说明此时干酪对变形抵抗最大,且其硬度由开始的(1 959.62±294.58) g升高至(4 426.36±272.25) g,由此可知,贮藏后期抑菌膜组的水分流失比较严重,使其硬度增加。MAHCENE等[19]研究表明,海藻酸钠生物膜包装干酪在贮藏过程中所有处理组干酪的硬度都显著增加(P<0.05)。

a-L*值;b-b*值
图2 不同膜包装对干酪L*、b*值的影响
Fig.2 Effect of different film packaging on L*, b* value of cheese
随着贮藏时间的增加,弹性不具有显著性的差异(图3-b),但是在第7天抑菌膜组的弹性显著增加,这可能是因为贮藏过程中随着脂肪球的降解,酪蛋白的网状结构变得宽松,使得干酪的弹性增加[20]。在第13天时,抑菌膜组的弹性有显著性的差异(P<0.05),这可能是由于硬度的增加,使其弹性减弱。由图3-c可知,贮藏过程中2组干酪的咀嚼性呈先升高后降低的趋势,这是因为随着成熟期的延长,干酪质地变得坚硬而易碎,使得咀嚼性下降。在贮藏过程中,干酪硬度和咀嚼性的升高可能与其较低的水分含量和紧凑的结构有关[21]。

a-硬度;b-弹性;c-咀嚼性
图3 不同膜包装对干酪质构特性的影响
Fig.3 Effect of different film packaging on texture characteristics of cheese
2.4.4 干酪贮藏期间菌落总数和霉菌、酵母菌总数的变化
随着贮藏时间的增加,干酪中微生物数量增加趋势如图4所示。复合膜处理组干酪的菌落总数和霉菌酵母总数上升速率快,显著高于抑菌膜组(P<0.05)。在第7天时(图4-a),其菌落总数为(5.11±0.05) lg CFU/mL,而抑菌膜组为(3.91±0.03) lg CFU/mL,具有显著性差异(P<0.05),由图4-b可知,在第7天时,抑菌膜组的霉菌酵母菌总数为(3.83±0.02) lg CFU/mL,显著低于复合膜处理组的(5.13±0.10) lg CFU/mL。且在11 d时抑菌膜组的细菌总数和霉菌酵母总数为(4.36±0.05)、(4.51±0.10) lg CFU/mL,低于第7天时的复合膜组的数值。由此可知,采用抑菌膜包装干酪能减缓在贮藏期间干酪中菌落总数和霉菌、酵母菌总数的增加。抑菌膜组干酪的菌落总数和霉菌、酵母菌总数在贮藏前、中期不断升高,之后开始缓慢下降,这可能是由于抗菌肽发挥了良好的抑菌效果,有效地抑制了腐败菌的生长代谢。曹志军等[22]研究发现,在壳聚糖复合膜中添加纳他霉素和溶菌酶制备的天然抑菌膜对Cheddar干酪具有良好的抗菌保鲜性。SILVA等[23]研究表明,添加具有抑制细菌作用的乳酸菌的海藻酸盐涂层抑制了干酪贮藏过程中腐败菌的生长。LIM等[24]在葡萄柚籽提取物与聚己二酸丁二醇酯中添加产细菌素乳酸菌制备包装膜,发现其可抑制干酪中单增李斯特菌的生长。与这些研究相比,本研究在壳聚糖复合膜中添加乳源抗真菌肽制备的抑菌膜能更有效地抑制干酪中腐败真菌的生长。
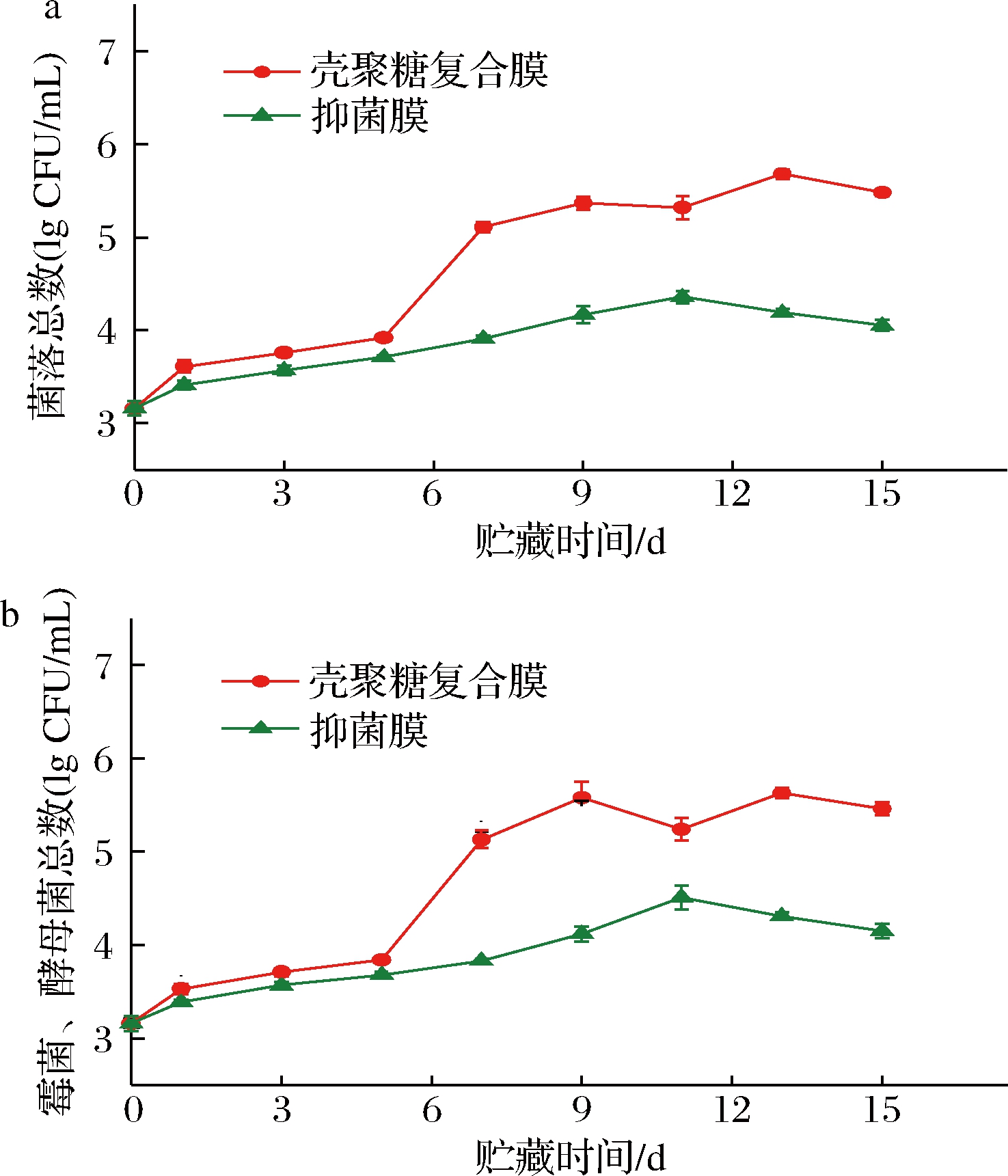
a-菌落总数;b-霉菌、酵母菌总数
图4 不同膜包装对干酪菌落总数和霉菌、酵母菌总数的影响
Fig.4 Effect of different film packaging on total amount of colonies, total amount of molds and yeasts in cheese
3 结论
本研究首先确定了壳聚糖复合膜的最优成膜条件:壳聚糖体积分数1.25%,明胶1.75%,甘油0.3%。然后添加抗菌肽制备了抑菌膜,发现2×MIC的抗菌肽的添加有助于提高抑菌膜的机械性能和抑菌性能。抑菌膜的拉伸强度和断裂伸长率分别为(81.35±0.48) MPa和(17.87±0.22)%。抑菌试验表明,抑菌膜对于大肠杆菌、金黄色葡萄球菌及白假丝酵母具有良好的抑菌活性,其抑菌效果与复合膜相比具有显著性差异(P<0.05)。将抑菌膜对干酪进行包膜贮藏试验,结果发现在贮藏期间,抑菌膜组水分含量下降的较快,说明抑菌膜的隔水性较差,因此,在后期试验中应充分考虑抑菌膜的隔水性能,以防止干酪中水分蒸发。此外,两种膜处理的L*值都随着时间的延长而降低,而抑菌膜处理组的b*值先降低后缓慢增加。两组膜处理干酪的硬度均随着时间的增加而显著增加(P<0.05),咀嚼性降低。且采用抑菌膜包装干酪能减缓在贮藏期间干酪中菌落总数和霉菌、酵母菌总数的增加。综上所述,使用具有生物活性的多糖与抗菌肽制备抑菌膜对再制干酪贮藏期间表面腐败菌的生长具有抑制作用。目前,将抗菌肽与多糖复配制备的抑菌膜应用于干酪包装的研究还较少,因此,本研究为进一步开展抑菌膜在食品包装和保鲜等方面的研究奠定了基础。
[1] COSTA M J, MACIEL L C, TEIXEIRA J A, et al.Use of edible films and coatings in cheese preservation:Opportunities and challenges[J].Food Research International, 2018, 107:84-92.
[2] WANG L Q, CAMPANELLA O, PATEL B, et al.Rheological properties of film-forming solutions and mechanical properties of edible composite films based on sodium alginate, sodium carboxymethyl cellulose and gelatin[J].Journal of Biobased Materials and Bioenergy, 2018, 12(1):28-33.
[3] DIVSALAR E, TAJIK H, MORADI M, et al.Characterization of cellulosic paper coated with chitosan-zinc oxide nanocomposite containing nisin and its application in packaging of UF cheese[J].International Journal of Biological Macromolecules, 2018, 109:1 311-1 318.
[4] 周文艺, 蔡文韬, 吴泽玲, 等.植物精油壳聚糖基活性包装膜的制备及保鲜效果研究[J/OL].食品与发酵工业, 2022, 1-12.DOI:10.13995/j.cnki.11-1802/ts.029563.
ZHOU W Y, CAI W T, WU Z L, et al.Study on preparation and fresh-keeping effect of chitosan-based active packaging film of plant essential oil[J/OL].Food and Fermentation Industries, 2022, 1-12.DOI:10.13995/j.cnki.11-1802/ts.029563.
[5] MUHIALDIN B J, ALGBOORY H L, KADUM H, et al.Antifungal activity determination for the peptides generated by Lactobacillus plantarum TE10 against Aspergillus flavus in maize seeds[J].Food Control, 2020, 109:106898.
[6] CHEN Z J, LI X T, GAO H C.Production of proteinaceous antifungal substances from Lactobacillus plantarum ALAC-4 isolated from Inner Mongolian traditional fermented dairy food[J].International Journal of Dairy Technology, 2017, 71:223-229.
[7] 赵洁. 具有抑真菌特性的乳杆菌产抑菌物质的纯化及应用研究[D].呼和浩特:内蒙古农业大学,2018.
ZHAO J.Purification and application of antifungal metabolites from Lactobacillus[D].Hohhot:Inner Mongolia Agricultural University, 2018.
[8] 蒋梦曦, 林福兴, 别小妹, 等.Iturin A与肉桂精油复配提升樱桃番茄贮藏品质[J].食品与发酵工业, 2019, 45(19):206-212.
JIANG M X, LIN F X, BIE X M, et al.Effects of iturin A compounded with cinnamon essential oil on storage quality of cherry tomatoes[J].Food and Fermentation Industries, 2019, 45(19):206-212.
[9] LEE K Y, YANG H J, SONG K B.Application of a puffer fish skin gelatin film containing Moringa oleifera Lam.leaf extract to the packaging of Gouda cheese[J].Journal of Food Science and Technology, 2016, 53(11):3 876-3 883.
[10] 段星星, 段杉, 罗慧芬, 等.可食性抗菌肽-明胶复合膜的制备及性能表征[J].现代食品科技, 2019, 35(4):140-147;272.
DUAN X X, DUAN S, LUO H F, et al.Preparation and characterization of edible antibacterial peptide-gelatin composite films[J].Modern Food Science and Technology, 2019, 35(4):140-147;272.
[11] BAGDE P, NADANATHANGAM V.Mechanical, antibacterial and biodegradable properties of starch film containing bacteriocin immobilized crystalline nanocellulose[J].Carbohydrate Polymers, 2019, 222:115021.
[12] 刘会平, 宗学醒, 郭林海, 等.不同包装材料对贮藏期Mozzarella干酪功能特性的影响[J].中国乳品工业, 2009, 37(3):30-34.
LIU H P, ZONG X X, GUO L H, et al.Study on extending storage of Mozzarella cheese packed in various materials[J].China Dairy Industry, 2009, 37(3):30-34.
[13] 钱磊, 张业尼, 李涛, 等.羧甲基壳聚糖与滑菇肽对杏鲍菇保鲜效果研究[J].食品与发酵工业, 2019, 45(18):168-175.
QIAN L, ZHANG Y N, LI T, et al.Study on effects of carboxymethyl chitosan and Pholiota nameko peptides on fresh keeping of Pleurotus eryngii[J].Food and Fermentation Industries, 2019, 45(18):168-175.
[14] BERM DEZ-AGUIRRE D, BARBOSA-C
DEZ-AGUIRRE D, BARBOSA-C NOVAS G V.Processing of soft hispanic cheese (“queso fresco”) using thermo-sonicated milk:A study of physicochemical characteristics and storage life[J].Journal of Food Science, 2010, 75(9):S548-S558.
NOVAS G V.Processing of soft hispanic cheese (“queso fresco”) using thermo-sonicated milk:A study of physicochemical characteristics and storage life[J].Journal of Food Science, 2010, 75(9):S548-S558.
[15] BRASIL I M, GOMES C, PUERTA-GOMEZ A, et al.Polysaccharide-based multilayered antimicrobial edible coating enhances quality of fresh-cut Papaya[J].LWT-Food Science and Technology, 2012, 47(1):39-45.
[16] LU Z Y, SALDA A M D A, JIN Z M, et al.Layer-by-layer electrostatic self-assembled coatings based on flaxseed gum and chitosan for Mongolian cheese preservation[J].Innovative Food Science & Emerging Technologies, 2021, 73:102785.
A M D A, JIN Z M, et al.Layer-by-layer electrostatic self-assembled coatings based on flaxseed gum and chitosan for Mongolian cheese preservation[J].Innovative Food Science & Emerging Technologies, 2021, 73:102785.
[17] LEE M R.Objective measurements of textural and rheological properties of cheese[J].Journal of Milk Science and Biotechnology, 2018, 36(2):73-80.
[18] 杨述, 高昕, 许加超, 等.不同硬度奶酪的质构及流变特性比较[J].食品科学, 2010, 31(21):50-53.
YANG S, GAO X, XU J C, et al.Comparison of cheese samples with different hardness in texture and rheological properties[J].Food Science, 2010, 31(21):50-53.
[19] MAHCENE Z, KHELIL A, HASNI S, et al.Home-made cheese preservation using sodium alginate based on edible film incorporating essential oils[J].Journal of Food Science and Technology, 2021, 58(6):2 406-2 419.
[20] KARAMI M, EHSANI M R, MOUSAVI S M, et al.Changes in the rheological properties of Iranian UF-Feta cheese during ripening[J].Food Chemistry, 2009, 112(3):539-544.
[21] YOUSSEF A M, EL-SAYED S M, SALAMA H H, et al.Evaluation of bionanocomposites as packaging material on properties of soft white cheese during storage period[J].Carbohydrate Polymers, 2015, 132:274-285.
[22] 曹志军, 李洵洲, 刘敏, 等.复合天然抑菌膜对Cheddar干酪的保鲜效果[J].食品工业科技, 2017, 38(18):226-231.
CAO Z J, LI X Z, LIU M, et al.The preservation effect of composite natural antibacterial film on Cheddar cheese[J].Science and Technology of Food Industry, 2017, 38(18):226-231.
[23] SILVA S P M, RIBEIRO S C, TEIXEIRA J A, et al.Application of an alginate-based edible coating with bacteriocin-producing Lactococcus strains in fresh cheese preservation[J].LWT, 2022, 153:112486.
[24] LIM J Y, LEE C L, KIM G H, et al.Using lactic acid bacteria and packaging with grapefruit seed extract for controlling Listeria monocytogenes growth in fresh soft cheese[J].Journal of Dairy Science, 2020, 103(10):8 761-8 770.