静电纺丝技术是一种利用静电场力作用高分子聚合物制备纳米级和微米级纤维的技术,因操作简单、成本低、非热技术而广为食品领域所接受。目前,已有大量研究通过该技术以蛋白质和多糖为聚合物基质制备纳米纤维,包封类胡萝卜素、维生素、矿物质、植物甾醇、多不饱和脂肪酸、精油等生物活性成分[1]。MAFTOONAZAD等[2]利用豌豆分离蛋白-聚乙烯醇负载肉桂醛应用于抗菌垫料,所得纳米纤维结构稳定均匀,同时负载1%肉桂醛的纳米纤维对革兰氏阳性菌和革兰氏阴性菌具有显著抑制作用。李娟等[3]采用静电纺丝技术制备负载百里香酚的玉米醇溶蛋白/阿拉伯胶纳米纤维抗菌膜,玉米醇溶蛋白与百里香酚质量比为5∶1时,纳米纤维微观结构良好,具有良好的疏水性与缓释性。然而研究表明基于传统静电纺丝设备制备纤维的产率较低,特别是针对一些天然高分子物质,通常流速不超过2 mL/h,浓度低于35%[4]。由此,WU等[5]提出气流辅助能有效提升静电纺丝效率,主要是在传统静电纺丝设备基础上,增添供气系统并优化喷头结构。电纺效率的提高是由于聚合物在气流与静电力的共同作用下,加速拉伸分裂,迅速向接收器偏移。
肉桂醛是从肉桂精油中提取的常见挥发性醛类生物活性物质,能够抑制微生物的生长繁殖,被称为天然抑菌剂。已被美国食品药品监督管理局(Food and Drug Administration)归类为一般公认安全(Generally Recognized as Safe,GRAS)[6]。然而其应用受限于易挥发、疏水、不良气味等特性。课题组前期研究表明明胶/玉米醇溶蛋白质量比为1∶1时纳米纤维形貌结构稳定、机械性能、润湿性能较好[7]。本文选用该比例作为负载肉桂醛的纳米纤维体系,以研究不同浓度肉桂醛对气体辅助静电纺丝纳米纤维微观形貌和宏观性质及生物活性的影响。
1 材料与方法
1.1 材料与仪器
肉桂醛、明胶、分析纯乙酸,阿拉丁试剂(上海)有限公司;玉米醇溶蛋白(Z3625)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,4,6-三吡啶基三嗪(2,4,6-tris(2-pyridyl)-s-triazine,TPTZ),Sigma-Aldrich公司;大肠杆菌 ATCC 25922、金黄色葡萄球菌 CMCC(B)26003,北京生物保藏中心。其他试剂均来自国药集团化学试剂有限公司。
JDF05型静电纺丝机,长沙纳仪仪器科技有限公司;无油空气压缩机,台州市奥突斯工贸有限公司;SU-8010扫描电子显微镜,日本日立公司;DR-508A电脑试验拉力机,东莞市东日仪器有限公司;STA449F3DSC/TG同步热分析仪,德国NETZSCHN;傅里叶红外光谱仪,BRUKER光谱仪器公司;高压蒸汽灭菌锅,上海申安医疗器械厂;超净工作台,上海沪净医疗器械有限公司;BSA124S电子天平,赛多利斯科学仪器有限公司;Infinite 200 PRO酶标仪,瑞士Tecan;电热恒温培养箱,上海新苗医疗器械制造有限公司。
1.2 溶液配制和纳米纤维制备
1.2.1 溶液配制
将150 g/L明胶,150 g/L玉米醇溶蛋白溶解于80%乙酸水溶液中,然后分别加入明胶-玉米醇溶蛋白总质量0%、0.1%、0.5%、1.0%(质量分数)的肉桂醛,分别简写为C0、C0.1、C0.5、C1.0,搅拌均匀,超声除气泡,制得样品。
1.2.2 气体辅助静电纺丝
将明胶/玉米醇溶蛋白/肉桂醛溶液注入10 mL注射器,在注射泵推动下以10.0 mL/h的速率推进到达针尖(内径0.5 mm),启动高压电源发生器激发直流高压电场,打开气阀使气流速度稳定在300 L/h,静电纺丝电压为20 kV,纺丝距离为15 cm。
1.3 纳米纤维表征
剪取纳米纤维膜经真空喷金处理后,于扫描电子显微镜上观察纳米纤维的微观形貌。使用软件Nano Measure从纳米纤维的扫描电子显微镜图中随机选取不少于40根纤维,对其直径进行统计,根据所得数据拟合得出纤维平均直径并计算标准差。
从纳米纤维膜上剪取一小块样品直接进行测试。扫描范围:4 000~400 cm-1,分辨率2 cm-1,累加32次,以空气为背景,每次扫描前扣除背景。
利用差示扫描量热/热重同步热分析仪(differential scanning calorimetry/thermogravimetry,DSC/TG)对纳米纤维膜进行热特性分析。准确称取6~10 mg样品放入铝坩埚中,密封。以10 ℃/min的升温速度从30 ℃升温至600 ℃。整个过程均在干燥N2下进行。
将纳米纤维膜剪成直径6 cm,厚度均匀的圆片状,封于盛有10 mL透水杯口,每隔1 h称重并记录,每个样品重复3次记录6 h。水蒸气透过率(water vapor permeability,WVP)按公式(1)计算:
(1)
式中:Ws/t,质量随时间的线性回归,g/s;A,纳米纤维与水蒸气的接触面积,cm2;L,厚度,cm;ΔP,饱和蒸气压差,Pa(2 237.8 Pa,28 ℃)
将纳米纤维膜剪成5 cm×1.5 cm,厚度0.1 mm左右,利用DR-508A电脑试验拉力机进行机械性能测试。纳米纤维膜放入夹具,精确测量并输入样品的厚度、宽度、截距,拉力载荷为5 N,拉伸速率为5 mm/min,每个样品重复5次。
1.4 抗氧化性分析
1.4.1 DPPH法
参考王存堂等[8]的方法。称量5.0 mg样品置于10 mL离心管中,平行3次,加入2 mL 500 μmol/L DPPH乙醇溶液避光反应30 min,在517 nm处测定吸光度。按公式(2)计算自由基清除率:
DPPH自由基清除率![]()
(2)
式中:A0,对照组吸光度;A1,样品组吸光度。
1.4.2 亚铁能力还原法(ferric reducing antioxidant power,FRAP)
参考张巧骞[9]的方法。将0.3 mol/L醋酸钠缓冲液,20 mmol/L FeCl3溶液,10 mmol/L TPTZ溶液以10∶1∶1体积比混合得到TPTZ工作液。称量5.0 mg样品置于10 mL离心管中,平行3次,加入2 mL TPTZ工作液于37 ℃反应30 min后,在592 nm处测定吸光度,以OD值表示还原能力。
1.5 抗菌分析
采用抑菌圈法考察包埋有肉桂醛的纳米纤维膜的抑菌特性。选用革兰氏阴性菌Escherichia coli和革兰氏阳性菌Staphylococcus aureus作为研究对象。用打孔器将纤维膜制成直径5 mm的圆片在紫外灯下灭菌30 min。取100 μL菌悬液(1×106 CFU/mL)均匀涂布于已灭菌的培养基上,然后将纤维膜贴于培养基表面,37 ℃恒温培养箱中培养24 h,用游标卡尺测量抑菌圈直径。
1.6 数据分析
以上所有纳米纤维测试数据均至少进行3次平行试验,以平均值±标准差表示。利用Origin软件进行单因素方差分析和Tukey检验显著性分析(P<0.05)并作图。
2 结果与分析
2.1 纤维形态及产率
图1为添加不同浓度肉桂醛的明胶/玉米醇溶蛋白纳米纤维的扫描电镜图的直径分布图。

图1 负载不同浓度肉桂醛的明胶/玉米醇溶蛋白纳米纤维电镜图的直径分布图
Fig.1 SEM images and fiber diameter distributions of the gelatin/zein nanofibers with different concentration cinnamaldehyde
纳米纤维微观形貌稳定,光滑均匀。肉桂醛浓度的变化对纤维直径变化无显著性影响。纤维直径的变化受到多种因素的影响。LIU等[10]研究溶液吹纺法制备鱼皮明胶基肉桂醛纳米纤维,肉桂醛质量分数从0%增加到30%,相应纤维直径从67.5 nm增加到98.3 nm,归因于在气体辅助静电纺丝过程中,聚合物溶液的黏度和表面张力变化对纤维形成的影响。WANG等[11]发现百里香酚能够降低电纺液表面电荷密度,从而降低延伸率使纤维合并增加直径。RIEGER等[12]研究壳聚糖/聚环氧乙烷负载肉桂醛(0%,0.5%,5.0%),所得纤维直径无显著变化。如表1所示,参考DUAN等[13]的方法计算电纺产率。
表1 传统电纺与气流辅助电纺总流量与产率对比
Table 1 Comparison of total flow and yield between conventional electrospinning and air-assisted electrospinning
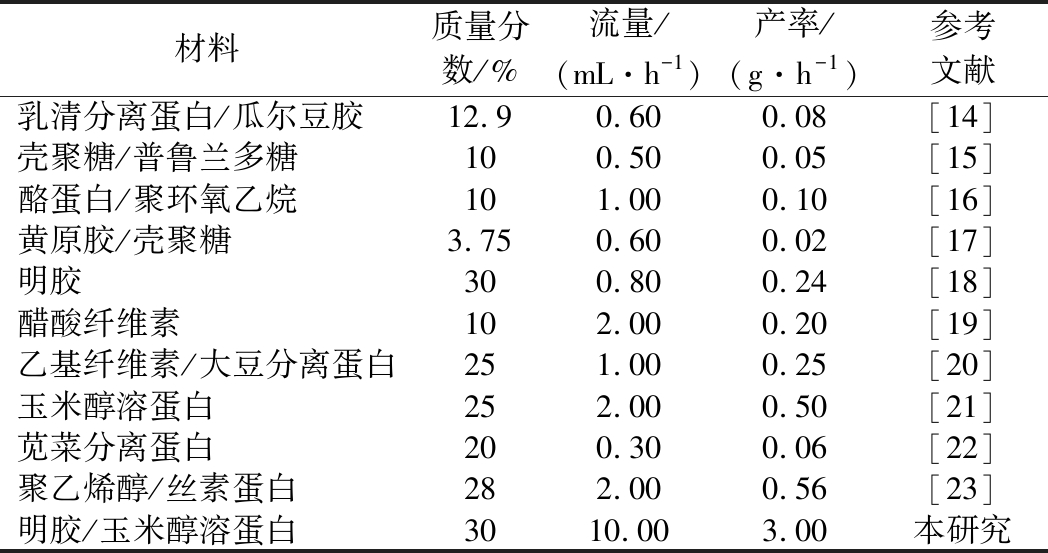
材料质量分数/%流量/(mL·h-1)产率/(g·h-1)参考文献乳清分离蛋白/瓜尔豆胶12.90.600.08[14]壳聚糖/普鲁兰多糖100.500.05[15]酪蛋白/聚环氧乙烷101.000.10[16]黄原胶/壳聚糖3.750.600.02[17]明胶300.800.24[18]醋酸纤维素102.000.20[19]乙基纤维素/大豆分离蛋白251.000.25[20]玉米醇溶蛋白252.000.50[21]苋菜分离蛋白200.300.06[22]聚乙烯醇/丝素蛋白282.000.56[23]明胶/玉米醇溶蛋白3010.003.00本研究
传统电纺总流量不超过2.0 mL/h,产率不超过1.0 g/h,而本研究中气流辅助静电纺丝技术总流量能达到10.0 mL/h,产率达到3.0 g/h。产率的提高强烈依赖于聚合物离开喷头后,开放式高速气流通常会引起被拉伸纤维的力学波动,破坏力学平衡,造成纤维多次分裂,同时溶剂加速挥发,充分沉积在收集器上。
2.2 红外光谱
添加不同肉桂醛浓度的纳米纤维红外光谱如图2所示,3 289 cm-1处的吸收峰对应N—H伸缩振动和O—H伸缩振动,2 957 cm-1处的吸收峰对应C—H的伸缩振动,1 637~1 640 cm-1处的吸收峰对应酰胺I带的C![]() O伸缩振动、1 534 cm-1左右的峰对应酰胺II带的N—H弯曲振动和C—H伸缩振动,1 450 cm-1处的峰对应C—N伸缩振动和N—H弯曲振动,1 240 cm-1左右的峰对应酰胺III带的C—N伸缩振动,1 081~1 167 cm-1的峰对应C—H弯曲振动和C—O伸缩振动。与纯明胶/玉米醇溶蛋白纳米纤维相比,添加不同浓度肉桂醛纳米纤维特征峰相似,没有出现新的峰,说明肉桂醛均相地分布在纳米纤维中,随着肉桂醛添加量的增加,对应特征峰2 900~3 300 cm-1、1 250~1 750 cm-1区域的吸收强度变大,表明明胶/玉米醇溶蛋白与肉桂醛发生氢键的相互作用力。酰胺I带特征峰发生红移,酰胺II带先蓝移后红移可能是氢键与分子构象变化的共同作用。
O伸缩振动、1 534 cm-1左右的峰对应酰胺II带的N—H弯曲振动和C—H伸缩振动,1 450 cm-1处的峰对应C—N伸缩振动和N—H弯曲振动,1 240 cm-1左右的峰对应酰胺III带的C—N伸缩振动,1 081~1 167 cm-1的峰对应C—H弯曲振动和C—O伸缩振动。与纯明胶/玉米醇溶蛋白纳米纤维相比,添加不同浓度肉桂醛纳米纤维特征峰相似,没有出现新的峰,说明肉桂醛均相地分布在纳米纤维中,随着肉桂醛添加量的增加,对应特征峰2 900~3 300 cm-1、1 250~1 750 cm-1区域的吸收强度变大,表明明胶/玉米醇溶蛋白与肉桂醛发生氢键的相互作用力。酰胺I带特征峰发生红移,酰胺II带先蓝移后红移可能是氢键与分子构象变化的共同作用。
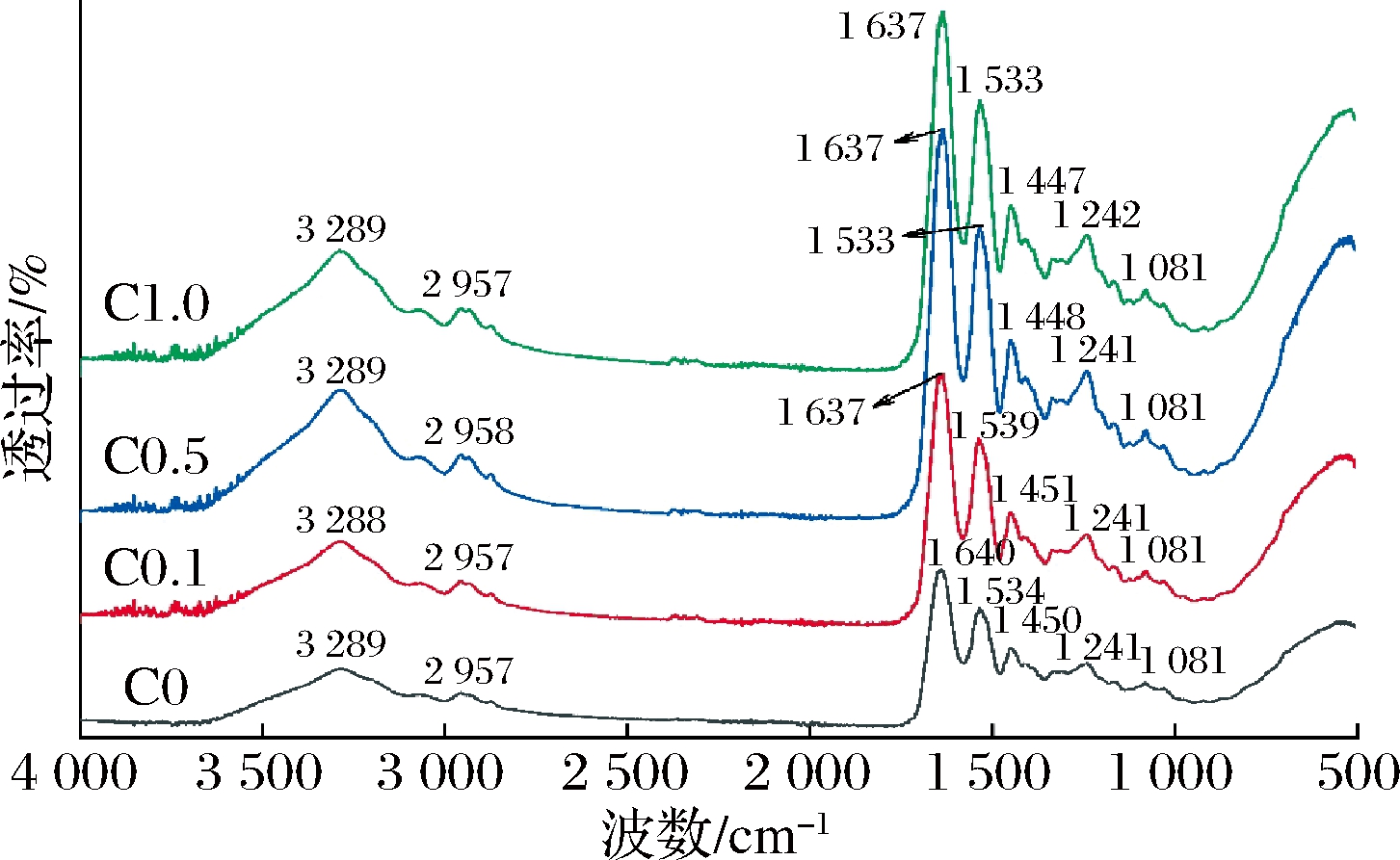
图2 负载不同浓度肉桂醛纳米纤维红外光谱图
Fig.2 FTIR spectra of the nanofibers with different concentration cinnamaldehyde
2.3 热力学分析
图3-a为添加不同浓度肉桂醛纳米纤维的DSC谱图,DSC曲线的特征吸热峰称为玻璃化转变温度(Tg)和熔融温度(Tm)。第1个峰(Peak1)表明聚合物从玻璃态变为高弹态。随着肉桂醛浓度的提高,玻璃化转变温度从49.3 ℃升至62.2 ℃,玻璃化转变反映了分子的流动性和可混合性,氢键相互作用能提高玻璃化转变温度[18]。第2个峰(Peak2)代表熔融温度(Tm),一般来说较高的熔融点表明体系内分子的相互作用较强,需要更高的能量使其解聚。在300~320 ℃的第3个峰(Peak3)归因于纳米纤维薄膜的热降解。图3-b为纳米纤维热重谱图。生物聚合物的热降解包括聚合物单体的内部共价键和纤维网络结构的降解,纳米纤维的降解主要分2个阶段,第1阶段在40~120 ℃,主要是游离水、乙酸的挥发,这一区域的失重率均低于C0,可能是因为部分水与肉桂醛发生氢键的相互作用;第2阶段在160~380 ℃,主要是明胶、玉米醇溶蛋白以及肉桂醛的降解。负载肉桂醛的纳米纤维失重率显著高于C0,失重温度低于C0,表明肉桂醛的稳定性较明胶、玉米醇溶蛋白差,而失重点均高于肉桂醛的挥发点248 ℃,说明纳米纤维对肉桂醛的热稳定性有积极作用。

a-DSC;b-TGA
图3 负载不同浓度肉桂醛的明胶/玉米醇溶蛋白纳米纤维热力学分析图
Fig.3 Thermodynamic analysis diagram of the gelatin/zein nanofibers with different concentration cinnamaldehyde
2.4 水蒸气透过率和机械性能分析
水蒸气透过率是指示纳米纤维水蒸气阻隔性的关键参数。负载不同浓度肉桂醛的纳米纤维的水蒸气透过率如表2所示,由于肉桂醛的疏水性,质量分数增加至0.1%时,水蒸气阻隔性增强,然而肉桂醛质量分数继续增加到0.5%时,水蒸气阻隔性相比对照有一定降低,当质量分数达到1.0%时,水蒸气透过率又出现降低趋势。水蒸气透过率的降低主要是受到肉桂醛的疏水性以及聚合物之间亲疏水基团相互作用的影响。LIU等[24]将葵花籽油皮克林乳液添加到魔芋葡甘聚糖纳米纤维能降低水蒸气透过率,可能是由于分散的皮克林乳液扰乱基质中水分子的迁移路径,同时魔芋葡甘聚糖与乳液之间的氢键阻碍魔芋葡甘聚糖与水之间的相互作用。
表2 负载不同浓度肉桂醛的明胶/玉米醇溶蛋白纳米纤维水蒸气透过率和杨氏模量,拉伸强度,断裂伸长率
Table 2 WVP, young modulus, tensile strength, elongation at break results of the gelatin/zein nanofibers with different concentration cinnamaldehyde
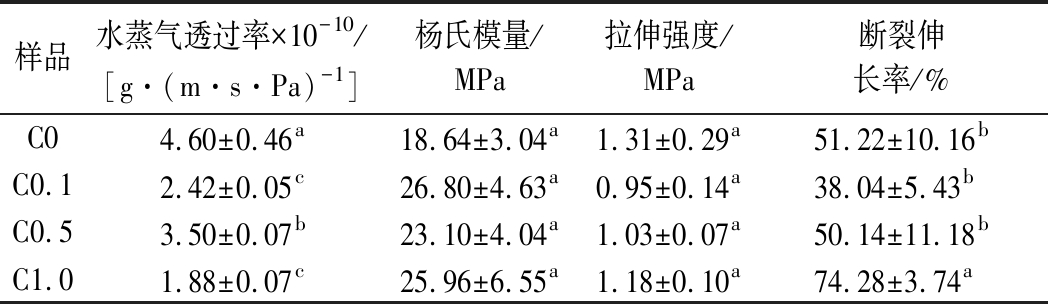
样品水蒸气透过率×10-10/[g·(m·s·Pa)-1]杨氏模量/MPa拉伸强度/MPa断裂伸长率/%C04.60±0.46a18.64±3.04a1.31±0.29a51.22±10.16bC0.12.42±0.05c26.80±4.63a0.95±0.14a38.04±5.43bC0.53.50±0.07b23.10±4.04a1.03±0.07a50.14±11.18bC1.01.88±0.07c25.96±6.55a1.18±0.10a74.28±3.74a
纳米纤维膜拉伸测试分析得到的杨氏模量、拉伸强度和断裂伸长率见表2。杨氏模量指示纳米纤维刚性结构;拉伸强度指示纳米纤维在断裂前有效横截面所能保持的最大拉力;断裂伸长率指示纳米纤维的延展性。本文添加肉桂醛后,杨氏模量与拉伸强度无显著性变化,而C1.0断裂伸长率显著增强,说明纳米纤维的延伸得到提高,通过增加分子链迁移而降低纤维的硬度,并提高弹性以及与聚合物基质之间通过氢键进行的界面相互作用[11]。
2.5 抗氧化和抑菌分析
如图4-a和4-b所示,随着肉桂醛的加入,自由基清除率无显著性变化,而铁离子还原能力逐步提高,表现出量效关系。不同浓度肉桂醛纳米纤维DPPH自由基清除率均在20%左右,主要归因于肉桂醛结构供氢能力弱,而明胶中存在抗氧化肽,玉米醇溶蛋白中固有的氨基酸残基、短肽以及叶黄素的抗氧化能力[25]。C1.0铁离子还原能力显著高于其他负载浓度纳米纤维,由于醛基的还原性,同时明胶/玉米醇溶蛋白对肉桂醛的负载提高溶解性,从而整体上提高离子还原能力。图4-c为添加不同浓度肉桂醛纳米纤维对大肠杆菌和金黄色葡萄球菌的抑菌活性分析。未添加肉桂醛的明胶/玉米醇溶蛋白纳米纤维无显著抑菌效果,与WANG等[11]实验结果一致。肉桂醛的添加对大肠杆菌和金黄色葡萄球菌均具有显著抑制作用,肉桂醛已被研究证明对多种食源性病原体具有显著的抗菌活性,其作用机制主要是疏水结构和游离醛基可以改变膜的物理化学性质,影响双层膜的稳定性和脂质有序性,膜通透性平衡被打破,导致细胞功能障碍和细胞内成分渗出,最终导致细菌死亡[26]。

a-DPPH;b-FRAP;c-抑菌圈结果
图4 负载不同浓度肉桂醛的明胶/玉米醇溶蛋白纳米纤维抗氧化与抑菌圈分析结果
Fig.4 Antioxidant activity and antimicrobial effect of the gelatin/zein nanofibers with different concentration cinnamaldehyde
3 结论
本文采用气流辅助静电纺丝技术成功制备添加不同浓度肉桂醛/明胶/玉米醇溶蛋白纳米纤维。气流辅助加速纤维的拉伸分裂提高产率,同时纤维形貌光滑均匀,无断裂聚集。结构分析证实,肉桂醛均匀分散在纳米纤维中,肉桂醛、明胶和玉米醇溶蛋白之间的相互作用发生在分子水平上,主要是氢键的作用。肉桂醛的疏水、塑化等特性改善纳米纤维的水蒸气阻隔性与机械强度。通过该技术负载肉桂醛,提升其热稳定性并保留抗氧化、抗菌等生物活性。综上所述,明胶/玉米醇溶蛋白纳米纤维负载肉桂醛具有开发为可食用食品活性包装的前景。
[1] DIMA C, ASSADPOUR E, DIMA S, et al.Bioactive-loaded nanocarriers for functional foods:From designing to bioavailability[J].Current Opinion in Food Science, 2020, 33:21-29.
[2] MAFTOONAZAD N, SHAHAMIRIAN M, JOHN D, et al.Development and evaluation of antibacterial electrospun pea protein isolate-polyvinyl alcohol nanocomposite mats incorporated with cinnamaldehyde[J].Materials Science and Engineering:C, 2019, 94:393-402.
[3] 李娟, 许雪儿, 胡卫成, 等.静电纺丝法制备玉米醇溶蛋白基纳米纤维抗菌膜[J].食品与发酵工业, 2019, 45(10):104-109;115.
LI J, XU X E, HU W C, et al.Preparation of zein based nanofiber antibacterial films by electrospinning technology[J].Food and Fermentation Industries, 2019, 45(10):104-109;115.
[4] LIM L T, MENDES A C, CHRONAKIS I S.Electrospinning and electrospraying technologies for food applications[J].Advances in Food and Nutrition Research, 2019, 88:167-234.
[5] 迟蕾, 姚永毅, 李瑞霞, 等. 静电纺丝方法制备纳米纤维的最新进展[J]. 纺织科技进展, 2004, (5): 1-6.
CHI L, YAO Y Y, LI R X, et al. Recent advance in manufacture of nano-fibers by electrospinning[J]. Progress in Textile Science & Technology, 2004, (5): 1-6.
[6] WEN P, ZHU D H, FENG K, et al.Fabrication of electrospun polylactic acid nanofilm incorporating cinnamon essential oil/β-cyclodextrin inclusion complex for antimicrobial packaging[J].Food Chemistry, 2016, 196:996-1 004.
[7] DENG L L, ZHANG X, LI Y, et al.Characterization of gelatin/zein nanofibers by hybrid electrospinning[J].Food Hydrocolloids, 2018, 75:72-80.
[8] 王存堂, 李子钰, 高增明, 等.洋葱皮提取物对卡拉胶可食性膜的物化性质及生物活性的影响[J].食品与发酵工业, 2022, 48(9):146-153.
WANG C T, LI Z Y, GAO Z M, et al.Effects of onion skin extract on physicochemical properties and biological activity of carrageenan edible membrane[J].Food and Fermentation Industries, 2022, 48(9):146-153.
[9] 张巧骞. 静电纺丝法制备丹皮酚复合纳米纤维及其防腐性能的研究[D].深圳:深圳大学, 2020.
ZHANG Q Q.Study on preparation and antiseptic property of paeonol composite nanofibers by electrospinning[D].Shenzhen:Shenzhen University, 2020.
[10] LIU F, SARICAOGLU F T, AVENA-BUSTILLOS R J, et al.Preparation of fish skin gelatin-based nanofibers incorporating cinnamaldehyde by solution blow spinning[J].International Journal of Molecular Sciences, 2018, 19(2):618.
[11] WANG D B, SUN J Y, LI J L, et al.Preparation and characterization of gelatin/zein nanofiber films loaded with perillaldehyde, thymol, or ɛ-polylysine and evaluation of their effects on the preservation of chilled chicken breast[J].Food Chemistry, 2022, 373:131439.
[12] RIEGER K A, SCHIFFMAN J D. Electrospinning an essential oil: Cinnamaldehyde enhances the antimicrobial efficacy of chitosan/poly(ethylene oxide) nanofibers[J]. Carbohydrate Polymers, 2014, 113: 561-568.
[13] DUAN G G, GREINER A.Air-blowing-assisted coaxial electrospinning toward high productivity of core/sheath and hollow fibers[J].Macromolecular Materials and Engineering, 2019, 304(5):1800669.
[14] AMAN MOHAMMADI M, RAMAZANI S, ROSTAMI M, et al.Fabrication of food-grade nanofibers of whey protein isolate-guar gum using the electrospinning method[J].Food Hydrocolloids, 2019, 90:99-104.
[15] QIN Z Y, JIA X W, LIU Q, et al.Fast dissolving oral films for drug delivery prepared from chitosan/pullulan electrospinning nanofibers[J].International Journal of Biological Macromolecules, 2019, 137:224-231.
[16] DAI J M, HU W, YANG H Y, et al.Controlled release and antibacterial properties of PEO/casein nanofibers loaded with Thymol/β-cyclodextrin inclusion complexes in beef preservation[J].Food Chemistry, 2022, 382:132369.
[17] SHEKARFOROUSH E, AJALLOUEIAN F, ZENG G H, et al.Electrospun xanthan gum-chitosan nanofibers as delivery carrier of hydrophobic bioactives[J].Materials Letters, 2018, 228:322-326.
[18] LI M, YU H, XIE Y F, et al.Fabrication of eugenol loaded gelatin nanofibers by electrospinning technique as active packaging material[J].LWT, 2021, 139:110800.
[19] LEE H, KIM J R.Facile fabrication of durable acaricidal nanofibers effective against Dermatophagoides farinae via emulsion electrospinning of eugenol-encapsulated cellulose acetate[J].Cellulose, 2020, 27(12):6 909-6 919.
[20] RASHIDI M, SEYYEDI MANSOUR S, MOSTASHARI P, et al.Electrospun nanofiber based on Ethyl cellulose/Soy protein isolated integrated with bitter orange peel extract for antimicrobial and antioxidant active food packaging[J].International Journal of Biological Macromolecules, 2021, 193:1 313-1 323.
[21] SALEVI A, STOJANOVI
A, STOJANOVI D, LEVI
D, LEVI S, et al.The structuring of sage (Salvia officinalis L.) extract-incorporating edible zein-based materials with antioxidant and antibacterial functionality by solvent casting versus electrospinning[J].Foods, 2022, 11(3):390.
S, et al.The structuring of sage (Salvia officinalis L.) extract-incorporating edible zein-based materials with antioxidant and antibacterial functionality by solvent casting versus electrospinning[J].Foods, 2022, 11(3):390.
[22] ACEITUNO-MEDINA M, LOPEZ-RUBIO A, MENDOZA S, et al.Development of novel ultrathin structures based in amaranth (Amaranthus hypochondriacus) protein isolate through electrospinning[J].Food Hydrocolloids, 2013, 31(2):289-298.
[23] WEI L L, ZHOU D R, KANG X J.Electrospinning as a novel strategy for the encapsulation of living probiotics in polyvinyl alcohol/silk fibroin[J].Innovative Food Science & Emerging Technologies, 2021, 71:102726.
[24] LIU Z, LIN D H, SHEN R, et al.Characterizations of novel konjac glucomannan emulsion films incorporated with high internal phase Pickering emulsions[J].Food Hydrocolloids, 2020, 109:106088.
[25] ROY S, RHIM J W.Gelatin/agar-based functional film integrated with Pickering emulsion of clove essential oil stabilized with nanocellulose for active packaging applications[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2021, 627:127220.
[26] 索标, 常玉婷, 王瑞, 等.肉桂醛促进即食牛肉中蜡样芽孢杆菌热失活的动力学模型[J].食品与发酵工业, 2021, 47(12):90-94.
SUO B, CHANG Y T, WANG R, et al.Kinetic model of cinnamaldehyde promoting thermal inactivation of Bacillus cereus in ready-to-eat beef[J].Food and Fermentation Industries, 2021, 47(12):90-94.