由有机凝胶乳液、双层乳液、Pickering乳液等构建的乳液系统可以提高脂溶性营养成分的稳定性[1]。Pickering乳液是一种由固体颗粒稳定的乳液输送系统,具有稳定性强、抗奥氏熟化、安全性好等优点[2]。在食品领域,已有文献报道将蛋白质Pickering乳液用于营养物质的传送,认为其较厚的界面颗粒层可以起到保护屏障的作用,确保被封装的营养成分免受化学降解[3]。Pickering乳液的稳定性主要与液滴的特性密切相关,液滴间的相互作用是决定乳液稳定性的最主要因素。盐离子可以通过静电屏蔽作用影响乳液液滴间的相互作用力,从而影响乳液的稳定性。DELAHAIJE等[4]研究发现,NaCl浓度为150 mmol/L时,乳液发生絮凝,乳液的粒径显著增加,乳液贮藏稳定性降低。同时食品体系中一般含有钠盐和钙盐,而蛋白质及其稳定的乳液又易受环境中盐离子的影响,因此研究盐离子对Pickering乳液的稳定性于食品乳液体系具有十分重要的意义。
蛋白质纤维聚集体是指在远离等电点pH值和低离子强度条件下,对蛋白质进行长时间的热处理,形成的富含β-折叠结构的微米级或纳米级丝状纤维。由于纤维聚集体独特的丝状结构和较高的横纵比,使其在乳液形成和稳定方面表现出优异的性能[5]。相比于β-乳球蛋白,β-乳球蛋白原纤维具有优越的乳化活性和更高的稳定性[6]。大豆分离蛋白是一种资源丰富且氨基酸全面的蛋白质,富含天门冬氨酸和谷氨酸,容易形成蛋白纤维[7]。然而,关于大豆蛋白纤维聚集体制备Pickering乳液以及蛋白纤维聚集体Pickering乳液对生物活性物质包埋稳定性的研究较少报道。
β-胡萝卜素是类胡萝卜素的一种,存在于很多果蔬之中,具有抗癌、抗氧化和预防心血管疾病等功能[8]。β-胡萝卜素是一种脂溶性营养成分,在氧、热及光存在的条件下,容易发生氧化降解,导致其在运输、储存、食品应用等方面受到了很大的限制[9]。目前,β-胡萝卜素多以乳液的形式装载,与传统乳液相比,Pickering乳液具有更强的稳定性可以更好包埋β-胡萝卜素。本研究利用酸热处理制备大豆分离蛋白纤维聚集体,探究蛋白浓度、油相比例和NaCl浓度对蛋白纤维聚集体乳液制备及其稳定性的影响,同时研究该纤维聚集体乳液在不同离子浓度下对β-胡萝卜素的包埋效率及贮藏稳定性的影响,研究结果可为大豆分离蛋白纤维聚集体在包埋活性物质中的应用提供依据。
1 材料与方法
1.1 材料与仪器
脱脂豆粕,山东禹王公司;β-胡萝卜素,上海麦克林生化科技有限公司;大豆油,益海嘉里金龙鱼粮油食品股份有限公司;其他试剂均为分析纯。
Fluko-FA25高速剪切乳化剂机,上海Fluko公司;Nicolet67傅里叶变换红外光谱仪,美国Thermo公司;JEM-1400flash透射电子显微镜,日本电子公司;F97 Pro荧光光谱仪,上海棱光技术有限公司。
1.2 实验方法
1.2.1 大豆分离蛋白(soy protein isolated, SPI)的提取
参考王金梅等[10]的方法,以料液比1∶15(g∶mL)向低温脱脂豆粕加入去离子水,调节pH值为8并搅拌3 h,8 000×g离心30 min后,取上清液过滤,并将滤液pH值调节至4.5。以6 500×g离心30 min,取沉淀。水洗沉淀2次,加水溶解并将其pH值调至7.0,4 ℃透析48 h,冻干备用。
1.2.2 大豆分离蛋白纤维聚集体(soy protein isolate fibril, SPIF)的制备
称取SPI冻干粉溶于去离子水中,制成质量浓度40 g/L的溶液,室温搅拌5 h后,静置水合过夜。用2 mol/L HCl溶液调节溶液pH值至2.0,以8 000×g离心30 min,上清液用0.45 μm的滤膜进行抽滤,用预调至pH 2.0的去离子水调节溶液至终质量浓度20 g/L。将样品90 ℃恒温水浴8 h,温和搅拌。结束后立即冷却至室温,放置于4 ℃冰箱中储藏备用[11]。
1.2.3 SPIF乳液的制备
用pH 2.0的去离子水将SPIF溶液浓度稀释至不同质量浓度(2.5、5、10和20 g/L),加入不同浓度的NaCl(0、200、400、600、800、1 000 mmol/L)搅拌均匀,以不同的油相比例(0.4、0.6、0.8)加入大豆油混合。15 000 r/min剪切乳化2 min,得到SPIF乳液。
1.2.4 包埋β-胡萝卜素的SPIF乳液的制备
将0.2 g β-胡萝卜素溶于200 mL大豆油中,磁力搅拌器充分搅拌2 h至β-胡萝卜素完全溶解。将油相与一定浓度的SPIF溶液按一定比例充分混匀后,以15 000 r/min剪切2 min,4 ℃冷藏保存,在相同条件下以SPI溶液制备乳液作为对照组。所有的容器均使用铝箔纸包裹,以最大程度的保护β-胡萝卜素,减少在制备过程中的损失[12]。
1.2.5 SPIF的表征
1.2.5.1 硫黄素T(thioflavin T,ThT)荧光分析
将8 mg ThT溶解于10 mL 磷酸缓冲液(10,150 mmol/L NaCl,pH 7.0)中,过0.22 μm的滤膜得到ThT母液[13]。对母液稀释50倍后得到ThT工作液。取40 μL样品溶液(10 g/L)与4 mL ThT工作液混合,于室温反应2 min。激发波长设置为440 nm,对460~600 nm波长进行扫描[14]。
1.2.5.2 傅里叶红外光谱分析(Fourier transform infrared spectroscopy,FTIR)
取SPI和SPIF的冻干粉,使用傅里叶红外光谱仪进行全波长扫描(400~4 000 cm-1),随后用Peakfit 4.12软件对蛋白质二级结构进行拟合分析。
1.2.5.3 透射电子显微镜(transmission electron microscope,TEM)
对SPI和SPIF溶液用预调至pH 2.0的去离子水稀释至1 mg/mL,取10 μL滴在铜网上,多余溶液用滤纸吸干,自然干燥24 h,用TEM观察微观形貌。
1.2.6 SPIF乳液的表征
1.2.6.1 不同条件下乳液的外观观察
将不同蛋白浓度(2.5、5、10和20 g/L),不同离子强度(0、200、400、600、800、1 000 mmol/L)和油相比例(0.4、0.6、0.8)的SPIF乳液置于室温环境下静置一段时间后,进行外观拍照观察。
1.2.6.2 乳化活性(emulsification activity index,EAI)和乳化稳定性(end system identifier,ESI)测定
根据刘昊天等[15]的方法稍作修改,取3 mL 20 g/L的SPIF溶液分别加入不同浓度的NaCl,搅拌均匀,与1 mL大豆油混合,以15 000 r/min剪切2 min,立即从离心管管底取样50 μL,用1 g/L SDS溶液稀释100倍。振荡混匀后以1 g/L SDS溶液作为空白,读取样品在500 nm波长处的吸光值记作A0 min,样品放置10 min后再次在相同位置取样50 μL,重复上述步骤记录A10 min。样品的EAI和ESI分别按公式(1)(2)计算:
(1)
(2)
式中:ρ,样品质量浓度,g/L;φ,油相比例;N,稀释倍数。
1.2.6.3 乳液的界面蛋白吸附率
参照江连洲等[16]的方法,取1 mL新制的乳液在13 000×g下离心45 min后,乳液分离为上层乳析层和下层水相,将离心管顶部的乳析层小心移除,用一次性注射器取出下层清液。取100 μL清液用水稀释至1 mL,使用考马斯亮蓝法测蛋白含量Cf,C0为乳液中的总蛋白含量。乳液的界面蛋白吸附率按公式(3)计算:
界面蛋白吸附率/%=(C0-Cf)×100/C0
(3)
1.2.7 包埋β-胡萝卜素的SPIF乳液性质
1.2.7.1 β-胡萝卜素的包埋率
参照SURH等[17]的方法,在1 mL的乳液中加入3 mL的正己烷,振荡30 s。混匀后8 000×g离心5 min。取上清液于10 mL容量瓶中用正己烷定容。置于紫外分光光度计中测定在450 nm处的吸光值。利用β-胡萝卜素标准曲线计算其中β-胡萝卜素的含量,由此测出的含量即为未被包埋的β-胡萝卜素的含量(μg/mL)。用公式(4)计算:
包埋率![]()
(4)
1.2.7.2 脂肪上浮率
按照曹亚倩等[18]的方法,取10 mL新制备的乳液置于西宁瓶中,竖直放置于4 ℃下贮藏。同时记录不同时间(0、1、2、4、7、15 d)的下清液层高度(Hs)和总高度(Ht),脂肪上浮率按公式(5)计算。
脂肪上浮率![]()
(5)
1.2.7.3 光学显微镜
取新鲜制得的乳液1 mL,并稀释5倍,然后取40 μL滴加到载玻片上,盖上盖玻片,在20倍镜下观察液滴分布。
1.2.7.4 贮藏稳定性
将β-胡萝卜素乳液置于西宁瓶中于55 ℃下贮藏7 d。每隔1 d取β-胡萝卜素乳液1.0 mL,分别加入乙醇和正己烷(1∶2,体积比)。振荡,取上清液。用分液漏斗重复萃取3次,合并上层萃取液,并于10 mL容量瓶中定容,测其在450 nm处的吸光值[19]。根据β-胡萝卜素标准曲线计算出β-胡萝卜素的质量浓度(μg/mL),结果以ρ/ρ0表示,其中ρ为贮藏一定时间后乳液中β-胡萝卜素的质量浓度(μg/mL),ρ0为乳液中β-胡萝卜素的初始质量浓度(μg/mL)。
1.2.8 统计分析
每个实验重复3次,结果以平均值±标准差表示,采用SPSS Statistics进行显著性分析,当P<0.05时认为差异显著。
2 结果与讨论
2.1 SPIF的表征
2.1.1 ThT荧光分析
ThT荧光分析在研究中常被用于定性检测蛋白的纤维结构,其荧光强度会随着纤维聚合物的增加而上升[20]。从图1-a中可发现在酸性条件下(pH 2.0)加热8 h后,SPI在486 nm处的最大荧光强度显著增加。图1-b显示加热8 h后,SPI样品的荧光强度值从97.67增加至333.70,提升了241.7%,说明SPI经酸热处理后自组装形成了具有β-折叠结构的纤维聚合物SPIF。

图1 不同加热时间对SPI的荧光光谱和荧光强度的影响
Fig.1 Fluorescence spectrum and fluorescence intensity of SPI under different heating time
注:不同小写字母代表差异显著,P<0.05,(下同)
2.1.2 FTIR分析
FTIR是一种有效的检测蛋白质结构的分析方法,位于1 600~1 700 cm-1的酰胺I带常被用于蛋白质二级结构的分析。酰胺I带的振动频率主要取决于C![]() O和N—H之间的氢键性质,通过对酰胺I带进行分析可得到蛋白质的二级结构α-螺旋(1 650~1 660 cm-1)、β-折叠(1 618~1 640 cm-1和1 670~1 690 cm-1)、β-转角(1 660~1 670 cm-1和1 690~1 700 cm-1)和无规则卷曲(1 640~1 650 cm-1)[21]。由表1可见。热处理8 h后的SPI样品的β-折叠含量由37.53%增加为47.48%,α-螺旋由22.36%下降至12.89%。这表明在SPI自组装生成SPIF的过程中,蛋白质中的α-螺旋结构转化为β-折叠结构,β-折叠结构也是构成蛋白质纳米纤维的主要结构[22]。
O和N—H之间的氢键性质,通过对酰胺I带进行分析可得到蛋白质的二级结构α-螺旋(1 650~1 660 cm-1)、β-折叠(1 618~1 640 cm-1和1 670~1 690 cm-1)、β-转角(1 660~1 670 cm-1和1 690~1 700 cm-1)和无规则卷曲(1 640~1 650 cm-1)[21]。由表1可见。热处理8 h后的SPI样品的β-折叠含量由37.53%增加为47.48%,α-螺旋由22.36%下降至12.89%。这表明在SPI自组装生成SPIF的过程中,蛋白质中的α-螺旋结构转化为β-折叠结构,β-折叠结构也是构成蛋白质纳米纤维的主要结构[22]。
表1 不同加热时间下的SPI样品的二级结构 单位:%
Table 1 The secondary structure of SPI samples under different heating time

热处理时间/hα-螺旋β-折叠β-转角无规则卷曲022.36±0.17∗37.53±0.9118.65±0.12∗21.46±0.27812.89±0.0547.48±0.21∗14.98±0.1524.65±0.10∗
注:同列数据标有*表示差异显著(P<0.05)
2.1.3 微观形貌
TEM常用于物质微观形貌的观察。根据图2-a可以观察到未加热的SPI样品为圆球状颗粒,在pH 2.0条件下加热处理8 h,20 g/L SPI形成很多细而长的线状聚合物,即大豆分离蛋白纳米纤维。SPIF长短不一,其直径在几至十几纳米,都具有较高的横纵比(图2-b)。
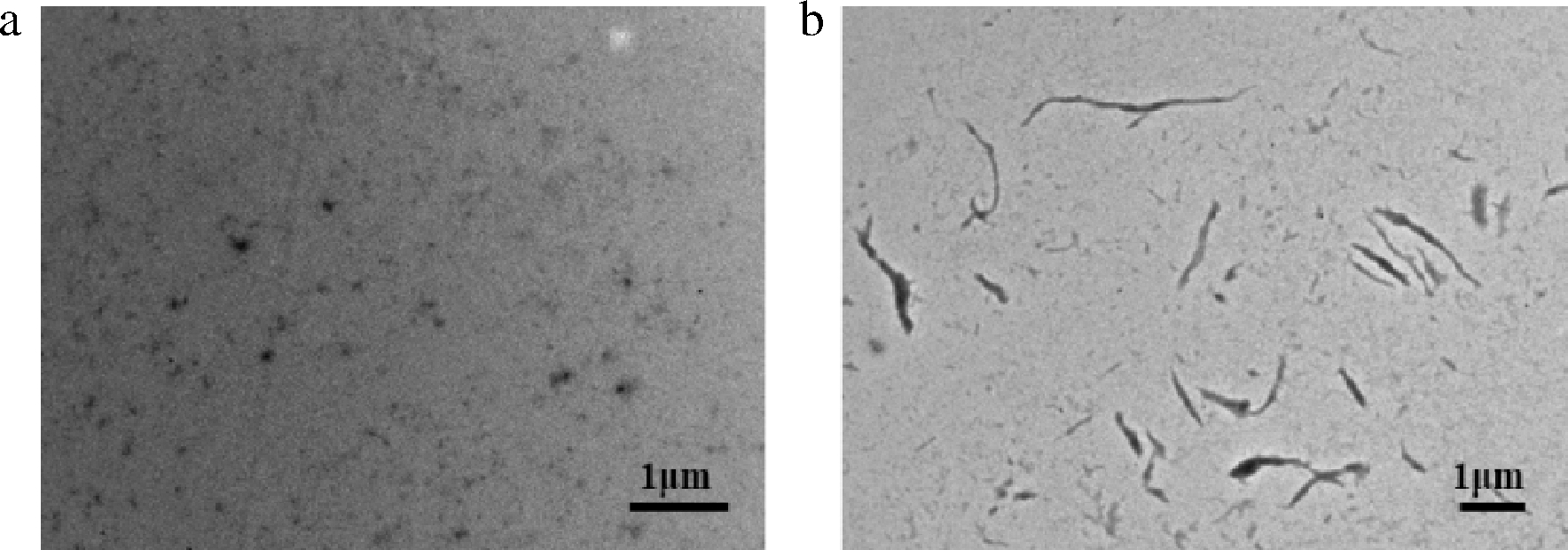
a-0 h;b-8 h
图2 不同加热时间下SPI的TEM形貌图
Fig.2 Transmission electron microscope morphology of SPI under different heating time
2.2 SPIF乳液的表征
2.2.1 乳液的外观观察
不同蛋白浓度和油相比的乳液外观如图3所示。新制备的乳液均包含上层的乳液层和下层的水相层,随着SPIF浓度的增加,相同油相比例下的乳液层的厚度逐渐增加,说明大豆油被成功分散,增加SPIF的浓度可以更好地稳定Pickering乳液体系[18]。当SPIF质量浓度达到20 g/L时,乳液几乎没有分层,可得出最适蛋白浓度为20 g/L。但是在油相比例0.8时,乳液顶部有析油现象,说明蛋白浓度为20 g/L的SPIF不足以包裹住全部油滴表面,可得出0.6为最适油相比例,因此选取20 g/L蛋白浓度和0.6的油相比例进行后续实验。

图3 不同蛋白浓度和油相比例下的乳液外观
Fig.3 The emulsion appearance in different protein concentrations and oil fraction
NaCl的静电屏蔽效应会导致乳液液滴的进一步聚集,不同浓度的Na+会对乳液的稳定性造成一定影响。从图4中发现,盐离子的添加有效地增加了乳液层的厚度,显著提高了SPIF乳液的稳定性。同时添加NaCl的乳液未分层,且随着时间的增加,乳液的表观状态并没有发生改变,各个离子浓度的乳液变化肉眼难以识别。

图4 不同离子强度下0和7 d的乳液外观
Fig.4 The emulsion appearance at 0 and 7 d with different ionic strengths
2.2.2 乳化活性和乳化稳定性分析
由图5可见,相对于SPI,SPIF的乳化活性和乳化稳定性明显增加。

a-乳化活性;b-乳化稳定性
图5 不同离子强度下SPIF的乳化特性
Fig.5 Emulsifying properties of SPIF at different ionic strengths
随着盐离子浓度的增加,SPIF的乳化活性和乳化稳定性均呈现先增高后下降的趋势。当离子强度为600 mmol/L时,SPIF的乳化活性和乳化稳定性最高。这可能是由于盐离子的加入屏蔽了SPIF之间的静电斥力,降低了分子间的空间位阻,使得SPIF可以更好地包裹住油滴表面,增加了SPIF的乳化性能[23]。但是当NaCl浓度继续增加时,SPIF因静电斥力的减小相互聚集成更大的团聚体,不利于在油滴表面的吸附。并且随着液滴间的静电斥力进一步减小,使得乳液液滴之间发生相互聚集,降低了乳液的稳定性[23]。综上在适当的盐离子浓度下,SPIF的乳化活性和乳化稳定性会有一定的提高。
2.2.3 界面蛋白吸附率
如图6所示,随着离子强度的增加,蛋白乳液的界面蛋白吸附率逐渐上升。当离子强度达到600 mmol/L时,界面蛋白吸附率的增加逐渐趋于平稳。这可能是由于纤维聚集体间静电斥力减弱,使得蛋白结构的柔顺性更好,可高效且稳定的吸附于油水界面[16]。然而过高的离子强度会使乳液液滴间絮凝,从而界面蛋白吸附率进一步增加,但是乳液的稳定性下降。
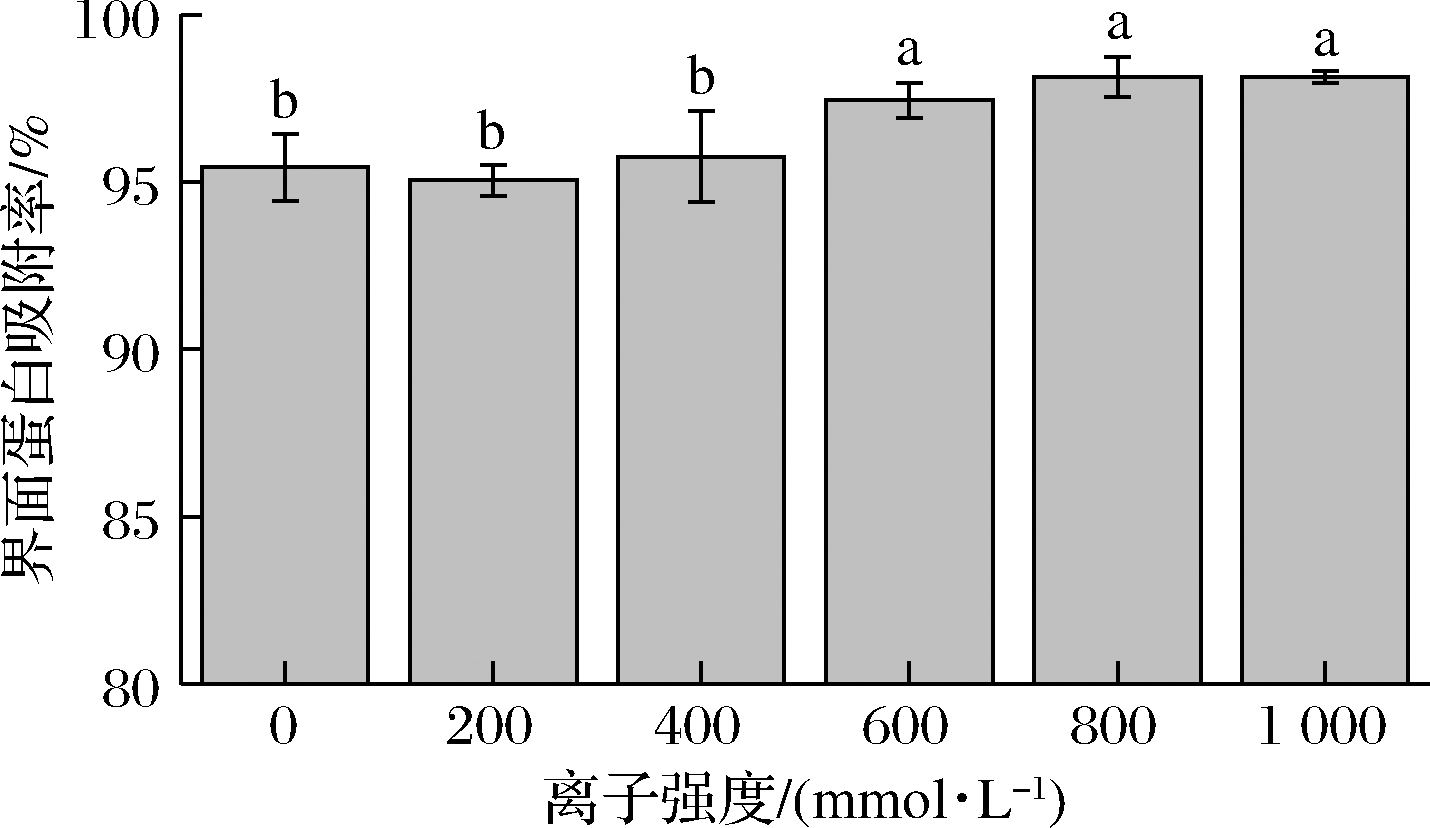
图6 不同离子强度下SPIF乳液的界面蛋白吸附率
Fig.6 Percentage of adsorbed protein of SPIF emulsion under different ionic strengths
2.3 包埋β-胡萝卜素的SPIF乳液的表征
2.3.1 包埋率
SPI与SPIF在不同离子强度下对β-胡萝卜素的包埋率如图7所示。

图7 不同离子强度下SPI和SPIF乳液对β-胡萝卜素的包埋率
Fig.7 Encapsulation efficiency of β-carotene in SPI and SPIF emulsions under different ionic strengths
在0 mmol/L时,SPIF乳液对β-胡萝卜素的包埋率为95.78%,相较于SPI乳液的83.36%,提高了12.42%。SPIF乳液对β-胡萝卜素的包埋率随着离子强度的增加而增加,当离子强度大于200 mmol/L时,包埋率为98.2%以上。而SPI乳液对β-胡萝卜素的包埋率随着离子强度的增加先上升后下降,说明SPI乳液易受到环境中盐离子的影响。
2.3.2 脂肪上浮率
脂肪上浮率通常用来表征乳液的稳定性,乳液的不稳定会加速脂肪上浮的现象。图8-a显示,SPI乳液(0~1 000 mmol/L)储存一段时间后都出现了不同程度的脂肪上浮。盐离子的添加降低了SPI乳液的脂肪上浮率,原因可能是离子强度的增加使得乳液的黏度增加,在一定程度上阻碍了脂肪的上浮[24]。从图8-b发现盐离子的添加显著减少了SPIF乳液的脂肪上浮率,当离子强度大于200 mmol/L时,SPIF的脂肪上浮率仅在4.2%以下。并且随着时间的增加,SPIF的脂肪上浮率没有变化,说明盐离子极大地提高了SPIF乳液的稳定性。

a-SPI;b-SPIF
图8 不同贮藏时间下包埋β-胡萝卜素乳液的脂肪上浮率
Fig.8 Cream index of emulsions encapsulated β-carotene at different storage times
2.3.3 光学显微镜
图9为不同离子强度包埋β-胡萝卜素的SPI和SPIF乳液的微观结构,乳液微观结构是最为直观地表征乳液稳定性的方法。在SPI乳液中,液滴分布不均,液滴大小不一。随着盐离子的添加,乳液液滴粒径变大,且有液滴聚集现象发生,这可能与乳液液滴较大有关。

图9 不同离子强度下包埋β-胡萝卜素SPI(a,b,c,d,e,f)和SPIF(A,B,C,D,E,F)乳液的显微镜观察图
Fig.9 Microscopic observation of SPI (a,b,c,d,e,f) and SPIF (A,B,C,D,E,F) emulsions encapsulated β-carotene at different ionic strengths
相较于同样离子强度下的SPI乳液,SPIF乳液液滴大小明显减小,且大小较为均一,分布较为一致,乳液乳化稳定性强。TANG等[25]发现蛋白结构的柔性是影响乳化性的重要因素。SPIF的乳化性比SPI要好,可能是因为SPIF的线性构象柔顺性更好,相比SPI可以更高效地吸附在界面上。并且在盐离子浓度低于800 mmol/L的情况下,随着离子强度的增加乳化体系中液滴大小没有明显变化,进一步说明了SPIF乳液具有较强的耐盐性。
2.3.4 贮藏稳定性
β-胡萝卜素在光、热条件下易氧化分解,减少β-胡萝卜素的降解是提高生物利用率和稳定性的有效途径[8]。测定了乳液中β-胡萝卜素在55 ℃储藏过程的保留率,结果如图10所示。

a-SPI;b-SPIF
图10 不同离子强度下乳液中β-胡萝卜素的贮藏稳定性
Fig.10 Storage stability of β-carotene in emulsions with different ionic strengths
β-胡萝卜素在乳液中的含量会随着时间逐渐降低。在未添加盐离子的情况下,SPIF乳液中β-胡萝卜素第7天的保留率为60.28%,相对于SPI乳液提高了7.46%。β-胡萝卜素在SPI和SPIF乳液中的保留率均随着盐离子浓度的增高先升高后降低,且均高于未添加盐离子时的保留率,说明盐离子的添加在一定程度上有利于减少β-胡萝卜素的降解。在储藏第7天,当离子强度为200 mmol/L时,β-胡萝卜素在SPI乳液中的保留率达到最大72.39%;SPIF乳液中β-胡萝卜素的保留率在600 mmol/L时达到最大值81.46%。这说明SPIF乳液能更好地稳定β-胡萝卜素,并且具有更好的耐盐性。
3 结论
SPI通过酸热处理后,自组装生成了具有大量β-折叠结构的SPIF。透射电镜图片显示SPIF是一种细而长的纤维状结构,具有很高的横纵比。SPIF的乳化活性和乳化稳定性均高于SPI。界面蛋白吸附率的变化证明离子强度的增加使SPIF更好地吸附在乳液液滴表面,从而增加了乳液的稳定性。同时SPIF乳液相对于SPI可以更好地包埋β-胡萝卜素,提高乳液中β-胡萝卜素的储藏稳定性,并且SPIF乳液还可以更好地抵抗环境中盐离子的干扰。通过观察乳液的微观结构发现,SPI乳液在高盐离子浓度下粒径随着离子强度的增加而明显增大,而SPIF乳液液滴分布均匀,具有一定的耐盐性。本研究有助于扩展SPIF在稳定Pickering乳液和包埋生物活性物质的开发中的应用。
[1] TING Y W, JIANG Y K, HO C T, et al.Common delivery systems for enhancing in vivo bioavailability and biological efficacy of nutraceuticals[J].Journal of Functional Foods, 2014, 7:112-128.
[2] 李海明, 杨盛, 韦何雯, 等.食品级Pickering乳液的研究进展[J].食品科学, 2015, 36(19):265-270.
LI H M, YANG S, WEI H W, et al.Food grade Pickering emulsion:A review[J].Food Science, 2015, 36(19):265-270.
[3] XIAO J, LI Y Q, HUANG Q R.Recent advances on food-grade particles stabilized Pickering emulsions:Fabrication, characterization and research trends[J].Trends in Food Science & Technology, 2016, 55:48-60.
[4] DELAHAIJE R J, WIERENGA P A, VAN NIEUWENHUIJZEN N H, et al.Protein concentration and protein-exposed hydrophobicity as dominant parameters determining the flocculation of protein-stabilized oil-in-water emulsions[J].Langmuir: the ACS Journal of Surfaces and Colloids, 2013, 29(37):11 567-11 574.
[5] MOHAMMADIAN M, MADADLOU A.Technological functionality and biological properties of food protein nanofibrils formed by heating at acidic condition[J].Trends in Food Science & Technology, 2018, 75:115-128.
[6] JUNG J M, GUNES D Z, MEZZENGA R.Interfacial activity and interfacial shear rheology of native β-lactoglobulin monomers and their heat-induced fibers[J].Langmuir, 2010, 26(19):15 366-15 375.
[7] LI S, JIANG Z Y, WANG F X, et al.Characterization of rice glutelin fibrils and their effect on in vitro rice starch digestibility[J].Food Hydrocolloids, 2020, 106:105918.
[8] ALBANES D.β-Carotene and lung cancer:A case study[J].The American Journal of Clinical Nutrition, 1999, 69(6):1345S-1350S.
[9] BAI C Q, ZHENG J X, ZHAO L, et al.Development of oral delivery systems with enhanced antioxidant and anticancer activity:Coix seed oil and β-carotene coloaded liposomes[J].Journal of Agricultural and Food Chemistry, 2019, 67(1):406-414.
[10] 王金梅, 陈燕琼, 王梦萍, 等.大豆蛋白自组装纤维聚集体的界面及乳化性质研究[J].中国粮油学报, 2016, 31(12):33-38.
WANG J M, CHEN Y Q, WANG M P, et al.Interfacial and emulsifying properties of self-assembly fibrillar aggregates from soy protein[J].Journal of the Chinese Cereals and Oils Association, 2016, 31(12):33-38.
[11] LARA C, ADAMCIK J, JORDENS S, et al.General self-assembly mechanism converting hydrolyzed globular proteins into giant multistranded amyloid ribbons[J].Biomacromolecules, 2011, 12(5):1 868-1 875.
[12] 谢桂杰, 梁蓉, 杨成.运载β-胡萝卜素的Pickering乳液的制备及表征[J].精细化工, 2018, 35(9):1 582-1 588.
XIE G J, LIANG R, YANG C.Preparation and characterization of Pickering emulsions loaded with β-carotene[J].Fine Chemicals, 2018, 35(9):1 582-1 588.
[13] BODE D C, STANYON H F, HIRANI T, et al.Serum albumin’s protective inhibition of amyloid-β fiber formation is suppressed by cholesterol, fatty acids and warfarin[J].Journal of Molecular Biology, 2018, 430(7):919-934.
[14] 陈震东, 陈嘉琦, 王金梅, 等.热诱导大豆蛋白纤维聚集体的分离及性质研究[J].现代食品科技, 2015, 31(6):172-177.
CHEN Z D, CHEN J Q, WANG J M, et al.Properties of isolated, thermally induced soy protein fibrillar aggregates[J].Modern Food Science and Technology, 2015, 31(6):172-177.
[15] 刘昊天, 李媛媛, 汪海棠,等.不同水解度猪骨蛋白水解物对水包油型乳状液乳化特性的影响[J].食品科学, 2018, 39(16):53-60.
LIU H T, LI Y Y, WANG H T, et al.Effects of porcine bone protein hydrolysates with different degrees of hydrolysis on properties of oil-in-water emulsions[J].Food Science, 2018, 39(16):53-60.
[16] 江连洲, 朱颖, 王中江.大豆蛋白结构柔性与界面功能的构效关系[J].中国食品学报, 2020, 20(1):284-289.
JIANG L Z, ZHU Y, WANG Z J.Structure-activity relationship between the flexibility structure of soybean protein and interface function[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(1):284-289.
[17] SURH J, DECKER E A, MCCLEMENTS D J.Properties and stability of oil-in-water emulsions stabilized by fish gelatin[J].Food Hydrocolloids, 2006, 20(5):596-606.
[18] 曹亚倩, 肖军霞, 蒋林宏, 等.玉米纤维素在Pickering乳液制备中的应用研究[J].中国粮油学报, 2020, 35(4):54-60.
CAO Y Q, XIAO J X, JIANG L H, et al.Application of corn fiber in the preparation of Pickering emulsions[J].Journal of the Chinese Cereals and Oils Association, 2020, 35(4):54-60.
[19] 刘欣, 罗志刚, 李小林.海藻酸钠-壳聚糖表面修饰维生素C/β-胡萝卜素复合脂质体的制备[J].现代食品科技, 2020, 36(11):163-169.
LIU X, LUO Z G, LI X L.Preparation of vitamin C/β-carotene composite liposomes with their surfaces modified by sodium alginate-chitosan[J].Modern Food Science and Technology, 2020, 36(11):163-169.
[20] AVEYARD R, BINKS B P, CLINT J H.Emulsions stabilised solely by colloidal particles[J].Advances in Colloid and Interface Science, 2003, 100-102:503-546.
[21] WANG K Q, LUO S Z, ZHONG X Y, et al.Changes in chemical interactions and protein conformation during heat-induced wheat gluten gel formation[J].Food Chemistry, 2017, 214:393-399.
[22] FENG Z B, LI L L, ZHANG Y, et al.Formation of whey protein isolate nanofibrils by endoproteinase GluC and their emulsifying properties[J].Food Hydrocolloids, 2019, 94:71-79.
[23] WEI Z H, CHENG J W, HUANG Q R.Food-grade Pickering emulsions stabilized by ovotransferrin fibrils[J].Food Hydrocolloids, 2019, 94(6):592-602.
[24] 刘蕾, 袁芳, 高彦祥.α-乳白蛋白提高β-胡萝卜素乳液稳定性[J].农业工程学报, 2016, 32(S2):423-429.
LIU L, YUAN F, GAO Y X.α-lactalbumin enhancing emulsion stability of β-carotene[J].Transactions of the Chinese Society of Agricultural Engineering, 2016, 32(S2):423-429.
[25] TANG C H, SHEN L.Role of conformational flexibility in the emulsifying properties of bovine serum albumin[J].Journal of Agricultural and Food Chemistry, 2013, 61(12):3 097-3 110.