豌豆蛋白(pea protein isolate, PPI)是一种天然健康的植物蛋白,其氨基酸比例平衡,赖氨酸含量丰富,具有降低胆固醇、降血压的功能,越来越受到人们的关注[1]。PPI在pH 7.0~10.0的水溶液中表现出较好的稳定性,但PPI在等电点(约pH 4.6)附近时,因自身静电荷被中和,发生聚集沉淀而不能起到乳化作用,限制了其在酸性饮料中的开发利用[2-3]。因此,提高PPI在等电点附近的稳定性是很有必要的。
研究表明,阴离子多糖类聚电解质可与蛋白静电复合形成可溶性复合物,有利于提高蛋白在酸性环境下的稳定性。这是因为带负电荷的多糖与带正电荷的蛋白发生静电复合后,静电斥力和空间位阻使体系保持均匀分散的状态;多糖的加入也使连续相的黏度增大,阻碍了大分子间的聚集[4-5]。LAN等[6]研究发现PPI和高甲氧基果胶发生静电复合形成了网络结构,增强了PPI的热稳定性;LIU等[7]研究了PPI与阿拉伯胶的复合体系,发现静电相互作用提高了PPI在酸性环境中的溶解度和乳化性;WAGONER等[8]研究发现乳清蛋白在等电点附近与果胶形成了对热稳定的可溶性复合物,并应用到饮料产品中。γ-聚谷氨酸(γ-polyglutamic acid, γ-PGA)是谷氨酸单体以α-胺基和γ-羧基之间经酰胺键联结所构成的同型聚酰胺。具有无毒、可生物降解、增稠的特性以及降低胆固醇、增强免疫力的生理活性,已广泛应用于食品、医疗行业中[9-10]。本课题组前期的研究表明γ-PGA与大豆分离蛋白形成可溶性复合物,提高了大豆蛋白的热稳定性[11]。目前尚未有关于γ-PGA与PPI静电相互作用对PPI在酸性环境中稳定性影响的相关研究,本文研究了pH、复合比例、蛋白浓度对复合物形成的影响,以找到形成可溶性复合物的条件,并对复合体系的溶解度、表面疏水性、乳化性进行分析以筛选出酸性环境下稳定效果最佳的复合比例。
1 材料与方法
1.1 材料与试剂
豌豆,市购;γ-PGA,西安四季生物科技有限公司;玉米油,中粮福临门食品营销有限公司;福林酚,北京博奥脱达科技有限公司;8-苯胺-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid, ANS),阿拉丁上海试剂有限公司;罗丹明B,西格玛奥德里奇(上海)贸易有限公司;其余均为分析纯。
1.2 仪器与设备
Virtis型冻干机,美国SP Scientific;5430R型离心机,德国艾本德公司;TU-1901双光束紫外可见分光光度计,北京普析通用仪器有限公司;Zetasizer Nano ZS90电位仪,英国马尔文仪器有限公司;T18高速剪切分散器,德国IKA仪器设备有限公司;A1激光共聚焦显微镜,日本尼康株式会社;Lumia荧光分光光度计,美国赛默飞世尔公司。
1.3 实验方法
1.3.1 豌豆分离蛋白的提取
参考STONE等[12]的方法,将去皮豌豆磨碎成粉后,以质量比1∶15分散在去离子水中,用0.5 mol/L的NaOH溶液将pH调至9.0,室温下磁力搅拌2 h。4 ℃下以5 000 r/min离心20 min后收集上清液,用0.5 mol/L的HCl溶液将其pH调至4.5,4 500 r/min离心20 min后收集沉淀并分散在去离子水中,调pH至7.0,冷冻干燥后,经凯氏定氮测得蛋白含量为83.60%。
1.3.2 PPI与γ-PGA复合溶液的制备
参考LAN等[6]的方法,制备不同蛋白浓度的复合溶液。低蛋白浓度复合体系的制备:先制备PPI和γ-PGA的储备液,质量浓度均为1.0 g/L,置于4 ℃冰箱中水化24 h。将2种储备液按一定比例混合,加入适当体积的去离子水,配制成不同质量复合比(r=1、2、5、10、15、20)PPI-γ-PGA复合溶液(PPI浓度固定为0.5 g/L)。使用浓度分别为1.0、0.5、0.1 mol/L NaOH和HCl溶液调节复合溶液的pH为2.0~7.0,以尽量减小NaOH和HCl溶液的稀释作用。
高蛋白浓度复合体系的制备:取水化24 h后,质量浓度均为20.0 g/L的PPI和γ-PGA储备液,配制成PPI质量浓度固定为10.0 g/L的不同质量复合比(r=1、2、5、10、15、20)PPI-γ-PGA复合溶液,使用浓度分别为2.0、1.0、0.5、0.1 mol/L 的NaOH和HCl溶液调节pH为2.0~7.0。
1.3.3 浊度的测定
使用双光束紫外分光光度计在波长600 nm处测定低蛋白浓度复合溶液的吸光度,以去离子水作为空白对照,每个样品平行测定3次。
1.3.4 相图的绘制
使用NaOH和HCl溶液将高、低蛋白浓度复合溶液的pH调至2.0~7.0后,置于玻璃瓶中于室温下放置24 h后,记录体系的状态。以复合比例r为横轴,pH为纵轴,进行相图绘制。
1.3.5 Zeta电位的测定
使用电位仪测定高、低蛋白浓度复合溶液的Zeta电位。将复合溶液注入样品池中,平衡时间为2 min,测定温度25 ℃[8]。
1.3.6 蛋白溶解度的测定
采用MU等[13]的方法测定蛋白溶解度,以牛血清蛋白为标准物作标准曲线。取pH 4.5的高蛋白浓度复合溶液10 mL于离心管中,4 ℃下以 4 500 r/min离心20 min,吸取1 mL上清液将其与5 mL福林酚试剂甲混匀,室温放置10 min后加入0.5 mL福林酚试剂乙,立即摇匀,反应30 min后测定吸光度,通过标准曲线计算样品蛋白含量,溶解度按公式(1)计算:
溶解度![]()
(1)
1.3.7 蛋白乳化性的测定
参考ZHU等[14]的方法,略作修改。取pH 4.5的高蛋白浓度复合溶液85 mL,加入15 mL玉米油混合,使用高速剪切机于20 000 r/min下均质2 min,分别在0和10 min后从瓶底吸取50 μL乳液,用0.1 g/L十二烷基硫酸钠(sodium dodecyl sulfate,SDS)稀释100倍,以SDS溶液为空白,于波长500 nm处测OD值。乳化活性计算如公式(2)所示,乳化稳定性计算如公式(3)所示:
乳化活性![]()
(2)
乳化稳定性![]()
(3)
式中:A0、A10,0、10 min测得的吸光度;DF,稀释倍数;Φ,油相体积分数,%;θ,光路长度,cm;ρ,蛋白质量浓度,g/mL。
1.3.8 微观结构
使用激光共聚焦显微镜(confocal laser scanning microscope,CLSM)观测样品的微观结构。取1 mL pH 4.5的高蛋白浓度复合溶液,加入20 μL 2 g/L的罗丹明B,染色20 min后,吸取少量于载玻片上,物镜倍数为20×。
1.3.9 表面疏水性的测定
使用ANS荧光探针法测定蛋白的表面疏水性[15]。通过1.3.6的方法测定pH 4.5的高蛋白浓度复合溶液的蛋白溶解度,随后用pH 4.5的磷酸盐缓冲液稀释上清液,使其蛋白质量浓度分别为0.10、0.15、0.20、0.25、0.30 mg/mL。配制8 mmol/L的ANS,取稀释后的样品4 mL,加入20 μL ANS,避光放置10 min后,测定蛋白的荧光强度。设定激发波长为370 nm、发射波长470 nm,以蛋白浓度为横坐标,荧光强度为纵坐标绘制曲线,曲线的斜率即为蛋白的表面疏水性。
1.4 数据统计与分析
试验数据采用Origin 9.0软件作图,SPSS Statistics 25软件进行方差分析,所有试验均重复3次。
2 结果与分析
2.1 pH对PPI-γ-PGA复合物形成的影响
通过浊度分析来研究低浓度下蛋白与多糖的相互作用[16]。随着pH从7.0降至2.2,PPI的浊度曲线表现出先增大后减小的趋势(图1),在等电点pH 4.6时,蛋白发生聚集,浊度达到最大,随后pH远离等电点,蛋白分子间静电斥力增大,浊度逐渐降低。PPI-γ-PGA的浊度曲线被分为3个相区。当pH>pHc为共溶区,此时体系的浊度没有发生明显变化,PPI与γ-PGA为共溶状态。当pHφ1
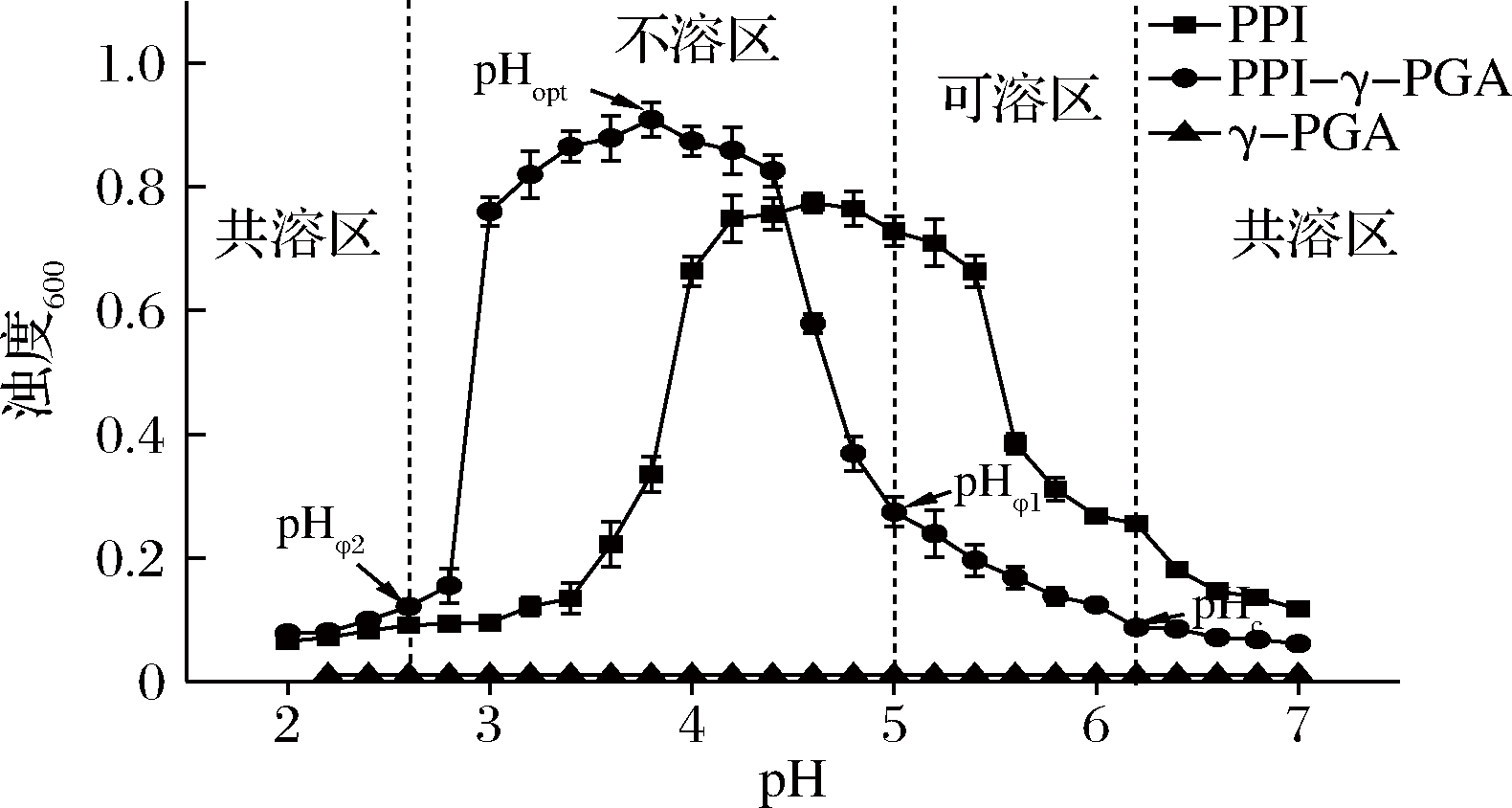
pHc-可溶性复合物开始形成时的pH;pHφ1-不溶性复合物开始形成时的pH;pHopt-浊度最大时的pH;pHφ2-不溶性复合物开始崩解时的pH
图1 pH对复合溶液浊度的影响
Fig.1 Effect of pH on turbidity of mixed solution
由图2可知,PPI的电位随pH的增大不断降低,在pH 4.58时其电势为0,达到了PPI等电点。PPI-γ-PGA的电位也随pH的增大而不断降低,在pH 3.85时电势为0,此时复合物分子间的静电斥力最小,分子发生聚集沉淀,体系的浊度达到最大,在图1中pHopt出现在3.8附近,也是与此对应。与PPI相比,PPI-γ-PGA体系的等电点往酸性的方向移动,可能是γ-PGA上的阴离子羧基与PPI表面的阳离子氨基通过静电结合形成了复合物,γ-PGA 携带的负电荷使复合物的等电点发生了改变[16]。
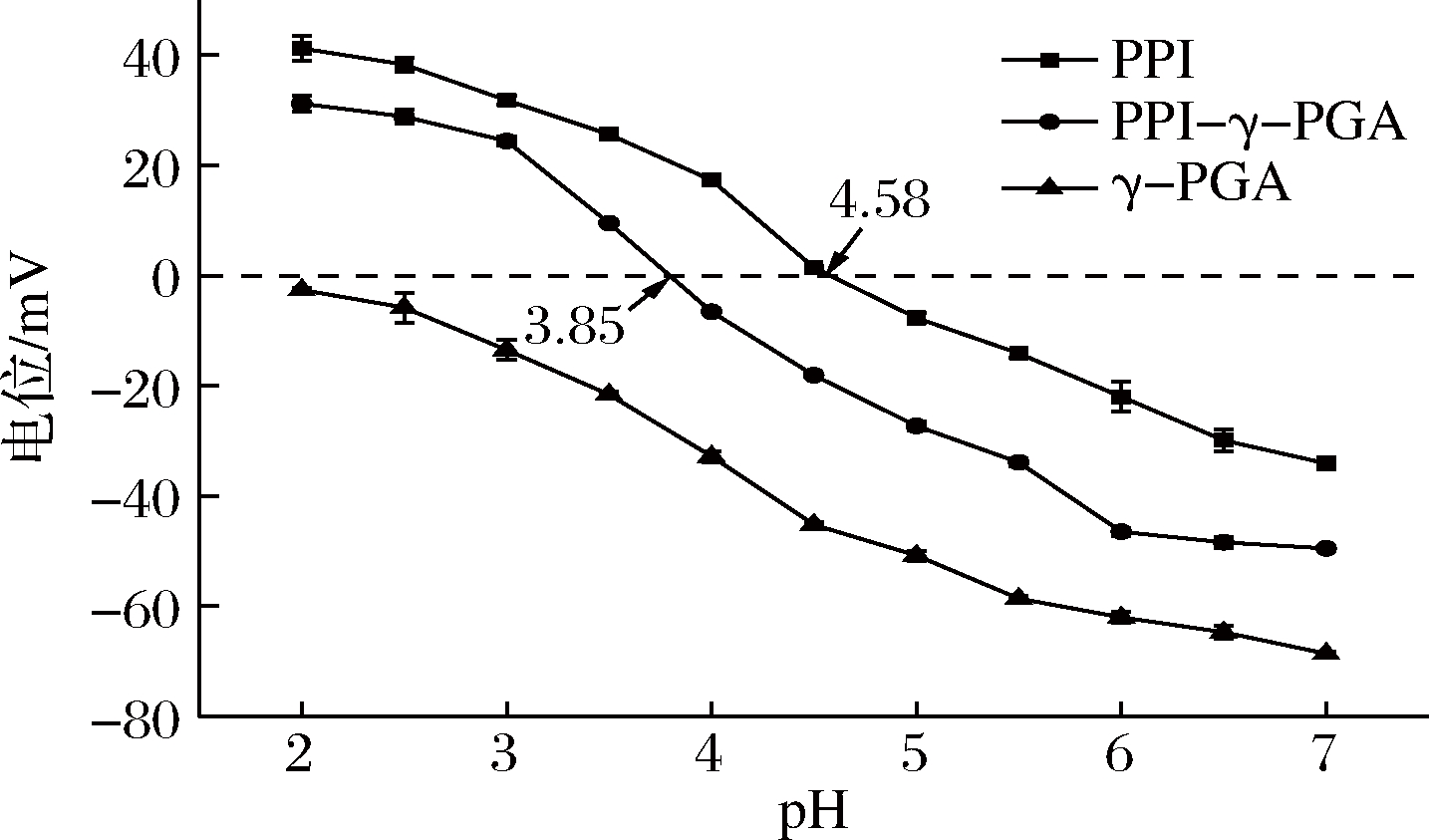
图2 pH对复合溶液ζ-电位的影响
Fig.2 Effect of pH on zeta potential of mixed solution
2.2 复合比例对PPI-γ-PGA复合物形成的影响
研究了低蛋白浓度时复合比例对复合物形成的影响。参考LAN等[6]和LIU等[18]的方法确定了临界转变点(pHs),当pH>pHs时,有可溶性复合物生成,体系状态为可溶相,当pH

图3 复合比例对pHs的影响
Fig.3 Influence of mixing ratio on pHs
2.3 不同蛋白浓度对复合物形成的影响
由于浊度分析只适合研究低浓度下蛋白与多糖的相互作用,通过相图分析来研究浓度对复合物形成的影响。PPI与γ-PGA复合水溶液在不同的pH条件下表现为清晰、浑浊、部分相分离以及完全相分离4种状态。清晰和浑浊表明体系都为可溶相,部分相分离及完全相分离表明体系为不溶相。与LAN等[6]的研究相似,在相图中存在可溶相与不溶相的边界线。在低蛋白浓度下,上方的白色可溶相区域随复合比例的减小而增大(图4-a),表明与相转变相关的临界转变点也向酸性方向移动,这与pHs随复合比例变化的结果相一致。与图4-a相似,图4-b也观察到可溶相区域随复合比例的减小而增大的现象,表明高浓度下pHs也随复合比例的减小而减小;但图4-b中黑色不溶相的区域更大,可溶相与不溶相的边界线向上方移动,说明pHs较低蛋白浓度复合体系有所增大。

a-低蛋白质量浓度(0.5 g/L);b-高蛋白质量浓度(10.0 g/L)
图4 复合体系的相图
Fig.4 Phase diagram of the mixed system
研究了2种蛋白浓度下复合体系电位随pH变化的情况,见图5。

a-低蛋白质量浓度(0.5 g/L);b-高蛋白质量浓度(10.0 g/L)
图5 pH对复合溶液的ζ-电位的影响
Fig.5 Effect of pH on zeta potential of mixed solution
图5中电位曲线的变化表明复合比例与体系的电位表现出一定的依赖性。复合比例影响着形成复合体系整体的电荷数量,当复合比例r由20减小到1时,体系中的γ-PGA数量增大,此时有更多的γ-PGA提供负电荷,当其与PPI携带的正电荷发生中和后,体系的电荷量发生改变,复合溶液的电位曲线整体向下移动。在图5中也观察到PPI的等电点向酸性方向移动,表明静电相互作用提高了PPI在酸性条件下的稳定性。注意到2种蛋白浓度下复合体系的电位较为接近,但在相图中高蛋白浓度体系却更不稳定,如pH 4.5时,高蛋白浓度体系仅有复合比r=1与r=2中无相分离出现,而低蛋白浓度体系在复合比例为r=5时,体系中便未出现相分离。这可能是因为高蛋白浓度下,体系中的大分子数量较多,此时需要更多的γ-PGA来提供阴离子羧基与PPI上的氨基结合,以提供更强的静电斥力来阻止分子间的聚集[19]。
2.4 微观结构
对pH 4.5时高蛋白浓度的复合体系进行了微观结构分析。图中绿色区域为蛋白,黑色区域为水相或多糖相。图6-d~图6-g中可以看到蛋白发生了大范围的聚集,而在图6-c中蛋白仅发生了小范围的聚集,表明γ-PGA开始起到了一定的阻止聚集的作用。图6-a、图6-b中可以看到大分子均匀分散的状态,表明PPI与γ-PGA形成了可溶性复合物,体系保持稳定。樊雪静等[20]通过激光共聚焦也发现,单独的大豆分离蛋白在pH 6.0时出现小范围聚集,而大豆分离蛋白和寡糖形成的可溶性静电复合物却能保持分散。
2.5 PPI与γ-PGA相互作用对蛋白溶解度的影响
蛋白质的溶解度影响着蛋白质的乳化性,通常溶解度高的蛋白质具有较高的界面迁移率[21]。图7为高蛋白浓度复合体系在pH 4.5时的溶解度。随着复合比例由大变小,溶解度先降低后升高。当复合比例r=10、15、20时,蛋白溶解度比PPI略低,这可能是因为当γ-PGA分子数量较少时,PPI与γ-PGA发生桥联絮凝,在庞淑婕等[22]的研究中也发现了相似的现象。当r≤5时,复合体系的溶解度显著升高(P<0.05),在r=1时达到了最大值52.46%,这与MOLINA等[23]在大豆分离蛋白和卡拉胶复合体系的研究结果相似。随着复合比例的减小,体系中γ-PGA的数量增大,其与PPI形成复合物后,复合物表面的电荷数量增多,分子间的静电斥力增大,蛋白溶解度增大。

a-r=1;b-r=2;c-r=5;d-r=10;e-r=15;f-r=20;g-PPI
图6 pH 4.5时不同复合比例下的微观结构
Fig.6 Microstructure of different mixing ratios at pH 4.5

图7 pH 4.5时不同复合比例下的蛋白溶解度
Fig.7 Protein solubility at different mixing ratio at pH 4.5
注:小写字母不同表示组间差异显著(P<0.05)(下同)
2.6 PPI与γ-PGA相互作用对乳化性和表面疏水性的影响
研究表明,蛋白的乳化能力与蛋白质自身的溶解特性、蛋白组成、分子大小、柔韧性以及表面疏水性有关,通常疏水性越强,蛋白吸附在界面上的能力越强,乳化能力越好[24]。图8为不同复合比例下蛋白的表面疏水性。

图8 pH 4.5时不同复合比例下PPI的表面疏水性
Fig.8 Surface hydrophobicity of PPI at different mixing ratio at pH 4.5
随着复合比例由大变小,蛋白的表面疏水性显著增大(P<0.05),表明静电相互作用使PPI内部的一些疏水基团暴露出来,提高了蛋白的表面疏水性,同时这也说明蛋白的三级结构发生了变化[25]。观察到r=5的表面疏水性最大,但在图9中并未表现出最佳的乳化性能,这是因为此时蛋白溶解度较低的原因,尽管蛋白能较快吸附在界面上,但参与乳化的蛋白的数量远小于r=1和r=2的体系[26]。
图9为pH 4.5时不同复合比例下PPI的乳化活性与乳化稳定性。随着复合比例由大变小,乳化活性与乳化稳定性先降低后增大。

图9 pH 4.5时不同复合比例下PPI的乳化活性和乳化稳定性
Fig.9 Emulsification activity and emulsification stability of PPI at different mixing ratio at pH 4.5
这是因为当复合比较高时(r=10、15、20),蛋白溶解度与表面疏水性都较低。图5-b的电位数据也表明此时体系整体的静电斥力较低,无法阻止大分子间的聚集。当体系中的大多数蛋白发生沉淀,参与乳化的蛋白数量太少不足以包裹油滴时,小油滴便逐渐聚集成大油滴,体系发生乳析分层[27]。随着复合比例的降低,γ-PGA与PPI通过静电相互作用形成了可溶性复合物,溶解度与表面疏水性的增大使参与乳化的蛋白分子数量增多,界面吸附能力增强,因此乳化活性得到改善。此外可溶性复合物的形成也增大了体系的静电斥力和空间位阻,PPI-γ-PGA复合物包裹油滴后,液滴之间彼此排斥,乳液稳定性增强[22]。
3 结论
通过研究pH、复合比例、蛋白浓度对PPI与γ-PGA静电复合的影响,发现在酸性环境下低蛋白浓度与高蛋白浓度的复合体系都表现出pHs随复合比例减小而减小的现象。在高蛋白浓度(10.0 g/L),当pH<4.5时,γ-PGA没有起到足够强的稳定作用,各个复合体系中都有沉淀出现。而在pH 4.5时,复合比r≤2的体系因具有较大静电斥力在微观和宏观上都能保持稳定;静电相互作用使蛋白的溶解度和表面疏水性增大,改善了蛋白的乳化能力。当r=1时,蛋白的乳化活性与乳化稳定性最好。综上,通过PPI与γ-PGA的静电复合可以提高PPI在酸性条件下的稳定性。
[1] ADEBIYI A P, ALUKO R E.Functional properties of protein fractions obtained from commercial yellow field pea (Pisum sativum L.) seed protein isolate[J].Food Chemistry, 2011, 128(4):902-908.
[2] LIANG H N, TANG C H.pH-dependent emulsifying properties of pea[Pisum sativum (L.)] proteins[J].Food Hydrocolloids, 2013, 33(2):309-319.
[3] ALUKO R E, MOFOLASAYO O A, WATTS B M.Emulsifying and foaming properties of commercial yellow pea (Pisum sativum L.) seed flours[J].Journal of Agricultural and Food Chemistry, 2009, 57(20):9 793-9 800.
[4] TUINIER R, ROLIN C, DE KRUIF C G.Electrosorption of pectin onto casein micelles[J].Biomacromolecules, 2002, 3(3):632-638.
[5] LIN D Q, LU W, KELLY A L,et al.Interactions of vegetable proteins with other polymers:Structure-function relationships and applications in the food industry[J].Trends in Food Science & Technology, 2017, 68:130-144.
[6] LAN Y, CHEN B C, RAO J J.Pea protein isolate-high methoxyl pectin soluble complexes for improving pea protein functionality:Effect of pH, biopolymer ratio and concentrations[J].Food Hydrocolloids, 2018, 80:245-253.
[7] LIU S, ELMER C, LOW N H, et al.Effect of pH on the functional behaviour of pea protein isolate-gum Arabic complexes[J].Food Research International, 2010, 43(2):489-495.
[8] WAGONER T B, FOEGEDING E A.Whey protein-pectin soluble complexes for beverage applications[J].Food Hydrocolloids, 2017, 63:130-138.
[9] PARK J H, CHOI J C, SUNG M H, et al.High molecular weight poly-gamma-glutamic acid regulates lipid metabolism in rats fed a high-fat diet and humans[J].Journal of Microbiology and Biotechnology, 2011, 21(7):766-775.
[10] KHALIL I R, IRORERE V U, RADECKA I, et al.Poly-γ-glutamic acid:Biodegradable polymer for potential protection of beneficial viruses[J].Materials (Basel, Switzerland), 2016, 9(1):28.
[11] 齐蕾, 仵心军, 徐超, 等.γ-聚谷氨酸对大豆分离蛋白热稳定性的影响[J].中国粮油学报, 2021, 36(3):41-45.
QI L, WU X J, XU C, et al.Effect of γ-polyglutamic acid on thermal stability of soybean protein isolate[J].Journal of the Chinese Cereals and Oils Association, 2021, 36(3):41-45.
[12] STONE A K, KARALASH A, TYLER R T, et al.Functional attributes of pea protein isolates prepared using different extraction methods and cultivars[J].Food Research International, 2015, 76:31-38.
[13] MU L X, ZHAO M M, YANG B, et al.Effect of ultrasonic treatment on the graft reaction between soy protein isolate and gum Acacia and on the physicochemical properties of conjugates[J].Journal of Agricultural and Food Chemistry, 2010, 58(7):4 494-4 499.
[14] ZHU Z B, ZHU W D, YI J H, et al.Effects of sonication on the physicochemical and functional properties of walnut protein isolate[J].Food Research International, 2018, 106:853-861.
[15] HASKARD C A, LI-CHAN E C Y.Hydrophobicity of bovine serum albumin and ovalbumin determined using uncharged (PRODAN) and anionic (ANS-) fluorescent probes[J].Journal of Agricultural and Food Chemistry, 1998, 46(7):2 671-2 677.
[16] ARYEE F N A, NICKERSON M T.Formation of electrostatic complexes involving mixtures of lentil protein isolates and gum Arabic polysaccharides[J].Food Research International, 2012, 48(2):520-527.
[17] NIU F G, SU Y J, LIU Y T, et al.Ovalbumin-gum Arabic interactions:Effect of pH, temperature, salt, biopolymers ratio and total concentration[J].Colloids and Surfaces B:Biointerfaces, 2014, 113:477-482.
[18] LIU S H, LOW N H, NICKERSON M T.Effect of pH, salt, and biopolymer ratio on the formation of pea protein isolate-gum Arabic complexes[J].Journal of Agricultural and Food Chemistry, 2009, 57(4):1 521-1 526.
[19] AZARIKIA F, ABBASI S.Mechanism of soluble complex formation of milk proteins with native gums (tragacanth and Persian gum)[J].Food Hydrocolloids, 2016, 59:35-44.
[20] 樊雪静, 刘红玉, 迟玉杰.大豆分离蛋白与寡糖静电相互作用及复合物乳化性的分析[J].食品科学,2018,39(12):126-132.
FAN X J, LIU H Y, CHI Y J.Electrostatic interaction of soybean protein isolate with oligosaccharide and emulsifying capacity of their complexes[J].Food Science, 2018, 39(12):126-132.
[21] LOPES-DA-SILVA J A, MONTEIRO S R.Gelling and emulsifying properties of soy protein hydrolysates in the presence of a neutral polysaccharide[J].Food Chemistry, 2019, 294:216-223.
[22] 庞淑婕, 李娜娜, 任思, 等.豌豆分离蛋白-羧甲基纤维素纳静电复合物在乳液中的应用研究[J].食品工业科技, 2020, 41(21):75-80.
PANG S J, LI N N, REN S, et al.Application of pea protein isolate-carboxymethylcellulose complex in emulsions[J].Science and Technology of Food Industry, 2020, 41(21):75-80.
[23] MOLINA ORTIZ S E, PUPPO M C, WAGNER J R.Relationship between structural changes and functional properties of soy protein isolates-carrageenan systems[J].Food Hydrocolloids, 2004, 18(6):1 045-1 053.
[24] KIM H J, DECKER E A, MCCLEMENTS D J.Influence of protein concentration and order of addition on thermal stability of beta-lactoglobulin stabilized n-hexadecane oil-in-water emulsions at neutral pH[J].Langmuir:the ACS Journal of Surfaces and Colloids, 2005, 21(1):134-139.
[25] DUCEL V, RICHARD J, POPINEAU Y, et al.Rheological interfacial properties of plant protein-Arabic gum coacervates at the oil-water interface[J].Biomacromolecules, 2005, 6(2):790-796.
[26] AZARIKIA F, ABBASI S.Efficacy of whey protein-tragacanth on stabilization of oil-in-water emulsions:Comparison of mixed and layer by layer methods[J].Food Hydrocolloids, 2016, 59:26-34.
[27] LEERMAKERS F A M, ATKINSON P J, DICKINSON E, et al.Self-consistent-field modeling of adsorbed β-casein:Effects of pH and ionic strength on surface coverage and density profile[J].Journal of Colloid and Interface Science, 1996, 178(2):681-693.