南极磷虾是一种形似虾的海洋甲壳类动物,与其他无脊椎动物的肌肉相似,南极磷虾的肌原纤维蛋白占总蛋白的60%,关于南极磷虾的研究主要集中在蛋白质提取方面,然而,由于其内源性蛋白酶活性较高,极易自溶导致凝胶特性差、质地粗糙和持水力低等现象[1-2]。凝胶的形成主要与肌肉来源类型,蛋白含量和离子强度等有关[3]。肉糜制品的弹性取决于其凝胶特性,但如果没有功能性添加剂(蛋白酶抑制剂、增稠剂),南极磷虾蛋白通常不能形成凝胶[4]。南美白对虾(Litopenaeus vannamei)是西半球的主要虾种,研究表明南美白对虾糜凝胶比其他鱼类鱼糜具有更高的交联度、弹性和硬度,其微观结构相对致密[5]。因此,在保留南极磷虾风味并充分利用肌肉组织的同时,提高其凝胶性能是一个亟需解决的问题。
淀粉或变性淀粉是糜类制品加工中最常见的添加剂,它们可以降低成本提高鱼糜产品的质量,与天然淀粉相比,变性淀粉通常具有更高的溶胀能力和溶解度[6]。羟丙基木薯淀粉(hydroxypropyl cassava starch,HCS)是原淀粉经醚化而成的变性淀粉,含有亲水的羟丙基基团,在吸水过程中会阻碍自身的交联,提高水合能力,在凝胶形成过程中,淀粉糊化吸水膨胀填充在凝胶网络中,使凝胶网络更加致密,以增强凝胶强度[7]。研究表明淀粉能够增加肉糜的弹性模量(G′)提高产品的硬度和弹性,然而过量的淀粉会影响鱼糜凝胶形成,降低凝胶强度[7-10]。
目前,关于羟丙基木薯淀粉对南极磷虾糜凝胶特性和分子间作用力影响的研究较少。因此,本文以未漂洗的南极磷虾和南美白对虾为原料,研究添加不同比例的羟丙基木薯淀粉对南极磷虾混合虾糜3D打印特性、凝胶强度、质构特性、持水性、流变学特性、水分分布特性、分子间作用力、蛋白质二级结构及微观结构的影响,确定HCS最适添加量,为南极磷虾糜制品的产业化生产提供理论依据。
1 材料与方法
1.1 材料与仪器
冷冻南极磷虾、南美白对虾,辽渔集团;羟丙基木薯淀粉,苏州高峰;食盐,大连市山姆会员店;溴化钾,国药集团;戊二醛固定液(2.5%),雷根生物;无水乙醇,天津科密欧试剂有限公司;尿素,生工生物工程有限公司;NaCl、β-巯基乙醇,天津大茂化学试剂厂;Bradford蛋白浓度测定试剂盒,上海碧云天生物技术有限公司。
SD-JR53绞肉器,佛山三的电器制造有限公司;3D打印机,上海富奇凡科技有限公司;TA.XT.plus质构仪,英国SMS公司;XHF-DY高速分散器,宁波新芝生物科技有限公司;DHR-2流变仪,上海TA仪器有限责任公司;MesoQMR23-060H核磁共振分析仪、Frontier傅里叶变换红外光谱仪,日本铂金埃尔默仪器有限公司;CP100 NX高速冷冻离心机、SU8010冷场发射扫描电镜,株式会社日立制作所;K850二氧化碳超临界干燥仪,南京覃思科技有限公司;LC-1.0冷冻干燥机,沈阳航空信阳速冻厂。
1.2 实验方法
1.2.1 混合虾糜及凝胶制备
1.2.1.1 混合虾糜
冷冻的南美白对虾、南极磷虾于4 ℃下解冻。按照南极磷虾∶南美白对虾=1∶1(质量比)称重,添加食盐(质量分数1.5%),用绞肉机斩拌10 min,分别加入虾糜总质量0%,0.5%,1%,2%,4%的羟丙基木薯淀粉继续斩拌3 min,调节水分含量至80%左右。控制整个流程温度低于4 ℃,混合虾糜过40目筛,立即用于3D打印。
1.2.1.2 混合虾糜热诱导凝胶制备
取1.2.1.1制备好的混合虾糜灌入柱状PC管(长×宽×高=25 mm×25 mm×30 mm),保鲜膜包裹,参考LUO等[7]的方法采用二段式加热的方法,于40 ℃加热60 min;90 ℃加热30 min后,置于冰水冷却20 min, 4 ℃冰箱过夜储藏。
1.2.2 3D打印
将1.2.1.1制备好的混合虾糜导入到3D打印机的进料筒中,选择打印图形(圆柱,直径25 mm,高20 mm),设置喷嘴直径为1 mm,打印速度为15 mm/s,平台移动速度为20 mm/s,打印温度为25 ℃[10]。
1.2.3 凝胶强度测定
将室温平衡30 min后的热诱导凝胶切成高30 mm的圆柱,用质构仪的P/5S球形金属探头测定其凝胶强度。测试前后速度1 mm/s,测试速度1 mm/s,时间30 s,穿刺比50%,触发力5 g。记录破裂力和破裂距离[9]。凝胶强度计算如公式(1)所示:
凝胶强度/(g·mm)=破裂力(g)×破裂距离(mm)
(1)
1.2.4 全质构测定
样品前处理同1.2.3。用质构仪的P/50圆柱形探头测试其质构特性,测试前后速度2 mm/s,测试速度1 mm/s,连续2次下压,形变量50%,触发力5 g[9]。
1.2.5 持水力和水分分布测定
将热诱导凝胶切成质量2 g左右的段,每段精确称重m0,用3层滤纸包裹后离心(4 000 r/min,20 min)。离心后迅速取出样品, 用滤纸吸干表面水分,立刻称重m1。样品的持水力按公式(2)计算[2]。
持水力![]()
(2)
将热诱导凝胶切成(2 cm×2 cm×2 cm)左右的柱体,将表面的水吸干,用聚乙烯薄膜包裹后置于32 ℃永磁场的射频线圈中心,使用CPMG脉冲序列测定样品的自旋-自旋弛豫时间(T2)。测试参数:采样频率200 kHz,模拟增益=20,90°脉冲=22 μs,数字增益=2,重复采样等待时间3 000 ms,累加次数8,180°脉冲=43.04 μs,回波时间0.5 ms,回波个数3 000。测试结束对数据进行反衍[7]。
1.2.6 流变学性质测定
1.2.6.1 频率扫描
采用流变仪测定混合虾糜及热诱导凝胶的流变学性质。测试参数:直径40 mm及20 mm平行板,测试温度25 ℃,应变为0.5%,两板间隙1 mm。在频率0.1~70 Hz内进行振荡扫描。测定扫描频率与样品弹性模量(G′)、黏性模量(G″)之间的关系[10]。
1.2.6.2 温度扫描
制备的混合虾糜置于DHR-2流变仪平台上在振荡模式,线性黏弹区范围内进行温度扫描。测试参数:直径40 mm平行板,频率为1 Hz,应变为0.5%,两板间隙1 mm,温度20~90 ℃,升温速率5 ℃/min。
1.2.7 化学作用力测定
准确称取虾糜凝胶样品(2.0 g),分别加入10 mL 0.05 mol/L NaCl溶液(S0),0.6 mol/L NaCl溶液(S1),0.6 mol/L NaCl溶液+1.5 mol/L 尿素(S2),0.6 mol/L NaCl溶液+8 mol/L尿素(S3),0.6 mol/L NaCl溶液+8 mol/L尿素+0.6 mol/L β-巯基乙醇(S4),采用高速分散机匀浆(10 000 r/min,1 min),4 ℃冰箱静置提取1 h后离心(10 000 r/min,10 min),采用Bradford法测定上清液中蛋白质含量[11]。含量计算如下所示:离子键=S1-S0;氢键=S2-S1;疏水相互作用=S3-S2;二硫键=S4-S3。
1.2.8 傅里叶变换红外光谱分析
将冻干样品粉与溴化钾按1∶100的质量比混合,用研钵研磨均匀。压片后,利用傅里叶变换红外光谱仪在4 000~400 cm-1内扫描,得到光谱。利用OMNIC软件分析该蛋白二级结构变化[5]。
1.2.9 微观结构分析
将热诱导凝胶切成3 mm厚方块,密封在玻璃瓶子后加入2.5%的戊二醛溶液,置于4 ℃冰箱浸泡48 h,用去离子水清洗后用梯度浓度的乙醇脱水,每次15 min,并浸泡在无水乙醇中。用CO2临界点干燥仪置换,最后使用扫描电子显微镜放大2万倍扫描微观结构[11]。
1.3 数据处理
所有试验平行测定3次,结果为均值±标准差。实验数据采用IBM SPSS统计软件进行方差和显著性分析,显著性水平P<0.05,使用Origin 2021软件进行图表绘制。
2 结果与分析
2.1 3D打印特性分析
添加不同比例的HCS对混合虾糜3D打印特性的影响见图1。材料的性质和成分是影响3D打印过程的重要因素,材料不仅需要具有合适的黏弹性,还需要有适当的流变性,淀粉不仅能够增加产品保水性和弹性,而且还可以有效改善打印材料的流动性和成型效果[12-14]。混合虾糜体系是一种黏性的凝胶,而凝胶是一种具有半刚性的溶胶体,3D打印与其凝胶性能密切相关[15]。对照组的打印圆柱基本成型但存在变形现象,层与层之间存在明显缝隙,粘合效果差;俯视面凹凸不平,层与层之间分界清晰且存在塌陷现象,这可能与南极磷虾未经漂洗,水分含量高,盐溶性蛋白含量低,且内源性蛋白酶活性较高,极易自溶,导致黏弹性和支撑性较差有关[1]。随着HCS比例的增加,柱体表面变得光滑平整,断裂减少,在HCS添加量达到1%时,打印的柱体与预期设计尺寸接近一致,层与层之间无明显变形现象,这是因为淀粉吸水膨胀会增加复合物的黏度,形成具有不同强度的黏弹性系统,从而增加打印过程的支撑性和黏弹性[12]。然而,HCS添加量超过2%时,打印柱体出现了变形,且材料挤出连续性变差。PAN等[10]研究发现过量的淀粉会使材料的流动性变差,挤出困难,导致打印性状变差。因此,添加1%淀粉能够改善物料断丝,提高打印精度和支撑稳定性,且增强其打印特性。

图1 3D打印预设模型及模型打印照片(a);不同含量的羟丙基木薯淀粉对混合虾糜3D打印特性的影响(b)
Fig.1 3D printing preset model and model print photo (a);Effect of different HCS on 3D printing properties of mixed shrimp surimi gel (b)
注:b图中Ⅰ为正视图;Ⅱ为俯视图
2.2 凝胶强度分析
如图2所示,添加HCS对混合虾糜热诱导凝胶强度有显著影响(P<0.05),凝胶强度随着淀粉比例的增大呈现先上升后下降的趋势。与对照相比,添加0.5% HCS混合虾糜热诱导凝胶的凝胶强度显著提高了18%(P<0.05)。这归因于加热过程中,虾糜蛋白变性展开,淀粉与蛋白中的反应基团相互作用交联,形成淀粉-虾糜复合体系,同时淀粉吸水膨胀对蛋白质基质施加压力,此外,低浓度的淀粉能够促进凝胶中的疏水相互作用,从而提高凝胶强度[7,16]。然而,当HCS的添加量超过0.5%,凝胶强度呈现下降趋势,这是因为过量的淀粉与虾糜蛋白竞争水分,不能充分糊化,导致虾糜蛋白浓度降低,从而降低凝胶强度,这与MI等[9]的研究结果相似。

图2 羟丙基木薯淀粉对混合虾糜热诱导凝胶强度的影响
Fig.2 Effect of HCS on gel strength of mixed shrimp surimi heat-induced gel
注:不同小写字母代表差异显著(P<0.05)(下同)
2.3 全质构特性分析
HCS添加量对混合虾糜热诱导凝胶质构特性的影响如表1所示。与对照相比,添加HCS对混合虾糜热诱导凝胶的质构特性具有显著影响(P<0.05),随着淀粉添加量的增加,热诱导凝胶的硬度显著上升(P<0.05),这是由于氢键能够在凝胶冷却后重新形成,提高样品硬度[17]。而弹性、黏聚性、咀嚼度和回复性呈现先上升后下降的趋势,在0.5%时达到了最大值,这与LUO等[7]的研究结果相似,在加热过程中淀粉吸水膨胀对凝胶基质产生压力,导致凝胶网络结构更加紧密,但过高的淀粉含量会稀释肌原纤维蛋白浓度,导致质构特性的下降[18]。
表1 羟丙基木薯淀粉对混合虾糜热诱导凝胶质构特性的影响
Table 1 Effects of HCS on texture properties of mixed shrimp surimi heat-induced gel

HCS添加量/%硬度/g弹性黏聚性咀嚼度回复性0839.429±1.322e0.632±0.012a0.297±0.004a150.671±3.850b0.101±0.000b0.5899.902±11.185d0.638±0.017a0.306±0.003a181.051±9.766a0.107±0.002a1983.326±22.159c0.607±0.015ab0.260±0.008b148.490±5.373b0.101±0.002b21 148.968±14.041b0.580±0.004bc0.202±0.000c131.298±2.315c0.070±0.003c41 311.990±33.821a0.558±0.042c0.179±0.004d130.661±11.618c0.052±0.001d
注:不同小写字母表示同列之间差异显著(P<0.05)(下同)
2.4 持水力和水分分布分析
持水力是反映凝胶结构和影响最终产品感官属性的重要参数,凝胶网络结构越密集,持水能力越强[10]。随着HCS添加量的增大,凝胶的持水力显著增加(P<0.05),当HCS添加量为4%时,与对照相比提高了50%。这可能是由于HCS的羟丙基引起分子间和分子内排斥,提高淀粉延展性,增强水与淀粉间的相互作用,使淀粉颗粒锁住更多水分,从而增加了混合虾糜凝胶的持水力[19]。MI等[9]也证实随着 HCS添加量的增加,鲢鱼鱼糜凝胶的持水能力增加。
混合虾糜热诱导凝胶的横向弛豫时间(T2)和水分分布状态如图3-b和表2所示,所有HCS添加量都存在3个峰,从左到右依次为T21(0.01~10 ms)、T22(10~200 ms)和T23(>200 ms),分别代表了结合水,不易流动水和自由水[7]。T22在T2图谱中占比最大,占总信号的91%~95%,反映了水的主要成分。与对照相比,随着HSC添加量的增大,T22和T23呈逐渐右移的趋势,而T21在0%~1%内呈左移趋势,在0.5%添加量下达到最小值,当添加量继续增大,T21开始呈现右移趋势,说明添加淀粉能够增强对水的束缚作用,增加结合水的含量,而结合水含量过高则会导致弛豫时间延长。与对照组相比,添加淀粉后,混合虾糜热诱导凝胶体系中结合水(A21)和不易流动水(A22)的相对含量显著上升(P<0.05),且随着淀粉添加量的增大而上升,在4%添加量下达到最大,而自由水(A23)的相对含量随着淀粉添加量的增大呈下降趋势,说明自由水向不易流动水和结合水迁移,使凝胶持水性增强,这可能是由于淀粉在加热过程中,淀粉分子中游离的羟基在氢键作用下结合成网络结构,并充分吸水,使体系中的结合水和不易流动水增多,自由水减少[10]。此外,羟丙基基团具有强亲水性,可以使凝胶与水分子紧密结合增强水的稳定性[6],这与持水性结果相似。

a-持水力;b-弛豫时间
图3 羟丙基木薯淀粉对混合虾糜热诱导凝胶持水力和弛豫时间的影响
Fig.3 Effect of HCS on WHC and T2 of shrimp surimi heat-induced gels
2.5 流变学分析
2.5.1 频率扫描
图4显示了HCS添加量对混合虾糜及热诱导凝胶弹性模量和黏性模量与频率变化的影响。流变性质的变化能够影响3D打印过程中样品堆积的稳定性[20]。在相同的测定条件下,弹性模量(G′)和黏性模量(G")具有相似的变化趋势,且弹性模量(G′)始终大于黏性模量(G″),表明样品在凝胶过程中弹性大于黏性,表现为类固体性质[21]。如图4-a所示,虾糜样品的G′和G″都随着振荡频率的增大而增大,这可能与混合虾糜内蛋白分子之间相互作用逐渐形成网络结构,进而形成弹性较强的凝胶有关[22]。在同一频率下,G′和G″表现出随淀粉添加量的增加而增加趋势,这是由淀粉溶胀导致凝胶网络更加紧密导致的[7]。结合3D打印特性,对照组虾糜的G′和G″较小,在打印过程中易出现断裂现象,导致打印性状差,淀粉的添加增加了虾糜的G′和G″,利于虾糜连续挤出改善打印性能。然而,虾糜经40 ℃水浴60 min和90 ℃水浴30 min热诱导后,凝胶的G′和G″显著提高,这与虾糜经热诱导后大量的蛋白质发生聚集,凝胶网络结构更加紧密有关[23]。此外,热诱导凝胶的G′和G″随着HCS添加量的增加呈现先上升后下降的趋势,当HCS添加量超过1%时,热诱导凝胶的G′和G″值下降,表明混合虾糜凝胶的黏弹性模量没有随着淀粉量的增加而提高,这是因为随着淀粉含量的增加,疏水相互作用和离子键会降低,对凝胶基质产生负面影响,从而阻碍凝胶网络的形成[9]。
表2 不同HCS添加量的混合虾糜热诱导凝胶3种状态的水分相对百分比
Table 2 Relative water content in the three states of mixed shrimp minced heat-induced gel with different HCS additions
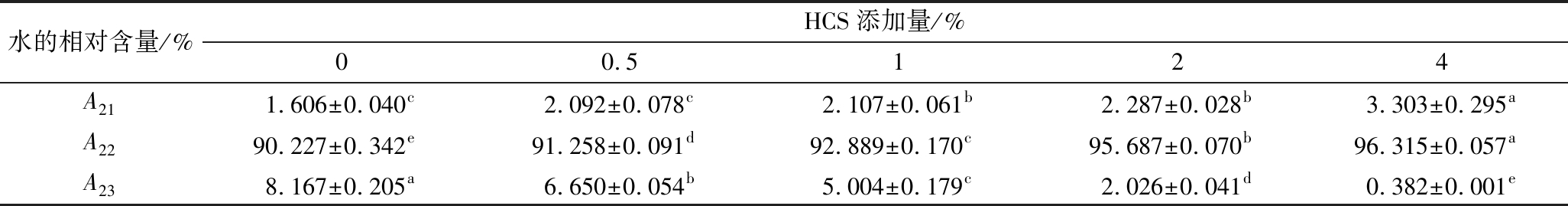
水的相对含量/%HCS添加量/%00.5124A211.606±0.040c2.092±0.078c2.107±0.061b2.287±0.028b3.303±0.295aA2290.227±0.342e91.258±0.091d92.889±0.170c95.687±0.070b96.315±0.057aA238.167±0.205a6.650±0.054b5.004±0.179c2.026±0.041d0.382±0.001e
注:A代表峰面积占总峰面积的百分比

a-混合虾糜;b-热诱导凝胶
图4 羟丙基木薯淀粉对混合虾糜和热诱导凝胶>流变学性质的影响
Fig.4 Effect of HCS on rheological properties of mixed shrimp surimi and heat-induced gel
2.5.2 温度扫描
如图5所示,添加HCS的虾糜弹性模量(G′)和黏性模量(G″)随着温度的升高(20~45 ℃)均呈现下降的趋势,并在45 ℃左右达到最低值,这是因为随着温度的升高氢键被破坏,同时虾糜中的内源性水解酶活性提高,肌原纤维蛋白发生降解,蛋白质分子延伸,虾糜网络结构被破坏,流动性增强,发生凝胶劣化[24]。此外,添加HCS后,虾糜的G′和G″在20~50 ℃明显低于对照组,且随着淀粉含量的增加而降低。有研究发现添加淀粉会降低鱼糜在5~55 ℃内的G′,这是因为为了保持相同的水分含量,淀粉会起到非活性填料的作用,代替部分虾糜蛋白,从而使G′随填料的增加而下降[18]。而且随着淀粉比例的增大,虾糜凝胶劣化区G′的最低点向高温方向移动,这可能是因为淀粉的糊化程度不同以及淀粉加入使得分子间聚集,阻碍了维持稳定网络结构的化学键形成,导致G′的最低点温度高于对照组[9]。进一步加热(45~90 ℃),虾糜的G′和G″在70~90 ℃明显高于对照组,这是因为加热使肌球蛋白和肌动蛋白重链发生变性,疏水相互作用、二硫键等化学键形成造成大量蛋白质聚集,导致虾糜凝胶网络继续增强,同时淀粉本身具有一定的黏弹性,吸水膨胀后填充在虾糜凝胶网络中,膨胀的淀粉对凝胶基质产生一定的挤压,导致G′迅速增大[23]。并在80 ℃左右趋于稳定,高温处理导致氢键被破坏,形成有序的不透明蛋白质凝胶网络[25]。
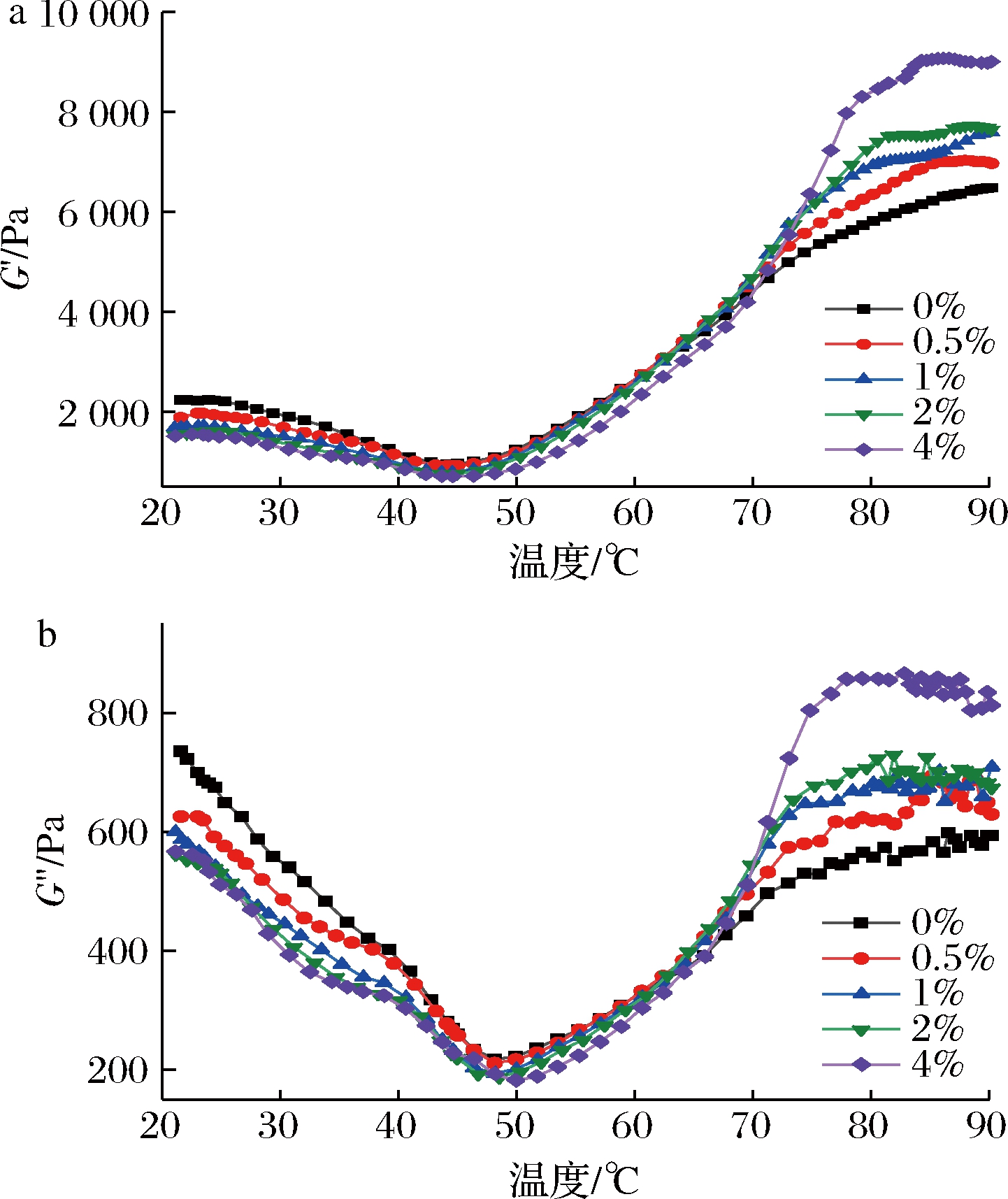
a-G′;b-G″
图5 羟丙基木薯淀粉对混合虾糜动态流变学性质的影响
Fig.5 Effect of HCS on dynamic rheological properties of mixed shrimp surimi
2.6 化学作用力分析
非共价键(包括非特异性缔合、离子键、氢键和疏水相互作用)在维持凝胶三维结构和增强凝胶强度方面发挥着重要作用[26]。如图6所示,氢键含量随着HSC添加量的增加呈现上升趋势,氢键是偶极键,与凝胶硬度和持水力密切相关,氢键的增加是造成南极磷虾虾糜硬度增加的主要原因[17]。在加热过程中,除了二硫键形成,疏水相互作用的形成被认为是加热或高压诱导鱼糜凝胶形成的主要机制[27],与其他非共价键相比,凝胶基质中的疏水相互作用占主导地位,它们对维持凝胶网络稳定性至关重要。在低浓度(0.5%)的HCS添加量下,混合虾糜凝胶中的二硫键含量和疏水相互作用增加。当HCS的添加量为2%和4%时,淀粉阻碍了凝胶网络的形成,凝胶中的离子键、疏水作用和二硫键呈下降趋势,这与凝胶强度结果一致。因此,在混合虾糜体系中添加少量的淀粉能够增强虾糜的疏水相互作用,进一步提高虾糜的凝胶强度。

图6 羟丙基木薯淀粉对混合虾糜凝胶化学作用力的影响
Fig.6 Effect of HCS on the chemical force of mixed shrimp surimi gel
2.7 蛋白质二级结构分析
图7显示了混合虾糜和混合虾糜热诱导凝胶的蛋白质二级结构相对含量的变化。随着淀粉添加量的增加,混合虾糜中蛋白质的二级结构发生了显著变化(P<0.05)。随着HCS添加量的增大,β-折叠呈现先上升后下降的趋势,α-螺旋呈现先下降后上升的趋势,无规则卷曲含量无显著性变化(P>0.05)。凝胶的强度与α-螺旋含量呈负相关,与β-折叠含量呈正相关,此外羟丙基基团的引入可以改善虾糜蛋白的构象,利于疏水基团与淀粉之间的相互作用,在虾糜蛋白中形成更多的β-折叠,形成紧密的网络结构[25, 28],因此混合虾糜的凝胶强度提高。与虾糜相比,添加0.5%HCS的虾糜经热诱导形成凝胶后,β-折叠和无规则卷曲含量显著上升,由42.44%和8.90%分别上升到49.35%和14.49%(表3),β-转角含量显著下降(P<0.05),淀粉添加量继续增大,β-折叠和无规则卷曲含量呈现下降趋势,β-转角含量上升,α-螺旋无显著变化,这与倪伟等[29]关于羟丙基二淀粉磷酸酯(hydroxypropyl distarch phosphate,HPDSP)对中华管鞭虾虾糜凝胶二级结构变化的研究相似,加热引起β-折叠增加表明蛋白质结构比未加热基团更有序和稳定。

a-混合虾糜;b-热诱导凝胶
图7 羟丙基木薯淀粉对混合虾糜和热诱导凝胶中
蛋白质二级结构的影响
Fig.7 Effect of HCS on protein secondary structure of mixed shrimp surimi and heat-induced gel
表3 不同HCS添加量的混合虾糜和热诱导凝胶蛋白质二级结构含量
Table 3 The protein secondary structure of mixed shrimp surimi and heat-induced gel with different HCS additions
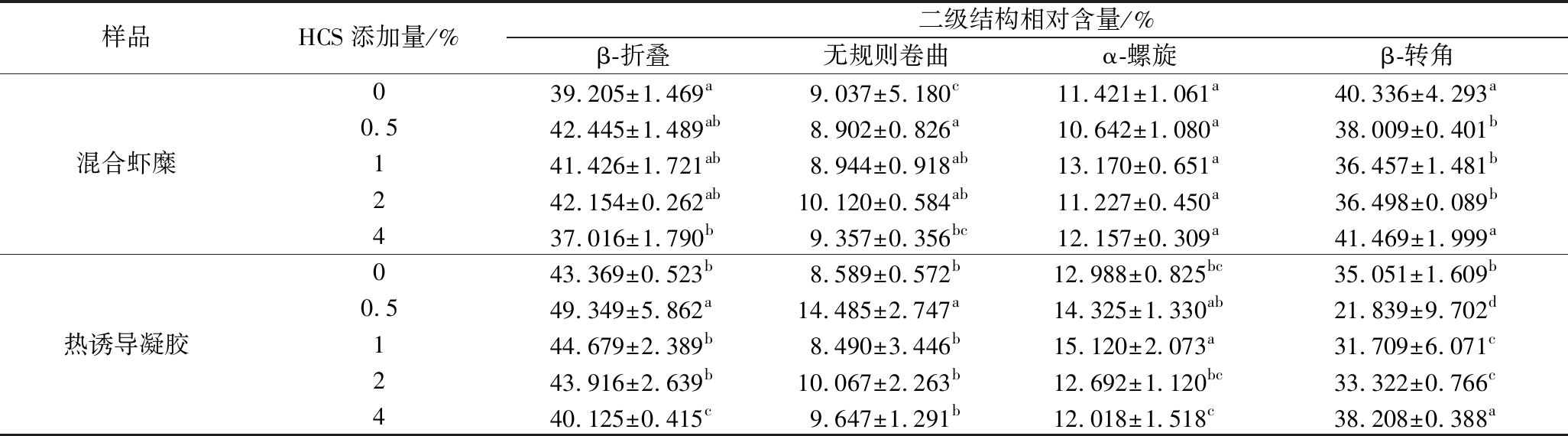
样品HCS添加量/%二级结构相对含量/%β-折叠无规则卷曲α-螺旋β-转角混合虾糜039.205±1.469a9.037±5.180c11.421±1.061a40.336±4.293a0.542.445±1.489ab8.902±0.826a10.642±1.080a38.009±0.401b141.426±1.721ab8.944±0.918ab13.170±0.651a36.457±1.481b242.154±0.262ab10.120±0.584ab11.227±0.450a36.498±0.089b437.016±1.790b9.357±0.356bc12.157±0.309a41.469±1.999a热诱导凝胶043.369±0.523b8.589±0.572b12.988±0.825bc35.051±1.609b0.549.349±5.862a14.485±2.747a14.325±1.330ab21.839±9.702d144.679±2.389b8.490±3.446b15.120±2.073a31.709±6.071c243.916±2.639b10.067±2.263b12.692±1.120bc33.322±0.766c440.125±0.415c9.647±1.291b12.018±1.518c38.208±0.388a
2.8 微观结构分析
图8为添加不同质量分数的HCS对混合虾糜热诱导凝胶微观结构的影响。与添加HCS的凝胶相比,对照组显示出疏松的网络结构,存在较多的蛋白质聚集体和孔洞,添加少量HCS的凝胶交联度增加,形成有序且均匀的孔洞结构,这与凝胶强度一致。然而,随着HCS添加量的增大,凝胶基质网络结构变得松散,孔洞增加,这可能是由于过量的淀粉会吸水膨胀到蛋白质网络中施加高压影响其在凝胶结构中的均匀性,破坏了网络结构[25]。HUNT等[16]发现,淀粉糊化有助于增加淀粉和蛋白质之间界面的断裂强度,但高溶胀能力可能形成较差的蛋白质网络框架。结果表明,添加0.5%的羟丙基木薯淀粉有利于混合虾糜凝胶形成,凝胶强度最高。

图8 羟丙基木薯淀粉对混合虾糜凝胶微观结构影响(×20 000)
Fig.8 Effect of HCS on the microstructure of shrimp surimi gel
3 结论
添加HCS可以有效提高混合虾糜的3D打印精度和支撑稳定性,含有1%HCS的虾糜的打印精度和稳定性最高。此外,HCS的适当添加提高了混合虾糜的G′和G″,使样品易于从喷嘴中挤出,提高了样品流动性和堆积性,解决了样品打印过程中断丝的现象。少量的HCS(<1%)能够增加混合虾糜凝胶中二硫键的形成和疏水相互作用,稳定网络结构,有效改善混合虾糜的凝胶强度;凝胶中的氢键随着淀粉含量的增加呈现上升的趋势,自由水向不易流动水转变,对水的束缚作用增强,凝胶的持水性显著增高。但添加过量的HCS会导致凝胶质构特性变化,凝胶的硬度增大,弹性降低。少量淀粉可促进蛋白质二级结构从α-螺旋向β-折叠转变,使凝胶结构更为紧密。加入0.5% HCS的混合虾糜热诱导凝胶具有更均匀密集的网络结构。因此,添加少量的HCS有利于提高混合虾糜凝胶特性,改善虾糜制品品质,为HCS在南极磷虾虾糜制品中产业化应用提供依据。
[1] SUZUKI T, SHIBATA N.The utilization of Antarctic krill for human food[J].Food Reviews International, 1990, 6(1):119-147.
[2] ZHENG H N, BEAMER S K, MATAK K E, et al.Effect of κ-carrageenan on gelation and gel characteristics of Antarctic krill (Euphausia superba) protein isolated with isoelectric solubilization/precipitation[J].Food Chemistry, 2019, 278:644-652.
[3] SUN X D, HOLLEY R A.Factors influencing gel formation by myofibrillar proteins in muscle foods[J].Comprehensive Reviews in Food Science and Food Safety, 2011, 10(1):33-51.
[4] 吴香, 李新福, 李聪, 等.变性淀粉对肌原纤维蛋白凝胶特性的影响[J].食品科学, 2020, 41(2):22-28.
WU X, LI X F, LI C, et al.Effect of different modified starches on gel properties of myofibrillar protein[J].Food Science, 2020, 41(2):22-28.
[5] YANG Y, LIU X Y, XUE Y, et al.The process of heat-induced gelation in Litopenaeus vannamei[J].Food Hydrocolloids, 2020, 98:105260.
[6] 米红波, 王聪, 仪淑敏, 等.淀粉在鱼糜制品中的应用研究进展[J].食品与发酵工业, 2018, 44(1):291-295.
MI H B, WANG C, YI S M, et al.Research progress on starch use in surimi seafood[J].Food and Fermentation Industries, 2018, 44(1):291-295.
[7] LUO H B, GUO C X, LIN L, et al.Combined use of rheology, LF-NMR, and MRI for characterizing the gel properties of hairtail surimi with potato starch[J].Food and Bioprocess Technology, 2020, 13(4):637-647.
[8] 畅阳. 不同种木薯变性淀粉对肌原纤维蛋白热诱导凝胶特性的影响[D].南京:南京农业大学, 2012.
CHANG Y.Effects of different modified tapioca starches on the heat-induced gelation properties of myofibrillar protein[D].Nanjing:Nanjing Agricultural University, 2012.
[9] MI H B, WANG C, SU Q, et al.The effect of modified starches on the gel properties and protein conformation of Nemipterus virgatus surimi[J].Journal of Texture Studies, 2019, 50(6):571-581.
[10] PAN Y M, SUN Q X, LIU Y, et al.The relationship between rheological and textural properties of shrimp surimi adding starch and 3D printability based on principal component analysis[J].Food Science & Nutrition, 2021, 9(6):2 985-2 999.
[11] 钟坦君, 洪鹏志, 周春霞, 等.没食子酸对金线鱼鱼糜凝胶特性及其体外消化产物活性的影响[J].食品科学, 2022,43(14):76-84.
ZHONG T J, HONG P Z, ZHOU C X, et al.Effect of Gallic acid on gel properties and in vitro activity of digested products of Nemipterus virgatus surimi[J].Food Science, 2022,43(14):76-84.
[12] DONG X P, HUANG Y, PAN Y X, et al.Investigation of sweet potato starch as a structural enhancer for three-dimensional printing of Scomberomorus niphonius surimi[J].Journal of Texture Studies, 2019, 50(4):316-324.
[13] LIU Z B, ZHANG M, BHANDARI B, et al.3D printing:Printing precision and application in food sector[J].Trends in Food Science & Technology, 2017, 69:83-94.
[14] 王琳. 鲢鱼糜凝胶体系的挤压式三维打印研究[D].无锡:江南大学, 2017.
WANG L.Research on extrusion-based 3D printing surimi gel system[D].Wuxi:Jiangnan University, 2017.
[15] WANG L, ZHANG M, BHANDARI B, et al.Investigation on fish surimi gel as promising food material for 3D printing[J].Journal of Food Engineering, 2018, 220:101-108.
[16] HUNT A, GETTY K J K, PARK J W.Roles of starch in surimi seafood:A review[J].Food Reviews International, 2009, 25(4):299-312.
[17] HOWE J R, HAMANN D D, LANIER T, et al.Fracture of Alaska pollock gels in water:Effects of minced muscle processing and test temperature[J].Journal of Food Science, 1994, 59:777-780.
[18] JIANG X, CHEN Q, XIAO N Y, et al.Changes in gel structure and chemical interactions of Hypophthalmichthys molitrix surimi gels:Effect of setting process and different starch addition[J].Foods (Basel, Switzerland), 2021, 11(1):9.
[19] LAWAL O S.Hydroxypropylation of pigeon pea (Cajanus cajan) starch:Preparation, functional characterizations and enzymatic digestibility[J].LWT-Food Science and Technology, 2011, 44(3):771-778.
[20] DICK A, BHANDARI B, DONG X P, et al.Feasibility study of hydrocolloid incorporated 3D printed pork as dysphagia food[J].Food Hydrocolloids, 2020, 107:105940.
[21] 潘燕墨. 食品配料改善虾肉糜3D打印适应性的研究[D].湛江:广东海洋大学, 2021.
PAN Y M.Research on improving the adaptability of 3D printing of shrimp surimi by adjusting food ingredients[D].Zhanjiang:Guangdong Ocean University, 2021.
[22] 李勇, 程裕东.白鲢鱼糜流变特性的研究[J].食品科学, 2007, 28(10):100-104.
LI Y, CHENG Y D.Rheological properties of silver carp surimi[J].Food Science, 2007, 28(10):100-104.
[23] 鲍佳彤. 外源添加物对未漂洗鲶鱼鱼糜凝胶形成的影响[D].天津:天津农学院, 2020.
BAO J T.Effects of exogenous additives on surimi gel formation in unwashed catfish[D].Tianjin:Tianjin Agricultural University, 2020.
[24] SUN F Y, HUANG Q L, HU T, et al.Effects and mechanism of modified starches on the gel properties of myofibrillar protein from grass carp[J].International Journal of Biological Macromolecules, 2014, 64:17-24.
[25] 王聪. 淀粉和亲水胶体对白鲢鱼鱼糜凝胶特性的增效作用研究[D].锦州:渤海大学, 2019.
WANG C.Synergistic effect of starch and hydrocolloid on gel properties of silver carp surimi[D].Jinzhou:Bohai University, 2019.
[26] LIU Y, SUN Q X, WEI S, et al.Insight into the correlations among rheological behaviour, protein molecular structure and 3D printability during the processing of surimi from golden pompano (Trachinotus ovatus)[J].Food Chemistry, 2022, 371:131046.
[27] VISESSANGUAN W, OGAWA M, NAKAI S, et al.Physicochemical changes and mechanism of heat-induced gelation of arrowtooth flounder myosin[J].Journal of Agricultural and Food Chemistry, 2000, 48(4):1 016-1 023.
[28] MI H B, LI Y, WANG C, et al.The interaction of starch-gums and their effect on gel properties and protein conformation of silver carp surimi[J].Food Hydrocolloids, 2021, 112:106290.
[29] 倪伟, 米杰, 孙仲麒, 等.羟丙基二淀粉磷酸酯对虾糜凝胶特性及其蛋白结构的影响[J].水产学报, 2021, 45(7):1 181-1 190.
NI W, MI J, SUN Z Q, et al.Effects of hydroxypropyl distarch phosphate on the gel properties and protein structure of shrimp surimi[J].Journal of Fisheries of China, 2021, 45(7):1 181-1 190.