糖尿病作为慢性非传染性代谢性疾病,其主要临床特征为高血糖,近年来糖尿病患者人数逐年增多,已严重危害人体的健康和生活质量[1]。缓解糖尿病及其并发症的有效途径是控制并降低血糖,目前抑制α-淀粉酶和α-葡萄糖苷酶的活性已成为治疗餐后高血糖的主要途径[2]。此外,人体正常生长代谢过程中活性氧的产生,会导致自由基的合成,而高浓度的自由基会导致氧化应激产生[1],减少β细胞的胰岛素分泌,并损害靶组织中的胰岛素信号传导,从而引起Ⅱ型糖尿病及其并发症。由此说明,氧化应激与糖尿病并发症密切相关,清除自由基的抗氧化疗法为糖尿病的治疗提供了新的方向[3],因此,天然抗氧化剂具有潜在的降糖作用。
目前治疗糖尿病的药物以化学合成类为主,存在安全性低、副作用多、成本高的问题,而天然降糖功能因子不仅来源广泛、副作用小、价格低廉,且结合适当运动能较好地控制糖尿病患病率,是日常保健、调养的良好手段。目前,治疗糖尿病的天然功能因子有多糖类、黄酮类、生物碱类、萜类、活性肽等,其中,活性肽因其安全性高、营养价值高、易消化的特点备受青睐。牡蛎,俗称蚝,双壳类软体动物,是我国沿海地区一种重要的海洋经济贝类,养殖产量高居贝类之首[4],其营养价值高,素有“海底牛奶”之美称[5],是我国卫生部门批准的第一批药食同源的海产品之一。牡蛎具有高蛋白低脂肪的特点,是制备生物活性肽的良好来源,研究报道牡蛎肽具有抗氧化、抗肿瘤、降血压、降糖及改善男性生理功能等活性[6-10]。牡蛎肽因具备特殊海洋环境赋予的独特氨基酸序列结构,在抗氧化和降糖应用方面具有天然优势[11-12],有替代抗氧化剂和降糖剂的潜在能力,在营养和健康方面具有广阔的应用前景。
目前对牡蛎肽的抗氧化活性研究比较成熟,但对牡蛎生物活性肽的降糖活性及胃肠消化特性研究甚少。本试验利用酶解法制备牡蛎肽,采用HPLC技术分析其分子质量分布,采用液相色谱串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)技术鉴定其肽谱特征。随后建立体外模拟胃肠消化模型,结合抗氧化活性评价模型(DPPH自由基清除率)和降糖活性评价模型(α-淀粉酶和α-葡萄糖苷酶抑制率)探究牡蛎肽经体外模拟胃肠消化后的短肽含量及氨基酸组分变化、抗氧化和降糖活性变化,以期为牡蛎肽消化吸收和稳态化保护提供科学依据。
1 材料与方法
1.1 材料与试剂
香港牡蛎(Crassostrea hongkongensis),湛江市东风市场;Folin-酚试剂盒,北京鼎国昌盛生物技术有限公司;2,2-联苯基-1-苦基肼基(1,1-diphenyl-2-picrylhydrazyl,DPPH)、三氟乙酸,上海麦克林生物科技有限公司;α-淀粉酶(≥5 U/mg),美国Sigma公司;DNS试剂,美国Solarbio公司;α-葡萄糖苷酶(33 U/mg)、胃蛋白酶(高纯,1∶10 000)、中性蛋白酶(100 U/mg),上海源叶生物科技有限公司;胰蛋白酶(≥250 u/mg),上海阿拉丁生化科技股份有限公司;乙腈,赛默飞世尔科技公司;甲酸,Dima Technology INC公司;乙腈、三氟乙酸为色谱纯,其他试剂均为分析纯。
1.2 仪器与设备
FE28型pH计,梅特勒-托利多仪器(上海)有限公司;SHJ-6AB磁力搅拌水浴锅,常州金坛良友仪器有限公司;Agilent 1200 LC半制备高效液相色谱仪,美国Agilent有限公司;Q Exactive全自动酶标仪和质谱仪,赛默飞世尔科技公司;Ultimate3000高效液相色谱仪,美国Dionex公司。
1.3 实验方法
1.3.1 牡蛎肽的制备
参考ZHANG等[8]和柏昌旺等[13]的方法并稍作修改。新鲜牡蛎开壳取肉,使用超纯水快速洗净,牡蛎全肉打浆均匀,按料液比1∶3(g∶mL)加超纯水,调至中性蛋白酶最适pH值,8 000 r/min均质2 min,加入中性蛋白酶后于50 ℃水浴酶解4 h,沸水浴灭酶10 min,静置冷却至室温,离心(8 000 r/min,4 ℃)15 min,收集上清液并冷冻干燥。
1.3.2 牡蛎肽相对分子质量分布
利用HPLC分析牡蛎肽的分子质量分布,参考GB/T 22729—2008《海洋鱼低聚肽粉》。分析条件:TSKgel G4000SW(7.8 mm×300 mm)色谱柱;流动相:V(乙腈)∶V(水)∶V(三氟乙酸)=45∶55∶0.1;色谱运行条件:检测波长214 nm;流动相等度洗脱,速率0.5 mL/min;柱温,室温;进样体积20 μL;标准品,L-酪氨酸(Mw=181.19 Da)、维生素B12(Mw=1 355.37 Da)、溶菌酶(Mw=2 899.27 Da)、抑肽酶(6 511.51 Da)。以相对分子质量的对数(lgMw)对保留时间作线性回归方程,得到标准曲线方程为:lgMw=-0.077t+4.8118,R2=0.972 4。
1.3.3 牡蛎肽的肽谱特征及肽序列分析
采用LC-MS/MS技术鉴定牡蛎肽的肽谱特征和序列,色谱柱:Acclaim PepMap 100(75 μm × 2 cm),C18,3 μm,100Å;分析柱:喷针一体柱,75 μm×15 cm,填料为:C18,5 μm,150Å。流动相A:0.1%甲酸水溶液,流动相B:0.1%甲酸乙腈溶液,线性梯度洗脱流程:0~40 min,B相0%~30%、流速0.4 μL/min;40~48 min,B相30%~80%、流速0.4 μL/min;进样量10 μL;质谱条件:正离子模式、一级扫描范围为350~2 000 Da、一级扫描分辨率70 000、二级扫描范围依赖于一级母离子质荷比自动选择、二级碰撞能量28%;二级分辨率17 500、毛细管温度360 ℃、离子源电压1 800 V、碎裂模式HCD。
1.3.4 体外模拟胃肠道消化
参照GONG等[14]的方法并稍作修改。配制模拟胃液:将2 g NaCl、3.2 g胃蛋白酶、7.0 mL浓盐酸溶于水,并定容至1 000 mL,调节pH至(2.0±0.1);配制模拟肠液:取6.8 g KH2PO4,用250 mL水溶解,加77 mL NaOH(0.2 mol/L), 10 g胰蛋白酶,加水定容至1 000 mL并调节pH至(6.8±0.1)。取一定量的牡蛎肽溶解于100 mL模拟胃液,充分溶解后置于磁力搅拌水浴锅(37 ℃)中模拟胃消化2 h,转速为200 r/min。胃消化完毕后,100 ℃沸水浴10 min进行灭酶;待消化液冷却至室温,用1 mol/L NaOH调节pH至(6.8±0.1),4 ℃、8 000 r/min离心10 min,收集上清液,4 ℃储存待用。取等比例胃消化液和模拟肠液充分混匀后,放入37 ℃磁力搅拌水浴锅模拟肠消化4 h,转速为200 r/min。肠消化完毕后,100 ℃沸水浴10 min灭酶,待冷却至室温,4 ℃、8 000 r/min离心10 min,收集上清液,4 ℃储存待用。
1.3.5 牡蛎肽短肽含量测定
采用Folin-酚试剂盒分析短肽含量,取1 mL样品溶液和5 mL Folin-酚试剂甲液,室温放置10 min,加入0.5 mL Folin-酚试剂乙液,立即混匀,于室温静置30 min,在500 nm处测定其吸光值。选用牛血清白蛋白(bovine serum albumin,BSA)作为标准品,按照相同方法分别加入Folin-酚试剂后测定吸光值,以BSA的质量浓度(μg/mL)为横坐标,吸光值为纵坐标,得到线性回归方程:![]() 0.000 6x+0.053 4,R2=0.981 8。将样品测得的吸光值对照标准曲线计算短肽质量浓度。
0.000 6x+0.053 4,R2=0.981 8。将样品测得的吸光值对照标准曲线计算短肽质量浓度。
1.3.6 牡蛎肽消化后的氨基酸组成分析
氨基酸含量测定参考GB/T 5009.124—2016《食品中氨基酸的测定》。
1.3.7 DPPH自由基清除率测定
将DPPH溶解于无水乙醇中,充分振摇,避光保存。参考马勇等[15]的方法,以L-抗坏血酸为阳性对照,样品组依次加入100 μL试样和100 μL DPPH溶液于96孔板中;空白组用无水乙醇代替DPPH溶液;对照组为100 μL无水乙醇和100 μL DPPH溶液混合,于避光处反应30 min,517 nm处测其吸光值。DPPH自由基清除率按公式(1)计算。
DPPH自由基清除率![]()
(1)
1.3.8 α-淀粉酶活性抑制测定
参考潘玥[16]的方法,以阿卡波糖为阳性对照,取50 μL样品溶液和50 μL α-淀粉酶溶液(1.25 U/mL)于2 mL离心管,用涡旋振荡器混匀后于37 ℃水浴10 min,加入100 μL 1%(质量分数)淀粉溶液,该体系混匀后于37 ℃水浴10 min,加入400 μL DNS试剂于沸水浴中反应10 min,冷却至室温,加入1 mL蒸馏水稀释,540 nm 测吸光值。实验设置样品组、样品空白组、对照组和空白组,样品空白组用PBS(0.02 mol/L,pH=6.8,下同)代替α-淀粉酶溶液,对照组用PBS代替样品溶液,空白组用PBS代替α-淀粉酶和样品溶液;α-淀粉酶抑制率按公式(2)计算。
α-淀粉酶抑制率![]()
(2)
式中:A1,样品组吸光值;A2,样品空白组吸光值;A3,对照组吸光值;A4,空白组吸光值。
1.3.9 α-葡萄糖苷酶活性抑制测定
参考潘玥[16]的方法,采用PNPG法测定α-葡萄糖苷酶抑制活性,以阿卡波糖为阳性对照。取50 μL样品溶液和50 μL α-葡萄糖苷酶溶液(1.26 U/mL)于2 mL离心管,用涡旋振荡器混匀后于37 ℃水浴 10 min,加入100 μL PNPG溶液(6 mmol/L),该体系混匀后于37 ℃水浴1 h后,加入1 mL Na2CO3 溶液(1 mol/L)终止反应,于405 nm处测吸光值。实验设置样品组、样品空白组、对照组和空白组,样品空白组用PBS代替α-葡萄糖苷酶溶液,对照组用PBS代替样品溶液,空白组用PBS代替α-淀粉酶和样品溶液;α-葡萄糖苷酶抑制率按公式(3)计算。
α-葡萄糖苷酶抑制率![]()
(3)
式中:A1,样品组吸光值;A2,样品空白组吸光值;A3,对照组吸光值;A4,空白组吸光值。
1.4 数据处理
所有实验操作至少重复3次,结果以平均值±标准偏差表示。使用SPSS 26.0软件进行数据处理和方差分析,P<0.05表示差异显著且具有统计学意义。使用Origin 2022软件处理和生成图像。
2 结果与分析
2.1 牡蛎肽的相对分子质量分布
如图1所示,牡蛎肽的分子质量主要集中在2 kDa以下,占总比例的93.78%。低分子质量肽具有更好的抗氧化作用,一般的抗氧化肽是由分子质量<1 kDa的短肽组成[17]。低分子质量肽还具有良好的降糖作用,如从豆类酶解液中分离出的小于1 kDa的肽组分对α-葡萄糖苷酶的抑制率高达(76.4±0.5)%[18]。低分子质量肽,因其氨基酸残基上更活跃的侧链暴露在外部,从而增加与α-淀粉酶催化位点或子位点相互作用的可能性[19],因而具有高降糖活性。因此,牡蛎低聚肽可能具备潜在的抗氧化和降糖活性。
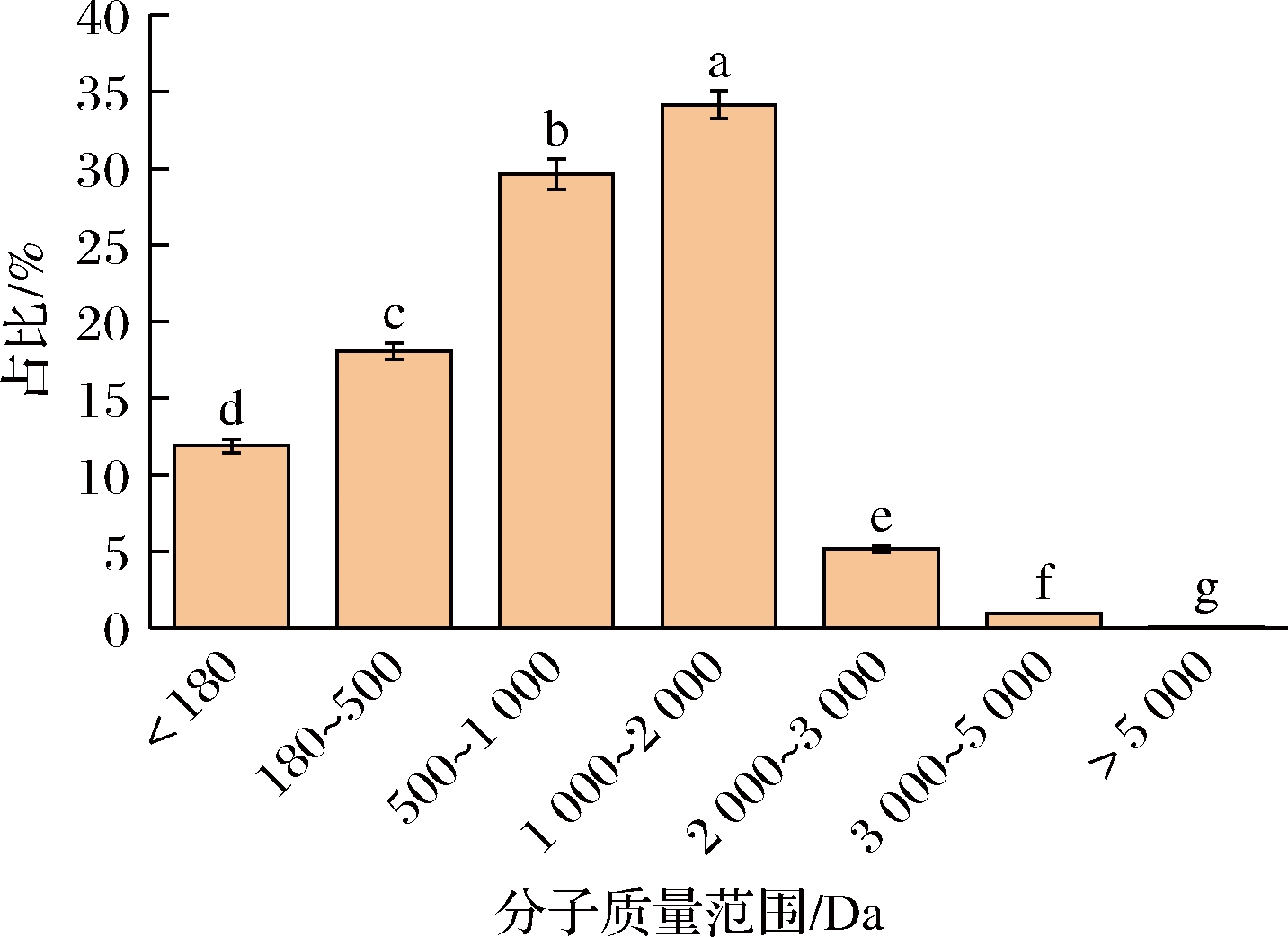
图1 牡蛎肽的分子质量分布
Fig.1 Molecular weight distribution of oyster peptides
2.2 牡蛎肽的肽谱特征及肽序列分析
采用LC-MS/MS技术分析牡蛎肽的肽谱特征及肽序列。经与数据库对比匹配到28条蛋白,检测到72条肽链,综合考虑可信度、肽链长度和匹配段数,主要肽序列如表1所示,其中可信度是指肽段匹配度,酶解后的牡蛎肽经质谱仪离子化后产生母离子且获得一级质谱,然后选择母离子进行碎裂,得到各个离子碎片的质荷比(m/z)和强度信息,从而在数据库中提取出与产生该实验质谱的母离子质量偏差在一定范围内的所有肽段形成肽谱匹配,然后预测给出每一个候选肽段的理论质谱,并计算其与对应的实验质谱的匹配度得分[20]。
表1 牡蛎肽的主要肽序列
Table 1 Main peptide sequences of oyster peptides

编号肽序列匹配段数肽链长度相对分子质量质荷比(m/z)可信度1GEPGPEGPAGPIGPR6151 386.689 3694.351 9442IDEDIEPPR591 082.523 4542.269 0533DMEGKPSPPGPS4121 197.535 1599.774 8484QDIGGQIPGNKGQN4141 424.680 3713.347 4405GEDGAEGPTGPVGPL4151 351.629 4676.822 0346GPSGEPGPEGPAGPIGPR3181 627.797 3814.905 9537YDDTYVPR381 027.462 4514.738 5358EAAKGGGETWILYRG3151 606.831 9804.423 2359SSGPIPTTPPPPPPVPK2171 664.919 5833.467 03810QEAEVFSIMENL2121 408.645 6705.330 12811SEPSEVVGPITPKPK2151 563.853 4782.934 01912LMTNMSEHH291 114.453 6558.240 24013LRGFGNPPT19957.492 1479.753 31414VDVVLPK17768.474 9385.244 74515ITTLLTAI18844.535 9423.275 2716NGEVGPLGLPG1111 008.516 2505.265 42517GLIDEDIEPPR1111 252.627 4627.321 04318YDNLPAECKLA1111 292.592 7647.303 63219GVGDDIAPR19898.451 9450.233 21420LVLECKASNPH1111 266.653 5634.334 11621LPYDKPGAPGTPK1131 339.714 1670.864 32722QDRDHIIIGWEP191 477.752 0739.883 32023GFAGDDAPRA110975.443 1488.728 837
生物活性肽特定的结构决定其生物活性的强弱,如氨基酸组成、序列、链长、疏水性和静电荷[21],也影响其在胃肠道消化过程中的稳定性,研究报道肽链N端氨基酸残基为丝氨酸(Ser)、苏氨酸(Thr)和酪氨酸(Tyr),脯氨酸(Pro)靠近C端,丙氨酸(Ala)或蛋氨酸(Met)位于C端具有较强的α-葡萄糖苷酶抑制作用。此外,疏水性氨基酸(hydrophobic amino acid,HAA)和Pro位于肽的N端前4个位置或支链氨基酸(branched chain amino acid,BCAA,包括Val、Leu和Ile)位于N端前3个位置时该肽显示出显著的DPP-IV抑制特性[22], 降糖潜力巨大。稳定肽的N端有较高比例的BCAA和Pro含量[23],这类肽同时也具有较高的抗氧化和降糖活性[24]。本研究中,23条肽序列中分别符合这些结构特征的牡蛎肽含有10条以上,其中可信度得分>50的肽段有2条(IDEDIEPPR和GPSGEPGPEGPAGPIGPR),IDEDIEPPR序列中Ile位于N端第1个位置,Pro靠近C端;GPSGEPGPEGPAGPIGPR序列中Pro位于肽链N端第2个位置且靠近C端。GPSGEPGPEGPAGPIGPR序列和GEPGPEGPAGPIGPR序列来源于太平洋牡蛎胶原蛋白α-1(X)链,该蛋白得分为80,这2条肽序列与太平洋牡蛎胶原蛋白α-1(X)链氨基酸序列的叠加如表2所示,可以直观看出水解产生的相关肽家族,结构分析显示牡蛎肽序列中HAA比例高达43.22%,尤其富含Pro,其中GEPGPEGPAGPIGPR序列N端第3个位置和靠近C端的位置都为Pro。因此基于上述序列结构特征分析,牡蛎肽可能具备潜在的抗氧化和降糖活性。
表2 牡蛎多肽序列与太平洋牡蛎胶原蛋白α-1(X)链氨基酸序列的叠加
Table 2 Overlay of oyster peptide sequences on the collagen α-1(X) chain[Crassostrea gigas] amino acid sequence
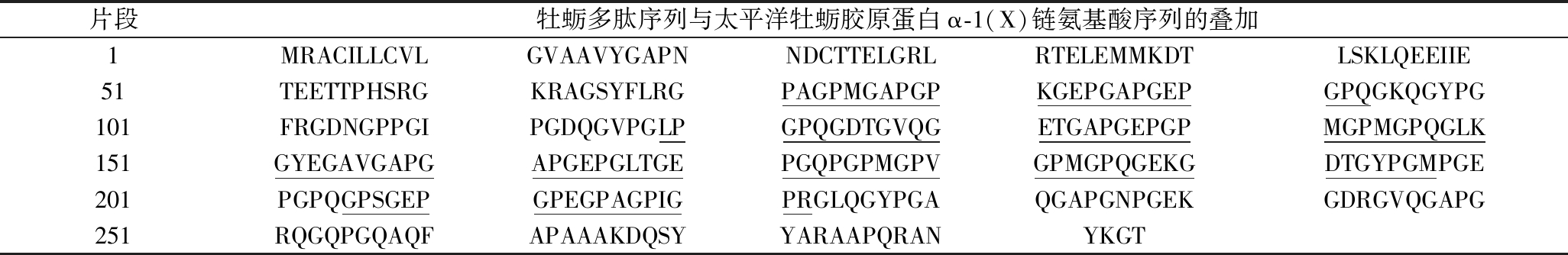
片段牡蛎多肽序列与太平洋牡蛎胶原蛋白α-1(X)链氨基酸序列的叠加1MRACILLCVLGVAAVYGAPNNDCTTELGRLRTELEMMKDTLSKLQEEIIE51TEETTPHSRGKRAGSYFLRGPAGPMGAPGPKGEPGAPGEPGPQGKQGYPG101FRGDNGPPGIPGDQGVPGLPGPQGDTGVQGETGAPGEPGPMGPMGPQGLK151GYEGAVGAPGAPGEPGLTGEPGQPGPMGPVGPMGPQGEKGDTGYPGMPGE201PGPQGPSGEPGPEGPAGPIGPRGLQGYPGAQGAPGNPGEKGDRGVQGAPG251RQGQPGQAQFAPAAAKDQSYYARAAPQRANYKGT
注:下划线表示重叠序列
2.3 胃肠消化前后短肽含量变化
如图2所示,牡蛎肽的短肽含量为24.40%,经胃液消化其短肽含量增加至37.25%,肠液消化后其短肽含量显著增加至60.72% (P<0.05)。推断是胃液中的强酸性条件及胃蛋白酶等对牡蛎肽链的裂解和酶切作用致使肽链断裂,肠液中的胰蛋白酶会进一步将牡蛎肽裂解为短肽。活性肽在胃肠道的消化过程中易被各类消化酶分解成为小肽和游离氨基酸,产生的小肽种类、肽段氨基酸数目及序列具有随机性,可能导致其生理活性降低甚至失去活性[25]。本研究中牡蛎肽经过消化后,其短肽含量显著增加,所以有必要对其消化后的生理活性进行分析。

图2 胃肠消化前后牡蛎肽的短肽含量
Fig.2 Short peptide content of oyster peptides before and after gastrointestinal digestion
2.4 胃肠消化前后氨基酸含量分析
如表3所示,牡蛎肽的活性与氨基酸组分及含量关系密切,根据胃肠消化前后各类氨基酸含量的变化(图3)来表示牡蛎肽的抗氧化和降糖活性的变化,其中必需氨基酸(essential amino acid,EAA)和HAA占比为46.94%和47.68%,与肽序列结构分析一致。牡蛎肽经过胃肠消化后,其游离氨基酸总量(total amino acid,TAA)显著增加。肽的抗自由基性质依赖于HAA的存在[26],抗氧化剂能够通过不同的机制来改善糖尿病并发症[27],RAM RZ FUENTES等[2]研究也证明含有HAA的肽序列是有效的DPP-IV抑制剂,有利于与靶酶的氢键和疏水键相互作用,因此HAA和BCAA对牡蛎肽的抗氧化和降糖功能至关重要,经过胃肠消化后其含量增加了93.13%和78.76%。牡蛎肽经过胃肠消化后氨基酸各组分变化明显,表明其相关的生理活性也会发生相应的变化,因此有必要对其活性进一步研究。
RZ FUENTES等[2]研究也证明含有HAA的肽序列是有效的DPP-IV抑制剂,有利于与靶酶的氢键和疏水键相互作用,因此HAA和BCAA对牡蛎肽的抗氧化和降糖功能至关重要,经过胃肠消化后其含量增加了93.13%和78.76%。牡蛎肽经过胃肠消化后氨基酸各组分变化明显,表明其相关的生理活性也会发生相应的变化,因此有必要对其活性进一步研究。
表3 牡蛎肽消化前后的氨基酸组分 单位:%
Table 3 Oyster enzyme lysate hydrolyzed amino acid components before and after gastrointestinal digestion
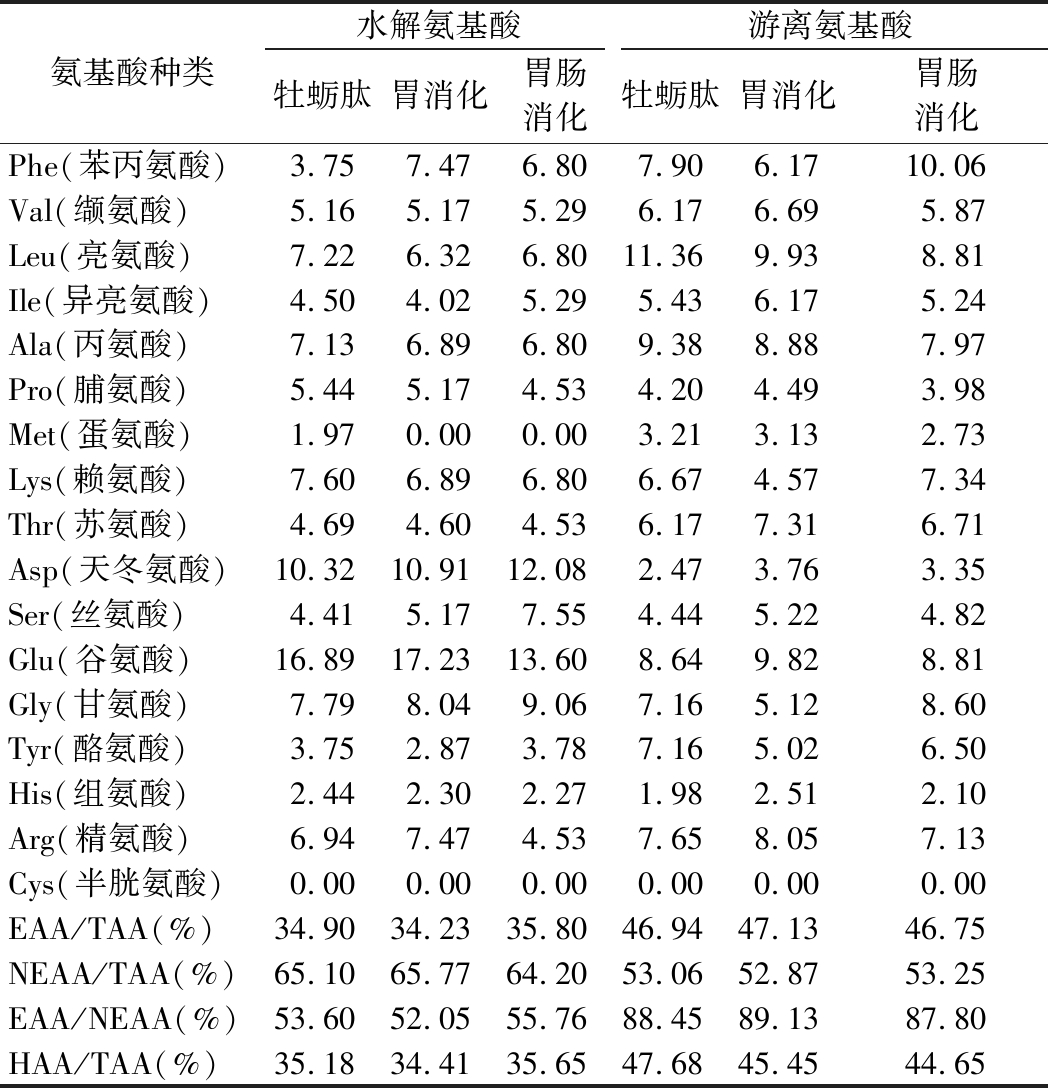
氨基酸种类水解氨基酸游离氨基酸牡蛎肽胃消化胃肠消化牡蛎肽胃消化胃肠消化Phe(苯丙氨酸)3.757.476.807.906.1710.06Val(缬氨酸)5.165.175.296.176.695.87Leu(亮氨酸)7.226.326.8011.369.938.81Ile(异亮氨酸)4.504.025.295.436.175.24Ala(丙氨酸)7.136.896.809.388.887.97Pro(脯氨酸)5.445.174.534.204.493.98Met(蛋氨酸)1.970.000.003.213.132.73Lys(赖氨酸)7.606.896.806.674.577.34Thr(苏氨酸)4.694.604.536.177.316.71Asp(天冬氨酸)10.3210.9112.082.473.763.35Ser(丝氨酸)4.415.177.554.445.224.82Glu(谷氨酸)16.8917.2313.608.649.828.81Gly(甘氨酸)7.798.049.067.165.128.60Tyr(酪氨酸)3.752.873.787.165.026.50His(组氨酸)2.442.302.271.982.512.10Arg(精氨酸)6.947.474.537.658.057.13Cys(半胱氨酸)0.000.000.000.000.000.00EAA/TAA(%)34.9034.2335.8046.9447.13 46.75NEAA/TAA(%)65.1065.7764.2053.0652.87 53.25EAA/NEAA(%)53.6052.0555.7688.4589.13 87.80HAA/TAA(%)35.1834.4135.6547.6845.45 44.65
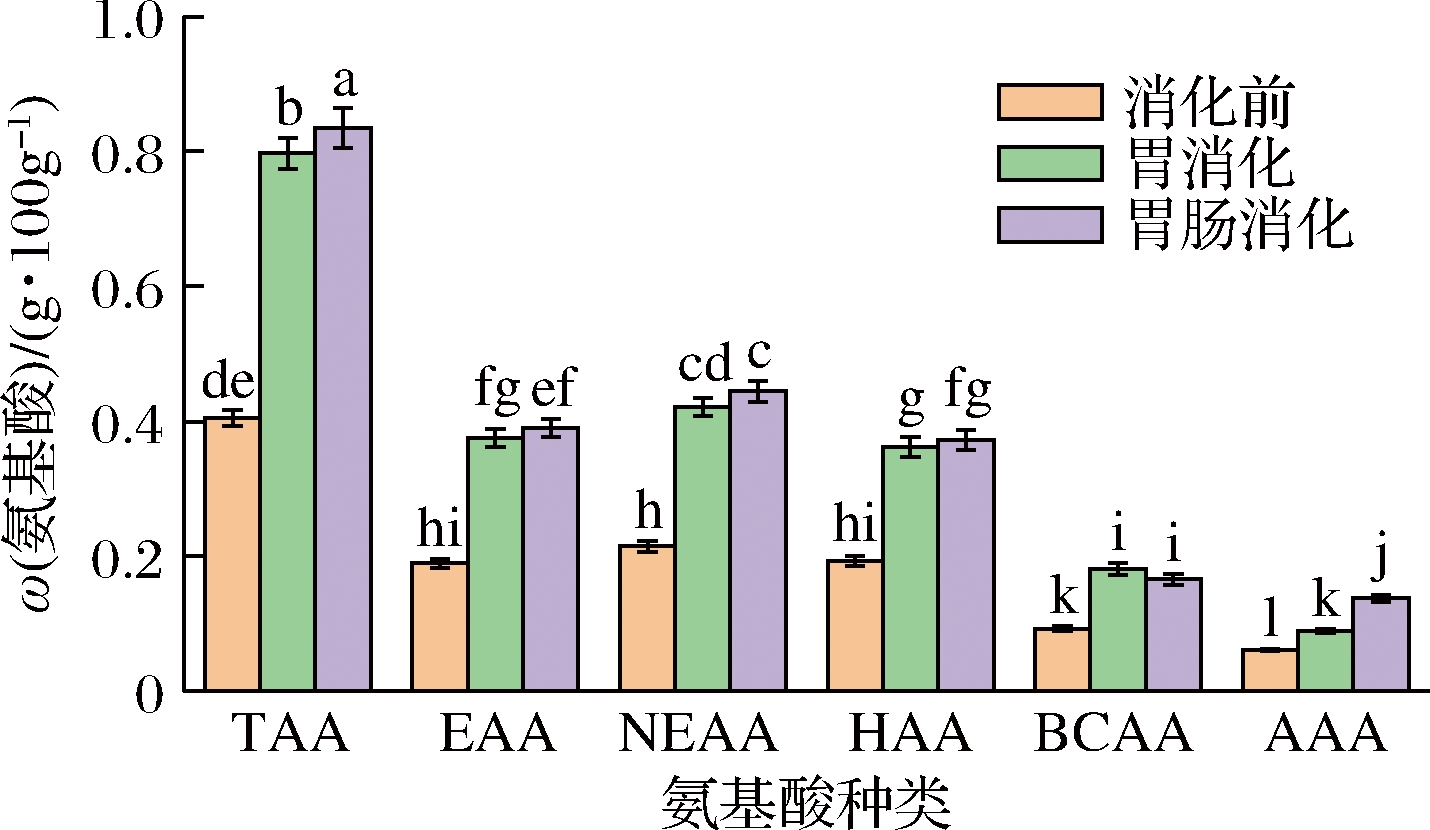
图3 胃肠消化前后牡蛎肽游离氨基酸的含量
Fig.3 Content of free amino acids before and after gastrointestinal digestion
注:AAA-芳香族氨基酸
2.5 胃肠消化对牡蛎肽的DPPH自由基清除能力的影响
DPPH自由基结构简单、性质稳定,肽类自由基抑制剂可同DPPH自由基中心的氮原子配对形成稳定的DPPH-H化合物从而表现出抗氧化性。由图4可知,质量浓度<2.50 g/L时,牡蛎肽对DPPH自由基的清除率呈明显的剂量依赖关系,IC50为1.16 g/L,马勇等[15]以去壳牡蛎肉为原料通过酶解法得到牡蛎低聚肽对DPPH自由基的IC50为6.10 g/L。
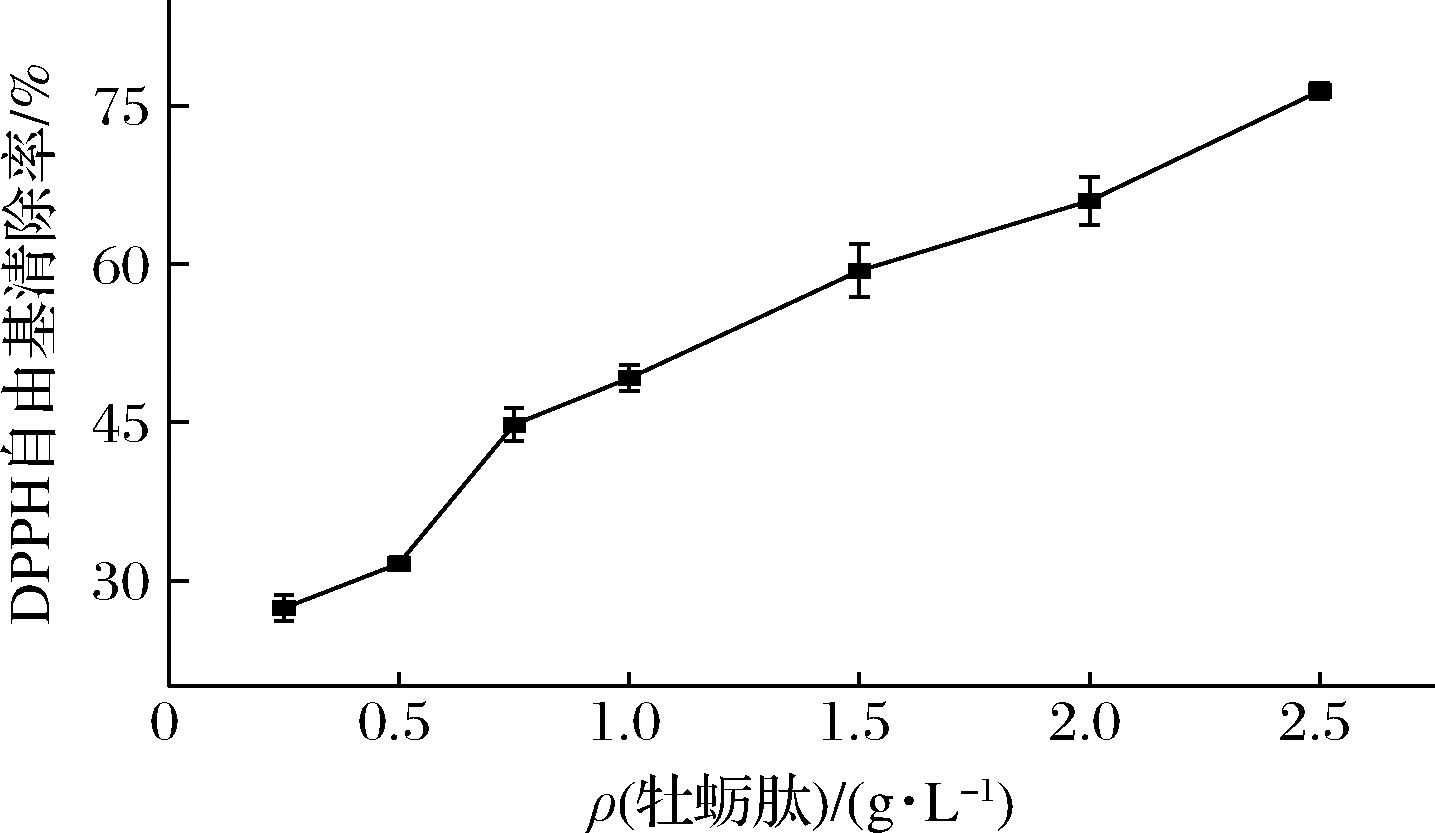
图4 牡蛎肽的DPPH自由基清除活性
Fig.4 DPPH radical-scavenging activity of oyster peptides
如图5所示,牡蛎肽质量浓度为2.50 g/L,消化前对DPPH自由基清除率为76.38%;经胃消化、胃肠消化后,其DPPH自由基清除率分别显著降低至49.25%和44.99%(P <0.05),这很可能是胃肠道的消化环境破坏了牡蛎肽发挥DPPH清除作用所需的结构。牡蛎肽在胃环境中对DPPH自由基的清除率大幅降低,其降低幅度显著高于肠消化阶段,说明胃环境(胃蛋白酶和极低的pH)不利于牡蛎肽抗氧化活性的保留。

图5 胃肠消化前后牡蛎肽的DPPH自由基清除活性
Fig.5 DPPH radical-scavenging activity of oyster peptides before and after gastrointestinal digestion
2.6 胃肠消化对牡蛎肽α-淀粉酶抑制作用的影响
α-淀粉酶是淀粉水解所需的首要酶,能加速食物中淀粉的α-1,4糖苷键水解,其抑制剂可通过减少α-1,4糖苷键的水解,减缓单糖的吸收,进而降低餐后血液中葡萄糖浓度,因此,α-淀粉酶抑制剂是治疗餐后高血糖症的重要策略[28]。由图6可知,牡蛎肽对α-淀粉酶的抑制呈剂量依赖趋势,随质量浓度增加对该酶的抑制率也逐渐增加,其IC50为0.124 g/L。
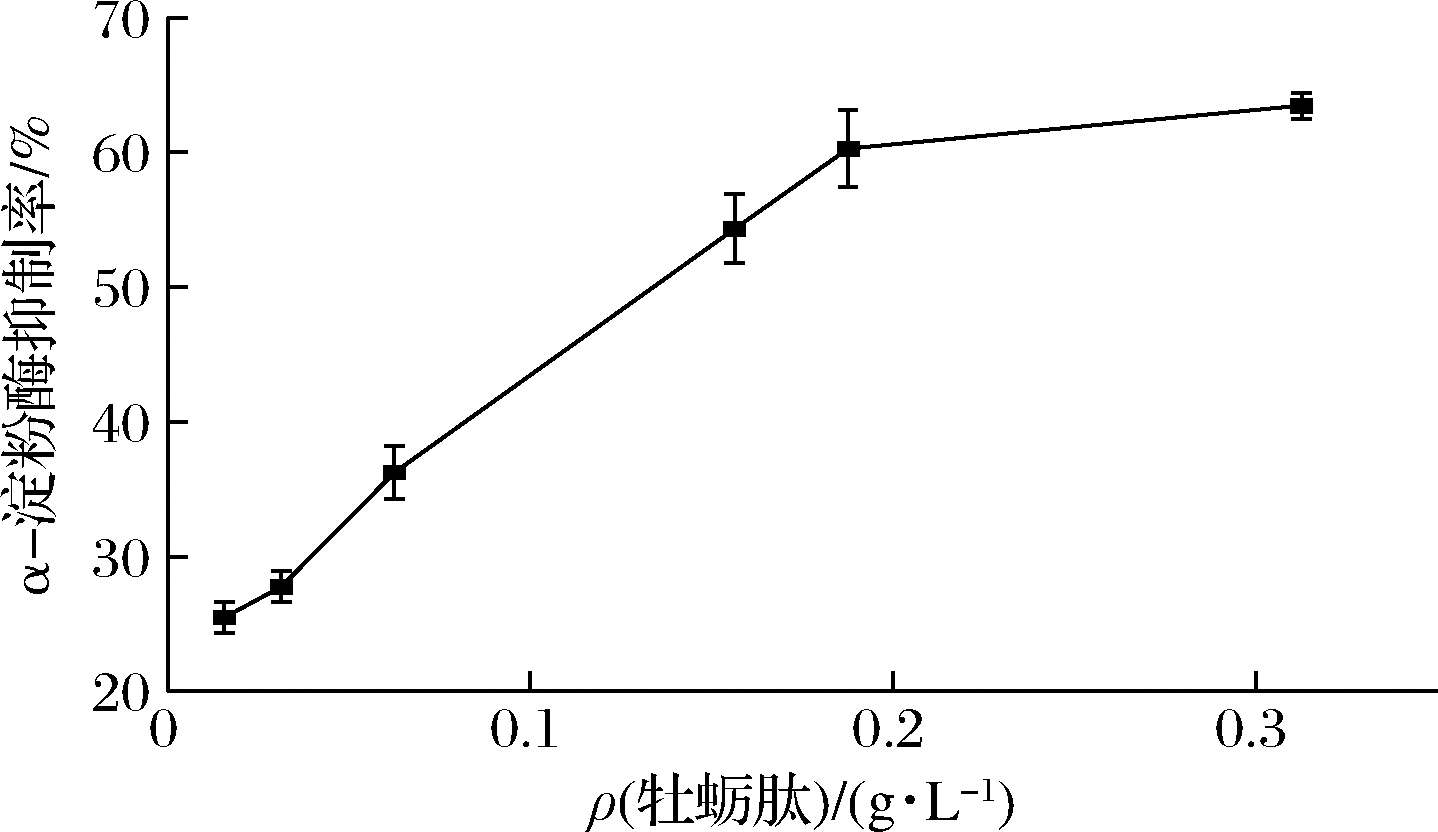
图6 牡蛎肽的α-淀粉酶抑制能力
Fig.6 α-Amylase inhibition ability of oyster peptides
如图7所示,牡蛎肽质量浓度为0.156 g/L时,消化前对α-淀粉酶的抑制率为54.76%,经胃消化后其抑制率显著降低至29.02%,是由于胃蛋白酶将牡蛎肽中具有α-淀粉酶抑制能力的肽序列分解;经胃肠消化后,牡蛎肽对α-淀粉酶抑制率降低至33.94%,相较于胃消化后增加了4.92%,说明肠消化环境有利于牡蛎肽中对α-淀粉酶有抑制作用的疏水氨基酸残基的暴露,或是将具有抑制该酶的特定小肽序列从肽链完整结构中释放[2]。总体看来,消化后牡蛎肽的降糖活性显著降低,对α-淀粉酶抑制活性的损失主要发生在胃环境。

图7 胃肠消化前后牡蛎肽的α-淀粉酶抑制能力
Fig.7 α-Amylase inhibition ability of oyster peptides before and after gastrointestinal digestion
2.7 胃肠消化对牡蛎肽α-葡萄糖苷酶抑制作用的影响
唾液和胰腺淀粉酶将淀粉分解为葡萄糖、二糖和三糖等,这些单糖和低聚糖可在小肠中被α-葡萄糖苷酶分解,而该酶抑制剂可以抑制小肠上部对单糖和低聚糖的吸收,从而降低血糖[29]。由图8可知,牡蛎肽对α-葡萄糖苷酶的抑制呈剂量依赖趋势,随质量浓度的增加对此酶的抑制率也逐渐增加,其IC50为0.438 g/L。
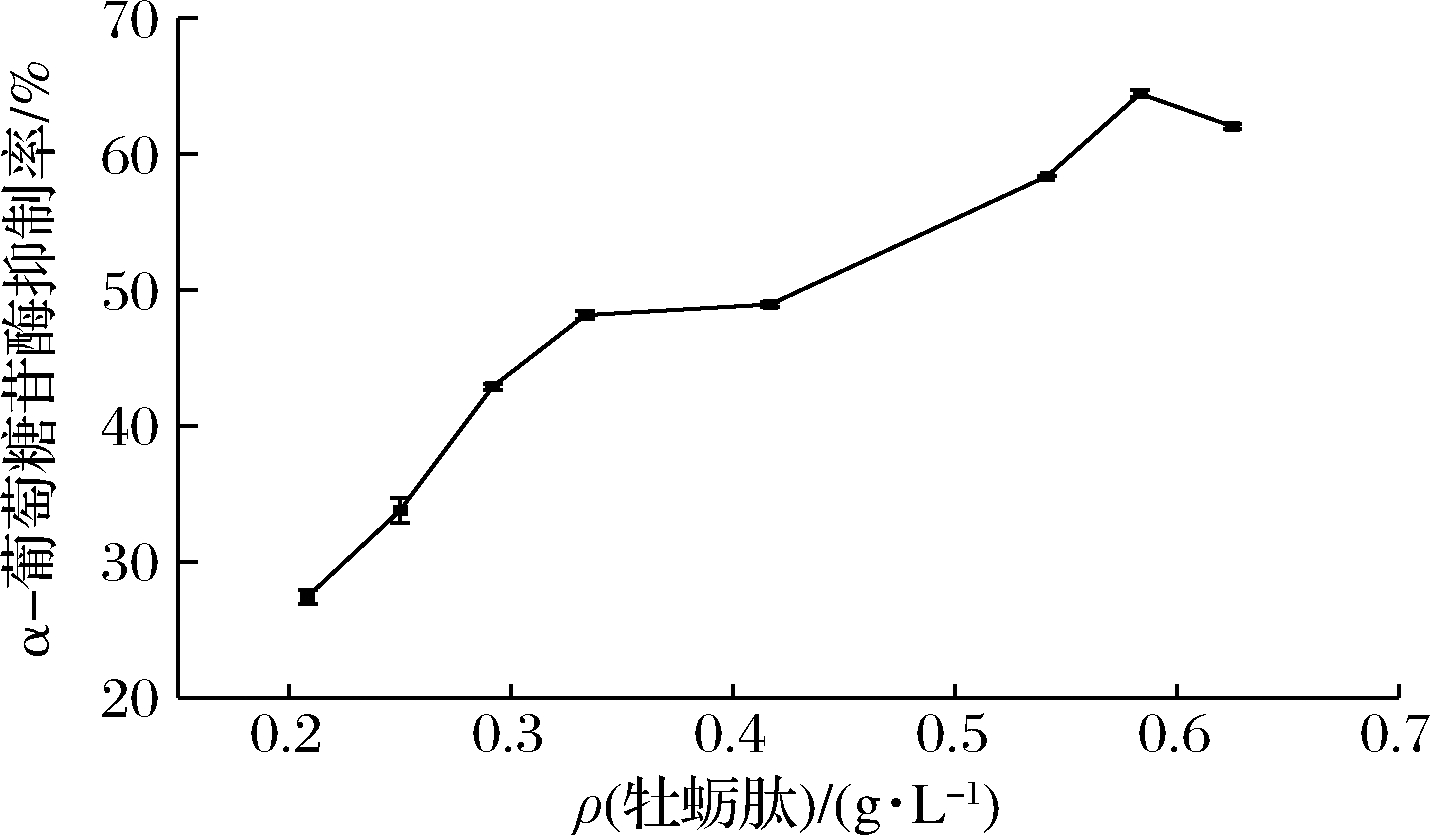
图8 牡蛎肽的α-葡萄糖苷酶抑制能力
Fig.8 α-Glucosidase inhibition ability of oyster peptides
由图9可知,牡蛎肽质量浓度为0.417 g/L时,对α-葡萄糖苷酶的抑制率为48.95%,胃环境消化后其抑制率显著降低至13.79%,经肠消化阶段后其抑制率又降低至2.85%,牡蛎肽经胃肠消化后对α-葡萄糖苷酶的抑制能力显著降低,说明胃液到肠液急剧变化的pH环境(pH 2~6.8)、胃液中的盐酸、胃蛋白酶和胰蛋白酶对牡蛎肽的降解,使其难以保持完整的结构形态到达目标位置,从而影响其降糖活性[30]。
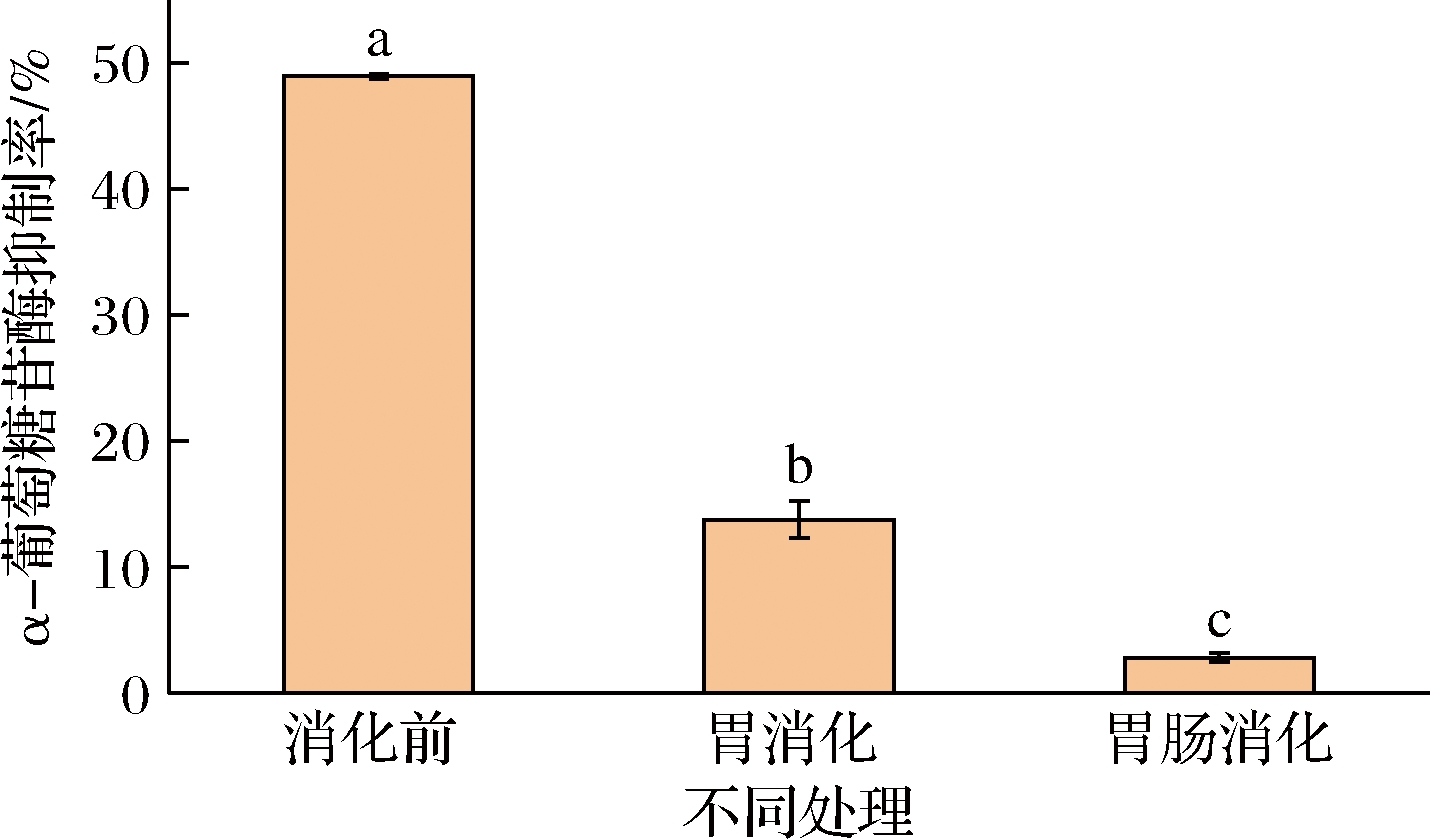
图9 胃肠消化前后牡蛎肽的α-葡萄糖苷酶抑制能力
Fig.9 α-Glucosidase inhibition ability of oyster peptides before and after gastrointestinal digestion
3 结论
本研究中牡蛎活性肽的氨基酸组成和分子质量分布显示其具有潜在的抗氧化和降糖活性,其中疏水性氨基酸含量较高,占比高达47.68%, 分子质量分布主要在2 kDa以下。肽谱分析显示其富含支链氨基酸和脯氨酸(Pro),且靠近肽链N端位置,推测这是抗氧化及降糖肽的典型结构模式;DPPH自由基清除率、α-淀粉酶和α-葡萄糖苷酶抑制实验结果表明,牡蛎肽具备较强的抗氧化和降糖活性。经过体外模拟胃肠消化后,游离氨基酸总量、必需氨基酸和疏水性氨基酸显著增加;DPPH自由基清除率、α-淀粉酶和α-葡萄糖苷酶的抑制率大幅下降,且生理活性损失主要出现在胃消化阶段,说明胃消化条件(强酸性环境、胃蛋白酶等)可能破坏了牡蛎肽发挥抗氧化和降糖活性所必备的结构基础。以上结果表明,牡蛎抗氧化及降糖肽经体外模拟胃肠消化后抗氧化和降糖活性显著降低,说明牡蛎肽的消化稳定性较差,有待进一步研究提高其消化稳定性、降低其活性损失的方法。
[1] LV R Z, DONG Y F, BAO Z J, et al.Advances in the activity evaluation and cellular regulation pathways of food-derived antioxidant peptides[J].Trends in Food Science & Technology, 2022, 122:171-186.
[2] RAM REZ FUENTES L, RICHARD C, CHEN L Y.Sequential alcalase and flavourzyme treatment for preparation of α-amylase, α-glucosidase, and dipeptidyl peptidase (DPP)-IV inhibitory peptides from oat protein[J].Journal of Functional Foods, 2021, 87:104829.
REZ FUENTES L, RICHARD C, CHEN L Y.Sequential alcalase and flavourzyme treatment for preparation of α-amylase, α-glucosidase, and dipeptidyl peptidase (DPP)-IV inhibitory peptides from oat protein[J].Journal of Functional Foods, 2021, 87:104829.
[3] NEWSHOLME P, CRUZAT V F, KEANE K N, et al.Molecular mechanisms of ROS production and oxidative stress in diabetes[J].The Biochemical Journal, 2016, 473(24):4 527-4 550.
[4] 农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会编制.中国渔业统计年鉴-2020[M].北京:中国农业出版社, 2020.
Fisheries Administration of the Ministry of Agriculture.China fishery statistical yearbook[M].Beijing:China Agricultural Press, 2021.
[5] LI W, XU C, ZHANG C H, et al.The purification and identification of immunoregulatory peptides from oyster (Crassostrea hongkongensis) enzymatic hydrolysate[J].RSC Advances, 2019, 9(56):32 854-32 863.
[6] WANG Q K, LI W, HE Y H, et al.Novel antioxidative peptides from the protein hydrolysate of oysters (Crassostrea talienwhanensis)[J].Food Chemistry, 2014, 145:991-996.
[7] UMAYAPARVATHI S, MEENAKSHI S, VIMALRAJ V, et al.Antioxidant activity and anticancer effect of bioactive peptide from enzymatic hydrolysate of oyster (Saccostrea cucullata)[J].Biomedicine & Preventive Nutrition, 2014, 4(3):343-353.
[8] ZHANG W W, WEI Y F, CAO X X, et al.Enzymatic preparation of Crassostrea oyster peptides and their promoting effect on male hormone production[J].Journal of Ethnopharmacology, 2021, 264:113382.
[9] WANG J P, HU J N, CUI J Z, et al.Purification and identification of a ACE inhibitory peptide from oyster proteins hydrolysate and the antihypertensive effect of hydrolysate in spontaneously hypertensive rats[J].Food Chemistry, 2008, 111(2):302-308.
[10] 周田田, 程伟, 孙运奇, 等.牡蛎肽的提取纯化及生物活性研究进展[J].食品科技, 2021, 46(7):150-154.
ZHOU T T, CHENG W, SUN Y Q, et al.Research progress on extraction, purification and bioactivity of oyster peptides[J].Food Science and Technology, 2021, 46(7):150-154.
[11] XIA E Q, ZHU S S, HE M J, et al.Marine peptides as potential agents for the management of type 2 diabetes mellitus-A prospect[J].Marine Drugs, 2017, 15(4):88.
[12] HAO L L, WANG X C, CAO Y R, et al.A comprehensive review of oyster peptides:Preparation, characterisation and bioactivities[J].Reviews in Aquaculture, 2022, 14(1):120-138.
[13] 柏昌旺, 章超桦, 林海生, 等.响应面法优化制备牡蛎短肽工艺[J].广东海洋大学学报, 2019, 39(6):85-92.
BAI C W, ZHANG C H, LIN H S, et al.Optimization of preparation process of oyster oligopeptides by response surface methodology[J].Journal of Guangdong Ocean University, 2019, 39(6):85-92.
[14] GONG P X, WANG B K, WU Y C, et al.Release of antidiabetic peptides from Stichopus japonicas by simulated gastrointestinal digestion[J].Food Chemistry, 2020, 315:126273.
[15] 马勇, 高丽辉, 冯晓文, 等.模拟胃肠消化对牡蛎低聚肽抗氧化活性的影响[J].食品与机械, 2020, 36(11):133-137;176.
MA Y, GAO L H, FENG X W, et al.Effect of simulated gastrointestinal digestion in vitro on the antioxidant activity of oyster oligopeptides[J].Food & Machinery, 2020, 36(11):133-137;176.
[16] 潘玥. 蓝莓叶多酚提取物对α-淀粉酶和α-葡萄糖苷酶的抑制作用及其在低GI米糕中应用研究[D].上海:上海海洋大学, 2021.
PAN Y.Inhibitory effect of blueberry leaf polyphenols on α-amylase and α-glucosidase and its application in low GI rice cake[D].Shanghai:Shanghai Ocean University, 2021.
[17] CAI M Y, GU R Z, LI C Y, et al.Pilot-scale production of soybean oligopeptides and antioxidant and antihypertensive effects in vitro and in vivo[J].Journal of Food Science and Technology, 2014, 51(9):1 866-1 874.
[18] OSEGUERA TOLEDO M E, GONZALEZ DE MEJIA E, SIVAGURU M, et al.Common bean (Phaseolus vulgaris L.) protein-derived peptides increased insulin secretion, inhibited lipid accumulation, increased glucose uptake and reduced the phosphatase and tensin homologue activation in vitro[J].Journal of Functional Foods, 2016, 27:160-177.
[19] NGOH Y Y, GAN C Y.Enzyme-assisted extraction and identification of antioxidative and α-amylase inhibitory peptides from Pinto beans (Phaseolus vulgaris cv.Pinto)[J].Food Chemistry, 2016, 190:331-337.
[20] 闵鑫. 基于序列模型的肽序列可信度评估[D].淄博:山东理工大学, 2020.
MIN X.Confidence evaluation of peptide sequences based on the sequence model[D].Zibo:Shandong University of Technology, 2020.
[21] MAESTRI E, PAVLICEVIC M, MONTORSI M, et al.Meta-analysis for correlating structure of bioactive peptides in foods of animal origin with regard to effect and stability[J].Comprehensive Reviews in Food Science and Food Safety, 2019, 18(1):3-30.
[22] GONZ LEZ-MONTOYA M, HERN
LEZ-MONTOYA M, HERN NDEZ-LEDESMA B, MORA-ESCOBEDO R, et al.Bioactive peptides from germinated soybean with anti-diabetic potential by inhibition of dipeptidyl peptidase-IV, α-amylase, and α-glucosidase enzymes[J].International Journal of Molecular Sciences, 2018, 19(10):2883.
NDEZ-LEDESMA B, MORA-ESCOBEDO R, et al.Bioactive peptides from germinated soybean with anti-diabetic potential by inhibition of dipeptidyl peptidase-IV, α-amylase, and α-glucosidase enzymes[J].International Journal of Molecular Sciences, 2018, 19(10):2883.
[23] AHMED T, SUN X H, UDENIGWE C C.Role of structural properties of bioactive peptides in their stability during simulated gastrointestinal digestion:A systematic review[J].Trends in Food Science & Technology, 2022, 120:265-273.
[24] DULLIUS A, FASSINA P, GIROLDI M, et al.A biotechnological approach for the production of branched chain amino acid containing bioactive peptides to improve human health:A review[J].Food Research International, 2020, 131:109002.
[25] 丁龙. 蛋清肽结构鉴定与完整吸收的构效关系研究[D].长春:吉林大学, 2018.
DING L.Identification of egg white derived peptides and relationships between structure and transport[D].Changchun:Jilin University, 2018.
[26] SUNDE H, RYDER K, BEKHIT A E D A, et al.Analysis of peptides in a sheep beta lactoglobulin hydrolysate as a model to evaluate the effect of peptide amino acid sequence on bioactivity[J].Food Chemistry, 2021, 365:130346.
[27] MOJICA L, LUNA-VITAL D A, GONZ LEZ DE MEJ
LEZ DE MEJ A E.Characterization of peptides from common bean protein isolates and their potential to inhibit markers of type-2 diabetes, hypertension and oxidative stress[J].Journal of the Science of Food and Agriculture, 2017, 97(8):2 401-2 410.
A E.Characterization of peptides from common bean protein isolates and their potential to inhibit markers of type-2 diabetes, hypertension and oxidative stress[J].Journal of the Science of Food and Agriculture, 2017, 97(8):2 401-2 410.
[28] REN J Y, CHEN S D, LI C M, et al.A two-stage modification method using 1, 4-α-glucan branching enzyme lowers the in vitro digestibility of corn starch[J].Food Chemistry, 2020, 305:125441.
[29] ELAM E, FENG J, LV Y M, et al.Recent advances on bioactive food derived anti-diabetic hydrolysates and peptides from natural resources[J].Journal of Functional Foods, 2021, 86:104674.
[30] BECHAUX J, GATELLIER P, LE PAGE J F, et al.A comprehensive review of bioactive peptides obtained from animal byproducts and their applications[J].Food & Function, 2019, 10(10):6 244-6 266.