生物蛋白肽是一类由2~20个氨基酸经过脱水缩合,相对分子质量低于6 kDa的蛋白水解中间产物[1],具有增强人体免疫力[2]、抗氧化[3-4]、降血压[5]和抑菌[6]等生物功能。生物肽来源广泛,大体可以分为植物肽和动物肽,动物肽由天然肌肽、海洋生物肽、乳品肽等组成,海洋生物较其他生物更为复杂和特殊,这使得其蛋白肽易产生不同于其他生物蛋白肽的功效[7]。海洋生物中鱼类的数量占相当大的比例,鱼类资源丰富易捕捞,是制备蛋白肽常见的原料,目前海洋生物蛋白肽的制备多来源于低值鱼及其下脚料[8]。
鲐鱼(Pneumatophorus japonicus)系鲭科鲐属,形体较粗壮,在我国主要分布于东海和黄海海域。鲐鱼具有生长迅速、年产量稳定、鱼汛期集中、捕捞难度较小的特点[9],为我国重要的经济鱼类之一。目前,鲐鱼主要被加工成鱼干[10]、鱼露[11]、鱼粉[12]等低值产品,在深加工利用方面未得到很好的开发。鲐鱼营养较为丰富,主要营养成分为蛋白质和多不饱和脂肪酸,是新型功能食品的优质蛋白原料[13],具有较大的开发潜力。本文以鲐鱼为原料,采用单因素试验和响应面分析法优化鲐鱼酶解工艺,并对酶解物的相对分子质量分布、氨基酸组成、抗氧化能力及稳定性进行探讨,旨在为鲐鱼的精深加工和高效利用提供依据。
1 材料与方法
1.1 材料与试剂
新鲜鲐鱼,宁波路林水产市场,清洗后去头去骨去皮去内脏,取鱼肉搅碎备用。
K2SO4、H2SO4、硼酸、NaOH、乙醇、盐酸、Na2HPO4、柠檬酸、三氯乙酸、铁氰化钾等,上海国药集团化学试剂有限公司;中性、酸性、碱性、木瓜、复合、胃、胰蛋白酶,北京索莱宝科技有限公司;1,1-二苯基-2-三硝基苯肼 (1,1-diphenyl-2-picryhydrazyl, DPPH),美国Sigma公司。
1.2 仪器与设备
721G分光光度计,上海菁华公司;5804R高速离心机,德国Eppendorf公司;FE20实验pH计,上海梅特勒托利多公司;ALPHA2-4冷冻干燥仪,德国Christ公司;KDN-04C消化炉、KDN-812凯氏定氮仪,上海纤检公司;L-8900全自动氨基酸分析仪,日本日立公司。
1.3 实验方法
1.3.1 蛋白酶的筛选
选用表1所示5种蛋白酶作为酶解用酶,按表1固定酶添加量(5 000 U/g)、底物质量分数(10%)和时间(6 h),在各酶最适温度和pH条件下进行酶解。酶解结束后于100 ℃灭酶15 min,冷却,于4 ℃ 10 000 r/min离心15 min,取上清液,以DPPH自由基清除率为主、水解度为辅评价各蛋白酶酶解效果。
表1 蛋白酶最适pH和温度
Table 1 Optimal enzymatic hydrolysis conditions of proteases

蛋白酶最适温度/℃最适pH中性蛋白酶507.0酸性蛋白酶503.0碱性蛋白酶4510.0木瓜蛋白酶606.5复合蛋白酶506.5
1.3.2 DPPH自由基清除率测定
参考陈思远等[14]的方法,将样品与DPPH乙醇溶液(1×10-4 mmol/mL)等体积混匀,室温避光反应30 min,在波长517 nm测定吸光值,记作Ay;以乙醇代替DPPH乙醇溶液,测得吸光值A0;以水代替样品,测得吸光值Ax,按公式(1)计算:
DPPH自由基清除率![]()
(1)
1.3.3 氨基氮含量测定
采用GB 5009.235—2016《食品安全国家标准 食品中氨基酸态氮的测定》中酸度计法测定,取样品与水混匀,用NaOH标准溶液滴定至pH为8.2,加入10 mL甲醛,再滴定至9.2,消耗的NaOH标准溶液体积为V1;用20 mL水代替样品,操作同上,消耗的NaOH标准溶液体积为V2。按公式(2)计算:
(2)
式中:X,试样中氨基态氮的含量,g/100 g;c,NaOH浓度,mol/L;0.014,1 mmol氮的质量,g;V,取样体积,mL;V3,取样品稀释液体积,mL;V4,样品稀释液定容体积,mL。
1.3.4 总氮含量测定
采用GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》的凯氏定氮法测定。
1.3.5 水解度测定
参考李美娜等[15]的方法,以样液氨基氮与原料中总氮的比值表示,按公式(3)计算:
水解度![]()
(3)
1.3.6 单因素试验
分别探究酶添加量(按物料质量加入0.05%、0.1%、0.2%、0.3%、0.4%、0.5%、1.0%)、时间(3、4、5、6、7、10 h)、温度(30、40、45、50、55、60 ℃)和底物质量分数(2%、5%、10%、15%、20%、30%)对鲐鱼酶解效果的影响。选取各因素最佳水平,进行4因素3水平旋转正交试验。
1.3.7 旋转正交试验
综合单因素试验结果,确定酶添加量(A)、时间(B)、温度(C)和底物质量分数(D)自变量水平,DPPH自由基清除率为响应值,采用Box-Behnken模型进行旋转正交试验,得出最佳酶解工艺条件,各因素水平见表2。
表2 BOX-Behnken因素水平设计
Table 2 Factor level of BOX-Behnken test

因素水平-101酶添加量/%0.10.20.3时间/h456温度/℃405060底物质量分数/%51015
1.3.8 抗氧化活性测定
1.3.8.1 ·OH清除率测定
参考王雪芹[16]的方法稍作修改,依次加入0.5 mL样品、0.5 mL水杨酸乙醇溶液(10 mmol/L)和3.5 mL水混匀,再加入0.5 mL FeSO4溶液(10 mmol/L)振荡混匀,最后加入5.0 mL新鲜配制H2O2溶液(100 mmol/L)启动反应,于37 ℃保温60 min,测定波长510 nm处吸光值Ay;以0.5 mL水代替FeSO4溶液,测得吸光值A0;以0.5 mL水代替0.5 mL样品,测得吸光值Ax,按公式(4)计算:
·OH清除率![]()
(4)
1.3.8.2 ABTS阳离子自由基清除率测定
参考曹叶霞等[17]的方法,将样品与ABTS工作液按比例混匀,室温遮光静置60 min,于波长734 nm处测得吸光值Ay;以PBS代替样品,测得吸光值Ax;以水代替ABTS工作液测得吸光值A0,按公式(5)计算:
ABTS阳离子自由基清除率![]()
(5)
1.3.9 相对分子质量分析
参考李宁等[18]方法,将质量浓度为10 mg/mL的样品过膜上样测定相对分子质量分布。分析条件:色谱柱TSKgel 2000 SWXL(300 mm×7.8 mm,5 μm),流动相V(乙腈)∶V(水)∶V(三氟乙酸)=45∶55∶0.1,检测波长为220 nm,流速0.5 mL/min,柱温30 ℃。
1.3.10 氨基酸组成分析
参考王乐等[19]的方法,称取适量样品加入10 mL 6 mol/L盐酸,氮吹封口,110 ℃静置水解24 h,定容过滤,10 000 r/min离心,取0.2 mL上清液氮吹,加入0.02 mol/L盐酸2 mL溶解,0.22 μm滤膜过滤,进样测定样品各氨基酸含量。测定条件:磺酸型阳离子分析柱(4.6 mm×60 mm,3 μm),柱温57 ℃,梯度洗脱,双通道波长为440和570 nm,反应器温度135 ℃,茚三酮流速0.35 mL/min,进样量20 μL,每个样品平行进样3次。
1.3.11 鲐鱼蛋白肽抗氧化稳定性实验
1.3.11.1 温度对鲐鱼蛋白肽抗氧化活性的影响
将质量浓度为10 mg/mL的样品溶液置于不同温度(4、20、40、60、80、100 ℃)下静置2 h,然后测定其DPPH自由基清除率,按公式(6)计算抗氧化活性保持率:
抗氧化活性保持率![]()
(6)
1.3.11.2 pH对鲐鱼蛋白肽抗氧化活性的影响
配制质量浓度为10 mg/mL的样品溶液,用1 mol/L HCl或NaOH溶液调整pH(2、4、6、7、8、10、12),室温静置1、2、3、4、5 h后,将样品溶液的pH调至7,测定其DPPH自由基清除率,并计算抗氧化活性保持率。
1.3.11.3 食用糖对鲐鱼蛋白肽抗氧化活性的影响
将样品溶于不同质量分数(2%、4%、6%、8%、10%)的葡萄糖、蔗糖、果糖溶液中,终质量浓度为10 mg/mL,以蒸馏水为对照,室温下静置2 h,测定其DPPH自由基清除率,并计算抗氧化活性保持率。
1.3.11.4 食品防腐剂对鲐鱼蛋白肽抗氧化活性的影响
将样品溶于不同质量分数(0.05%、0.1%、0.15%、0.2%、0.25%)的柠檬酸、山梨酸钾、苯甲酸钠中,终质量浓度为10 mg/mL,以蒸馏水为对照,室温下静置2 h,测定其DPPH自由基清除率,并计算抗氧化活性保持率。
1.3.11.5 金属离子对鲐鱼蛋白肽抗氧化活性的影响
将样品溶液与K+、Ca2+、Mg2+、Fe3+、Zn2+母液混合,使得样品溶液终质量浓度为10 mg/mL,各金属离子终浓度为0.1、0.5、1.0、2.0、3.0、4.0和5.0 mmol/mL,以蒸馏水为对照,室温静置2 h,测定其DPPH自由基清除率,并计算抗氧化活性保持率。
1.3.11.6 NaCl对鲐鱼蛋白肽抗氧化活性的影响
将样品溶于不同质量分数(2%、4%、6%、8%和10%)的NaCl溶液中,终质量浓度为10 mg/mL,以水为对照,室温静置2 h,测定其DPPH自由基清除率,并计算抗氧化活性保持率。
1.3.11.7 胃肠模拟消化对鲐鱼蛋白肽抗氧化活性的影响
参考刘珊珊等[20]的方法稍作修改,用人工胃液配制质量浓度为10 mg/mL的样品溶液,于37 ℃保温10 min,添加1%(质量分数)胃蛋白酶混匀后,分别消化1、2、3、4、5和6 h,100 ℃灭酶;将消化6 h的溶液加入等体积人工肠液,37 ℃保温10 min,添加2%(质量分数)胰蛋白酶混匀,分别消化1、2、3和4 h,100 ℃灭酶,快速冷却至室温,10 000 r/min离心15 min,取上清液测定其DPPH自由基清除率,并计算抗氧化活性保持率。
1.4 数据统计与分析
每组实验重复3次,实验数据采用SPSS 21和Design expert 10.0.7进行分析,GraphPad Prism 7.04作图。
2 结果与分析
2.1 最适酶筛选分析
由表3可知,固定其他条件,酸性蛋白酶的产物清除DPPH自由基的效果最好、水解度最高,中性酶次之。
表3 各蛋白酶对DPPH自由基清除率及水解度的影响
Table 3 Effect of proteases on the degree of hydrolysis and DPPH radical scavenging rate
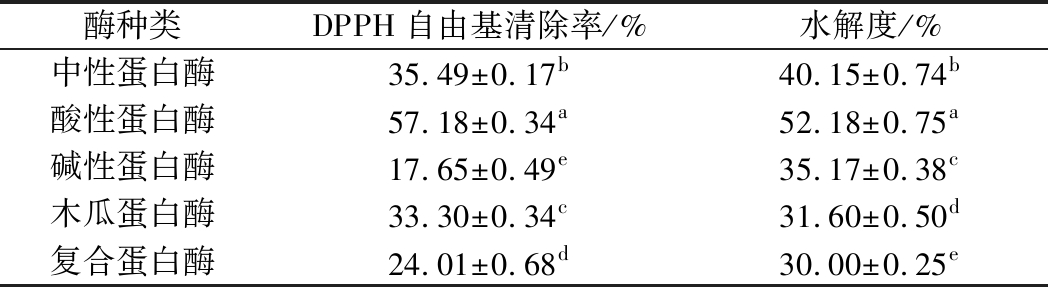
酶种类DPPH自由基清除率/%水解度/%中性蛋白酶35.49±0.17b40.15±0.74b酸性蛋白酶57.18±0.34a52.18±0.75a碱性蛋白酶17.65±0.49e35.17±0.38c木瓜蛋白酶33.30±0.34c31.60±0.50d复合蛋白酶24.01±0.68d30.00±0.25e
注:同列不同字母表示差异显著(P<0.05)
2.2 单因素试验分析
由图1-a、1-d可知,在其他条件相同情况下,随着酶添加量或底物质量分数的增加,水解度逐渐增加,但其DPPH自由基清除率呈先上升后下降的趋势,以0.2%添加量和10%底物质量分数为最佳;由图1-b、1-c可知,随着水解时间的延长或温度的上升,产物的DPPH自由基清除率和水解度均先上升后下降,这可能是由于水解时间过长、温度过高,具有抗氧化活性的多肽进一步降解成小分子氨基酸,使其清除DPPH自由基的效果下降,水解5 h、温度45 ℃为最佳。

a-酶添加量;b-酶解时间;c-酶解温度;d-底物质量分数
图1 酶添加量、酶解时间、酶解温度和底物质量分数对DPPH自由基清除率和水解度的影响
Fig.1 Effect of enzyme addition on, time, temperature and substrate concentration on DPPH radical scavenging rate and degree of hydrolysis
注:不同字母代表差异显著,(P<0.05),(下同)
2.3 旋转正交试验优化分析
2.3.1 正交结果及方差分析
鲐鱼蛋白肽的响应面实验结果如表4,通过Design Expert 10.0.7对表4进行分析,得到回归方程:
DPPH自由基清除率/%=-4.16A2-7.47B2-4.01C2-5.30D2+2.63AB-4.30AC-1.46AD+1.06BC-2.88BD-0.65CD+2.50A+2.21B+2.89C+1.94D+60.23
表4 Box-Behnken试验设计及结果
Table 4 Box-Behnken experiment design and results
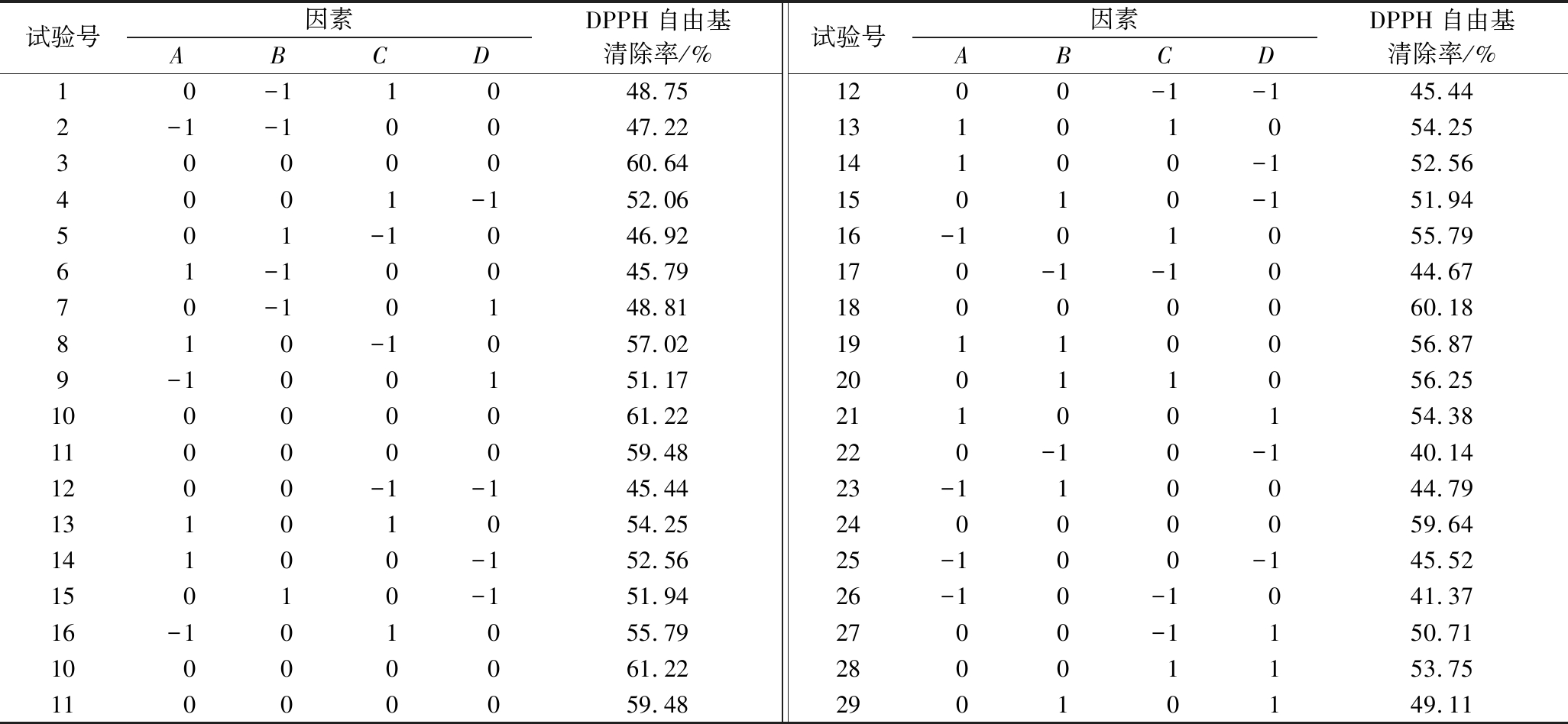
试验号因素ABCDDPPH自由基清除率/%试验号因素ABCDDPPH自由基清除率/%1 0-1 1 048.752-1-10047.223000060.644001-152.06501-1046.9261-10045.7970-10148.81810-1057.029-100151.1710000061.2211000059.481200-1-145.4413101054.2514100-152.5615010-151.9416-101055.7910000061.2211000059.481200-1-145.4413101054.2514100-152.5615010-151.9416-101055.79170-1-1044.6718000060.1819110056.8720011056.2521100154.38220-10-140.1423-110044.7924000059.6425-100-145.5226-10-1041.372700-1150.7128001153.7529010149.11
回归方程的方差分析见表5。
表5 回归方程方差分析
Table 5 Analysis of variance of regression equation
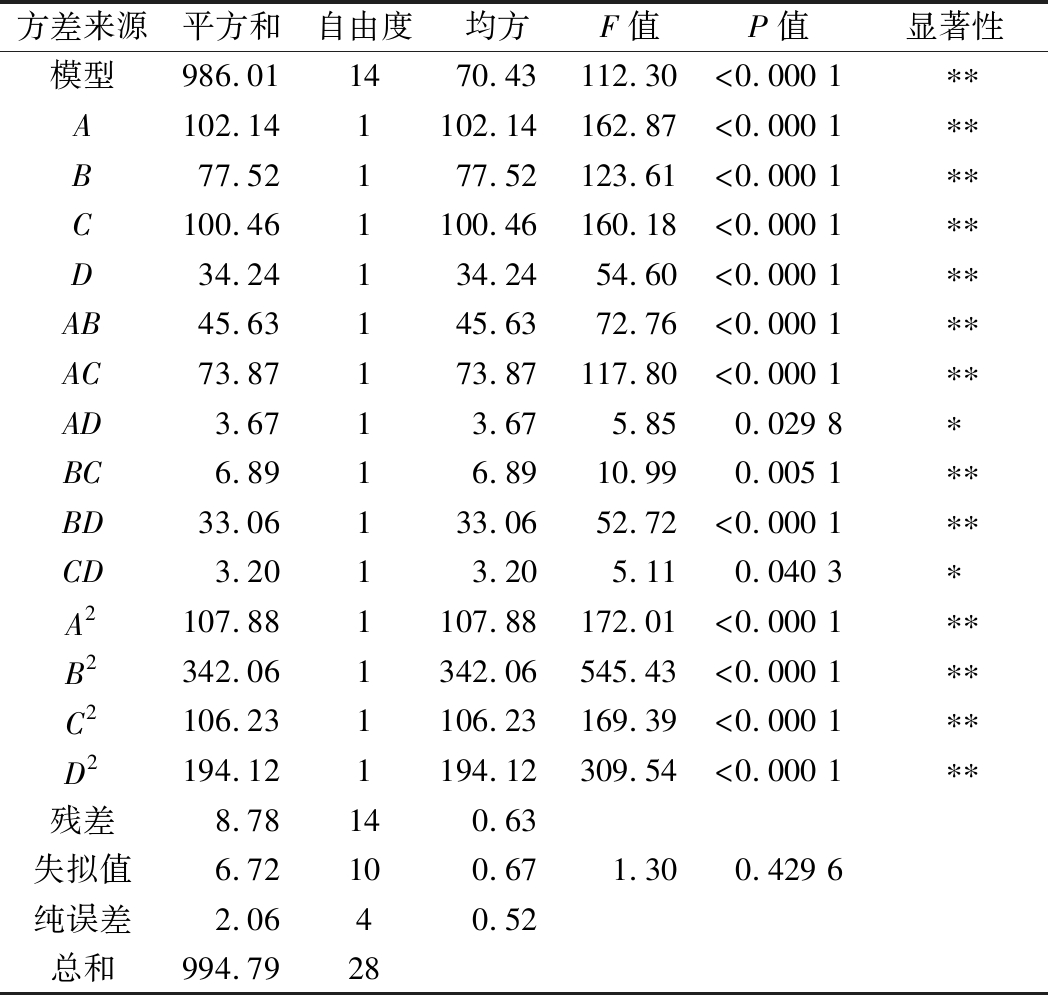
方差来源平方和自由度均方F值P值显著性模型986.011470.43112.30<0.000 1∗∗A102.141102.14162.87<0.000 1∗∗B77.52177.52123.61<0.000 1∗∗C100.461100.46160.18<0.000 1∗∗D34.24134.2454.60<0.000 1∗∗AB45.63145.6372.76<0.000 1∗∗AC73.87173.87117.80<0.000 1∗∗AD3.6713.675.850.029 8∗BC6.8916.8910.990.005 1∗∗BD33.06133.0652.72<0.000 1∗∗CD3.2013.205.110.040 3∗A2107.881107.88172.01<0.000 1∗∗B2342.061342.06545.43<0.000 1∗∗C2106.231106.23169.39<0.000 1∗∗D2194.121194.12309.54<0.000 1∗∗残差8.78140.63失拟值6.72100.671.300.429 6纯误差2.0640.52总和994.7928
注:“*”表示差异显著(P<0.05);“** ”表示差异极显著(P<0.01)
回归模型极显著(P<0.01),失拟值不显著(P=0.429 6>0.05),相关系数R2=0.972 7,矫正系数![]() 表明模型可靠,能较好预测酶解工艺条件对鲐鱼蛋白肽活性的影响。此外,F(A)>F(C)>F(B)>F(D),酶添加量对其影响最大,其次为温度、时间和底物浓度。
表明模型可靠,能较好预测酶解工艺条件对鲐鱼蛋白肽活性的影响。此外,F(A)>F(C)>F(B)>F(D),酶添加量对其影响最大,其次为温度、时间和底物浓度。
2.3.2 响应面分析与条件优化
由图2可知,响应值随着酶添加量、时间、温度和底物浓度的增大均呈现先上升后下降的趋势,酶添加量与温度的交互作用最强,温度和底物浓度的交互作用最弱。

a-酶添加量和时间;b-酶添加量和温度;c-酶添加量和底物质量分数;d-时间和温度;e-时间和底物质量分数;f-温度和底物质量分数
图2 各因素交互作用对DPPH自由基清除率的影响
Fig.2 Response surface of enzymolysis conditions on DPPH radical scavenging rate
2.3.3 模型验证实验
根据Box-Behnken模型得到鲐鱼蛋白肽酶解工艺的最佳参数为:酶添加量0.211 6%(按物料质量)、时间5.14 h、温度53.09 ℃和底物质量分数10.65%。在此条件下,酶解物对DPPH自由基清除率为61.14%。为了实际操作方便,本实验对鲐鱼蛋白肽最优工艺参数进行微调,即酶添加量0.21%、酶解时间5 h、酶解温度53 ℃和底物质量分数10.65%。经3次平行验证实验,得到DPPH自由基清除率为(62.23±0.15)%,与理论值相符,表明该模型对鲐鱼蛋白肽最优参数的预测有较高的准确度,具有一定的实用价值,该条件酶解得率为93.25%。
2.4 相对分子质量分布分析
由图3可知,所制备的鲐鱼蛋白肽相对分子质量主要分布在3 kDa以下,其中相对分子质量在1 kDa以下的组分高达92.15%。有关文献研究表明,蛋白酶解产物相对分子质量分布在1 kDa以下的组分具有更高的抗氧化活性[21]。
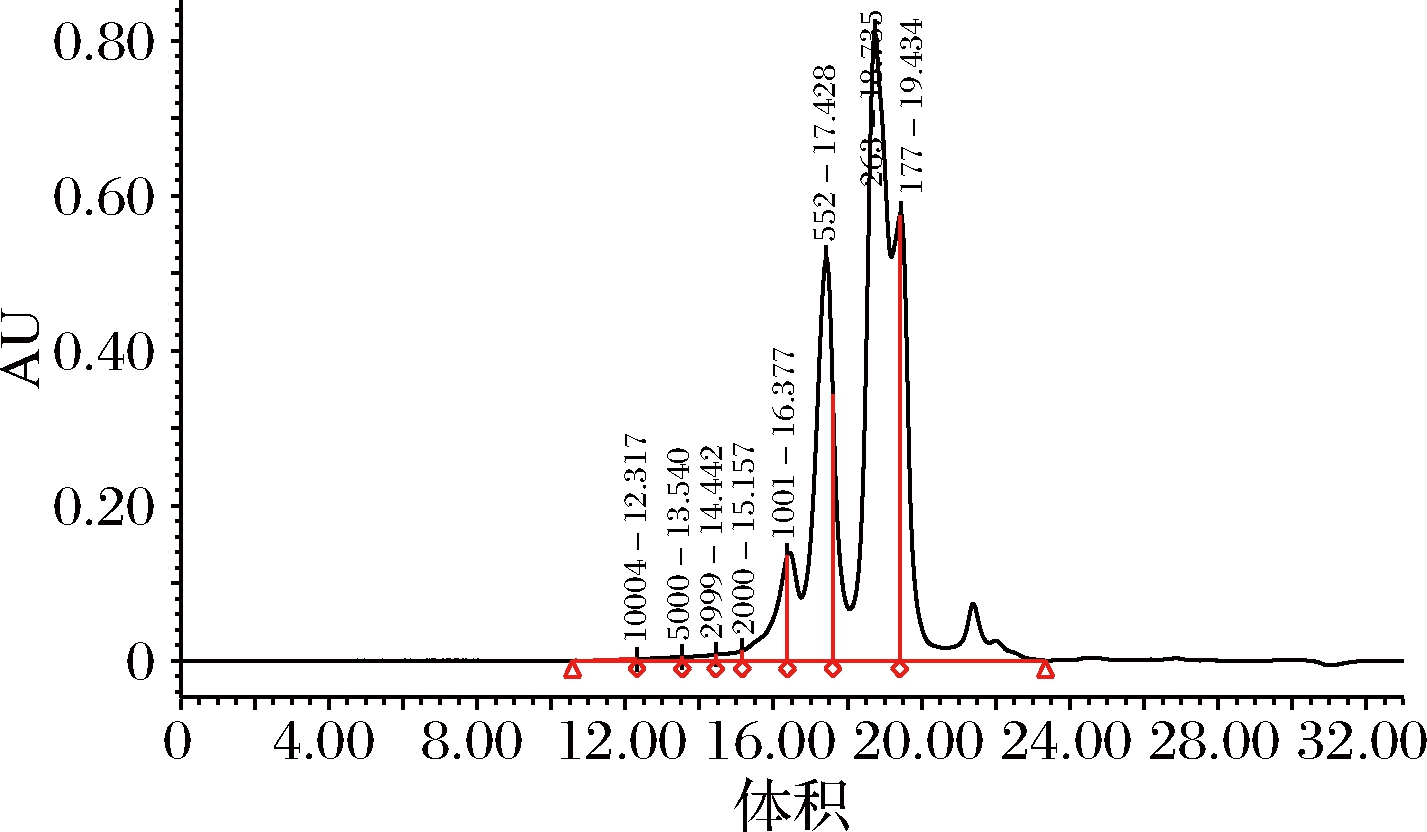
图3 鲐鱼蛋白肽相对分子质量分布图
Fig.3 Molecular weight distribution of mackerel protein peptide
2.5 氨基酸组成分析
由表6可知,鲐鱼蛋白肽中人体必需氨基酸占氨基酸总量的40.10%;具有给质子能力的氨基酸占氨基酸总量的40.06%;疏水性氨基酸占氨基酸总量的35.33%。而具有给质子能力的氨基酸和疏水性氨基酸是影响抗氧化能力的重要因素[22],推断鲐鱼蛋白肽具有较高抗氧化能力。
表6 氨基酸组成
Table 6 The amino acid composition

氨基酸种类含量/[g·(100 g)-1]天冬氨酸4.007精氨酸2.516酪氨酸1.480谷氨酸5.715甘氨酸∗∗∗1.880丙氨酸∗∗/∗∗∗2.460缬氨酸∗/∗∗/∗∗∗2.296蛋氨酸∗/∗∗/∗∗∗1.151异亮氨酸∗/∗∗/∗∗∗1.943亮氨酸∗/∗∗/∗∗∗3.287丝氨酸1.513苯丙氨酸∗/∗∗/∗∗∗1.601赖氨酸∗3.813组氨酸2.873苏氨酸∗1.859半胱氨酸0.064脯氨酸∗∗/∗∗∗1.315必需氨基酸总量15.950疏水氨基酸总量14.053具有给质子能力氨基酸总量15.933氨基酸总量39.773
注:带*为必需氨基酸;带**为疏水氨基酸;带***为具有给质子能力氨基酸
2.6 抗氧化活性分析
由图4可知,各自由基清除率与蛋白肽溶液浓度有一定的线性量效关系,清除·OH、ABTS阳离子自由基、DPPH自由基的能力随着蛋白肽浓度增加而提高,其清除·OH、ABTS阳离子自由基和DPPH自由基的IC50为3.77、14.14、8.91 mg/mL,表明鲐鱼蛋白肽具有较好的清除自由基的能力。

a-·OH;b-ABTS阳离子自由基;c-DPPH自由基
图4 蛋白肽的·OH、ABTS阳离子自由基、DPPH自由基清除能力
Fig.4 ·OH, ABTS cationic radical and DPPH radical scavenging rate of protein peptide
2.7 鲐鱼蛋白肽稳定性的分析
2.7.1 温度对鲐鱼蛋白肽抗氧化活性的影响
由图5可知,在20~100 ℃随着温度升高,抗氧化活性保持率下降;但100 ℃下保温2 h后,抗氧化活性保持率仍有80.18%。完整的二级结构对维持肽类的生物活性十分重要[23],处理温度过高、加热时间过长可能会改变鲐鱼蛋白肽的二级结构,从而影响其稳定性。
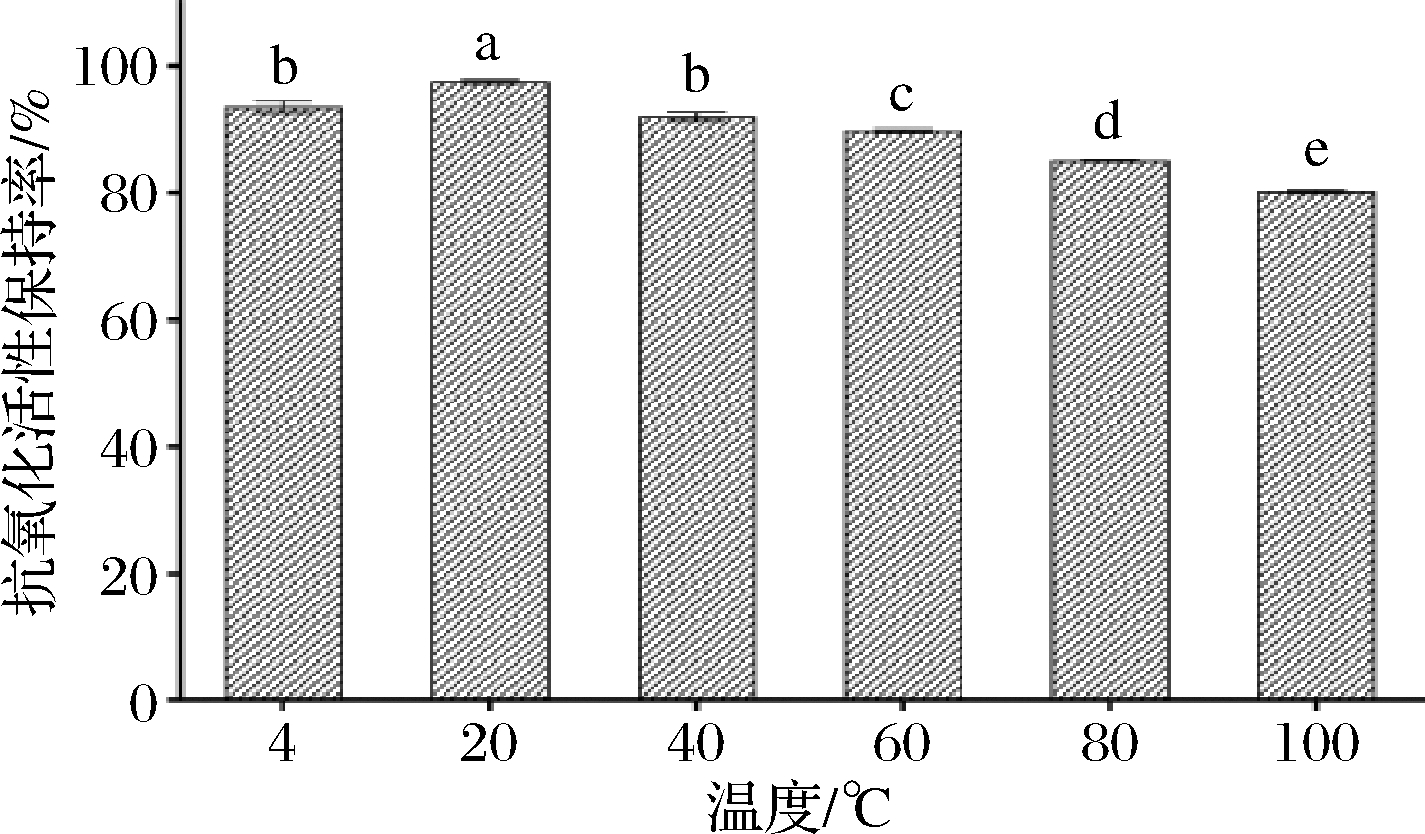
图5 温度对蛋白肽稳定性的影响
Fig.5 Effect of temperature on stability of protein peptide
注:不同字母表示差异显著(P<0.05)(下同)
2.7.2 pH对鲐鱼蛋白肽抗氧化活性的影响
由图6可知,在pH 2.0~7.0,pH值变化对鲐鱼蛋白肽的抗氧化活性保持率影响不显著(P>0.05);当pH>7.0时,随着pH升高,其抗氧化活性保持率显著下降(P<0.05),碱性条件可能会使肽类物质发生外消旋或脱酰胺反应,从而影响活性及稳定性[24]。放置时间对其活性影响不显著(P>0.05)。

图6 pH对蛋白肽稳定性的影响
Fig.6 Effect of pH on stability of protein peptide
2.7.3 食用糖及食品防腐剂对鲐鱼蛋白肽抗氧化活性的影响
由图7可知,在实验的质量分数范围内,不同食用糖(葡萄糖、蔗糖和果糖)及食品防腐剂对样品的抗氧化活性影响不显著(P>0.05)。

a-食用糖;b-食品防腐剂
图7 食用糖和食品防腐剂对蛋白肽活性的影响
Fig.7 Effect of edible sugar and food preservatives on stability of protein peptide
2.7.4 金属离子对鲐鱼蛋白肽抗氧化活性的影响
由图8可知,不同的金属离子对鲐鱼蛋白肽活性的影响不一,随着Zn2+和Fe3+浓度的升高,样品的抗氧化活性显著性下降(P<0.05),Mg2+、K+、Ca2+对样品的抗氧化活性影响不显著(P>0.05),对其抗氧化活性影响从大到小依次为:Zn2+>Fe3+>Mg2+>K+>Ca2+。当Zn2+浓度达到5.0 mmol/mL时,其抗氧化活性保持率仅为72.5%。因此,在存储、运输、生产及加工过程中应尽量避免使用锌和铁制品。

图8 金属离子对蛋白肽稳定性的影响
Fig.8 Effect of metal ions on stability of protein peptide
2.7.5 NaCl对鲐鱼蛋白肽抗氧化活性的影响
由图9可知,随着NaCl浓度的升高,其抗氧化活性保持率显著性下降(P<0.05),这可能是由于NaCl溶液浓度过高会破坏肽的结构,导致其抗氧化活性的下降。
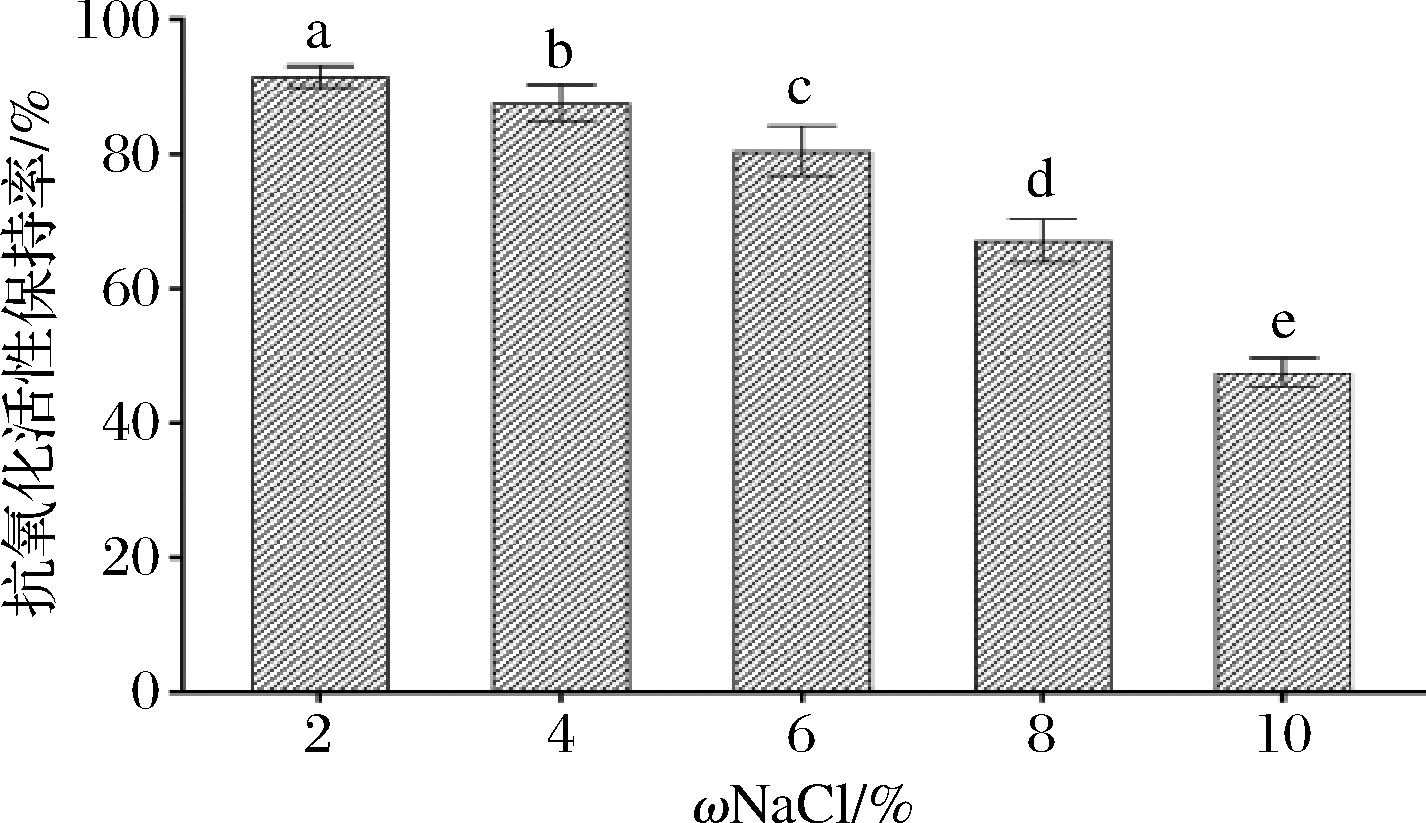
图9 NaCl质量分数对蛋白肽稳定性的影响
Fig.9 Effect of NaCl concentration on stability of protein peptide
2.7.6 胃肠模拟消化对鲐鱼蛋白肽抗氧化活性的影响
由图10可知,鲐鱼蛋白肽在胃液中的抗氧化活性保持率较高,达93.47%,表明较低pH及胃蛋白酶对其抗氧化活性影响不大;而在肠液中,其抗氧化活性随着消化时间的增加呈显著下降趋势(P<0.05),胃液消化6 h后,肠液再消化4 h,其终抗氧化活性保持率为30.93%。这可能是由于缓慢加热和蛋白酶使肽链展开,从而使多肽进一步降解成小肽,有可能造成抗氧化活性的下降[25]。
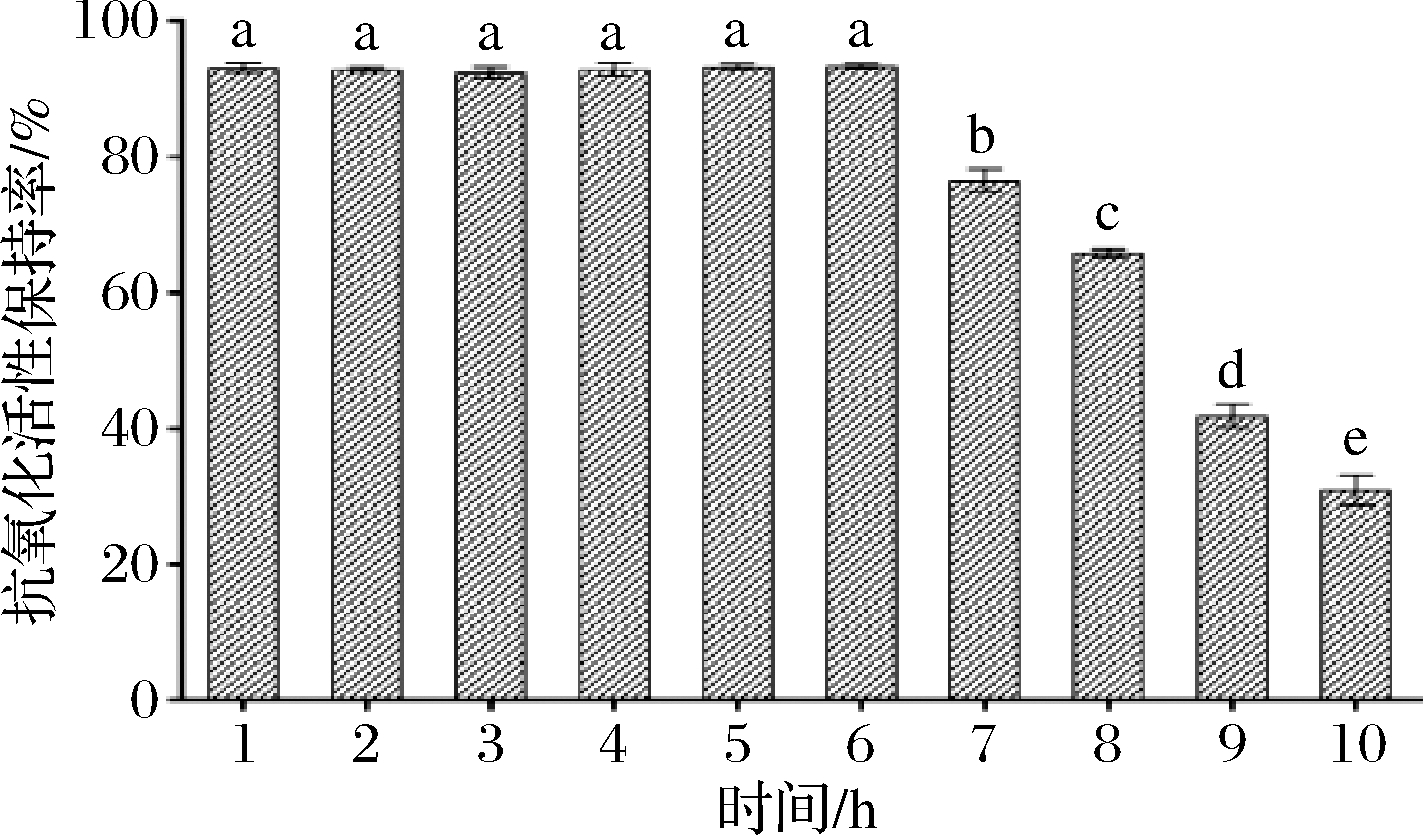
图10 胃肠模拟消化对蛋白肽稳定性的影响
Fig.10 Effect of simulated gastrointestinal digestion on stability of protein peptide
3 结果与讨论
本文以鲐鱼为原料,优化鲐鱼蛋白肽制备工艺,并对其氨基酸组成、抗氧化活性和稳定性进行了探讨。研究发现,所制备的鲐鱼蛋白肽相对分子质量<1 kDa组分占总量的92.15%;该蛋白肽中人体必需氨基酸占比40.10%、具有给质子能力的氨基酸占比40.06%、疏水性氨基酸占比35.33%;其清除·OH、ABTS阳离子自由基和DPPH自由基的IC50值分别为3.77、14.14、8.91 mg/mL,具有较高的抗氧化活性。鲐鱼蛋白肽在酸性条件和高温条件下较为稳定;在一定添加范围内,食用糖和食品添加剂对鲐鱼蛋白肽的活性无显著性影响(P>0.05);而随着NaCl浓度上升,鲐鱼蛋白肽抗氧化活性显著下降(P<0.05);胃液模拟消化无显著性影响(P>0.05),肠液模拟消化对其稳定性影响显著(P<0.05),经胃肠模拟消化后鲐鱼蛋白肽仍能保持30.93%的活性。综上所述,鲐鱼蛋白肽抗氧化活性较高,稳定性较好,开发潜力较大,具有良好的应用前景,本实验为鲐鱼的精深加工和高效利用提供了一定理论依据。
[1] WANG X Q, YU H H, XING R E, et al.Preparation and identification of antioxidative peptides from Pacific herring (Clupea pallasii) protein[J].Molecules (Basel, Switzerland), 2019, 24(10):1946.
[2] 何佳易, 徐鑫, 刘国艳, 等.小黄鱼免疫肽制备条件的响应面优化[J].食品科学, 2012, 33(3):151-156.
HE J Y, XU X, LIU G Y, et al.Optimization of hydrolysis conditions for production of immune peptides from small yellow croaker using response surface methodology[J].Food Science, 2012, 33(3):151-156.
[3] WONGSRANGSAP N, CHUKIATSIRI S.Purification and identification of novel antioxidant peptides from enzymatically hydrolysed Samia ricini pupae[J].Molecules (Basel, Switzerland), 2021, 26(9):2588.
[4] SONKLIN C, ALASHI A M, LAOHAKUNJIT N, et al.Functional characterization of mung bean meal protein-derived antioxidant peptides[J].Molecules (Basel, Switzerland), 2021, 26(6):1515.
[5] 纪钱萍, 李伟, 佟长青.大鲵活性肽牡蛎多糖复合粉体外ACE抑制作用的研究[J].农产品加工, 2020, 20:29-31.
JI Q P, LI W, TONG C Q.Study on angiotensin I-converting enzyme inhibitory activity of giant salamander active peptides and oyster polysaccharides composite powder in vitro[J].Farm Products Processing, 2020, 20:29-31.
[6] 练家惠, 陈向东, 汪辉, 等.人工合成抗菌肽生物信息学分析及其抑菌活性研究[J].药学与临床研究, 2020, 28(4):251-254.
LIAN J H, CHEN X D, WANG H, et al.Bioinformatics and antimicrobial activity of a remoulded antimicrobial peptide[J].Pharmaceutical and Clinical Research, 2020, 28(4):251-254.
[7] ZHANG Q T, LIU Z D, WANG Z, et al.Recent advances in small peptides of marine origin in cancer therapy[J].Marine Drugs, 2021, 19(2):115.
[8] PAVLICEVIC M, MAESTRI E, MARMIROLI M.Marine bioactive peptides-an overview of generation, structure and application with a focus on food sources[J].Marine Drugs, 2020, 18(8):424.
[9] LI Y, WU C H, WU T T, et al.Antioxidant and antibacterial properties of coating with chitosan:Citrus essential oil and effect on the quality of Pacific mackerel during chilled storage[J].Food Science and Nutrition, 2019, 7(3):1 131-1 143.
[10] 王珏. 鲐鱼干制过程中营养和风味物质变化研究[D].杭州:浙江工商大学, 2018.
WANG J.Study on the changes in nutrition and flavor of mackerel during dried process[D].Hangzhou:Zhejiang Gongshang University, 2018.
[11] JIANG J J, JIA Q, LIN W L, et al.Nutritional analysis and physiological activity evaluation of Pneumatophorus japonicus sauce[J].Agricultural Science & Technology, 2019, 20(1):49-54.
[12] 马丹妮, 马佳雯, 赵震震, 等.鲐鱼蛋白粉的制备及其品质分析[J].食品工业科技, 2020, 41(7):133-138;145.
MA D N, MA J W, ZHAO Z Z, et al.Preparation and quality analysis of mackerel protein powder[J].Science and Technology of Food Industry, 2020, 41(7):133-138;145.
[13] 崔琪, 陈敬蕊, 姜秀云, 等.海洋生物活性肽药物应用的研究进展[J].中国海洋药物, 2019, 38(2):54-60.
CUI Q, CHEN J R, JIANG X Y, et al.Advances in the application of marine bioactive peptide drugs[J].Chinese Journal of Marine Drugs, 2019, 38(2):54-60.
[14] 陈思远, 刘永祥, 曹小舟, 等.从麦胚清蛋白分离制备高活性抗氧化肽[J].中国农业科学, 2016, 49(12):2 379-2 388.
CHEN S Y, LIU Y X, CAO X Z, et al.The preparation process for isolation of a highly active antioxidant peptide derived from wheat germ albumin[J].Scientia Agricultura Sinica, 2016, 49(12):2 379-2 388.
[15] 李美娜, 黎德佳, 谢景, 等.鲤鱼鱼鳞蛋白的酶解制备工艺及其抗氧化活性[J].安徽农业科学, 2017, 45(19):86-89.
LI M N, LI D J, XIE J, et al.Study on enzymatic hydrolysis preparation and antioxidant activity of protein from carp scales[J].Journal of Anhui Agricultural Sciences,2017, 45(19):86-89.
[16] 王雪芹. 鲐鱼多肽的抗氧化活性与抗疲劳作用研究[D].青岛:中国科学院研究生院(海洋研究所), 2014.
WANG X Q.Study on the antioxidant activity and antifatigue effect of mackerel peptides[D].Qingdao:Institute of Oceanology, Chinese Academy of Sciences, 2014.
[17] 曹叶霞, 李蔷薇, 李佳佳, 等.野生蕨菜中总多酚的提取及抗氧化性研究[J].粮食与油脂, 2021, 34(5):137-141.
CAO Y X, LI Q W, LI J J, et al.Extraction and antioxidant activity of total polyphenols from wild Pteridium aquilinum[J].Cereals & Oils, 2021, 34(5):137-141.
[18] 李宁, 刘红芝, 刘丽, 等.中性蛋白酶分步酶解花生分离蛋白制备花生短肽的研究[J].中国农业科学, 2013, 46(24):5 237-5 247.
LI N, LIU H Z, LIU L, et al.Preparation of peanut oligopeptides from peanut protein isolated by neutral proteinase stepping hydrolysis[J].Scientia Agricultura Sinica, 2013, 46(24):5 237-5 247.
[19] 王乐, 李享, 刘文营, 等.清酱肉体外模拟消化后粗肽的抗氧化活性和氨基酸分析[J].中国食品学报, 2021, 21(2):319-326.
WANG L, LI X, LIU W Y, et al.Antioxidant activities and amino acid composition of crude peptides extracted from pickled sauced meat after in vitro simulated gastrointestinal digestion[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(2):319-326.
[20] 刘珊珊, 敖静, 谢宁宁, 等.酪蛋白抗氧化肽的胃肠消化稳定性研究[J].中国食品学报, 2014, 14(2):47-54.
LIU S S, AO J, XIE N N, et al.Study on the stability of casein antioxidant peptides during simulated gastrointestinal digestion[J].Journal of Chinese Institute of Food Science and Technology, 2014, 14(2):47-54.
[21] 姬中伟. 小米醇溶蛋白肽的制备及其抗氧化与抗炎活性研究[D].无锡:江南大学, 2020.
JI Z W.Study on the preparation of foxtail millet prolamins peptide and its antioxidant and anti-inflammatory activities[D].Wuxi:Jiangnan University, 2020.
[22] 樊雨梅, 汝文文, 史传超, 等.阿胶低聚肽的成分分析及其抗氧化活性[J].食品工业科技, 2020, 41(18):314-318;323.
FAN Y M, RU W W, SHI C C, et al.Composition and its antioxidant activity of Colla corii asini oligopeptides[J].Science and Technology of Food Industry, 2020, 41(18):314-318;323.
[23] 姚轶俊, 张晶, 鞠兴荣, 等.菜籽抗氧化肽WDHHAPQLR的环境稳定性研究[J].中国粮油学报, 2019, 34(8):54-60.
YAO Y J, ZHANG J, JU X R, et al.Environmental stability of rapeseed antioxidant peptide WDHHAPQLR[J].Journal of the Chinese Cereals and Oils Association, 2019, 34(8):54-60.
[24] 裴云成, 朱丹, 崔采莲, 等.杏鲍菇柄抗氧化肽的制备及其稳定性初步分析[J].食品工业科技, 2020, 41(4):146-152;160.
PEI Y C, ZHU D, CUI C L, et al.Preparation of antioxidant peptides from Pleurotus eryngii stalk and its stability preliminary analysis[J].Science and Technology of Food Industry, 2020, 41(4):146-152;160.
[25] 陈丽花, 朱楚楚, 李冉冉.体外消化对金瓜籽抗氧化肽抗氧化活性的影响[J].食品科学, 2019, 40(3):78-86.
CHEN L H, ZHU C C, LI R R.Effect of in vitro digestion on antioxidant activity of antioxidant peptides from marrow seeds(Cucurbita pepo L.var.medullosa alef.)[J].Food Science, 2019, 40(3):78-86.