GB/T 17204—2008《饮料酒分类》中将饮料酒定义为酒精度在0.5%(体积分数)以上的酒精饮料,包括各种发酵酒、蒸馏酒及配制酒,如黄酒、啤酒、果酒、葡萄酒、白酒、白兰地、威士忌、伏特加、朗姆酒和露酒等。酒精度是饮料酒的一项重要质量指标,是影响酒类产品等级及口感的重要因素[1]。以酒精度为标准可将白酒分为高度白酒、中度白酒和低度白酒。研究显示,酒精度是影响浓香型白酒中总酸总酯含量的重要因素之一[2]。目前,国家有关部门根据食品质量法、食品安全法加强了酒类产品的抽检力度,酒精度是其中的重要指标[3]。
现行饮料酒中酒精度的测定方法依据GB 5009.225—2016《食品安全国家标准 酒中乙醇浓度的测定》。其中,密度瓶法适用于蒸馏酒、发酵酒和配制酒,仪器成本低、便于普及,但操作繁琐、对温度敏感[4];酒精计法适用于酒精、蒸馏酒、发酵酒和配制酒(除啤酒外),仪器操作简单,但易受酒中其他成分干扰、对温度敏感[5];气相色谱法适用于葡萄酒、果酒和啤酒,仪器稳定,但测定酒精度高的饮料酒时需蒸馏和稀释,操作繁琐;数字密度计法适用于啤酒、白兰地、威士忌和伏特加,测试快速、简单,但需蒸馏法除去不挥发物质,前处理复杂、样品用量大。此外,王超等[6]利用直接酒精计法测定了不含糖露酒的酒精度,但无法准确测定其他酒体含量复杂的饮料酒,样品用量大。近红外光谱法适用于发酵酒和蒸馏酒酒精度的测定[7-8],但在实际测定中,样品中水分掩盖了其他成分的吸收信号,对测定结果有一定影响[5,9],且需蒸馏操作,测试过程相对复杂费时。综上,目前实验室中常用测定饮料酒中酒精度的方法,大都需要预先对饮料酒进行蒸馏处理,且实际检测过程中实验操作人员的熟练度对测定结果的影响很大。
定量核磁共振技术(quantitative nuclear magnetic resonance, QNMR)是一种十分有效的定量技术,具有前处理简单、样品用量少、可同步进行定性和定量分析的优点[10]。目前,QNMR已经广泛应用于制药、食品、生命科学、化工等行业,并被各国药典收录[3]。QNMR在啤酒[11-12]、葡萄酒[13]、白酒[14-15]、黄酒[16]等饮料酒中均有相关应用研究,如CAO等[11]用QNMR定量液体饮料中的蔗糖,栾晓菲等[12]用QNMR定量分析了啤酒中28种主要成分。
本文采用台式低场(60 MHz)核磁共振波谱仪对饮料酒中酒精度进行定量分析,基于一维核磁共振氢谱(1H nuclear magnetic resonance, 1H NMR)技术对饮料酒中酒精度测定方法进行了研究,并对代表性的几种饮料酒(白酒、啤酒、葡萄酒、樱桃发酵酒)酒精度测定方法做了方法验证,以期开发出一种简单、快速、准确性好的饮料酒中酒精度测定方法。
1 材料与方法
1.1 材料与仪器
柠檬酸(99%)、琥珀酸(99%),Sigma-Aldrich公司;无水乙醇(分析纯),天津市致远化学试剂有限公司;重水(99.9%),北京伊诺凯科技有限公司;白酒样品购于某电商平台,含浓香型、浓香酱香兼香型和酱香型3种香型4个样品;啤酒样品购于某超市,共4个样品;葡萄酒样品和樱桃发酵酒样品购于某电商平台。
NMReady-60PRO高性能60 MHz基准核磁共振波谱仪,Nanalysis公司;AB204-N天平,瑞士Mettler Toledo公司。
1.2 实验方法
1.2.1 乙醇标准溶液、柠檬酸溶液及琥珀酸溶液配制
乙醇标准溶液:用无水乙醇和水配制成体积分数分别为0.5%、2.5%、5%、10%、15%、20%、30%、40%、50%、60%、70%、80%的乙醇水溶液。
白酒测定的柠檬酸外标溶液:称取柠檬酸4 g(精确到0.01 mg),用水定容到10 mL。
啤酒、葡萄酒和樱桃发酵酒测定的柠檬酸外标溶液:称取柠檬酸1 g(精确到0.01 mg),用水定容到10 mL。
柠檬酸内标溶液:称取柠檬酸4 g(精确到0.01 mg),用重水定容到10 mL。
琥珀酸内标溶液:称取琥珀酸0.4 g(精确到0.01 mg),用重水定容到10 mL。
1.2.2 上机样品制备
标曲法:取500 μL酒样加入到2 mL 离心管中,再加入500 μL重水,混匀后取600 μL于核磁管中待测。用同样的方法制备乙醇标准溶液上机样品。
外标法:取500 μL酒样加入到2 mL 离心管中,再加入500 μL重水,混匀后取600 μL于核磁管中待测。用同样的方法制备柠檬酸外标液上机样品。
内标法:取500 μL酒样加入到2 mL 离心管中,再加入500 μL柠檬酸或琥珀酸内标液,混匀后取600 μL于核磁管中待测。
1.2.3 1H NMR测定参数
空扫次数:0次;扫描次数:16次;谱宽:8 000 Hz;激发中心:标曲法和外标法中标准样品和酒样品激发中心位置为乙醇甲基的出峰位置δ 1.0,白酒测定的外标样品为δ 2.45,啤酒、葡萄酒、樱桃发酵酒测定的外标样品为δ 2.85。内标法中激发中心位置为内标样品出峰位置和乙醇甲基出峰位置的中间位置δ 1.50;接收增益:14;检测脉冲:激发角度为90°的单脉冲;弛豫时间:标曲法和外标法测定时,白酒、啤酒、葡萄酒、樱桃发酵酒酒精度测定弛豫延迟时间(D1)分别为10、30、15、15 s,内标法分别为10、30、25、25 s;采样点数:4 096。
1.2.4 1H NMR谱图预处理
使用MestReNova12.0软件(Mestrelab Research S.L.,MestReNova(Mnova)NMR,USA)对测试所得原始数据进行傅里叶变换、相位校正、基线校正及定标处理,将乙醇甲基的化学位移定为δ 1.00,柠檬酸外标溶液中没有乙醇,将H2O的化学位移定为δ 4.79。
1.2.5 精密度分析
随机取1份样品,在1 d内分别用标曲法、外标法、内标法重复测定5次,求相对标准偏差,分析日内精密度;随机取1份样品,在5 d内分别用标曲法、外标法、内标法重复测定5次,求相对标准偏差,分析日间精密度。
1.2.6 加标回收率分析
取1份样品,加入4份不同浓度水平的乙醇,每个浓度水平分别用外标法、内标法、标曲法分别测定2次,测定结果取平均值,分别计算加标回收率。
1.2.7 准确性分析
将标曲法、外标法、内标法测定结果与GB 5009.225—2016《食品安全国家标准 酒中乙醇浓度的测定》中数字密度计法测定结果进行对比分析。
2 结果与分析
2.1 定量方法选择
核磁常用的定量方法有标曲法、外标法和内标法。标曲法需要配制系列标准样品,标准样品需要模拟待测样品,不确定度高,但无需选择外标样品和内标样品。外标法无需考虑外标物质与待测物是否相互影响,在保证外标样品不变质的前提下可以多次重复使用,但需要同时测试样品和外标的90°脉冲宽度和定量1H NMR,不确定度也相对较高。内标法定量不确定度优于标曲法和外标法,内标物和待测样品只需经过1次检测即可,但需仔细选择内标物质以避免内标物质和待测物之间的相互作用,导致信号重叠,内标物质和待测物必须可溶于所选的核磁共振溶剂中。
本研究分别采用标曲法、外标法和内标法对饮料酒的酒精度检测方法进行了研究。
2.1.1 标曲法
将乙醇标准液定量1H NMR的定量峰积分面积的绝对值为横坐标,乙醇标准液的浓度为纵坐标,得到线性回归方程y=αx+β,再用相同方法得到待测样品的定量1H NMR定量峰积分面积的绝对值,用插值法得到样品中酒精度。乙醇标准液和待测样品的测试参数和处理参数必须完全一致。
2.1.2 外标法
PULCON外标法定量使用外部参考样品,将外部参考样品的校准转移到实际样品中,因此无需考虑分析物和参考样品之间的相互作用和信号重叠。此外,采用PULCON外标法成本相对较低,可重复多次利用,进一步降低了核磁共振的检测成本,简化了前处理操作。柠檬酸结构简单,性质稳定,易溶于水,如图1所示以水做溶剂的1H NMR谱仅在δ 2.44处有柠檬酸2个亚甲基的4个氢的一组峰,用于定量分析结果准确,因此选择柠檬酸作为外部参考物,用公式(1)计算待测物的含量。
CS=![]()
(1)
式中:C,分析物质量浓度,mg/L;A,绝对积分面积;M,相对分子质量,Da;nH,质子数;NS,扫描次数;P1,1H 90°脉冲宽度;T,检测温度,℃;下标Q表示外部参考样品;下标S表示待测分析物。
2.1.3 内标法
内标法定量需在样品溶液中加入一定量的内部参考物,在充分弛豫的条件下,核磁共振信号强度(峰面积)与产生该信号的原子的数目成正比,而与其化学性质和所处的化学环境无关。琥珀酸化学性质稳定,不与酒中物质发生反应,在水中有较高的溶解度,其水溶液的1H NMR谱只有一组峰,代表4个氢原子,由图1可知,其信号不与啤酒、葡萄酒、樱桃发酵酒中乙醇信号峰发生重叠,和乙醇的信号基线分离良好,所以选用琥珀酸作为酒精度较低饮料酒的内标物质。白酒中酒精度较高,相应的需要内标物质的浓度也要高一些,但琥珀酸在20 ℃时的溶解度为7 g/100 g,对于酒精度一般大于18%vol的白酒,琥珀酸不适合作为内标物质。柠檬酸易溶于水,性质稳定,由图1可知,柠檬酸的信号δ 2.74不和白酒中乙醇的信号重叠,基线分离较好,所以用柠檬酸作为白酒酒精度测定的内标物质。以内标物的相对峰面积作为参考,饮料酒甲基的信号峰作为定量峰,根据公式(2)计算饮料酒中乙醇的浓度。
(2)
式中:C,分析物质量浓度,mg/L;M,相对分子质量,Da;nH,质子数;A,信号积分面积;下标S表示待测分析物;下标Std表示内标物。

图1 外标柠檬酸和各饮料酒与内标混合溶液的1H NMR谱图
Fig.1 1H NMR spectrum of external standard citric acid and mixed solutions of alcoholic beverages with internal standards
2.2 测试参数优化
核磁共振测试中,弛豫过程分为自旋-晶格弛豫(纵向弛豫)和自旋-自旋弛豫(横向弛豫),纵向弛豫时间(T1)一般大于横向弛豫时间(T2)。弛豫延迟时间(D1)是QNMR中非常重要的一个参数,弛豫延迟时间设置太短会导致纵向磁化矢量不能完全恢复[18],使定量峰的积分面积不能代表实际质子数,从而影响定量的准确性,但弛豫延迟时间设置过长又会导致测试时间过长。本文采用反转恢复法测定了标曲法和外标法中白酒、啤酒、葡萄酒、樱桃酒样品中乙醇的甲基、亚甲基和外标柠檬酸样品的T1,以及内标法中白酒、啤酒、葡萄酒、樱桃酒样品中乙醇的甲基、亚甲基及内标物质的T1,设置D1为定量峰T1的5倍[19],以达到准确定量的目的,测定结果见表1。使用标曲法和外标法测定时,白酒、啤酒、葡萄酒、樱桃发酵酒酒精度测定时D1分别设为10、30、15、15 s,内标法分别为10、30、25、25 s。
表1 T1测定结果
Table 1 T1 determination results
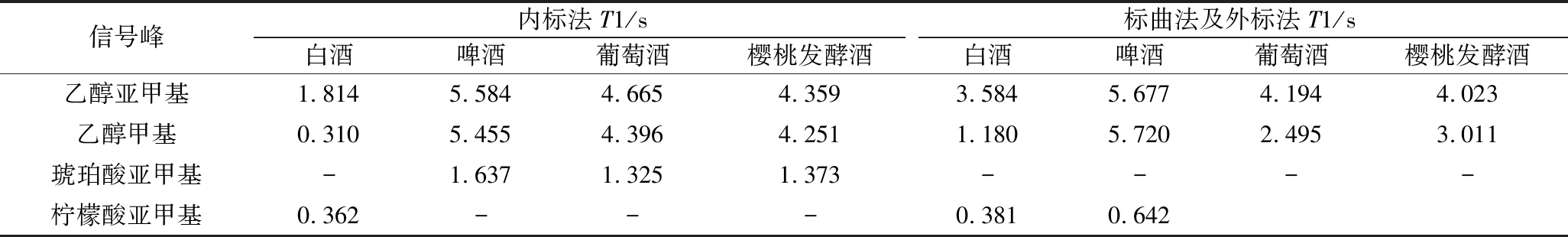
信号峰内标法T1/s标曲法及外标法T1/s白酒啤酒葡萄酒樱桃发酵酒白酒啤酒葡萄酒樱桃发酵酒乙醇亚甲基1.8145.5844.6654.3593.5845.6774.1944.023乙醇甲基0.3105.4554.3964.2511.1805.7202.4953.011琥珀酸亚甲基-1.6371.3251.373----柠檬酸亚甲基0.362---0.3810.642
激发中心位置(o1p)在标曲法和外标法中为定量峰的出峰位置,对于内标法而言为内标物质的出峰位置和乙醇定量峰的中间位置。接收增益值既不能太大也不能太小,太大数据会溢出,太小会影响定量的灵敏度,通过仪器计算发现增益值为14较合适。
需要特别说明的是标曲法中标准样品和待测样品所有测试参数必须保持完全一致;外标法中外标样品和待测样品的所有测试参数必须保持一致。
2.3 定量峰和积分区域的选择
定量峰应包含的质子数多、峰裂分少,才能使定量灵敏度高。定量峰所代表的基团T1时间应相对较短,测试时间才能短。乙醇的甲基信号峰相比亚甲基包含的质子数多、裂分少,由表1和表2可知T1也较短,所以选用乙醇甲基的信号峰作为定量峰。
积分区域应最大包含定量峰的区域,但不能把定量峰周边其他杂质峰包含进去,在不把杂质峰包含进去的前提下,一般以定量峰为中点至少向两边延伸20倍的半峰宽。使用标曲法及外标法时,乙醇标准液的积分区域为δ 1.43~0.30;白酒的积分区域为δ 1.29~0.64,啤酒、葡萄酒、樱桃发酵酒的积分区域分别为δ 1.30~0.67、δ 1.30~0.65、δ 1.30~0.64;白酒测定的外标柠檬酸的积分区域为δ 2.82~2.03,啤酒、葡萄酒、樱桃发酵酒测定的外标柠檬酸的积分区域为δ 3.22~2.46。使用内标法时,白酒乙醇甲基积分区域为δ 1.30~0.67,内标柠檬酸积分区域为δ 3.12~2.31;啤酒、葡萄酒、樱桃发酵酒乙醇甲基积分区域分别为δ 1.30~0.68、δ 1.30~0.65、δ 1.30~0.66,内标琥珀酸积分区域分别为δ 2.63~2.30、δ 2.61~2.30、δ 2.62~2.30。
2.4 方法学考察
2.4.1 线性分析
以1.2.3的参数测定1.2.1配制的乙醇标准溶液1H NMR,以乙醇标准液体积分数作为横坐标,1H NMR中乙醇甲基峰积分面积作为纵坐标,得到线性回归方程y=10.63x-8.074,R2=0.996 1,可见乙醇体积分数为0.5%~80%时,标曲法测定线性良好。
以外标法测定1.2.1配制的乙醇标准溶液的体积分数为横坐标,乙醇标准液体积分数为纵坐标,得到线性回归方程y=1.054 4x-0.610 1,R2=0.996 1,可见乙醇体积分数为0.5%~80%时,外标法线性良好。
以内标法测定1.2.1配制的乙醇标准溶液的体积分数为横坐标,乙醇标准液体积分数作纵坐标,得到线性回归方程y=0.953 6x+0.389 8,R2=0.999 5,可见乙醇体积分数为0.5%~80%时,内标法线性良好。
2.4.2 精密度分析
2.4.2.1 日内精密度
白酒、啤酒、葡萄酒、樱桃发酵酒各取1个样品,在1 d内每间隔2 h分别用标曲法、外标法和内标法测定酒精度,共测定5次,计算日内精密度,由表2可知,相对标准偏差(relative standard deviation,RSD)<5%,日内精密度良好,满足方法准确性要求。
表2 日内精密度(n=5)
Table 2 Intra-day precisions (n=5)
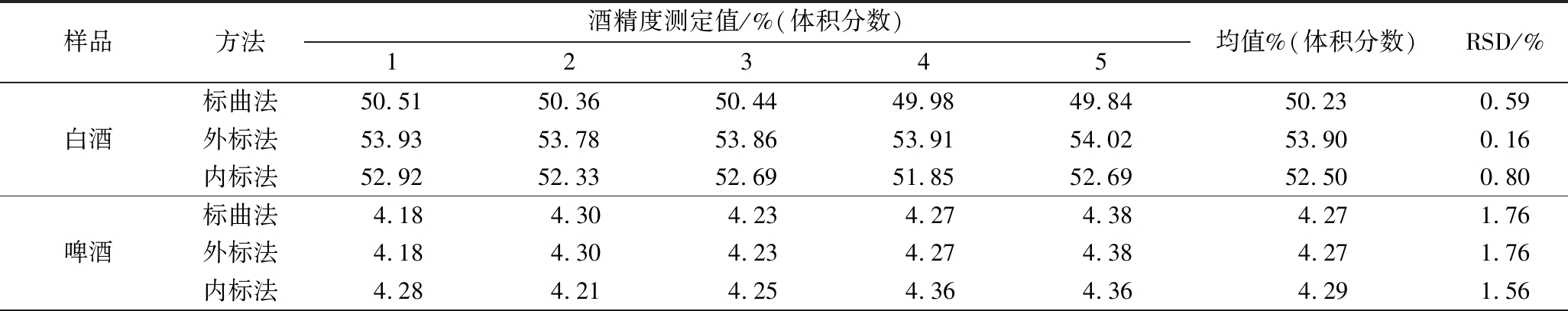
样品方法酒精度测定值/%(体积分数)12345均值%(体积分数)RSD/%白酒标曲法50.5150.3650.4449.9849.8450.230.59外标法53.9353.7853.8653.9154.0253.900.16内标法52.9252.3352.6951.8552.6952.500.80啤酒标曲法4.184.304.234.274.384.271.76外标法4.184.304.234.274.384.271.76内标法4.284.214.254.364.364.291.56
续表2

样品方法酒精度测定值/%(体积分数)12345均值%(体积分数)RSD/%葡萄酒标曲法10.8412.3311.4411.2211.3711.444.80外标法10.5411.8411.1010.8711.0011.074.33内标法11.2411.1911.5910.8610.9611.172.54樱桃发酵酒标曲法8.248.648.237.977.988.213.32外标法8.308.078.658.088.298.282.84内标法8.228.158.188.368.488.281.67
2.4.2.2 日间精密度
白酒、啤酒、葡萄酒、樱桃发酵酒各取1个样品,分别用标曲法、外标法和内标法测定,共测定5 d,计算日间精密度。从表3可见,RSD<3%,日间精密度良好,满足方法准确性要求。
表3 日间精密度(n=5)
Table 3 Inter-day precisions (n=5)

样品方法酒精度测定值/%(体积分数)12345均值%(体积分数)RSD/%白酒标曲法37.9437.8137.7537.7538.1337.870.43外标法37.2437.1137.0537.0537.4237.170.43内标法37.0237.5737.6537.2937.1237.330.74啤酒标曲法4.293.804.113.773.933.982.18外标法4.273.764.083.733.893.942.28内标法4.293.883.823.803.943.952.02葡萄酒标曲法11.1311.1211.1310.8510.8511.011.34外标法10.8910.8810.8910.6210.6210.781.35内标法10.3610.4510.3810.3410.2910.360.57樱桃发酵酒标曲法7.377.447.237.307.367.341.04外标法7.197.267.067.137.197.171.05内标法7.447.707.487.507.537.531.31
2.4.3 回收率分析
白酒、啤酒、葡萄酒、樱桃发酵酒各取1个样品,加入4份不同体积分数乙醇(表4),分别使用标曲法、外标法和内标法对样品中酒精度进行测定,计算回收率,结果见表4。白酒的加标回收率为94.62%~99.28%;啤酒的加标回收率标曲法和外标法分别为97.81%和100.60%,内标法为83.73%;葡萄酒加标回收率分别为84.67%~97.08%;樱桃发酵酒加标回收率分别为88.50%~100.25%。可见对于白酒、啤酒、葡萄酒、樱桃发酵酒3种方法的加标回收率均能满足定量准确性要求。
表4 加标回收率
Table 4 Spiked recoveries

样品方法未加标/%(体积分数)加标量/%(体积分数)测定值/%(体积分数)回收率/%RSD/%平均回收率/%白酒标曲法40.8外标法43.89内标法41.209.6749.3288.100.8416.5756.3793.930.5026.3667.42100.961.2031.6471.0195.500.199.6752.7091.160.8116.5759.9997.190.4926.3671.43104.471.1731.6475.1598.810.189.6750.5396.610.4016.5755.0083.280.9926.3668.96105.330.9131.6476.60111.910.6994.6297.9199.28
续表4
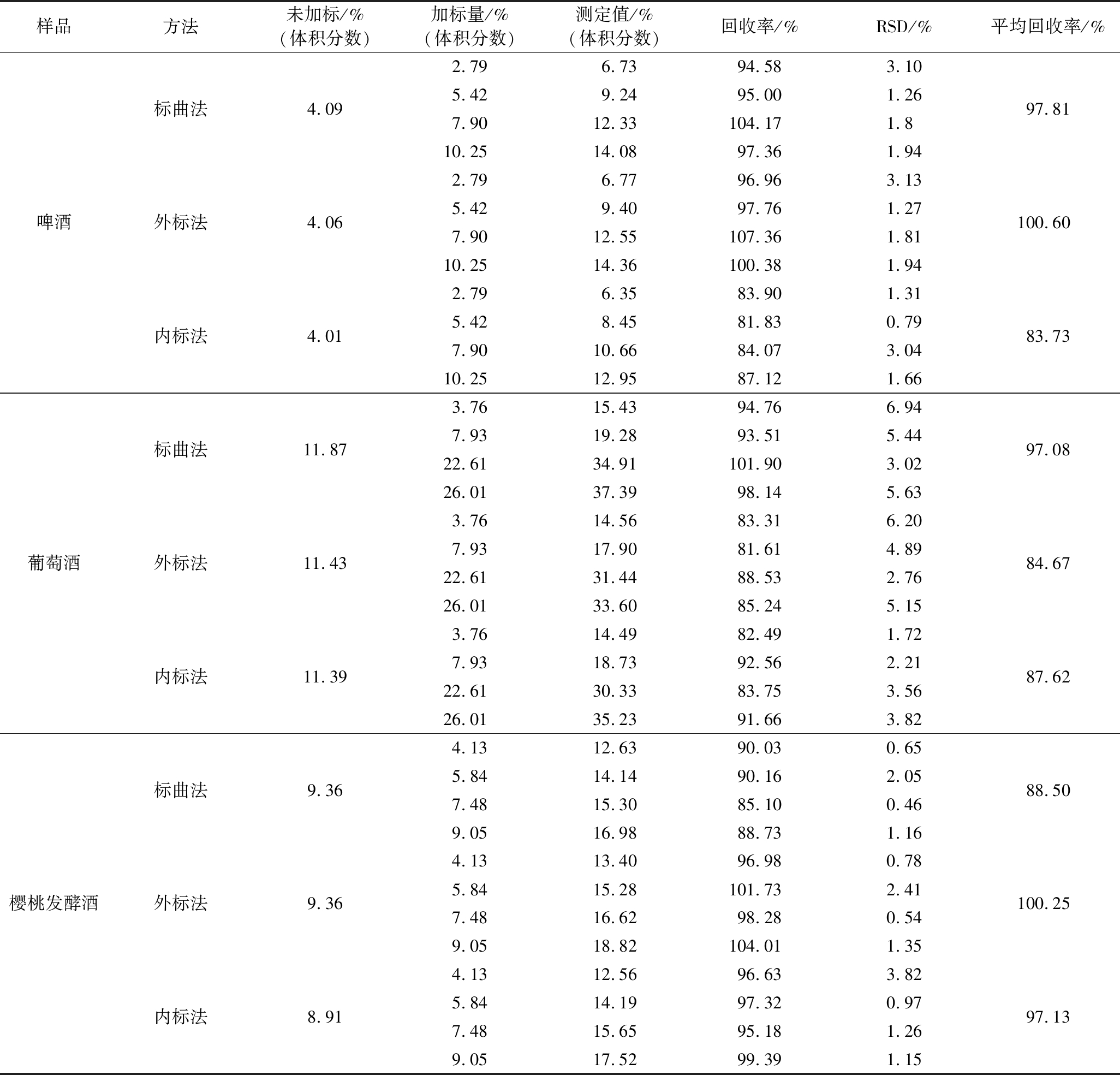
样品方法未加标/%(体积分数)加标量/%(体积分数)测定值/%(体积分数)回收率/%RSD/%平均回收率/%啤酒标曲法4.09外标法4.06内标法4.012.796.7394.583.105.429.2495.001.267.9012.33104.171.810.2514.0897.361.942.796.7796.963.135.429.4097.761.277.9012.55107.361.8110.2514.36100.381.942.796.3583.901.315.428.4581.830.797.9010.6684.073.0410.2512.9587.121.6697.81100.6083.73葡萄酒标曲法11.87外标法11.43内标法11.393.7615.4394.766.947.9319.2893.515.4422.6134.91101.903.0226.0137.3998.145.633.7614.5683.316.207.9317.9081.614.8922.6131.4488.532.7626.0133.6085.245.153.7614.4982.491.727.9318.7392.562.2122.6130.3383.753.5626.0135.2391.663.8297.0884.6787.62樱桃发酵酒标曲法9.36外标法9.36内标法8.914.1312.6390.030.655.8414.1490.162.057.4815.3085.100.469.0516.9888.731.164.1313.4096.980.785.8415.28101.732.417.4816.6298.280.549.0518.82104.011.354.1312.5696.633.825.8414.1997.320.977.4815.6595.181.269.0517.5299.391.1588.50100.2597.13
2.4.4 定量限和检出限
将乙醇标准品样品1.2.3的测试参数及1.2.4的数据处理条件下得到的谱图,定量峰乙醇甲基峰信噪比为3时的浓度作为检出限,信噪比为10时的浓度作为定量限[20-21],该方法的检出限为0.08%(体积分数),定量限为0.26%(体积分数),可满足GB/T 17204—2008《饮料酒分类》中规定的酒精度在0.5%(体积分数)以上的酒精饮料酒精度测定要求。
2.4.5 和国标法对比分析
用上述建立的1H NMR标曲法、外标法、内标法和GB 5009.225—2016《食品安全国家标准 酒中乙醇浓度的测定》中第四法-数字密度计法,分别对市售4个白酒、4个啤酒、1个葡萄酒和1个樱桃发酵酒样品酒精度进行测定,每个样品每种方法重复测定6次,测定结果取平均值,结果见表5。以国标法测定结果为横坐标,分别以本文所建立的1H NMR标曲法、外标法和内标法的测定结果为纵坐标作线性回归曲线,线性回归关系R2分别为0.999 8、0.999 7和0.999 7。结果表明,本文所建立的1H NMR法与GB 5009.225—2016《食品安全国家标准 酒中乙醇浓度的测定》中第四法-数字密度计法测定结果误差在5%以内,满足方法的可行性验证要求。
表5 核磁共振波谱法与国标法测定结果比较 单位:%vol
Table 5 Alcohol content determined by NMR and GB (Chinese national standard)

方法白酒啤酒12341234葡萄酒樱桃发酵酒标曲法35.6941.4951.9250.684.284.264.294.0911.878.30外标法36.1342.4953.9152.144.284.254.274.0611.438.35内标法36.1041.7952.1452.794.264.344.294.0111.398.31国标法36.3042.5053.5052.904.304.304.304.0012.208.40
3 结论
本研究采用60 MHz低场台式核磁共振波谱仪,基于1H NMR定量技术,分别采用标曲法、外标法和内标法对饮料酒的酒精度测定方法进行了研究,选取了具有代表性的饮料酒如白酒、啤酒、葡萄酒、樱桃发酵酒做了方法验证,对测定方法的线性、精密度、回收率、检出限、定量限分别做了考察,并与GB 5009.225—2016《食品安全国家标准 酒中乙醇浓度的测定》中第四法-数字密度计法测定结果进行了对比。
结果表明,在0.5%~80%的浓度范围内,标曲法、外标法、内标法的线性相关系数R2分别为0.996 1、0.996 1、0.999 5,说明这3种方法线性关系良好。分别用3种方法测定白酒、啤酒、葡萄酒、樱桃发酵酒的酒精度,日内和日间精密度均<5%。其中,白酒的标曲法、外标法和内标法的加标回收率分别为94.62%、97.91%和99.28%;啤酒的加标回收率分别为97.81%、100.60%和83.73%;葡萄酒的加标回收率分别为97.08%、84.67%、87.62%;樱桃发酵酒的加标回收率分别为88.50%、100.25%和97.13%。可见对于白酒、啤酒、葡萄酒、樱桃发酵酒,3种方法的加标回收率均能满足定量准确性要求。该方法的检出限为0.08%(体积分数),定量限为0.26%(体积分数)。本文所建立的1H NMR法与GB 5009.225—2016《食品安全国家标准 酒中乙醇浓度的测定》中第四法-数字密度计法测定结果误差在5%以内,满足方法的可行性验证要求。可见,基于低场台式核磁共振波谱仪建立的1H NMR标曲法、外标法、内标法可以用于饮料酒中酒精度的测定,且相比于GB 5009.225—2016《食品安全国家标准 酒中乙醇浓度的测定》中酒精度的测定方法,样品无需复杂前处理、样品用量少(仅需500 μL)、测样时间短(<5 min)。相对于高场核磁共振波谱仪(400 MHz),低场台式核磁共振波谱仪体积小、质量轻、便于移动,适合饮料酒中酒精度的快速和规模化分析测定。
[1] 刘宏欣, 张军, 黄富荣, 等.近红外光谱法快速测定啤酒的主要品质参数[J].光谱学与光谱分析, 2008, 28(2):313-316.
LIU H X, ZHANG J, HUANG F R, et al.Investigation on the quality indicators of beers using NIR[J].Spectroscopy and Spectral Analysis, 2008, 28(2):313-316.
[2] 李东军, 马伯荣, 胡兴美, 等.影响浓香型白酒总酸总酯变化的主要因素[J].酿酒, 2021, 48(3):130-131.
LI D J, MA B R, HU X M, et al.Main factors affecting the changes of total acids and esters in Luzhou-flavor liquor[J].Liquor Making, 2021, 48(3):130-131.
[3] 刘恩满, 李雪玉, 宗绪岩, 等.基于核磁共振氢谱技术建立白酒乙醇浓度检测方法[J].食品与发酵工业, 2021, 47(12):231-235.
LIU E M, LI X Y, ZONG X Y, et al.Detection of alcohol content in Chinese Baijiu based on 1H nuclear magnetic resonance spectrum[J].Food and Fermentation Industries, 2021, 47(12):231-235.
[4] 符郁馥, 刘冬妮, 周玉玲, 等.密度瓶法测定糯米酒中酒精度的不确定度评定[J].食品安全质量检测学报, 2019, 10(14):4 726-4 729.
FU Y F, LIU D N, ZHOU Y L, et al.Uncertainty evaluation for determination of alcohol degree in glutinous rice wine by pycnometer method[J].Journal of Food Safety & Quality, 2019, 10(14):4 726-4 729.
[5] 王秋瑾, 章平.白酒中乙醇含量检测方法的研究进展[J].现代食品, 2020(5):14-17.
WANG Q J, ZHANG P.Advance of ethanol content detection methods in liquor[J].Modern Food, 2020(5):14-17.
[6] 王超, 石利影, 刘楚楚, 等.不含糖露酒酒精度检测方法的探讨[J].酿酒, 2017, 44(6):73-74.
WANG C, SHI L Y, LIU C C, et al.Discussion on methods for the alcohol degree detection in sugar-free liqueur[J].Liquor Making, 2017, 44(6):73-74.
[7] 胡徽祥. 近红外光谱法快速测定调味料酒中的酒精度[J].现代食品, 2019(8):138-143.
HU H X.Rapid determination of condiment liquor by near-infrared spectroscopy alcohol quality[J].Modern Food, 2019(8):138-143.
[8] 樊双喜, 钟其顶, 李国辉, 等.近红外光谱法快速检测黄酒的酒精度、总糖和总酸[J].中国酿造, 2015, 34(2):135-138.
FAN S X, ZHONG Q D, LI G H, et al.Rapid determination of alcohol content, total sugar and total acid in Chinese rice wine by near-infrared spectroscopy[J].China Brewing, 2015, 34(2):135-138.
[9] PATZ C D, BLIEKE A, RISTOW R, et al.Application of FT-MIR spectrometry in wine analysis[J].Analytica Chimica Acta, 2004, 513(1):81-89.
[10] 祁慧雪. 核磁共振技术在化学物质定量分析中的应用[J].广东化工, 2012, 39(6):121;49.
QI H X.The Application of nuclear magnetic resonance technology in quantitative analysis of chemicals[J].Guangdong Chemical Industry, 2012, 39(6):121;49.
[11] CAO R G, NONAKA A, KOMURA F, et al.Application of diffusion ordered-1H-nuclear magnetic resonance spectroscopy to quantify sucrose in beverages[J].Food Chemistry, 2015, 171:8-12.
[12] 栾晓菲, 沈桂平, 郑彦婕, 等.基于核磁共振技术结合多元统计分析的啤酒化学组分定量与品牌鉴别[J].酿酒科技, 2016(5):48-53.
LUAN X F, SHEN G P, ZHENG Y J, et al.Compositional quantitation and brand identification of beer via NMR approach combined with multivariate statistical analysis[J].Liquor-Making Science & Technology, 2016(5):48-53.
[13] KUBALLA T, BRUNNER T S, THONGPANCHANG T, et al.Application of NMR for authentication of honey, beer and spices[J].Current Opinion in Food Science,2018,19:57-62.
[14] GODELMANN R, KOST C, PATZ C D, et al.Quantitation of compounds in wine using 1H NMR spectroscopy:Description of the method and collaborative study[J].Journal of AOAC International, 2019, 99(5):1 295-1 304.
[15] 吉鑫, 樊双喜, 李宜聪, 等.白酒中有机酸和醛类的偏最小二乘回归法定量分析模型[J].食品与发酵工业, 2020, 46(14):204-210;215.
JI X, FAN S X, LI Y C, et al.Quantitative analysis of organic acids and aldehydes in Baijiu via PLSR model[J].Food and Fermentation Industries, 2020, 46(14):204-210;215.
[16] 刘敏. 低场核磁共振技术(LF-NMR)在酿造酒品质检测中的应用[D].上海:上海理工大学, 2014.
LIU M.Assessment of brewing wine quality by LF-NMR[D].Shanghai:University of Shanghai for Science & Technology, 2014.
[17] 李刚, 张松, 高碧霞, 等.核磁共振波谱法分析代县黄酒成分及酒龄[J].化学分析计量, 2021, 30(8):28-33.
LI G, ZHANG S, GAO B X, et al.Analysis of components of Daixian wine based on 1H NMR technology and confirmation of wine ages[J].Chemical Analysis and Meterage, 2021, 30(8):28-33.
[18] 万相勇, 徐雪晶, 徐英杰, 等.定量核磁共振技术的测试流程[J].山东化工, 2020, 49(10):141-142.
WAN X Y, XU X J, XU Y J, et al.The study of testing process on quantitative nuclear magnetic resonance[J].Shandong Chemical Industry, 2020, 49(10):141-142.
[19] 徐雪晶, 万向勇, 赵锦漪, 等.氢核磁共振定量法初探[J].广东化工, 2020, 47(4):104;87.
XU X J, WAN X Y, ZHAO J Y, et al.The study on quantitative hydrogen nuclear magnetic resonance[J].Guangdong Chemical Industry, 2020, 47(4):104;87.
[20] 冯翠萍, 刘一诺, 樊双喜, 等.核磁共振磷谱法测定乳制品中的酪蛋白含量[J].食品科学, 2021, 42(4):221-226.
FENG C P, LIU Y N, FAN S X, et al.Determination of casein content in dairy products by 31P nuclear magnetic resonance[J].Food Science, 2021, 42(4):221-226.
[21] SCHOENBERGER T, MONAKHOVA Y B, LACHENMEIER D W, et al.Guide to NMR method development and validation-Part I:Identification and quantification[J].Eurolab Technical Report, 2014.DOI:10.13140/RG.2.1.1244.3689.