枸杞(Lycium barbarum)为茄目(Solanales)茄科(Solanaceae)枸杞属(Lycium)多年生落叶灌木[1],在我国是重要的药食两用资源。相关研究表明,枸杞的功能特性归功于其高含量的营养素(维生素、矿物质、叶酸和纤维素等)和酚类物质。其中,多酚类物质是植物界中最常见的含量丰富的芳香族次生代谢产物,被称为人体的“第七类营养素”,人体不能通过自身合成,需从外界食物中获取[2],多酚类物质作用于人体的生理功能主要包括抗氧化[3]、抗炎[4]、抗癌[5]、降血脂[6]、降血糖[7]等。
由于品种、加工条件、贮存方式等方面的制约,植物的酚类物质活性容易发生相应的变化。近年来,随着各类代谢组学方法日趋成熟,依赖代谢组学手段对植物中酚类物质的检测、鉴定与分析能够帮助人们建立食品功能活性变化与代谢物之间的关系[8]。例如,WANG等[9]以液相色谱-电喷雾质谱(liquid chromatography-electrospray mass spectrometry, LC-ESI-MS/MS)为检测手段,利用广泛靶向代谢组分析了5个柑橘品种中169个类黄酮的代谢产物;ZHAO等[10]采用超高效液相色谱-光电二极管阵列质谱(ultra performance liquid chromatography-diode array detector mass spectrometry, UPLC-DAD-MS),探索了微波处理、烘烤及煮沸对蓝莓中酚类物质的影响;雷嗣超等[11]采用超高效液相色谱-串联质谱(ultra performance liquid chromatography-mass spectrometry, UPLC-MS/MS),利用广泛靶向代谢技术研究了板栗皮中儿茶素类物质经过模拟消化体系后的组成变化,得出其在消化过程中稳定性较差。上述研究说明了代谢组学技术在植物多酚成分科学研究中的可靠性以及广阔的前景。
但是,利用代谢组学技术对枸杞酒发酵前后酚类物质变化的研究却鲜有报道。本研究以宁杞1号枸杞干果为研究材料,采用超高效液相色谱-离子阱-静电场轨道阱质谱(ultra performance liquid chromatography-linear ion trap quadrupole-Orbitrap-mass-spectrometry,UPLC-LTQ-Orbitrap-MS),利用广泛靶向代谢技术,对枸杞酒发酵前后酚类物质的主要代谢成分及酚类物质的积累做了分析,拓宽了对枸杞及枸杞酒中多酚类成分的基础研究,为枸杞酒活性机理的研究奠定理论基础,并为枸杞的深加工利用提供基础理论依据。
1 材料与方法
1.1 材料与试剂
宁杞1号枸杞干果,中宁县吉利宝枸杞制品有限公司;白砂糖,市售;一水柠檬酸(食品级),潍坊英轩实业有限公司;果胶酶、Txl酿酒活性干酵母,法国LAMOTHE-ABIET公司;甲醇(纯度≥99.9%)、甲酸(纯度≥98.0%)、乙腈(纯度≥99.9%),天津市大茂化学试剂厂。
1.2 仪器与设备
LTQ Orbitrap XL Domain35A高分辨液-质联用仪,Thermo Fisher公司;超纯水机,湖南科尔顿水务有限公司;静音真空高速破壁机,九阳股份有限公司;数字折射计,浙江托普云农科技股份有限公司;PHSJ-3F实验室PH计,上海仪电科学仪器股份有限公司;电子恒温不锈钢水浴锅,上海宜昌仪器纱筛厂。
1.3 实验方法
1.3.1 枸杞酒酿造工艺
原料拣选→冲洗→复水→打浆→硫杀→酶解→过滤→调整成分→接种酵母→陈酿→灌装→成品
枸杞汁制备:剔除枸杞中的霉果、烂果,流动水冲洗干净表面的灰尘,沥干水分后以1∶7(g∶mL)的料水比加入超纯水浸泡6 h,打浆2 min,加入H2SO3使SO2的质量浓度达到60 mg/L,添加40 mg/kg果胶酶,45 ℃恒温水浴酶解5 h,1、2、4、8层纱布依次过滤,初始糖度为8.4 °Brix,白砂糖调节糖度至20.0 °Brix,一水柠檬酸调节pH至3.2~3.5。
接种酵母:配制质量分数1%~5%的糖溶液,将干酵母以枸杞发酵汁总量0.2 g/L计算用量,加入配制好的糖溶液中,置于25~30 ℃培养箱中30 min后,加入制备好的枸杞汁中。
发酵:将枸杞汁装入2.5 L发酵罐,置于20 ℃培养箱中发酵,主发酵结束后吸取上清液进行陈酿,15 ℃陈酿90 d。分别在发酵0 d(BF)以及陈酿90 d(AF)取样,3个生物学重复分别命名为BF-1、BF-2、BF-3和AF-1、AF-2、AF-3,存放于-80 ℃冰箱中。
1.3.2 样品信息
待测样本为AF-1、AF-2、AF-2和BF-1、BF-2、BF-3。同时制备质控(quality control, QC)样本:将BF组及AF组进行等量混合,用于平衡色谱-质谱系统,评价系统稳定性[12]。本研究设置3个生物学重复,每个生物学重复的样品进行3个技术重复。
1.3.3 多酚的提取
根据焦阳[13]的方法略作改进:取样品于4 ℃解冻,冷冻干燥后低温研磨,称取1 g于15 mL的Eppendorf管中,在不断通入N2的同时加入10 mL 70%(体积分数)的甲醇溶液。避光超声波处理30 min,4 ℃、10 000 r/min离心20 min,将上层清液收集于棕色瓶中,上述操作再进行2次重复,将3次提取液收集混合后,再过0.22 μm有机相滤膜,避光保存于-80 ℃冰箱待测。
1.3.4 色谱分离
色谱柱规格型号:AccucoreTMC18,150 mm×2.1 mm,2.6 μm;流动相:A:乙睛,B:0.1%甲酸-水,洗脱梯度:0~1 min,5%~5% A;1~4 min,5%~10% A;4~10 min,10%~14% A;10~16 min,14%~70% A;16~16.5 min,70%~95% A,16.5~18 min,95%~95% A;柱温35 ℃;流速0.3 mL/min;进样体积2 μL;分析时间20 min。
1.3.5 质谱采集
采用电喷雾电离源,在正离子和负离子模式下采集数据,鞘内气体流速40 arb,辅助气体流速10 arb,正、负离子模式下辅助气体喷射电压分别为3.50和3.20 kV,喷射电流0.04 μA,毛细管温度350 ℃,毛细管电压-30 V,管透镜-110 V,低碰撞能15 eV,高碰撞能60 eV,设置一级质谱质量扫描范围100~1 000 m/z,二级质谱质量扫描范围50~1 000 m/z。
1.4 统计分析
通过文献检索汇总与枸杞相关的酚类物质化学成分,通过HumanMetabolome Database (HMDB)(http://www.hmdb.ca),Metlin(http://metlin.scripps.edu),massbank(http://www.massbank.jp/),mzclound(https://www.mzcloud.org/)等数据库中进一步匹配注释获得各代谢物准确的一级、二级离子信息,根据相关信息自建枸杞酚类物质化学成分质谱数据库。代谢物的鉴定首先进行一级质谱数据对比(Δppm<10),然后根据MS/MS模式所得碎片离子在自建库中进行比对确认。利用XcaliburTM4.0软件设置仪器方法、编辑序列和色谱、质谱数据处理。利用Omicshare云平台(https://www.omicshare.com/tools/)、微生信平台(http://www.bioinformatics.com.cn/)以及Metware Cloud平台(https://cloud.metware.cn/)进行差异代谢物的相关数据分析。
2 结果与分析
2.1 基于UPLC-LTQ-Orbitrap-MS平台鉴定枸杞及枸杞酒中酚类化合物
基于样品处理方法及分析条件,对枸杞酒发酵前后样品中的酚类物质进行分析。在正、负离子模式下从BF及AF中共检出55种酚类物质(图1)。BF中检出52种酚类物质。按照酚类物质的一级分类,有28种酚酸、15种黄酮、5种酚酰胺衍生物、3种香豆素以及1种芪类。从AF中检出49种酚类物质,其中包括23种酚酸、16种黄酮、6种酚酰胺衍生物、3种香豆素以及1种芪类。BF与AF共同检出的物质有46种,相关内容见电子版增强出版附件(http://doi.org/10.13995/j.cnki.11-1802/ts.030506),其中有22种酚酸、15种黄酮、5种酚酰胺衍生物、3种香豆素以及1种芪类。BF中检出而AF未检出物质有6种,皆为酚酸类物质,分别是4-甲氧基肉桂酸、对香豆酸甲酯、6-O-咖啡酰-D-葡萄糖、酪醇、1-O-肉桂酰-β-D-葡萄糖、阿魏酰咖啡酰酒石酸;AF中检出而BF未检出物质有3种,1种酚酰胺衍生物、1种黄酮、1种酚酸,分别为N-N-二(二羟基咖啡酰)亚精胺、3′,4,4′,5,7-五羟基黄烷、4-氨基水杨酸。
发酵前有5种酚酸类物质为结合态酚酸,相关研究表明,在发酵体系中,随着微生物的作用,产生的酶类可将结合态酚酸分解为游离态酚酸[14],这5种结合态酚酸或将分解为肉桂酸、对香豆酸、咖啡酸、阿魏酸等游离态酚酸,从而提高枸杞酒中酚酸类物质的抗氧化活性及生物利用度。

图1 实验组样品的酚类物质韦恩图
Fig.1 Venn diagram of phenolic substances in different groups
2.2 酚类化合物主成分分析(principal components analysis,PCA)
PCA得分图的聚散程度反映了样本代谢物的相近程度,即反映了枸杞酒发酵前后酚类代谢物的聚集情况,在代谢水平上差异越大的样品在得分图上间距越大[15]。由图2可知,QC样本聚集性好,说明检测过程仪器稳定性好、信号较为稳定,具有良好的实验重现性。实验组BF及AF在PCA空间紧密聚集,同时,第一主成分(PC1)和第二主成分(PC2)的解释率分别为99.16%和0.54%,两者累计贡献率达99.70%,可见各实验组样本之间分离效果较好,代谢物数据结果可靠,BF及AF组间存在显著差异。BF与AF组分离明显,这表明样品经过发酵处理后,样品中的酚类代谢物发生了明显的改变。

图2 QC组和实验组样品PCA得分图
Fig.2 PCA scoring plot of QC and experimental samples
2.3 酚类化合物正交偏最小二乘法分析(orthogonal partial least squares discriminant analysis, OPLS-DA)
OPLS-DA相对于偏最小二乘法分析,能够有效剔除与研究无关的影响,从而筛选出差异代谢物,为准确获得组间及组内酚类物质的差异状况,本研究又采用OPLS-DA有监督的判别方法对发酵前后的酚类物质进行分析。OPLS-DA得分图及置换检验图结果(图3)与PCA结果大体一致,可以看出BF与AF组发生了明显的分离。

a-模型得分图;b-置换检验图
图3 实验组OPLS-DA得分图及OPLS-DA置换检验图
Fig.3 OPLS-DA model and OPLS-DA permutation test of different groups
模型中参数![]() 表明所建模型对自变量X的解释率为
表明所建模型对自变量X的解释率为![]() 表示对分类变量Y的解释率为100%;Q2=0.999,说明该模型对样本变量的预测程度为99.9%,在置换检验图中,模型Q2点从右到左均低于最右端的原始Q2点,且位于最右边的R2、Q2均大于0.9,Q2回归线的截距为-0.22,说明OPLS-DA模型稳定性良好,且预测能力较强。
表示对分类变量Y的解释率为100%;Q2=0.999,说明该模型对样本变量的预测程度为99.9%,在置换检验图中,模型Q2点从右到左均低于最右端的原始Q2点,且位于最右边的R2、Q2均大于0.9,Q2回归线的截距为-0.22,说明OPLS-DA模型稳定性良好,且预测能力较强。
2.4 酚类差异代谢物的筛选与分析
从共同可检的46种酚类物质中,依据T检验,取P<0.05,差异倍数(fold change,FC)>2且FC<0.5,筛选出28种物质,如图4。再以OPLS-DA模型中变量的权重值(variable important in projection,VIP)>1为条件,筛选出的差异代谢物13种,如表1所示。
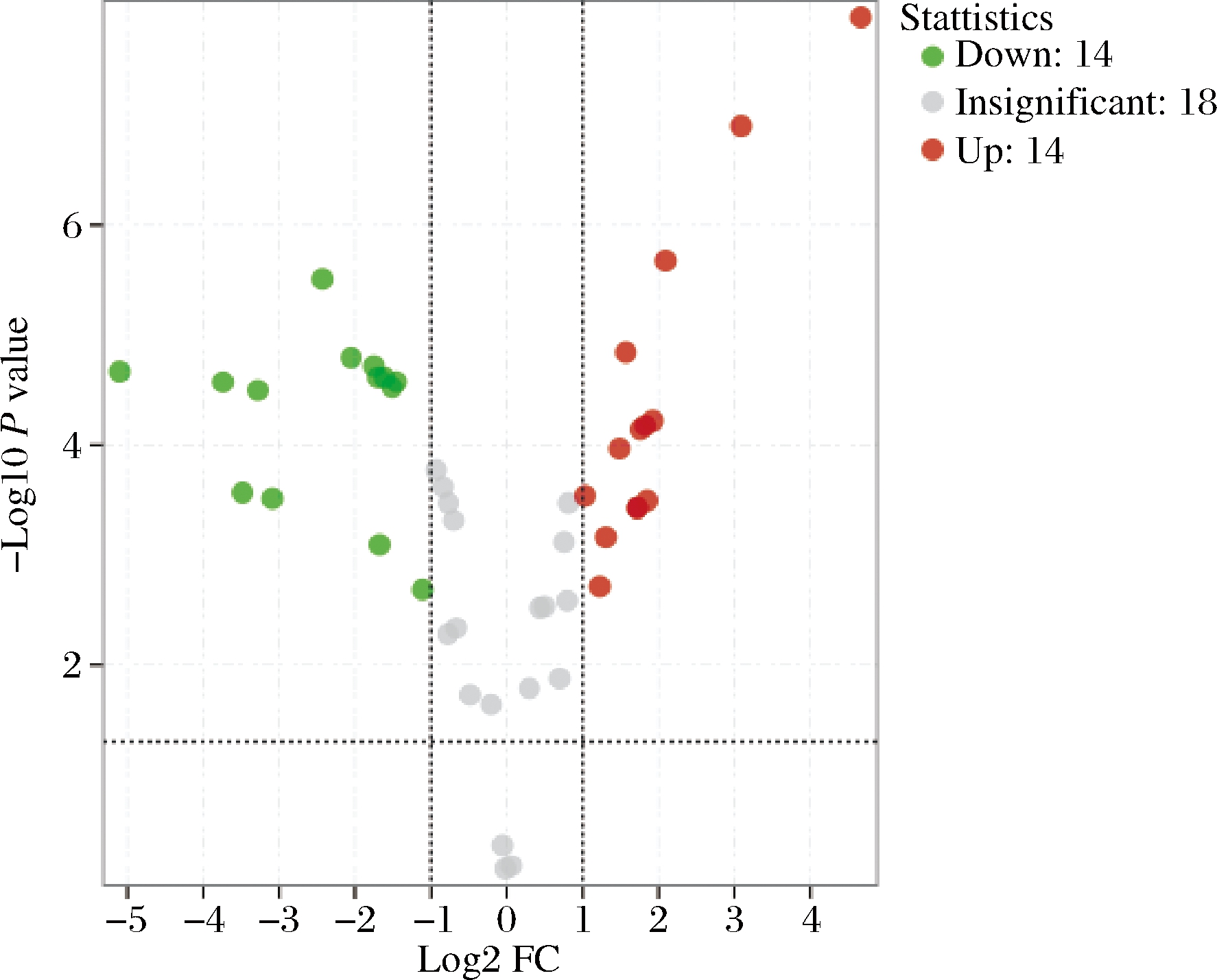
图4 酚类差异代谢物火山图
Fig.4 Volcanic map of phenolic substances
由表1可见,在BF与AF组的对比中,筛选出差异代谢物共13种,其中包括酚酸、黄酮、酚酰胺衍生物以及香豆素,分别占比为57.14%、14.29%、14.29%以及7.14%。差异代谢物中,酚酸类物质占比最大,且丰度高。筛选出的13种差异代谢物中,有5种物质上调,分别是对香豆酸-4-O-葡萄糖苷、6-O-阿魏酰-D-葡萄糖、槲皮素-3-O-芸香糖苷、N-N-二(二羟基咖啡酸)亚精胺己糖苷以及异莨菪亭。8种物质下调,依次是1-萘酚、二氢阿魏酸、绿原酸、对香豆酸-4-O-二己糖苷、2,5-二羟基苯甲醛、α-羟基肉桂酸、苜蓿素-5-O-葡萄糖苷、(二氢咖啡酰)咖啡酰亚精胺。
表1 枸杞酒发酵前后酚类差异代谢物
Table 1 Phenolic substances of L. barbarum wine before and after the fermentation

类别酚类差异代谢物对照组平均相对含量处理组平均相对含量log2_FCP错误发现率VIP上升/下降酚酸1-萘酚98 696 567.6711 582 781.21-3.09 0.000 3 0.000 61.01下降二氢阿魏酸264 142 210.5023 605 998.57-3.480.000 30.000 61.69下降绿原酸 (3-O-咖啡酰奎宁酸)199 222 160.6792 197 202.13-1.110.002 10.002 81.11下降对香豆酸-4-O-葡萄糖苷88 877 772.67263 448 312.931.57<0.000 10.000 11.44上升6-O-阿魏酰-D-葡萄糖75 162 319.17640 083 848.583.09<0.000 1<0.000 12.60上升对香豆酸-4-O-二己糖苷278 411 607.8386 930 422.92-1.680.000 80.001 21.50下降2,5-二羟基苯甲醛114 067 781.6721 148 385.91-2.43<0.000 1<0.000 11.05下降α-羟基肉桂酸104 175 467.2610 715 353.24-3.28<0.000 10.000 11.06下降黄酮槲皮素-3-O-芸香糖苷 (芦丁)60 142 778.38197 839 750.40 1.72 0.000 4 0.000 61.28上升苜蓿素-5-O-葡萄糖苷179 965 982.1965 467 883.59-1.46<0.000 10.000 11.17下降酚酰胺衍生物N-N-二(二羟基咖啡酸)亚精胺己糖苷146 234 575.67 623 343 985.11 2.09<0.000 1<0.000 12.39上升(二氢咖啡酰)咖啡酰亚精胺255 485 941.9461 557 207.00-2.05<0.000 10.000 11.52下降香豆素异莨菪亭13 507 858.00342 882 144.994.67<0.000 1<0.000 11.99上升
注:log2_FC>1表示差异代谢物上调,log2_FC<-1表示差异代谢物下调;错误发现率是通过对差异显著性P值进行校正得到的,log2_FC>1表示差异代谢物上调
VIP>1.5的物质,从大到小排序依次为6-O-阿魏酰-D-葡萄糖、N-N-二(二羟基咖啡酸)亚精胺己糖苷、异莨菪亭、二氢阿魏酸、(二氢咖啡酰)咖啡酰亚精胺、对香豆酸-4-O-二己糖苷。这6种物质中,6-O-阿魏酰-D-葡萄糖对整个模型的贡献率最大,其他物质则依次递减。
为了直观观察发酵前后酚类差异代谢物的浓度变化趋势,依据每个差异代谢物的相对含量做出热图,如图5所示,热图的颜色代表了代谢物在该组样本中相对表达量的大小,颜色由绿到黄再到红代表着代谢物丰度逐渐升高,高低表达交互存在,红色为高表达组分,绿色为低表达组分。依据2组样品进行聚类,可将图5分成2个区域,发酵前样品为第一区域,发酵后的枸杞酒为第二区域。
酚酸具有良好的生物学活性,枸杞中酚酸类化合物,如咖啡酸和绿原酸,可抗病毒、抗肿瘤、抗氧化,阿魏酸有消炎、抗血栓的作用[16];所筛选的差异代谢物中酚酸类物质显著上调的有对香豆酸-4-O-葡萄糖苷、6-O-阿魏酰-D-葡萄糖,显著下调的有1-萘酚、二氢阿魏酸、绿原酸、对香豆酸-4-O-二己糖苷、2,5-二羟基苯甲醛、α-羟基肉桂酸。在枸杞酒发酵过程中酚酸类物质大多呈下调趋势,相关研究表明,一些酵母或细菌可将酚酸类物质脱羧为乙烯基酚,导致酚酸类物质含量下降[17]。其中,对香豆酸-4-O-二己糖苷下调的同时,对香豆酸-4-O-葡萄糖苷上调,推测其侧链二糖基团在发酵过程中分解为单糖基团。

图5 酚类差异代谢物聚类热图
Fig.5 Cluster heat map of phenolic substances
黄酮类物质也广泛存在于自然界的浆果中,枸杞黄酮是众多生理实验中发挥抗氧化、抗衰老、治疗心脑血管疾病等药理活性的主要物质基础,不仅可以抗辐射、抗疲劳、促进免疫力,还能减缓细胞的退化,预防癌症的发生[18-21]。所筛选的差异代谢物中酚酸类物质呈显著上调的是槲皮素-3-O-芸香糖苷(芦丁)。芦丁是一种良好的抗氧化剂,其苷元槲皮素,与绿原酸、山奈酚、异鼠李素是枸杞果实中具有较高抗氧化活性的物质[22],枸杞酒中的芦丁含量增加可能是由于枸杞果实中的前体物质在发酵过程中合成。有研究表明,由于黄酮类物质庞大的糖苷基团,使得其位阻效应起首要作用,削弱或阻碍了苯环3、4位的—OH的作用,使得其抗氧化性降低,但芦丁的糖苷化却对抗氧化性无显著影响[23],故枸杞酒发酵过程芦丁含量增加,或将增加枸杞酒的抗氧化活性;苜蓿素-5-O-葡萄糖苷则呈显著下调,可能是酵母中的β-葡萄糖苷酶使葡萄糖苷部分水解导致。
枸杞中的酚酰胺衍生物除具有抗菌、抗病毒、抗癌等药理作用外,还可通过激活Nrf2/HO-1途径来预防脑I/R损伤,改善氧化损伤和神经细胞凋亡[24]。在表1的代谢物中,N,N-二(二羟基咖啡酸)亚精胺己糖苷呈显著上调,VIP值为2.39,大于呈下调的(二氢咖啡酰)咖啡酰亚精胺,表明其对模型的贡献率较大。(二氢咖啡酰)咖啡酰亚精胺下调伴随着N,N-二(二羟基咖啡酸)亚精胺己糖苷上调,推测二者是前体与产物的关系。另外,有研究报道,酚酰胺衍生物为枸杞果实中苦味物质的重要来源[25-26],或将与枸杞酒中苦味有关,这些都有待进一步研究。
部分香豆素具有抗炎、镇痛以及降低尿酸的作用,枸杞中抑制血管紧张素转化酶活性的主要物质可能为香豆素类化合物[27-29]。实验检测出的异莨菪亭显著上调,或将更加丰富枸杞酒的生理功能。
3 结论
本研究基于UPLC-LTQ-Orbitrap-MS技术,结合自建枸杞酚类物质数据库,鉴定出宁杞1号枸杞中含有酚酸、黄酮、酚酰胺衍生物、香豆素、芪类等5大类物质中的55种酚类物质,通过PCA和OPLS-DA,从代谢组学层面系统分析了宁杞1号枸杞在发酵前后酚类物质的差异。共筛选出13种差异代谢物,通过显著变化的酚类物质分析表明,枸杞发酵过程中,酚类物质的各类变化将赋予枸杞酒更显著的生理活性及风味特征,研究结果为探索酒精发酵对酚类物质的影响及代谢机制提供参考。
[1] 闫欣. 种质和成熟度对枸杞鲜果挥发性物质的影响[D].杨凌:西北农林科技大学, 2021.
YAN X.Effects of germplasm and ripeness on volatile compounds of Lycium barbarum fruits[D].Yangling:Northwest A & F University, 2021.
[2] MANDAL S M, CHAKRABORTY D, DEY S.Phenolic acids act as signaling molecules in plant-microbe symbioses[J].Plant Signaling & Behavior, 2010, 5(4):359-368.
[3] DIAO J X, OU J Y, DAI H, et al.Antioxidant and antiapoptotic polyphenols from green tea extract ameliorate CCl 4-induced acute liver injury in mice[J].Chinese Journal of Integrative Medicine, 2020, 26(10):736-744.
[4] LEONG D J, CHOUDHURY M, HANSTEIN R, et al.Correction to:Green tea polyphenol treatment is chondroprotective, anti-inflammatory and palliative in a mouse posttraumatic osteoarthritis model[J].Arthritis Research&Therapy, 2019, 21(1).DOI:10.1186/s13075-018-1791-9.
[5] MIYATA Y, SHIDA Y, HAKARIYA T, et al.Anti-cancer effects of green tea polyphenols against prostate cancer[J].Molecules (Basel, Switzerland), 2019, 24(1):193.
[6] QI R, LIAN G, YU M M, et al.Study on hypolipidemic and anti-atherosclerosis effects of grapeseed polyphenols[J].Atherosclerosis, 2017, 263:e168.
[7] 韦芳媚. 桑叶提取物、茶多酚及其复配物的抗氧化和降血糖活性[D].广州:华南理工大学, 2019.
WEI F M.Antioxidant and hypoglycemic activities of mulberry leaves extract, tea polyphenols and their compounds[D].Guangzhou:South China University of Technology, 2019.
[8] 于淼, 王长远, 王霞.代谢组学在植物多酚类物质检测分析中的应用[J].食品与发酵工业, 2020, 46(13):280-285.
YU M, WANG C Y, WANG X.Application of metabolomics in detection and analysis of plant polyphenols[J].Food and Fermentation Industries, 2020, 46(13):280-285.
[9] WANG F, CHEN L, CHEN H P, et al.Analysis of flavonoid metabolites in citrus peels (Citrus reticulata “Dahongpao”) using UPLC-ESI-MS/MS[J].Molecules (Basel, Switzerland), 2019, 24(15):2 680-2 692.
[10] ZHAO Y, WU X L, YU L L, et al.Retention of polyphenols in blueberries (Vaccinium corymbosum) after different cooking methods, using UHPLC-DAD-MS based metabolomics[J].Journal of Food Composition and Analysis, 2017, 56:55-66.
[11] 雷嗣超, 张家音, 赵泓涛, 等.基于广泛靶向代谢组学研究板栗皮儿茶素类物质消化前后的组成变化[J].中国果菜, 2021, 41(6):105-111.
LEI S C, ZHANG J Y, ZHAO H T, et al.Composition changes of catechins in chestnut peel before and after digestion based on widely targets metabolomics[J].China Fruit & Vegetable, 2021, 41(6):105-111.
[12] 胡明珍, 刘慧燕, 潘琳, 等.基于非靶向代谢组学分析副干酪乳杆菌发酵枸杞汁各阶段代谢差异[J].食品科学, 2022, 43(8):142-149.
HU M Z, LIU H Y, PAN L, et al.Non-targeted metabolomics analysis of differential metabolite profiles of goji juice fermented by Lactobacillus paracasei[J].Food Science, 2022, 43(8):142-149.
[13] 焦阳. 基于UPLC-QQQ-MS/MS和循环伏安法的猕猴桃疏果多酚鉴定及功能特性研究[D].杨凌:西北农林科技大学, 2019.
JIAO Y.UPLC-QQQ-MS/MS and cyclic voltammetry based phenolic identification in thinned young kiwifruit and its functional characteristic study[D].Yangling:Northwest A&F University, 2019.
[14] 王文琼, 孙志勇, 黄冬成, 等.乳酸菌发酵蓝莓乳清混合体系体外抗氧化特性分析[J].现代食品科技, 2021, 37(1):142-149.
WANG W Q, SUN Z Y, HUANG D C, et al.Antioxidant properties analysis in vitro of lactic acid bacteria fermentation blueberry and whey mixture system[J].Modern Food Science and Technology, 2021, 37(1):142-149.
[15] CEBOLLERO E, CARRASCOSA A V, GONZALEZ R.Evidence for yeast autophagy during simulation of sparkling wine aging:A reappraisal of the mechanism of yeast autolysis in wine[J].Biotechnology Progress, 2005, 21(2):614-616.
[16] 刘少静, 刘萌, 郭秀英, 等.枸杞润肤霜中两种酚酸类成分的高效液相色谱检测及质谱确证[J].分析科学学报, 2016, 32(1):133-136.
LIU S J, LIU M, GUO X Y, et al.Simultaneous determination of two phenolic acids components in wolfberry cream by high performance liquid chromatography and verification by liquid chromatography-tandem mass spectrometry[J].Journal of Analytical Science, 2016, 32(1):133-136.
[17] 张志鹏. 乳酸菌与植物内生菌联合发酵对黑枣多酚及其降血糖活性的影响研究[D].北京:北京林业大学, 2018.
ZHANG Z P.Polyphenol compounds and hypoglycemic effects of Diospyros lotus L.fermented with endophyte and Lactobacillus[D].Beijing:Beijing Forestry University, 2018.
[18] 禄璐, 米佳, 罗青, 等.枸杞总黄酮提取工艺优化及其体外抗氧化活性分析[J].食品工业科技, 2019, 40(24):165-171.
LU L, MI J, LUO Q, et al.Optimization of extraction process of flavonoids from Lycium barbarum L.var.auranticarpum K.F.Ching and its antioxidant activities in vitro[J].Science and Technology of Food Industry, 2019, 40(24):165-171.
[19] ZU M H, SONG H L, ZHANG J B, et al.Lycium barbarum lipid-based edible nanoparticles protect against experimental colitis[J].Colloids and Surfaces B:Biointerfaces, 2020, 187:110747.
[20] WU S H, WANG Y Y, GONG G L, et al.Adsorption and desorption properties of macroporous resins for flavonoids from the extract of Chinese wolfberry (Lycium barbarum L.)[J].Food and Bioproducts Processing, 2015, 93:148-155.
[21] GAO Y J, WEI Y F, WANG Y Q, et al.Lycium barbarum:A traditional Chinese herb and A promising anti-aging agent[J].Aging and Disease, 2017, 8(6):778-791.
[22] ZHANG X F, CHEN J, YANG J L, et al.UPLC-MS/MS analysis for antioxidant components of Lycii fructus based on spectrum-effect relationship[J].Talanta, 2018, 180(1):389-395.
[23] 钱井. 柑橘黄酮类化合物组分鉴定与抗氧化活性研究[D].杭州:浙江大学, 2017.
QIAN J.Determination and antioxidant evaluation of flavonoids compounds from different citrus cultivars[D].Hangzhou:Zhejiang University, 2017.
[24] 李澜芯, 何甜, 石清明, 等.脑缺血再灌注损伤信号通路的研究进展[J].局解手术学杂志, 2021, 30(4):359-362.
LI L X, HE T, SHI Q M, et al.Research progress of signal pathway in cerebral ischemia-reperfusion injury[J].Journal of Regional Anatomy and Operative Surgery, 2021, 30(4):359-362.
[25] GAO K, LIU M Y, DING Y, et al.A phenolic amide (LyA) isolated from the fruits of Lycium barbarum protects against cerebral ischemia-reperfusion injury via PKCε/Nrf2/HO-1 pathway[J].Aging, 2019, 11(24):12 361-12 374.
[26] QIAN D, CHEN J L, LAI C, et al.Dicaffeoyl polyamine derivatives from bitter goji:Contribution to the bitter taste of fruit[J].Fitoterapia, 2020, 143:104543.
[27] KONG L D, ZHOU J, WEN Y L, et al.Aesculin possesses potent hypouricemic action in rodents but is devoid of xanthine oxidase/dehydrogenase inhibitory activity[J].Planta Medica, 2002, 68(2):175-178.
[28] 聂安政, 林志健, 张冰.秦皮化学成分和药理作用研究进展[J].中草药, 2016, 47(18):3 332-3 341.
NIE A Z, LIN Z J, ZHANG B.Advance in studies on chemical constituents of Fraxini Cortex and their pharmacological effects[J].Chinese Traditional and Herbal Drugs, 2016, 47(18):3 332-3 341.
[29] 范彦娜, 赵俊香, 陈琨, 等.枸杞ACE抑制肽成分提取及测定研究[J].中国卫生标准管理, 2016, 7(20):162-164.
FAN Y N, ZHAO J X, CHEN K, et al.Extraction and determination of ACE inhibitory peptide from Chinese wolfberry fruit[J].China Health Standard Management, 2016, 7(20):162-164.