茶叶因其具有独特的口感风味和保健作用,深受消费者喜爱[1]。茶叶的食品安全问题,如重金属超标、农药残留,特别是非法添加香精香料等问题日益引起人们的关注[2-3]。
常用香精香料大都具有怡人的气味。如樟脑有清凉、芳香的气味[4];胡薄荷酮具有薄荷味芳香[5];胡椒酚甲醚和反式茴香脑具有甜味,呈似茴香香气;桉油精,又名1,8-桉叶(油)素,有类樟脑气味[6]。研究表明,樟脑具有毒性,会对人体神经系统、生殖系统等产生危害[7];胡薄荷酮为2B类致癌物[8]。因此,食品中添加香料、香精有严格的限制。中国、美国和欧盟等对在食品中允许使用的香精成分及限量做出了明确规定[9]。我国GB 2760—2014《食品安全国家标准 食品添加剂使用标准》中规定茶叶不得添加香料香精。上述5种香精均为茶叶中可能添加的禁用香精[10-12]。
近几年,茶叶中禁用香精成为研究热点。目前香精香料主要研究方法有高效液相色谱法(high performance liquid chromatography, HPLC)[13]、超高效液相色谱法(ultra performance liquid chromatography, UPLC)[14]和超高效液相色谱-串联质谱法(UPLC-tandem mass spectrometry, UPLC-MS/MS)[15]。梁志森等[11]运用UPLC-MS/MS法检测茶叶中7种香精,香精多为小分子,有些香精分子质量接近流动相,因此检测效果不佳。香精香料成分多具有挥发性,气相色谱法[16]、气相色谱-质谱法(gas chromatography mass spectrometry, GC-MS)[17-18]和气相色谱-串联质谱法(gas chromatography tandem mass spectrometry, GC-MS/MS)[19]相比液相色谱法更适合挥发性物质的定性和定量检测,因此GC-MS和GC-MS/MS在香精香料检测应用较多。陈玉珍等[12]基于气相色谱-四级杆/飞行时间质谱法建立了检测茶叶中10中香料化合物的方法。王玉娇等[10]采用QuEchERS技术结合GC-MS/MS,建立了快速检测茶叶中6种禁用香精成分的方法。梁嘉慧[20]建立了基于全二维气相色谱-飞行时间质谱检测茶叶中香精的高通量筛查方法。上述方法共同特点是需要对茶叶进行前处理,降低基质干扰。但茶叶基质复杂,经过固相萃取或QuEchERS技术对待测物会造成损失,净化后的基质仍存在较多杂质,不仅增加仪器损耗,同时增加基线噪声,降低灵敏度[21]。茶叶中香精香料含量较低,检测灵敏度不足会导致较多假阴性,方法也无法较好应用于本底调查。
静态顶空气进样前处理简单,能减少挥发性物质的损失,也可降低噪声[22]。采用静态顶空气法对茶叶中微量挥发性物质分析,能有效减少复杂基质的干扰,具有定性定量准确度高、特异性强、灵敏度高、稳定性好的优点[23]。香精属于易挥发化合物,静态顶空气法具有测定香精的优势。此外,由于茶叶基质更为复杂,茶叶中挥发性化合物含量低且种类多,而飞行时间质谱法的特异性强、分辨相似化合物能力强,相比于四极杆质谱和串接四极杆质谱能避免样品假阳性。飞行时间质谱结合静态顶空气进样系统能够增加进样量、减少基质干扰,获得更好的检测效果,在茶叶禁用香精检测方面有一定的应用前景。
为开发一种简便、快捷、高灵敏度和高准确性的5种禁用香精检测方法,本研究以市售绿茶及绿茶再制茶为研究对象,基于静态顶空气-气相色谱串接飞行时间质谱同时测定多种禁用香精,以期为绿茶禁用香精的检测和判别提供技术支撑。
1 材料与方法
1.1 材料与试剂
绿茶、花茶样品、绿茶香精,网购;樟脑、胡薄荷酮、胡椒酚甲醚、桉油精、反式茴香脑(≥98%),德国Dr.Ehrenstorfer GmbH公司。
1.2 仪器与设备
7697A-7890B-7200顶空气进样-气相色谱串接飞行时间质谱仪,美国Agilent公司;ME 204分析天平,梅特勒-托利多仪器有限公司。
1.3 实验方法
1.3.1 绿茶样品处理
绿茶经粉碎后立即过60目筛,筛下物密封保存。测定时准确称取筛下物2 g于20 mL顶空瓶中,迅速封盖,待测定。“毛尖1”作为空白绿茶试样。
1.3.2 标准溶液配制
标准储备液:分别称取10 mg樟脑、胡薄荷酮、胡椒酚甲醚、桉油精和反式茴香脑于10 mL容量瓶中,用丙酮混匀并定容,配制成1 000 μg/mL标准储备液。
标准品混合液:量取20 μL樟脑、胡薄荷酮、胡椒酚甲醚、桉油精和反式茴香脑标准储备液于100 mL容量瓶中,用丙酮混匀并定容,配制成0.2 μg/mL标准品混合液。
标准品混合中间液:量取1 mL标准品混合液于10 mL容量瓶中,用丙酮定容并混匀,配制成0.02 μg/mL标准品混合中间液。
基质标准工作曲线配制:在顶空瓶中准确称量空白试样2 g,分别准确移取标准品混合中间液100、50、25 μL,标准品混合液100、50 μL,迅速封盖,室温静置72 h,配制成10、5、2、1、0.5 μg/kg的基质标准工作曲线。
1.3.3 仪器参数条件
顶空进样条件:顶空瓶温度140 ℃;定量环温度150 ℃;传输线温度160 ℃;平衡时间80 min;进样体积1.0 mL;顶空瓶摇晃次数100 次/min。
气相色谱条件:DB-624UI(30 m×0.25 mm×1.4 μm)毛细管色谱柱;载气He,流速1.2 mL/min;进样采用脉冲分流进样,分流比20∶1;进样口温度260 ℃;柱温箱升温程序:40 ℃保持1 min,以5 ℃/min升至120 ℃,20 ℃/min升至260 ℃;传输线温度280 ℃。
质谱条件:检测方式为质量全扫描模式,扫描质量范围m/z 35~600;电离方式为电子轰击离子源(EI源,电子能量70 eV,离子源温度230 ℃)。
1.3.4 定性定量方法
测定的样品与浓度相近的基质标准工作曲线的定性/定量离子比例偏差均≤20%,则定性通过,定性离子和定量离子m/z提取分辨率为20×10-6,各化合物的定性离子和定量离子详见表1。
表1 待测化合物定量离子、定性离子及保留时间
Table 1 Quantitative ion, qualitative ion and retention time of the compounds to be tested
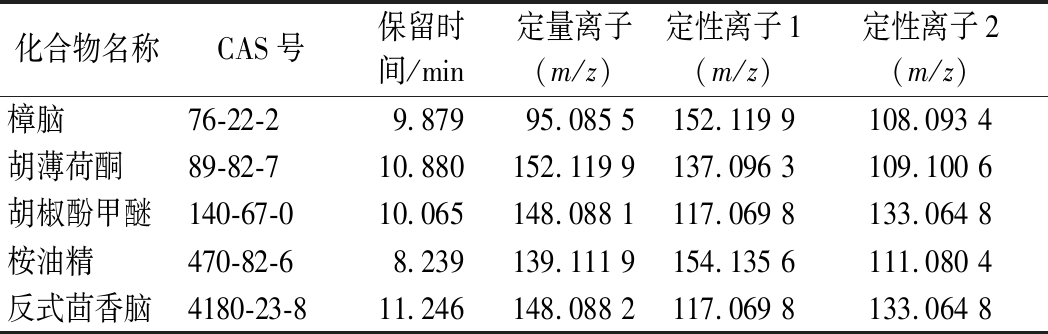
化合物名称CAS号保留时间/min定量离子(m/z)定性离子1(m/z)定性离子2(m/z)樟脑76-22-29.87995.085 5152.119 9108.093 4胡薄荷酮89-82-710.880152.119 9137.096 3109.100 6胡椒酚甲醚140-67-010.065148.088 1117.069 8133.064 8桉油精470-82-68.239139.111 9154.135 6111.080 4反式茴香脑4180-23-811.246148.088 2117.069 8133.064 8
上机测定基质标准工作曲线,以化合物浓度(X,μg/kg)为横坐标,以定量离子丰度Y为纵坐标,绘制标准曲线。分别测定待测液的定量离子丰度,代入标准曲线方程计算得到待测液中的各化合物浓度,外标法定量。
2 结果与分析
2.1 仪器参数的选择
在空白绿茶试样中添加10 μL的樟脑、胡薄荷酮、胡椒酚甲醚、桉油精和反式茴香脑标准储备液,相当于添加质量浓度为5 mg/kg,采用1.3.3仪器参数条件对样品进行采集。自动积分总离子流图并积分识别化合物,扣除化合物附近的基线背景并与NIST数据库比对,对化合物确证。上述5种化合物总离子流图见图1。

图1 五种化合物总离子流图
Fig.1 Total ion current map of five compounds
从图1可以看出,使用DB-624UI色谱柱能够对上述5种化合物做到基线完全分离,保留时间在8~12 min,化合物在色谱柱上分离和保留效果较好。在此基础上选择1个定量离子和2个定性离子,并准确采集m/z。为了降低基线噪声和降低假阳性率,定性离子和定量离子m/z提取分辨率设定为20×10-6。
2.2 顶空加热温度
在顶空瓶中准确称量空白绿茶试样2 g,分别加入10 μL的樟脑、胡薄荷酮、胡椒酚甲醚、桉油精和反式茴香脑标准储备液,迅速封盖,静置72 h,配制成5 mg/kg阳性样品。设定顶空平衡时间30 min,顶空瓶温度分别60、80、100、120、140 ℃进行单因素实验。以顶空瓶温度为横坐标,化合物定量离子相对丰度(以140 ℃对应的丰度为100%)为纵坐标绘制并拟合指数曲线,见图2。
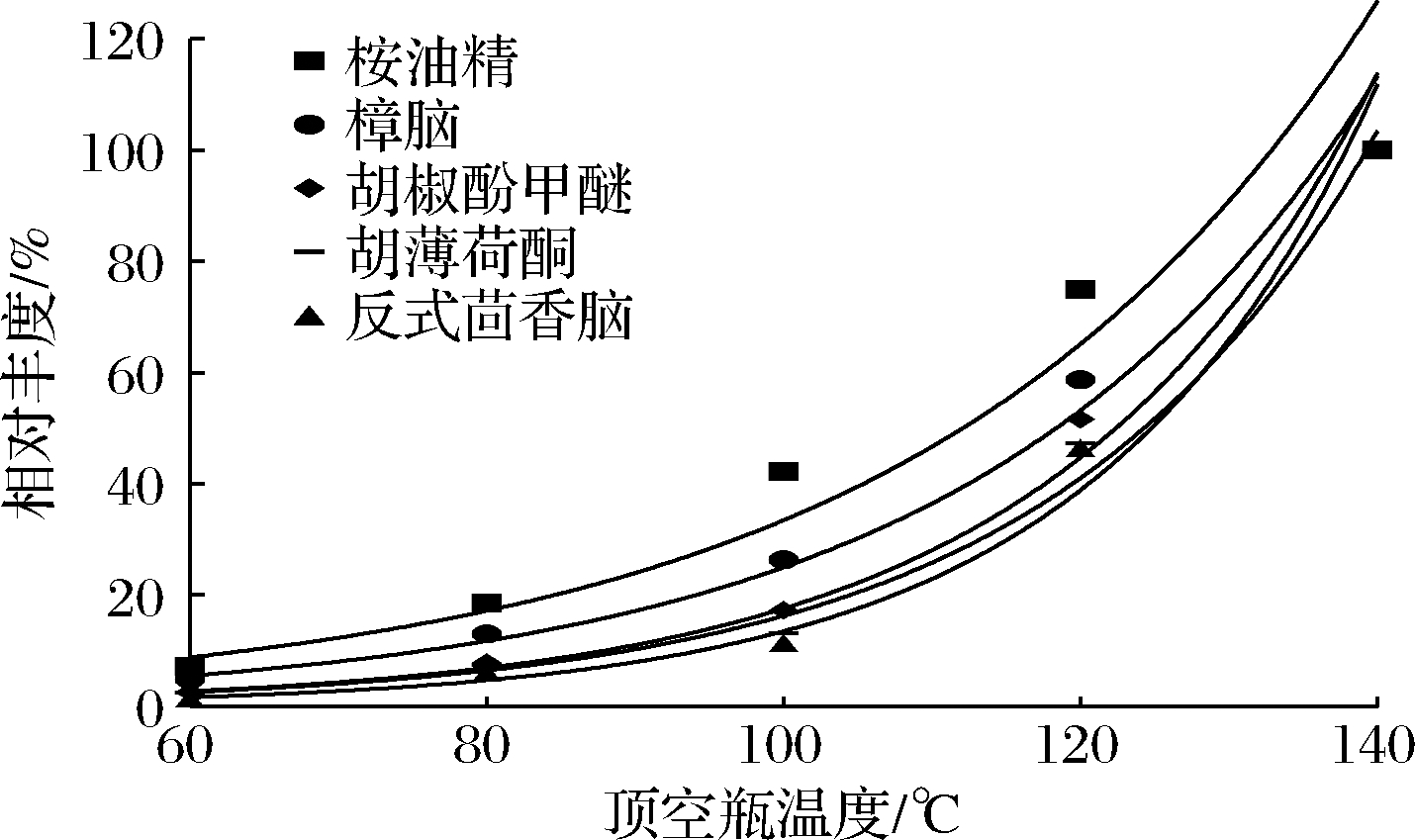
图2 加热温度对待测物相对丰度的影响
Fig.2 Effect of headspace heating temperature on relative abundance of tested compounds
随温度升高,化合物响应变大。樟脑、胡薄荷酮、胡椒酚甲醚和反式茴香脑指数拟合相关系数(r2)>0.9。化合物相对丰度随顶空瓶温度增加呈指数增大趋势,这说明了提高温度能够显著提高顶空气中化合物浓度。但是,顶空瓶温度增加到160 ℃时茶叶严重焦糊,产生烟雾会加速仪器损耗,部分顶空瓶泄露,污染设备。综上所述,选择顶空加热温度140 ℃。
2.3 顶空平衡时间
在顶空瓶中准确称量空白绿茶试样2 g,分别加入10 μL的樟脑、胡薄荷酮、胡椒酚甲醚、桉油精和反式茴香脑标准储备液,迅速封盖,静置72 h,配制成5 mg/kg阳性样品。设定顶空瓶温度140 ℃,顶空平衡时间分别为5、20、40、60、80、100 min进行单因素试验。以顶空平衡时间为横坐标,化合物定量离子相对丰度(以最高响应对应的丰度为100%)为纵坐标绘制并拟合趋势线,见图3。

图3 平衡时间对待测物相对丰度的影响
Fig.3 Effects of headspace equilibrium time on relative abundance of tested compounds
随平衡时间延长,化合物响应先变大后趋于平缓。响应最大值在80 min附近。继续增加平衡温度不能显著提高响应值。相反,如胡椒酚甲醚可能因高温加压导致缓慢泄漏,响应降低。因此本研究中选择的顶空平衡时间为80 min。
2.4 检出限和线性范围
在顶空瓶中准确称量空白绿茶试样2 g,按照1.3.2配制基质标准工作曲线最低点0.5 μg/kg上机测试。以3倍信噪比(S/N)响应时所对应的质量浓度作为检出限。各化合物S/N分别为:樟脑5.1、胡薄荷酮5.6、胡椒酚甲醚15.8、桉油精7.7、反式茴香脑10,详见图4。由此获得方法检出限:樟脑0.3 μg/kg、胡薄荷酮0.3 μg/kg、胡椒酚甲醚0.1 μg/kg、桉油精0.2 μg/kg、反式茴香脑0.2 μg/kg。
按照1.3.2配制基质标准工作曲线,上机测试,进行线性回归。通过标准曲线可知,5种化合物在0.5~10 μg/kg的范围内的线性回归方程分别为樟脑y=811.69x+1 289.3,R2=0.998;胡薄荷酮y=124.76x+33.027,R2=0.999;胡椒酚甲醚y=2 092.7x-559.19,R2=0.999;桉油精y=551.34x+121.71,R2=0.999;反式茴香脑y=364.63x+319.52,R2=0.999;表明具有较好的线性关系。
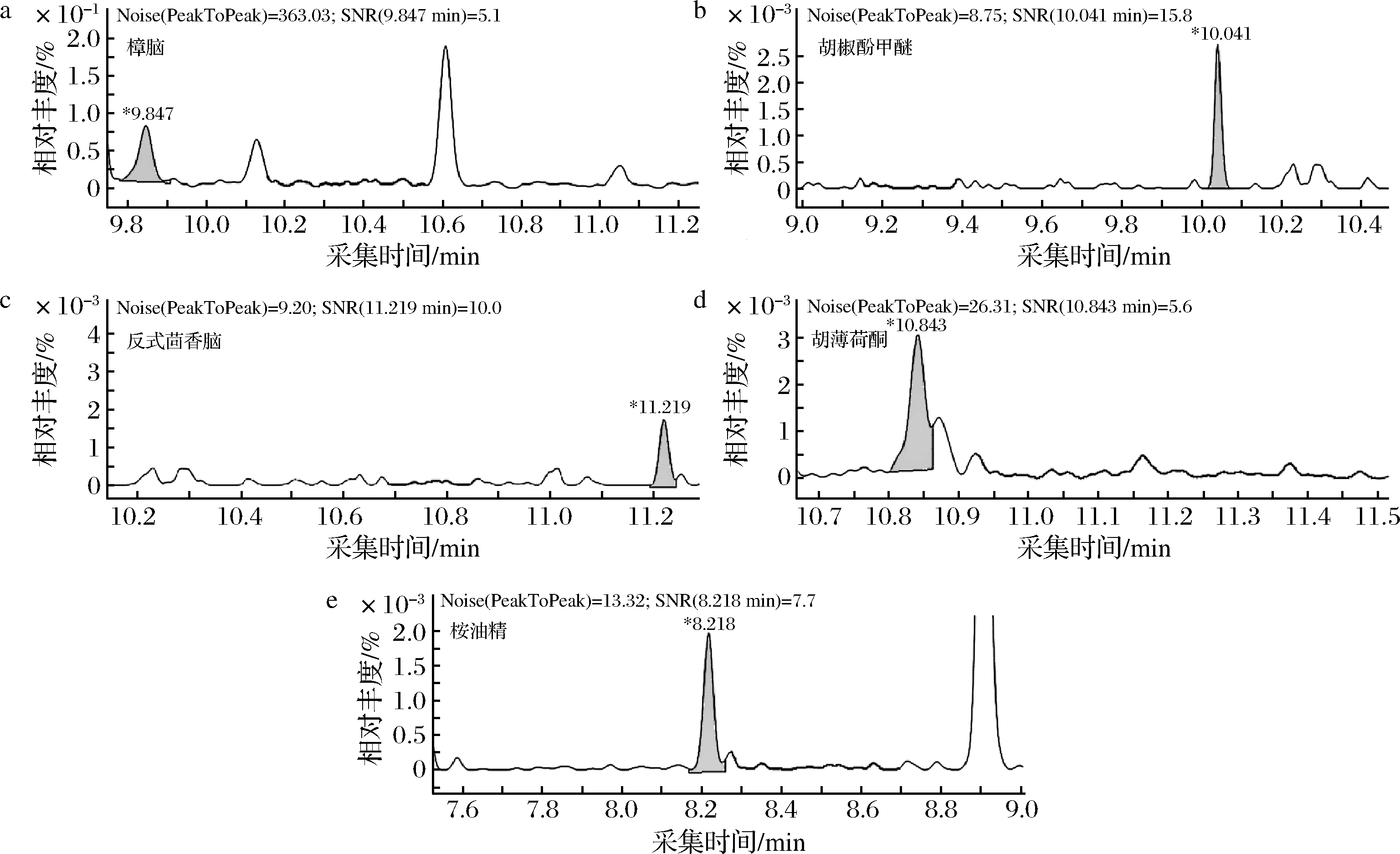
a-樟脑;b-胡椒酚甲醚;c-反式茴香脑;d-胡薄荷酮;e-桉油精
图4 化合物检出限附近的信噪比
Fig.4 Signal to noise ratio near the detection limit of tested compounds
2.5 精密度
在空白绿茶试样中添加5个不同质量浓度(0.5、1.0、2.0、5.0、10.0 μg/kg)的标准溶液进行加标试验,每个添加水平平行测定6次,精密度以相对标准偏差(relative standard deviation,RSD)表示,详见表2。5种化合物总体RSD为0.88%~3.36%,表明该方法精密度良好。
表2 待测化合物的精密度 单位:%
Table 2 Precision of the tested compounds

化合物名称质量浓度/(μg·kg-1)0.5 1.0 2.0 5.0 10.0樟脑3.362.332.263.101.72胡薄荷酮1.401.360.891.142.43胡椒酚甲醚3.052.372.432.261.82桉油精3.122.842.201.521.56反式茴香脑2.292.251.841.630.88
2.6 实际样品测定
采购了市售绿茶及再制茶23批次,其中绿茶13批次(碧螺春2批次、毛尖9批次、抹茶粉2批次),茉莉花茶(绿茶再制茶)10批次。
使用本研究建立的方法测定樟脑、胡薄荷酮、胡椒酚甲醚、桉油精、反式茴香脑。桉油精检出7批次,占比30%,检出率较高说明绿茶及茉莉花茶中可能存在本底。胡椒酚甲醚和樟脑各检出一批次。其中碧螺春1和茉莉花茶3桉油精含量分别为210和330 μg/kg,明显高于其他样品,此外胡椒酚甲醚和樟脑也在茉莉花茶3中检出。说明市售绿茶及茉莉花茶中可能存在禁用香精的使用情况。
3 结论与讨论
研究建立了静态顶空-气相色谱串接飞行时间质谱法测定绿茶中5种禁用香精方法,该法使用挥发性化合物测定柱DB-624UI对化合物分离,优化了顶空加热温度和平衡时间,获得了良好的检测效果。5种化合物在质量浓度0.5~10 μg/kg时具有较好的线性关系,相关系数r2为0.998~0.999。方法检出限:樟脑0.3 μg/kg、胡薄荷酮0.3 μg/kg、胡椒酚甲醚0.1 μg/kg、桉油精0.2 μg/kg、反式茴香脑0.2 μg/kg。相比气相色谱飞行时间质谱法(检出限为30~100 μg/kg)[12]。和液相色谱质谱法(检出限为20~30 μg/kg)[11]。5种禁用香精的检出限在0.1~0.3 μg/kg,灵敏度提高了2个数量级。与液体进样相比,顶空进样体积大、基质干扰物较少,因此检测灵敏度高。此外,样品不需要经过提取和净化,节省了前处理耗材、提取溶剂等消耗,操作简便,成本低,同时也降低了仪器的维修保养频次。该方法RSD为0.88%~3.36%,表明其精密度良好。测量不确定度主要来自样品称样质量和仪器本身误差,不确定度来源较少,方法容易再现。
研究检测了市售绿茶及茉莉花茶23批次,测定樟脑、胡薄荷酮、胡椒酚甲醚、桉油精、反式茴香脑。桉油精检出7批次,胡椒酚甲醚和樟脑各检出1批次。其中碧螺春1和茉莉花茶3桉油精含量分别为210和330 μg/kg,明显高于其他样品,此外胡椒酚甲醚和樟脑也在茉莉花茶3中检出。说明了市售绿茶及茉莉花茶中可能存在禁用香精的使用情况。桉油精检出7批次,占比30%,绿茶及茉莉花茶中可能存在本底。因此,判断风味化合物是否为茶叶中禁用香精,本底调查尤为重要。
市售绿茶及茉莉花茶中桉油精检出7批次,其中5批次小于20 μg/kg;胡椒酚甲醚和樟脑各检出1批次,均小于20 μg/kg。这些化合物在本次检测的茶样中含量低,采用气相色谱飞行时间质谱法和液相色谱质谱法均较难检出。因此,基于静态顶空-气相色谱串接飞行时间质谱法测定茶叶禁用香精,检测的灵敏度高,更适合绿茶禁用香精的本底调查。
[1] 欧阳凌, 廖翼, 梁景普.我国茶叶产业国际竞争力与提升对策分析[J].湖南农业科学, 2020(4):76-79.
OUYANG L, LIAO Y, LIANG J P.Analysis on international competitiveness of China’s tea industry and its development countermeasures[J].Hunan Agricultural Sciences, 2020(4):76-79.
[2] 姚奋增, 高海荣, 刘晨, 等.茶叶中铝、铅、砷、汞、铬、镉含量的分析及危害评价[J].食品安全质量检测学报, 2021, 12(1):291-297.
YAO F Z, GAO H R, LIU C, et al.Analysis and hazard evaluation of aluminium, lead, arsenic, mercury, chromium and cadmium content in tea[J].Journal of Food Safety & Quality, 2021, 12(1):291-297.
[3] 吴梅, 黎小椿, 罗杨合.茶叶农药残留与常用检测方法[J].食品工业, 2021, 42(6):347-352.
WU M, LI X C, LUO Y H.Pesticide residues in tea and common detection methods[J].The Food Industry, 2021, 42(6):347-352.
[4] 熊颖, 吴雪茹, 涂兴明, 等.樟脑的药学研究进展[J].检验医学与临床, 2009, 6(12):999-1 001.
XIONG Y, WU X R, TU X M, et al.Advances in pharmaceutical research of camphor[J].Laboratory Medicine and Clinic, 2009, 6(12):999-1 001.
[5] 解宇环, 郭沛鑫, 缪飞, 等.胡薄荷酮对急性炎症动物模型影响的实验研究[J].时珍国医国药, 2013, 24(6):1 344-1 346.
XIE Y H, GUO P X, MIU F.et al.Research on effects of pulegone to the acute inflammation animal models[J].Lishizhen Medicine and Materia Medica Research, 2013, 24(6):1 344-1 346.
[6] 侯明槠, 常聪, 陈林霖, 等.桉油精的药理作用研究进展[J].中国现代应用药学, 2021, 38(16):2 023-2 032.
HOU M Z, CHANG C, CHEN L L, et al.Research progress in pharmacological effects of 1, 8-cineole[J].Chinese Journal of Modern Applied Pharmacy, 2021, 38(16):2 023-2 032.
[7] 丁元刚, 马红梅, 张伯礼.樟脑药理毒理研究回顾及安全性研究展望[J].中国药物警戒, 2012, 9(1):38-42.
DING Y G, MA H M, ZHANG B L.Research on pharmacology, toxicology and safety of camphor:Review and prospect[J].Chinese Journal of Pharmacovigilance, 2012, 9(1):38-42.
[8] 国家药品监督管理局. 世界卫生组织国际癌症研究机构致癌物清单[EB/OL].[2017-10-30].https://www.nmpa.gov.cn/xxgk/mtbd/20171030163101383.html.[2021-03-25].
National Medical Products Administration.World Health Organization International Agency for Research on Cancer (IARC) List of Carcinogens[EB/OL].[2017-10-30].https://www.nmpa.gov.cn/xxgk/mtbd/20171030163101383.html.[2021-03-25].
[9] EFSA.Compendium of botanicals reported to contain naturally occuring substances of possible concern for human health when used in food and food supplements[J].EFSA Journal, 2012, 10(5):2663.
[10] 王玉娇, 刘通, 邓亚美, 等.QuEChERS-气相色谱-串联质谱法快速检测茶叶中6种禁用香精成分[J].色谱, 2019, 37(7):766-772.
WANG Y J, LIU T, DENG Y M, et al.Rapid determination of six banned fragrance components in tea by QuEChERS-gas chromatography-tandem mass spectrometry[J].Chinese Journal of Chromatography, 2019, 37(7):766-772.
[11] 梁志森, 陈玉珍, 周朗君.超高效液相色谱—串联质谱法快速同时检测茶叶中7种香料[J].食品与机械, 2020, 36(11):51-57.
LIANG Z S, CHEN Y Z, ZHOU L J.An UHPLC-MS/MS method for rapid analysis of tea for the potential presence of illegally added flavorings[J].Food & Machinery, 2020, 36(11):51-57.
[12] 陈玉珍, 梁志森, 曾广丰, 等.气相色谱-四极杆/飞行时间质谱法同时测定茶叶中10种香料化合物[J].食品安全质量检测学报, 2021, 12(23):9 043-9 049.
CHEN Y Z, LIANG Z S, ZENG G F, et al.Simultaneous determination of 10 kinds of fragrance compounds in tea by gas chromatography-high resolution quadrupole time-of-flight mass spectrometry[J].Journal of Food Safety & Quality, 2021, 12(23):9 043-9 049.
[13] MA Y J, BI A Q, WANG X Y, et al.Dispersive solid-phase extraction and dispersive liquid-liquid microextraction for the determination of flavor enhancers in ready-to-eat seafood by HPLC-PDA[J].Food Chemistry, 2020, 309:125753.
[14] CAO C M, LIU W, BABAJANIAN S, et al.Development and validation of a UPLC-DAD method for quantitative analysis of coumarin, trans-cinnamic acid, trans-cinnamaldehyde, and eugenol in encapsulated cinnamon flavoring powder[J].Journal of AOAC INTERNATIONAL, 2020, 103(5):1 394-1 399.
[15] 许博舟, 许秀丽, 国伟, 等.高效液相色谱-串联质谱法同时测定饮料中8种香豆素类化合物[J].食品安全质量检测学报, 2021, 12(19):7 578-7 584.
XU B Z, XU X L, GUO W, et al.Simultaneous determination of 8 kinds of coumarins in beverage by high performance liquid chromatography-tandem mass spectrometry[J].Journal of Food Safety & Quality, 2021, 12(19):7 578-7 584.
[16] 陈骁勇, 葛玉松, 支荣荣.GC法测定三香散中桂皮醛、反式茴香脑含量[J].中国当代医药, 2020, 27(36):33-36.
CHEN X Y, GE Y S, ZHI R R.Determination of cinnamaldehyde and trans-anethole in Sanxiang Powder by GC method[J].China Modern Medicine, 2020, 27(36):33-36.
[17] 谭丽容, 程敏, 林伟斌.气相色谱-质谱法检测薄荷香精中的限用物质反-2-己烯醛、α-己基肉桂醛、香豆素的研究[J].食品安全质量检测学报, 2018, 9(15):4 119-4 124.
TAN L R, CHENG M, LIN W B.Determination of trans-2-hexenal, α-hexylcinnamaldehyde and coumarin in peppermint flavor by gas chromatography-mass spectrometry[J].Journal of Food Safety & Quality, 2018, 9(15):4 119-4 124.
[18] AFIFI S M, EL-MAHIS A, HEISS A G, et al.Gas chromatography-mass spectrometry-based classification of 12 fennel (Foeniculum vulgare miller) varieties based on their aroma profiles and estragole levels as analyzed using chemometric tools[J].ACS Omega, 2021, 6(8):5 775-5 785.
[19] 司晓喜, 向本富, 蒋薇, 等.加热卷烟气溶胶中香气成分的GC-MS/MS同时测定和比较[J].食品与机械, 2021, 37(6):86-96.
SI X X, XIANG B F, JIANG W, et al.Determination and comparison of aroma components in different heated cigarette aerosols by GC-MS/MS[J].Food & Machinery, 2021, 37(6):86-96.
[20] 梁嘉慧. 茶叶中香精高通量筛查及精准鉴定方法研究[D].长沙:湖南师范大学, 2017.
LIANG J H.Study on the high-throughput screening and accurate identification methods of flavor additives in tea[D].Changsha:Hunan Normal University, 2017.
[21] 官金艳, 董军, 韩艳云, 等.茶叶中农药多残留测定的样品前处理方法综述[J].湖北农业科学, 2020, 59(S1):20-27.
GUAN J Y, DONG J, HAN Y Y, et al.Summary of sample pretreatment for determination of pesticide residues in tea[J].Hubei Agricultural Sciences, 2020, 59(S1):20-27.
[22] 周玮婧, 江小明, 王澍.静态顶空与顶空固相微萃取-气相色谱法测定食用油中正己醛含量比较[J].食品工业科技, 2016, 37(19):311-313;319.
ZHOU W J, JIANG X M, WANG S.Comparison of determination of hexanal in edible oils by static headspace and headspace- SPME method[J].Science and Technology of Food Industry, 2016, 37(19):311-313;319.
[23] 谭鹏, 周永峰, 黄浩洲, 等.基于顶空-固相微萃取-气相色谱-三重四极杆质谱联用的诃子挥发性成分分析[J].中草药, 2021, 52(11):3 398-3 407.
TAN P, ZHOU Y F, HUANG H Z, et al.Analysis of volatile compounds in Chebulae Fructus based on head space-solid phase microextraction-gas chromatography-triple quadrupole mass spectrometry[J].Chinese Traditional and Herbal Drugs, 2021, 52(11):3 398-3 407.