作为重要的平台化合物,2,3-丁二醇(2,3-butanediol,2,3-BD)的应用遍及航空航天、食品、医药、化工和燃料等领域[1]。1906年HARDEN等[2]首次发现了2,3-BD在微生物中的积累,但随后由于化石基燃料的大量应用,生物法合成2,3-BD逐步被化学法所替代[3]。然而化学法存在工艺繁琐、不易操作、原材料昂贵等诸多弊端,生物法以可再生资源为发酵原料,具有环境友好、低碳排放和绿色环保等优点[4]。近年来,伴随着石油资源紧缺、化石燃料价格上涨以及环境恶化等问题的不断加剧,生物法合成2,3-BD重新受到广泛关注[5]。
目前2,3-BD的生产菌株主要以克雷伯氏菌为主,生产菌株种类偏少,并且克雷伯氏菌是条件致病菌,严重限制了2,3-BD的开发利用[6]。霍氏肠杆菌具有可利用多种碳源、生长速度快等优点,且在底物利用等特性上均与克雷伯氏菌类似,然而截至目前并未见相关报道[7]。本研究以筛选获得的霍氏肠杆菌为宿主,通过发酵工艺优化,以期得到高产2,3-BD的菌株,为后续相关研究奠定坚实的基础。
1 材料与方法
1.1 实验菌株
本研究所采用的菌株为霍氏肠杆菌,来源于土壤(江苏,无锡),被命名为WM11,16S rRNA序列已上传至NCBI,编号为OL636379.1。
1.2 试剂和主要仪器
氨水,上海泰坦科技股份有限公司;非离子型T-F复合型发酵用消泡剂,上海生工生物工程有限公司;玉米芯水解糖液,易高环保投资集团。除上述外,本研究其它试剂均购自国药集团化学试剂有限公司。
UV-1800分光光度计,上海翱艺仪器有限公司;QWZY-C3组合式摇床,太仓市强文实验设备有限公司;ZQZY-CT振荡培养箱,上海知楚仪器有限公司;GT80T高温高压灭菌锅,致徽仪器有限公司;T&J-AType 5 L发酵罐,迪必尔生物工程有限公司;1260Ⅱ高效液相色谱仪,美国安捷伦科技有限公司;TSQ-8000型E重四极杆气质联用仪,赛默飞世尔(中国)有限公司。
1.3 培养基
平板及斜面保藏固体培养基(g/L):胰蛋白胨10,酵母膏5,NaCl 10,琼脂粉20,pH 7.0。
种子富集培养基(g/L):胰蛋白胨10,酵母膏5,NaCl 10,pH 7.0。
发酵培养基
SOC培养基(g/L):Na2HPO4 6.78,KH2PO4 3,NaCl 0.5,NH4Cl 1,MgSO4 2 mmol/L,CaCl2 0.1 mmol/L,pH自然;
SOB培养基(g/L):胰蛋白胨20,酵母膏5,MgCl2·6H2O 2.03,NaCl 0.5,KCl 0.186,pH自然;
TB培养基(g/L):胰蛋白胨12,酵母膏24,KH2PO4 2.31,K2HPO4·H2O 16.43,pH自然;
LB培养基(g/L):胰蛋白胨10,酵母膏5,NaCl 10,pH自然。
上述培养基均121 ℃灭菌20 min。
1.4 培养条件
摇瓶:装液量50 mL,温度37 ℃,转速250 r/min。发酵需添加初始糖时,葡萄糖和玉米芯水解液均额外添加至发酵培养基中,接种量为2%(体积分数,下同)。
5 L发酵罐:装液量2 L,温度30 ℃,通气量1 vvm,接种量为5%,发酵过程中用纯氨水调节罐内pH使其保持在7.0~7.2。消泡剂为非离子型T-F复合型发酵用消泡剂。
1.5 实验方法
1.5.1 菌株筛选
初筛:将采集到的土壤样品于种子富集培养基中培养12 h,取不同稀释度菌液涂布平板。大量挑取单菌落发酵培养,48 h后离心取上清液置于酶标板中进行乙偶姻显色反应。将显红色的阳性菌株保藏复筛备用。
复筛:从斜面上挑取菌株接种到富集培养基中,培养至对数期,按2%接种量接入含4 g/L葡萄糖的SOB发酵培养基中振荡培养48 h。收集发酵液,离心取上清液用于HPLC检测。
1.5.2 2,3-BD定性和定量
定性:将发酵上清液用乙酸乙酯萃取,再用Na2SO4吸干萃取液中剩余水分后抽滤、氮吹。干燥后加入硅烷化试剂再次氮吹,用正己烷复溶用于GC-MS鉴定。
定量:取发酵液12 500 r/min离心,上清液用0.22 μm的水系滤膜过滤用于HPLC检测。
1.5.3 菌株鉴定
16S rRNA测序由天霖生物科技有限公司完成,结果在NCBI数据库中与已有序列进行比较分析,并使用MEGA7.0绘制进化树。
1.5.4 摇瓶及补料分批发酵
摇瓶发酵:菌株平板划线分离,挑取单菌落接入LB液体培养基中连续传代2次,最后按2%接种量摇瓶发酵。
补料分批发酵:发酵罐空消后加入液体培养基,插入溶氧及pH电极,密封发酵罐,115 ℃灭菌30 min。使用火焰接种法接种上罐,打开搅拌待稳定后开启pH及消泡自控。
1.6 分析方法
乙偶姻在碱性含α-萘酚环境中能与胍基化合物快速反应生成红色物质,将发酵上清液和显色剂按体积比1∶2添加进行显色测定[8]。细胞密度通过紫外可见分光光度计进行测定,波长为600 nm。发酵液各成分含量使用液相检测,液相检测条件:Aminex HPX-87H(300 mm×7.8 mm)柱,参考ZHAO等[9]的方法检测。产物定性使用GC-MS检测,GC-MS检测条件:色谱柱SP-5,参考孙兴云等[10]的方法检测。
2 结果与分析
2.1 菌株筛选及产物鉴定
初筛以采集的样品土壤为菌源,从其制备的平板中挑选出823个单菌落进行发酵。发酵结束后,收集样品进行乙偶姻显色反应,得到78个备选菌株,部分显色反应结果如图1-a所示。对其进行复筛,通过HPLC检测,发现编号WM11菌株产量最高。2,3-BD积累量在48 h达到1.12 g/L(图1-b),该产量是丁昊等[11]筛选出的酿酒酵母2,3-BD积累量的5倍。

a-菌株显色反应;b-菌株2,3-BD产量及摩色转化率
图1 产2,3-BD菌株的筛选
Fig.1 Screening of 2,3-BD-producing strains
对其发酵上清液进行GC-MS测定,结果如图2所示,发酵液样品的出峰时间和特征离子(m/z 73.1、m/z 117.1、m/z 147.1)与2,3-BD标样皆相同[10]。由此可以断定,WM11确实可以用于2,3-BD的生产。此外,在发酵液样品中还检测到乳酸、乙酸等副产物,这为后期的发酵优化指明了方向。
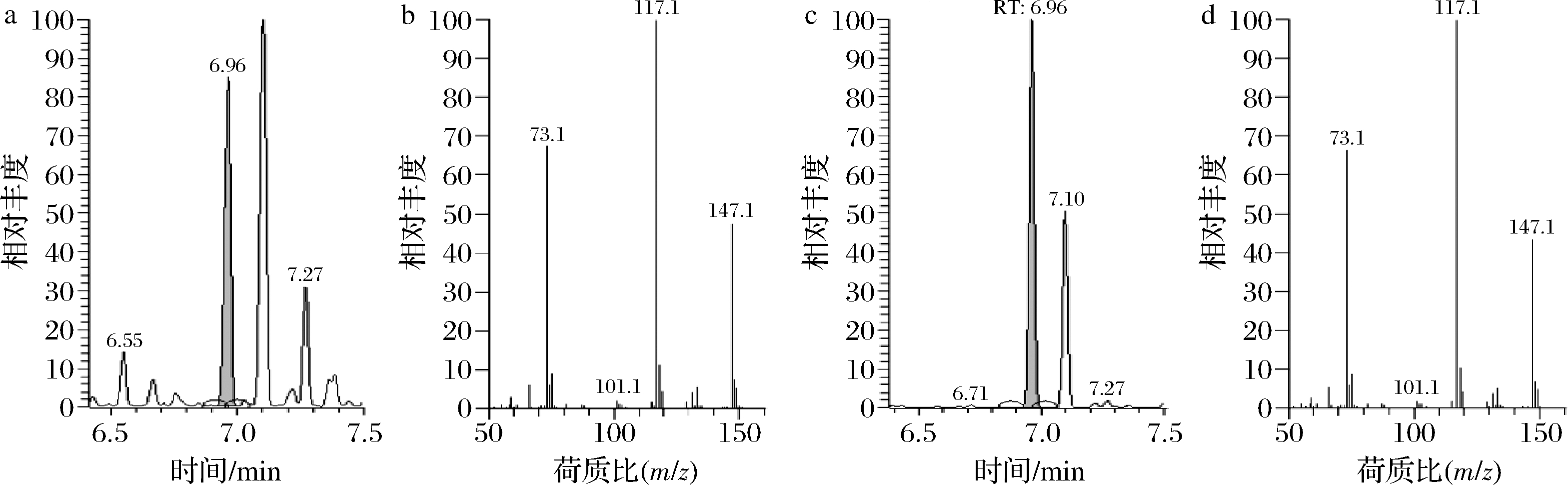
a-发酵液气相图谱;b-发酵液质谱图;c-2,3-BD标样气相图谱;d-2,3-BD标样质谱图
图2 GC-MS结果
Fig.2 Results of GC-MS
2.2 菌株的鉴定
在上述基础上对菌株WM11进行鉴定,通过比对16S rRNA序列,发现研究菌株和霍氏肠杆菌(Enterobacter hormaechei)相似性达到了99.79%。通过MEGA7.0绘制了研究菌株的16S rRNA序列系统发育树,结果如图3所示,WM11菌株与E.hormaechei subsp. xiangfangensis strain OSUKPC4-L亲缘关系更近,因此将其命名为E.hormaechei WM11。

图3 WM11菌株的16S rRNA序列系统发育树
Fig.3 Phylogenetic tree of 16S rRNA sequences of WM11
2.3 摇瓶发酵实验
获得WM11菌株后,首先在摇瓶水平优化了发酵产2,3-BD的最佳培养基。本实验选取了SOB、SOC、TB和LB培养基进行研究,初始糖质量浓度4 g/L,发酵结果如图4所示。初始糖浓度相同的情况下,TB培养基中菌体的生长密度和产量远远高于其他培养基。菌体最高OD600为14.02,48 h时2,3-BD积累量最高为1.23 g/L,实际产率为0.3。TB培养基中2,3-BD积累量最高主要与其营养成分丰富有关,在4种培养基中,其含有的酵母粉、蛋白胨和K+含量均最高[12]。其中酵母粉和蛋白胨富含氨基酸和微量元素,能够促进2,3-BD合成[13],而K+具有维持细胞新陈代谢、调节渗透压、保持酸碱平衡的作用,从而使菌体能大量积累2,3-BD[14]。综合以上因素,后续的实验均采用TB培养基为发酵培养基。

a-生长曲线;b-2,3-BD浓度
图4 摇瓶发酵结果
Fig.4 Results of shake flask fermentation
2.4 葡萄糖为碳源5L上罐发酵
2.4.1 分批发酵实验
根据摇瓶发酵结果,以TB为发酵培养基分批上罐,发酵结果如图5所示。菌体稳定期OD600达到28,是摇瓶2倍,表明5 L罐条件更有利于菌体生长。发酵11 h时2,3-BD产量最高,但仅有0.8 g/L,分析原因是该发酵条件下碳源主要用于菌体生长或副产物的合成。乙酸作为主要的发酵副产物,在发酵前期迅速积累,最高达到9 g/L,后随碳源缺乏逐渐降低。2,3-BD产量在乙酸积累量降低时逐渐升高,乙酸耗尽时达到最高。表明乙酸的合成利用了大量碳源,抑制了2,3-BD的合成,即使发酵后期菌体可利用乙酸,但产生的能量都被用于维持菌体生长,而不是2,3-BD的合成[15]。因此,提高碳源浓度和抑制乙酸合成是提高2,3-BD产量的主要策略。

a-产量和底物浓度;b-菌株的生长情况及发酵液溶氧
图5 分批上罐结果
Fig.5 Results of batching on the tank
2.4.2 补料分批实验
根据分批发酵结果,上罐为提高碳源的供给,采用补料分批的方式发酵。针对乙酸积累过快的问题,菌体生长阶段选择通过降低搅拌以降低菌体的比生长速率来控制乙酸的积累[16]。同时在菌体产2,3-BD期间通过加大葡萄糖的供给、增大搅拌转速来加快2,3-BD的产出速率。最后为了弥补发酵中后期C/N失衡,选择补加氮源来维持C/N的平衡,发酵结果如图6所示。补料分批上罐最高OD600为33,2,3-BD在72 h的积累量达到了65.23 g/L,是分批上罐产量的81.5倍,糖醇转化率达到了41%,并且发酵过程中副产物积累量始终保持在相对较低的水平。

a-产量和底物浓度;b-菌株生长情况及发酵液溶氧
图6 葡萄糖补料分批发酵结果
Fig.6 Fermentation results of glucose supplement batch
2.5 玉米芯水解液为碳源5L上罐发酵
玉米芯水解液(corn cob hydrolysate,CCH)原料廉价易得,是一种绿色可持续的“负碳”原料。CHH由葡萄糖、木糖和乙酸等物质组成,其中木糖是木质纤维素的水解产物,乙酸是由半纤维素中的乙酰基脱水形成的[17-18]。如前文所述,乙酸渗透到细胞膜后可以减少细胞内的质子梯度,解除质子动力的耦合,从而抑制ATP合成和细胞的生长,与SUO等[19]的研究结果一致。
结合上述情况,进行了CCH补料分批发酵。为了控制乙酸的积累,结合葡萄糖补料分批的发酵经验,采用两阶段补料策略进行发酵[20]。在8~24 h内,首先用低浓度的CCH以22 mL/h的速度流加补料,然后用高浓度的葡萄糖以20 mL/h的速度流加。在8~24 h内,糖主要用于细胞生长,因此补加低浓度的CCH,但在这之后,流加高浓度的CCH,主要用于生产2,3-BD。如图7所示,在两阶段的补料策略下,2,3-BD的产量达到42.92 g/L,乙酸含量12.57 g/L,生产强度0.60 g/(L·h)。结果表明,在细胞生长阶段降低糖的浓度(即CCH)足以支持细胞生长,并减少了最终的乙酸积累。最重要的是,两阶段补料策略可以将细胞生长和2,3-BD生产分为两个阶段,从而合理地补加不同阶段所需碳源,这不仅能节约资源,而且也为其他木质纤维素原料的规模化发酵利用提供了借鉴。

a-产量和底物浓度;b-菌株的生长情况及发酵液溶氧
图7 玉米芯水解液补料分批发酵结果
Fig.7 Fermentation results of corn cob hydrolysate supplementation batch
3 结论
研究从自然环境中筛选获得了一株生产2,3-BD的野生型霍氏肠杆菌。首先通过摇瓶优化确认了最佳的发酵培养基,其次在发酵罐中进行发酵条件优化,菌株最终积累了65.23 g/L的2,3-BD。考虑到原料环保、2,3-BD的工业化和底物种类等因素,本研究又采用玉米芯水解液为碳源发酵生产2,3-BD,其产量在72 h达到42.92 g/L。本研究所使用的菌种是未经过基因改造的野生型霍氏肠杆菌,该菌种自带2,3-BD合成途径。倘若后续对其进行基因改造,例如抑制2,3-丁二醇脱氢酶基因催化2,3-BD合成乙偶姻的反应;敲除乙酸、乳酸等副产物的合成途径;以及增强目标途径中的α-乙酰乳酸脱羧酶、α-乙酰乳酸合成酶和2,3-丁二醇脱氢酶基因的表达,2,3-BD产量将会得以进一步提升。
[1] PRIYA A, LAL B.Efficient valorization of waste glycerol to 2, 3-butanediol using Enterobacter cloacae TERI BD 18 as a biocatalyst[J].Fuel, 2019, 250:292-305.
[2] HARDEN A, WALPOLE G S. Chemical action of Bacillus lactis aerogenes (Escherich) on glucose and mannitol: Production of 2,3-butylenglycol and acetylmethylcarbinol[J]. Proceedings of the Royal Society of London Series A-Containing Papers of Amathematical and Physical, 1906, 77(B): 399-405.
[3] ZENG A P, SABRA W.Microbial production of diols as platform chemicals:Recent progresses[J].Current Opinion in Biotechnology, 2011, 22(6):749-757.
[4] LI L X, LI K, WANG Y, et al.Metabolic engineering of Enterobacter cloacae for high-yield production of enantiopure (2R, 3R)-2, 3-butanediol from lignocellulose-derived sugars[J].Metabolic Engineering, 2015, 28:19-27.
[5] JI X J, HUANG H, OUYANG P K.Microbial 2, 3-butanediol production:A state-of-the-art review[J].Biotechnology Advances, 2011, 29(3):351-364.
[6] ERIAN A M, GIBISCH M, PFLÜGL S.Engineered E.coli W enables efficient 2, 3-butanediol production from glucose and sugar beet molasses using defined minimal medium as economic basis[J].Microbial Cell Factories, 2018, 17(1):190.
[7] DAI J J, CHENG J S, LIANG Y Q, et al.Regulation of extracellular oxidoreduction potential enhanced (R, R)-2, 3-butanediol production by Paenibacillus polymyxa CJX518[J].Bioresource Technology, 2014, 167:433-440.
[8] 范宜晓, 赵祥颖, 张家祥, 等.产3-羟基丁酮菌株的筛选及产物分析[J].食品与发酵工业, 2012, 38(11):42-46.
FAN Y X, ZHAO X Y, ZHANG J X, et al.The screening of acetoin-producing strain and identification of metabolite[J].Food and Fermentation Industries, 2012, 38(11):42-46.
[9] ZHAO M, HUANG D X, ZHANG X J, et al.Metabolic engineering of Escherichia coli for producing adipic acid through the reverse adipate-degradation pathway[J].Metabolic Engineering, 2018, 47:254-262.
[10] 孙兴云, 郑璞, 刘海丽, 等.气质联用法测定发酵液中二氢茉莉酮酸[J].分析试验室, 2019, 38(10):1 209-1 213.
SUN X Y, ZHENG P, LIU H L, et al.Determination of dihydrojasmonicacid in fermentation broth by gas chromatography-mass spectrometry[J].Chinese Journal of Analysis Laboratory, 2019, 38(10):1 209-1 213.
[11] 丁昊, 刘文娟, 孙健, 等.高产2, 3-丁二醇的潜在酿酒酵母菌株筛选[J].中国农学通报, 2020, 36(24):107-115.
DING H, LIU W J, SUN J, et al.Potential Saccharomyces cerevisiae strains of producing 2, 3-butanediol:Screening[J].Chinese Agricultural Science Bulletin, 2020, 36(24):107-115.
[12] HORI C, YAMAZAKI T, RIBORDY G, et al.High-cell density culture of poly(lactate-co-3-hydroxybutyrate)-producing Escherichia coli by using glucose/xylose-switching fed-batch jar fermentation[J].Journal of Bioscience and Bioengineering, 2019, 127(6):721-725.
[13] BEVILACQUA R, REGUEIRA A, MAURICIO-IGLESIAS M, et al.Understanding the effect of trace elements supplementation on volatile fatty acids production from proteins[J].Journal of Environmental Chemical Engineering, 2021, 9(5):105934.
[14] 刘建民. 工业酒精酵母活力检测方法的应用评价及高活力培养[D].无锡:江南大学, 2009.
LIU J M.Establishment of evaluation system for vitality test of industrial yeast strains for ethanol fermentation and its application in high vitality culture[D].Wuxi:Jiangnan University, 2009.
[15] EITEMAN M A, ALTMAN E.Overcoming acetate in Escherichia coli recombinant protein fermentations[J].Trends in Biotechnology, 2006, 24(11):530-536.
[16] KANCHANARACH W, THEERAGOOL G, INOUE T, et al.Acetic acid fermentation of Acetobacter pasteurianus:Relationship between acetic acid resistance and pellicle polysaccharide formation[J].Bioscience, Biotechnology, and Biochemistry, 2010, 74(8):1 591-1 597.
[17] KUMAR V, KRISHANIA M, PREET SANDHU P, et al.Efficient detoxification of corn cob hydrolysate with ion-exchange resins for enhanced xylitol production by Candida tropicalis MTCC 6192[J].Bioresource Technology, 2018, 251:416-419.
[18] JÖNSSON L J, ALRIKSSON B, NILVEBRANT N O.Bioconversion of lignocellulose:Inhibitors and detoxification[J].Biotechnology for Biofuels, 2013, 6(1):16.
[19] SUO Y K, LIAO Z P, QU C Y, et al.Metabolic engineering of Clostridium tyrobutyricum for enhanced butyric acid production from undetoxified corncob acid hydrolysate[J].Bioresource Technology, 2019, 271:266-273.
[20] HAO Y N, MA Q, LIU X Q, et al.High-yield production of L-valine in engineered Escherichia coli by a novel two-stage fermentation[J].Metabolic Engineering, 2020, 62:198-206.