发酵食品是指利用有益微生物或酶的作用,使加工原料发生有益的物理或化学变化而制得的一类食品,在人类的饮食文化中占有重要地位。动物性食品包括畜禽肉、蛋类、水产品、奶制品等。发酵动物性食品是以动物性食品为主要原料,在自然或人工控制条件下,利用微生物的发酵或酶的水解作用使原料发生一系列生物化学变化及物理变化,从而形成风味、色泽和质地独特且具有较长保质期的食品,主要包括奶酪、发酵乳、干腌火腿、发酵香肠、发酵酸肉、鱼露、发酵鱼肉等。动物性食品蛋白含量丰富,在发酵过程中微生物的蛋白水解系统可以直接分泌产生大量蛋白酶,将蛋白质降解为小分子多肽。研究表明,这些小肽(活性肽)具有抗氧化、降血压、降血脂、抗疲劳以及免疫调节等一系列生理功能[1],其功能活性与氨基酸的组成、序列、分子质量、电荷和空间构象等有关。研究证实,经口服摄入活性肽后,部分在消化道内发挥一定的生理功能,部分可完整通过肠上皮细胞,吸收入血后通过免疫、神经、内分泌系统等发挥生理功能[2]。本文探讨了发酵动物性食品中生物活性肽的来源、分类、分离提纯、结构分析方法以及产生机理,以期为进一步挖掘发酵动物性食品来源生物活性肽提供参考。
1 发酵动物性食品来源生物活性肽的生理功能
生物活性肽(bioactive peptide, BAP)是指对生物机体的生命活动有益或具有生理作用的肽类分子。生物活性肽是氨基酸以不同的组成和排列方式构成的,结构介于氨基酸和蛋白质之间,小到只有2个氨基酸,大到复杂的长链或环状多肽,并可通过糖基化、磷酸化或酰基化而被修饰[3]。目前,在发酵动物性食品中发现的生物活性肽主要有抗高血压、抗氧化、抗菌、抗炎、抗血栓、降低胆固醇等功能特性[4]。表1列举了近年来发酵动物性食品的种类、优势菌群及其产生生物活性肽的种类、来源、氨基酸序列等。
1.1 血管紧张素转化酶抑制肽
血管紧张素转化酶(angiotensin converting enzyme,ACE)会将血管紧张素型转化为Ⅰ型、转化为Ⅱ型,ACE抑制肽可抑制转化酶的活力,从而起到预防或治疗高血压的作用。目前,在奶酪、发酵乳、火腿、发酵鱼等发酵动物性食品中发现了具有抗高血压活性的生物活性肽[5-7]。
1.2 抗氧化肽
抗氧化肽是指能够清除自由基、抑制脂质过氧化、螯合过渡金属离子和降低细胞自氧化速率,并且能够有效捕获并中和自由基的一类活性物质。在酸奶、火腿、奶酪、虾酱等发酵动物性食品中已经被分离出多种抗氧化肽,且具有生物活性高和毒性低等优点[8]。抗氧化肽是目前食源性天然产物的研究热点。据统计,目前在多肽数据库(BIOPEP数据库)已知的3 285个肽段中,抗氧化肽占比最高,约为16.1%[9]。发酵动物制品中含有丰富的抗氧化肽,其形成机理和加工条件对抗氧化肽形成的影响研究相对较少。
1.3 降血糖肽
目前临床上常用于控制血糖和预防糖尿病的药物中包含二肽基肽酶IV抑制剂(DPP-IV)类药物[10-11],降血糖肽就是作为DPP-IV抑制剂进而发挥降低血糖作用的[6]。目前对于天然食品源降糖肽研究较少,特别是发酵动物性食品中降糖肽鲜有报道,发酵动物性食品含有丰富的肽类物质,有关降糖肽的提取分离、结构表征及其降糖机制等方面的研究有待进一步深入。
1.4 抗菌肽
抗菌肽是指具有一定抗菌、抗病毒和抗真菌活性的小分子蛋白质,分子结构具有两亲性,一般带正电荷[12]。发酵动物性食品中含有大量细菌或真菌的发酵产物,这些发酵产物中抗菌肽含量丰富,天然食品来源的抗菌肽毒性低,可应用于研发食品防腐剂和抗生素替代品,具有广泛的应用前景[13-14]。但目前关于发酵动物性食品中抗菌肽的研究较少,抗菌肽的结构组成和抗菌机理尚不明确。
1.5 抗炎肽
抗炎肽是机体通过综合调控细胞炎症因子的分泌、炎性介质合成与释放和炎症信号通路,调节机体炎症反应的一类小分子肽,一般由2个或多个氨基酸组成。小分子肽通常在完整的蛋白质结构中不能发挥其生物活性,而经过酶解或在酸碱等极端条件下被释放出来时才会表现出其特定的生理活性[15]。发酵动物性食品蛋白含量高,是抗炎肽的良好来源[16-17]。目前发酵动物性食品中抗炎肽的研究相对较少,这些肽如何产生与释放,是否可进入细胞,以及其如何介导细胞炎性反应有待深入研究。
表1 发酵动物性食品来源生物活性肽的种类及氨基酸序列
Table 1 Summary of the type and amino acid sequences of bioactive peptides from animal-derived fermented foods
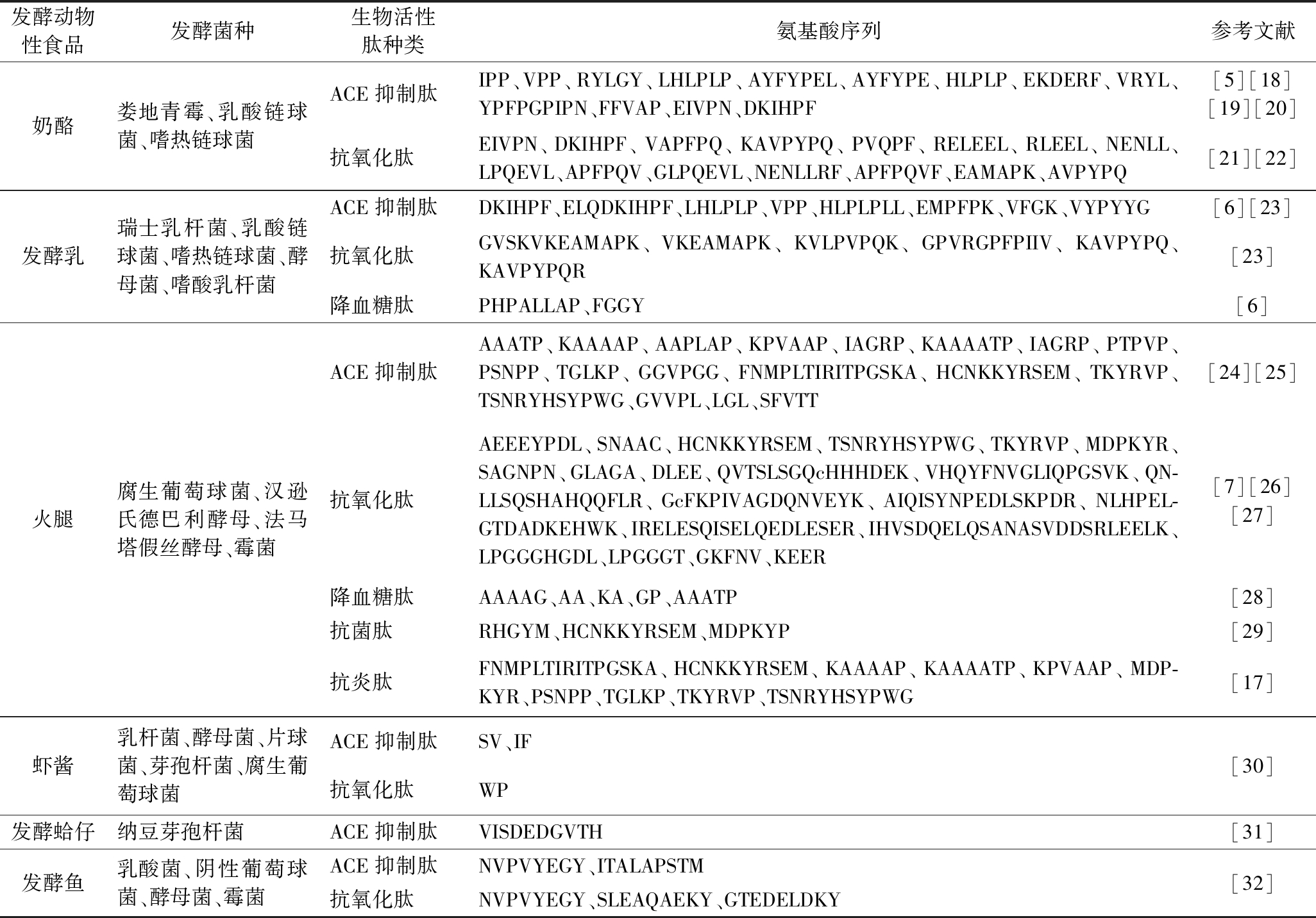
发酵动物性食品发酵菌种生物活性肽种类氨基酸序列参考文献奶酪娄地青霉、乳酸链球菌、嗜热链球菌ACE抑制肽IPP、VPP、RYLGY、LHLPLP、AYFYPEL、AYFYPE、HLPLP、EKDERF、VRYL、YPFPGPIPN、FFVAP、EIVPN、DKIHPF[5][18][19][20]抗氧化肽EIVPN、DKIHPF、VAPFPQ、KAVPYPQ、PVQPF、RELEEL、RLEEL、NENLL、LPQEVL、APFPQV、GLPQEVL、NENLLRF、APFPQVF、EAMAPK、AVPYPQ[21][22]发酵乳瑞士乳杆菌、乳酸链球菌、嗜热链球菌、酵母菌、嗜酸乳杆菌ACE抑制肽DKIHPF、ELQDKIHPF、LHLPLP、VPP、HLPLPLL、EMPFPK、VFGK、VYPYYG[6][23]抗氧化肽GVSKVKEAMAPK、VKEAMAPK、KVLPVPQK、GPVRGPFPIIV、KAVPYPQ、KAVPYPQR[23]降血糖肽PHPALLAP、FGGY[6]火腿腐生葡萄球菌、汉逊氏德巴利酵母、法马塔假丝酵母、霉菌ACE抑制肽AAATP、KAAAAP、AAPLAP、KPVAAP、IAGRP、KAAAATP、IAGRP、PTPVP、PSNPP、TGLKP、GGVPGG、FNMPLTIRITPGSKA、HCNKKYRSEM、TKYRVP、TSNRYHSYPWG、GVVPL、LGL、SFVTT[24][25]抗氧化肽AEEEYPDL、SNAAC、HCNKKYRSEM、TSNRYHSYPWG、TKYRVP、MDPKYR、SAGNPN、GLAGA、DLEE、QVTSLSGQcHHHDEK、VHQYFNVGLIQPGSVK、QN-LLSQSHAHQQFLR、GcFKPIVAGDQNVEYK、AIQISYNPEDLSKPDR、NLHPEL-GTDADKEHWK、IRELESQISELQEDLESER、IHVSDQELQSANASVDDSRLEELK、LPGGGHGDL、LPGGGT、GKFNV、KEER[7][26][27]降血糖肽AAAAG、AA、KA、GP、AAATP[28]抗菌肽RHGYM、HCNKKYRSEM、MDPKYP[29]抗炎肽FNMPLTIRITPGSKA、HCNKKYRSEM、KAAAAP、KAAAATP、KPVAAP、MDP-KYR、PSNPP、TGLKP、TKYRVP、TSNRYHSYPWG[17]虾酱乳杆菌、酵母菌、片球菌、芽孢杆菌、腐生葡萄球菌ACE抑制肽SV、IF抗氧化肽WP[30]发酵蛤仔纳豆芽孢杆菌ACE抑制肽VISDEDGVTH[31]发酵鱼乳酸菌、阴性葡萄球菌、酵母菌、霉菌ACE抑制肽NVPVYEGY、ITALAPSTM抗氧化肽NVPVYEGY、SLEAQAEKY、GTEDELDKY[32]
2 生物活性肽的制备与提取
多肽的制备和提取方法较多,各有利弊,可以通过对多肽性质的研究优化提取方法,进而获得高活性、高纯度和大批量的生物活性肽。目前从发酵动物性食品中获取生物活性肽的方法主要包括蛋白酶水解、浸取、双水相萃取等。酶解法制备生物活性肽的优点是生产工艺成本低、化学试剂和毒性物质残留少,目前广泛应用于生物活性肽的制备工艺中。酶解蛋白常用的酶包括胃蛋白酶、胰蛋白酶、中性蛋白酶、碱性蛋白酶以及木瓜蛋白酶等。祝超智[28]用胃蛋白酶、胰酶等消化酶对金华火腿抗氧化肽进行酶解提取,分析比较了酶解前后肽段的抗氧化活性差异,结果表明酶解后分子质量更小的肽段具有更强的抗氧化活性。
双水相萃取技术(aqueous two-phase extraction,ATPS)与液相萃取技术原理相似,都是利用目标物在两水相的溶解度不同,导致分配系数存在差异而对目标物进行分离的技术[33]。在双水相系统中,两相的水分都在85%~95%左右,且成相的高聚物与无机盐都是生物相容的,这一新型分离技术的特点是生物活性物质或细胞在这种水相环境下,它们不仅不会丧失活性,而且还会提高稳定性,在生物分离技术领域有较好的应用前景。目前采用双水相萃取技术从发酵动物性食品中提取生物活性肽还未见报道,但有采用该方法从乳清分离蛋白中分离出生物活性肽的报道[34]。双水相萃取技术应用的难点在于双水相体系的构建,利用新的双水相体系对生物活性肽进行分离纯化的开发过程较为繁杂,但该方法对于生物活性肽的大批量分离纯化具有重要意义。
3 生物活性肽的分离纯化及结构分析
3.1 分离纯化
生物活性肽的分离纯化是其生物活性研究与结构鉴定的基础,通常会根据分子质量、等电点、疏水性、酸碱性等理化性质的不同,选择合适的分离纯化方法。同时,多维色谱组合,以及多种分离方法联用,可以获得更好的分离效果。发酵动物性食品中研究比较多的是发酵肉制品和发酵乳制品,从这些产品中分离纯化生物活性肽通常采用超滤、凝胶层析色谱、离子交换色谱以及各方法与反相液相色谱的联用等。
忽晓平[35]利用孔径分别为3 k、10 kDa的超滤膜分离金华火腿粗肽,得到2种不同分子质量的多肽组分,并且分子质量<3kD的金华火腿小肽的抗氧化活性显著高于粗肽。柯义强[36]使用Sephadex系列凝胶将发酵法制备的牦牛乳酪蛋白抗氧化肽按照分子质量大小进行分离,将超滤后的组分依次经过凝胶SephadexG-50、SephadexG-25和SephadexG-10,其中经SephadexG-25凝胶过滤层析后的组分F1,再经过SephadexG-10凝胶层析后,其抗氧化能力显著提升。邢路娟[27]采用阴离子交换柱(HiPrep 16/10 DEAE)为固定相,用0~100% NaCl与磷酸盐缓冲液进行梯度洗脱,以2 mL/min的洗脱速度成功将宣威火腿中抗氧化肽组分分离出来。PIOVESANA等[37]采用反相高效液相色谱分离与柱后添加增压剂相结合的方法分离小分子多肽,以多孔石墨碳作为固定相,极大增加了极性分子和离子在固定相中的保留时间,从而可以更有效地分离纯化极性高的多肽[37]。在实际应用中,单一的分离方法往往不能达到良好的分离效果,将多种分离方法进行组合可以得到高纯度高活性的多肽,例如离子交换色谱-反相液相色谱结合、凝胶过滤色谱-反相高效液相色谱结合。XING等[38]采用阴离子交换柱和反相高效液相色谱联用对宣威火腿的多肽组分进行了分离,根据其电荷性和疏水性的不同,分离出了抗氧化活性较强的组分。除了2种分离方法联用外,3种分离方法的联用也被普遍应用,多种分离技术的优势互补,更有利于复杂样品的分离纯化。
3.2 生物活性肽一级结构分析
生物活性肽的结构鉴定方法研究对于揭示多肽结构与功能间的关系具有重要意义。目前发酵动物性食品中生物活性肽的一级结构分析方法主要有电泳法和质谱法。
不同发酵动物性食品源的ACE抑制肽氨基酸序列和肽链长度各不相同,但都具有相似的生理功能,生物活性肽肽链C-端氨基酸的组成是与ACE活性部位结合的关键,因此C-端的三肽序列会影响ACE抑制活性。有研究表明[39],该三肽序列为疏水性氨基酸(芳香族氨基酸/带支链氨基酸)或为赖氨酸和精氨酸且ε-氨基带正电荷均可提高ACE抑制活力。总之,活性较强的ACE抑制肽肽链N-端一般为疏水性氨基酸或碱性氨基酸,C-端一般为具有环状结构的芳香族氨基酸或脯氨酸。
在抗氧化肽中,氨基酸的组成及其在肽段中的位置是其抗氧化活性强度的主要影响因素,目前,已有研究表明抗氧化肽肽段中含有His、Leu、Met及芳香族氨基酸(Tyr、Trp、Phe)可提高其自由基清除能力。发酵乳制品来源的抗氧化肽中Tyr、His、Lys、Pro等氨基酸含量高,Cys含量低。金华火腿和宣威火腿的抗氧化肽中His含量最高,其次为Glu、Lys、Asp、Val和Leu,而Cys的含量均最低[27]。这些氨基酸都具有自由基清除能力,但这些氨基酸的组成含量以及在肽段中的位置对发酵动物性食品来源的抗氧化肽活性的影响有待进一步探讨。
邢路娟[27]采用液相色谱-质谱联用法(HPLC-MS/MS)成功对宣威火腿中抗氧化肽进行分离纯化和二级质谱鉴定。目前除了采用质谱法鉴定多肽序列以外,电泳法也是一个辅助手段。电泳法不仅可快速得出多肽基本的信息(分子质量和等电点等),为进一步鉴定多肽结构奠定基础,同时也可分离多肽。电泳技术包括毛细管电泳、聚丙烯酰胺凝胶电泳以及等电聚焦电泳等。目前,有关电泳法对发酵动物食品中生物活性肽进行结构鉴定的研究较少,毛细管电泳技术的优点是其对疏水性相近的肽段的分离效果较好,可为进一步研究发酵动物食品中生物活性肽的结构和功能提供新的途径。
3.3 生物活性肽的空间结构与特殊官能团分析
目前生物活性肽的空间结构和特殊官能团的分析方法主要有分子对接模拟、红外光谱和圆二色谱等。分子对接模拟可以分析ACE抑制肽和DPP-IV抑制肽的作用位点和作用力。氢键、疏水作用、离子键和范德华力等是维持蛋白质空间结构的重要因素,抑制肽对酶的抑制作用是通过氢键和疏水作用等作用力实现的。采用Gold进行分子对接模拟,可以预测ACE抑制肽或DPP-IV抑制肽能否与相关酶的主要活性部位氨基酸结合形成氢键,从而抑制ACE或DPP-IV与其他底物相结合,进而起到降低相关酶活性的作用。通过分子对接模拟分析可以得到肽段与酶结合的三维结构图和二维结构图,说明肽段可与酶的活性位点结合形成氢键,并且得出氢键和范德华力的共同存在可使酶与多肽的结合更稳定[6]。因此,DPP-IV和ACE抑制肽的抑制活性与肽和酶结合的稳定性相关。
红外光谱(infrared spectrum,IR)可通过特征基团的伸缩振动来推测多肽中可能存在的基团,也可通过对比红外光谱谱图峰形变化来确定化学反应前后多肽发生变化的基团。该方法主要用来分析多肽中存在的基团以及二级结构。核磁共振(nuclear magnetic resonance,NMR)通常与红外光谱联用,鉴定多肽中存在的特殊官能团,一般可用来分析少于30个氨基酸组成的多肽。圆二色谱(circular dichroism,CD)可对多肽的二级结构进行鉴定和分析预测,对于进一步全面了解多肽的空间结构具有重要作用[40]。
不同发酵动物性食品来源的生物活性肽、肽链长度不同、氨基酸组成不同,所形成的空间结构也会不同,但目前有关发酵动物食品中生物活性肽的二级结构和空间结构鉴定的研究较少,分子对接模拟、红外光谱和圆二色谱等分析方法可结合细胞水平和动物水平实验进一步研究生物活性肽结构和功能间的关系。
4 生物活性肽生物信息学研究方法
生物活性肽构效关系的研究已经取得一些进展,生物活性肽的氨基酸序列可以通过多种方法鉴定出来,但生物活性肽的功能活性和分子机制的研究方法目前还是需要大批量、高强度的实验操作。为了提高科研效率,一些生物信息学网址提供的软件和功能团模型可基于影响肽功能活性的结构特征和理化因素对肽段进行高效的虚拟筛选,并且可以利用分子对接和分子动力学模拟等新型生物信息学技术以进一步系统的研究生物活性肽发挥功能活性的作用机制。表2为分析生物活性肽肽段序列常用的生物信息学研究工具。
UniProt是目前使用最广泛的蛋白质序列数据库,UniProt主要功能分为以下两个部分:来源于实验的有详细注释的序列(SwissProt)和自动注释序列(TrEMBL)。有详细注释的序列源于Swiss-Prot数据库,可信度非常高。源于TrEMBL的自动注释序列是由核苷酸数据库中注释为蛋白质编码区的自动翻译而成的序列,可信度较低,但也有一定的参考价值。UniProt整合了多个数据库资源,与100多个数据库统一了编号,可相互参照,互相链接,在UniProt中可用关键词和序列比对对多肽序列进行检索。UniProt中的UniRef板块在UniProtKB板块的基础上可获得冗余度更低的蛋白质序列。UniProt数据库中的Proteomes板块收录了已知物种编码的所有蛋白质及蛋白质组学信息。
一般情况下,从天然来源的食物中分离纯化并鉴定功能活性肽的结构,以及验证肽的活性,整个实验过程繁琐,耗时长。而在线数据库和计算机分析工具等生物信息技术具有高效、省时的优点,因此可以广泛应用于功能肽的预测和鉴定中。另外,在综合分析肽理化性质和空间结构的基础上,通过生物信息学工具可进一步探究肽氨基酸残基对其功能活性的影响,进而在很大程度上减少实验量,高效获得具有高活性的生物活性肽。
表2 分析肽段序列常用的生物信息学研究工具[41-43]
Table 2 Bioinformatics tools for analyzing peptide sequences

类别名称功能网址蛋白质数据库NCBI氨基酸序列比对https://www.ncbi,nlm.nih.govUniProt提供有详细注释的蛋白质氨基酸序列,可与100多个数据库相互参照https://www.uniprot.org/PDB蛋白质三维结构库http://www.rcsb.org活性肽数据库BIOPEP生物活性肽氨基酸序列数据库http://www.uwm.edu.pl/biochemia/index.php/en/biopep计算肽特性工具Peptide Calculater计算肽的分子质量、等电点和静电荷https://pepcalc.comExPASy ProtParam计算肽的不稳定性指数https://web.expasy.org/protparam/PEAKS确定多肽的蛋白质来源软件PEPTIDE 2.0计算疏水性氨基酸比例https://www.peptide2.comHeliQuest计算肽的疏水性指数和疏水力矩https://heliquest.ipmc.cnrs.fr/cgi-bin/ComputParams.pyPeptideRanker肽的潜在生物学活性预测http://bioware.ucd.ie/~compass/biowareweb/Innovagen肽的溶解度预测http://www.innovagen.com/proteomics-toolsadmetSAR计算肽的ADMET性质(肠道吸收能力、血脑屏障穿透能力、急性口服毒性等)http://lmmd.ecust.edu.cn/admetsar1/predict/?smiles=RPKHPIK&action=ASOPMA预测肽的二级结构https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.htmlSubLoc预测活性肽细胞内定位http://www.bioinfo.tsinghua.edu.cn/Subloc/eu_predict.htmTMpred肽的跨膜区段预测http://www.ch.embnet.org/software/TMPRED_form.htmlSignalP信号肽的剪切位点肽的细胞穿透力预测http://www.cbs.dtu.dk/services/SignalP/
5 发酵动物性食品来源生物活性肽的形成机理
研究表明,许多传统的发酵动物性食品的加工时间较长,蛋白质在内源酶及微生物共同作用下,降解为结构更简单的二肽、三肽、寡肽或其他小分子多肽。下面以干腌火腿为例具体阐述发酵动物性食品在加工过程中生物活性肽形成机理。
猪肉肌肉含有多种蛋白水解酶,尤其是内肽酶和外肽酶,它们在干腌过程中对肌原纤维和肌浆蛋白的水解起着重要作用。蛋白质水解是先由内肽酶启动的,例如钙蛋白酶和组织蛋白酶,特别是在后续15个月的加工过程中仍然活跃的组织蛋白酶B、H和L,可使蛋白质被水解成小分子的蛋白和多肽。这些多肽可以被外肽酶进一步水解,产生小肽和游离氨基酸[44]。蛋白质水解的程度和产生的生物活性肽数量受多个因素影响,包括原材料、肌肉酶的类型和活性、加工条件和加工时间等。如随着加工时间的延长,肉的水分活度会降低,肌肉肽酶活性会在一定程度上有所下降,但在整个加工过程中肌肉的内源酶还是会保持一定的活性的[45]。
研究表明,西班牙传统干腌火腿成熟期间,肌肉在肽酶的作用下产生大量游离氨基酸和多肽。肌肉蛋白首先被内源性内肽酶(肽链内切酶)水解,然后被一系列外肽酶进行连续的水解。这些蛋白质水解反应是非常剧烈的,可以产生大量的游离氨基酸和不同序列与长度的肽类物质,其中一些具有一定的生理活性,如血管紧张素转换酶抑制活性、抗氧化活性、二肽基肽酶IV抑制活性、体内抗高血压活性、降血糖活性和抗炎活性等[46]。目前应用肽组学工具可模拟火腿腌制等复杂化学变化以及模拟后续蛋白质水解过程,并且使鉴定感兴趣的肽段序列成为可能。研究表明,很多生物活性肽作为肌肉蛋白的一部分时没有活性,但在干腌加工或胃肠消化过程中会被肌肉肽酶水解释放出来,从而变得有生物活性[47]。
研究表明,主要的肌肉肽酶包括三肽酶(tripeptidase,TPP)和二肽酶(dipeptidase,DPP),它们可以水解小分子蛋白和多肽N端的三肽和二肽。其中DPP Ⅰ、DPP Ⅱ和TPP Ⅰ的活性特别高,因为它们在微酸性(pH 5.5~6.5)的条件下活性最强,该微酸性条件与加工过程中火腿的pH(6.0~6.5)相接近。在西班牙干腌火腿加工过程中,被外肽酶水解的二肽有TS、TL、FD、VK、AT和QT,三肽有SRG、TVQ、NAS、KIE和GKM[7]。DPP Ⅰ和DPP Ⅱ可以从N端水解成如AE、RG、NP、IL、AG、SG和SQ等的二肽,而TPP I可以从N端水解成如IIP、RGA、GNP、GAG和GPG等的三肽,在N端主要由丙氨酰基和甲硫氨酰基氨基肽酶水解,释放的氨基酸有Gly、Ser、Ala、Leu和Ile,而C端由羧基肽酶A和B水解,释放的氨基酸有Leu、Tyr、Lys、Ala、Gly、Glu和Asp[48]。金华火腿在最后的加工阶段持续的高温有助于蛋白质的水解,进而产生大量的肽类物质,尤其是二肽(占23.59%)和三肽(占48.28%)。二肽主要包括VE、PL、AH和AR等,三肽主要包括LPK、SGL、AAP、SGV和LHA等,其他参与蛋白质水解的外肽酶包括氨基肽酶和羧肽酶,它们分别从N端和C端开始水解蛋白质,进而产生大量的游离氨基酸和小分子肽[49]。
然而,迄今为止,干腌火腿成熟过程中自然产生的多肽的结构特征仍不清楚,特别是它们的生物活性与涉及加工过程的代谢反应的相关性尚不明确。另外,需要进一步研究影响干腌火腿生产加工过程中生物活性肽释放的潜在因素。
6 总结和展望
目前,有关发酵动物性食品生物活性肽的分离、纯化和鉴定的研究手段已较为完善,但该领域还有许多问题有待深入研究:(1)有待挖掘和研究促进发酵过程中生物活性肽高产出的菌株;(2)不同种类生物活性肽在体内的生物利用率和作用机理研究较少;(3)多个具有不同空间结构和不同氨基酸序列的生物活性肽在同时发挥其各种生理功能时是否有协同作用有待进一步研究;(4)缺乏细胞实验、动物实验、人体临床实验等进一步验证多种生物活性肽的生理功能。
[1] 王爽, 刘雪松, 徐馨, 等.动物源生物活性肽研究进展[J].中国兽药杂志, 2021, 55(10):79-85.
WANG S, LIU X S, XU X, et al.Research progress of bioactive peptides from animals[J].Chinese Journal of Veterinary Drug, 2021, 55(10):79-85.
[2] 舒丹阳. 沙棘籽蛋白酶解肽的抗氧化活性、对小鼠的降血糖效果及肾脏保护作用[D].广州:华南理工大学, 2020.
SHU D Y.Antioxidative activity, hypoglycemic effect and renal protective effect of seabuckthorn seed protein enzymatic peptide in mice[D].Guangzhou:South China University of Technology, 2020.
[3] 李文龙, 张慧, 汤琦, 等.高效液相色谱在多肽分离分析中的应用[J].分析仪器, 2018(1):63-67.
LI W L, ZHANG H, TANG Q, et al.Advances in polypeptide separation and analysis by HPLC[J].Analytical Instrumentation, 2018(1):63-67.
[4] WANG Y F, HUANG Q F, KONG D D, et al.Production and functionality of food-derived bioactive peptides:A review[J].Mini Reviews in Medicinal Chemistry, 2018, 18(18):1 524-1 535.
[5] STUKNYTÉ M, CATTANEO S, MASOTTI F, et al.Occurrence and fate of ACE-inhibitor peptides in cheeses and in their digestates following in vitro static gastrointestinal digestion[J].Food Chemistry, 2015, 168:27-33.
[6] 唐蓉. 乳酸菌与酵母菌共发酵驼乳中ACE和DPP-Ⅳ抑制肽的研究[D].昆明:昆明理工大学, 2021.
TANG R.Study on ACE and DPP-Ⅳ inhibitory peptides in camel milk co-fermented by lactic acid bacteria and yeast[D].Kunming:Kunming University of Science and Technology, 2021.
[7] GALLEGO M, MORA L, TOLDR F.Potential cardioprotective peptides generated in Spanish dry-cured ham[J].Journal of Food Bioactives, 2019, 6:110-117.
F.Potential cardioprotective peptides generated in Spanish dry-cured ham[J].Journal of Food Bioactives, 2019, 6:110-117.
[8] SAH B N P, VASILJEVIC T, MCKECHNIE S, et al.Antioxidative and antibacterial peptides derived from bovine milk proteins[J].Critical Reviews in Food Science and Nutrition, 2018, 58(5):726-740.
[9] MINKIEWICZ P, DZIUBA J, IWANIAK A, et al.BIOPEP database and other programs for processing bioactive peptide sequences[J].Journal of AOAC International, 2008, 91(4):965-980.
[10] SATO A, OGITA H.Pathophysiological implications of dipeptidyl peptidases[J].Current Protein & Peptide Science, 2017, 18(8):843-849.
[11] DEACON C F.Dipeptidyl peptidase 4 inhibitors in the treatment of type 2 diabetes mellitus[J].Nature Reviews.Endocrinology, 2020, 16(11):642-653.
[12] 蒋摇静, 李俊峰, 任丽伟, 等.胰高血糖素样肽1(GLP-1)对心血管疾病治疗的研究进展[J].复旦学报(医学版), 2018, 45(6):877-883.
JIANG Y J, LI J F, REN L W, et al.Advances of glucagon-like peptide-1(GLP-1)in the therapy of cardiovascular diseases[J].Fudan University Journal of Medical Sciences, 2018, 45(6):877-883.
[13] THÉOLIER J, HAMMAMI R, FLISS I, et al.Antibacterial and antifungal activity of water-soluble extracts from Mozzarella, Gouda, Swiss, and Cheddar commercial cheeses produced in Canada[J].Dairy Science & Technology, 2014, 94(5):427-438.
[14] CASTELLANO P, MORA L, ESCUDERO E, et al.Antilisterial peptides from Spanish dry-cured hams:Purification and identification[J].Food Microbiology, 2016, 59:133-141.
[15] 汪雄, 赵燕, 徐明生, 等.食源性抗炎肽的制备、分离、鉴定及其抗炎机制研究进展[J].食品工业科技, 2017, 38(15):335-341.
WANG X, ZHAO Y, XU M S, et al.Research progress in the preparation, isolation, identification and anti-inflammatory mechanism of anti-inflammatory peptides derived from food[J].Science and Technology of Food Industry, 2017, 38(15):335-341.
[16] ELFAHRI K R, DONKOR O N, VASILJEVIC T.Potential of novel Lactobacillus helveticus strains and their cell wall bound proteases to release physiologically active peptides from milk proteins[J].International Dairy Journal, 2014, 38(1):37-46.
[17] MORA L, GALLEGO M, TOLDR F.Degradation of myosin heavy chain and its potential as a source of natural bioactive peptides in dry-cured ham[J].Food Bioscience, 2019, 30:100416.
F.Degradation of myosin heavy chain and its potential as a source of natural bioactive peptides in dry-cured ham[J].Food Bioscience, 2019, 30:100416.
[18] 白永飞. 干酪乳杆菌刺激肠细胞产生抗菌肽的筛选及其对肠上皮细胞增殖作用研究[D].大庆:黑龙江八一农垦大学, 2021.
BAI Y F.Screening of antimicrobial peptides produced by Lactobacillus casei stimulated mice intestine cells and its effect on proliferation of intestinal epithelial cells[D].Daqing:Heilongjiang Bayi Agricultural University, 2021.
[19] HUMA N, RAFIQ S, SAMEEN A, et al.Antioxidant potential of buffalo and cow milk Cheddar cheeses to tackle human colon adenocarcinoma (Caco-2) cells[J].Asian-Australasian Journal of Animal Sciences, 2018, 31(2):287-292.
[20] LU Y, GOVINDASAMY-LUCEY S, LUCEY J A.Angiotensin-I-converting enzyme-inhibitory peptides in commercial Wisconsin Cheddar cheeses of different ages[J].Journal of Dairy Science, 2016, 99(1):41-52.
[21] TIM N M L, ANDRÉS A I, OTTE J, et al.Antioxidant peptides (<3 kDa) identified on hard cow milk cheese with rennet from different origin[J].Food Research International, 2019, 120:643-649.
N M L, ANDRÉS A I, OTTE J, et al.Antioxidant peptides (<3 kDa) identified on hard cow milk cheese with rennet from different origin[J].Food Research International, 2019, 120:643-649.
[22] PEPE G, SOMMELLA E, VENTRE G, et al.Antioxidant peptides released from gastrointestinal digestion of “Stracchino” soft cheese:Characterization, in vitro intestinal protection and bioavailability[J].Journal of Functional Foods, 2016, 26:494-505.
[23] PADGHAN P V, MANN B, HATI S.Purification and characterization of antioxidative peptides derived from fermented milk (lassi) by lactic cultures[J].International Journal of Peptide Research and Therapeutics, 2018, 24(2):235-249.
[24] 吴宝森, 孙玥晖, 刘姝韵, 等.火腿中抗氧化肽的研究进展[J].食品安全质量检测学报, 2016, 7(12):4 809-4 814.
WU B S, SUN Y H, LIU S Y, et al.Research progress of antioxidant peptides in ham[J].Journal of Food Safety & Quality, 2016, 7(12):4 809-4 814.
[25] ESCUDERO E, MORA L, TOLDR F.Stability of ACE inhibitory ham peptides against heat treatment and in vitro digestion[J].Food Chemistry, 2014, 161:305-311.
F.Stability of ACE inhibitory ham peptides against heat treatment and in vitro digestion[J].Food Chemistry, 2014, 161:305-311.
[26] GALLEGO M, MORA L, HAYES M, et al.Peptides with potential cardioprotective effects derived from dry-cured ham byproducts[J].Journal of Agricultural and Food Chemistry, 2019, 67(4):1 115-1 126.
[27] 邢路娟. 宣威火腿中抗氧化肽的分离鉴定及抗氧化机理研究[D].南京:南京农业大学, 2019.
XING L J.Study on the identification and the antioxidant mechanism of antioxidant peptides in Xuanwei ham[D].Nanjing:Nanjing Agricultural University, 2019.
[28] 祝超智. 金华火腿抗氧化肽的活性研究及组分鉴定[D].南京:南京农业大学, 2015.
ZHU C Z.Study of identification and antioxidant activity of peptides from Jinhua ham[D].Nanjing:Nanjing Agricultural University, 2015.
[29] GALLEGO M, ARISTOY M C, TOLDR F.Dipeptidyl peptidase IV inhibitory peptides generated in Spanish dry-cured ham[J].Meat Science, 2014, 96(2):757-761.
F.Dipeptidyl peptidase IV inhibitory peptides generated in Spanish dry-cured ham[J].Meat Science, 2014, 96(2):757-761.
[30] KLEEKAYAI T, HARNEDY P A, O’KEEFFE M B, et al.Extraction of antioxidant and ACE inhibitory peptides from Thai traditional fermented shrimp pastes[J].Food Chemistry, 2015, 176:441-447.
[31] CHEN Y Y, GAO X, WEI Y X, et al.Isolation, purification and the anti-hypertensive effect of a novel angiotensin I-converting enzyme (ACE) inhibitory peptide from Ruditapes philippinarum fermented with Bacillus natto[J].Food & Function, 2018, 9(10):5 230-5 237.
[32] JEMIL I, MORA L, NASRI R, et al.A peptidomic approach for the identification of antioxidant and ACE-inhibitory peptides in sardinelle protein hydrolysates fermented by Bacillus subtilis A26 and Bacillus amyloliquefaciens An6[J].Food Research International, 2016, 89:347-358.
[33] 谢昕, 钱春, 刘邵鹏.双水相萃取技术在生物分离提取中的应用研究进展[J].科学大众(科学教育), 2015(11):150;160.
XIE X, QIAN C, LIU S P.Advances in the application of aqueous two-phase systems extraction in biological separation extraction[J].Popular Science, 2015(11):150;160.
[34] JIANG B, ZHANG X Q, YUAN Y Q, et al.Separation of antioxidant peptides from pepsin hydrolysate of whey protein isolate by ATPS of EOPO co-polymer (UCON)/phosphate[J].Scientific Reports, 2017, 7:13320.
[35] 忽晓平. 金华火腿多肽的提取及功能特性研究[D].郑州:河南农业大学, 2017.
HU X P.Research of extraction and properties of peptides from Jinhua ham[D].Zhengzhou:Henan Agricultural University, 2017.
[36] 柯义强. 发酵法制备牦牛乳酪蛋白抗氧化肽的研究[D].兰州:西北民族大学, 2021.
KE Y Q.Preparation of antioxidant peptides from yak casein by microbial fermentation[D].Lanzhou:Northwest Minzu University, 2021.
[37] PIOVESANA S, MONTONE C M, CAVALIERE C, et al.Sensitive untargeted identification of short hydrophilic peptides by high performance liquid chromatography on porous graphitic carbon coupled to high resolution mass spectrometry[J].Journal of Chromatography A, 2019, 1590:73-79.
[38] XING L J, HU Y Y, HU H Y, et al.Purification and identification of antioxidative peptides from dry-cured Xuanwei ham[J].Food Chemistry, 2016, 194:951-958.
[39] 王立平. 瑞士乳杆菌酪蛋白源活性肽制备及其生理功效研究[D].北京:北京林业大学, 2008.
WANG L P.Production and physiological effects of casein-derived peptides formed with Lactobacillus helveticus cells[D].Beijing:Beijing Forestry University, 2008.
[40] FU Y, YOUNG J F, LØKKE M M, et al.Revalorisation of bovine collagen as a potential precursor of angiotensin I-converting enzyme (ACE) inhibitory peptides based on in silico and in vitro protein digestions[J].Journal of Functional Foods, 2016, 24:196-206.
[41] 谢博, 傅红, 杨方.生物活性肽的制备、分离纯化、鉴定以及构效关系研究进展[J].食品工业科技, 2021, 42(5):383-391.
XIE B, FU H, YANG F.Research progress on preparation, purification, identification and structure-activity relationship of bioactive peptides[J].Science and Technology of Food Industry, 2021, 42(5):383-391.
[42] 李杰, 杭柏林, 秦爱建, 等.牛血红蛋白源抗菌肽P3及其类似肽的生物信息学分析[J].中国畜牧兽医, 2017, 44(1):59-64.
LI J, HANG B L, QIN A J, et al.Bioinformatics analysis of antimicrobial peptide P3 from bovine hemoglobin and its analogs[J].China Animal Husbandry & Veterinary Medicine, 2017, 44(1):59-64.
[43] 蔡苗苗. 舌状蜈蚣藻抗氧化肽的制备、纯化及结构鉴定[D].上海:上海海洋大学, 2020.
CAI M M.Preparation, purification, structure identification of antioxidant peptide from Grateloupia livida[D].Shanghai:Shanghai Ocean University, 2020.
[44] 李平, 张志, 周辉, 等.干腌火腿中肽的形成机理研究进展[J].食品与发酵工业, 2022, 48(4):294-300.
LI P, ZHANG Z, ZHOU H, et al.The mechanism of peptides formation in dry-cured ham:A review[J].Food and Fermentation Industries, 2022, 48(4):294-300.
[45] ZHOU G H, ZHAO G M.Biochemical changes during processing of traditional Jinhua ham[J].Meat Science, 2007, 77(1):114-120.
[46] HAJFATHALIAN M, GHELICHI S, GARC A-MORENO P J, et al.Peptides:production, bioactivity, functionality, and applications[J].Critical Reviews in Food Science and Nutrition, 2018, 58(18):3 097-3 129.
A-MORENO P J, et al.Peptides:production, bioactivity, functionality, and applications[J].Critical Reviews in Food Science and Nutrition, 2018, 58(18):3 097-3 129.
[47] TOLDR F, REIG M, ARISTOY M C, et al.Generation of bioactive peptides during food processing[J].Food Chemistry, 2018, 267:395-404.
F, REIG M, ARISTOY M C, et al.Generation of bioactive peptides during food processing[J].Food Chemistry, 2018, 267:395-404.
[48] MORA L, GALLEGO M, ESCUDERO E, et al.Small peptides hydrolysis in dry-cured meats[J].International Journal of Food Microbiology, 2015, 212:9-15.
[49] VIRGILI R, SACCANI G, GABBA L, et al.Changes of free amino acids and biogenic amines during extended ageing of Italian dry-cured ham[J].LWT-Food Science and Technology, 2007, 40(5):871-878.