毛韧革菌(Stereum hirsutum),属担子菌纲、多孔菌目、革菌科、韧革菌属。通常情况下,作为宿主菌株,被一些大型食用真菌寄生后形成相应的子实体,特别是在金耳[Naematelia aurantialba (Bandoni & M.Zang) Millanes & Wedin]的菌丝发育和出菇过程中发挥着重要的作用[1-2]。毛韧革菌伴随在金耳的整个发育周期,金耳出菇后,其本质上仍然是与毛韧革菌组成的异质复合体。金耳作为一种传统食用真菌,其安全性已经得到了广泛的认可,因此与其共生的毛韧革菌在理论上也具有食用安全性。
金耳子实体,作为一种金耳与毛韧革菌的异质复合体,具有药食同源的特性,多糖是其主要活性成分。国内已针对金耳多糖开展了大量研究,发现其具有降血糖[3-4]、抗氧化[5]、降血脂[6]、抗肿瘤抗病毒[7]等生物活性。而有关毛韧革菌是否也产生具有类似生物活性的多糖则鲜有报道。因此,本研究从新鲜金耳子实体内分离到1株毛韧革菌(Stereum hirsutum) NX-22,通过液体深层发酵研究其是否合成胞外多糖,并对其分泌胞外多糖进行发酵优化。同时本研究还对毛韧革菌胞外多糖的单糖组成进行初步分析并评价其活性。
1 材料与方法
1.1 菌株
Stereum hirsutum NX-22,本实验室保藏,保藏培养基为PDA培养基。
1.2 培养基
种子培养基(g/L):马铃薯葡萄糖肉汤(potato dextrose broth,PDB)培养基初始发酵培养基(g/L):葡萄糖20.0,玉米粉10.0,KH2PO4 1.0,MgSO4 0.4,胰蛋白胨1.0[8]。
1.3 菌株培养及发酵条件优化
用接种勺从PDA固态培养基上挖取3~4块米粒大小的菌丝体转接至种子培养基中,于25 ℃培养3 d,在无菌环境下将长好的种子液用80目细胞筛过滤后,按照体积分数10%的接种量转接至初始发酵培养基,25 ℃培养5~6 d。
培养条件优化:发酵过程每24 h取样,绘制发酵过程多糖产量及菌丝生物量随时间变化曲线,连续取样7 d,确认最佳发酵时间;分别更改初始发酵培养基的初始pH值(4、5、6、7、8)和温度(22、25、28、30、32、35 ℃),确认最优发酵pH及温度。
培养基优化:在初始培养基基础上,将碳源葡萄糖、玉米粉更换为20 g/L的阿拉伯糖、果糖、麦芽糖、蔗糖、甘露糖、葡萄糖、半乳糖、玉米粉,研究不同碳源对产糖和菌丝生长的影响,并对最优碳源浓度进一步优化;在获得最优碳源的基础上,将氮源胰蛋白胨替换为1.0 g/L的NH4Cl、鱼粉蛋白胨、(NH4)2SO4、尿素、豆粕粉、酵母粉,研究不同氮源对产糖和菌丝生长的影响,并对最优氮源浓度进一步优化;在获得最优碳氮源的基础上,对培养基中的盐离子浓度(K+,Mg2+)进行优化,并确认最佳培养基成分。
1.4 毛韧革菌多糖的提取及纯化
发酵液于8 000×g离心10 min,取上清液加入3 g/L的活性炭搅拌1 h进行脱色,随后浓缩至其体积的20%。将浓缩后上清液加入3倍体积的无水乙醇,静置12 h。分别用体积分数为75%和50%的乙醇洗涤沉淀后,加入不多于其旋蒸后体积的蒸馏水复溶,醇沉,以此重复3次,冻干,即得毛韧革菌胞外多糖(Stereum hirsutum polysaccharide,SHPS)。
1.5 毛韧革菌多糖结构表征
分子质量测定:使用HPLC法[9]进行测定。分析柱为2根串联的凝胶渗透色谱(gel permeation chromatograph, GPC)柱(OHpak SB-806M HQ,8.0 mm×300 mm,日本Shodex)。流动相为2 mmol/L乙酸铵(pH 4.0),流速1.0 mL/min。检测器为蒸发光散射检测器(ELSD-16),漂移管温度60 ℃,通气量3.0 L/min。根据不同分子质量的葡聚糖标准品(Sigma公司,分子质量分别为670 000、270 000、150 000、80 000、50 000、25 000、12 000、5 000 Da)建立的标准线性方程计算SHPS的分子质量。
结构表征:分别用傅里叶变换红外光谱仪、紫外光谱仪、扫描电镜对多糖的光谱结构和形态结构进行表征。
单糖组分分析:准确称取3 mg SHPS,2 mL 2 mol/L三氟乙酸在100 ℃的沸水浴中水解4 h。反应结束后,水解产物和各种单糖标准品用1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone, PMP)衍生化,然后利用HPLC分析。色谱柱为Sepax GP-C18柱(4.6 mm×250 mm),流动相由PBS缓冲液(0.1 mol/L,pH 6.80)和乙腈按8∶2(体积比)混合配制,流速为1.0 mL/min,柱箱温度35 ℃,检测器为紫外检测器,波长设置为250 nm。用标准单糖的保留时间测定单糖的组成,用响应因子的峰面积计算单糖之间的比值。
1.6 毛韧革菌多糖抗氧化活性测定
参考ZHANG等[10]的方法分别研究毛韧革菌多糖对于超氧阴离子、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、羟自由基(·OH)清除能力,并均以抗坏血酸作为阳性对照。
清除超氧阴离子![]() 的能力:采取邻苯三酚法测定。将2.8 mL 50 mmol/L pH 8.2的Tris-HCl缓冲液和1.0 mL不同浓度的SHPS溶液在25 ℃下反应5 min,放置10 min后加入25 ℃预热的200 mL邻苯三酚,在320 nm处测量吸光度,每隔30 min测定一次吸光度记录,计算邻苯三酚的自氧化速率。
的能力:采取邻苯三酚法测定。将2.8 mL 50 mmol/L pH 8.2的Tris-HCl缓冲液和1.0 mL不同浓度的SHPS溶液在25 ℃下反应5 min,放置10 min后加入25 ℃预热的200 mL邻苯三酚,在320 nm处测量吸光度,每隔30 min测定一次吸光度记录,计算邻苯三酚的自氧化速率。![]() 清除能力按公式(1)计算:
清除能力按公式(1)计算:
![]() 清除率
清除率![]()
(1)
式中:A0,空白对照吸光度;A1,样品吸光度。
清除DPPH自由基的能力:在室温下,将2 mL不同浓度的SHPS溶液和2 mL 0.2 mmol/L DPPH乙醇溶液均匀混合。反应时间为30 min,在517 nm处测量吸光度。DPPH自由基清除能力按公式(2)计算:
DPPH自由基清除率![]()
(2)
式中:A0,空白对照吸光度;A1,样品吸光度。
清除·OH的能力:反应体系为3.0 mL,分别含有0.2 mmol/L EDTA-Fe螯合物、3.0 mmol/L H2O2和2.0 mmol/L水杨酸在37 ℃水浴中反应15 min,然后在37 ℃水浴中加入0.8 mL不同浓度SHPS溶液反应60 min。在510 nm处测量吸光度。·OH清除能力按公式(3)计算:
·OH清除能力![]()
(3)
式中:A0,空白对照吸光度;A1,样品吸光度。
2 结果与分析
2.1 毛韧革菌多糖结构表征
纯化的SHPS在高效液相色谱上利用GPC色谱柱进行纯度和分子质量分析,如图1所示。色谱柱出峰仅为1个单峰,表明本研究的纯化方案获得了纯度较高的多糖。SHPS在液相色谱上的出峰时间为30.40 min,通过利用不同分子质量的葡聚糖建立分子质量-保留时间相关曲线方程:lg Mw=-0.385 7t+16.33,R2=0.993 2,Mw为分子质量(Da),t为时间,计算得到SHPS的分子质量为39 810 Da。
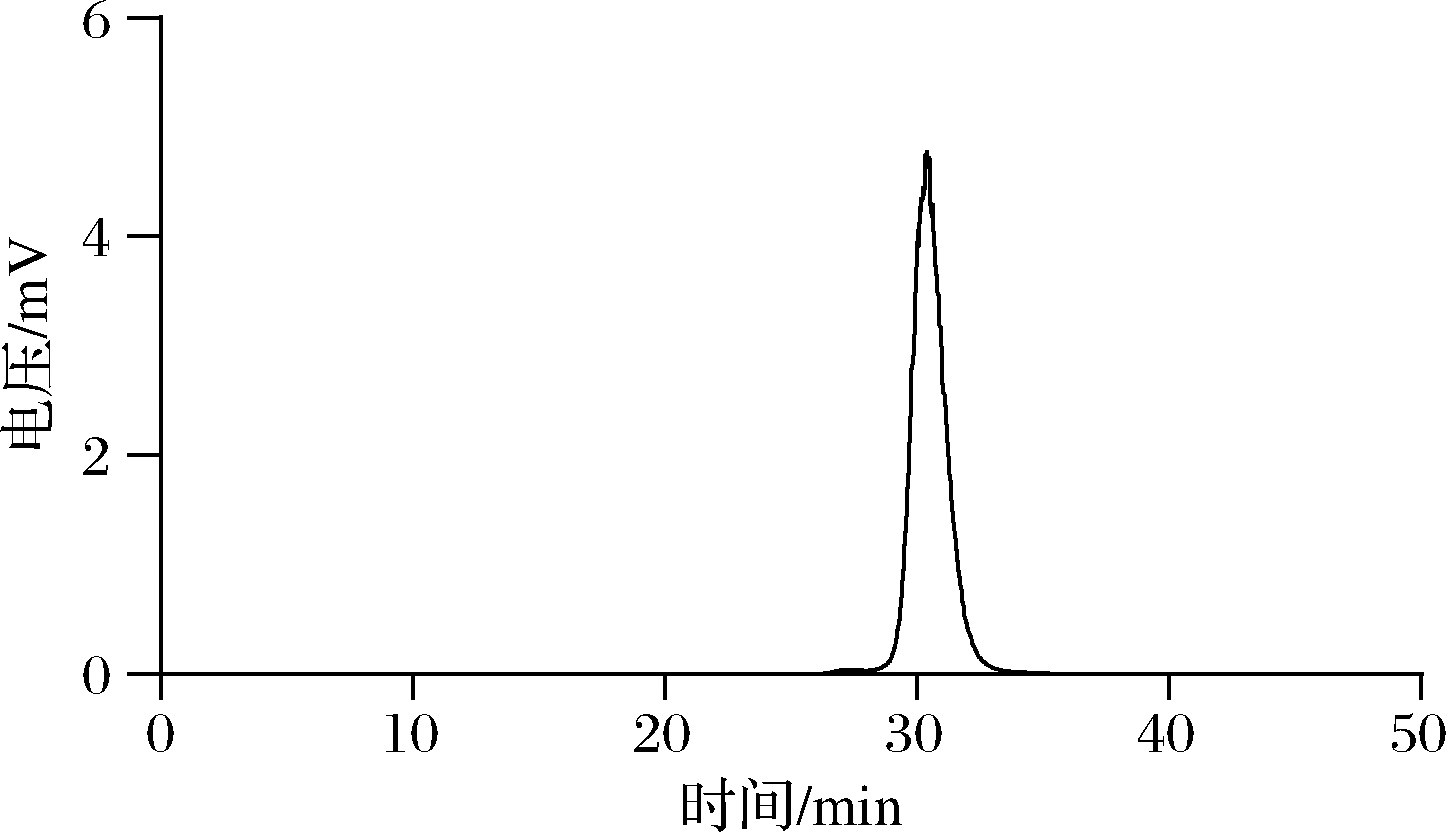
图1 SHPS-GPC色谱图
Fig.1 SHPS-GPC chromatogram
SHPS经扫描电镜放大20 000倍后的形态如图2-a所示,SHPS呈蜂窝网状,表明多糖分子间存在相互作用并且紧密聚集。SHPS的紫外光谱表征如图2-b所示,在260及280 nm附近的紫外吸收强度几乎没有变化,表明SHPS中的核酸及蛋白质含量较低,符合多糖的紫外吸收特征,也证明纯化效果较好。SHPS的红外光谱表征结果如图2-c所示,3 330.40 cm-1处的吸收峰是由多糖分子间或分子内的O—H的伸缩振动引起的;2 931.30 cm-1处的吸收峰是糖类不对称C—H的伸缩振动吸收峰;1 676.45 cm-1处的是羧基的C—O键的伸缩振动吸收峰,表明SHPS中有糖醛酸;1 198.75和1 126.78 cm-1处的吸收峰是由于C—O—C和C—O的伸缩振动;1 095.77 cm-1的吸收峰证明SHPS中有吡喃糖环存在;894.41 cm-1处的吸收峰则表明SHPS中具有β-糖苷键构型,而在830 cm-1处无吸收峰,表明可能不存在α-糖苷键。

a-扫描电镜图;b-红外光谱;c-紫外光谱
图2 SHPS的结构表征
Fig.2 Structural characterization of SHPS
2.2 毛韧革菌多糖的单糖组分分析
单糖组分分析结果如图3所示,其单糖组成及物质的量比为:M(甘露糖)∶M(葡萄糖醛酸)∶M(氨基半乳糖)∶M(半乳糖)∶M(木糖)=0.37∶21.43∶1.01∶76.93∶0.28。由结果可知,半乳糖的摩尔分数在SHPS占比高达76.93%,表明SHPS的骨架结构为多聚半乳糖。此外,SHPS中葡萄糖醛酸的摩尔分数为21.43%,表明其为一种酸性多糖。
2.3 毛韧革菌多糖的抗氧化性评价
抗氧化活性被认为是多糖最重要的生物活性之一,大部分的天然多糖都具有或高或低的抗氧化能力[11]。本研究对SHPS抗氧化活性进行了初步评价。如图4所示,在实验所取的浓度范围内,SHPS对·O2-无明显清除作用,但对DPPH自由基、·OH具有一定的的清除能力。SHPS的质量浓度达到1.2 g/L时具有最好的抗氧化效果,DPPH自由基清除率达到38.42%,·OH的清除率达到53.72%。综上,这意味着SHPS在抗衰老、抗肿瘤、抗病毒、抗炎症、抗糖尿病活性等方面具有潜在的应用前景[11-13]。

Man-甘露糖;GlcA-葡萄糖醛酸;Rha-鼠李糖;GalA-半乳糖醛酸;Glc-葡萄糖;Gal-半乳糖;Xyl-木糖;Ara-阿拉伯糖
图3 SHPS液相色谱图
Fig.3 HPLC chromatography of SHPS
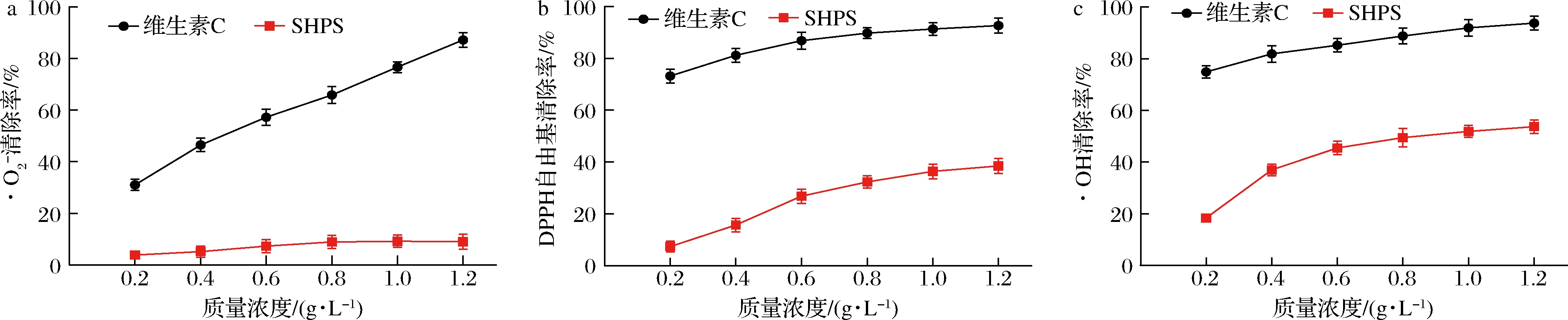
a-·O2-;b-DPPH自由基;c-·OH
图4 SHPS抗氧化能力
Fig.4 Antioxidant ability of SHPS
2.4 毛韧革菌多糖的发酵制备优化
2.4.1 最适发酵条件的确定
不同的菌株有其独特的生长曲线,发酵时间过短会导致菌体的生长量还未达到最高,产糖效率低下;发酵时间过长,菌体则会由于代谢产物的累积,发生菌体衰亡。由图5-a可知,最佳发酵时间为5 d时,多糖产量为1.196 g/L,菌丝体生物量为10.532 g/L。由图5-b可知,毛韧革菌在25 ℃内培养效果最好,多糖产量为1.235 g/L,菌丝体生物量为10.612 g/L。随着温度的升高,产量逐渐上升,但在25 ℃时达到最大值后随着温度升高产量逐渐下降。培养基初始pH对多糖产量的影响见图5-c,毛韧革菌发酵培养基的最适初始pH=7,与实验初设条件一致,此条件下多糖产量达到1.231 g/L,菌丝体生物量为10.527 g/L。

a-时间;b-温度;c-初始pH
图5 培养条件对SHPS产量的影响
Fig.5 Effect of fermentation conditions on SHPS production
2.4.2 最优培养基的确定
2.4.2.1 碳源对多糖产量的影响
在发酵过程中,一些可以直接被菌体利用的单糖或双糖往往能够节省菌体生长所需的能量,且有利于代谢产物的积累。另外,考虑到一些真菌在利用淀粉类碳源时也往往具有优势,因此,分别考察了阿拉伯糖、果糖、麦芽糖、蔗糖、甘露糖、葡萄糖、半乳糖、玉米粉等8种常用碳源对毛韧革菌生长及产糖的影响,结果如图6所示。当碳源质量浓度为20 g/L时,玉米粉最有利于SHPS的合成。进一步优化发现,玉米粉最优添加质量浓度为40 g/L,此时多糖产量达到4.472 g/L,菌丝体生物量为21.235 g/L。
通过NCBI数据库检索发现,毛韧革菌基因组中存在着3个淀粉酶基因(Gene ID:18798273、18806366、18807072),这意味着它能够通过水解淀粉合成多糖。我们猜测其水解效果较好的原因不仅是玉米粉中含有大量的淀粉,还可能是它在溶液中能起到增加液体对菌体的剪切力,促使菌体生长以增加产量的作用[14-15]。杨静静[16]也发现玉米粉对灵芝菌丝体的形态、生物量等有影响。但在本研究中,尽管SHPS是一种聚半乳糖多糖,但半乳糖并非合成SHPS的最优碳源,这意味着SHPS并非通过半乳糖直接聚合而成,而是通过胞内复杂的糖苷转移酶系统拼装而成[17]。

a-碳源种类(1-阿拉伯糖,2-半乳糖,3-果糖,4-麦芽糖,5-蔗糖,6-甘露糖,7-葡萄糖,8-玉米粉);b-玉米粉质量浓度
图6 不同碳源对SHPS产量的影响
Fig.6 Effect of different carbon sources on SHPS production
2.4.2.2 氮源对多糖产量的影响
尽管SHPS多糖中氮含量极低,但菌体的生长以及与多糖合成相关酶系的表达都需要氮的参与。因此本研究中,考察了4种有机氮源(胰蛋白胨、鱼粉蛋白胨、豆粕粉、酵母粉)和3种无机氮源[NH4Cl、(NH4)2SO4、尿素]对菌体生长和多糖产量的影响。由图7可知,酵母粉、鱼粉蛋白胨、胰蛋白胨作为氮源产糖效果较好,这表明在合成SHPS时,有机氮源更为有利。当以3 g/L酵母粉作为氮源时,多糖产量达到最高5.681 g/L,菌丝体生物量为23.723 g/L,所以将其作为最佳氮源。酵母粉作为速效氮源,效果略优于蛋白胨,可能是酵母粉中含有丰富的游离氨基酸、维生素、微量元素等营养物质,能更好地为菌丝体的生长及多糖的产量提供保证。有研究同样表明酵母粉对灵芝菌丝体的生长以及胞内多糖的产量提高效果优于其他氮源[18]。

a-氮源种类(1-胰蛋白胨,2-NH4Cl,3-鱼粉蛋白胨,4-(NH4)2SO4,5-尿素,6-豆粕粉,7-酵母粉);b-酵母粉质量浓度
图7 不同氮源对SHPS产量的影响
Fig.7 Effect of different nitrogen sources on SHPS production
2.4.2.3 金属离子对多糖产量的影响
金属离子能够维持生物大分子和细胞结构的稳定以及调节和维持细胞的渗透压,能对微生物代谢具有重要影响。有报道表明金属离子Mg2+和K+能显著提高中国块状菌胞外多糖产量[19];Ca+有利于虫草多糖合成以及增加多糖合成酶的活性[20]。
不同金属离子浓度对多糖产量的影响如图8所示,各浓度均对多糖产量有积极影响,MgSO4、K2HPO4和KH2PO4的最适质量浓度分别为0.6、1.0、1.5 g/L。由此可见,金属离子在微生物的生长及代谢产物的合成中具有重要的调节作用,本实验中金属离子能够提高多糖的产量,可能是由于金属离子改变代谢途径中的酶活力从而使得胞外代谢物的产量变化。根据此条件优化后的多糖产量达到5.964 g/L,菌丝体生物量为24.634 g/L。
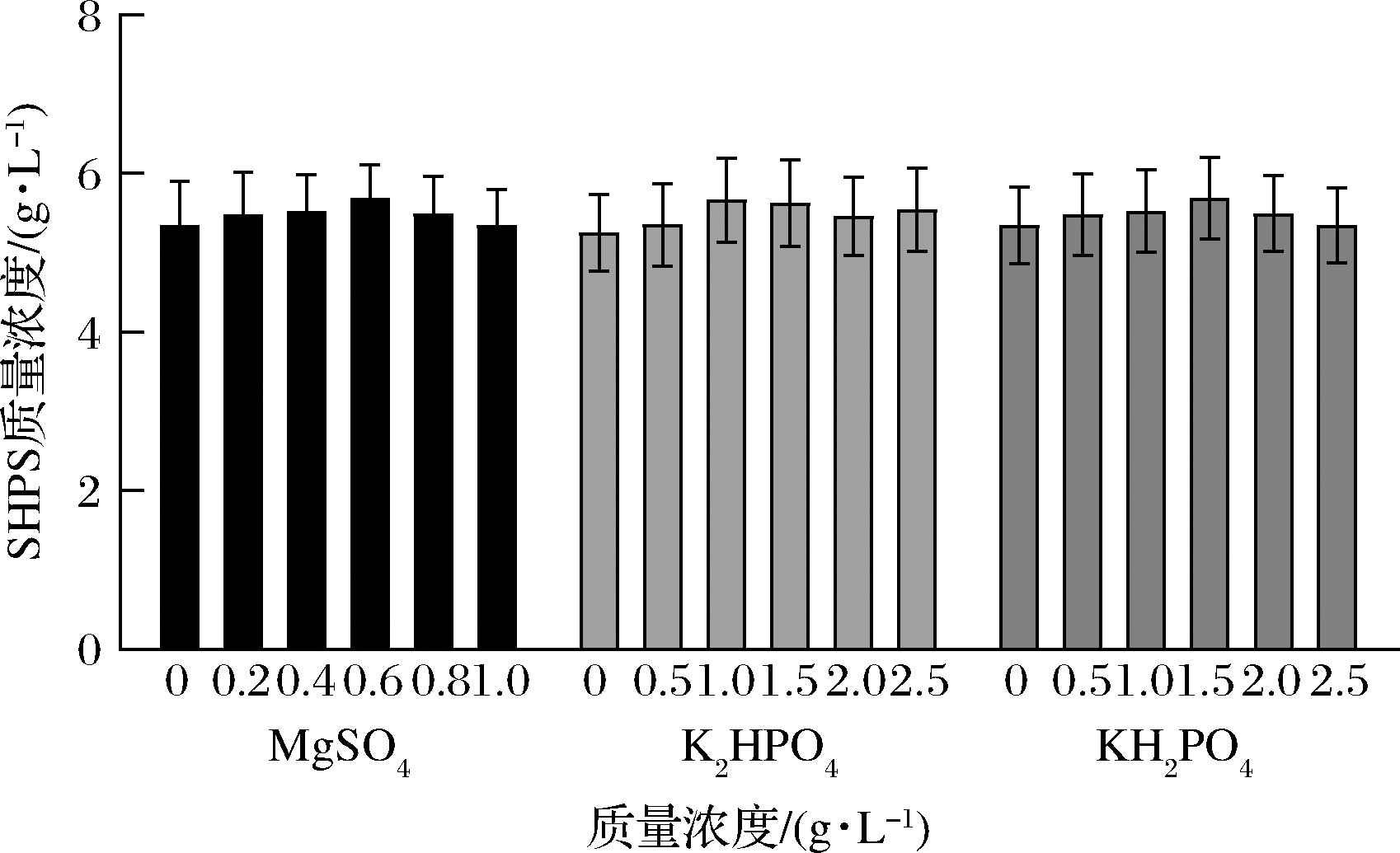
图8 不同金属离子及其浓度对SHPS产量的影响
Fig.8 Effect of different metal ions and concentrations on SHPS production
3 结论
毛韧革菌是一种极具应用价值的药用真菌,本研究首次利用毛韧革菌深层发酵获得了其胞外多糖SHPS,通过对其结构表征,表明其主体结构为一种β-糖苷键构型的聚半乳糖。抗氧化活性实验表明SHPS对![]() 无明显清除效果,对DPPH自由基、·OH具有一定的清除效果。本研究还确定了毛韧革菌多糖最佳发酵培养条件:玉米粉40 g/L,酵母粉3 g/L,MgSO4 0.6 g/L,K2HPO4 1.0 g/L,KH2PO4 1.5 g/L,温度25 ℃,最佳发酵pH=7,发酵周期为5 d,多糖产量为5.964 g/L。本研究为进一步开发毛韧革菌的药用价值,特别是其多糖的制备与应用提供了借鉴。
无明显清除效果,对DPPH自由基、·OH具有一定的清除效果。本研究还确定了毛韧革菌多糖最佳发酵培养条件:玉米粉40 g/L,酵母粉3 g/L,MgSO4 0.6 g/L,K2HPO4 1.0 g/L,KH2PO4 1.5 g/L,温度25 ℃,最佳发酵pH=7,发酵周期为5 d,多糖产量为5.964 g/L。本研究为进一步开发毛韧革菌的药用价值,特别是其多糖的制备与应用提供了借鉴。
[1] SUN T, ZHANG Y X, JIANG H, et al.Whole genome sequencing and annotation of Naematelia aurantialba (basidiomycota, edible-medicinal fungi)[J].Journal of Fungi (Basel, Switzerland), 2021, 8(1):6.
[2] 叶彬. 金耳菌种的分子鉴定及出菇实验[D].福州:福建农林大学, 2012.
YE B.Identification and cultivation of golden Tremella(Tremella aurantialba)[D].Fuzhou:Fujian Agriculture and Forestry University, 2012.
[3] 张雯, 瞿伟菁, 张晓玲, 邓云霞, 褚书地.金耳菌丝体多糖降血糖作用研究[J].营养学报, 2004, 26(4):300-303.
ZHANG W, QU W J, ZHANG X L, et al.The anti-hyperglycemic activity of polysaccharides from Tremella aurantialba mycelium[J].Acta Nutrimenta Sinica, 2004, 26(4):300-303.
[4] 张雯, 赵旌旌, 王捷思, 等.金耳菌丝体多糖对实验性2型糖尿病大鼠的降血糖作用研究[J].天然产物研究与开发, 2010, 22(1):49-53.
ZHANG W, ZHAO J J, WANG J S, et al.Hypoglycemic activity of polysaccharides extracted from Tremella aurantialba mycelia in experimental type 2 diabetic rats[J].Natural Product Research and Development, 2010, 22(1):49-53.
[5] 王宣东. 金耳多糖的提取、分离和纯化及抗氧化活性的研究[D].聊城:聊城大学, 2018.
WANG X D.Study on extraction, isolation and purification of polysaccharide from Tremella aurantialba and its antioxidant activity[D].Liaocheng:Liaocheng University, 2018.
[6] 汪虹, 瞿伟菁, 褚书地, 李明娟, 田翠平.金耳菌丝体多糖对小鼠高脂血症的防治作用[J].营养学报, 2002, 24(4):431-432;443.
WANG H, QU W J, CHU S D, et al.Studies on the preventive and therapeutic effects of the polysaccharide of Tremella aurantiabla mycelia on diet-induced hyperlipidemia in mice[J].Acta Nutrimenta Sinica, 2002, 24(4):431-432;443.
[7] 杜秀菊, 潘迎捷, 张劲松, 等.金耳菌丝体醇提物体外抗肿瘤抗病毒活性研究[J].食用菌学报, 2009, 16(4):39-42.
DU X J, PAN Y J, ZHANG J S, et al.Effect of ethanolic extracts of Tremella aurantialba mycelia on the proliferation of selected tumor cells and viruses in vitro[J].Acta Edulis Fungi, 2009, 16(4):39-42.
[8] 李志涛, 彭蕊, 朱冰清, 等.蛹虫草液体发酵培养基的研究[J].农业科技与装备, 2019(2):3-4;7.
LI Z T, PENG R, ZHU B Q, et al.Study on liquid fermentation medium of Cordyceps militaris[J].Agricultural Science & Technology and Equipment, 2019(2):3-4;7.
[9] SUN T, WANG R, SUN D F, et al.High-efficiency production of Tremella aurantialba polysaccharide through basidiospore fermentation[J].Bioresource Technology, 2020, 318:124268.
[10] ZHANG Q, LI Y, ZONG S, et al.Optimization of fermentation of fomes fomentarius extracellular polysaccharide and antioxidation of derivatized polysaccharides[J].Cellular and Molecular Biology, 2020, 66(7):56-65.
[11] YU Y, SHEN M Y, SONG Q Q, et al.Biological activities and pharmaceutical applications of polysaccharide from natural resources:A review[J].Carbohydrate Polymers, 2018, 183:91-101.
[12] ULLAH S, KHALIL A A, SHAUKAT F, et al.Sources, extraction and biomedical properties of polysaccharides[J].Foods (Basel, Switzerland), 2019, 8(8):304.
[13] ALBUQUERQUE P B S, DE OLIVEIRA W F, DOS SANTOS SILVA P M, et al.Skincare application of medicinal plant polysaccharides:A review[J].Carbohydrate Polymers, 2022, 277:118824.
[14] KAUP B A, EHRICH K, PESCHECK M, et al.Microparticle-enhanced cultivation of filamentous microorganisms:Increased chloroperoxidase formation by Caldariomyces fumago as an example[J].Biotechnology and Bioengineering, 2008, 99(3):491-498.
[15] DRIOUCH H, SOMMER B, WITTMANN C.Morphology engineering of Aspergillus niger for improved enzyme production[J].Biotechnology and Bioengineering, 2010, 105(6):1 058-1 068.
[16] 杨静静. 玉米粉对灵芝液体发酵的影响[D].无锡:江南大学, 2015.
YANG J J.Effect of corn powder on Ganoderma lucidum during fermentation[D].Wuxi:Jiangnan University, 2015.
[17] 姜浩, 孙涛, 姚皓昱, 等.食用真菌多糖的研究进展[J].食品工业科技, 2022, 43(12):447-456.
JIANG H, SUN T, YAO H Y, et al.Research progress of edible fungal polysaccharides[J].Science and Technology of Food Industry, 2022, 43(12):447-456.
[18] FENG J, FENG N, TANG Q J, et al.Optimization of Ganoderma lucidum polysaccharides fermentation process for large-scale production[J].Applied Biochemistry and Biotechnology, 2019, 189(3):972-986.
[19] TANG Y J, ZHU L L, LIU R S, et al.Quantitative response of cell growth and Tuber polysaccharides biosynthesis by medicinal mushroom Chinese truffle Tuber sinense to metal ion in culture medium[J].Bioresource Technology, 2008, 99(16):7 606-7 615.
[20] ZHU Z Y, LIU X C, DONG F Y, et al.Influence of fermentation conditions on polysaccharide production and the activities of enzymes involved in the polysaccharide synthesis of Cordyceps militaris[J].Applied Microbiology and Biotechnology, 2016, 100(9):3 909-3 921.