1979年ENDO等[1]在红曲霉发酵液中发现了一种能特异性地抑制胆固醇合成的物质,该物质与土曲霉(Aspergillus terreus)产的洛伐他汀(Lovastatin) 为同一物质,将其命名为莫纳可林K(Monacolin K,MK),是目前临床上被广泛应用的降胆固醇药物之一[2-3]。目前,功能红曲MK的生产均采用传统的三角瓶固态发酵,鉴于固态发酵存在诸多弊端,现阶段主要进行液态发酵的研究。由于红曲菌产MK的代谢机制尚未明晰,故只能借鉴土曲霉中MK合成的途径及酶系的鉴定和表征[4]。
甘油作为常用碳源之一,对红曲菌生长和代谢起着重要作用,且不会产生碳代谢物的阻遏效应[5]。目前采用甘油作碳源的液态发酵产MK,在摇瓶和15 L小型发酵罐中进行的试验已取得成功[6],但甘油作为发酵原料,既不符合GB 2760—2014《食品安全国家标准 食品添加剂使用标准》,也不符合QB/T 2847—2007《功能性红曲米(粉)》,无法量产,而采用纯谷物淀粉为碳源的液态发酵,MK产量不足100 mg/L,产量低,成本高,亦无法量产。目前将表面活性剂作为发酵促进剂的研究越来越多,主要应用在以发酵法生产酶制剂[7]、氨基酸[8]、新材料[9-10]等工业领域,但上述研究均以传统的表面活性剂为主,新型的表面活性剂的应用研究不多[11]。近年来的研究表明,在液态发酵过程中加入非离子表面活性剂,通过萃取发酵的模式可以提高次级代谢产物的产量,并且不同的非离子型表面活性剂对细胞的生长与代谢机制不同[12-15]。然而, CHEN等[16]发现,聚乙二醇PEG-4000作为萃取剂,在发酵过程中并没有明显的效果。为此本文拟研究聚乙二醇(polyethylene glycol,PEG)对紫色红曲菌TY02发酵过程中MK产量的影响,探讨PEG对紫色红曲菌TY02的代谢调控机理,以期对符合标准且可利用谷物淀粉作为碳源的原料进行发酵,能大幅提高红曲菌代谢的MK产量,降低成本,从而为实现功能红曲液态发酵的量产提供理论参考。
1 材料与方法
1.1 实验材料
1.1.1 实验菌株
紫色红曲菌(Monascus purpureus)TY02,广东天益生物科技有限公司保藏于中国典型培养物保藏中心,保藏编号CCTCC M2018586。
1.1.2 实验仪器
HWY-2112型双层恒温培养摇床,上海智城分析仪器制造有限公司;LC-20AD高效液相色谱仪、SPD-20A紫外分光检测器,日本岛津仪器有限公司;SW-CJ-1FD型超净化工作台,苏州净化器设备有限公司;LS-B50L型立式蒸汽灭菌锅,上海医用核子仪器厂;LXJ-ⅡB型低速大容量多管离心机,上海安亭科学仪器厂;DHG-9140A型鼓风干燥箱、HWS-28型电热恒温水浴锅、LRH-150型生化培养箱,上海一恒科学仪器有限公司;B2200S型超声波清洗器,必能信超声(上海)有限公司;MP502B型电子天平,上海精密实验器材有限公司。
1.2 培养基
斜面培养基:12°Bx麦芽汁培养基。
种子培养基(g/L):葡萄糖60,蛋白胨25,玉米浆10,NaNO3 2,MgSO4·7H2O 1,K2HPO4·3H2O 1.5,pH值自然。
发酵培养基(g/L):黏米粉80,大豆水解液45,玉米浆5,NaNO3 5,MgSO4·7H2O 1.25,K2HPO4·3H2O 2.5,pH 4.5。
上述培养基均121 ℃灭菌30 min。
1.3 培养条件及方法
斜面培养:挑取1环菌种接种于斜面培养基中,在30 ℃培养箱中培养至菌丝长满斜面。
种子液培养:用10 mL无菌水洗涤试管斜面孢子,接种至100 mL种子液培养基的500 mL三角瓶中,在30 ℃、180 r/min的旋转摇床上培养48 h。
液体摇瓶发酵培养:将种子液按10%(体积分数)接种量接种于装有100 mL发酵培养基的500 mL三角瓶中,在30 ℃、180 r/min的旋转摇床上培养3 d,然后于25 ℃发酵至第22天。
1.4 主因素效应实验设计
选取对MK代谢影响较大的黏米粉、PEG-2000、大豆水解液、玉米浆、MgSO4·7H2O、NaNO3、K2HPO4·3H2O作为Plackett-Burman设计的7个因素,每个因素取2个水平,高水平为低水平的1.5倍,实验设计见表1。
表1 Plackett-Burman设计试验各因素及其水平取值
Table 1 Levels of factors for Plackett-Burman design

代码因素高水平(+1)低水平(-1)X1黏米粉/(g·L-1)9060X2PEG-2000/(g·L-1)128X3大豆水解液/(g·L-1)52.535X4玉米浆/(g·L-1)64X5MgSO4·7H2O/(g·L-1)1.51X6NaNO3/(g·L-1)64X7K2HPO4·3H2O/(g·L-1)32
1.5 发酵液的预处理
固液分离:发酵液经抽真空过滤,分离得菌体和滤液,菌体再经蒸馏水洗涤2~3次,再过滤得菌体,并收集滤液。首次分离得到的滤液与洗涤所得的滤液汇总,用于后续实验,并统计加入的蒸馏水数量,以便确定体积的换算系数。菌体经低温干燥及粉碎得固态产品。
PEG的去除:在固液分离得到的滤液中,分别加入0.005 mol/L K4[Fe(CN)6]溶液使终质量浓度为0.01 g/L(此为初始培养基中PEG为5 g/L时的用量,其余浓度PEG的溶液添加量可依此类推),0.01 mol/L NaCl 0.4 g/L,搅拌均匀,静置沉淀10 min,抽真空过滤,分离后取滤液、弃渣。
过量K4[Fe(CN)6]的去除:在上述滤液中,加入0.005 mol/L ZnSO4溶液使终质量浓度为0.05 g/L(此为初始培养基中PEG为5 g/L时的用量,其余浓度PEG的溶液添加量可依此类推),搅拌均匀,静置沉淀10 min,抽真空过滤,分离后取滤液、弃渣,备用。
1.6 分析方法
菌体量的测定:菌体量采用干重法测定,用3层纱布过滤发酵液,蒸馏水洗涤2~3次,拧干,在60 ℃烘箱中烘干至恒重,生物量按公式(1)计算[17]:
生物量![]()
(1)
发酵液的预处理:称取发酵液5 g,加入35 mL 75%分析纯乙醇,超声波萃取50 min,然后再加入适量的75%分析纯乙醇,再超声波萃取10 min,冷却后定容至50 mL,3 500 r/min离心10 min,然后用0.45 μm的有机微孔滤膜过滤,滤液用于测定MK,测定的MK为总MK。胞外MK的测定以发酵醪液经过滤后的滤液为样品,样品预处理方法和测定方法与总MK测定相同。
色谱条件:色谱柱:C18柱(250 mm×4.6 mm);柱温:20~25 ℃;紫外检测器SPD-20A:检测波长238 nm;流动相:V(甲醇)∶V(水)∶V(磷酸)=385∶115∶0.14;流速1.0 mL/min;进料量20 μL。
MK参照QB/T 2847—2007《功能性红曲米(粉)》中的方法测定;PEG参照文献[18]的方法测定;K4[Fe(CN)6]参照GB/T 13025.10—2003中的方法测定。
2 结果与分析
2.1 PEG分子质量对紫色红曲菌TY02生长和 MK代谢的影响
在发酵初始时(0 d)分别添加0.5 g/L PEG-400、PEG-600、PEG-800、PEG-1000、PEG-2000、PEG-4000、PEG-6000进行培养,菌体生物量、MK的质量浓度与PEG分子质量的关系如图1所示。

图1 PEG的分子质量对紫色红曲菌TY02生长和 MK代谢的影响
Fig.1 Effect of molecular weight of PEG on the growth and MK metabolism of Monascus purpureus TY02
由图1可知,随着添加PEG分子质量的增加,紫色红曲菌TY02的生长与代谢均呈递增趋势,体现在菌体生物量与产MK均呈正增长,至分子质量达到2 kDa时,菌体生物量与产MK均达极值,此时生物量为46.70 g/L,MK产量为469 mg/L,分别为对照生物量(32.28 g/L)的1.45倍和MK产量(63 mg/L)的7.44倍,此后,随着分子质量的进一步提高,生物量与MK会逐步下降,说明分子质量过大会抑制菌体的生长和MK的分泌。
2.2 PEG-2000浓度对TY02的MK代谢影响
在发酵初始时(0 d)分别添加0、0.5、1、5、10、15、20 g/L的PEG-2000进行培养,MK的产量与发酵时间的关系如图2所示。

图2 PEG-2000含量对紫色红曲菌TY02的MK代谢影响
Fig.2 Effect of PEG-2000 concentration on the MK metabolism of M.purpureus TY02
由图2可知,在发酵初始时(0 d)加入不同含量的PEG-2000,紫色红曲菌TY02的MK产量均呈正增长,对产MK的影响顺序为10>15>5>20>1>0.5>0 g/L,其中添加10 g/L PEG-2000时MK产量最高达845 mg/L,为对照(81 mg/L)的10.43倍,在发酵8~16 d,MK产率最高,18 d为拐点,此后,产MK趋向平稳,发酵周期为20~22 d。
2.3 PEG-2000添加时间节点对TY02生长和MK代谢的影响
在发酵0、2、4、6、8、10、12 d分别添加PEG-2000 10 g/L进行培养,菌体生物量、MK产量与PEG-2000添加时间的关系如图3所示。

图3 PEG-2000添加时间节点对紫色红曲菌TY02生长和MK代谢的影响
Fig.3 Effect of PEG-2000 addition time on the growth and MK metabolism of M. purpureus TY02
由图3可知,在不同发酵节点添加PEG-2000,紫色红曲菌TY02的细胞生长与MK代谢受到不同程度的影响。与对照相比,分别在0、2、4、6、8、10、12 d添加,菌体生物量均增加,MK的产量均得到提高,在0 d时添加PEG-2000时,生物量和MK产量达到最大值,此时生物量为60.62 g/L,MK产量为845 mg/L,分别比对照增加了81.44%和943.21%,故得到PEG-2000最佳的添加时间节点为发酵初始时(0 d)。
2.4 PEG-2000对紫色红曲菌TY02总MK、胞外MK产量以及胞外MK占比的影响
在发酵初始时(0 d)添加10 g/L PEG-2000进行培养,MK的质量浓度、胞外MK占比与发酵时间的关系如图4所示。
由图4可知,紫色红曲菌TY02在发酵初始时(0 d)添加0、10 g/L的PEG-2000,其MK代谢的总MK与胞外MK的变化趋势基本一致,发酵22 d,其产总MK、胞外MK分别为81、34、845、682 mg/L,后者产总MK、胞外MK分别为前者的10.43、20.06倍;胞外MK占比的代谢趋势,前者与后者亦基本上一致,发酵22 d,分别为41.98%、80.71%,后者为前者的1.92倍。可见发酵初始时(0 d)添加10 g/L PEG-2000能大幅提高紫色红曲菌TY02的MK产量和胞外MK的占比,这与谭海玲[19]研究的红曲霉产黄色素的发酵类似。
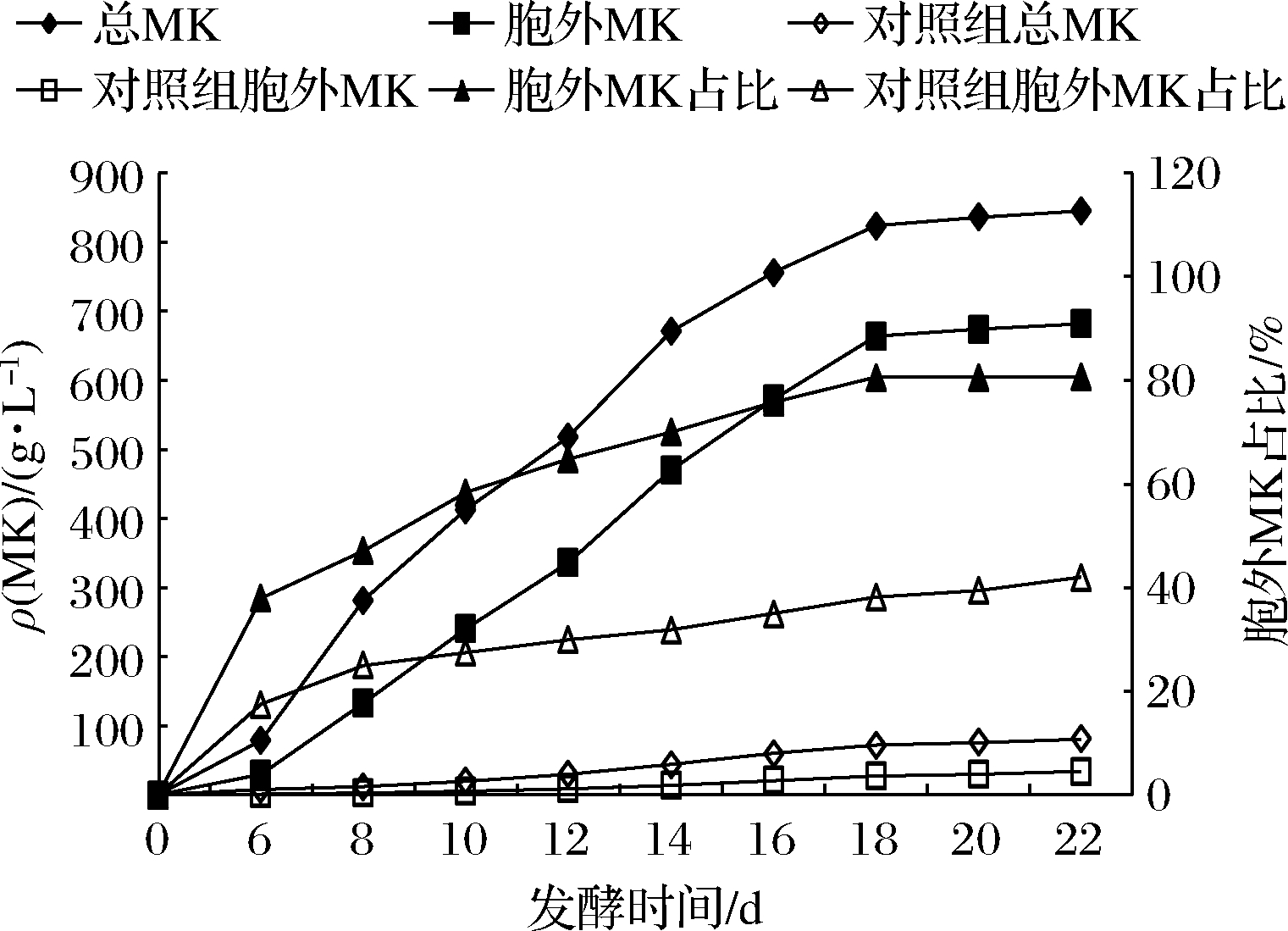
图4 PEG-2000对紫色红曲菌TY02总MK、胞外MK产量以及胞外MK占比的影响
Fig.4 Effect of PEG-2000 on the concentration of total MK, extracellular MK and the proportion of extracellular MK in MK metabolism of M.purpureus TY02
2.5 紫色红曲菌TY02发酵过程
在发酵开始时(0 d)添加10 g/L PEG-2000进行培养,MK的质量浓度、pH值、菌丝体生物量与发酵时间的关系如图5所示,整个发酵过程,pH先上升,最高至6.91,然后略有下降,至6.6左右时渐趋平稳;当pH<6.0时紫色红曲菌TY02主要处于生长期,pH>6.0时则处于MK合成代谢期;当发酵至8 d,菌体合成MK开始加速,10~16 d为MK合成代谢的高峰期,18 d为合成MK的拐点,此后渐趋平稳,第22天时MK达最高值(845 mg/L)。
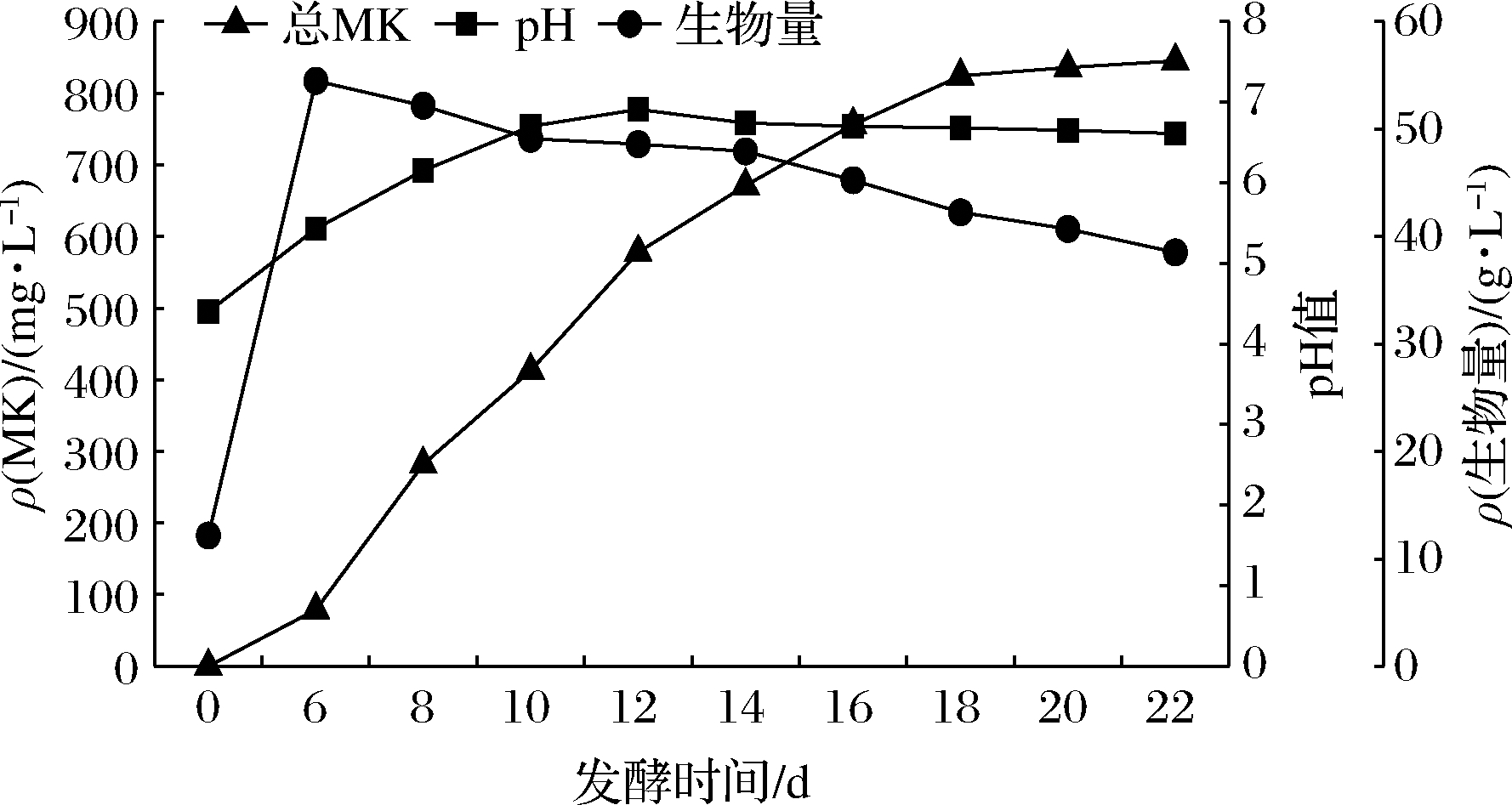
图5 MK的质量浓度、pH值、菌体生物量与发酵时间的关系
Fig.5 Relationship between MK mass concentration, pH,cell biomass and fermentation time
由图5可知,发酵至第6天,菌体生物量达最大值(54.49 g/L),此后生物量逐渐下降,下降至52.17 g/L时,即发酵8 d,MK合成开始加速;生物量处于49.09~45.23 g/L(发酵10~16 d),为MK合成的旺盛期;当生物量降至42.24 g/L(发酵18 d),MK合成出现拐点;当生物量降至38.52 g/L(发酵22 d),紫色红曲菌TY02产MK达最大值(845 mg/L),从生物量与MK合成的关系可知,功能红曲液态发酵为典型的次级代谢,这与童振宇等[20]的研究结果相符合。
2.6 影响MK代谢重要因素的确定[21]
按Plackett-Burman实验设计共进行12个实验,用Minitab17软件对所得到的实验数据进行分析,实验设计结果及因素效应分析见表2和表3。
表2 Plackett-Burman实验设计及结果
Table 2 The Plackett-Burman design matrix and experimental results

试验序号X1X2X3X4X5X6X7MK/(mg·L-1)1-1-1-1+1+1+1-15362+1+1-1+1-1-1-16013+1-1-1-1+1+1+15234+1-1+1+1-1+1-14575-1-1+1+1+1-1+13986+1+1-1+1+1-1+17267+1-1+1-1-1-1+12858+1+1+1-1+1+1-17819-1-1-1-1-1-1-135210-1+1-1-1-1+1+166411-1+1+1-1+1-1-153912-1+1+1+1-1+1+1640
表3 因素主效应分析
Table 3 Analysis sheet of major factor
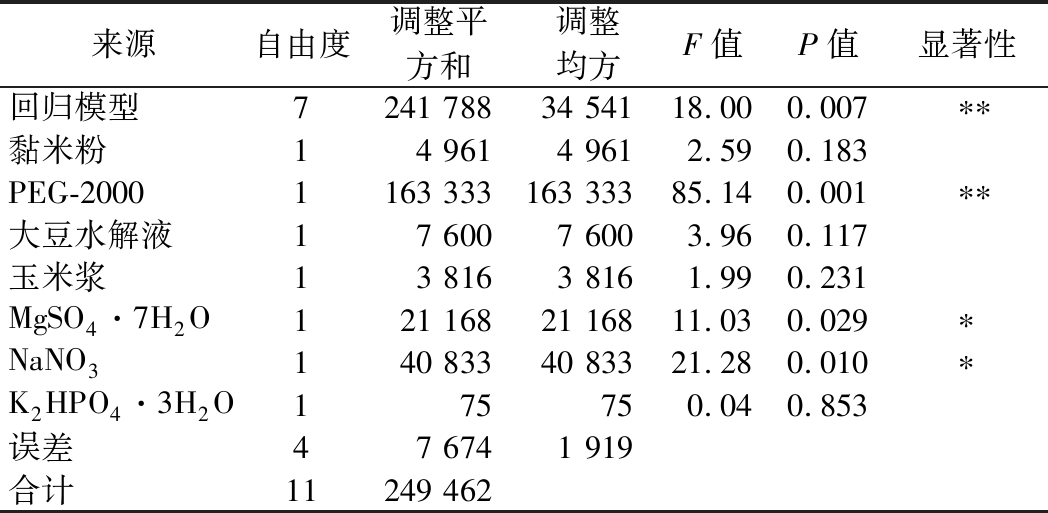
来源自由度调整平方和调整均方F值P值显著性回归模型7241 78834 54118.000.007∗∗黏米粉14 9614 9612.590.183PEG-20001163 333163 33385.140.001∗∗大豆水解液17 6007 6003.960.117玉米浆13 8163 8161.990.231MgSO4·7H2O121 16821 16811.030.029∗NaNO3140 83340 83321.280.010∗K2HPO4·3H2O175750.040.853误差47 6741 919合计11249 462
注:*表示差异显著(P<0.05),**表示差异极显著(P<0.01)
通过Minitab17对实验结果进行统计分析,拟合一次回归方程为:
Y=-596+1.356X1+58.33X2-2.88X3+17.8X4+168X5+58.33X6-5.0X7
(2)
其中响应值Y为MK的质量浓度,模型汇总R-sq为96.92%,这表明,通过一次模型方程得到的响应值的可信度达到96.92%,同时模型也极显著(P=0.007<0.01),说明响应值与变量之间存在极显著的线性关系。从表3可知,MgSO4·7H2O、NaNO3、PEG-2000的P值分别为0.029、0.010、0.001,影响程度分别为显著、显著、极显著。在本文的研究范围内,上述3个因子对MK代谢影响最大,为主效因子,其中PEG-2000的影响达到极显著。
2.7 发酵液的预处理效果
在发酵初始时(0 d)分别添加0.5、1、5、10、15、20 g/L的PEG-2000进行培养,然后按照1.5的方法进行发酵液的预处理,发酵液中PEG残留浓度及预处理检测结果见表4。
表4 发酵液预处理后的检测结果
Table 4 Detection results after pretreatment of fermentation broth
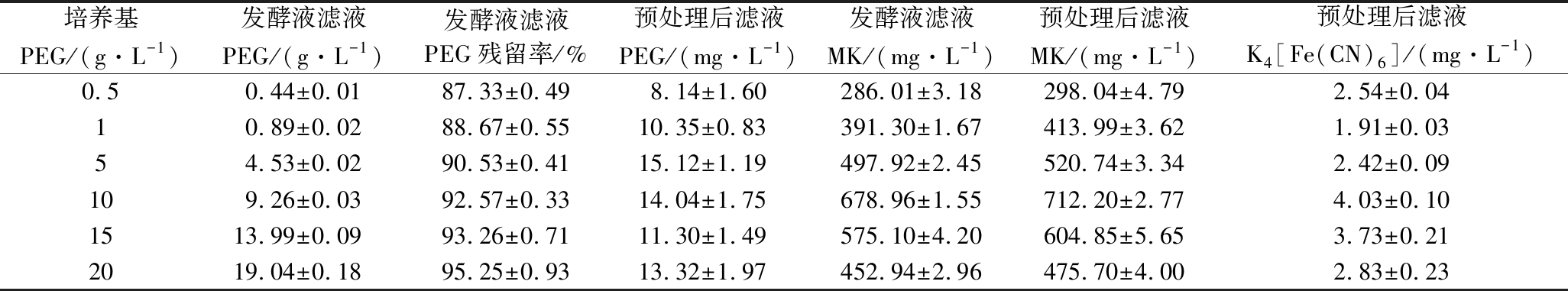
培养基PEG/(g·L-1)发酵液滤液PEG/(g·L-1)发酵液滤液PEG残留率/%预处理后滤液PEG/(mg·L-1)发酵液滤液MK/(mg·L-1)预处理后滤液MK/(mg·L-1)预处理后滤液K4[Fe(CN)6]/(mg·L-1)0.50.44±0.0187.33±0.498.14±1.60286.01±3.18298.04±4.792.54±0.0410.89±0.0288.67±0.5510.35±0.83391.30±1.67413.99±3.621.91±0.0354.53±0.0290.53±0.4115.12±1.19497.92±2.45520.74±3.342.42±0.09109.26±0.0392.57±0.3314.04±1.75678.96±1.55712.20±2.774.03±0.101513.99±0.0993.26±0.7111.30±1.49575.10±4.20604.85±5.653.73±0.212019.04±0.1895.25±0.9313.32±1.97452.94±2.96475.70±4.002.83±0.23
从表4可知,非离子表面活性剂PEG在发酵结束后的发酵液中的残留率为87.33%~95.25%,并随着PEG添加量的增加而逐步上升。添加K4[Fe(CN)6]沉淀PEG,分离后得滤液,滤液中过量的K4[Fe(CN)6]再添加ZnSO4进行沉淀,再次分离得滤液,测定滤液中PEG的残留量为8.14~15.12 mg/L,符合GB 2760—2014《食品安全国家标准 食品添加剂使用标准》,测定预处理后的滤液中K4[Fe(CN)6]的残留量为1.91~4.03 mg/L,也符合上述标准的要求。同时预处理后的滤液中的MK较处理前提高了4.21%~5.80%,说明预处理过程没有对MK造成损失,反而提高了滤液的纯度。
3 结论
实验结果表明,PEG对紫色红曲菌TY02液态发酵产MK有重要的影响。分子质量为2 000 Da、浓度为10 g/L的聚乙二醇对紫色红曲菌TY02的MK代谢影响最大。在发酵初始时(0 d)分别添加0、10 g/L的PEG-2000,紫色红曲菌TY02产MK、胞外MK占比分别为81 mg/L、41.98%和845 mg/L、80.71%,添加10 g/L PEG-2000组的产MK、胞外MK占比为对照组的10.43倍、1.92倍。在Plackett-Burman实验设计筛选重要影响因子的实验中,筛选出的主效因子分别为MgSO4·7H2O、NaNO3、PEG-2000,其P值分别为0.029、0.010、0.001,为重要的影响因子,且均为正效应,其中PEG-2000对紫色红曲菌TY02的MK代谢影响极显著。采用Minitab17拟合的一次模型方程得到的响应值可信度达到96.92%。PEG-2000作发酵原料虽符合标准,但因红曲菌利用PEG较难,且产品中残留过高含量的PEG亦不利于保健食品的生产。为此,对发酵液进行了预处理,预处理后滤液的相关指标检测结果符合标准。综上,PEG可大幅提高紫色红曲菌TY02胞外MK的代谢占比,部分解除了胞内代谢物的反馈抑制,从而大幅提高MK代谢能力,突破了无甘油液态发酵功能红曲低产MK而无法量产的技术瓶颈。研究结果可为非甘油原料的液态发酵功能红曲的量产提供技术参考,鉴于PEG能够明显促进红曲菌MK的代谢合成,因此,从基因表达和代谢调控途径上研究PEG促进MK代谢的机理具有现实意义。
[1] ENDO A.Monacolin K, a new hypocholesterolemic agent produced by a Monascus species[J].The Journal of Antibiotics, 1979, 32(8):852-854.
[2] MANZONI M, ROLLINI M.Biosynthesis and biotechnological production of statins by filamentous fungi and application of these cholesterol-lowering drugs[J].Applied Microbiology and Biotechnology, 2002, 58(5):555-564.
[3] BARRIOS-GONZ LEZ J, MIRANDA R U.Biotechnological production and applications of statins[J].Applied Microbiology and Biotechnology, 2010, 85(4):869-883.
LEZ J, MIRANDA R U.Biotechnological production and applications of statins[J].Applied Microbiology and Biotechnology, 2010, 85(4):869-883.
[4] HENDRICKSON L, DAVIS C R, ROACH C, et al.Lovastatin biosynthesis in Aspergillus terreus:Characterization of blocked mutants, enzyme activities and a multifunctional polyketide synthase gene[J].Chemistry & Biology, 1999, 6(7):429-439.
[5] MIYAKE T, UCHITOMI K, ZHANG M Y, et al.Effects of the principal nutrients on lovastatin production by Monascus pilosus[J].Bioscience, Biotechnology, and Biochemistry, 2006, 70(5):1 154-1 159.
[6] 陈晔, 朱华, 许赣荣.红曲霉9901液态发酵产莫纳可林K的发酵条件[J].食品与发酵工业, 2004, 30(1):57-61.
CHEN Y, ZHU H, XU G R.Liquid fermentation of Monascus sp.9901 to produce monacolin K[J].Food and Fermentation Industries, 2004, 30(1):57-61.
[7] ÜREK R Ö, PAZARLIO LU N K.Production and stimulation of manganese peroxidase by immobilized Phanerochaete chrysosporium[J].Process Biochemistry, 2005, 40(1):83-87.
LU N K.Production and stimulation of manganese peroxidase by immobilized Phanerochaete chrysosporium[J].Process Biochemistry, 2005, 40(1):83-87.
[8] DUPERRAY F, JEZEQUEL D, GHAZI A, et al.Excretion of glutamate from Corynebacterium glutamicum triggered by amine surfactants[J].Biochimica et Biophysica Acta (BBA) - Biomembranes, 1992, 1 103(2):250-258.
[9] GALINDO E, SALCEDO G.Detergents improve xanthan yield and polymer quality in cultures of Xanthomonas campestris[J].Enzyme and Microbial Technology, 1996, 19(2):145-149.
[10] ALKASRAWI M, ERIKSSON T, BÖRJESSON J, et al.The effect of Tween-20 on simultaneous saccharification and fermentation of softwood to ethanol[J].Enzyme and Microbial Technology, 2003, 33(1):71-78.
[11] 卫云路, 宁正祥, 郑成.新型表面活性剂在谷氨酸发酵中的应用[J].现代食品科技, 2009, 25(3):289-295.
WEI Y L, NING Z X, ZHENG C.Application of new-type surfactants in the glutamate acid fermentation by Corynebacterium glutamicum T-613[J].Modern Food Science and Technology, 2009, 25(3):289-295.
[12] 胡志强. 表面活性剂胶束溶液中萃取发酵红曲色素的研究[D].广州:华南理工大学, 2013.
HU Z Q.Study on extractive fermentation for production of Monascus pigments in nonionic surfactant micelle aqueous solution[D].Guangzhou:South China University of Technology, 2013.
[13] 康碧玉. 红曲霉菌萃取发酵及其次级代谢产物的调控[D].广州:华南理工大学, 2014.
KANG B Y.Monascus extraction fermentation and regulation of the secondary metabolites[D].Guangzhou:South China University of Technology, 2014.
[14] 熊旭. 红曲色素转化及低桔霉素的发酵调控[D].广州:华南理工大学, 2015.
XIONG X.Fermentation control for transformation of Monascus pigments and low citrinin contents[D].Guangzhou:South China University of Technology, 2015.
[15] 王博. 红曲霉菌油脂与色素代谢关联及其静息培养体系的建立[D].广州:华南理工大学, 2016.
WANG B.Investigation of the relationship between the biosynthise of Monascus lipid and pigments and the establishment of resting-cell culture system of Monascus[D].Guangzhou:South China University of Technology,2016.
[16] CHEN G, BEI Q, SHI K, et al.Saturation effect and transmembrane conversion of Monascus pigment in nonionic surfactant aqueous solution[J].AMB Express, 2017, 7(1):24.
[17] 邱源, 周立平, 嘉晓勤.红色红曲菌液态发酵产Monacolin K重要影响因素的研究[J].酿酒科技, 2010(5):47-50.
QIU Y, ZHOU L P, JIA X Q.Study on the important factors influencing monacolin K production by liquid fermentation of Monascus ruber GM011[J].Liquor-Making Science & Technology, 2010(5):47-50.
[18] 谭天伟, 沈忠耀.生物及食品物料中聚乙二醇含量的测定[J].食品与发酵工业, 1990, 16(4):44-48.
TAN T W, SHEN Z Y.Determination of polyethyleneglycol in biomaterials and foods[J].Food and Fermentation Industries, 1990, 16(4):44-48.
[19] 谭海玲. PEG表面活性剂促进胞外红曲黄色素代谢与产物活性鉴定及可食用薄膜制备[D].广州:华南理工大学, 2019.
TAN H L.Study on PEG promoting metabolism of extracellular yellow Monascus pigments and production activities and preparation of edible films[D].Guangzhou:South China University of Technology, 2019.
[20] 童振宇, 周立平, 陈旭峰.响应面法优化红曲霉菌株Monascus purpureus WX液态发酵产Monacolin K工艺条件[J].浙江工业大学学报, 2007, 35(1):35-40.
TONG Z Y, ZHOU L P, CHEN X F.Enhance of Monacolin K production by response surface methodology of Monascus purpureus WX[J].Journal of Zhejiang University of Technology, 2007, 35(1):35-40.
[21] 王诗然, 赵世光, 薛正莲, 等.Plackett-Burman设计在漆酶发酵培养基主要影响因子筛选中的应用[J].安徽工程科技学院学报(自然科学版), 2010, 25(2):14-17.
WANG S R, ZHAO S G, XUE Z L, et al.Application of Plackett-Burman design for screening key factors on laccase fermentation medium[J].Journal of Anhui University of Technology and Science (Natural Science), 2010, 25(2):14-17.