生物胺是一类主要存在于发酵食品中具有生物活性的低分子碱性含氮化合物[1]。在食品或葡萄酒发酵过程中,相应的微生物利用前体物质氨基酸脱羧形成生物胺[2-3]。作为许多生物大分子的前体物,适量的生物胺可以提高人体免疫力,有增强血管活性等生理作用[4]。但过量摄入生物胺,可能会对人体产生毒性作用(头痛、低血压、心悸、呕吐),具体表现取决于个人的敏感性[5-6]。
葡萄酒酒精发酵过程中,存在着甲胺、乙胺、苯乙胺、异戊胺和尸胺等胺类物质[7-8],但在此发酵过程中,这些生物胺能够被微生物降解;而在苹果酸乳酸发酵(malolactic fermentation,MLF)过程中,生物胺主要来源于乳酸菌对葡萄酒中游离氨基酸的脱羧作用[9]。目前,控制发酵食品中生物胺的方式主要为优化生产工艺以及高压、冷冻等物理方法[10-12],但这些方法具有一定的局限性,无法控制发酵过程中生成的生物胺。研究发现,如果生物胺已经存在于传统发酵食品中,或当生物胺的产生基于本地微生物群落时,胺降解菌株的应用将有助于降低这些风险[13-14]。因此,通过接种具有生物胺降解功能的乳酸菌来控制葡萄酒MLF过程中产生的生物胺是有效的手段。而从乳酸菌中筛选出具有生物胺降解菌株,不仅避免了生物胺积累的风险,还可作为发酵剂应用于多种发酵食品中,以及作为益生菌可在人体中发挥益生功能,同时为探究生物胺降解机理提供参考依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
实验室自酿葡萄酒、白酒酒醅,宁夏食品微生物应用技术与安全控制重点实验室保存。
氨基酸:鸟氨酸、赖氨酸、精氨酸、酪氨酸、色氨酸、苯丙氨酸、组氨酸(均为分析纯),上海阿拉丁试剂有限公司。
生物胺标准品:组胺、精胺、亚精胺、尸胺,上海源叶生物科技有限公司;色胺、腐胺、酪胺(纯度均≥98%)、丹磺酰氯(纯度≥99%),西格玛奥德里奇中国公司。
试剂:K2HPO4、KH2PO4、无水乙酸钠、NaCl(均为分析纯);乙腈、甲醇(均为色谱级);丙酮(分析纯),天津大茂化学试剂厂。
1.1.2 培养基的制备
MRS培养基(g/L):蛋白胨 10.0,牛肉浸粉8.0,酵母浸粉 4.0,葡萄糖 20.0,乙酸钠 5.0,柠檬酸二铵 2.0,吐温-80 1.0,K2HPO4 2.0,MgSO4·7H2O 0.2,MnSO4·H2O 0.04,pH 调至5.5。
生物胺显色培养基[15](g/L):MgSO4 0.4,MnSO4 0.3,FeSO4·7H2O 0.04,柠檬酸三铵2,CaCO3 0.1,K2HPO4 2,5-磷酸吡哆醛2,维生素B1 0.01,氨基酸(组氨酸、酪氨酸、色氨酸、赖氨酸、苯丙氨酸、酪氨酸)1,溴甲酚紫 0.06,pH 调至5.5。
以上培养基均121 ℃灭菌15 min。
1.1.3 仪器与设备
W-CJ-2FD超净工作台,苏州安泰空气技术有限公司;YXQ-LS-50SII立式压力蒸汽灭菌器、BSD-150生化培养箱,上海博讯实业有限公司医疗设备;PHSJ-3F型 pH 计,上海仪电科学仪器股份有限公司;PR224ZH电子天平,奥豪斯仪器(常州)有限公司;WH-861涡旋振荡器,太仓市华利达实验设备有限公司;EX30生物显微镜,舜宇光学科技有限公司;5430R高速冷冻离心机,德国Eppendorf公司;Agilent 1260高效液相色谱仪、C18色谱柱(4.6 mm×250 mm×5 μm ),美国Agilent公司。
1.2 实验方法
1.2.1 降生物胺乳酸菌的筛选
1.2.1.1 初筛
分别称取适量酒醅和葡萄酒酒样于100 mL无菌生理盐水中,于37 ℃培养箱中振荡培养30 min。吸取悬浮液并梯度稀释至10-6,然后吸取100 μL适宜梯度的稀释液分别均匀涂布于MRS固体培养基上,37 ℃培养32~48 h,选取乳酸菌相似形态菌株,进行划线分离并纯化,保存。
将纯化菌株接种于MRS液体培养基中进行活化,调整菌液浓度为1×108 CFU/mL,预先在96孔无菌板中加入1 mL生物胺显色培养基,吸取100 μL菌液,转接于96孔无菌培养板中,37 ℃培养48 h后,以不接种的培养基为空白对照,记录实验结果。观察培养基颜色的变化,显棕红色或紫色的为阳性(产胺菌),不变色即黄色为阴性(不产胺菌),设置3个平行实验。将阴性菌落挑出,在对应的培养基上划线分离纯化3次,然后于4 ℃保藏备用。
1.2.1.2 复筛
将初筛菌株接于MRS液体培养基中活化2~3代,并调整菌液浓度为108 CFU/mL,按接种量2%(体积分数,下同)接种至含6种生物胺的MRS液体培养基中,以不接种菌株的含生物胺MRS液体培养基为空白组。将培养液37 ℃静置培养24 h。24 h后于10 000 r/min离心5 min取上清液,采用高效液相色谱法测定生物胺含量,并与空白组进行对照,选取降解生物胺种类多且降解能力好的菌株作为生物胺降解菌株。生物胺降解率按公式(1)计算:
生物胺降解率![]()
(1)
式中:ρ0,对照中生物胺浓度,mg/L;ρ1,反应后生物胺浓度,mg/L。
1.2.2 生物胺含量的测定
1.2.2.1 标准曲线的测定
参考GB 5009.208—2016《食品安全国家标准 食品中生物胺的测定》,将质量浓度为1 mg/mL生物胺(尸胺、腐胺、组胺、色胺、精胺、酪胺)标准储备液用0.1 mol/L盐酸稀释定容,配制为100 mg/L的生物胺标准混合使用液。将上述使用液梯度稀释为2.5、10、15、25、50 mg/L的生物胺系列溶液,按照衍生方法衍生后测定。
1.2.2.2 生物胺降解率的测定
衍生方法参考文献[16-17],将含生物胺的菌株培养液8 000 r/min离心5 min,取上清液,精确吸取1 mL待测样液,依次加入0.2 mL的NaOH溶液(2 mol/L)使反应液呈碱性,0.3 mL的饱和NaHCO3缓冲液,及2 mL丹磺酰氯衍生溶液(10 mg/mL)。漩涡振荡60 s后置于40 ℃水浴锅中,避光反应45 min,期间每15 min取出漩涡振荡60 s,加入100 μL氨水终止反应,并于室温下避光静置25 min后用乙腈定容至5 mL,5 500 r/min离心5 min,取上清液过0.22 μm滤膜待测。
1.2.2.3 高效液相色谱条件
色谱分离条件参考徐洁[18]的方法,色谱柱为Agilent 5 TC C18柱(4.6 mm×250 mm,5 μm),流动相A为乙腈,B为超纯水,柱温30 ℃,进样量20 μL,流速0.8 mL/min,紫外检测波长254 nm。洗脱程序如表1所示。
表1 HPLC测定生物胺的洗脱程序
Table 1 Elution procedure of biogenic amines by HPLC
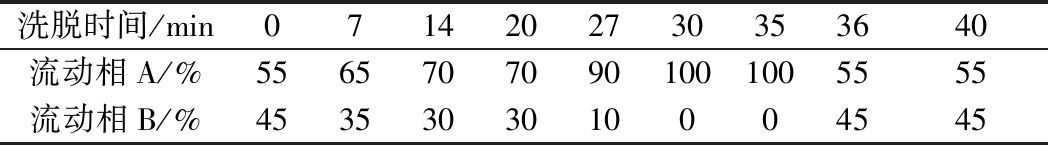
洗脱时间/min0714202730353640流动相A/%55657070901001005555流动相B/%4535303010004545
1.2.3 降生物胺乳酸菌的鉴定
将活化菌株接种于MRS液体培养基中,37 ℃培养18 h;4 ℃,8 000 r/min离心10 min获取菌泥,参照细菌基因组DNA提取试剂盒(天根生化科技有限公司)提取菌株DNA,采用通用引物(27F:5′-AGAGTTTGATCCTGGCTCAG-3′;1492R:5′-CTACGGCTACCTTGTTACGA-3′)对生物胺降解菌的16S rDNA进行PCR扩增,PCR纯化后采用1%琼脂糖凝胶电泳检测后,送往生工生物工程(上海)股份有限公司测序,所得序列与NCBI数据库序列进行比对,以确定菌株种属。
1.2.4 降生物胺乳酸菌的降解特性研究
1.2.4.1 降生物胺乳酸菌的生长曲线及其产酸能力
将活化两代的菌液以2%接种量接种至MRS液体培养基中,每2 h测定菌株在600 nm波长下OD值及pH值,设置空白对照组,每组3个平行实验。
1.2.4.2 降生物胺乳酸菌酸耐受性及降解生物胺能力的测定
将菌株于MRS液体培养基中活化,以2%接种量分别接种于pH为3.5、4、4.5、5的生物胺混合培养基中,37 ℃培养48 h,在600 nm波长下测定其OD值。5 500 r/min离心5 min,取上清液1 mL过0.22 μm滤膜待测。
1.2.4.3 降生物胺乳酸菌乙醇耐受性及降解生物胺能力的测定
将菌株于MRS液体培养基中活化,以2%接种量分别接种于乙醇含量为8%、10%、12%的生物胺混合培养基中,37 ℃培养48 h,在600 nm波长下测定其OD值。5 500 r/min离心5 min,取上清液1 mL过0.22 μm滤膜待测。
2 结果与分析
2.1 生物胺标准品图谱及标准曲线的制作
采用高效液相色谱法测定6种生物胺,从图1可以看出,6种生物胺在37 min内得到了很好的分离,并依此确定各生物胺标准品的保留时间。
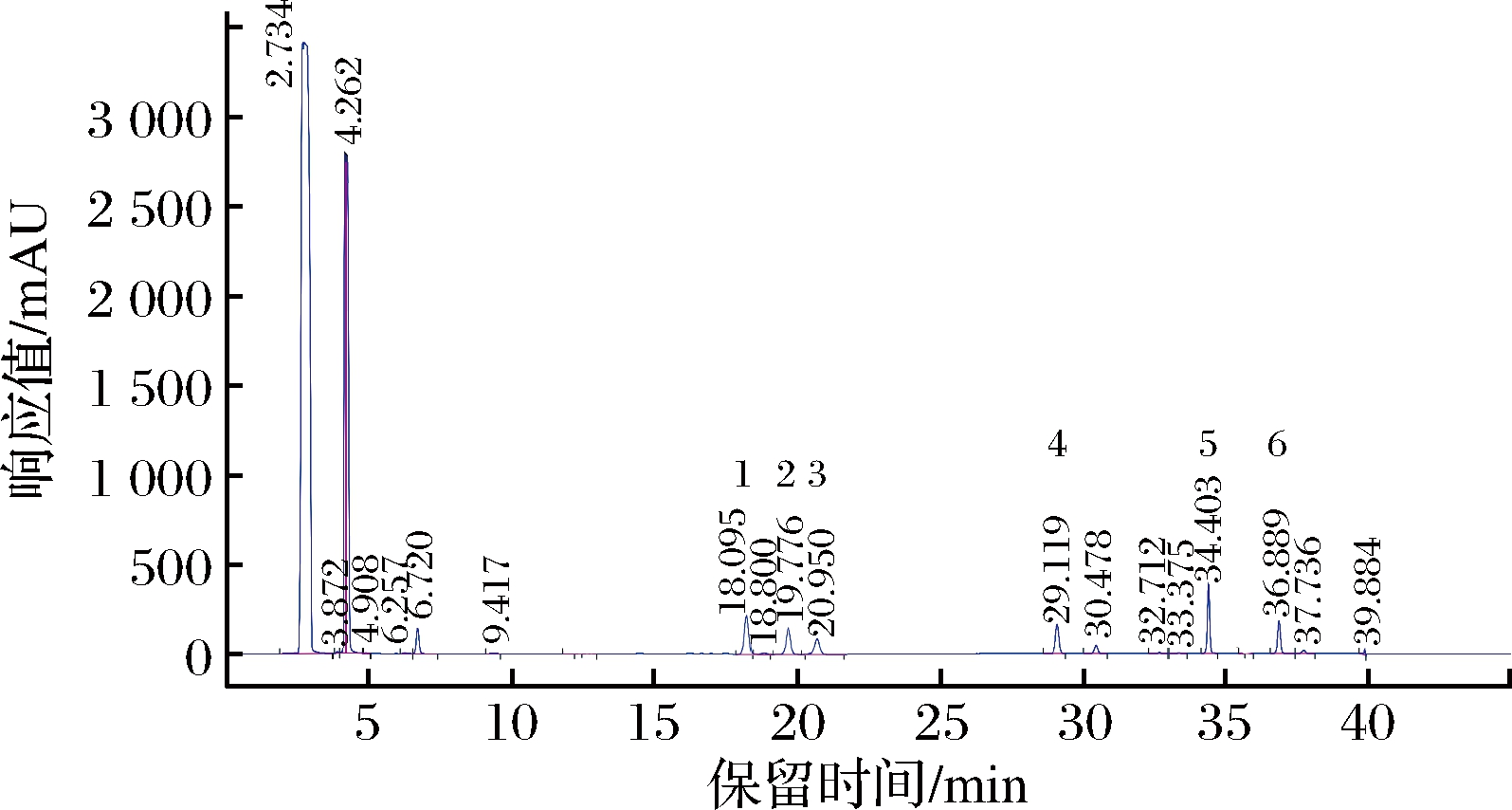
1-腐胺;2-尸胺;3-组胺;4-酪胺;5-精胺;6-色胺
图1 六种生物胺混合液相色谱图
Fig.1 The mixed liquid chromatogram of six biologenic amines standard
6种生物胺通过高效液相色谱法,以生物胺浓度为横坐标,峰面积为纵坐标,制作标准曲线,回归方程及相关系数如表2所示,6种生物胺在1~50 mg/L的浓度范围内线性关系良好,相关系数均>0.99。
表2 六种生物胺回归方程及相关系数
Table 2 Regression equations and R2 of six biogenic amines

生物胺回归方程相关系数(R2)腐胺y=25.57x+186.07 0.999尸胺y=45.329x+298.510.999组胺y=2.7274x+14.6650.995酪胺y=28.801x+108.080.998精胺y=42.176x+213.690.997色胺y=23.458x+170.240.997
2.2 降生物胺乳酸菌的筛选
2.2.1 降生物胺乳酸菌的初筛
通过MRS固体培养基从酒样与酒醅中共筛选出74株疑似乳酸菌菌株,将其分别接种于生物胺显色培养基,初步筛选得到19株不产生生物胺(培养基未变色)的菌株,显色反应结果如图2所示。

图2 生物胺显色反应
Fig.2 Color reaction of biogenic amines
2.2.2 降生物胺乳酸菌的复筛
将初筛得到的19株乳酸菌于添加生物胺的MRS液体培养基中培养24 h,测定其生物胺降解率,结果见表3。菌株NXU-Q7、NXU-Q12对5种生物胺均可降解,对腐胺的降解能力差别不明显。NXU-Q12对组胺和酪胺的降解能力显著高于NXU-Q7,其在发酵液中对组胺降解率为23.11%,酪胺降解率为16.85%。因此确定NXU-Q12为降生物胺乳酸菌,进行下一步的研究。
2.3 降生物胺乳酸菌的鉴定
2.3.1 形态学鉴定
菌株NXU-Q12在MRS固体培养基上的菌落形态和革兰氏染色镜检结果如图3所示。菌落呈圆形、表面光滑、边缘整齐,颜色呈奶黄色。革兰氏染色结果为蓝紫色,为革兰氏阳性菌。
2.3.2 分子生物学鉴定
将所得到的生物胺降解菌株测序结果通过NCBI中的BLAST进行同源性分析并构建其系统发育树,如图4所示。NXU-Q12与序列号为MZ571407.1的植物乳植物杆菌距离较近。因此,结合生物学形态与分子学鉴定可初步确定NXU-Q12为植物乳植物杆菌(Lactiplantibacillus plantarum)。
表3 不同菌株生物胺降解率的结果
Table 3 Degradation rate of biogenic amines by the different strains

腐胺尸胺组胺酪胺精胺G-1-1.37±0.023.56±0.68-28.40±0.49-14.31±0.91-11.12±0.53G-2-14.15±0.50-17.51±0.86-45.95±0.54-18.77±0.67-29.37±0.91G-3-18.55±0.94-17.40±0.57-42.73±0.61ND-24.86±0.31G-4-16.89±0.59-15.04±0.15-40.43±0.41-18.68±0.81-24.66±0.48G-5-11.54±0.24-14.57±0.37-28.46±0.58-41.91±0.23-16.52±0.61G-6-13.16±0.99-8.88±0.24-17.57±0.35-1.83±0.73NDNXU-Q130.98±0.6736.59±0.5617.50±0.52-81.69±0.3327.34±0.64NXU-Q2-12.36±0.64-99.36±0.24-14.43±0.72-40.55±0.10-11.34±0.70NXU-Q3-18.45±0.47-11.67±0.61-61.41±0.30-19.43±0.90-43.84±0.04NXU-Q533.88±0.0639.47±0.6913.32±0.06-70.84±0.4531.71±0.47NXU-Q631.93±0.9439.54±0.3922.62±0.47-81.65±0.0333.58±0.87NXU-Q728.61±0.5431.71±0.7424.37±0.0816.05±0.8210.09±0.82NXU-Q826.98±0.6031.13±0.0118.64±0.21-94.86±0.0237.51±0.66NXU-Q1034.82±0.95-30.22±0.50-98.91±0.37-240.92±0.66-47.82±0.12NXU-Q11-44.00±0.88-34.95±0.49-15.36±0.55-21.09±0.86-84.05±0.91NXU-Q1228.38±0.6836.31±0.9023.11±0.1616.85±0.2812.03±0.47NXU-Q1319.26±0.67-17.61±0.29-57.73±0.69-211.85±0.87-18.16±0.24M-93.96±0.68-87.70±0.29-23.91±0.46-62.07±0.92-14.47±0.75Z-66.49±0.79-59.11±0.28-231.79±0.57-39.12±0.71ND
注:ND表示未检出
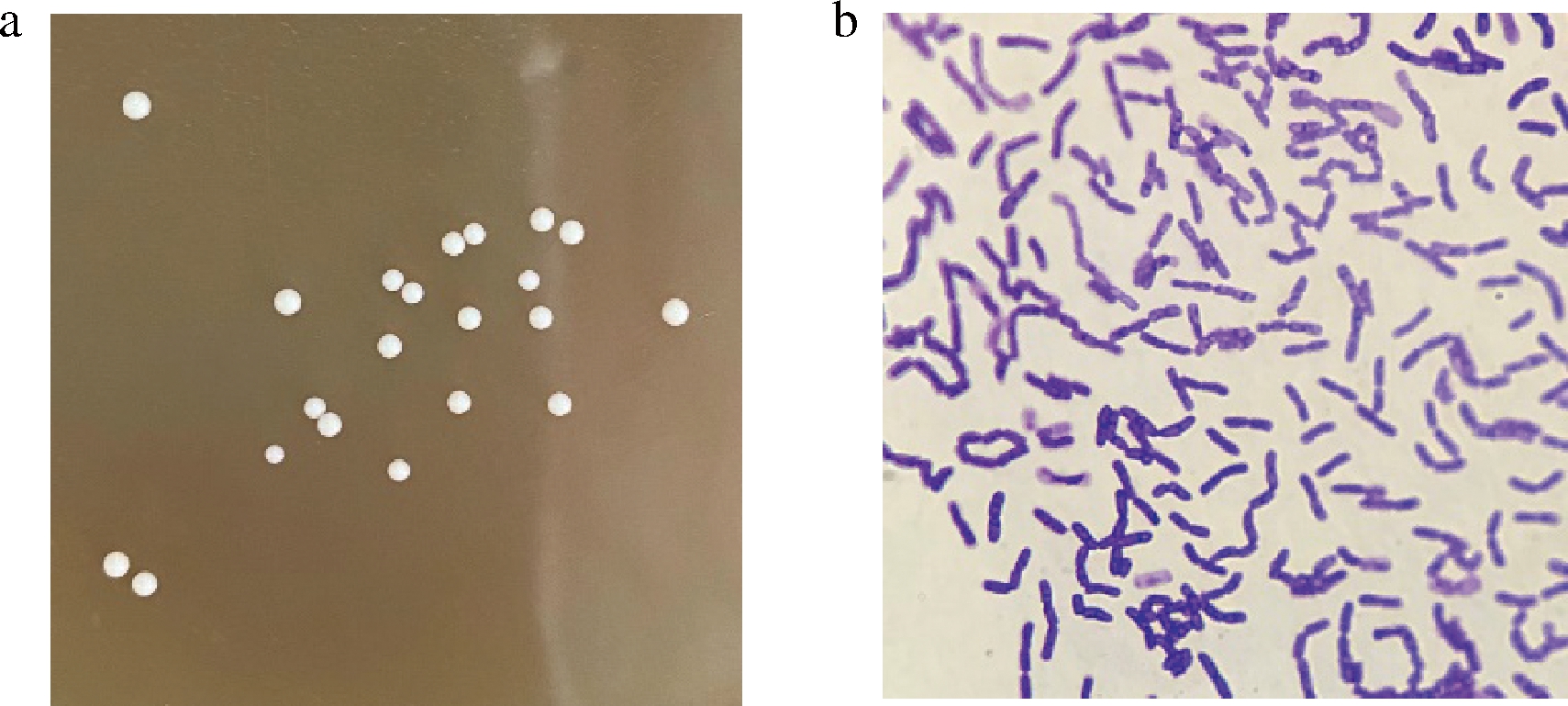
a-菌落形态;b-革兰氏染色光学显微镜图
图3 菌株NXU-Q12的形态学特征
Fig.3 Morphological characteristics of NXU-Q12
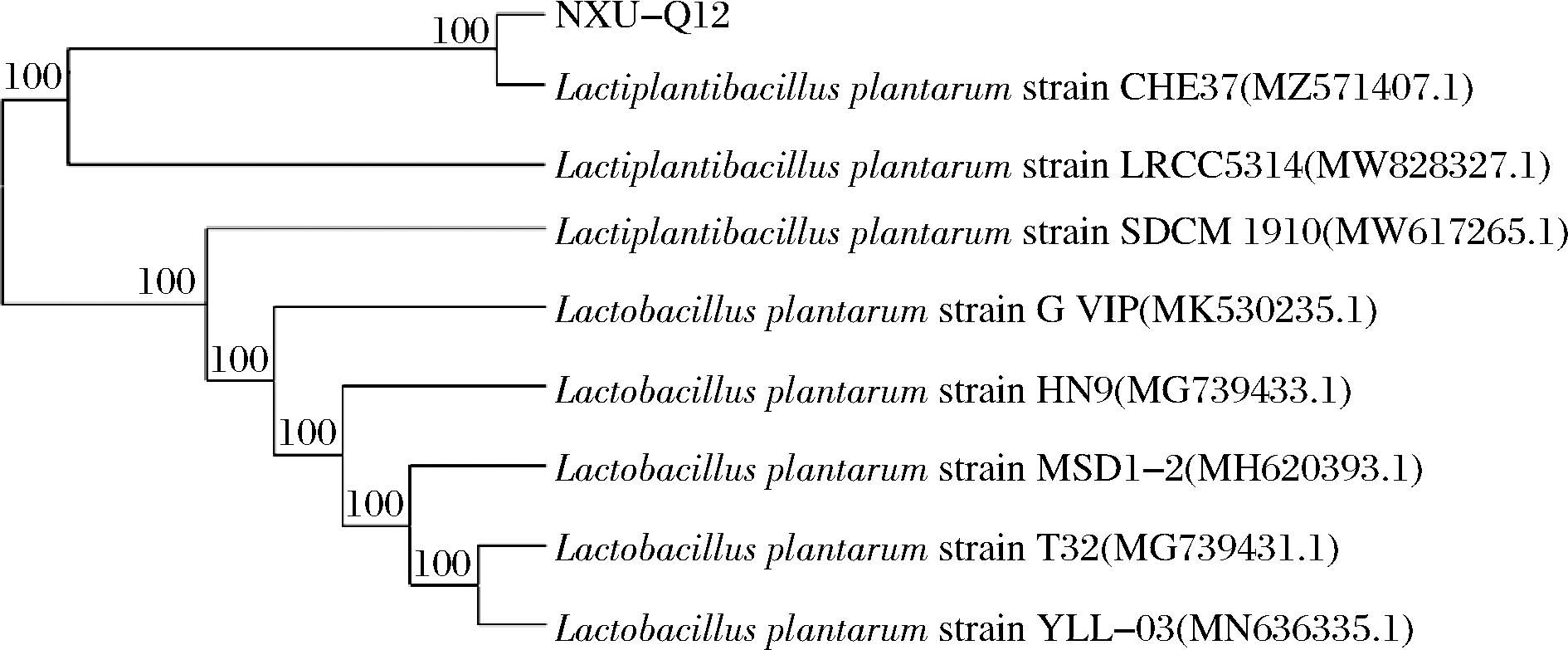
图4 菌株NXU-Q12基于16S rRNA基因序列的系统发育树
Fig.4 Phylogenetic tree based on 16S rRNA gene sequence constructed by NXU-Q12
2.4 降生物胺乳酸菌的降解特性研究
2.4.1 降生物胺乳酸菌的生长曲线及产酸能力
通过测定NXU-Q12在MRS液体培养基中24 h OD值可得到其生长曲线,并同时测定pH值确定其产酸能力。由图5可知,菌株在0~2 h生长缓慢,在4 h时进入对数生长期,16 h生长趋于稳定状态;菌株pH值与生长状态一致,初始阶段呈迅速下降后趋于平缓。
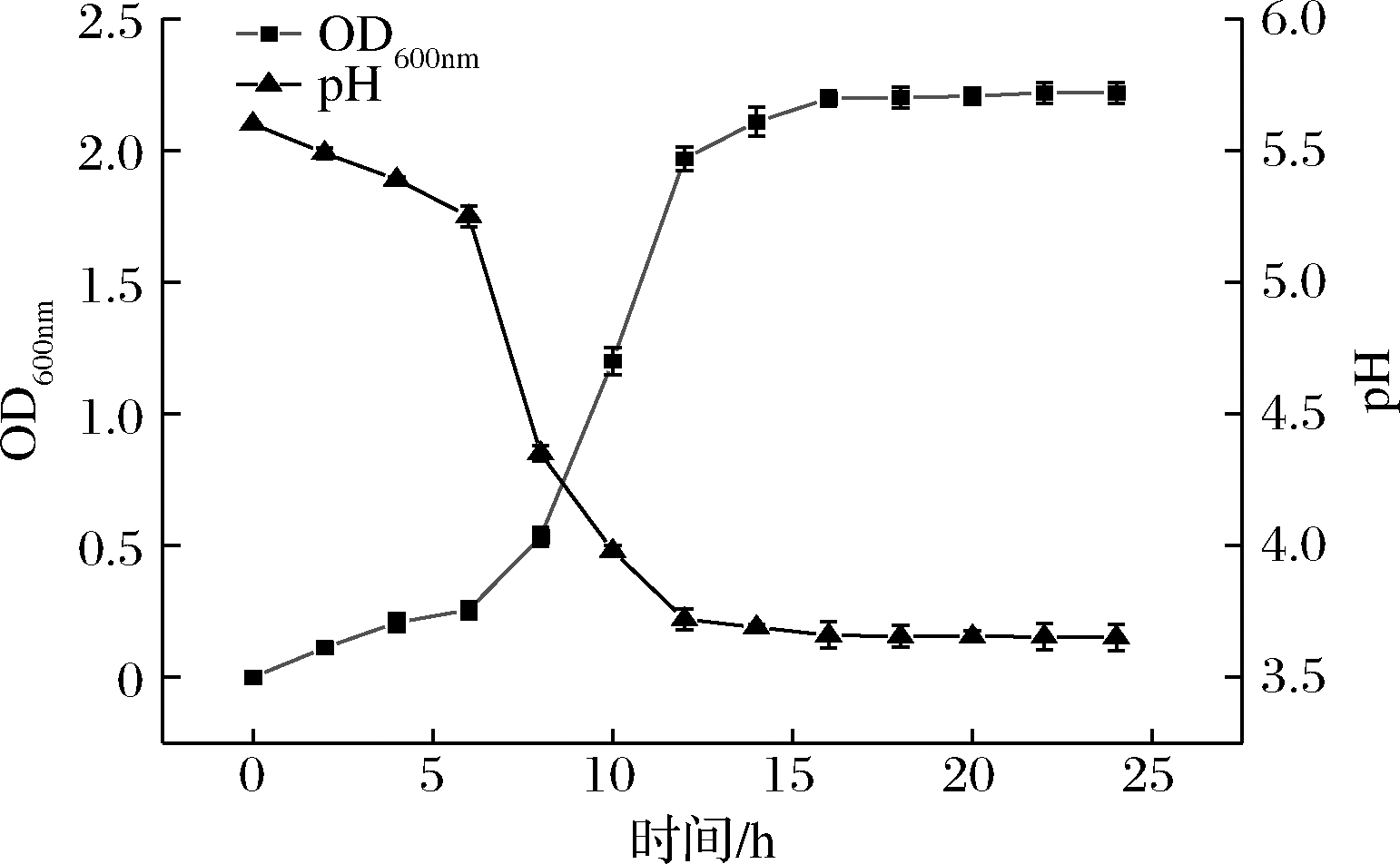
图5 菌株生长曲线和产酸能力
Fig.5 Growth curve and acid producing capacity of the strain
2.4.2 降生物胺乳酸菌的耐酸性及其降解生物胺能力
分别在3、3.5、4、4.5、5的pH值条件下对NXU-Q12进行研究,结果如图6所示。NXU-Q12在不同pH值条件下均能生长,说明菌株具有一定的耐酸能力;但随着pH值的减小,菌株的生长状态呈下降趋势,在pH值为5时,NXU-Q12的生长能力最好。
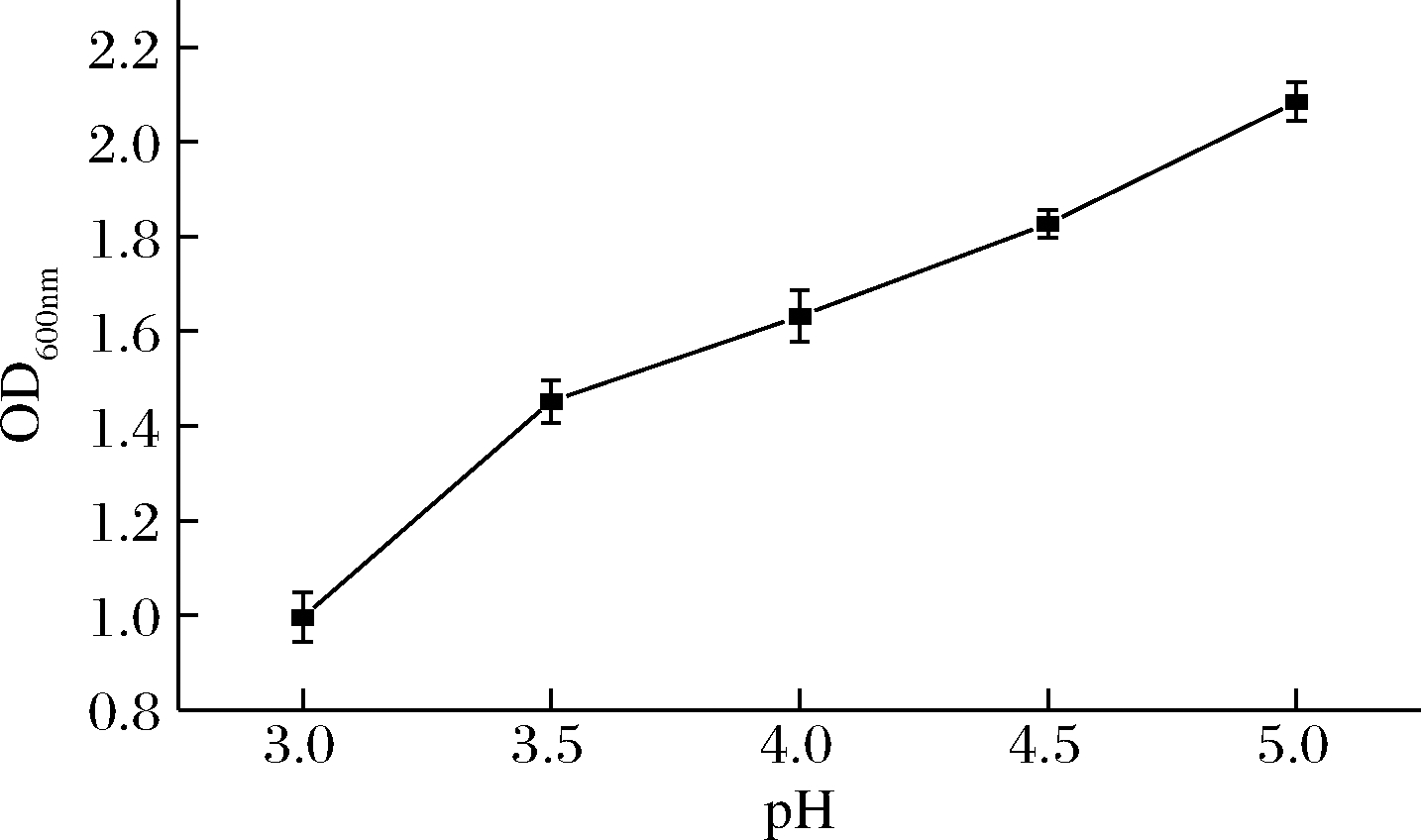
图6 酸度对菌株生长的影响
Fig.6 Effect of acidity on the growth of strain
不同pH条件下NXU-Q12生物胺的降解能力如表4所示,NXU-Q12在不同pH值对5种生物胺均有降解作用。当pH为4.5时,菌株的生物胺降解率最高,对腐胺、尸胺、组胺、酪胺、精胺的降解率分别为27.67%、25.00%、29.44%、27.96%、24.48%;在pH 3和3.5时,菌株降解能力呈下降趋势,其原因可能是在偏酸环境下菌株虽然具有一定的生长活性,但其氧化酶活性可能受到抑制,从而导致无法有效地降解生物胺[19]。
表4 不同pH条件下菌株生物胺降解能力
Table 4 Biogenic amines degradation ability of strains under different pH conditions
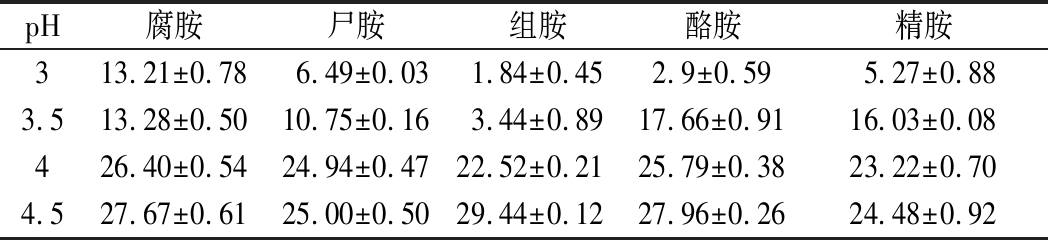
pH腐胺尸胺组胺酪胺精胺313.21±0.786.49±0.031.84±0.452.9±0.595.27±0.883.513.28±0.5010.75±0.163.44±0.8917.66±0.9116.03±0.08426.40±0.5424.94±0.4722.52±0.2125.79±0.3823.22±0.704.527.67±0.6125.00±0.5029.44±0.1227.96±0.2624.48±0.92
2.4.3 降生物胺乳酸菌耐乙醇能力及降解生物胺能力
分别在8%、10%、12%、14%的乙醇浓度条件下对NXU-Q12菌株进行研究,结果如图7所示。NXU-Q12在乙醇体积分数为10%时生长最好,与其他浓度差异明显;当乙醇体积分数为10%~14%时,菌株浓度呈下降趋势,说明菌株活性受到乙醇的影响。其原因可能是当乙醇达到一定浓度时,渗透于微生物细胞膜内,使细胞膜通透性发生改变;而当浓度超过一定范围后,会使细胞膜渗透压发生改变,从而使菌株活性降低。
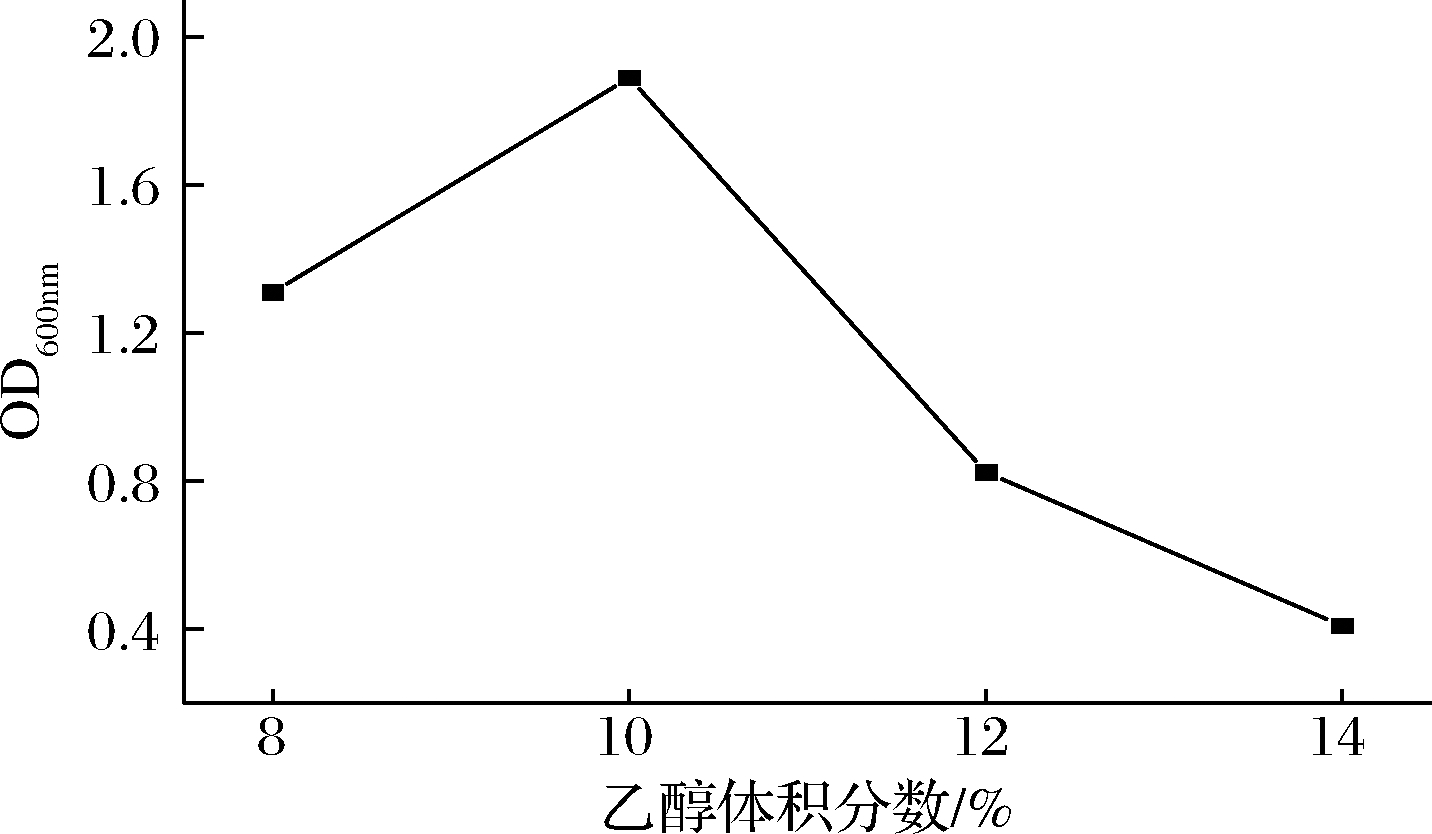
图7 乙醇体积分数对菌株生长的影响
Fig.7 Effect of ethanol content on the growth of strain
不同乙醇条件下NXU-Q12生物胺的降解能力如表5所示,随着乙醇浓度逐渐升高,菌株生物胺降解率逐渐降低。当乙醇体积分数为10%时,NXU-Q12对5种生物胺的降解率均高于20%;当乙醇体积分数为14%时,NXU-Q12对5种生物胺的降解率均低于11%。在高乙醇浓度条件下,菌株的生长能力降低,胺氧化酶活力降低甚至于失活,从而致使其降解率降低。GARC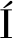 A-RUIZ等[2]研究发现,随着乙醇浓度的升高,乳酸菌降解生物胺的能力受到抑制,这与本实验结果一致。
A-RUIZ等[2]研究发现,随着乙醇浓度的升高,乳酸菌降解生物胺的能力受到抑制,这与本实验结果一致。
表5 不同乙醇体积分数下菌株生物胺降解能力
Table 5 Biogenic amines degradation ability of strains under different ethanol conditions
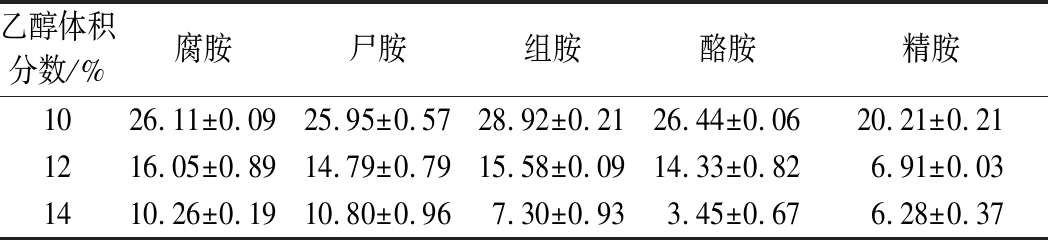
乙醇体积分数/%腐胺尸胺组胺酪胺精胺1026.11±0.0925.95±0.5728.92±0.2126.44±0.0620.21±0.211216.05±0.8914.79±0.7915.58±0.0914.33±0.826.91±0.031410.26±0.1910.80±0.967.30±0.933.45±0.676.28±0.37
3 结论
从葡萄酒酒样和白酒酒醅中通过生物胺显色实验和高效液相色谱法测定,筛选得到可降解生物胺的菌株共7株,以菌株降解生物胺的能力为指标,从中筛选得到1株降解生物胺能力较强的乳酸菌(NXU-Q12),经形态学和分子生物学鉴定为植物乳植物杆菌(Lactiplantibacillus plantarum),并对其生长特性和在不同环境条件下降解生物胺的能力进行研究。结果表明,该菌株在不同的pH和乙醇浓度条件下均可生长且具有降解生物胺的能力,但在pH为3~4.5和乙醇体积分数为10%~14%条件下,其生长活性与降解生物胺的能力同时受到抑制,这也与目前一些研究结果一致[20-21]。通过研究不同环境条件下的菌株生长特性及降解生物胺的能力,对葡萄酒MLF过程中生成的生物胺进行控制具有一定的参考价值。
[1] DOEUN D, DAVAATSEREN M, CHUNG M S.Biogenic amines in foods[J].Food Science and Biotechnology, 2017, 26(6):1 463-1 474.
[2] GARC A-RUIZ A, GONZ
A-RUIZ A, GONZ LEZ-ROMPINELLI E M, BARTOLOMÉ B, et al.Potential of wine-associated lactic acid bacteria to degrade biogenic amines[J].International Journal of Food Microbiology, 2011, 148(2):115-120.
LEZ-ROMPINELLI E M, BARTOLOMÉ B, et al.Potential of wine-associated lactic acid bacteria to degrade biogenic amines[J].International Journal of Food Microbiology, 2011, 148(2):115-120.
[3] KIM K H, LEE S H, CHUN B H, et al.Tetragenococcus halophilus MJ4 as a starter culture for repressing biogenic amine (cadaverine) formation during saeu-jeot (salted shrimp) fermentation[J].Food Microbiology, 2019, 82:465-473.
[4] KALA P.Recent advances in the research on biological roles of dietary polyamines in man[J].Journal of Applied Biomedicine, 2009, 7(2):65-74.
P.Recent advances in the research on biological roles of dietary polyamines in man[J].Journal of Applied Biomedicine, 2009, 7(2):65-74.
[5] LI B B, LU S L.The importance of amine-degrading enzymes on the biogenic amine degradation in fermented foods:A review[J].Process Biochemistry, 2020, 99:331-339.
[6] ÖZOGUL F, HAMED I.The importance of lactic acid bacteria for the prevention of bacterial growth and their biogenic amines formation:A review[J].Critical Reviews in Food Science and Nutrition, 2018, 58(10):1 660-1 670.
[7] 刘洋. 酿造工艺对葡萄酒生物胺的影响[D].杨凌:西北农林科技大学, 2020.
LIU Y.Effects of winemaking technology on biogenic amines in wine[D].Yangling:Northwest A & F University, 2020.
[8] 张春晖, 夏双梅, 张军翔.葡萄酒中的生物胺的生产与工艺控制[J].食品科学, 2002, 23(10):128-130.
ZHANG C H, XIA S M, ZHANG J X.Study on production and control of biogenic amines in wine[J].Food Science, 2002, 23(10):128-130.
[9] HENR QUEZ-AEDO K, DUR
QUEZ-AEDO K, DUR N D, GARCIA A, et al.Identification of biogenic amines-producing lactic acid bacteria isolated from spontaneous malolactic fermentation of Chilean red wines[J].LWT-Food Science and Technology, 2016, 68:183-189.
N D, GARCIA A, et al.Identification of biogenic amines-producing lactic acid bacteria isolated from spontaneous malolactic fermentation of Chilean red wines[J].LWT-Food Science and Technology, 2016, 68:183-189.
[10] ZHANG Y M, QIN N, LUO Y K, et al.Effects of different concentrations of salt and sugar on biogenic amines and quality changes of carp (Cyprinus carpio) during chilled storage[J].Journal of the Science of Food and Agriculture, 2015, 95(6):1 157-1 162.
[11] CLAUDIA R C, FRANCISCO J C.Effect of an Argon-containing packaging atmosphere on the quality of fresh pork sausages during refrigerated storage[J].Food Control, 2010, 21(10):1 331-1 337.
[12] ZHAO N, LAI H M, HE W, et al.Reduction of biogenic amine and nitrite production in low-salt Paocai by controlled package during storage:A study comparing vacuum and aerobic package with conventional salt solution package[J].Food Control, 2021, 123:107858.
[13] EOM J S, SEO B Y, CHOI H S.Biogenic amine degradation by Bacillus species isolated from traditional fermented soybean food and detection of decarboxylase-related genes[J].Journal of Microbiology and Biotechnology, 2015, 25(9):1 519-1 527.
[14] LEE Y C, KUNG H F, HUANG Y L, et al.Reduction of biogenic amines during miso fermentation by Lactobacillus plantarum as a starter culture[J].Journal of Food Protection, 2016, 79(9):1 556-1 561.
[15] 刘玉晗, 卢士玲, 陆静, 等.乳酸菌中生物胺氧化酶菌株的筛选[J].现代食品科技, 2016, 32(4):106-113.
LIU Y H, LU S L, LU J, et al.Screening of amine oxidase-producing strains from lactic acid bacteria[J].Modern Food Science and Technology, 2016, 32(4):106-113.
[16] 卢士玲. 传统中式香肠中生物胺产生及其控制技术的研究[D].南京:南京农业大学, 2010.
LU S L.Study on production of biogenic amines and control technology in traditional Chinese sausage[D].Nanjing:Nanjing Agricultural University,2010.
[17] 李春, 段春影, 张国芳, 等.环境条件对植物乳杆菌降解生物胺的影响[J].中国食品学报, 2019, 19(4):133-139.
LI C, DUAN C Y, ZHANG G F, et al.Effects of environmental conditions on the degradation of biogenic amines by Lactobacillus plantarum[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(4):133-139.
[18] 徐洁. 降生物胺多铜氧化酶的异源表达及性质研究[D].无锡:江南大学, 2019.
XU J.Characterization and heterologus expression of multicopper oxidases for degradation of biogenic amines[D].Wuxi:Jiangnan University, 2019.
[19] LUND P, TRAMONTI A, DE BIASE D.Coping with low pH:Molecular strategies in neutralophilic bacteria[J].FEMS Microbiology Reviews, 2014, 38(6):1 091-1 125.
[20] ZAMAN M Z, BAKAR F A, SELAMAT J, et al.Occurrence of biogenic amines and amines degrading bacteria in fish sauce[J].Czech Journal of Food Sciences, 2010, 28(No.5):440-449.
[21] 孙梦菲. 黄酒中降生物胺糖多孢菌的筛选及其胺氧化酶性质研究[D].无锡:江南大学, 2021.
SUN M F.Screening of bioamine-degrading Saccharopolyspora in Huangjiu and study on the properties of amine oxidases[D].Wuxi:Jiangnan University, 2021.