糖尿病通常被分为4种类型,Ⅰ型和Ⅱ型最为常见,其中Ⅱ型糖尿病患病人数最多[1]。尽管Ⅱ型糖尿病发病原因不明确,但是,其与遗传[2]、年龄[3]、代谢[4]、肥胖[5]、生活方式[6]、机体免疫力[7]、心情状态[8]等因素密切相关。最新研究发现,慢性炎症反应和代谢紊乱会造成机体免疫能力下降,导致Ⅱ型糖尿病以及相关并发症发生[9],暗示着改善炎症反应和调节代谢紊乱,可能是逆转Ⅱ型糖尿病的有效途径。
三叶木通[Akebia trifoliata(Thunb.) Koidz.]是药食同源植物,广泛分布于安徽、福建等地,是《本草纲目》和《中国药典》的记载品种[10],具有抗炎、抗氧化、调节肠道微生物菌群等作用[11-12]。三叶木通藤茎和果皮的天然产物不同,藤茎具有58种有效化学成分,果皮具有高级脂肪酸、酚酸、黄酮、常春藤皂苷和其他生物活性糖苷等43种化学成分。藤茎的常春藤皂苷具有抗肿瘤活性[13-14],果肉萃取物具有显著的体外抗氧化作用和抑制α葡萄糖苷酶活性,其ABTS阳离子自由基清除能力接近商业抗氧化剂[15]。本研究以三叶木通藤茎为原料,制备三叶木通乙酸乙酯提取物,研究其与模型动物炎症反应和糖尿病的关系。
1 材料与方法
1.1 实验动物
C57BL/6种小鼠60只,SPF级,健康雄性,鼠龄4~5周,体重(18±4) g,购于GemPharmatech公司[生产许可证:SCXK(苏)2018-0008],饲养在上海海洋大学动物实验室,保持环境温度(23±2) ℃,相对湿度45%~65%,自然昼夜。本研究经上海海洋大学动物伦理委员会审核批准(批准编号:SHOU-DW-2020-054)并严格按照动物使用管理条例进行。
1.2 材料与试剂
三叶木通乙酸乙酯提取物(ethyl acetate extract,EAE),自制;链脲佐菌素(streptozotocin,STZ),美国Sigma公司;盐酸二甲双胍,上海源叶生物科技有限公司;高脂高糖饲料、基础饲料,江苏省协同医药生物工程有限责任公司;肿瘤坏死因子α(tumor necrosis factor, TNF-α)、白介素6(interleukin-6, IL-6)试剂盒,南京建成生物工程研究所。
1.3 主要仪器
免调码型血糖仪,三诺生物传感股份有限公司;Spectra MAX M2 型酶标仪,美谷分子仪器有限公司;iChem-340 型全自动生化分析仪,深圳市库贝尔生物科技有限公司。
1.4 实验方法
1.4.1 EAE的制备
三叶木通藤茎由温州市农业科学研究院赠送,经上海海洋大学何培民教授鉴定。将三叶木通藤茎清洗、干燥、粉碎后得到藤茎粉末,粉末用体积分数95%乙醇提取3 h,此过程重复6次,提取后抽滤,合并所有滤液,滤液经真空浓缩得到浸膏,按体积比1∶1溶解在去离子水中,经乙酸乙酯萃取,重复3次后收集上清液,通过真空干燥得到乙酸乙酯提取物。
1.4.2 小鼠糖尿病模型的构建
高脂高糖饲养联合STZ注射,建立糖尿病动物模型。高脂高糖饲料喂养致小鼠发生代谢紊乱,胰岛素敏感度降低导致出现胰岛素抵抗,STZ对动物胰岛β细胞有破坏作用[16]。保持环境温度(23±2) ℃,相对湿度45%~65%,进行适应性饲养1周后,随机分笼出10只小鼠,投喂基础饲料,其余小鼠投喂高脂高糖饲料。观察所有小鼠精神状态,每周在固定时间对所有小鼠进行体重称量。饲养4周后,体重达标小鼠禁食12 h后进行STZ注射操作。取STZ粉末溶于浓度为0.1 mol/L柠檬酸缓冲液中,并在避光条件下进行滤膜除菌。一次性腹腔注射STZ,剂量为120 mg/kg,基础饲料喂养小鼠相同位置注射生理盐水。观察3周,根据体重、血糖指标和观察结果进行判定,选取出现精神萎靡症状且空腹血糖值(fasting blood glucose,FBG)>11.1 mmol/L的小鼠作为糖尿病小鼠模型。
1.4.3 实验设计与处理
将糖尿病小鼠模型随机分为5组,即空白组(DC)、阳性对照组(PC)和三叶木通乙酸乙酯提取物高(EAE-H)、中(EAE-M)、低剂量(EAE-L)处理组,每组8只小鼠。随机从基础饲料喂养小鼠中选取8只,作为对照组(NC)分笼饲养,投喂基础饲料,每日灌胃生理盐水。DC组投喂高脂高糖饲料,每日灌胃生理盐水。PC组投喂高脂高糖饲料,每日灌胃250 mg/kg二甲双胍生理盐水溶液。EAE-H组、EAE-M组、EAE-L组投喂高脂高糖饲料,每日分别灌胃含500、250、100 mg/kg EAE的生理盐水溶液,所有小鼠保持饮水自由。
1.4.3.1 血清采集
EAE处理3周后,用酒精棉棒擦拭小鼠眼周,擦拭后立即摘除小鼠眼球取血,柠檬酸钠抗凝后室温静置30 min,静置后3 000 r/min、4 ℃离心20 min,取上清液并分装、标记,-80 ℃冻存。
1.4.3.2 炎症指标测定
将冻存血清解冻后,稀释100倍,根据试剂盒依次加入样品、标准品、生物素抗原、亲和素、显色液和终止液,10 min内测定波长450 nm处的吸光度(OD值),做标准曲线后计算小鼠血清内炎症因子水平。
1.4.3.3 小鼠肝脏苏木精-伊红染色法(hematoxylin-eosin staining, HE)
眼球取血后立即准确摘取小鼠肝脏,经福尔马林溶液固定后修剪、脱水、包埋、制切片,切片经HE染色后进行中性树胶封片,显微镜下观察并拍照。
1.4.3.4 生化指标测定方法
将冻存血清解冻后,将样本用涡旋仪涡旋15 s,根据GPO-PAP法测定小鼠血清中甘油三酯(triglyceride, TG)、总胆固醇(total cholesterol, TC)含量,双试剂直接法测定小鼠血清中高密度脂蛋白胆固醇(high-density lipoprotein cholesterol, HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol, LDL-C)含量,用全自动生化分析仪进行测定,上机检测后读取原始数据。
1.4.3.5 FBG和口服葡萄糖糖耐量(oral glucose tolerance test, OGTT)指标测定
小鼠腹腔注射灭菌STZ后,每周固定时间禁食12 h,饮水自由,尾静脉取血,血糖仪测定小鼠血糖水平,记录结果。EAE处理3周,小鼠在同一时间禁食12 h,灌胃葡萄糖溶液,剂量为2 g/kg。尾静脉取血,在0、30、60、120 min时测定小鼠血糖水平。
1.4.3.6 一般药理与体重测定
每日定时观察小鼠皮毛状态、外形变化、进食、饮水、排尿、呼吸、自主活动、呼吸、心率等情况,每周称量记录小鼠体重。
1.5 统计学处理与分析
用GraphPad 8.0软件进行数据处理与分析,实验数据以平均数±标准差表示,采用Tukey多重检验法来分析组间差异,P<0.05时代表差异显著,具有统计学意义。
2 结果与分析
2.1 糖尿病小鼠模型的特征
高脂高糖饲养结合STZ注射,处理小鼠3周,构建糖尿病小鼠模型,糖尿病小鼠模型特征(表1)显示,模型组血糖16.9 mmol/L,对照组血糖6.0 mmol/L,2组血糖水平差异显著(P<0.05),说明糖尿病小鼠模型构建成功。模型组小鼠精神状况萎靡不振,皮毛粗糙毛躁,失去光泽,进食量增加,排尿增多,体重减少。
表1 小鼠糖尿病模型的特征指标表
Table 1 Characteristic index of diabetic mice model

组别饲料量/(g·d·只)体重/(g·只)血糖/(mmol·L-1)皮毛外观模型组7.83±0.1225.45±1.3516.9±1.00暗淡对照组3.11±0.2828.16±1.616.0±0.77光泽
2.2 EAE减轻糖尿病小鼠模型的炎症反应
EAE处理前后小鼠血清的TNF-α水平和IL-6水平如图1。与NC组相比,DC组小鼠血清中TNF-α从170.46 pg/mg升高至265.96 pg/mg,极显著升高56%(P<0.01);IL-6从104.25 pg/mg升高至179.70 pg/mg,极显著升高72%(P<0.01),说明与NC组相比,DC组出现炎性特征。
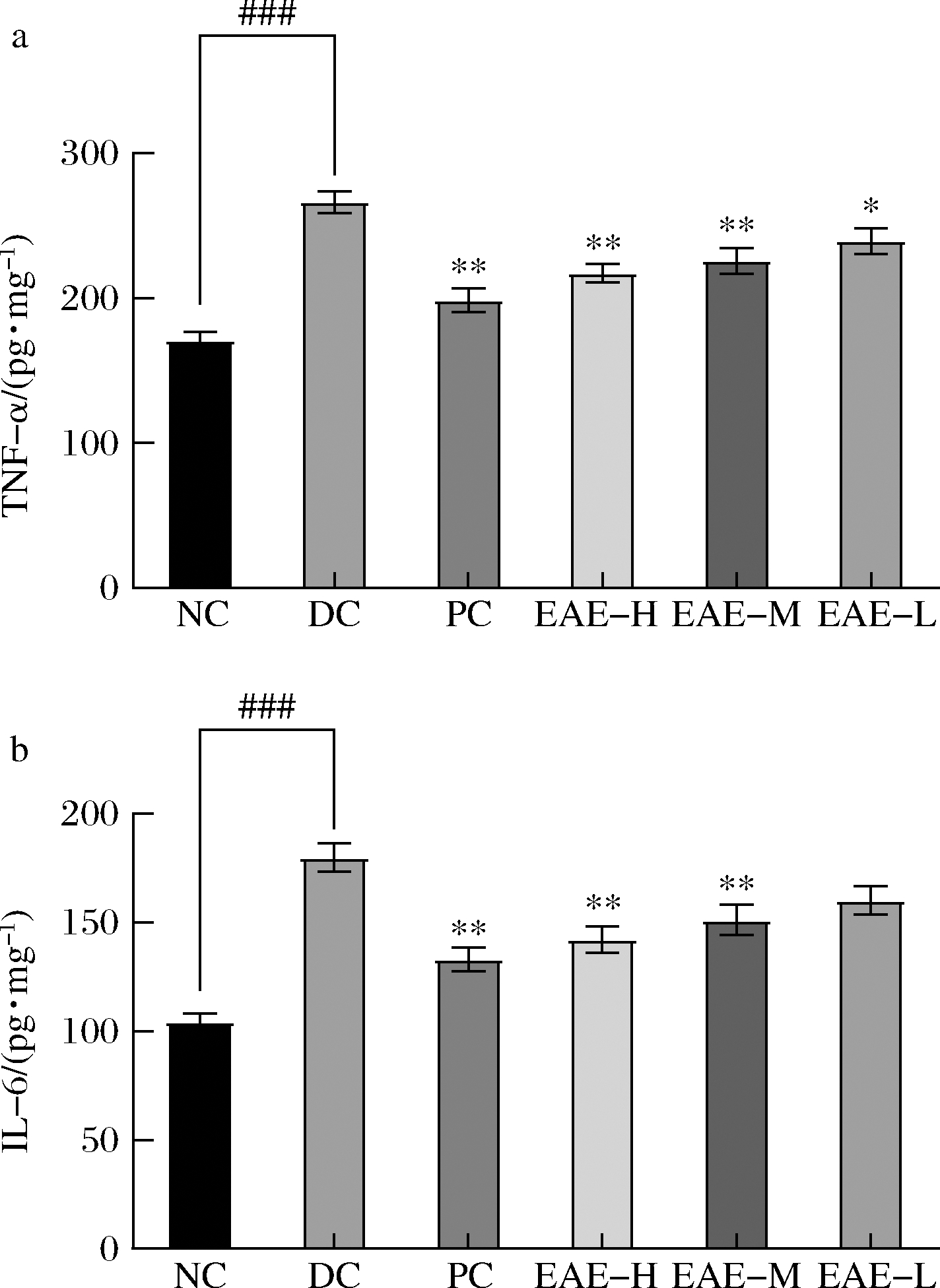
a-TNF-α;b-IL-6
图1 EAE对糖尿病小鼠模型炎症反应的影响
Fig.1 Effect of EAE on inflammatory response in diabetic mice model
注:*表示DC与处理组的统计分析,P<0.05;**表示DC与处理组各组的统计分析,P<0.01;##表示DC组与NC组的统计分析,P<0.001(下同)
与DC组相比,PC组、高、中、低剂量处理组的TNF-α从265.96 pg/mg分别降低至198.46、217.17、225.52、239.20 pg/mg,极显著降低25%(P<0.01)、18%(P<0.01)、15%(P<0.01) ,显著降低10%(P<0.05);PC组、高、中剂量处理组的IL-6从179.70 pg/mg分别降低至133.08、142.08、151.14 pg/mg,极显著降低26%(P<0.01)、21%(P<0.01)、16%(P<0.01),低剂量处理组降低11%,但与DC组无显著差异。
EAE处理前后小鼠肝脏HE染色结果显示(图2),NC组中小鼠肝小叶、肝窦清楚可见,未出现炎细胞浸润情况,纤维组织未出现增生。与NC组相比,DC组小鼠肝脏肝小叶轮廓界限模糊,肝细胞发生明显的脂肪变性,肝细胞胞质被大脂肪滴挤压。说明与NC组相比,DC组小鼠肝脏出现炎症损伤,DC组小鼠体内出现炎症反应,符合预期。
与DC组相比,PC组、高、中、低剂量处理组的小鼠肝脏肝细胞脂肪变性发生不同程度缓解,高剂量处理组的缓解效果好于低剂量处理组,说明EAE能够有效缓解糖尿病小鼠模型肝脏的炎症损伤。

a-NC;b-DC;c-PC;d-EAE-H;e-EAE-M;f-EAE-L
图2 EAE对糖尿病小鼠模型肝脏炎症反应的影响(400倍)
Fig.2 Effect of EAE on liver inflammation in diabetic mice model (400 ×)
2.3 EAE对糖尿病小鼠模型血脂代谢的影响
取适量样本,通过全自动生化分析仪测定小鼠血清中血脂代谢指标(表2)。表2显示,与NC组相比,DC组小鼠血清中TC水平从2.58 mmol/L升高至5.83 mmol/L,显著升高126%(P<0.01);TG水平从0.78 mmol/L升高至1.63 mmol/L,显著升高108%(P<0.01);LDL-C水平从0.83 mmol/L升高至1.90 mmol/L,显著升高128%(P<0.01);HDL-C水平从1.48 mmol/L降低至0.61 mmol/L,显著降低58%(P<0.01),说明与NC组相比,DC组小鼠机体内发生血脂代谢紊乱。
表2 EAE对糖尿病小鼠模型血脂代谢的影响
Table 2 Effect of EAE on blood lipid metabolism in diabetic mice model

组别血脂水平/(mmol·L-1)TCTGLDL-CHDL-CNC2.58±0.260.78±0.090.83±0.131.48±0.20DC5.83±0.55###1.63±0.17###1.90±0.16###0.61±0.15###PC3.09±0.26∗∗0.88±0.15∗∗1.28±0.13∗∗1.27±0.14∗EAE-H3.29±0.26∗∗1.00±0.12∗∗1.34±0.15∗1.16±0.19∗EAE-M3.46±0.28∗∗1.25±0.14∗1.42±0.11∗1.08 ±0.16∗EAE-L3.77±0.33∗1.43±0.161.55±0.14∗0.86±0.10
注:*表示DC与处理组的统计分析,P<0.05;**表示DC与处理组各组的统计分析,P<0.01;##表示DC组与NC组的统计分析,P<0.01(下同)
与DC组相比,PC组、高、中、低剂量处理组TC水平从5.83 mmol/L分别降低至3.09、3.29、3.46、3.77 mmol/L,极显著降低47%(P<0.01)、43%(P<0.01)、40%(P<0.01),显著降低35%(P<0.05);LDL-C水平从1.90 mmol/L分别降低至1.28、1.34、1.42、1.55 mmol/L,显著降低32%、29%、25%、18%(P<0.01、P<0.05,P<0.05,P<0.05);PC组、高、中剂量处理组的TG水平从1.63 mmol/L分别降低至0.88、1.00、1.25 mmol/L,显著降低46%、38%、23%(P<0.01,P<0.01,P<0.05);HDL-C水平从0.61 mmol/L分别升高至1.27、1.16、1.08 mmol/L,显著升高108%(P<0.05)、90%(P<0.05)、77%(P<0.05),说明处理组血脂代谢紊乱有不同程度的改善。
2.4 EAE对糖尿病小鼠模型血糖的影响
如表3所示,STZ注射3周后,与NC组相比,DC组、PC组、高、中、低剂量处理组小鼠血糖从6.0 mmol/L显著升高至16.9、17.3、17.5、17.6、17.8 mmol/L(P<0.01,P<0.01,P<0.01,P<0.01,P<0.01),说明各模型组糖尿病小鼠模型形成。
表3 EAE对糖尿病小鼠模型空腹血糖的影响
Table 3 Effect of EAE on fasting blood glucose in diabetic mice model
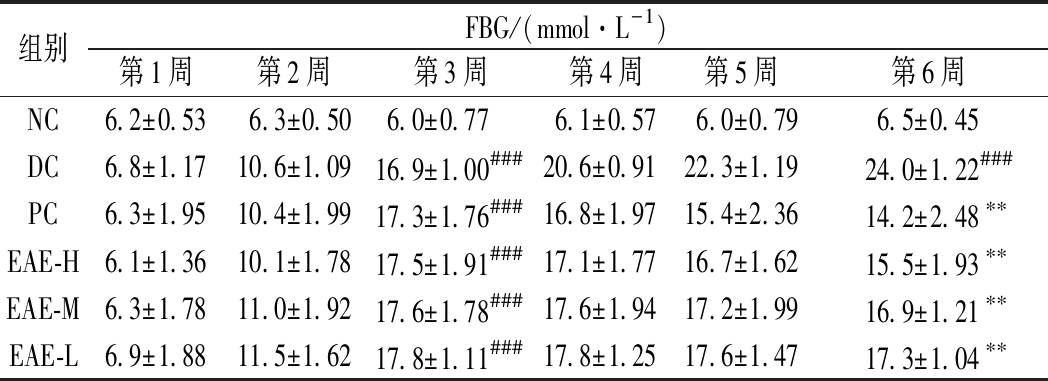
组别FBG/(mmol·L-1)第1周第2周第3周第4周第5周第6周NC6.2±0.536.3±0.506.0±0.77 6.1±0.576.0±0.796.5±0.45DC6.8±1.1710.6±1.0916.9±1.00###20.6±0.9122.3±1.1924.0±1.22###PC6.3±1.9510.4±1.9917.3±1.76###16.8±1.9715.4±2.3614.2±2.48∗∗EAE-H6.1±1.3610.1±1.7817.5±1.91###17.1±1.7716.7±1.6215.5±1.93∗∗EAE-M6.3±1.7811.0±1.9217.6±1.78###17.6±1.9417.2±1.9916.9±1.21∗∗EAE-L6.9±1.8811.5±1.6217.8±1.11###17.8±1.2517.6±1.4717.3±1.04∗∗
EAE处理6周后,与NC组相比,DC组小鼠血糖从6.5 mmol/L升高至24.0 mmol/L,显著升高270%(P<0.01)。与DC组相比,PC组、高、中、低剂量处理组血糖从24.0 mmol/L分别降低至14.2、15.5、16.9、17.3 mmol/L,显著降低40%、35%、29%、27%(P<0.01,P<0.01,P<0.01,P<0.01),说明处理组血糖含量有不同程度的减少。
通过尾静脉取血法测定0、30、60、120 min时小鼠空腹血糖水平,EAE处理前后小鼠OGTT水平和血糖线下面积(area under curve,AUC)显示(图3),灌胃葡萄糖30 min内,NC组小鼠血糖由6.53 mmol/L升高至13.47 mmol/L,显著升高106%(P<0.01),DC组小鼠血糖由24.05 mmol/L升高至28.67 mmol/L,显著升高19%(P<0.01),PC组、高、中、低剂量处理组血糖分别从17.26、19.90、21.47、22.55 mmol/L升高至25.55、26.63、25.73、27.12 mmol/L,极显著升高48%(P<0.01)、33%(P<0.01)、19%(P<0.01)、20%(P<0.01)。第120 min时,NC组小鼠血糖下降至8.67 mmol/L,DC组小鼠血糖下降至25.83 mmol/L,PC组、高、中、低剂量处理组血糖分别降低至18.27、20.91、23.06、24.32 mmol/L。
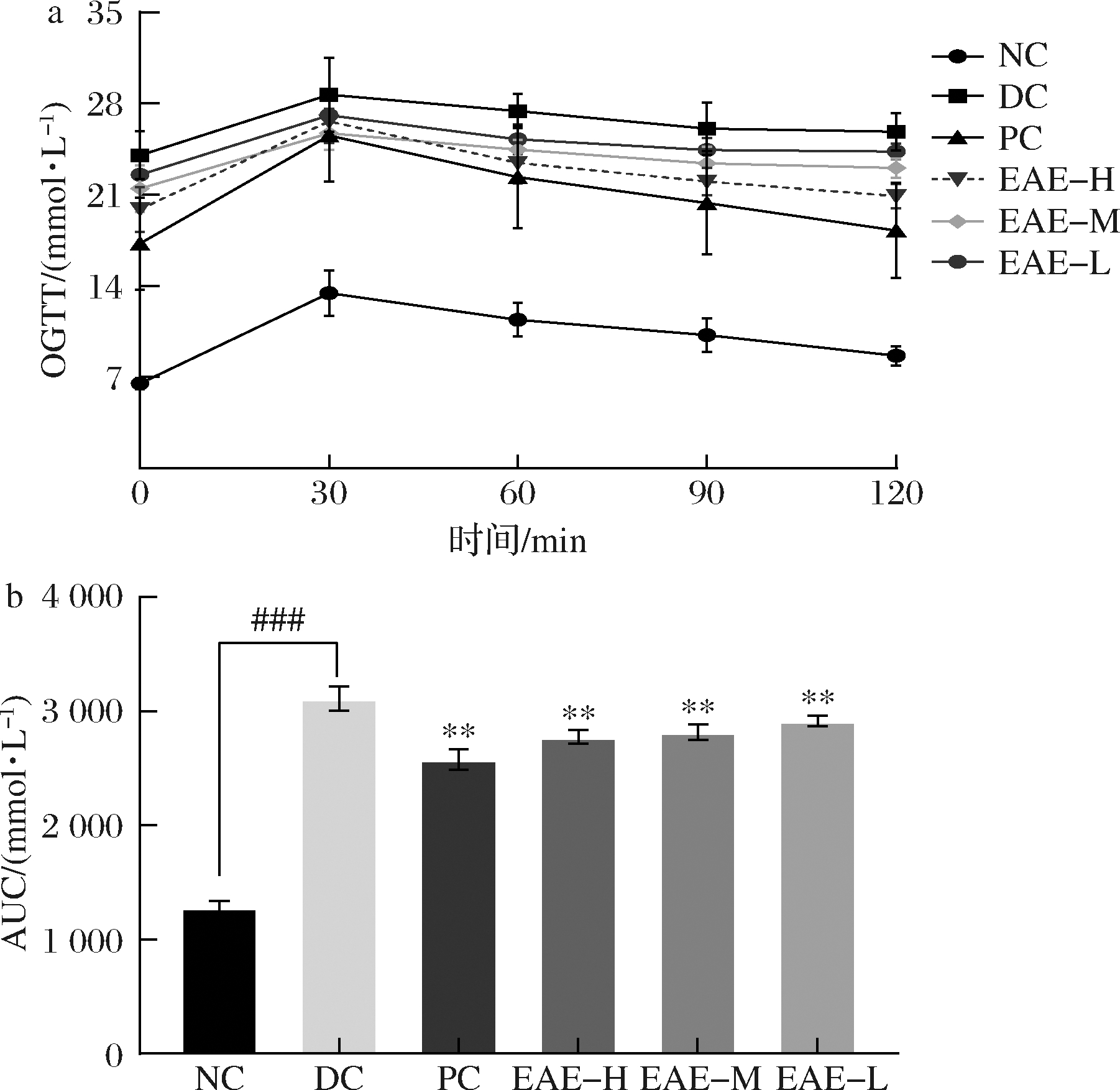
a-OGTT;b-AUC
图3 EAE对糖尿病小鼠模型口服糖耐量和
血糖曲线下面积的影响
Fig.3 Effect of EAE on oral glucose tolerance and area under the glucose curve in diabetic mice models
与NC组相比,DC组AUC值从1 282.10 mmol/L显著升高至3 113.81 mmol/L(P<0.01)。与DC组相比,PC组、高、中、低剂量处理组AUC值从3 113.81 mmol/L分别显著降低至2 581.76、2 775.43、2 819.63、2 918.77 mmol/L(P<0.01,P<0.01,P<0.01,P<0.05),说明EAE可缓解餐后血糖含量升高。
2.5 EAE对糖尿病小鼠模型体重的影响
每周称量记录小鼠体重,EAE处理前后小鼠体重水平如图4所示,经过3周干预,与NC组相比,DC组小鼠体重从28.16 g降低至25.45 g,显著降低9%(P<0.01)。第6 周时,与NC组相比,DC组小鼠体重从29.08 g降低至24.91 g,显著降低14%(P<0.01),说明Ⅱ型糖尿病导致DC组小鼠体重下降。
从第3周开始,与DC组相比,PC组、高、中、低剂量处理组体重从24.91 g分别升高至27.43、27.11、26.46、25.94 g,显著升高10%、8%、6%、4%(P<0.01,P<0.01,P<0.01,P<0.01)。第3 周与第6 周相比,DC组小鼠体重从25.45 g降低至24.91 g,极显著降低2%(P<0.01),PC组、高、中、低剂量处理组体重分别从26.04、26.01、25.11、24.92 g显著升高至27.43、27.11、26.46、25.94 g(P<0.01,P<0.01,P<0.01,P<0.01),说明EAE可以缓解Ⅱ型糖尿病模型小鼠体重下降情况。
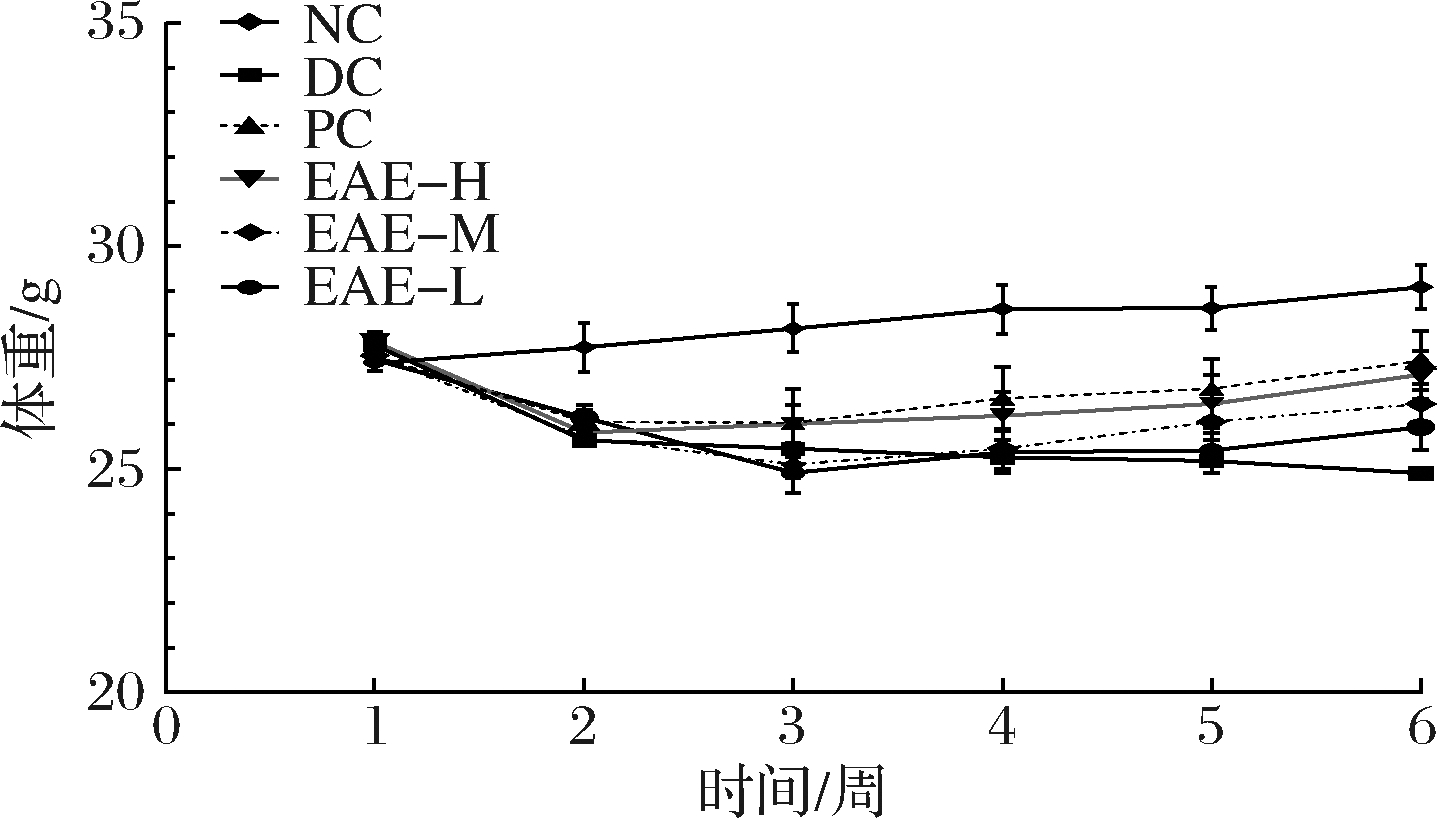
图4 EAE对糖尿病小鼠模型体重的影响
Fig.4 Effect of EAE on the body weight of diabetic mice models
注:第1~3周为建立糖尿病小鼠模型,第4~6周为EAE处理
3 结论与讨论
糖尿病通常会导致机体出现饮食量和排尿量增加,体重不正常降低等症状[17]。高脂高糖喂养结合STZ注射构建糖尿病小鼠模型,EAE处理3周后,与NC组相比,DC组小鼠饮食量增加,排尿增多,体重下降,说明高脂高糖喂养结合STZ注射导致DC组小鼠出现糖尿病相关症状。
TNF-α和IL-6是由炎症类细胞分泌的炎症因子[18],糖尿病患者机体内会产生慢性炎症。EAE处理3周,与DC组相比,PC组、高、中剂量处理组的TNF-α、IL-6水平显著降低(P<0.01),低剂量处理组的TNF-α水平显著降低(P<0.05),IL-6水平有所下降,但无显著性差异,肝脏损伤有不同程度的缓解,结果显示EAE能降低糖尿病小鼠模型血清的TNF-α、IL-6水平,减轻炎症反应,说明三叶木通所含成分具有抗炎作用,与前人研究结果一致[19]。
TC、TG、LDL-C、HDL-C含量异常说明机体出现血脂代谢紊乱情况[20-23]。与DC组相比,PC组、高、中、低剂量处理组经相应处理后,TC、LDL-C含量显著减少(P<0.05),PC组、高、中剂量处理组TG含量显著减少(P<0.05),HDL-C水平显著升高(P<0.05),结果表明EAE能降低模型组小鼠血清中TC、TG、LDL-C水平,升高HDL-C水平,缓解DC组小鼠体内的代谢紊乱。
机体血糖水平是判定糖尿病指标之一[24]。在高脂高糖饮食联合STZ注射作用下,第3周时DC组、PC组、高、中、低剂量处理组小鼠血糖值均>11.1 mmol/L,与NC组相比均显著升高(P<0.01),说明糖尿病动物模型构建成功。EAE处理3周后,与DC组相比PC组、高、中、低剂量处理组血糖水平均显著降低(P<0.05),降低效果PC组>EAE-H组>EAE-M组>EAE-L组。
OGTT与AUC可以表明机体的糖负荷能力,AUC与机体胰岛素敏感度呈负相关[25]。根据图3,各糖尿病小鼠模型的血糖-时间曲线均在NC组之上,在30 min时达到最高值,在120 min时趋于平稳。DC组AUC显著高于NC组(P<0.01),说明糖尿病小鼠模型体内的胰岛素敏感度低于正常组。与DC组相比,PC组、高、中、低剂量处理组AUC显著降低,说明EAE可以调节餐后血糖。
不明原因的体重降低是糖尿病患者最明显的体征变化[26],经饮食和STZ注射联合作用后,与NC组相比,模型组小鼠体重显著降低(P<0.01),EAE处理3周后,与DC组相比,PC组、高、中、低剂量处理组体重显著升高(P<0.01),说明EAE可以改善糖尿病小鼠模型体重减少的现象。EAE可减轻机体炎症反应,缓解肝脏炎症损伤,调节血脂代谢,抑制糖尿病血糖升高,改善机体体重减少现象。
糖尿病患者往往伴随着机体免疫力的下降。减轻炎症反应、调节血脂代谢紊乱可提升抗氧化能力,而抗氧化能力与机体的免疫力有关[27]。EAE可降低TNF-α、IL-6水平,提升抗氧化能力,进而帮助机体有效调节血脂代谢途径,改善紊乱,最终表现为血糖值下降,体重下降速度减缓。
[1] SOUSA M, BRUGES-ARMAS J.Monogenic diabetes:Genetics and relevance on diabetes mellitus personalized medicine[J].Current Diabetes Reviews, 2020, 16(8):807-819.
[2] 郑启文, 车前子, 陈思, 等.基于系统生物学方法的2型糖尿病遗传易感标志物的挖掘[J].中国慢性病预防与控制, 2020, 28(2):101-105.
ZHENG Q W, CHE Q Z, CHEN S, et al.The genetic susceptibility markers of type 2 diabetes mellitus identified by system biology approach[J].Chinese Journal of Prevention and Control of Chronic Diseases, 2020, 28(2):101-105.
[3] 郝国华, 曹思明, 翁文采.2型糖尿病患者并发糖尿病周围神经病变的影响因素[J].广西医学, 2018, 40(6):633-635.
HAO G H, CAO S M, WENG W C.Influencing factors of patients with type 2 diabetes mellitus complicated with diabetic peripheral neuropathy[J].Guangxi Medical Journal, 2018, 40(6):633-635.
[4] BACCHI E, NEGRI C, TARPERI C, et al.Relationships between cardiorespiratory fitness, metabolic control, and fat distribution in type 2 diabetes subjects[J].Acta Diabetologica, 2014, 51(3):369-375.
[5] HU C, JIA W P.Diabetes in China:Epidemiology and genetic risk factors and their clinical utility in personalized medication[J].Diabetes, 2018, 67(1):3-11.
[6] 康心怡, 吴浩, 崔佳文, 等.孕早期生活方式干预对妊娠期糖尿病高危孕妇妊娠结局的影响[J].现代预防医学, 2019, 46(16):2 955-2 959.
KANG X Y, WU H, CUI J W, et al.Effect of early lifestyle intervention on pregnancy outcome for high-risk pregnant women with gestational diabetes mellitus[J].Modern Preventive Medicine, 2019, 46(16):2 955-2 959.
[7] 高银宙. 加味四二汤联合六味地黄丸治疗早期糖尿病肾病的效果及对患者症状指标及免疫功能的影响[J].临床医学研究与实践, 2021, 6(19):140-142.
GAO Y Z.Effect of Jiawei Sier decoction combined with Liuwei Dihuang pill in the treatment of early diabetic nephropathy and its influences on symptom indexes and immune function of patients[J].Clinical Research and Practice, 2021, 6(19):140-142.
[8] ZHENG Y H, REN C Y, SHEN Y, et al.A cross-sectional study on the correlation between inflammatory cytokines, negative emotions, and onset of peripheral neuropathy in type 2 diabetes[J].Neuropsychiatric Disease and Treatment, 2020, 16:2 881-2 890.
[9] 傅方洁, 金丽媛, 董颖, 等.2型糖尿病肺功能损害的相关机制及治疗进展[J].医学综述, 2021, 27(8):1 596-1 600.
FU F J, JIN L Y, DONG Y, et al.Progress in mechanism and treatment of pulmonary dysfunction in patients with type 2 diabetes mellitus[J].Medical Recapitulate, 2021, 27(8):1 596-1 600.
[10] 吴连花, 徐文芬, 何顺志.我国木通科药用植物的种类与分布[J].安徽农业科学, 2010, 38(26):14 325-14 326;14 238.
WU L H, XU W F, HE S Z.Species and distribution of medicinal plants of Lardizabalaceae in China[J].Journal of Anhui Agricultural Sciences, 2010, 38(26):14 325-14 326;14 238.
[11] MIMAKI Y, KURODA M, YOKOSUKA A, et al.Triterpenes and triterpene saponins from the stems of Akebia trifoliata[J].Chemical and Pharmaceutical Bulletin, 2003, 51(8):960-965.
[12] NAVARRO DEL HIERRO J, HERRERA T, FORNARI T, et al.The gastrointestinal behavior of saponins and its significance for their bioavailability and bioactivities[J].Journal of Functional Foods, 2018, 40:484-497.
[13] 郑勇, 廖勤俭, 周韩玲, 等.三叶木通果皮活性成分的研究[J].食品与发酵科技, 2018, 54(6):57-60.
ZHENG Y, LIAO Q J, ZHOU H L, et al.Study on active components of the peel of Akebia trifoliate[J].Food and Fermentation Sciences and Technology, 2018, 54(6):57-60.
[14] XU J, WANG X D, ZHANG H Y, et al.Synthesis of triterpenoid derivatives and their anti-tumor and anti-hepatic fibrosis activities[J].Natural Product Research, 2018, 34(6):766-772.
[15] 丁林玲, 谢颖欣, 高伟, 等.三叶木通果肉提取物的体外抗氧化及抑制α-葡萄糖苷酶和乙酰胆碱酯酶能力[J].南方农业学报, 2021, 52(4):1 058-1 065.
DING L L, XIE Y X, GAO W, et al.In vitro antioxidant activities,α-glucosidase and acetylcholinesterase inhibition ability of Akebia trifoliata pulp extracts[J].Journal of Southern Agriculture, 2021, 52(4):1 058-1 065.
[16] 甘亚利, 韩晓春, 刘彩红, 等.建立2型糖尿病大鼠模型的研究进展[J].西部中医药, 2020, 33(5):152-154.
GAN Y L, HAN X C, LIU C H, et al.Research progress of establishing rat models of type two diabetes mellitus[J].Western Journal of Traditional Chinese Medicine, 2020, 33(5):152-154.
[17] WU S Y, ZUO J H, CHENG Y, et al.Ethanol extract of Sargarsum fusiforme alleviates HFD/STZ-induced hyperglycemia in association with modulation of gut microbiota and intestinal metabolites in type 2 diabetic mice[J].Food Research International, 2021, 147:110550.
[18] JANG S Y, CHOI S H, KIKKAWA D, et al.Association of fibroblast growth factor 10 with the fibrotic and inflammatory pathogenesis of Graves’ orbitopathy[J].PLoS One, 2021, 16(8):e0255344.
[19] WANG X, LIU R, ZHANG W, et al.Oleanolic acid improves hepatic insulin resistance via antioxidant, hypolipidemic and anti-inflammatory effects[J].Molecular and Cellular Endocrinology, 2013, 376(1-2):70-80.
[20] SHA Z J, LI C F, TANG S H, et al.Efficacy and mechanism of new resource medicinal materia Moringa oleifera leaves against hyperlipidemia[J].China Journal of Chinese Materia Medica, 2021, 46(14):3 465-3 477.
[21] CHEN L L, KAN J T, ZHENG N N, et al.A botanical dietary supplement from white peony and licorice attenuates nonalcoholic fatty liver disease by modulating gut microbiota and reducing inflammation[J].Phytomedicine, 2021, 91:153693.
[22] WANG G H, JIN J, LIU Y Q, et al.The changes of Lp-PLA2 in patients with gestational diabetes and its clinical significance[J].Medicine, 2021, 100(30):e26786.
[23] 张婷, 李树法, 孟凡东, 等.血清三酰甘油/高密度脂蛋白胆固醇比值在2型糖尿病合并代谢综合征中预测价值[J].安徽医药, 2021, 25(8):1 509-1 513.
ZHANG T, LI S F, MENG F D, et al.The predictive value of serum TG/HDL-C ratio in type 2 diabetes mellitus with metabolic syndrome[J].Anhui Medical and Pharmaceutical Journal, 2021, 25(8):1 509-1 513.
[24] HOSSAIN M S, BARUA A, TANIM M A H, et al.Ganoderma applanatum mushroom provides new insights into the management of diabetes mellitus, hyperlipidemia, and hepatic degeneration:A comprehensive analysis[J].Food Science and Nutrition, 2021, 9(8):4 364-4 374.
[25] LI X F, XU Q, JIANG T, et al.A comparative study of the antidiabetic effects exerted by live and dead multi-strain probiotics in the type 2 diabetes model of mice[J].Food and Function, 2016, 7(12):4 851-4 860.
[26] 徐伟,何艳,罗涌, 等.利拉鲁肽联合二甲双胍对肥胖2型糖尿病患者糖脂代谢、血管内皮功能及微炎症状态的影响[J].现代生物医学进展, 2021, 21(6):1 107-1 111.
XU W, HE Y, LUO Y, et al.The effect of lilaluptide combined with metformin on glucose and lipid metabolism, vascular endothelial function and microinflammation in obese type 2 diabetic patients[J].Progress in Modern Biomedicine, 2021, 21(6):1 107-1 111.
[27] 赵京杨, 邓昌彦, 熊远著.超营养剂量酵母硒对荷瘤小鼠抗氧化和免疫机能的影响[J].营养学报, 2007, 29(1):35-38.
ZHAO J Y, DENG C Y, XIONG Y Z.Effects of supranutritional levels of yeast-selenium on antioxidation status and immune function in mice with tumour[J].Acta Nutrimenta Sinica, 2007, 29(1):35-38.