豆蔻类香辛料作为我国传统的调味品广泛应用于五香粉、十三香粉以及民间烹饪配方中,与其他香辛料混合用于煮、卤、烧、烫等菜式,同时也是肉制品加工中重要的香辛料添加物。常见品种有姜科植物草豆蔻(Alpinia katsumadai Hayata)、草果(Amomum tsaoko Crevost et Lemarie)、小豆蔻[Elettaria cardamomum (L.) Maton]、香豆蔻(Amomum subulatum Roxb.)、白豆蔻(Amomum kravanh Pierre ex Gagnep.)以及肉豆蔻科植物肉豆蔻(Myristica fragrans Houtt.)的干燥近成熟种子,主要产于我国云南、广西、广东、海南等地,味辛、性温,具有去异增香的作用。GB/T 12729.1—2008《香辛料和调味品名称》中规定小豆蔻、肉豆蔻、草果、香豆蔻作为食品香辛料添加剂适用于香辛料和调味品的生产、流通、使用及有关科研和教学,且没有限量要求,可以按需使用。而卫法监发[2002]51号关于进一步规范保健食品原料管理通知中将白豆蔻添加入保健食品的添加剂中。2016年6月29日,中国台湾地区“卫福部食药署”发出FDA食字第10599903151号函,将草豆蔻列为药食两用产品,同时也是食品准用添加剂,在肉制品加工中按生产需要适量使用。由此草豆蔻、白豆蔻、小豆蔻、肉豆蔻、草果以及香豆蔻均为食品准用香辛料添加剂。豆蔻类香辛料中含有挥发油、二苯庚烷类、黄酮类、糖苷类等物质,其中山姜素(alpinetin,ALP)和小豆蔻明(cardamonin,CAR)含量较高,且两者互为同分异构体,在不同pH值、温度条件下相互转化,通常共存于上述豆蔻类香辛料中。据文献报道山姜素和小豆蔻明具有多种生物活性[1]:山姜素具有血管松弛剂、降血糖、抗感染等活性[2];小豆蔻明具有抗炎、抗菌、抗肿瘤[3]等活性。目前2种物质已应用于医药行业。
丙烯醛(acrolein,ACR)存在于各种热加工食品中,如熟肉、糖蜜、咸猪肉、鱼肉、烘焙咖啡、炸薯片薯条、乳酪等[4]以及大多数酒精饮料中[5],其主要由碳水化合物和氨基酸的热降解[6]、甘油脱水热处理和脂质过氧化[7-8]和微生物代谢和发酵[9]等形成。由饮食摄入的ACR是体内ACR的重要来源之一,不考虑环境吸入,以食品含有ACR上限计算,成年人仅从食物中摄入的ACR即达17 μg/(kg BW·d),远超世界卫生组织(World Health Organization,WHO)推荐的ACR日耐受摄入量:7.5 μg/(kg BW·d)[10]。摄入体内的ACR能够与巯基、氨基等基团反应形成有害加合产物[11],并引起蛋白质的交联[12]和DNA损伤[13],具有较高的细胞毒性。ACR已经被国际癌症研究机构(International Agency for Research on Cancer,IARC)确认为第III类致癌物[14],ACR在体内积聚易引起多种慢性病,如心脑血管及神经退役性病变、阿尔兹海默病、帕金森氏症等[12]。国内外大量研究报道了黄酮类化合物能有效捕获ACR从而降低体系中ACR的含量,如槲皮素[15]、橙皮素[16]、染料木素[17]等,其A环的C-5或C-7号位作为活性位点,能够通过迈克尔加成反应结合ACR形成产物,从而有效捕获ACR并降低游离ACR的毒性。本实验室前期研究发现,山姜素和小豆蔻明在小鼠体内能有效捕获ACR形成加合产物[18],而在高温条件下,食品复杂体系中两者是否依然具有抑制ACR的功能活性,国内外尚未见文献报道。鉴于此本研究设计以富含山姜素和小豆蔻明的香辛料为载体,拟考察其对高温加工过程中产生的ACR的抑制效果。
肉松是中国及东南亚一带喜闻乐见的休闲小吃,深受消费者喜爱。市售肉松按加工方式不同主要分为肉粉松、油酥肉松和太仓式肉松,肉松产品中ACR的含量尚未见报道。但高温加工肉制品ACR的含量已有大量文献报道,如:GOSETTI等[19]研究了烟熏三文鱼、烤法兰克福香肠、烤牛排、烤猪排和猪肉汁中ACR的含量,分别达到57、93、51、87、62 μg/kg。刘孟健[20]发现在道口烧鸡中ACR占总挥发物的7.4%。由于肉松制作过程中的煮制和高温炒制工艺,极有可能产生一定量的ACR,因此,本文首先抽样分析了市场不同类别肉松中ACR的含量,针对危害物ACR筛分富含山姜素和小豆蔻明的常用豆蔻类香辛料,并建立了定量分析山姜素和小豆蔻明的方法,对优选出高含量的香辛料,参照GB 2760—2014《食品安全国家标准 食品添加剂使用标准》添加到肉松加工体系中,研究其对肉松加工过程产生的ACR的抑制活性和作用机制。从而为开发食用级新型ACR抑制剂提供新思路。
1 材料与方法
1.1 材料与试剂
山姜素(含量98%),成都埃法生物科技公司;小豆蔻明(含量98%),西安天丰生物科技公司;山姜素-丙烯醛(含量98%,实验室自制),小豆蔻明-丙烯醛(含量98%,实验室自制),甲醇(色谱纯),美国EMD Millipore公司;水为纯化水;其余试剂均为国产分析纯。不同品种豆蔻购自玉林市升鼎聚原生中草药有限公司,由中国药科大学中药学院濮社班教授鉴定分别为姜科植物草豆蔻(Alpinia katsumadai Hayata)的干燥种仁,肉豆蔻科植物肉豆蔻(Myristica fragrans Houtt.)的干燥种仁,姜科植物草果(Amomum tsaoko Crevost et Lemarie)的干燥种仁,姜科植物白豆蔻的干燥种仁(Amomum kravanh Pierre ex Gagnep.),姜科植物小豆蔻[Elettaria cardamomum (L.) Maton]的干燥种仁,姜科植物香豆蔻(Amomum subulatum Roxb.)的干燥种仁。太仓肉松,海苔肉松,油酥肉松和肉粉松购自江苏省天猫超市,猪肉及调味料(食盐、料酒、白砂糖、酱油等)为南京市苏果超市购买。
1.2 仪器与设备
Waters XEVO TQ-XS串联三重四极杆液质联用仪(配有ESI电喷雾离子源和MassLynx数据处理系统), 美国Waters公司;FA2004分析天平,上海衡际科学仪器有限公司;WF177型粉碎机,天津市泰斯特仪器有限公司。
1.3 UPLC-MS/MS同步分析山姜素和小豆蔻明方法的建立
1.3.1 标准溶液的配制
精密称取山姜素和小豆蔻明1 g(精确至0.001 g),用甲醇配制质量浓度为1.000 mg/mL的山姜素和小豆蔻明标准储备液,置于-20 ℃保存。将标准储备液按一定比例稀释,配制成质量浓度为2.000 μg/mL的山姜素和小豆蔻明混合标准溶液工作液,置于-4 ℃保存。制作标准曲线时,将工作液按比例稀释,配制质量浓度分别为0.004、0.100、0.200、0.400、1.000、2.000 μg/mL的山姜素和小豆蔻明混合标准系列溶液。采用LC-MS/MS方法进行分析。
1.3.2 色谱条件
采用ACQUITY UPLC BEH C18色谱柱(2.1 mm×50 mm,1.7 μm)。流动相A为0.1%甲酸水,流动相B为乙腈,流动相梯度:0~2 min:20% B,2~4 min:20%~80% B,4~5 min:80% B,5~5.5 min:80%~95% B,5.5~7 min:95% B,7~8 min:95%~20% B。流速0.4 mL/min,柱温40 ℃,进样量10 μL。
1.3.3 质谱条件
离子源:电喷雾离子源,正离子模式;脱溶剂气温度500 ℃;脱溶剂气流速1 000 L/h;锥孔气流速150 L/h;雾化器流速0.7 MPa;碰撞气流速0.15 mL/min;毛细管电压2.55 kV;锥孔电压20 V;碰撞能量20 eV;以母离子m/z 271[M+H]+和子离子m/z 167[M+H]+检测山姜素/小豆蔻明。
1.4 六种豆蔻类香辛料中山姜素和小豆蔻明含量测定
取草豆蔻、肉豆蔻、草果、白豆蔻、小豆蔻和香豆蔻粉碎,过50目筛,精密称定0.5 g(精确至0.001 g),置于圆底烧瓶中,精密加入甲醇25 mL,80 ℃加热回流2 h,过滤收集滤液,将滤渣重复提取1次,合并2次滤液用甲醇定容至100 mL,采用上述UPLC-MS/MS方法测定山姜素和小豆蔻明的含量。
1.5 草豆蔻抑制肉松中ACR含量和机制的研究
1.5.1 市售肉松中ACR含量分析
肉松中ACR的含量分析参考本实验室建立的高效液相色谱仪配二极管阵列检测器(high-performance liquid chromatography-diode array detection,HPLC-DAD)方法[21],采用2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH)为衍生化试剂。
准确称取3 g(精确至0.01 g)肉松样品置于50 mL离心管中,加入5.0 mL蒸馏水,涡旋混合3 min,8 000 r/min离心10 min,取上清液。再向离心管中加入5.0 mL 50%的甲醇水溶液,涡旋混合后超声萃取60 min,8 000 r/min离心10 min,再次取上清液,将2次上清液合并混匀,8 000 r/min离心15 min,取上清液进行衍生化。
DNPH衍生化ACR:取500 μL上清液,加入300 μL DNPH溶液,涡旋混匀后于37 ℃,220 r/min的恒温摇床中避光反应2 h,反应结束后加入3 mL二氯甲烷溶液,涡旋30 s,超声萃取15 min(冰浴),6 000 r/min离心10 min,重复萃取2次,合并二氯甲烷相,真空浓缩至干,取300 μL 70%乙腈溶液复溶,用高效液相色谱检测ACR-DNPH含量。对比不同品种肉松中ACR的含量。
1.5.2 肉松的制备
以猪肉1 000 g计,其他配料为食盐10 g、味精6 g、白砂糖100 g、生抽30 g、老抽10 g、葱、姜、黄酒适量,草豆蔻粉末适量。
猪肉平均分为A、B、C 3组,每组1 000 g猪肉,其中A组为不添加配料和草豆蔻的空白组、B组为仅添加配料不添加草豆蔻的空白对照组、C组为添加配料和草豆蔻的实验组,在煮制和炒松阶段分次添加20 g(2%),40 g(4%),60 g(6%)草豆蔻粉末(以1 000 g猪肉计算)制作草豆蔻肉松样品。参考文献[22]的工艺流程制作肉松,主要流程为原料肉的选择,煮制,撕松,炒松,捡松,冷却包装。
自制肉松空白样品采用1.5.1方法分析ACR含量,与市售肉松中含量进行比较。
1.5.3 草豆蔻抑制肉松ACR活性分析
将不同肉松样品粉碎,参照1.5.1中方法提取ACR并衍生化,HPLC-DAD检测ACR-DNPH含量。对比添加草豆蔻和不添加草豆蔻样品中ACR的含量,计算得出添加草豆蔻样品中ACR清除率,如公式(1)所示:
ACR清除率![]()
(1)
1.5.4 UPLC-MS/MS分析草豆蔻抑制ACR机制
将实验室前期获得小豆蔻明/山姜素与ACR的加合产物CAR-ACR和ALP-ACR的纯品(纯度98%)溶解于甲醇中,使得溶液中CAR-ACR和ALP-ACR质量浓度均为1 μg/mL,作为标准品溶液。
将不同组别的肉松样品粉碎,分别准确称取0.5 g(精确至0.001 g)置于离心管中,加入5 mL乙腈饱和的正己烷溶液,涡旋混匀2 min,再加入15 mL正己烷饱和的乙腈溶液,涡旋混匀2 min,超声20 min后静置分层取下层,按以上步骤重复提取2次,合并乙腈层旋转蒸发至干,1 mL甲醇复溶,待UPLC-MS/MS测定。
1.5.5 UPLC-MS/MS分析方法
液相条件参照1.3.2。
质谱条件如下:离子源:电喷雾离子源,正离子模式;脱溶剂气温度500 ℃;脱溶剂气流速1 000 L/h;锥孔气流速150 L/h;雾化器流速7.0 bar;碰撞气流速0.15 mL/min;采用多反应监测(MRM)模式,以327[M+H]+为母离子,283[M+H]+为子离子建立检测条件;毛细管电压2.55 kV;锥孔电压20 V;碰撞能量25 eV。
1.6 数据分析
所有实验均做3组平行,采用Excel 2010、SPSS 17.0分析实验数据,结果以平均值±标准差表示。
2 结果与分析
2.1 色谱峰确立
图1为6种豆蔻样品中山姜素和小豆蔻明的液相图(左列)、样品中推测为山姜素峰的二级质谱图(中列)和推测为小豆蔻明峰的二级质谱图(右列)。分别在6种豆蔻样品液中搜索母离子和子离子271[M+H]+和167[M+H]+,在RT=3.05 min和RT=3.74 min出现2个色谱峰,对照标准品分别为山姜素(RT=3.05 min)和小豆蔻明(RT=3.74 min),采用子离子扫描模式对二者进行扫描,发现其二级碎片离子均为167[M+H]+,与标准品一致,证明2个峰确为山姜素和小豆蔻明。此外,两者分离度良好,无杂质峰干扰,达到分析要求。由此可见,所选6种豆蔻中均含有山姜素和小豆蔻明。

注:左列为6种豆蔻样品中ALP和CAR的液相图;中列为样品中推测为ALP峰的二级质谱图;右列为推测为CAR峰的二级质谱图
图1 样品中山姜素(ALP)和小豆蔻明(CAR)的MRM质谱图
Fig.1 MRM chromatograms of ALP and CAR in sample
2.2 方法学考察
2.2.1 标准曲线、线性范围和检出限及定量限测定结果
配制不同质量浓度(0.004 0~2.000 0 μg/mL)的山姜素和小豆蔻明混合标准系列溶液,按1.3.2和1.3.3条件进行测定,以标准样品质量浓度为横坐标,定量离子对的信号响应峰面积为纵坐标,绘制标准曲线。分别以信噪比3和10对应的质量浓度确定方法的检出限和定量限,结果如表1所示,山姜素与小豆蔻明在0.004 0~2.000 0 μg/mL范围内线性关系良好。
表1 标准曲线建立
Table 1 Establishment of standard curve

分析物标准曲线相关系数线性范围/(μg·mL-1)检出限/(μg·mL-1)定量限/(μg·mL-1)小豆蔻明y=4.54×107x+2.74×1050.997 80.004 0~2.000 00.000 20.000 6山姜素y=9.24×106x+1.74×1050.996 00.004 0~2.000 00.000 50.001 5
2.2.2 精密度实验
精密吸取质量浓度为0.2 μg/mL样品溶液10 μL,按1.3.2和1.3.3条件连续进样6次,记录峰面积,计算得山姜素与小豆蔻明峰面积的相对标准偏差(relative standard deviation,RSD)值分别为0.829%、0.880%,表明仪器的精密度良好。
2.2.3 稳定性实验
取同一批次供试样品,放置于室温(25 ℃),分别于0、2、4、8、12、24 h进样测定,记录峰面积,结果表明,样品中山姜素和小豆蔻明的RSD值分别为草豆蔻(2.54%,2.28%),草果(0.21%,0.20%),小豆蔻(2.52%,0.37%),香豆蔻(2.84%,2.18%),肉豆蔻(3.93%,4.84%),白豆蔻(3.56%,4.02%),表明24 h内,供试品溶液稳定性良好。
2.2.4 加样回收率实验
为评估方法的准确性,以草豆蔻为代表,分别添加3个水平(低、中、高)山姜素和小豆蔻明的对照品溶液,按1.3.1方法制备供试品溶液,进样分析,计算加样回收率。结果见表2,样品中山姜素和小豆蔻明平均回收率分别为95.10%和95.80%,RSD分别为4.15%和2.96%,表明该方法准确度良好。
表2 加样回收率
Table 2 Sample recovery rate
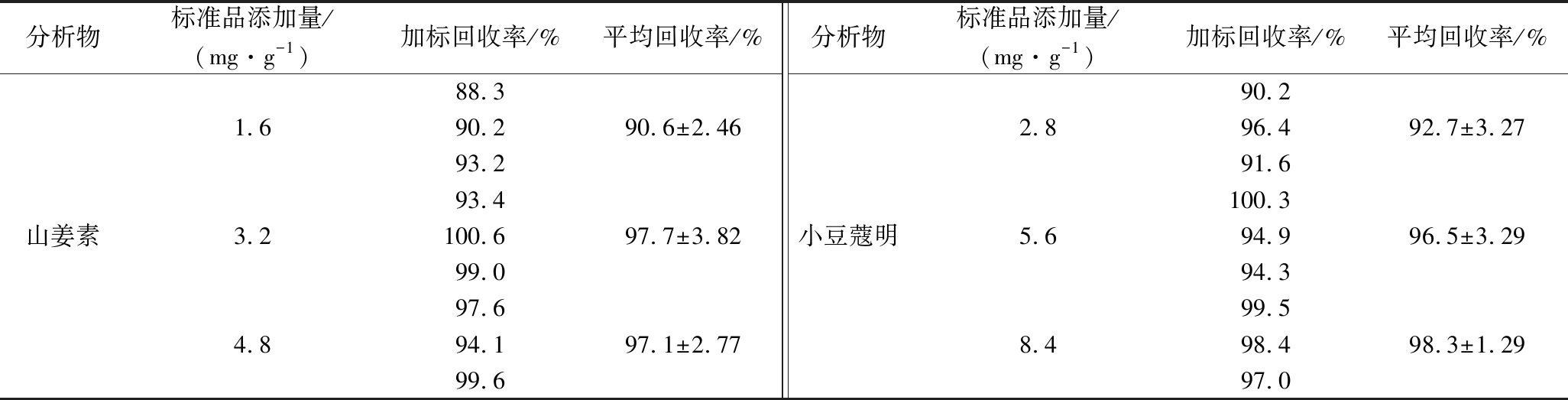
分析物标准品添加量/(mg·g-1)加标回收率/%平均回收率/%分析物标准品添加量/(mg·g-1)加标回收率/%平均回收率/%山姜素1.63.24.888.390.293.293.4100.699.097.694.199.690.6±2.4697.7±3.8297.1±2.77小豆蔻明2.85.68.490.296.491.6100.394.994.399.598.497.092.7±3.2796.5±3.2998.3±1.29
2.3 六种豆蔻香辛料中山姜素和小豆蔻明含量
采用上述方法测定6种豆蔻类香辛料中山姜素和小豆蔻明的含量,结果见表3,6种豆蔻类香辛料中均含有山姜素和小豆蔻明,其中草豆蔻中2种成分的含量远高于其他5种,山姜素含量达到(3.297±0.265)mg/g,小豆蔻明含量达到(5.528±0.083)mg/g,总含量达到8.825 mg/g。相关文献报道,草豆蔻中山姜素含量为8.610 mg/g、小豆蔻明含量为0.940 mg/g[23]。该样品中的山姜素和小豆蔻明含量与文献报道的数值[23]有一定差异,但两者总含量与之差异不大。其原因可能为小豆蔻明和山姜素之间存在C环的开环、关环之间的相互转化[24]。
表3 豆蔻类香辛料中山姜素和小豆蔻明含量
Table 3 Alpinetin and cardamonin contents in six kinds cardamom spices

样品种类编号山姜素含量/(mg·g-1)小豆蔻明含量/(mg·g-1)草豆蔻AKH-13.297±0.2655.528±0.083肉豆蔻MFH-10.133±0.0190.031±0.018草果ATCL-10.114±0.0110.163±0.014白豆蔻AKPG-10.137±0.0140.113±0.019小豆蔻ECM-10.199±0.0170.350±0.020香豆蔻ASR-10.025±0.0040.078±0.016
2.4 市售肉松中ACR的含量
市售不同品种的肉松ACR含量如表4所示。5种肉松均含有一定量的ACR,含量在1.780~7.788 mg/kg。以肉松中ACR含量平均值(3.916 mg/kg)为标准,60 kg成年人每日仅需摄入114.91 g肉松,ACR含量就超过了世卫组织推荐日耐受量[7.5 μg/(kg·d)]。鉴于此,有必要减控肉松加工中ACR的含量。
表4 不同肉松中ACR的含量
Table 4 Content of ACR in different meat floss

样品名含量/(mg·kg-1)太仓肉松1.780±0.270海苔肉松7.788±0.905油酥肉松2.589±2.027肉粉松4.273±2.900实验室自制肉松3.151±1.292平均值3.916±1.478
2.5 草豆蔻对肉松加工过程中形成的ACR减控
前期试验证明,山姜素和小豆蔻明在低温下捕获ACR形成加合物,从而降低小鼠体内ACR的含量[18]。山姜素和小豆蔻明均不是食品添加剂,但草豆蔻中富含山姜素和小豆蔻明,可以作为载体以香辛料形式添加到肉品加工过程中,且草豆蔻作为食品香辛料没有添加限量要求。本实验设计了豆蔻风味肉松,并邀请10位同学组成感官鉴评小组, 从肉松的组织状态、色泽、气味、滋味与杂质4个方面进行打分, 总分为100分, 取10人评分的平均值为样品最终分数, 参照GB/T 23968—2009《肉松》制定了感官评分标准,详见增强出版附件(https://doi.org/10.13995/j.cnki.11-1802/ts.031244)。通过感官鉴评小组,对草豆蔻添加量为2%、4%和6%的3种肉松进行感官评定,综合评分为80.2、77.3和82.6分。其中添加量在6%时,该肉松具有独特的豆蔻香气,可接受度良好。
液相色谱-二极管阵列检测器(liquid chromatography-diode array detection,LC-DAD)分析结果表明,在不添加任何配料的A组与添加除草豆蔻外配料的B组中ACR含量没有显著性差异,表明除草豆蔻外的糖、盐等其他配料不能降低体系中形成的ACR。以B组为空白对照组,分析测定添加草豆蔻的肉松中ACR的含量,发现其ACR含量较空白对照组均有不同程度下降,且草豆蔻对ACR的抑制率随着添加浓度的增大而提高,呈现明显的量效关系,有显著差异(P<0.05)(图2)。当添加量在6%时对ACR抑制率高达47.87%,结果显示添加草豆蔻能有效降低肉松加工过程中产生的ACR。

图2 不同草豆蔻添加量对肉松样品中ACR的抑制率
Fig.2 Inhibition rate of ACR in different levels of A. katsumadai Hayata on meat floss samples
注:不同小写字母代表不同添加量之间差异性显著(P<0.05)
2.6 UPLC-MS/MS分析草豆蔻抑制肉松中ACR作用机制
为研究添加草豆蔻降低肉松中ACR含量的作用机制,采用UPLC-MS/MS分析了添加草豆蔻前、后肉松中山姜素和小豆蔻明与ACR的作用产物。如图3所示,质谱MRM模式下,参照文献[18],在肉松样品提取液中搜索母离子和子离子:327[M+H]+(比山姜素和小豆蔻明质荷比m/z 271[M+H]+多56[Mw ACR, 56])和283[M-44+H]+(ACR与黄酮加合成环后丢失一分子[—CHOH—CH2—][17,25]),在保留时间为3.24、3.90 min处出现2个色谱峰,二者母离子均为327[M+H]+,推测山姜素/小豆蔻明与ACR发生加合反应,生成山姜素/小豆蔻明与ACR的一加合物。2个色谱峰的二级质谱均出现283[M-44+H]+,推测为山姜素/小豆蔻明加合一分子ACR(Mw 56)后丢失[—CHOH—CH2—](Mw 44)[16]片段而来。实验室前期研究表明,ALP和CAR在非高温条件下表现出显著的ACR捕获能力[18],并形成2个加合物ALP-ACR和CAR-ACR,进一步制备了2个加合物并作为标准对照品。对照标准品ALP-ACR、CAR-ACR可知,添加豆蔻肉松样品中的2个峰,其保留时间和二级碎片离子均与标准品溶液ALP-ACR/CAR-ACR一致。表明色谱峰(RT=3.24 min)为山姜素捕获ACR形成的加合产物山姜素-丙烯醛(ALP-ACR),色谱峰(RT=3.90 min)为小豆蔻明捕获ACR形成的加合产物小豆蔻明-丙烯醛(CAR-ACR)。此外,在A、B两组未添加草豆蔻的空白肉松样品中均未检出相应峰,这说明肉松本身不含有这2种物质。由此可知,在高温食品加工体系中,草豆蔻能有效抑制肉松中产生的ACR,其作用机制之一为草豆蔻中的山姜素和小豆蔻明通过捕获ACR形成2种加合产物,降低体系中ACR的含量。而草豆蔻中其他活性成分是否也参与捕获或抑制ACR的形成,有待进一步验证。

注:左列为标准品和肉松样品中ALP-ACR和CAR-ACR的液相图;中列为标准品和样品中ALP-ACR质谱图;右列为标准品和样品中CAR-ACR质谱图
图3 样品中山姜素-丙烯醛(ALP-ACR)和小豆蔻明-丙烯醛(CAR-ACR)的MRM质谱图
Fig.3 MRM chromatogram of ALP-ACR and CAR-ACR in samples
3 结论
本文建立了同步测定山姜素和小豆蔻明的UPLC-ESI-MS/MS分析方法,该方法专属性强、灵敏度高、稳定性好、检测时间短、操作较为简单,不仅适合香辛料,还可以应用于复杂食品体系中山姜素及小豆蔻明的检测。本研究测定了草豆蔻、肉豆蔻、草果、白豆蔻、小豆蔻和香豆蔻6种香辛料中山姜素和小豆蔻明的含量,结果显示,草豆蔻中山姜素和小豆蔻明含量最高,分别为(3.297±0.265)mg/g和(5.528±0.083) mg/g。在评估市场上不同品种肉松中ACR含量为1.780~7.788 mg/kg后,以香辛料草豆蔻为山姜素和小豆蔻明载体添加到特色豆蔻风味肉松中,发现草豆蔻能显著降低肉松中ACR,且呈现量效关系,当添加量6%时对ACR抑制率达到47.87%。UPLC-MS/MS分析结果表明,草豆蔻中山姜素和小豆蔻明可以通过捕获肉松中ACR形成加合物的路径,降低肉松加工中的ACR含量。6%草豆蔻添加量制作的豆蔻特色风味肉松,感官鉴评可接受度达到80%。
本研究表明草豆蔻既可以作为香辛料,又可作为高温食品加工过程产生的有害ACR的抑制剂,对有效提高食品安全化生产具有重要的现实意义和应用价值。而草豆蔻中其他活性成分是否也参与了抑制ACR活性,有待进一步考证。
[1] QIU J Y, WU H Y, FENG F, et al.Metabolic profiling of alpinetin in rat plasma, urine, bile and feces after intragastric administration[J].Molecules (Basel, Switzerland), 2019, 24(19):3458.
[2] ZHANG T, GUO S, ZHU X Y, et al.Alpinetin inhibits breast cancer growth by ROS/NF-κB/HIF-1α axis[J].Journal of Cellular and Molecular Medicine, 2020, 24(15):8 430-8 440.
[3] WANG C L, XIA Y, QU L H, et al.Cardamonin inhibits osteogenic differentiation of human valve interstitial cells and ameliorates aortic valve calcification via interfering in the NF-κB/NLRP3 inflammasome pathway[J].Food & Function, 2021, 12(23):11 808-11 818.
[4] STEVENS J F, MAIER C S.Acrolein:Sources, metabolism, and biomolecular interactions relevant to human health and disease[J].Molecular Nutrition & Food Research, 2008, 52(1):7-25.
[5] LEDAUPHIN J, LE MILBEAU C, BARILLIER D, et al.Differences in the volatile compositions of French labeled brandies (Armagnac, Calvados, Cognac, and Mirabelle) using GC-MS and PLS-DA[J].Journal of Agricultural & Food Chemistry, 2010, 58(13):7 782-7 793.
[6] WANG J Q, LU Y L, ZHENG T S, et al.Scavenging of acrolein by food-grade antioxidant propyl gallate in a model reaction system and cakes[J].Journal of Agricultural and Food Chemistry, 2019, 67(31):8 520-8 526.
[7] ZIRAK M R, MEHRI S, KARIMANI A, et al.Mechanisms behind the atherothrombotic effects of acrolein, a review[J].Food and Chemical Toxicology, 2019, 129:38-53.
[8] LEE C H, CHEN K T, LIN J A, et al.Recent advances in processing technology to reduce 5-hydroxymethylfurfural in foods[J].Trends in Food Science & Technology, 2019, 93:271-280.
[9] FERREIRA D C, NICOLLI K P, SOUZA-SILVA É A, et al.Carbonyl compounds in different stages of vinification and exposure risk assessment through Merlot wine consumption[J].Food Additives & Contaminants:Part A, 2018, 35(12):2 315-2 331.
[10] GUTH S, HABERMEYER M, BAUM M, et al.Thermally induced process-related contaminants:The example of acrolein and the comparison with acrylamide[J].Molecular Nutrition & Food Research, 2013, 57(12):2 269-2 282.
[11] CAI J, BHATNAGAR A, PIERCE W M J R.Protein modification by acrolein:Formation and stability of cysteine adducts[J].Chemical Research in Toxicology, 2009, 22(4):708-716.
[12] LOPACHIN R M, GAVIN T, PETERSEN D R, et al.Molecular mechanisms of 4-hydroxy-2-nonenal and acrolein toxicity:Nucleophilic targets and adduct formation[J].Chemical Research in Toxicology, 2009, 22(9):1 499-1 508.
[13] GREK C L, TEW K D.Redox metabolism and malignancy[J].Current Opinion in Pharmacology, 2010, 10(4):362-368.
[14] 朱梦旭. 白酒中易挥发的有毒有害小分子醛及其结合态化合物研究[D].无锡:江南大学, 2016.
ZHU M X.Volatile, toxic and small molecular aldehydes and their derivatives in Chinese liquor[D].Wuxi:Jiangnan University, 2016.
[15] ZAMORA R, AGUILAR I, GRANVOGL M, et al.Toxicologically relevant aldehydes produced during the frying process are trapped by food phenolics[J].Journal of Agricultural and Food Chemistry, 2016, 64(27):5 583-5 589.
[16] WANG W X, QI Y J, ROCCA J R, et al.Scavenging of toxic acrolein by resveratrol and hesperetin and identification of adducts[J].Journal of Agricultural and Food Chemistry, 2015, 63(43):9 488-9 495.
[17] HUANG Q J, ZHU Y D, LV L S, et al.Translating in vitro acrolein-trapping capacities of tea polyphenol and soy genistein to in vivo situation is mediated by the bioavailability and biotransformation of individual polyphenols[J].Molecular Nutrition & Food Research, 2020, 64(1):e1900274.
[18] LU Y, LIU J, TONG A Q, et al.Interconversion and acrolein-trapping capacity of cardamonin/alpinetin and their metabolites in vitro and in vivo[J].Journal of Agricultural and Food Chemistry, 2021, 69(40):11 926-11 936.
[19] GOSETTI F, CHIUMINATTO U, MAZZUCCO E, et al.Simultaneous determination of thirteen polycyclic aromatic hydrocarbons and twelve aldehydes in cooked food by an automated on-line solid phase extraction ultra high performance liquid chromatography tandem mass spectrometry[J].Journal of Chromatography A, 2011, 1 218(37):6 308-6 318.
[20] 刘孟健. 香辛料风味成分及微生物群落对烧鸡食用品质的影响[D].郑州:河南工业大学, 2014.
LIU M J.The effects of spice on flavor and quality in carbonado chicken[D].Zhengzhou:Henan University of Technology, 2014.
[21] JIANG X Y, LV H F, LU Y, et al.Trapping of acrolein by curcumin and the synergistic inhibition effect of curcumin combined with quercetin[J].Journal of Agricultural and Food Chemistry, 2021, 69(1):294-301.
[22] 张静, 祁兴普, 姚芳, 等.基于美拉德反应制备香酥肉松的研究[J].肉类工业, 2018(5):29-32.
ZHANG J, QI X P, YAO F, et al.Study on crisp fried dried meat floss prepared by Maillard reaction[J].Meat Industry, 2018(5):29-32.
[23] 邓锐, 邹毓兰, 吕海涛.微波辅助提取草豆蔻中山姜素和小豆蔻明工艺研究[J].食品工业, 2015, 36(10):184-186.
DENG R, ZOU Y L, LYU H T.Study on microwave extraction technique for alpinetin and cardamonin in Alpinia katsumadai Hayata[J].The Food Industry, 2015, 36(10):184-186.
[24] 邹毓兰, 吕海涛.草豆蔻中山姜素和小豆蔻明的HPLC测定及提取工艺优化[J].中成药, 2011, 33(1):145-148.
ZOU Y L, LYU H T.Determination of alpinetin and cardamonin in Alpinia katsumadai Hayata by HPLC and optimization of extraction technology[J].Chinese Traditional Patent Medicine, 2011, 33(1):145-148.
[25] ZHANG D M, JIANG X Y, XIAO L B, et al.Mechanistic studies of inhibition on acrolein by myricetin[J].Food Chemistry, 2020, 323:126788.