L-精氨酸在医药、畜牧等行业扮演重要角色[1]。随着遗传操作技术的发展,代谢工程改造被广泛应用于L-精氨酸高产菌株的选育中,使得L-精氨酸生产菌株的产率得到了极大的提高[2]。钝齿棒杆菌(Corynebacterium crenatum)不仅是L-脯氨酸、L-鸟氨酸、L-谷氨酸的生产菌,也是L-精氨酸的优势菌株。如图1所示,钝齿棒杆菌以葡萄糖为碳源转化为乙酰辅酶A,然后乙酰辅酶A经过三羧酸循环等代谢途径后转化成前体L-谷氨酸,L-谷氨酸通过位于同一基因簇上精氨酸主合成途径所有酶的编码argCJBDFRGH基因簇来催化合成L-精氨酸。在精氨酸合成途径中,乙酰辅酶A连接着糖酵解、三羧酸循环、氨基酸合成等重要代谢途径,是微生物代谢的重要中心枢纽[3]。乙酰辅酶A可以通过pta基因编码的磷酸乙酰基转移酶及ack基因编码的乙酸激酶合成乙酸,由于乙酸含量的积累,不仅会影响钝齿棒杆菌的生长代谢能力,也会降低乙酰辅酶A通量和L-精氨酸产率[4]。
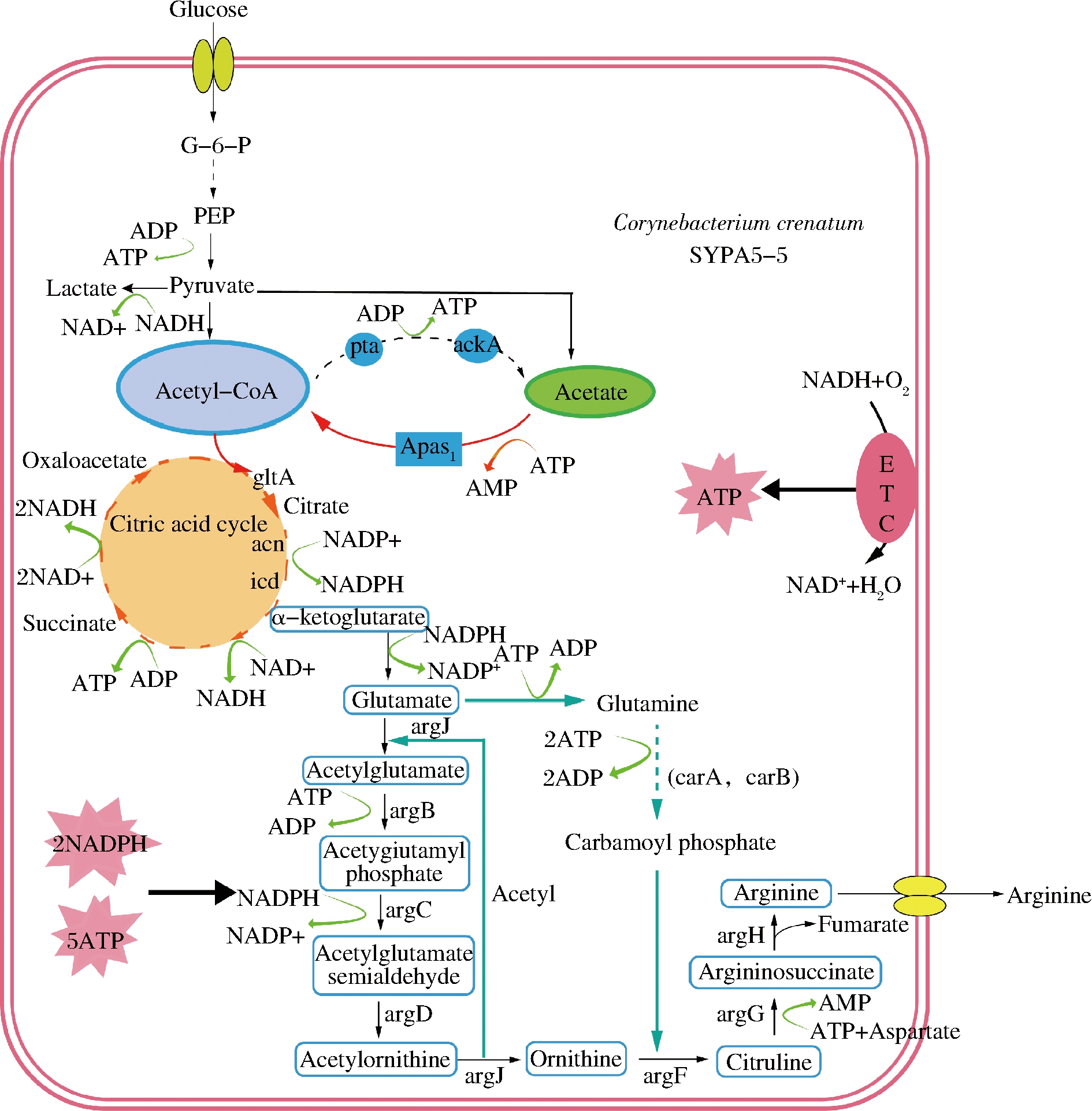
图1 钝齿棒杆菌SYPA5-5中L-精氨酸氨酸合成途径
Fig.1 L-arginine biosynthesis pathway in C. crenatum SYPA5-5
在代谢工程中,针对乙酰辅酶A通量调控的常见方法是通过乙酸途径[5],将乙酸途径合成基因敲除后,既能够降低乙酸对菌体的毒害作用,又能提高乙酰辅酶A合成。早期研究发现,pta-ack基因敲除后增强了乙酰辅酶A的通量,但同时也会增加副产物D-乳酸的含量,影响菌株的生长[6],其原因是由于乙酰辅酶A合成乙酸,是ATP的来源途径之一,且乙酸合成途径产物乙酰磷酸也是细胞信号调节的重要物质,敲除乙酸合成途径会影响流向乙酰辅酶A和丙酮酸的代谢流途径[7]。因此,如何通过改造乙酸生产途径调控乙酸与乙酰辅酶A的转化,是生产与辅酶A(coenzyme A,CoA)相关生物化学品的研究热点。ZHA等[8]在大肠杆菌中通过过表达乙酰辅酶A合成酶(acetyl-CoA synthetases,ACS),提高了乙酸流向乙酰辅酶A通量,将丙二酰辅酶A合成产率提高了4倍多。XIAO等[9]发现,乙酸能够通过ACS转化生成乙酰辅酶A,他们在大肠杆菌内表达ACS,有效利用乙酸使脂肪酸达到0.9 g/L。综上所述,过表达ACS是增强乙酸向乙酰辅酶A的转化有效策略之一。
在大肠杆菌和枯草芽胞杆菌中有1个ACS[10],巴氏醋酸杆菌(Acetobacter pasteurianus)内有2个ACS,分别为ACS1和ACS2[11]。本研究分别克隆表达了来自于Escherichia coli BL21、Bacillus subtilis subsp.subtilis str.168及Acetobacter pasteurianus ATCC 33445中的基因acs。将4种ACS克隆表达后,测定酶的pH和温度稳定性,选择最佳酶活性的来源巴氏醋酸杆菌中的ACS编码基因Apacs1,构建重组菌株SYPA5-5/pXMJ19-Apacs1(命名为SYPA-ACS),在C.crenatum中强化ACS的表达,测定重组菌株SYPA-ACS发酵产精氨酸的能力。
1 材料与方法
1.1 菌株与质粒
Corynebacterium crenatum SYPA5-5是由本实验室保藏[12]的L-精氨酸生产菌株;Escherichia coli BL21用于扩增基因Ecacs、Bacillus subtilis subsp.subtilis 168用于扩增基因Bsacs,购于中国工业微生物菌种保藏管理中心;Acetobacter pasteurianus ATCC 33445,购于ATCC工业微生物菌种保藏中心,用于扩增基因Apacs1和Apacs2;JM109,上海生物工程有限公司;质粒pET28a和pXMJ19,大连生物工程有限公司;重组质粒pET28a-Ecacs、pET28a-Bsacs、pET28a-Apacs1、pET28a-Apacs2、pXMJ19-Apacs1,均由本实验室构建,使用的菌株、质粒及引物见表1和表2。
表1 本实验所用的菌株及质粒
Table 1 Strains and plasmids used in this study

菌株/质粒特征性来源菌株E.coli JM109recA1, endA1, gyrA96, thi, hsdR17, supE44, relA1, Δ(lac-proAB),[F’traD36, proAB+, lac Iq, lacZ ΔM15]InvitrogenE.coli BL21F- ompT gal dcm lon hsdSB(rB- mB-) λ (DE3[lacI lacUV5-T7 gene 1 ind1 sam7 nin5])InvitrogenC. crenatum SYPA5-5A hyper arginine production strain, His-, SGr, D-Argr, H-Argr本实验室SYPA-ACSSYPA5-5 with pXMJ19-Apacs1本研究质粒pET28aexpression gene in E.coli, KanR本实验室pXMJ19expression gene in C.crenatum, Chl本实验室pET28a-EcacsA derivative of pET28a, harboring acs gene from E.coli under its native promoter本研究pET28a-BsacsA derivative of pET28a, harboring acs gene from B.subtilis under its native promoter本研究pET28a-Apacs1A derivative of pET28a, harboring acs gene from A.pasteurianus under its native promoter本研究pET28a-Apacs2A derivative of pET28a, harboring acs gene from A.pasteurianus under its native promoter本研究pXMJ19- Apacs1A derivative of pXMJ19, harboring acs gene from A.pasteurianus under its native promoter本研究
表2 本研究所用到的引物
Table 2 Primers used in this study

引物序列(5′-3′)ECacs-FCAAATGGGTCGCGGATCCGATGAGCCAAATTCACAAACACAECacs-RGAGTGCGGCCGCAATTACGATGGCATCGCGATABSacs-FATGGGTCGCGGATCCGATGAACTTGAAAGCGTTACBSacs-RCGAGTGCGGCCGCAATTAATCCTCCATTGTTGACAGAPacs1-FGGGTCGCGGATCCGAATTCGTGGTAGATGCGTTTTTCAPacs1-RGTGCTCGAGTGCGGCCGCAAGCTTCAGCCGTTCTGCTGAGCCACAPacs2-FGGGTCGCGGATCCGAATTCATGTCGGAAAACATCACTATC APacs2-RCGAGTGCGGCCGCAAGCTTCAGGCCCTTGCCTGTGTGCGp19-FGCTTGCATGCCTGCAGGTCGACTCTAGAAAAGGAGGACAACCGTGGTAGATGCGTTTTTCCCCGCp19-RCATCCGCCAAAACAGCCAAGCTGAATTCGAGTCAGCCGTTCTGCTGAGCCACCAGC
1.2 工具酶与试剂
质粒提取和胶回收试剂盒,上海生物工程有限公司;ATP检测试剂盒、NAD+/NADH、NADP+/NADPH检测试剂盒,上海碧云天生物技术有限公司;乙酰辅酶A(acetyl-CoA)含量测定试剂盒,齐源生物有限公司;乙酸盐检测试剂盒,金畔生物有限公司;taq DNA聚合酶、Ex taq DNA聚合酶、Primer StarDNA聚合酶、Hind Ⅲ、Xba I、EcoR I 限制性内切核酸酶,宝日医生物技术有限公司;苹果酸脱氢酶、柠檬酸合酶、L-苹果酸、CoA、ATP、NAD+,索莱宝科技有限公司;L-精氨酸、乙酸钾,阿拉丁生物试剂公司;其余所用试剂均来自于国药集团化试剂有限公司。
1.3 主要仪器设备
PCR仪、电转仪,德国Eppendorf公司;凝胶成像仪,英国UVP有限公司;恒温培养箱,上海博讯实业有限公司;往复式摇床,上海智诚有限公司;UV2000分光光度计,UNIC(上海)仪器有限公司;SBA-40C生物传感器,山东省科学院生物研究所;5 L发酵罐,Biotech上海保兴生物设备工程有限公司;1260高效液相色谱仪,美国安捷伦公司。
1.4 培养基及培养方法
Luria-Bertani(LB)液体培养基(g/L):NaCl 10,酵母粉5,蛋白胨10,pH 7.0。
醋酸杆菌培养基(g/L):葡萄糖10,酵母粉10,pH 5.5,灭菌后加入无水乙醇40 mL。
钝齿棒杆菌电转感受态培养基(g/L):吐温-80 100 μL,NaCl 10,蛋白胨10,甘氨酸3,酵母粉5。
种子培养基(g/L):酵母粉20,葡萄糖40,(NH4)2SO4 25,MgSO4·7H2O 1,KH2PO4 1.5,用氨水调pH至7.2。
摇瓶培养基(g/L):酵母粉20,葡萄糖120,(NH4)2SO440,MnSO4 0.02,FeSO4·7H2O 0.02,MgSO4·7H2O 0.5,KH2PO41.5,CaCO3 20,用氨水调 pH至 7.2。葡萄糖与其他成分分开灭菌。
5 L发酵培养基(g/L):酵母粉20,葡萄糖80,(NH4)2SO4 40,MgSO4·7H2O 0.5,KH2PO4 1.5,MnSO4 0.02,FeSO4·7H2O 0.02,用氨水调pH至7.2。
所有培养基均115 ℃灭菌20 min。
发酵培养条件:将钝齿棒杆菌菌株活化后接种于发酵培养基中,30 ℃、200 r/min摇床发酵培养96 h后测定发酵液产量。5 L发酵罐培养方法参考文献[13]。
1.5 不同来源的乙酰辅酶合成酶的筛选及酶学性质
1.5.1 乙酰辅酶合成酶表达载体的构建
经BRENDA酶数据库和NCBI基因组信息数据库分析,结合本实验室已有的菌株,分别以E. coli BL21、B. subtilis subsp.subtilis str.168和A. pasteurianus ATCC 33445的基因组为模板,采用Primer StarDNA扩增基因ECacs、Bsacs、Apacs1和Apacs2,回收目的扩增片段,目的片段再连接到线性质粒载体上,转化至大肠杆菌感受态细胞中。
1.5.2 乙酰辅酶合成酶的表达与纯化
构建成功的重组大肠杆菌活化后接种于10 mL LB 培养基,37 ℃培养8~12 h,然后转接至50 mL摇瓶中,培养菌液OD600值为0.8~1.0左右时,加入0.5 mmol/L的IPTG溶液,16 ℃下过夜诱导。诱导结束后,离心收集菌体细胞,用PBS悬浮细胞菌体2次后,最后加入5 mL PBS悬浮菌体。破碎悬浮细胞溶液直至菌液澄清,4 ℃、12 000 r/min离心20 min分离上清液与细胞沉淀,上清液通过SDS-PAGE来验证目的蛋白质[14],分析目标蛋白表达情况以及进行后续的酶活性测定或蛋白纯化实验。利用His-Trap HP 纯化柱纯化目的蛋白[15],利用牛血清血蛋白测定蛋白浓度[16]。
1.5.3 ACS活性测定
将纯化后的4种不同来源的ACS进行酶活力测定[17]。1 mL反应体系包含:100 μmol Tris-HCl(pH 7.4)、10 μmol L-苹果酸、10 μmol MgCl2、1 μmol NAD+、0.2 μmol CoA、3 U苹果酸脱氢酶、43.3 U柠檬酸合酶、10 μmol乙酸钾、10 μmol ATP、100 μL的纯化酶液,加入ATP开始反应。在柠檬酸合酶和苹果酸脱氢酶的作用下,能够将乙酰辅酶A的生成率与NADH的生成率关联起来,通过分析340 nm处的NADH的生成率,确定ACS的酶活力。
1.5.4 酶学性质的研究
酶的最适pH及温度确定:将缓冲液设定为不同pH,测定ACS最适反应pH;在不同梯度温度条件下,测定最适温度,最高酶活力定义为100%。温度稳定性研究:将缓冲液置于不同温度下(20、25、30、35、40、45、50、55、60 ℃),加入酶液后,测定相对酶活力。pH稳定性研究:将缓冲液设定为不同的pH条件(4.0、5.0、6.0、7.0、8.0、9.0、10),加入纯酶液,孵育30 min,测定相对酶活力,初始酶活力定义为100%。温度稳定性研究:将4种ACS纯酶液分别置于不同温度(20、30、40、50、60 °C),温浴1 h后测定残余酶活力,将初始测定的酶活力设置为100%。动力学参数研究:改变底物浓度(分别为5、10、20、40、60、80、100 mmol/L),测定酶活力。以Hill方程V=Vmax(Sn)/(Kn+Sn)进行线性拟合。
1.6 重组钝齿棒杆菌SYPA-ACS的构建
选择最优来源的ACS编码基因acs,用限制性内切酶酶切质粒载体pXMJ19,经纯化试剂盒回收后与目的扩增基因酶连接,获得重组质粒利用电转化入SYPA5-5感受态中[18]。挑取阳性转化子单菌落,利用引物P19-F、P19-R进行验证分析,将构建成功的重组钝齿棒杆菌菌株SYPA5-5/pXMJ19-Apacs1(命名为SYPA-ACS)的阳性转化子进行培养。
1.6 发酵参数的测定
1.6.1 菌体生物量的测定
取定量的发酵液,用0.125 mol/L HCl溶液去除发酵液中的CaCO3沉淀后,采用紫外分光光度计测定菌液在562 nm处细菌OD值,细菌干重(dry cell weight,DCW)与细菌OD562值的关系为OD562=0.375 g/L DCW[19]即OD562=1时,DCW为0.375 g/L。
1.6.2 葡萄糖含量的测定
将定量发酵液离心后取上清液,利用生物传感器测定发酵液中葡萄糖的含量。
1.6.3 乙酸含量的测定
取定量发酵液离心,将上清液稀释一定倍数后,采用乙酸盐检测试剂盒测定发酵液中乙酸的含量。
1.6.4 游离氨基酸的测定
将发酵液离心,取上清液稀释一定倍数,采用高效液相色谱仪测定。
2 结果与分析
2.1 不同来源ACS的克隆与表达
以4种不同的菌株为扩增模板,获得Ecacs、Bsacs、Apacs1、Apacs2基因片段,与线性化pET28a载体进行连接,化学转化至大肠杆菌感受态,采用表1中的引物,对重组菌株进行菌落PCR验证,验证扩增产物大小为1 959、1 719、1 923、1 989 bp(图2),分别对应Ecacs、Bsacs、Apacs1、Apacs2,符合它们的理论大小,通过以上实验,成功构建了pET28a-Ecacs、pET28a-Bsacs、pET28a-Apacs1、pET28a-Apacs2质粒,将构建的质粒进行测序分析,验证结果正确,表明重组质粒构建成功。
将过夜诱导表达的BL21/pET28a的菌液经超声波破碎后,取上清液进行验证分析。通过SDS-PAGE分析检测到分子质量约为71.83、66.06、70.51、72.93 kDa的特异性条带,如图3-a所示,不同acs基因在大肠杆菌中成功表达。

M-DNA Marker;1-Ecacs;2-Bsacs;3-Apacs2;4-Apacs1;5-pET28a-Ecacs;6-pET28a-Bsacs;7-pET28a-Apacs2;8-pET28a-Apacs1
a-目的基因PCR扩增验证电泳图谱;b-重组质粒双酶切验证电泳图谱
图2 acs基因的PCR及质粒pET28a-acs酶切验证结果
Fig.2 PCR results of acs genes and identification of pET28a-acs plasmids and pET28a plasmid by double enzyme digestion

M-标准蛋白Marker;1-pET28a;2-pET28a-Ecacs;3-pET28a-Bsacs;4-pET28a-Apacs2;5-pET28a-Apacs1;6-pET28a-Ecacs;7-pET28a-Bsacs;8-pET28a-Apacs2;9-pET28a-Apacs1
a-重组大肠杆菌E.coli BL21/pET28a-acs细胞破碎上清液;b-重组大肠杆菌E.coli BL21/pET28a-acs细胞破碎上清液纯化后
图3 重组菌株粗蛋白及ACS纯化SDS-PAGE分析
Fig.3 SDS-PAGE analysis of crude proteins and purification
纯化后测定ACS活力,测定结果如表3所示,ACS酶液活力为328.44、50.44、784.59、119.93 U/mL,表明4种来源的ACS中,A.pasteurianus来源的ACS1酶活力最高,对底物乙酸钾亲和力也更高。
表3 本实验涉及的ACS重组酶的酶学性质
Table 3 Enzymatic properties of recombinant enzymes used in this study

酶菌株酶的比活力/(U·mL-1)Km/(mmol·L-1)Vmax/(U·mg-1)EcACSE. coli BL21328.44±4.2211.5018.45BsACSB. subtilis subsp.subtilis str. 16850.44±2.9818.485.60ApACS1A. pasteurianus ATCC 33445784.59±9.625.2549.09ApACS2A. pasteurianus ATCC 33445119.93±6.0812.507.22
2.2 ACS的酶学性质的研究
ACS的最适温度结果如图4-a所示,4种不同ACS最适温度均在30~40 ℃范围内,然而随着反应温度的升高,ACS的酶活力也会逐渐上升,当温度超过一定范围后,酶的催化能力反而会下降,其原因是随着温度的上升,ACS蛋白失活,ACS基本没有了催化活性。ACS的最适pH见图4-b,在pH 7.0~8.0范围内,4种不同ACS的均为最适反应,随着缓冲液pH的增高,ACS的酶催化能力也逐渐下降。ACS的温度稳定性结果如图4-c所示,4种不同ACS在20~40 ℃均有较好的温度稳定性,1 h后的残余酶活力仍在50%以上,其中ApACS1的温度稳定性明显优于其他3种ACS。ACS的反应pH稳定性结果如图4-d所示,ApACS1的pH稳定性明显优于其他3种ACS,在pH 5.0~9.0孵育30 min,仍能保持50%的酶活力。综上所述,ApACS1最适温度为37 ℃,最适pH为7.0,与其他3种ACS的温度稳定性和pH稳定性相比,ApACS1稳定性更好。
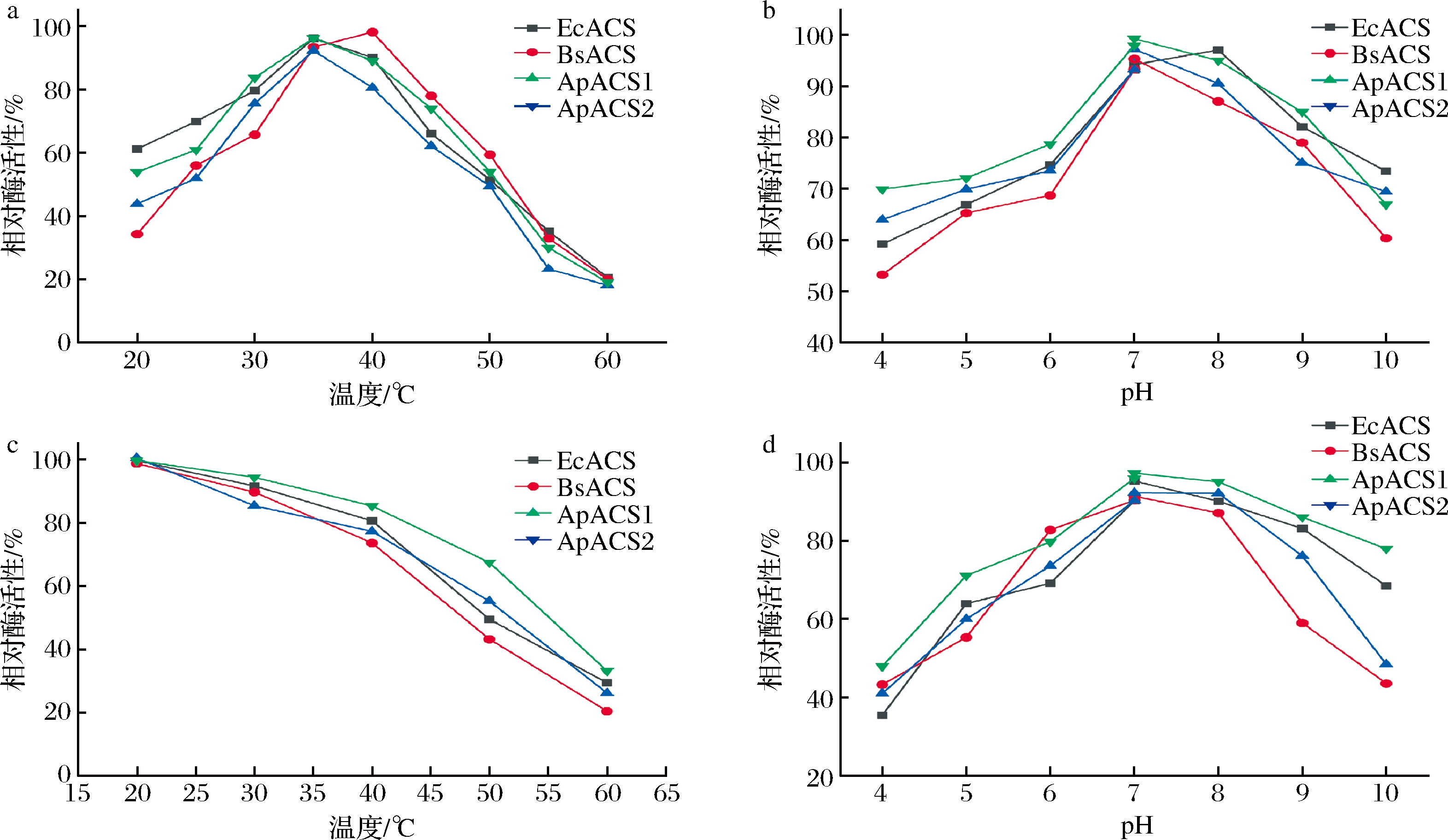
a-最适温度;b-最适pH;c-最适温度稳定性;d-最适pH稳定性
图4 四种ACS 的酶学性质比较
Fig.4 Comparison of the properties of four kinds of ACS
2.3 重组钝齿棒杆菌SYPA-ACS的构建
将A.pasteurianus来源的ACS编码基因acs1,与线性化质粒pXMJ19连接后转化至JM109感受态中,涂布于抗性平板,利用表2的引物进行菌落PCR,并进行酶切验证。如图5-a所示,在1 000~2 000 bp有明亮条带,符合Apacs1长度大小,在4 000~7 000 bp有明亮条带,符合pXMJ19线性化后的长度大小,表明pXMJ19-Apacs1重组质粒构建成功。
提取构建成功的重组质粒pXMJ19-acs1,电击转化进SYPA5-5,涂布含有氯霉素抗性平板上,利用引物表2中的引物菌落PCR,验证SYPA-ACS阳性菌落。挑选出发菌株SYPA5-5和SYPA-ACS于培养基中,30 ℃培养12 h转接至种子培养基,诱导后离心收集菌体并破碎,取上清液进行验证分析。如图5-b所示,ApACS1在钝齿棒杆菌中的表达大小为70.51 kDa,表明重组质粒pXMJ19-acs1在菌株SYPA5-5成功表达,重组菌株SYPA-ACS构建成功。
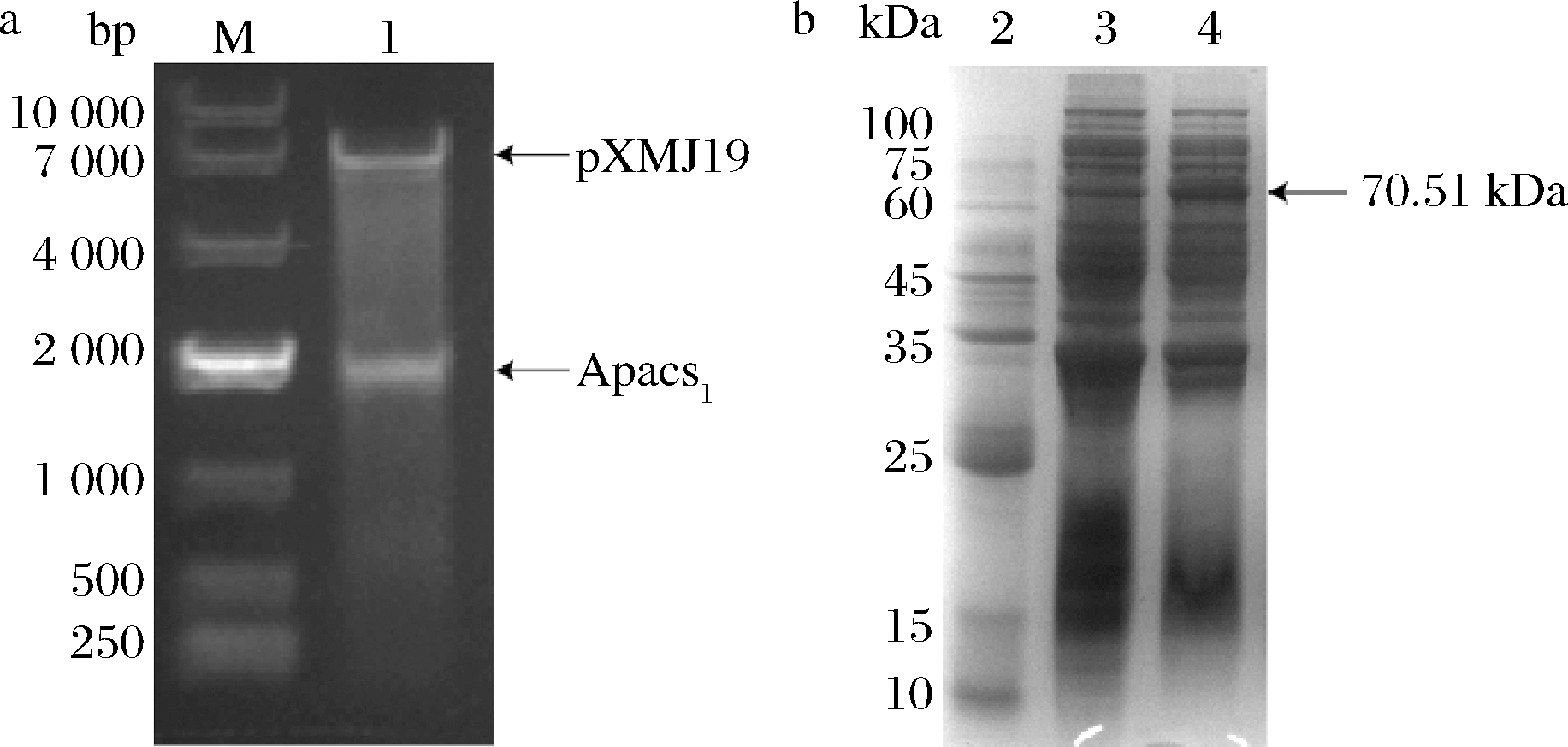
M-DNA Marker;1-pXMJ19-Apacs1双酶切;2-标准蛋白Marker;3-出发菌株细胞破碎上清液;4-重组菌株细胞破碎上清液
a-重组质粒pXMJ19-Apacs1双酶切验证;b-重组SYPA 5-5/pXMJ19-Apacs1菌株细胞破碎上清液
图5 构建SYPA 5-5/pXMJ19-Apacs1菌株及重组菌株粗酶液SDS-PAGE分析
Fig.5 Construction of SYPA 5-5/pXMJpXMJ19-Apacs1 and SDS-PAGE analysis of the overexpression of ApACS1 in recombinant strains
2.4 SYPA5-5与SYPA-ACS菌株摇瓶发酵比较
分别测定SYPA5-5与SYPA-ACS菌株粗酶液中ACS活力,如表4所示,重组菌株SYPA-ACS粗酶液的ACS活力为45.08 U/mL,证明重组菌株SYPA-ACS的ACS表达量加强。将上述的SYPA5-5与SYPA-ACS菌株进行摇瓶发酵实验,在种子培养基中培养至对数生长后转接摇瓶发酵培养基,培养96 h后,测定发酵产物参数。根据图6所示,重组菌株SYPA-ACS摇瓶发酵产量为33.14 g/L,相比较SYPA5-5菌株,产量提高21.39%,乙酸含量为0.836 g/L,与SYPA5-5相比,下降66.41%。利用试剂盒测定菌株乙酰辅酶A含量,表4显示,SYPA-ACS菌株乙酰辅酶A含量为3.34 nmol/mg,比SYPA5-5提高了31.6%。以上结果表明,在钝齿棒杆菌中过表达ACS,能够有效利用乙酸转化增强乙酰辅酶A的产率,进一步提高L-精氨酸产率。
表4 不同菌株摇瓶发酵产量
Table 4 Shake flask fermentation yield of different strains

菌株ACS活力/(U·mL-1)ρ(乙酸)/(g·L-1)c(乙酰辅酶A)/(nmol·mg-1)ρ(L-精氨酸)/(g·L-1) SYPA5-502.48±1.322.18±0.2627.36±3.27SYPA-ACS45.08±0.940.83±0.513.34±1.4733.14±1.32
为了验证acs1基因的过表达对胞内ATP、NADH和NADPH水平的影响,利用试剂盒测定SYPA5-5和SYPA-ACS菌株在对数生长期的胞内ATP、NADH和NADPH含量,结果如图6-b所示。由于acs1基因的过表达,SYPA-ACS菌株的胞内ATP与NADH水平为4.87、11.01 μmol/g DCW,与出发SYPA5-5菌株相比分别提高了13.71%、280.67%,同样,我们也测量了SYPA-ACS菌株的胞内NADPH含量为21.65 μmol/g DCW,相比较原始菌株含量增加了213.61%。由上述结果可知,利用乙酸提高乙酰辅酶A的含量对胞内ATP、NADH和NADPH提高有显著的效果,其原因可能是随着ACS的过表达,糖酵解、三羧酸循环等代谢途径也随之增强,伴随着ATP的合成,同时也为细胞信号调节提供重要物质乙酰磷酸,提高了重组菌株中NADH、NADPH含量。由于在L-精氨酸合成途径中,合成1分子L-精氨酸需要消耗5分子ATP与2分子NADPH,因此,ATP、NADH和NADPH含量提高,也有助于L-精氨酸的合成。
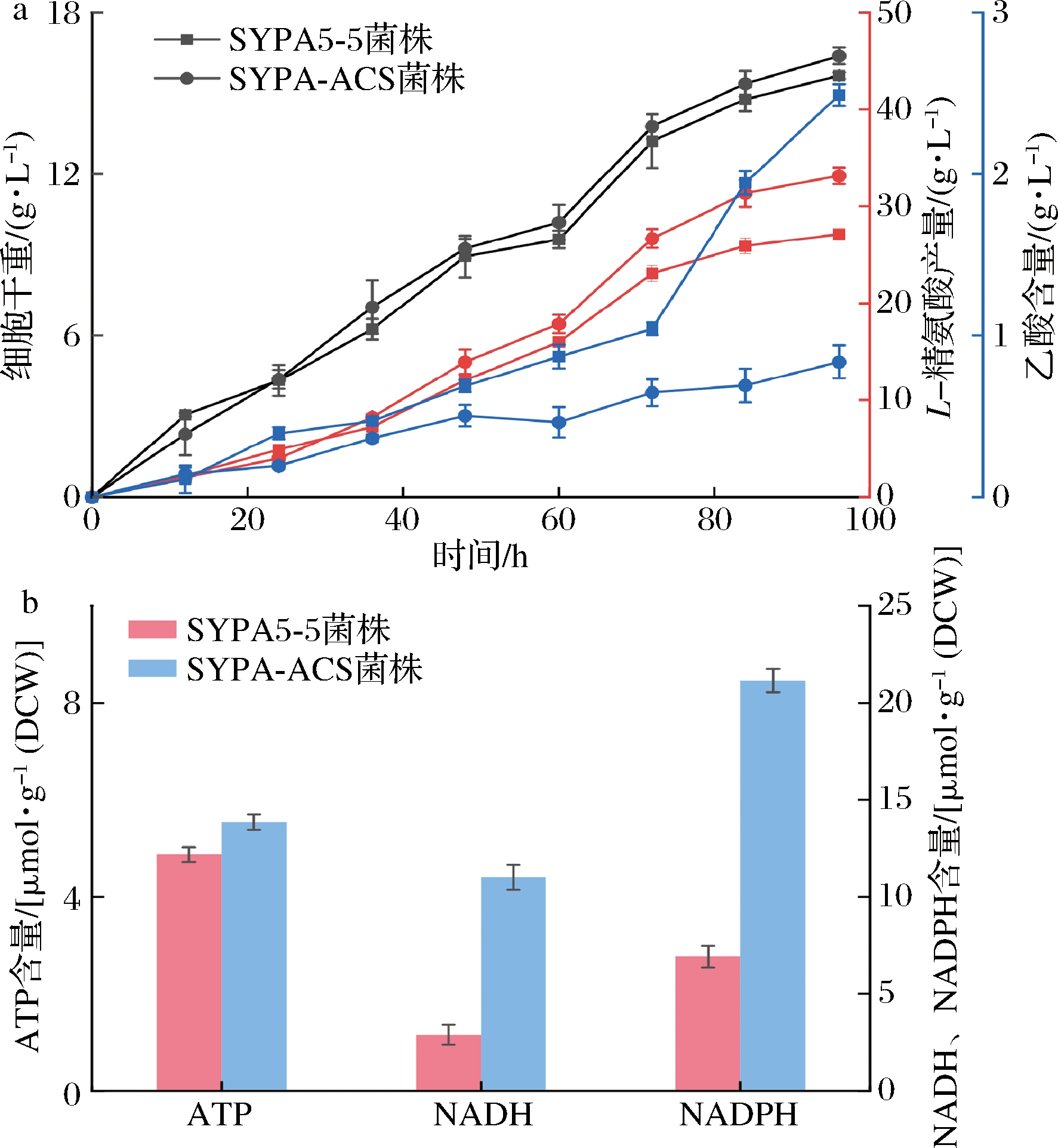
a-SYPA5-5、SYPA-ACS菌株摇瓶发酵产量;b-菌株胞内ATP、NADH和NADPH含量
图6 钝齿棒杆菌摇瓶发酵
Fig.6 Shake flask fermentation of strains
2.5 菌株发酵过程比较
根据菌株在5 L发酵罐发酵的结果可以分析出重组菌株SYPA-ACS产酸能力高于出发菌株SYPA5-5。如图7所示,在发酵培养前期,重组菌株SYPA-ACS的菌株生长与出发菌株SYPA5-5相差不大。当发酵时间培养稳定后,重组菌株SYPA-ACS的菌体量明显高于出发菌株。40~96 h是菌体积累L-精氨酸的重要时期,此时重组菌株SYPA-ACS发酵产酸能力相对出发菌株SYPA5-5优势较为明显,L-精氨酸的合成产量更高。如图7所示,发酵稳定期SYPA-ACS的产量达到53.43 g/L,比出发菌株41.91 g/L,提高了25.72%,产率0.577 g/(L·h)。综上,通过异源表达ACS,增加了乙酸的转化率,不仅利用了乙酸,减少了对细胞生长毒害作用,同时提高了乙酰辅酶A的通量,加强了菌株合成L-精氨酸的能力。
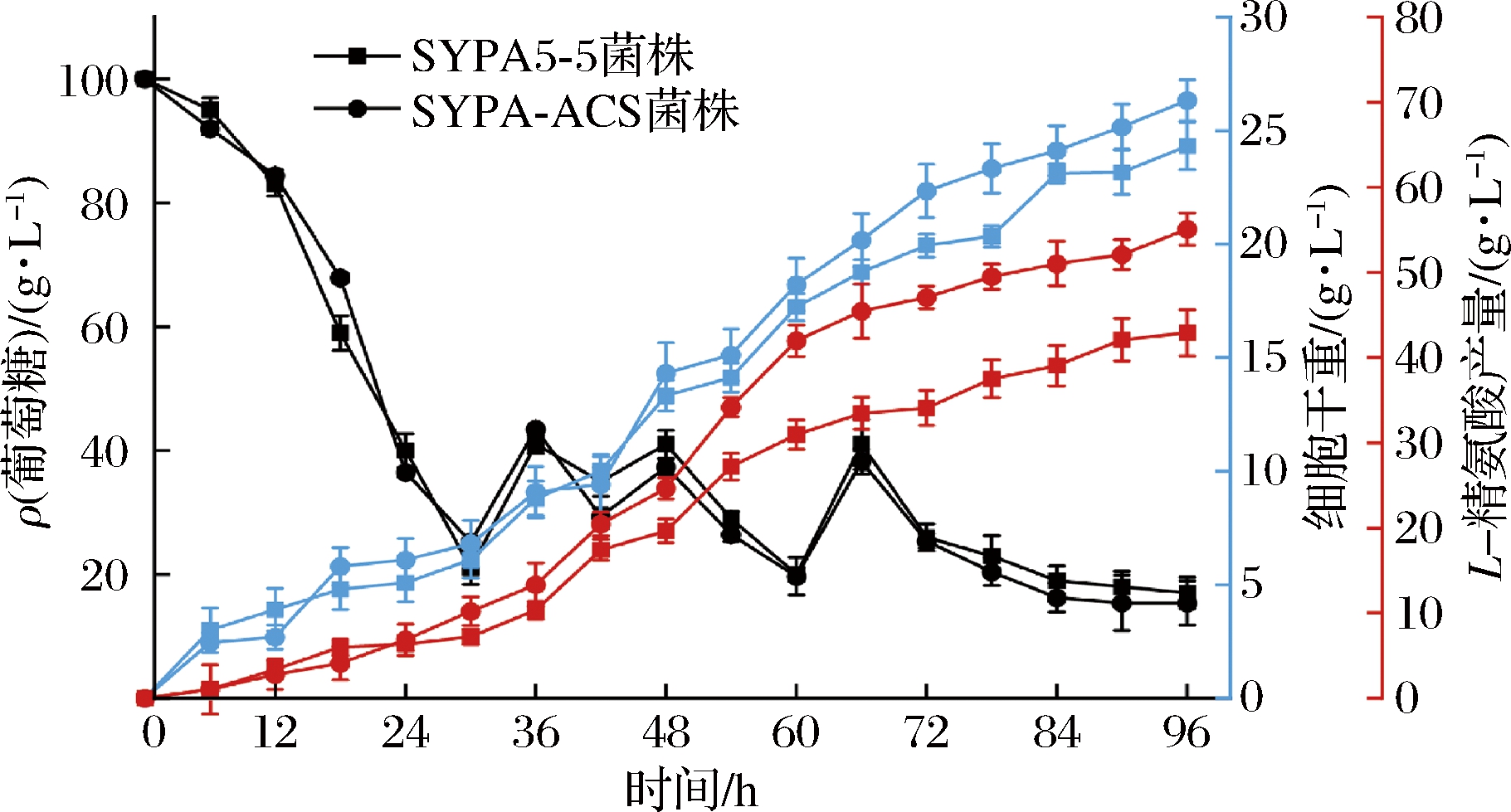
图7 SYPA-ACS菌株 5 L发酵产L-精氨酸性能测定
Fig.7 Fermentation performance of L-arginine producing SYPA-ACS strains in 5 L fermenter
3 讨论
本文首先对合成乙酰辅酶A进行筛选,对4种不同ACS编码基因acs进行克隆表达,并且对其酶学性质进行比较。巴氏醋酸杆菌来源的ACS最高活力为784.59 U/mL。ApACS1最适反应pH为7.0,最适反应温度为37 ℃。酶学稳定性实验显示,ApACS1酶活力最高且酶学稳定性更好,因此选择最适来源的ACS在钝齿棒杆菌克隆表达。钝齿棒杆菌中异源表达ApACS1后,在5 L发酵罐发酵培养研究其L-精氨酸生产性能,SPYA5-5和SYPA-ACS的细胞干重分别为24.33和26.09 g/L(图7),与SPYA5-5相比提高了7.37%,表明过表达ACS不会影响到菌体的生长速率,并能改善菌体生长环境。在发酵后期,SYPA-ACS菌株发酵产酸能力相较SPYA5-5提高27.48%,分别为53.43 g/L和41.91 g/L。相较于重组菌株SYPA-ACS,出发菌株SPYA5-5生长和产酸并没有重组菌株高,其原因由于乙酸的合成,不仅会对细胞产生毒害作用影响菌体生长,还会降低胞内pH,而菌株发酵培养的最适pH为6.5~7.0,且精氨酸的前体物质谷氨酸合成的关键酶——谷氨酸脱氢酶在pH中性条件下酶活力最高。当培养基pH降到6.5左右时,谷氨酸脱氢酶活力下降近一半[21],不仅影响菌体生长,也不利于细胞进行各项代谢调控合成精氨酸。通过异源表达ACS,能有效利用乙酸转化成乙酰辅酶A,提高代谢途径中的终产物L-精氨酸含量,为L-精氨酸的工业化提供了理论依据和实验基础。
[1] MAN Z W, RAO Z M, XU M J, et al.Improvement of the intracellular environment for enhancing L-arginine production of Corynebacterium glutamicum by inactivation of H2O2-forming flavin reductases and optimization of ATP supply[J].Metabolic Engineering, 2016, 38:310-321.
[2] GHOLAMI M, BOUGHTON B A, FAKHARI A R, et al.Metabolomic study reveals a selective accumulation of L-arginine in the D-ornithine treated tobacco cell suspension culture[J].Process Biochemistry, 2014, 49(1):140-147.
[3] SAGMEISTER P, SCHIMEK C, MEITZ A, et al.Tunable recombinant protein expression with E.coli in a mixed-feed environment[J].Applied Microbiology and Biotechnology, 2014, 98(7):2 937-2 945.
[4] SCHNEIDER J, NIERMANN K, WENDISCH V F.Production of the amino acids L-glutamate, L-lysine, L-ornithine and L-arginine from Arabinose by recombinant Corynebacterium glutamicum[J].Journal of Biotechnology, 2011, 154(2-3):191-198.
[5] FARMER W R, LIAO J C.Reduction of aerobic acetate production by Escherichia coli[J].Frontiers in Medicine, 1997, 63(8):3 205-3 210.
[6] CHANG D E, SHIN S, RHEE J S, et al.Acetate metabolism in a pta mutant of Escherichia coli W3110:Importance of maintaining acetyl coenzyme A flux for growth and survival[J].Journal of Bacteriology, 1999, 181(21):6 656-6 663.
[7] KAZMIRUK N V, BORONOVSKIY S E, NARTSISSOV Y R.Modeling the regulation of the activity of glutamine synthetase from Escherichia coli by magnesium ions[J].Biophysics, 2018, 63(3):318-324.
[8] ZHA W J, RUBIN-PITEL S B, SHAO Z Y, et al.Improving cellular malonyl-CoA level in Escherichia coli via metabolic engineering[J].Metabolic Engineering, 2009, 11(3):192-198.
[9] XIAO Y, RUAN Z H, LIU Z G, et al.Engineering Escherichia coli to convert acetic acid to free fatty acids[J].Biochemical Engineering Journal, 2013, 76:60-69.
[10] LIN H, CASTRO N M, BENNETT G N, et al.Acetyl-CoA synthetase overexpression in Escherichia coli demonstrates more efficient acetate assimilation and lower acetate accumulation:A potential tool in metabolic engineering[J].Applied Microbiology and Biotechnology, 2006, 71(6):870-874.
[11] ILLEGHEMS K, DE VUYST L, WECKX S.Complete genome sequence and comparative analysis of Acetobacter pasteurianus 386B, a strain well-adapted to the cocoa bean fermentation ecosystem[J].BMC Genomics, 2013, 14:526.
[12] MAN Z W, XU M J, RAO Z M, et al.Systems pathway engineering of Corynebacterium crenatum for improved L-arginine production[J].Scientific Reports, 2016, 6:28629.
[13] WANG Q, JIANG A, TANG J B, et al.Enhanced production of L-arginine by improving carbamoyl phosphate supply in metabolically engineered Corynebacterium crenatum[J].Applied Microbiology and Biotechnology, 2021, 105(8):3 265-3 276.
[14] SCH GGER H.Tricine-SDS-PAGE[J].Nature Protocols, 2006, 1(1):16-22.
GGER H.Tricine-SDS-PAGE[J].Nature Protocols, 2006, 1(1):16-22.
[15] SAMBROOK J, FRITSCH EF, MANIATIS T.Molecular cloning.A laboratory manual[J].Analytical Biochemistry, 2001,186:1.
[16] BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry, 1976, 72(1-2):248-254.
[17] 胡红, 张汝兵, 秦杰明, 等.乙酰辅酶A合成酶的酶学性质及其在甲羟戊酸合成中的应用[J].应用与环境生物学报, 2016, 22(3):357-362.
HU H, ZHANG R B, QIN J M, et al.Enzymatic characterization of acetyl CoA synthetase and its application in biosynthesis of mevalonate[J].Chinese Journal of Applied and Environmental Biology, 2016, 22(3):357-362.
[18] HENKE N A, KRAHN I, WENDISCH V F.Improved plasmid-based inducible and constitutive gene expression in Corynebacterium glutamicum[J].Microorganisms, 2021, 9(1):204.
[19] XU M J, RAO Z M, DOU W F, et al.Site-directed mutagenesis and feedback-resistant N-acetyl-L-glutamate kinase (NAGK) increase Corynebacterium crenatum L-arginine production[J].Amino Acids, 2012, 43(1):255-266.
[20] XU M J, RAO Z M, YANG J, et al.Heterologous and homologous expression of the arginine biosynthetic argC-H cluster from Corynebacterium crenatum for improvement of (L)-arginine production[J].Journal of Industrial Microbiology & Biotechnology, 2012, 39(3):495-502.
[21] 谢珊, 蔡友华, 李露.谷氨酸棒杆菌ATCC 14067中L-精氨酸合成途径关键酶的过表达对L-精氨酸合成的影响[J].食品科技, 2019, 44(8):23-30.
XIE S, CAI Y H, LI L.Effect of overexpression of key enzymes of L-arginine synthesis pathway on the synthesis of L-arginine in Corynebacterium glutamicum ATCC 14067[J].Food Science and Technology, 2019, 44(8):23-30.