动物乳具有较高的营养价值,能提供大量对人体有益的物质,如蛋白质、钙、维生素和矿物质等[1]。其中,乳蛋白质是动物乳中的主要营养成分,其氨基酸含量和构成比例基本同人体蛋白合成时所需要的数量、比例接近[2]。乳中氨基酸是构成乳蛋白大分子的基础物质,能够维持机体组织生长更新、参与多种化学反应、提供生理活动所需热能,并具有抗癌、降低胆固醇、强化免疫、抑制脂肪沉积及抗糖尿病等功能[3]。评价食品中营养价值的一项重要指标就是食品中氨基酸含量与种类是否丰富与齐全。从动物乳产品的多样化、安全性和货架期等方面考虑,生产厂家会对原料乳进行不同程度的热处理,使其符合相关的卫生标准,同时保证产品质量稳定。原料乳在不同的加热过程中会发生一系列的理化反应,导致蛋白质和脂肪的解离,破坏了原有的结构,形成一些新的游离物质会造成体系不稳定、营养成分流失等[4]。
牛乳是目前乳及乳制品最主要的来源,也是人类利用率最高的动物乳,占乳制品消费量的95%[5]。牛乳主要由水、蛋白质、脂肪、乳糖、矿物质等组成,是人们膳食结构的重要组成部分,也为人体提供必需营养物质。山羊乳的基本营养成分与牛乳类似[6],其酪蛋白的组成更接近人乳,β-乳球蛋白的含量较低(相比牛乳低50%),不易发生致敏反应[7];此外,羊乳脂肪球颗粒直径小,更容易被人体消化吸收[8]。被誉为“沙漠白金”的驼乳不含β-乳球蛋白,富含胰岛素和类胰岛素生长因子、不饱和脂肪酸等,具有极高的营养价值[9];此外,驼乳含有乳铁蛋白、免疫球蛋白、溶菌酶和维生素C等功效因子,具有一定的医疗保健作用[10-11]。热处理是原料乳及其乳制品加工保存最主要的方法。近年,随着人们对非牛乳营养、药用保健价值的研究兴趣逐渐增加,驼乳、羊乳及其乳制品的开发利用也迅速发展。然而,热处理条件对驼乳、牛乳和山羊乳中营养成分的影响至今还未得到科学、系统地研究。
目前,HPLC[12]和氨基酸分析仪[13]是检测食品中氨基酸的重要方法。HPLC与氨基酸分析仪法相比,具有检测限与灵敏度高、衍生化产物稳定、重复性好、简便可靠等优点[14]。然而,动物乳氨基酸组成的研究主要采用氨基酸分析仪[15-17],基于HPLC的驼乳、牛乳和山羊乳氨基酸组成的分析极为有限[18];且常见乳源(驼乳、牛乳和山羊乳)氨基酸组成与热处理条件的关系并不清楚。因此,本研究分别收集驼乳、牛乳和山羊乳样本,采用HPLC法对不同热处理条件下的3种乳进行氨基酸组成的检测和比较分析,进而解析乳中氨基酸的组成与热处理程度的关系,以期为不同热处理条件下的乳中氨基酸的进一步研究提供理论依据。
1 材料与方法
1.1 乳样的采集及处理
本研究所用到的驼乳、牛乳和山羊乳均采自内蒙古阿拉善左旗一牧场。采集后迅速用冰袋保存,运输至实验室。对驼乳、牛乳和山羊乳分别进行低温长时巴氏杀菌[(low temperature long time,LTLT)65 ℃、30 min]、高温短时杀菌[(high temperature short time,HTST)85 ℃、15 s]和超高温瞬时灭菌[(ultra-high temperature instantaneous sterilization,UHT)135 ℃、5 s]处理;同时设一组未处理组(对3种畜乳不做任何处理)。分别将不同热处理过的乳样和未处理的样本在-20 ℃冷冻保存,备用。
1.2 实验材料
甲醇、乙腈(均为色谱纯),美国Fisher Scientific公司;Na2B4O7·10H2O、Na2HPO4·12H2O、磷酸(均为分析纯),国药集团化学试剂有限公司;盐酸(优级纯),北京化工厂;移液器及吸液头,德国Eppendorf公司;水解管,pyrex,产品货号:60827-023 13 mm×100 mm;17种氨基酸混合标准品(纯度≥99%)、氨基酸衍生化试剂盒,日本岛津公司。
1.3 仪器与设备
LC-20A高效液相色谱系统、Lab Solution色谱工作站、RF20A荧光检测器,日本岛津公司;DHG-9123A型鼓风干燥箱,上海一恒科学仪器有限公司;BS210S型电子天平,江苏金坛市金城国胜实验仪器厂;vortex zx3漩涡振荡器,美国SI公司。
1.4 实验方法
1.4.1 样品处理
取3 mL的乳样于水解管中,加入等体积的6 mol/L盐酸,滴入新蒸馏的苯酚4滴,溶解;并充入高纯N2 2~3 min,反复置换3次后,在充N2状态下封口。将水解管置于(120±3) ℃的恒温干燥箱中,水解22~24 h。取出水解管,冷却至室温,用去离子水多次冲洗水解管,将水解液全部转移至容量瓶中,用1 mol/L的盐酸定容。再用0.45 μm尼龙滤膜过滤,准确吸取滤液于瓶中,在40~50 ℃真空干燥器中干燥,干燥后的残留物用去离子水溶解,再干燥,反复进行2次,最后蒸干。
1.4.2 流动相的配制
流动相A:Na2HPO4·12H2O 9.0 g, Na2B4O7·10H2O 9.5 g,加水2 000 mL,用36%盐酸(约3 mL)调pH至8.2,用0.45 μm滤膜过滤。流动相B:甲醇450 mL,乙腈450 mL,水100 mL,混匀,超声脱气。
1.4.3 衍生用样品溶液的配制
准确量取样品溶液500 μL,置于2 mL样品瓶中,准确加入内标溶液50 μL混匀,作为衍生用样品溶液。取邻苯二甲醛(phthalaldehyde reagent,OPA)衍生试剂A液1支,加入OPA衍生试剂B液60 μL混匀;作为OPA衍生试剂。
1.4.4 衍生用混合氨基酸标准溶液
准确量取氨基酸分析方法组件包中的氨基酸标准溶液100 μL,置于2 mL样品瓶中,准确加入内标溶液50 μL、0.1 mol/L盐酸400 μL,混匀,作为衍生用混合氨基酸标准溶液(表1)。
表1 氨基酸标准物质浓度
Table 1 Concentration of amino acid standards

名称相对分子质量质量浓度/(μg·mL-1)名称相对分子质量质量浓度/(μg·mL-1)组氨酸His155.15387.9胱氨酸Cys240.30600.8丝氨酸Ser105.09262.7赖氨酸Lys146.19365.5精氨酸Arg174.20435.5酪氨酸Tyr181.19453.0甘氨酸Gly75.07187.7蛋氨酸Met149.21373.0天门冬氨酸Asp133.10332.8缬氨酸Val117.15292.9谷氨酸Glu147.13367.8异亮氨酸Ile131.17327.9苏氨酸Thr119.12297.8亮氨酸Leu131.17327.9丙氨酸Ala89.09222.7苯丙氨酸Phe165.19413.0脯氨酸Pro115.13287.8
1.4.5 色谱条件
色谱柱:岛津AJS-01氨基酸专用分析柱(C18,3 μm,4.6 mm×150 mm);RF检测器激发波长340 nm,发射波长450 nm,柱温50 ℃。流动相A的梯度变化为:0~6 min(95%~90%),6~8 min(90%),8~10 min(90%~84%),10~23 min(84%~60%),23~30 min(60%~50%),30~31 min(50%~0%),31~34 min(0%);流动相B的梯度变化为:0~6 min(5%~10%),6~8 min(10%),8~10 min(10%~16%),10~23 min(16%~40%),23~30 min(40%~50%),30~31 min(50%~100%),31~34min(100%);进样量2 μL;流速1.6 mL/min。为了检测到检测样中的脯氨酸(Pro),反应27 min后将检测器激发波长和发射波长分别调整至266、305 nm。
1.5 数据处理
所有数据均采用平均值±标准差来表示。采用SPSS 24.0对氨基酸数据进行统计分析;并利用R语言、SPSS和SIMCA 14.1进行聚类和主成分分析(principal component analysis,PCA)。所有检验的统计学显著性标准均为P<0.05。
2 结果与分析
2.1 驼乳、牛乳和山羊乳中氨基酸的色谱图与聚类分析
通过HPLC的FR检测器测定氨基酸标准液(图1-a)。

a-氨基酸标准液;b-驼乳;c-牛乳;d-山羊乳
图1 氨基酸标准液、驼乳、牛乳和山羊乳的HPLC图
Fig.1 The HPLC chromatogram of amino acid standard solution, camel, cow and goat milk
图1可以看出FR检测器对于17种氨基酸均有很好的响应值,能够有效分离。重复3组平行样,其结果重现性好,说明FR检测器对氨基酸种类的检测具有良好的效果。在此基础上,采用FR检测器对未处理过的驼乳、牛乳和山羊乳样品进行氨基酸含量的检测,并采用内标法进行定量,如图1所示,3种原乳中所有氨基酸均被检出,各色谱峰峰形尖锐,且无杂峰干扰,分离度良好。
未处理组的驼乳、牛乳和山羊乳氨基酸色谱图,结合氨基酸标准品对3种畜乳中17种氨基酸含量进行分析,并借助聚类热图完成了可视化展示(图2)。3种乳均获得了17种氨基酸,且不同乳中的氨基酸含量差异较大。所有的检测乳样中Glu的聚类颜色最深(红色),说明含量最高;其次是Leu和Pro;而Glu的聚类蓝颜色最深,说明在3种乳中其含量最低。从整体聚类特性来看,3种乳均按照重复次数聚为1簇;且驼乳和山羊乳先聚在一起,然后再与牛乳聚类;说明相比牛乳,驼乳和山羊乳中的氨基酸含量更接近。
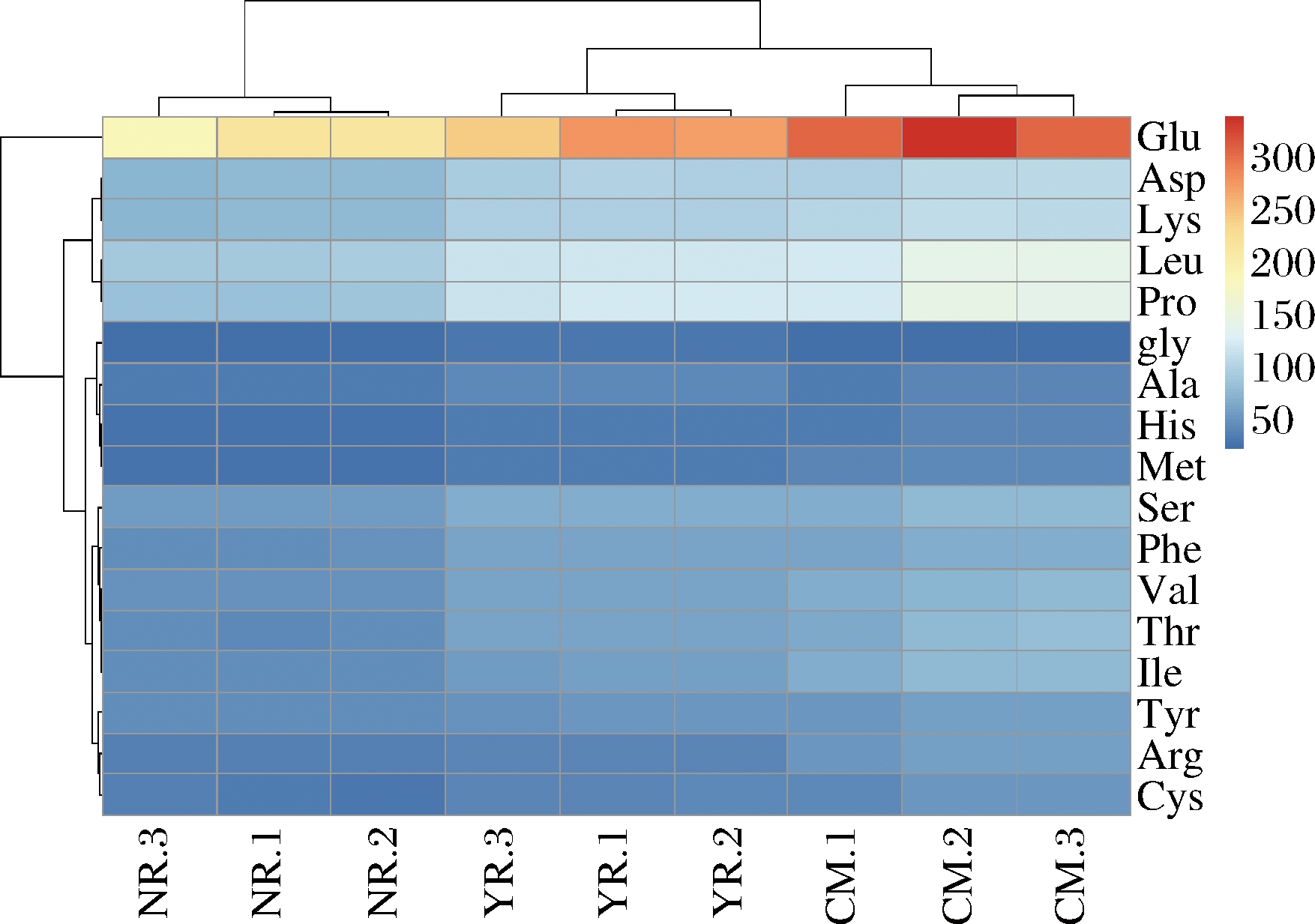
CM-驼乳;NR-牛乳;YR-山羊乳
图2 驼乳、牛乳和山羊乳中氨基酸组成聚类图
Fig.2 Cluster analysis of amino acid composition in camel, cow and goat milk
注:1、2和3分别为试验的3次重复
2.2 驼乳、牛乳和山羊乳中氨基酸含量比较分析
乳中氨基酸含量及组成是评价蛋白质营养价值高低的主要因素,会直接影响到乳中蛋白质营养价值[15]。由表2可知,驼乳、牛乳和山羊乳中氨基酸组成和相对含量差异显著。3种原乳中,总氨基酸(total amino acid,TAA)的含量具有显著差异(P<0.05);其中驼乳中TAA含量最高,为46.47 mg/g,牛乳最低,为30.37 mg/g。必需氨基酸(essential amino acid,EAA)的含量也存在显著差异(P<0.05);驼乳中的含量最高,其次是山羊乳,而牛乳中EAA的含量最低。3种原乳中含量最高的EAA为Leu。Leu可促进机体内肌肉蛋白质的合成,原料乳中较高含量的Leu,可提高机体肌肉蛋白质的代谢[19]。此外,研究表明Leu具有降低血糖的作用;相比牛乳和山羊乳,驼乳中Leu的含量分别高出1.5倍和0.8倍,这也许是驼乳具有降糖作用的另一证据。3种畜乳的EAA含量占据第2位的为Lys,尤其在驼乳中,其含量达到了3.40 mg/g,显著高于牛乳和山羊乳(P<0.05)。Lys作为人体第一限制氨基酸,在调节人体新陈代谢、增强抗病力等方面起着重要作用[20]。因此,推测驼乳具有的医疗保健作用,可能与乳中较高含量的Lys有关。此外,驼乳中的非必需氨基酸(non essential amino acid,NEAA)总量显著高于牛乳和羊乳(P<0.05),其中除了Gly和Ala的含量显著低于山羊乳(P<0.05),其余NEAA的含量均高于山羊乳。而驼乳中所有的NEAA含量均高于牛乳。
表2 驼乳、牛乳和山羊乳中氨基酸含量比较 单位:mg/g
Table 2 Comparison of amino acid content in camel, cow and goat milk

氨基酸驼乳牛乳山羊乳Asp3.29±0.20a2.36±0.05b3.12±0.10aGlu10.60±0.65a6.75±0.58b8.78±0.65cSer2.36±0.19a1.64±0.01b2.13±0.03cHis1.07±0.08a0.70±0.02b0.90±0.12cGly0.62±0.05a0.58±0.01a0.80±0.01bThr∗2.35±0.28a1.33±0.07b1.89±0.02cArg1.75±0.16a1.01±0.02b1.16±0.02bAla1.08±0.09a0.95±0.01b1.25±0.02cTyr1.74±0.14a1.33±0.03b1.56±0.03cCys1.48±0.21a0.94±0.09b1.21±0.10abVal∗2.28±0.16a1.45±0.01b1.93±0.02cMet∗1.22±0.09a0.69±0.02b0.93±0.04cIle∗2.36±0.19a1.37±0.03b1.75±0.02cPhe∗2.03±0.14a1.40±0.03b1.88±0.03aLys∗3.40±0.11a2.35±0.07b3.11±0.03cLeu∗4.41±0.38a2.88±0.06b3.84±0.06cPro4.42±0.38a2.65±0.07b3.88±0.13cTAA46.47±3.19a30.37±0.80b40.11±1.08cEAA19.13±1.43a12.17±0.22b16.23±0.15cNEAA27.34±1.82a18.21±0.62b23.89±0.96c
注:*表示人体必需氨基酸;同行不同小写字母表示差异显著(P<0.05)(下同)
采用SIMCA软件对未处理的驼乳、牛乳和山羊乳中17中氨基酸进行了PCA。由图3可见,主成分1和主成分2很好区分3种畜乳,且同一种乳的3次重复明显的聚在一起,表明不同畜乳中氨基酸含量存在一定差异性。PCA的结果再次证实了表3的结果,且与杨惠茹等[16]的研究结果一致。

图3 驼乳、牛乳和山羊乳中氨基酸含量的PCA
Fig.3 PCA of amino acid of camel, cow and goat milk
2.3 热处理对驼乳、牛乳和山羊乳中氨基酸组成的影响
2.3.1 热处理对驼乳、牛乳和山羊乳中氨基酸组成的比较分析
目前,原料乳不同程度的热处理杀菌是保证产品质量、延长产品保质期最主要的方式。不同热处理方式对原料乳营养价值有不同程度的影响,对其氨基酸含量也有不同程度的影响。在不同热处理(LTLT、HTST和UHT)条件下,驼乳、牛乳和山羊乳中氨基酸组成变化见表3。与未处理组相比,加热处理会增加3种畜乳中TAA和EAA的含量(表2和表3);众所周知,原料乳中存在多种酶类物质,在加热过程中耐热酶会使乳中蛋白质酶解,导致TAA的含量增加。此外,相比未处理组鉴定到的7种EAA,Thr、Ile、Phe和Leu氨基酸含量在3种热处理条件下都有所增加,而其余氨基酸(除Asp外)含量在加热处理过程中呈现了增加或减少的无规则变化(表2和表3)。研究表明,原料乳在加热过程中,蛋白质会酶解或氨基酸之间的化学键会断裂,使得氨基酸自身会发生裂解,或与乳中的糖类物质发生美拉德反应,导致游离氨基酸含量增加或减少[21-22]。
从表3可知,3种乳经过LTLT热处理后TAA和EAA的含量均有上升趋势,而相比LTLT热处理,HTST和UHT热处理对3种乳的影响各不相同。驼乳和山羊乳经过HTST和UHT热处理后,乳中TAA和EAA的含量显著降低(P<0.05),而3种热处理条件对牛乳中TAA和EAA含量的影响差异不显著(P>0.05)。
表3 不同热处理驼乳、牛乳和山羊乳的氨基酸组成 单位:mg/g
Table 3 The amino acid content of different heat-treated camel, cow and goat milk
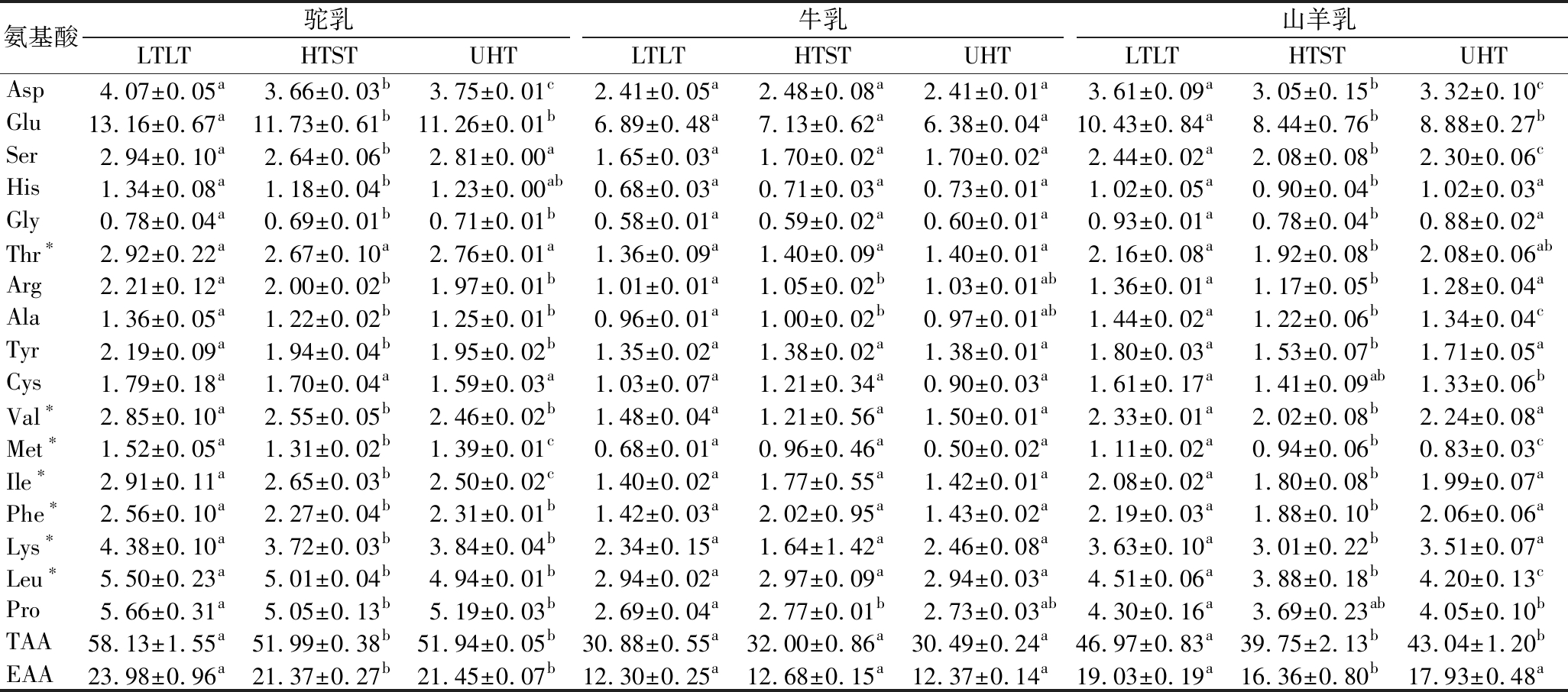
氨基酸驼乳牛乳山羊乳LTLTHTSTUHTLTLTHTSTUHTLTLTHTSTUHTAsp4.07±0.05a3.66±0.03b3.75±0.01c2.41±0.05a2.48±0.08a2.41±0.01a3.61±0.09a3.05±0.15b3.32±0.10cGlu13.16±0.67a11.73±0.61b11.26±0.01b6.89±0.48a7.13±0.62a6.38±0.04a10.43±0.84a8.44±0.76b8.88±0.27bSer2.94±0.10a2.64±0.06b2.81±0.00a1.65±0.03a1.70±0.02a1.70±0.02a2.44±0.02a2.08±0.08b2.30±0.06cHis1.34±0.08a1.18±0.04b1.23±0.00ab0.68±0.03a0.71±0.03a0.73±0.01a1.02±0.05a0.90±0.04b1.02±0.03aGly0.78±0.04a0.69±0.01b0.71±0.01b0.58±0.01a0.59±0.02a0.60±0.01a0.93±0.01a0.78±0.04b0.88±0.02aThr∗2.92±0.22a2.67±0.10a2.76±0.01a1.36±0.09a1.40±0.09a1.40±0.01a2.16±0.08a1.92±0.08b2.08±0.06abArg2.21±0.12a2.00±0.02b1.97±0.01b1.01±0.01a1.05±0.02b1.03±0.01ab1.36±0.01a1.17±0.05b1.28±0.04aAla1.36±0.05a1.22±0.02b1.25±0.01b0.96±0.01a1.00±0.02b0.97±0.01ab1.44±0.02a1.22±0.06b1.34±0.04cTyr2.19±0.09a1.94±0.04b1.95±0.02b1.35±0.02a1.38±0.02a1.38±0.01a1.80±0.03a1.53±0.07b1.71±0.05aCys1.79±0.18a1.70±0.04a1.59±0.03a1.03±0.07a1.21±0.34a0.90±0.03a1.61±0.17a1.41±0.09ab1.33±0.06bVal∗2.85±0.10a2.55±0.05b2.46±0.02b1.48±0.04a1.21±0.56a1.50±0.01a2.33±0.01a2.02±0.08b2.24±0.08aMet∗1.52±0.05a1.31±0.02b1.39±0.01c0.68±0.01a0.96±0.46a0.50±0.02a1.11±0.02a0.94±0.06b0.83±0.03cIle∗2.91±0.11a2.65±0.03b2.50±0.02c1.40±0.02a1.77±0.55a1.42±0.01a2.08±0.02a1.80±0.08b1.99±0.07aPhe∗2.56±0.10a2.27±0.04b2.31±0.01b1.42±0.03a2.02±0.95a1.43±0.02a2.19±0.03a1.88±0.10b2.06±0.06aLys∗4.38±0.10a3.72±0.03b3.84±0.04b2.34±0.15a1.64±1.42a2.46±0.08a3.63±0.10a3.01±0.22b3.51±0.07aLeu∗5.50±0.23a5.01±0.04b4.94±0.01b2.94±0.02a2.97±0.09a2.94±0.03a4.51±0.06a3.88±0.18b4.20±0.13cPro5.66±0.31a5.05±0.13b5.19±0.03b2.69±0.04a2.77±0.01b2.73±0.03ab4.30±0.16a3.69±0.23ab4.05±0.10bTAA58.13±1.55a51.99±0.38b51.94±0.05b30.88±0.55a32.00±0.86a30.49±0.24a46.97±0.83a39.75±2.13b43.04±1.20bEAA23.98±0.96a21.37±0.27b21.45±0.07b12.30±0.25a12.68±0.15a12.37±0.14a19.03±0.19a16.36±0.80b17.93±0.48a
3种乳在不同热处理条件下,其EAA的种类变化也各异。与LTLT处理相比,HTST和UHT处理驼乳中Val、Phe、Lys和Leu的含量均显著降低(P<0.05),而HTST和UHT2个处理组之间无显著差异(P>0.05)。在3种热处理条件下,驼乳中Met和Ile的含量都发生了显著的变化(P<0.05)。与LTLT处理相比,HTST和UHT处理后牛乳中7种EAA的含量均无显著变化(P>0.05)。此外,热处理对山羊乳中Met和Leu的含量影响最大;与LTLT相比,HTST和UHT加热处理会显著降低山羊乳中Met的含量,而Leu的含量随着温度的升高,呈先降低后上升的趋势(P<0.05)。此外,与原料乳相比,热处理条件会增加3种畜乳中的鲜味氨基酸的含量,如Glu和Asp。因此,推测鲜味氨基酸含量的增加,是提高原料乳中乳香味、使其具有独特风味的主要原因。
2.3.2 热处理对驼乳、牛乳和山羊乳氨基酸相对含量分析
由图4可知,驼乳、牛乳和山羊乳中EAA/TAA均达到了40%以上,分别是41.16%、40.07%和40.46%;且EAA/NEAA也均达到了65%以上,分别是69.97%、66.83%和67.93%,均符合并高于FAO/WHO理想蛋白相应指标(40%和60%)的标准[23]。3种乳在不同热处理条件下,由于氨基酸含量的改变,EAA/TAA和EAA/NEAA发生了不同程度的改变。驼乳在3种不同热处理条件下,乳中EAA/TAA>40%,且EAA/NEAA也处于较高值,其中LTLT和UHT处理条件下EAA/NEAA均达到了70%以上。对于牛乳来说,加热处理对其EAA的含量影响较大,因此LTLT和HTST处理条件下EAA/TAA的含量均<40%;而3种热处理条件下,牛乳EAA/NEAA均大于65%。羊乳在3种热处理条件下EAA/TAA和EAA/NEAA均高于40%和65%,且UHT处理条件下EAA/NEAA达到了70%以上。
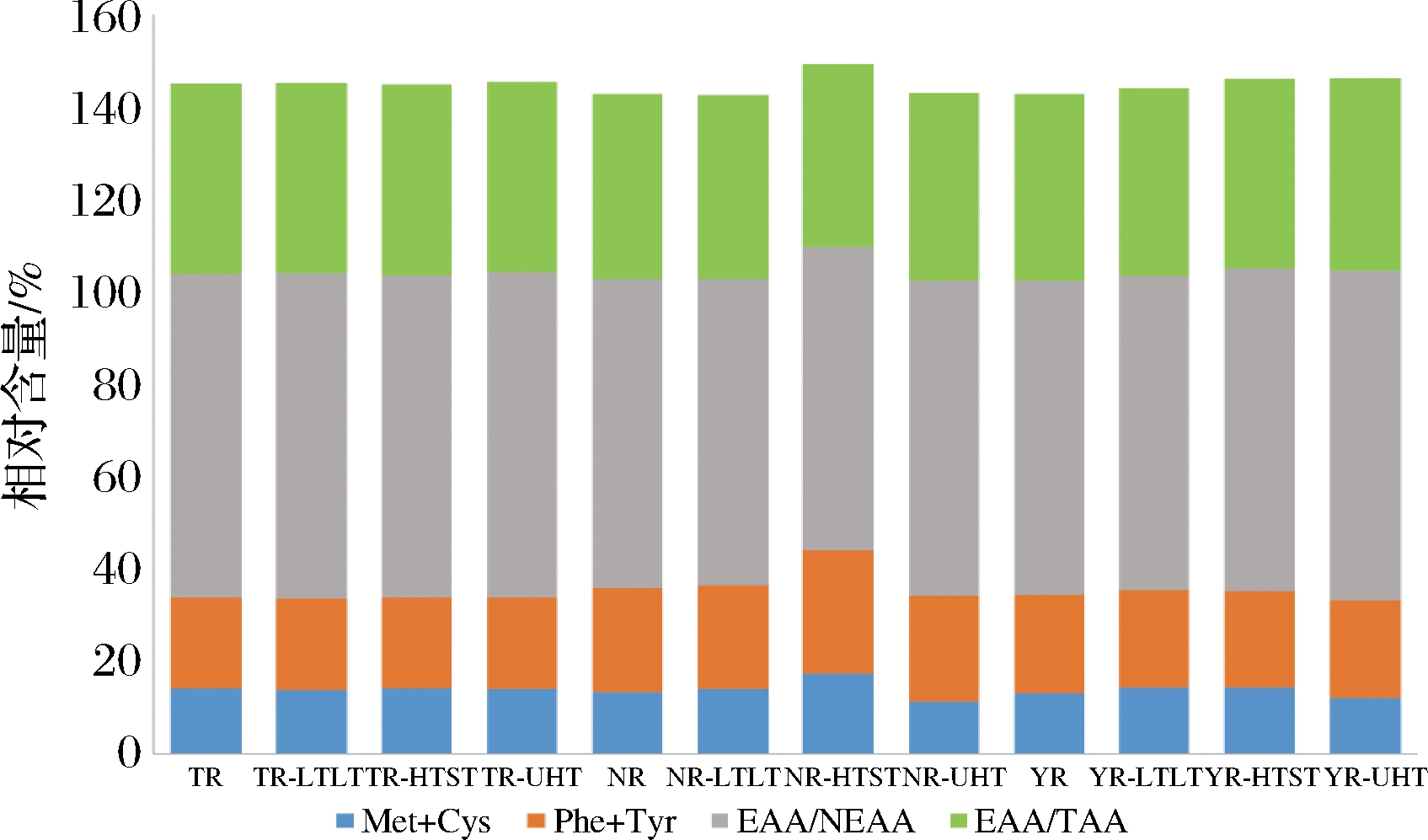
图4 不同热处理条件下3种乳中Met+Cys、Phe+Tyr、EAA/NEAA和EAA/TAA相对含量分析
Fig.4 Content of Met+Cys, Phe+Tyr, EAA/NEAA and EAA/TAA in camel, cow and goat milk under different heated treatment
Met和Cys是乳中含硫的EAA,含硫氨基酸是在热处理过程中对食品风味影响较大的一类氨基酸。其在加热过程中分解产生乙醛、半胱胺等物质,是乳香味的重要组成部分。相比未处理组,LTLT和HTST热处理条件下,3种乳中Met+Cys的含量升高,而在UHT热处理条件下,其含量有所降低,说明LTLT和HTST处理使乳中的乳香味得到进一步改善。
2.4 热处理对驼乳、牛乳和山羊乳氨基酸组成的PCA的影响
为了进一步分析加热处理对3种畜乳中氨基酸组成的影响,采用SPSS软件对3种热处理条件下的驼乳、牛乳和山羊乳中17种氨基酸进行PCA。如表4所示,从17种氨基酸组分中提取出2个主成分(特征值>1),主成分1的特征值为14.60,特征贡献率为85.87%,主要影响因子为Asp、Ser和His(表5);主成分2的特征值为1.34,特征贡献率为7.90%,主要影响因子为Gly和Ala;主成分1和主成分2的累计贡献率为93.77%。
表4 方差分析
Table 4 Analysis of variance

PC初始特征值提取平方和载入合计方差贡献率/%累计贡献率/%合计方差贡献率/%累计贡献率/%F114.6085.8785.8714.6085.8785.87F21.347.9093.771.347.9093.77
表5 PC系数向量值
Table 5 Vectors of principle components

序号氨基酸PC1PC21Asp0.0680.0832Glu0.066-0.0803Ser0.068-0.0014His0.068-0.0415Gly0.0390.6036Thr0.067-0.0767Arg0.063-0.2648Ala0.0550.4379Tyr0.068-0.03210Cys0.063-0.02611Val0.0630.08612Met0.061-0.21313Ile0.065-0.19114Phe0.057-0.04915Lys0.0670.06916Leu0.0680.01017Pro0.068-0.032
3种热处理条件下的驼乳、牛乳和山羊乳中17种氨基酸组成的PCA图如图5所示,3种热处理条件下的驼乳的云图分布于同一相区,共同聚类于三维图右方,且与牛乳和山羊乳的距离较远,再次验证了图3的结果,表明未处理组或即使经过了加热处理,3种乳中氨基酸的含量存在一定的差异。LTLT和UHT热处理条件下的驼乳氨基酸,从空间上聚类的更近一些,说明LTLT和UHT处理对驼乳氨基酸含量的影响更相似。对于牛乳和山羊乳,LTLT和HTST处理条件下的聚类更近一些,而UHT处理产生了较大的聚类距离;说明UHT加热处理对牛乳和山羊乳中的氨基酸组成影响较大。以上结果表明不同热处理方式对3种畜乳的氨基酸组成有明显的影响。利用17种氨基酸组成绘制PCA图,可很好地区分不同热处理样品。
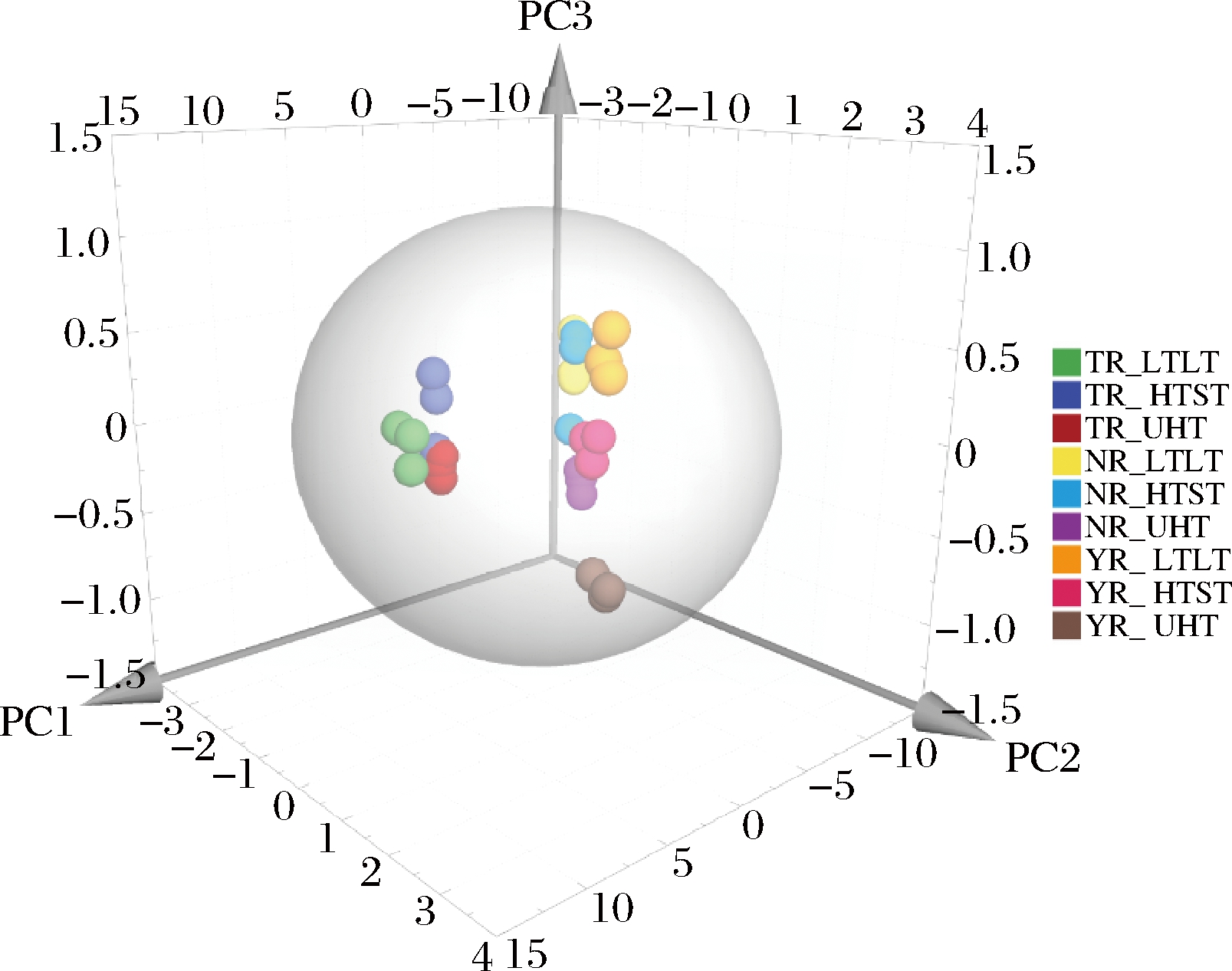
图5 不同处理条件下驼乳、牛乳和山羊乳中氨基酸组成的PCA图
Fig.5 Principal component analysis plot of amino acid composition in camel, cow and goat milk under different heated treatment
3 结论
本研究基于HPLC技术,对驼乳、牛乳和山羊乳在3种不同热处理条件下(LTLT,65 ℃、30 min;HTST,85 ℃、15 s;UHT,135 ℃、5 s)的氨基酸组成进行了比较分析。HPLC的FR检测器对乳中17种氨基酸均有很好的响应值,且各色谱峰峰形尖锐、无杂峰干扰。对3种乳中的氨基酸组成进行分析发现,未处理和加热处理的驼乳、牛乳、山羊乳中氨基酸组成和相对含量差异显著,且UHT加热处理的牛乳和山羊乳中氨基酸的组成差异较大;而相比牛乳和山羊乳,加热处理对驼乳中氨基酸的影响较低。同时,加热处理会不同程度的增加3种乳中Glu、Asp、Met和Cys的含量,说明加热处理使乳中的乳香味得到进一步改善。因此,生产厂家通过加热处理,不仅杀灭乳中微生物、增加其保质期,而且还可提高产品的风味,增加消费者的购买欲。由此可见,不同的热处理方式对驼乳、牛乳和山羊乳中氨基酸的组成和含量产生不同的影响。本研究为生产加工不同热处理品质的驼乳、牛乳和山羊乳产品提供依据。
[1] HAUG A, HØSTMARK A T, HARSTAD O M.Bovine milk in human nutrition:A review[J].Lipids in Health and Disease, 2007, 6:25.
[2] 吕中旺, 张娟霞, 杨永新, 等.不同物种乳氨基酸含量及组分的比较研究[J].中国畜牧兽医, 2013, 40(11):106-110.
LYU Z W, ZHANG J X, YANG Y X, et al.Comparative study on the content and composition of amino acids in milk from different species[J].China Animal Husbandry & Veterinary Medicine, 2013, 40(11):106-110.
[3] 刘锋. 内蒙古不同地区牛乳中常规营养成分及氨基酸的比较研究[D].呼和浩特:内蒙古农业大学, 2009.
LIU F.The study of milk nutrient component and amino acid of dairy cows in the different areas of the Inner Mongolia[D].Hohhot:Inner Mongolia Agricultural University, 2009.
[4] MELINI F, MELINI V, LUZIATELLI F, et al.Raw and heat-treated milk:From public health risks to nutritional quality[J].Beverages, 2017, 3(4):54.
[5] PARK Y W, ZHANG H P, ZHANG B L, et al.Mare Milk[M]//Handbook of Milk of Non-Bovine Mammals.Ames, Iowa, USA:Blackwell Publishing Professional,2006:275-296.
[6] 陈天鹏, 刘翠, 冷友斌, 等.羊乳营养成分及功能特性的研究进展[J].中国食物与营养, 2016, 22(3):71-76.
CHEN T P, LIU C, LENG Y B, et al.Research progress on nutritional components and functional property of goat milk[J].Food and Nutrition in China, 2016, 22(3):71-76.
[7] RESTANI P, BALLABIO C, DI LORENZO C, et al.Molecular aspects of milk allergens and their role in clinical events[J].Analytical and Bioanalytical Chemistry, 2009, 395(1):47-56.
[8] JANDAL J M.Comparative aspects of goat and sheep milk[J].Small Ruminant Research, 1996, 22(2):177-185.
[9] CARDOSO R R, SANTOS R M, CARDOSO C R, et al.Consumption of camel’s milk by patients intolerant to lactose.A preliminary study[J].Revista Alergia Mexico, 2010, 57(1):26-32.
[10] ALI A, BABY B, VIJAYAN R.From desert to medicine:A review of camel genomics and therapeutic products[J].Frontiers in Genetics, 2019, 10:17.
[11] AYOUB M A, PALAKKOTT A R, ASHRAF A, et al.The molecular basis of the anti-diabetic properties of camel milk[J].Diabetes Research and Clinical Practice, 2018, 146:305-312.
[12] 赫欣睿, 武中庸, 叶永丽, 等.高效液相色谱法测定氨基酸的研究进展[J].分析测试学报, 2016, 35(7):922-928.
HE X R, WU Z Y, YE Y L, et al.Research progress on detection of amino acids by high performance liquid chromatography[J].Journal of Instrumental Analysis, 2016, 35(7):922-928.
[13] 覃婷婷, 黄哲甦.氨基酸分析仪测定乌鸡增乳胶囊中的氨基酸含量[J].天津药学, 2017, 29(2):18-21.
TAN T T, HUANG Z S.Determination of amino acids in Wuji zengreu capsule by amino acid analyzer[J].Tianjin Pharmacy, 2017, 29(2):18-21.
[14] 顾志荣, 马转霞, 马天翔, 等.柱前衍生化RP-HPLC同时测定不同产区锁阳中17种游离氨基酸含量及其多元统计分析[J].中国实验方剂学杂志, 2020, 26(10):148-155.
GU Z R, MA Z X, MA T X, et al.Pre-column derivatization RP-HPLC for simultaneous determination of 17 amino acids in Cynomorii herba from different producing areas and its multivariate statistical analysis[J].Chinese Journal of Experimental Traditional Medical Formulae, 2020, 26(10):148-155.
[15] 李文斐, 张磊, 宋宇轩, 等.绵羊、山羊和牛乳的营养成分比较分析[J].食品工业科技, 2020, 41(24):286-291.
LI W F, ZHANG L, SONG Y X, et al.Comparative analysis of nutrients in sheep, goat and cow milk[J].Science and Technology of Food Industry, 2020, 41(24):286-291.
[16] 杨惠茹, 郭军, 古斯愣图, 等.六种家畜乳氨基酸特征聚类分析[J].食品与发酵工业, 2022, 48(6):233-240.
YANG H R, GUO J, GUSILENGTU, et al.Cluster analysis on amino acid properties of six livestock milk[J].Food and Fermentation Industries, 2022, 48(6):233-240.
[17] 张熙桐, 关博元, 孔繁华, 等.人乳、牛乳、羊乳中乳清部分氨基酸组成及乳清蛋白中蛋白质二级结构的对比[J].食品科学, 2017, 38(24):107-112.
ZHANG X T, GUAN B Y, KONG F H, et al.Comparative study of amino acid composition and secondary structure of whey proteins in human milk, cow milk, and goat milk[J].Food Science, 2017, 38(24):107-112.
[18] 赵瑞, 崔进, 梅连瑞, 等.超高效液相色谱-质谱测定牛乳中游离氨基酸[J].食品研究与开发, 2017, 38(19):156-160.
ZHAO R, CUI J, MEI L R, et al.Determination of free amino acids in milk by ultra-performance liquid chromatography-tandem mass spectrometry[J].Food Research and Development, 2017, 38(19):156-160.
[19] 祁翔. 亮氨酸补充对老龄大鼠骨骼肌生长的影响及机理探讨[D].上海:上海体育学院, 2015.
QI X.The research of the effects of leucine supplement in older people muscle protein metabolism[D].Shanghai:Shanghai University of Sport, 2015.
[20] 杨洁, 薛建岗, 陈永福, 等.西藏地区两种传统发酵乳的氨基酸含量分析[J].中国奶牛, 2013(8):50-53.
YANG J, XUE J G, CHEN Y F, et al.The analysis of amino acid compositions between two types of fermented milk in Tibet[J].China Dairy Cattle, 2013(8):50-53.
[21] SU G W, ZHENG L, CUI C, et al.Characterization of antioxidant activity and volatile compounds of Maillard reaction products derived from different peptide fractions of peanut hydrolysate[J].Food Research International, 2011, 44(10):3 250-3 258.
[22] ELLIOTT A J, DHAKAL A, DATTA N, et al.Heat-induced changes in UHT milks:Part 1[J].Australian Journal of Dairy Technology, 2003, 58:3-10
[23] JOINT WHO/FAO/UNU EXPERT CONSULTATION.Protein and amino acid requirements in human nutrition[J].World Health Organization Technical Report Series, 2007:935.