D-葡萄糖二酸(glucaric acid, GA)是葡萄糖的衍生物,是一种天然的二元酸,存在于许多水果和蔬菜中,特别是在十字花科蔬菜、西柚、柑橘等植物中葡萄糖二酸的含量较为丰富。葡萄糖二酸不仅在医药中有抗癌、治疗糖尿病的作用[1],而且因其能合成羟基化尼龙,在纺织服装方面也有广泛的应用[2]。因此,它在2004年被美国能源部确认为“最具价值的生物炼制产品”之一[3]。
目前,葡萄糖二酸主要通过葡萄糖的化学氧化方法合成,该方法以硝酸为溶剂和氧化剂[4]。但化学氧化法生产葡萄糖二酸存在收率低、副产物多、环境不友好等缺点。而采用生物法合成葡萄糖二酸对环境更加友好,并且能够实现低成本生产葡萄糖二酸。生物法生产葡萄糖二酸有很多种途径,现阶段,葡萄糖二酸的生物生产方法主要以微生物发酵为主。PRATHER团队通过共同表达酿酒酵母(Saccharomyces cerevisiae)的肌醇-1-磷酸合成酶(Ino1)、小家鼠的肌醇加氧酶(MIOX)和丁香假单胞菌(Pseudomonas syringae)的糖醛酸脱氢酶(Udh),构建了利用大肠杆菌从葡萄糖生物法合成葡萄糖二酸的途径[5]。由于酵母的耐酸性和较强的抗噬菌体能力,GUPTA等[6]将大肠杆菌的葡萄糖二酸合成途径转移到酿酒酵母中,在外加肌醇的条件下葡萄糖二酸的最大滴度达到1.6 g/L。此外,酿酒酵母可以通过自身的Ino1和肌醇单磷酸酶(Inm1/2)转化葡萄糖-6-磷酸生成肌醇,因此,研究人员只需要在酿酒酵母中表达外源的miox 基因和udh 基因即可实现葡萄糖到葡萄糖二酸的转化[6-8]。
在研究葡萄糖二酸代谢途径过程中,发现MIOX的酶活力比Udh低2个数量级[5],并且稳定性较差,容易失活。因此MIOX的催化过程成为葡萄糖二酸合成的限速步骤。研究人员采取了一系列代谢工程策略提高葡萄糖二酸的产量,这些策略包括蛋白质融合标签[9]、定向进化、构建多肽支架[10]等。本实验室通过将拟南芥(Arabidopsis thaliana)的miox4基因和丁香假单胞菌的udh 基因构建到酿酒酵母的delta位点上提高了葡萄糖二酸的产量[11];之后利用linker将MIOX4和Udh进行融合,在酿酒酵母的delta位点表达[12],使葡萄糖二酸的产量大大提高;这些方法均提高了葡萄糖二酸的产量,但MIOX4的活力及稳定性依然无法满足应用要求,因此采用定向进化的方法筛选出酶活力较高的MIOX4具有重要意义。
定向进化是利用基因工程技术模拟自然界中的进化,建立蛋白质突变库,从中筛出具有优良特性的蛋白质突变体[13]。研究人员通常采用易错PCR技术对酶进行定向进化[14-15]。葡萄糖二酸经跨膜蛋白转运进入胞内后激活CdaR[16]蛋白使其转变为活性形式,进而与操纵子区域结合,启动下游结构基因转录。基于上述原理,王毳等[17]在大肠杆菌中构建了葡萄糖二酸生物传感系统筛,并将其应用到筛选来自小鼠的肌醇加氧酶突变株的研究过程。本研究采取两轮易错PCR的方法提高肌醇加氧酶的活性,通过葡萄糖二酸的产量筛选正突变菌株。同时,利用本实验构建的大肠杆菌葡萄糖二酸传感器质粒R7M10[18]作为高通量筛选工具筛选MIOX4突变株。
本研究以酿酒酵母BY4741opi1Δ(敲除OPI1基因的BY4741菌株)[11]为出发菌株,利用酵母自身的Ino1将葡萄糖-6-磷酸转化为肌醇-1-磷酸,再经过酵母的Inm1/2将肌醇-1-磷酸转化成肌醇,肌醇经过外源的MIOX4转化为D-葡萄糖醛酸,之后再经过外源Udh的催化生成葡萄糖二酸。因此本实验通过将拟南芥来源的肌醇加氧酶miox4基因和丁香假单胞菌来源的醛酸脱氢酶udh 基因整合到BY4741opi1Δ的基因组上,以此构建葡萄糖二酸生物合成途径。本研究对拟南芥来源的MIOX4进行定向进化,通过两轮易错PCR构建MIOX4突变体文库,并利用大肠杆菌葡萄糖二酸传感器作为高通量筛选工具对MIOX4突变体文库进行初筛,然后对筛选到的阳性转化子进行摇瓶发酵,挑选正向突变体并确定发生有益突变的氨基酸位点(图1)。
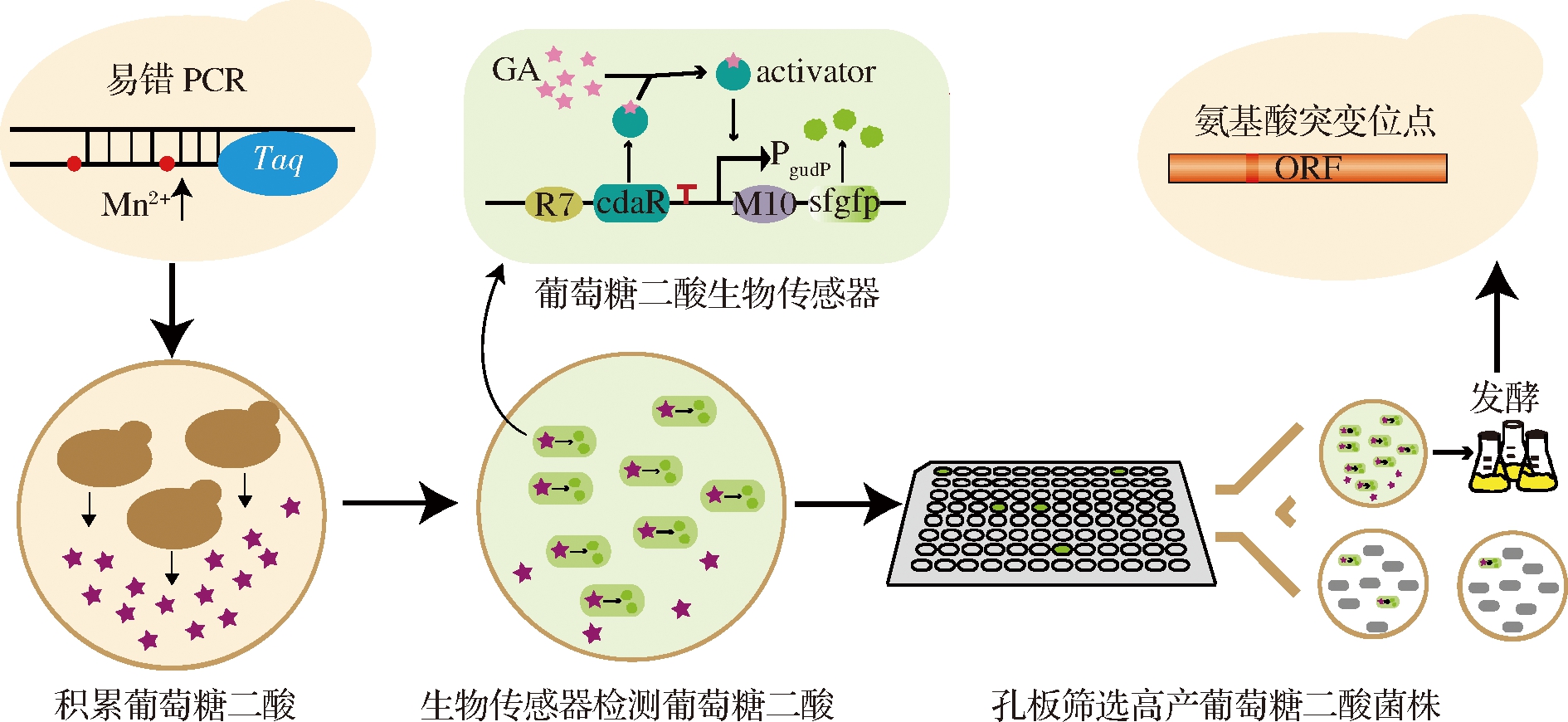
图1 MIOX4突变体文库构建和筛选策略示意图
Fig.1 The schematic diagram of the construction and screening strategy for MIOX4 mutant library
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
本实验所用菌株和质粒详见表1。
1.1.2 培养基
酿酒酵母用YPD[(g/L)(酵母提取物10、蛋白胨20、葡萄糖20)]、SD-URA、SD-HIS[(g/L)(葡萄糖20,无氨基酵母氮源1.7,硫酸铵5.0,10×必需氨基酸混合液,无对应的氨基酸URA/HIS)]培养基进行培养,发酵培养基在YPD培养基的基础上外加60 mmol/L肌醇;大肠杆菌用LB[(g/L)(氯化钠10,酵母提取物5,蛋白胨10)]培养基进行培养,加入相应的抗生素用于筛选转化子;检测荧光的大肠杆菌用M9[(g/L)(磷酸氢二钠6.78,磷酸二氢钾3,氯化钠0.5,氯化铵1,硫酸镁0.24,葡萄糖4,氯化钙0.1 mmol/L)]培养。以上培养基添加2.0%(质量分数)琼脂粉配制固体培养基。
表1 本研究所用菌株和质粒
Table1 Strains and plasmids used in this study

名称 特性描述来源BL21Strain used for detect fluorescence实验室贮藏BY4741opi1ΔMATa, his3Δ1, leu2Δ0, met15Δ0, ura3Δ0, opi1Δ0实验室贮藏菌株Bga-3BY4741piΔ1 carrying miox4, udh and HIS实验室贮藏BY4741opi1Δ-udhMATa, his3Δ1, leu2Δ0, met15Δ0, ura3Δ0, opi1Δ0, express udh本研究 BY4741OPI1Δ-udh-miox4MATa, his3Δ1, leu2Δ0, met15Δ0, ura3Δ0, opi1Δ0, express udh and miox4本研究 BY4741OPI1Δ-udh-miox4∗MATa, his3Δ1, leu2Δ0, met15Δ0, ura3Δ0, opi1Δ0, express udh and mutational miox4∗本研究 质粒R7M10pJKR-H-R7-cdaR-M10实验室贮藏pY26-miox4-udhE.coli and S.cerevisiae shuttle plasmid, Amp, ura, and contains genes miox4and udh实验室贮藏
注:*表示突变后序列
1.1.3 试剂和仪器
2×Taq PCR Master Mix,南京诺唯赞科技有限公司;PCR引物(表2)及基因序列测序,苏州金唯智生物有限公司;肌醇、葡萄糖二酸标准品,Sigma公司;其他常规试剂采用国产分析纯或进口分装。
ETC811基因扩增仪,德国Eppendorf公司;Gel Doc XR+凝胶成像仪,美国Bio-Rad公司;SYNERGY H1多功能酶标仪,南京拜尔克智能科技有限公司;UV-1800分光光度计,上海翱艺仪器有限公司;1260Ⅱ高效液相色谱,美国安捷伦科技有限公司。
表2 本研究所用引物序列
Table 2 Primer sequence used in this study

引物序列HIS3-udh-FGGGTAACTCTTCACAACTGGCCAGGAACATATTCCAAGTTAAAAAGAAAAGAAAAAGAAACGAGGCGGHIS3-udh-RGAGGCATCTCTAAGAAAAACGTTGTTAAAGCAAACGGAAACCGGCTTGCTGCGTCATCTTCTAACACCGcheck-udh-FATCGTGATATTGTACCAGCCcheck-udh-RGTGTGATGGTCGTCTATGTGURA3-FAATTCAGCTGGCGTAATAGCAGGCTATGGAACAACACTCAACCCTATCTURA3-RCGTGTTTAACTTGAGTGACGATTTTCTCCTCTGGGAGATACAAACCATGACTTAACTATGCGGCATCAGmiox4-1-FAAGTTTGTTGGTCGTGCACTTGTCTATATAGTTCTTCCAGCCTGGGTCCCATCGCCGTACCACTTCmiox4-1-RGAACTGTCTACCAAAGGCGmiox4-2-FGACACAAATGATGATGAGGCTTmiox4-2-RGTATGTCTCATTATGGAAGTCGmiox4-3-FGAGAATCCCGACTTCCATAATGmiox4-3-RTTCCACGTCAACATGCACmiox4-4-FGTAAGTCTAAAGTGCATGTTGACmiox4-4-RATAGCCTGCTATTACGCCAG
注:下划线为同源臂
1.2 实验方法
1.2.1 MIOX4蛋白活性位点的预测及三级结构模拟
在ZhangLab[19]https://zhanggroup.org/COACH/网站上预测来自拟南芥的MIOX4蛋白的配体结合位点和催化活性位点;利用Swiss-Modelhttps://swissmodel.expasy.org/在线软件对MIOX4进行同源建模;使用可视化工具PyMOL对MIOX4进行结构模拟。
1.2.2 基因的扩增
以菌株Bga-3[11]的基因组为模板,利用引物对HIS-udh-F/R扩增带有同源臂的HIS-udh,将该片段转化到酿酒酵母BY4741opi1Δ,涂布到SD-HIS的平板上,挑取转化子提基因组后利用引物对check-udh- F/R对基因组进行PCR验证,验证条带正确的转化子表示udh 整合到OPI1的终止子上,即为BY4741opi1Δ-udh。
以质粒pY26-miox4-udh[11]为模板,利用引物对URA3-F/R扩增带有同源臂的URA3,利用引物mi- ox4-1-F和miox4-4-R扩增miox4,将扩增得到的片段URA3和miox4利用引物URA3-F和miox4-4-R进行融合得到URA3-miox4,将该片段转化到BY4741opi1Δ-udh菌株中,涂布到SD-URA的平板上,对转化子提基因组验证,验证条带正确的转化子表示miox4整合到OPI1的启动子上,得到未突变的对照菌株BY4741opi1Δ-udh-miox4。
1.2.3 易错PCR构建突变体文库
将miox4分成4段,分别标记为1、2、3、4,miox4-1片段中包含miox4的启动子和ORF的上游,miox4-2片段为易错片段1,miox4-3片段为易错片段2,miox4-4片段中包含miox4的终止子和ORF的下游。以质粒pY26-miox4-udh为模板,利用引物对miox4-1-F/R扩增带有同源臂的miox4-1片段,引物miox4-3-F和miox4-4-R扩增miox4-3-4(包含3和4片段)片段,引物miox4-1-F和miox4-2-R扩增miox4-1-2(包含1和2片段),使用引物对miox4-2-F/R和miox4-3-F/R对miox4-2和miox4-3分别进行易错PCR;将扩增得到的miox4-1、易错片段miox4-2*、miox4-3-4进行融合,片段miox4-1-2、易错片段miox4-3、miox4-4进行融合PCR,均得到易错miox4*;将易错miox4*和URA3片段利用引物miox4-1-F和URA3-R进行融合PCR得到miox4*-URA3,将该片段转化到BY4741opi1Δ-udh菌株中,涂布到SD-URA的平板上,所得到的转化子即为突变体文库。
1.2.4 利用大肠杆菌葡萄糖二酸传感器初筛MI-OX4的正向突变体
将突变体文库菌株接种到装有2 mL YPD培养基的24孔板中,30 ℃培养12 h作为种子液,再转接到装有10 mL YPD(外加60 mmol/L肌醇)的试管中进行发酵培养,在24、48 h分别补5 g/L的葡萄糖,发酵培养7 d后,12 000 r/min转速离心5 min收集发酵液。
将含有质粒R7M10的大肠杆菌BL21种子以2%的接种量转接到M9培养基中,接种之后的混合物与发酵液按1∶1加入到96深孔板中,培养至OD600值为0.6~0.8,用酶标仪BioTek HT检测荧光(激发485 nm,发射528 nm)和OD600值,取荧光/OD600的值,筛选荧光比值比对照高的突变菌株。
1.2.5 突变菌株的摇瓶发酵
将突变菌株接种到250 mL的摇瓶中发酵培养,30 ℃、250 r/min的条件下培养,在细胞生长对数期24、48 h分别补加5 g/L的葡萄糖,每隔24 h取样检测OD600值及葡萄糖二酸的浓度。
1.2.6 葡萄糖二酸的测定
标准样品的准备:称取一定质量的葡萄糖二酸钾标样,融于超纯水中,用KOH溶液调pH至中性,定容到终质量浓度为1 g/L的葡萄糖二酸溶液。
样品处理:取发酵溶液12 000 r/min转速离心5 min,收集上清液,用10 mmol/L稀硫酸稀释2倍,再12 000 r/min转速离心5 min混匀,经0.22 μm滤膜过滤,供液相分析。
高效液相色谱(high-performance liquid chromatography,HPLC)分析条件:流动相为5 mmol/L稀硫酸,色谱柱为HPX-87H,进样量20 μL,流速0.6 mL/min,柱温35 ℃,检测器为示差检测器。
2 结果与分析
2.1 易错PCR片段的确定
由于MIOX4的编码区序列较长,直接易错PCR效率较低,因此为了提高MIOX4的突变概率,本研究在ZhangLab网站上预测MIOX4蛋白的配体结合位点和催化活性位点,利用Swiss-Model在线软件对MIOX4进行同源建模,使用可视化工具PyMOL对MIOX4进行结构模拟。通过模拟预测MIOX4的三维结构,发现其结合位点和活性位点在2个铁原子和底物的周围(图2-A)。预测结果显示,有13个配体结合位点,8个催化活性位点,配体结合位点分别是Arg59、Tyr75、Asp116、Ser118、Asp119、Asp155、Lys158、Gly175、Asp176、His227、His253、Ser254、Tyr256(蓝色和紫色);催化活性位点分别是His129、His154、Asp155、Lys158、His227、His253、Ser254、Asp286(粉色和紫色);其中Asp155、Lys158、His227、His253、Ser254既是催化活性位点,又是配体结合位点(紫色)(图2-B)。预测结果显示这些氨基酸位点大多集中在MIOX4编码区序列的中间区域,对MIOX4编码区的中间区域分成两段进行易错PCR,以此提高突变概率。
2.2 葡萄糖二酸合成途径的构建
为了方便对突变MIOX4进行筛选,本研究在酿酒酵母BY4741opi1Δ菌株上构建葡萄糖二酸的代谢途径,葡萄糖二酸由肌醇加氧酶MIOX4和糖醛酸脱氢酶Udh催化肌醇产生葡萄糖二酸,因此通过葡萄糖二酸的产量来筛选MIOX4突变株。以BY4741opi1Δ为出发菌株,在该菌株的基因组上构建葡萄糖二酸的代谢途径。首先将udh构建到BY4741opi1Δ菌株OPI1的终止子上,构建基础菌株BY4741opi1Δ-udh;然后将经过随机突变的miox4*构建到该菌株OPI1的启动子上得到突变体菌株BY4741opi1Δ-udh-miox4*,作为突变体文库,未发生突变的miox4作为对照菌株BY4741opi1Δ-udh-miox4(图3)。以菌株Bga-3基因组为模板扩增3 330 bp的HIS-udh(图4-A),并转化BY4741opi1Δ,正确的BY4741opi1Δ-udh转化子经过验证能扩增915 bp(图4-B)。
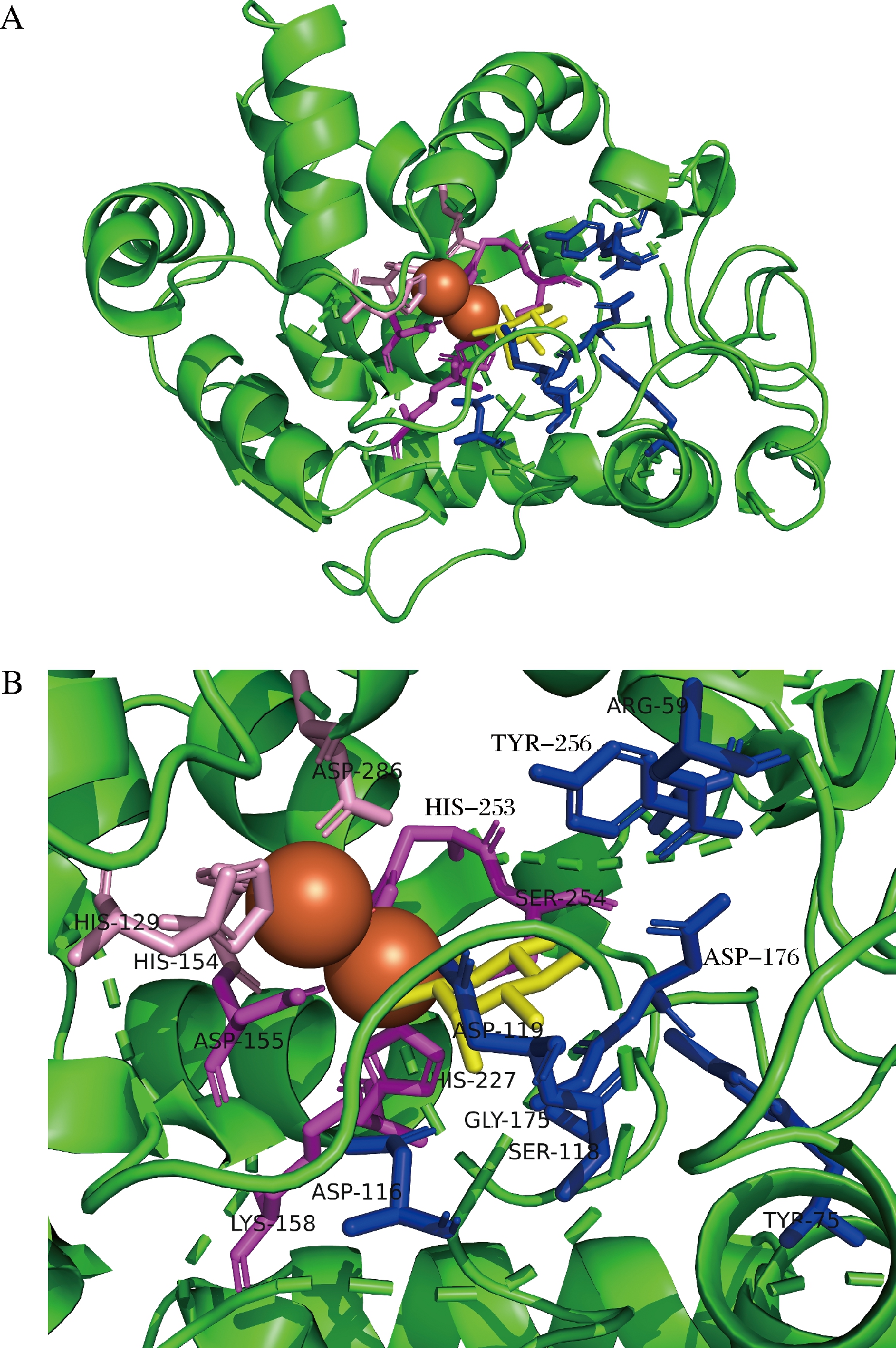
A-模拟MIOX4的三维结构;B-预测MIOX4的催化活性位点和配体结合位点
图2 MIOX4蛋白的三维结构模拟图
Fig.2 A simulation diagram of the three-dimensional structure of the MIOX4 protein
注:橙色球体为铁原子,黄色为底物肌醇,蓝色和紫色为配体结合位点,粉色和紫色为催化活性位点,紫色为配体结合位点和催化活性位点
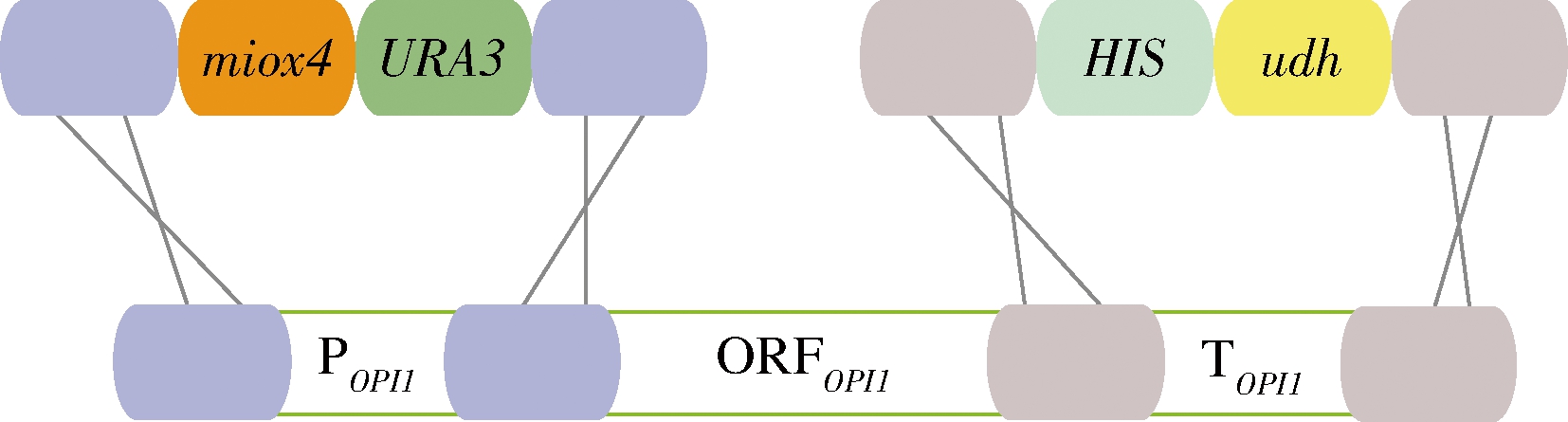
图3 构建葡萄糖二酸代谢途径的示意图
Fig.3 Schematic diagram of constructing glucaric acid metabolic pathway
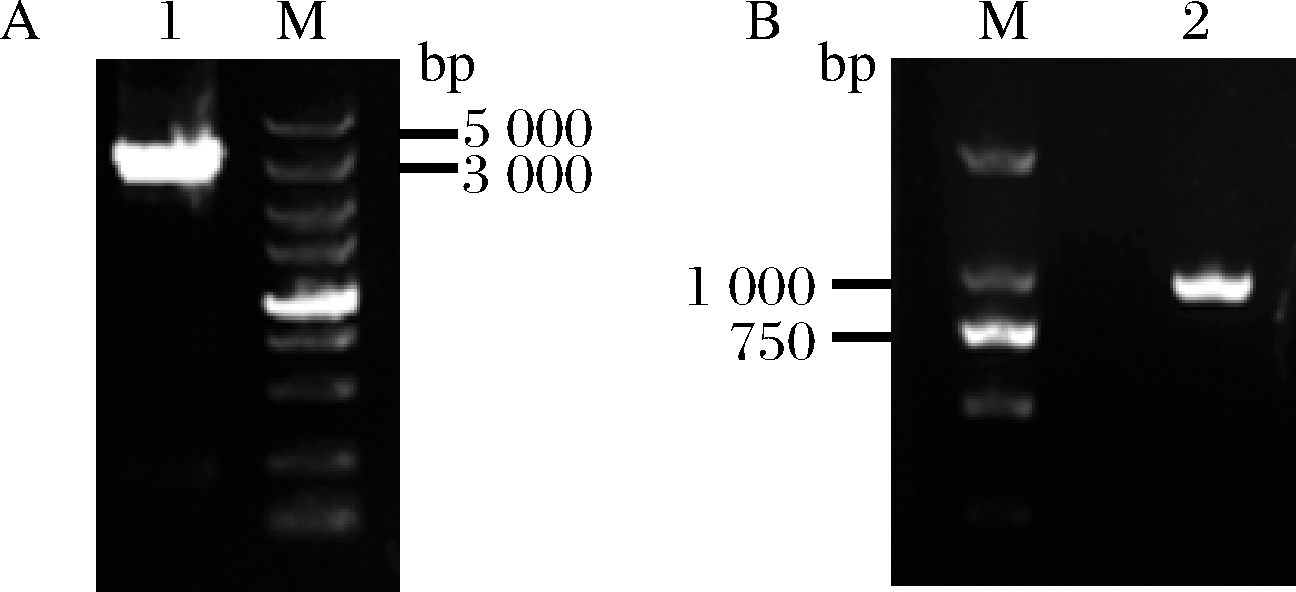
A-扩增HIS-udh;B-转化子验证结果
图4 BY4741opi1Δ上构建udh 基因
Fig.4 Construction of udh gene in BY4741opi1Δ
2.3 易错PCR对MIOX4定向进化
通过对MIOX4蛋白结构的预测,MIOX4蛋白的配体结合位点和催化活性位点集中在编码区的中间区域,为了提高突变率,将miox4的编码区的中间区域分成2段分别进行易错PCR。这样就有2种情况,一种情况是miox4-2发生突变,miox4-2序列包括39位的天冬氨酸到205位的酪氨酸(图5-A),另一种情况是miox4-3发生突变,miox4-3序列包括196位的谷氨酸到298位的谷氨酸(图5-B),以此扩大突变文库。
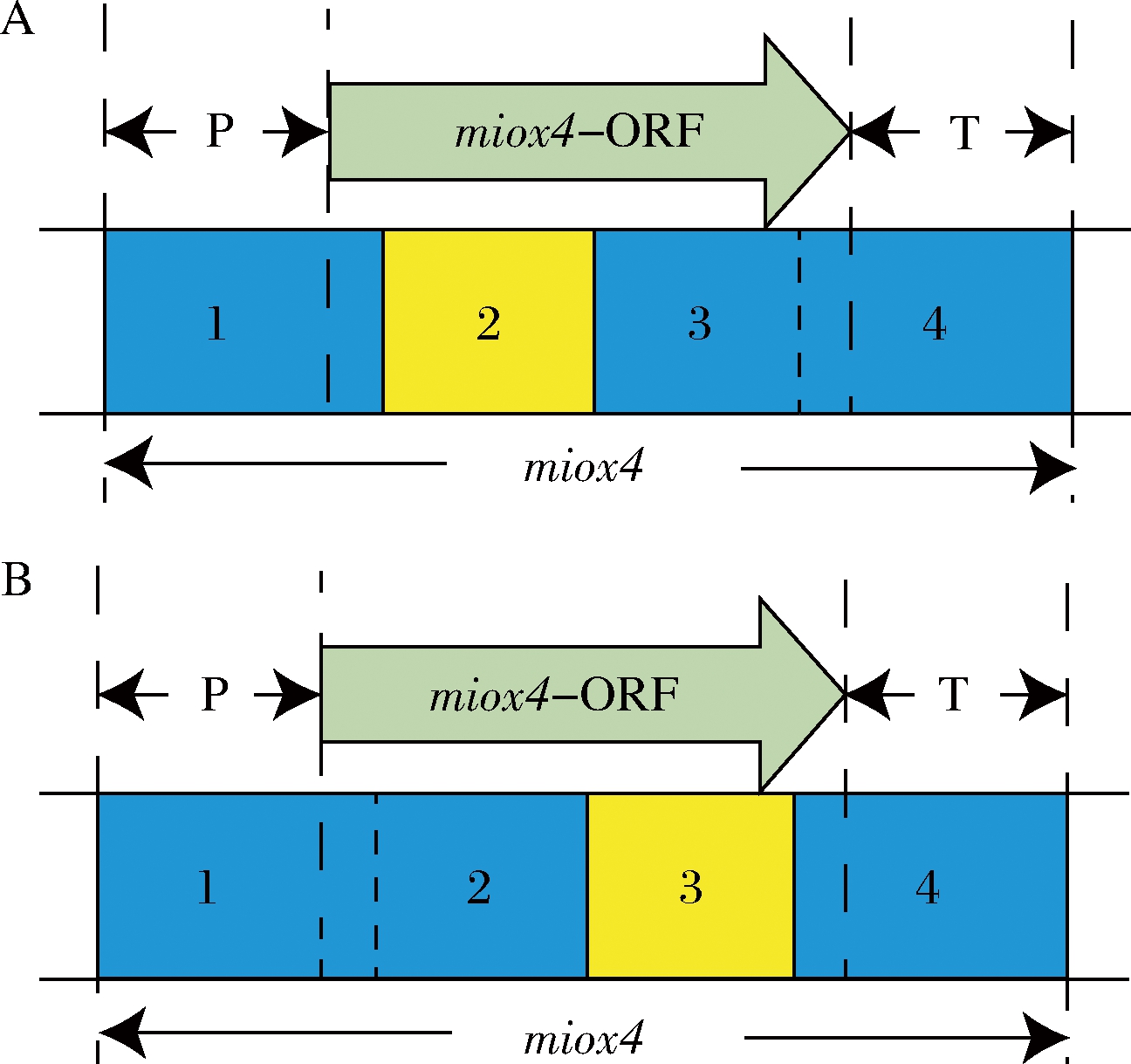
A-对miox4-2片段易错;B-对miox4-3片段易错
图5 两种易错PCR的情况示意图
Fig.5 Schematic diagram of two error-prone PCR scenarios
Mn2+可以通过降低聚合酶对模板的特异性而增加碱基错配概率,研究人员一般采用外加Mn2+的方式进行易错PCR[20-21] 。我们亦采用外加不同浓度的Mn2+进行易错PCR,为了提高突变率,本研究采用两轮易错PCR的方式来进行。以质粒pY26-miox4-udh为模板,选取浓度为1、1.5、2、2.5、3、3.5、4、4.5 mmol/L的Mn2+分别对miox4-2和miox4-3进行第一轮易错PCR,由图6-A可知,随着Mn2+浓度升高,条带逐渐变淡,选取Mn2+浓度为3.5、4、4.5 mmol/L的PCR产物作为模板对其进行第二轮易错PCR,Mn2+浓度为1、1.5、2、2.5、3、3.5、4、4.5 mmol/L,随着Mn2+浓度升高,条带逐渐变淡并且消失(图6-B)。
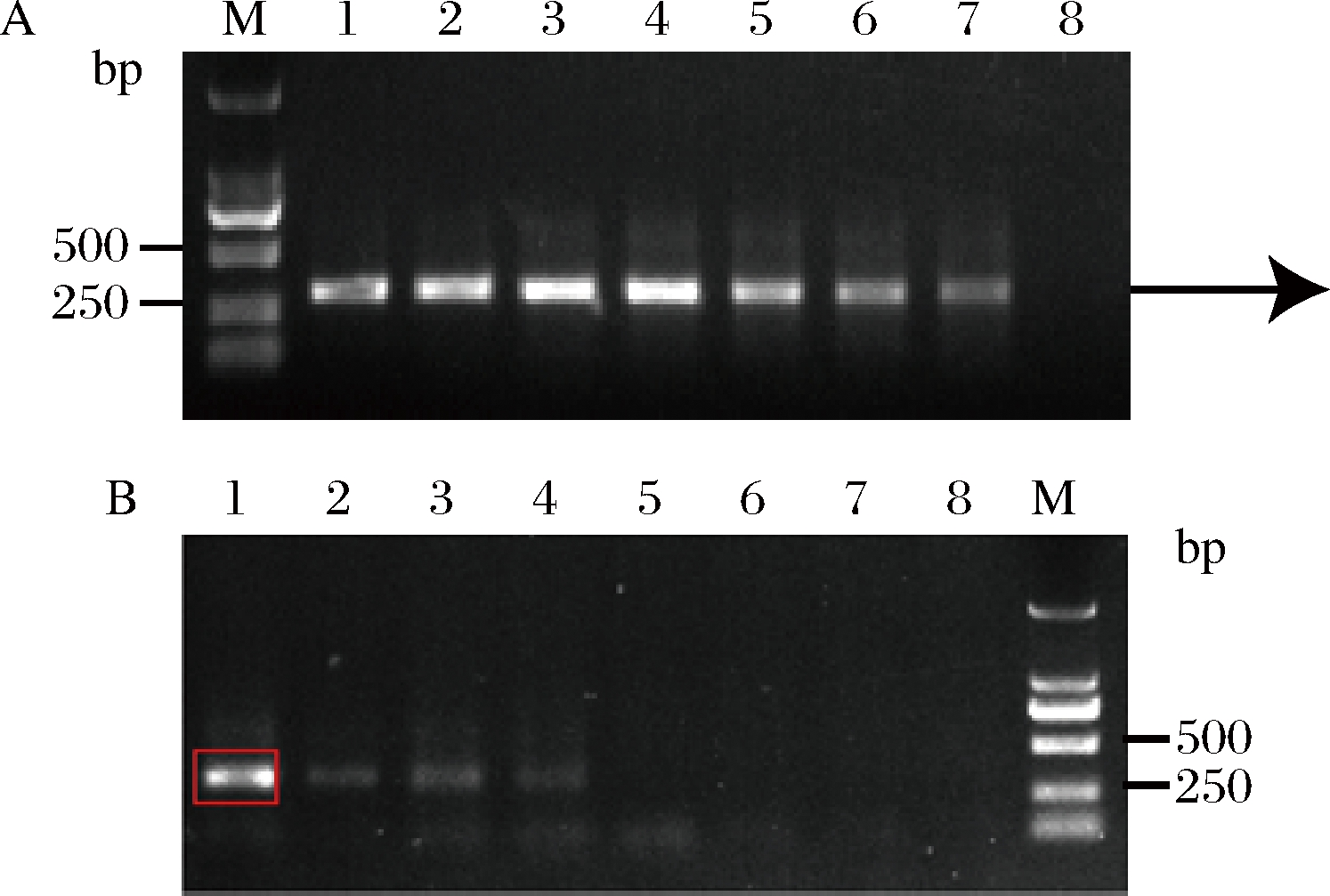
1~8-Mn2+浓度1、1.5、2、2.5、3、3.5、4、4.5 mmol/L
A-第一轮易错PCR;B-第二轮易错PCR
图6 外加不同Mn2+浓度进行易错PCR
Fig.6 Different Mn2+ concentrations for error-prone PCR
将易错片段miox4-2*和miox4-3*分别与其他片段融合得到突变的miox4*扩增产物,以质粒pY26-miox4-udh为模板扩增URA3,将突变的miox4*和URA3进行融合得到URA3-miox4*片段3 089 bp(图7),融合片段转化到菌株BY4741opi1Δ-udh中,构建突变体文库。
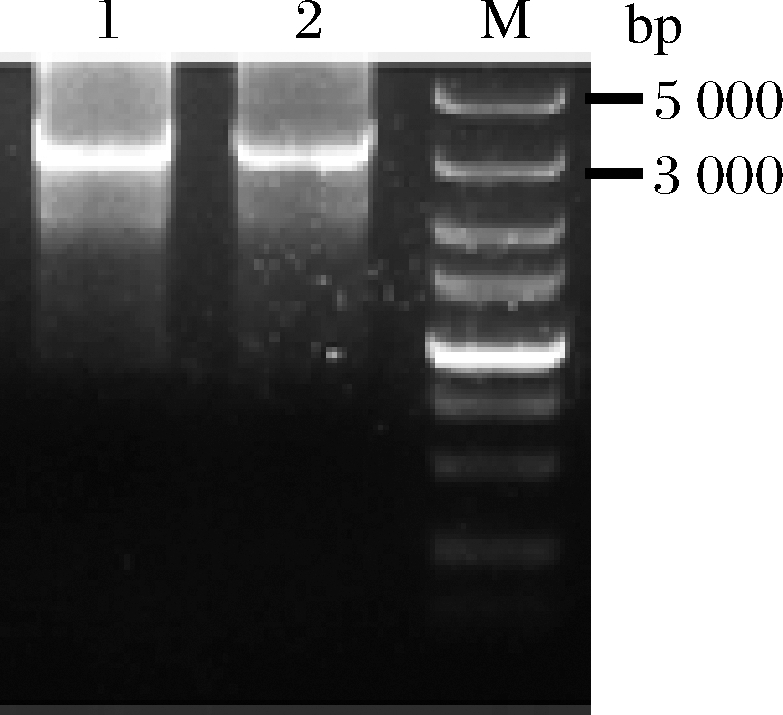
泳道1-第一种易错PCR情况与URA3融合的结果(miox4-2*与miox4-1、miox4-3-4、URA3融合);泳道2-第二种易错PCR
情况与URA3融合的结果(miox4-3*与miox4-1-2、miox4-4、URA3融合)
图7 两种易错PCR产物融合的结果
Fig.7 The results of the fusion of two error-prone PCR products
2.4 利用大肠杆菌葡萄糖二酸传感器对突变体文库进行初筛
在大肠杆菌中,葡萄糖二酸经膜蛋白转运到胞内后与cdaR结合变成激活形式,进而与操纵子区域结合,启动下游报告基因gfp的转录[17, 22]。R7M10质粒同时表达转录因子cdaR和绿色荧光蛋白GFP,能将葡萄糖二酸浓度以荧光的强弱显示出来[18]。为了确定荧光检测的时间,以对照菌株BY4741opi1Δ-udh- miox4(未突变)的发酵液为对照,检测不同比例的菌液和发酵液在不同时间的荧光/OD600值,实验结果显示,菌液和发酵液体积比为1∶1时在6~7 h检测荧光效果较好(图8)。
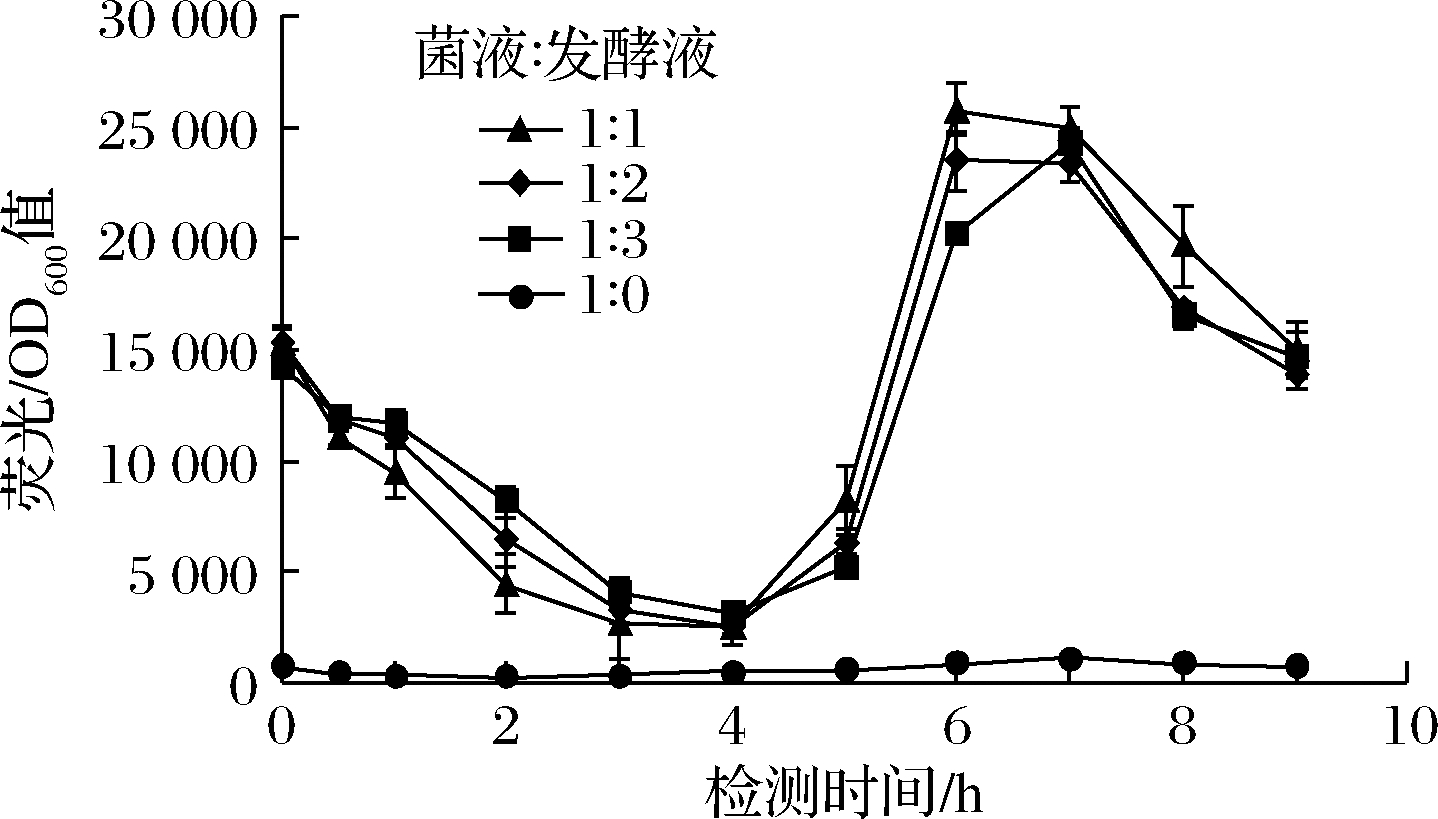
图8 菌液和发酵液比例以及荧光检测时间的确定
Fig.8 Determination of the ratio of bacterial liquid and fermentation liquid, fluorescence detection time
利用大肠杆菌葡萄糖二酸传感器作为一个高通量工具筛选突变体文库,检测突变株发酵液中的葡萄糖二酸。将带有质粒R7M10的大肠杆菌BL21菌液以2%的接种量转接到M9培养基中,然后与发酵液以1∶1的体积比加入到96深孔板中,培养6~7 h后用酶标仪检测,筛选荧光较强的突变株,从荧光结果发现,1 200株菌中有60株荧光较高且高于对照的菌株(图9)。
为了进一步确定这60株菌的葡萄糖二酸的产量,对60株菌进行发酵复筛。液相结果显示,有24株菌的葡萄糖二酸产量高于对照菌株(未突变菌株)(图10),其中9、15、41产量最高,分别是1.08、1.01、1.18 g/L,分别较对照菌株提高了34%、26%、48%。
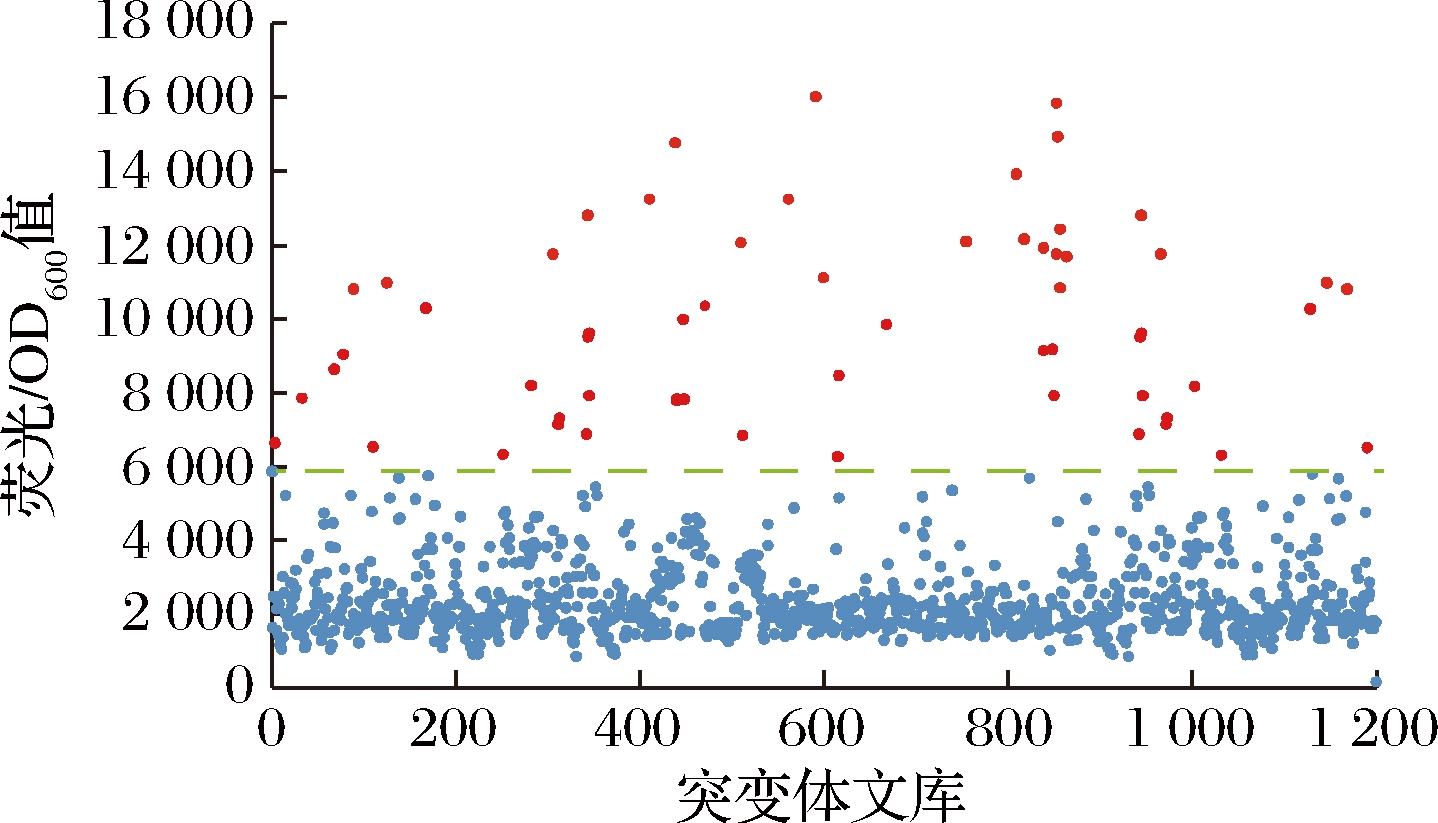
图9 大肠杆菌葡萄糖二酸传感器质粒对突变体文库初筛的荧光结果
Fig.9 Fluorescence results of screening of mutant library by E.coli glucaric acid biosensor
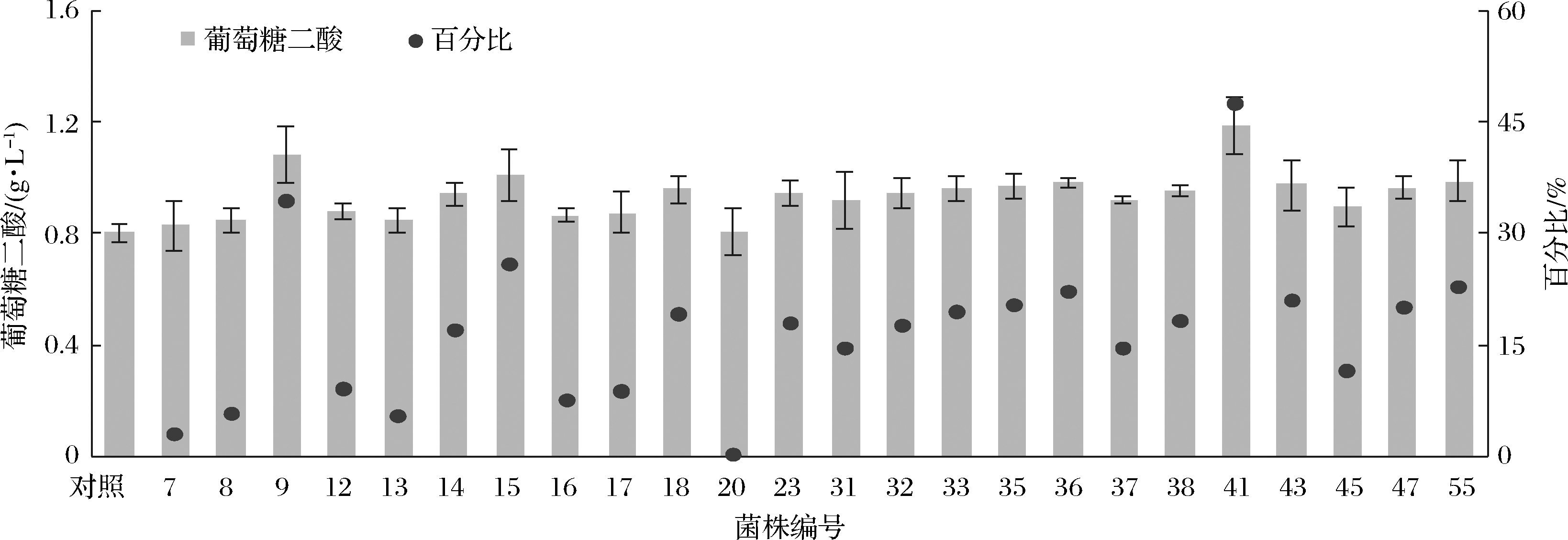
图10 60株荧光较高的菌株进行发酵复筛
Fig.10 Fermentation rescreening of 60 strains with higher fluorescence
2.5 突变菌株突变位点的确定及摇瓶发酵
为了鉴定上述24株菌的MIOX4的突变位点,对这24株菌的MIOX4序列进行了DNA测序。测序结果显示,第8、9、12、15、41、45号菌株的MIOX4的氨基酸序列发生了突变,其余没有发生突变,MIOX4的突变位点如表3所示。为了进一步确定这些突变位点是否为有益突变,对这6株突变株在外加60 mmol/L肌醇的培养基中进行摇瓶发酵,以未突变的菌株作为对照菌株。生长进入对数期后,在24、48 h分别补5 g/L葡萄糖。实验结果显示,突变株S133R、K88R、E72V、T40P在发酵168 h时葡萄糖二酸产量较对照菌株产量分别提高了53%、30%、21%、17%(图11),说明这4个位点为正向突变位点。
表3 突变位点的确定
Table 3 Determination of the mutation sites
菌株编号8912154145突变位点E72VS133RM222T、V63AK88RT40PE72G、P257S
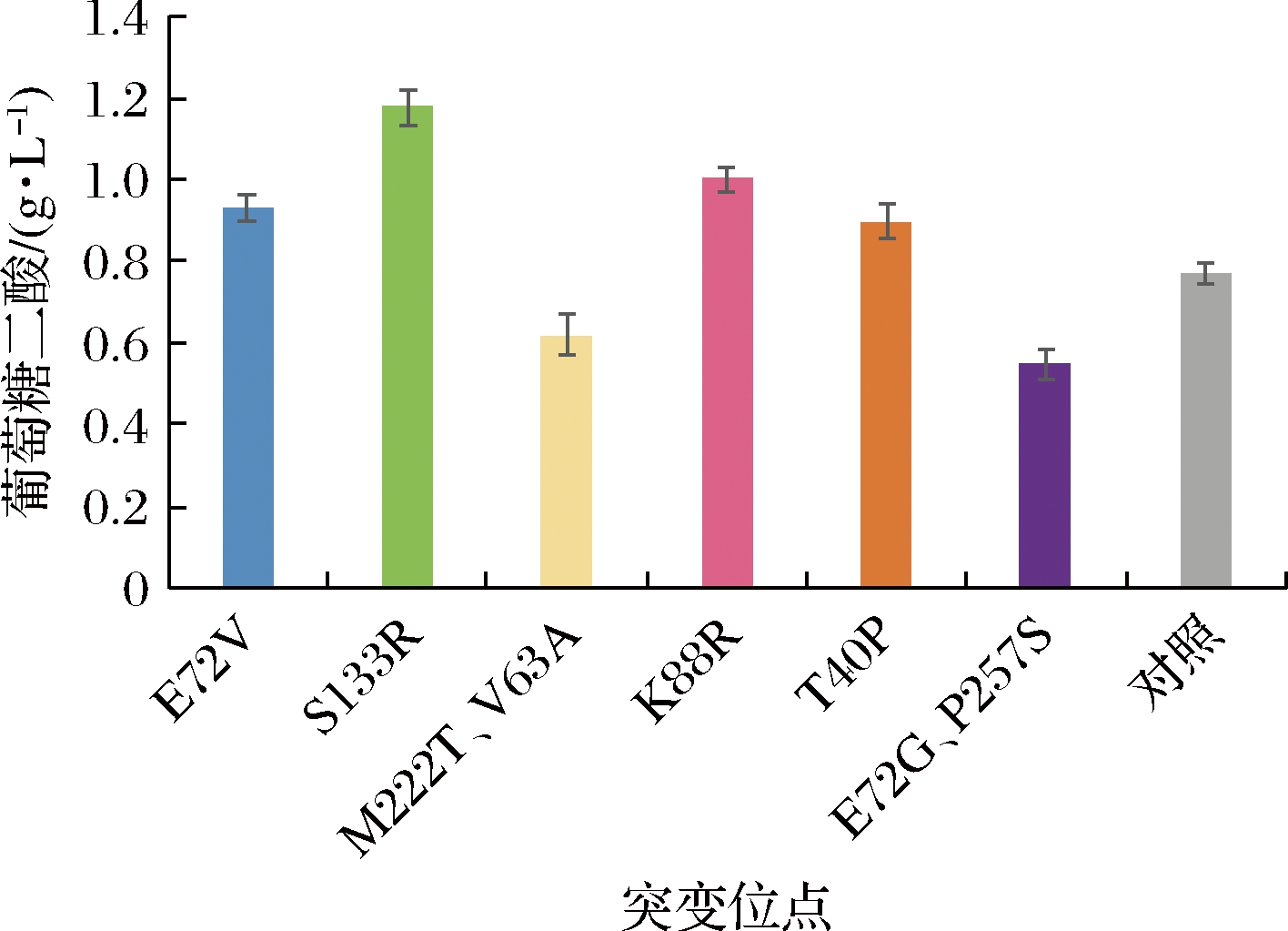
图11 突变株摇瓶发酵结果
Fig.11 Mutant shake flask fermentation results
2.6 MIOX4(S133R)蛋白三级结构分析
本研究中,我们对葡萄糖二酸产量提高最高的突变体MIOX4(S133R)进行蛋白结构分析,将突变后的MIOX4(S133R)蛋白序列输入到蛋白三级结构在线预测平台Swiss Model后,对突变蛋白进行同源建模,进一步分析突变后蛋白MIOX4(S133R)的氨基酸结构变化。分析结果显示,MIOX4蛋白S133突变成R133后,Arg133和底物肌醇之间的距离变远(图12),这种距离的增加导致了空间位阻的减少。KARKHANE等[23]通过定点诱变的方法减少空间位阻,使突变后的Phe181与催化Ser114之间的距离增大,脂肪酶活性增加了2.6倍。薄秀梅等[24]将MEKK3蛋白K391突变为M391后,使靠近反应中心的原子侧链占有的空间位置变大,增大了空间位阻而失去活性。空间位阻会限制底物进入酶活性的位点,因此空间位阻的减小可能会提高MIOX4的催化活性。
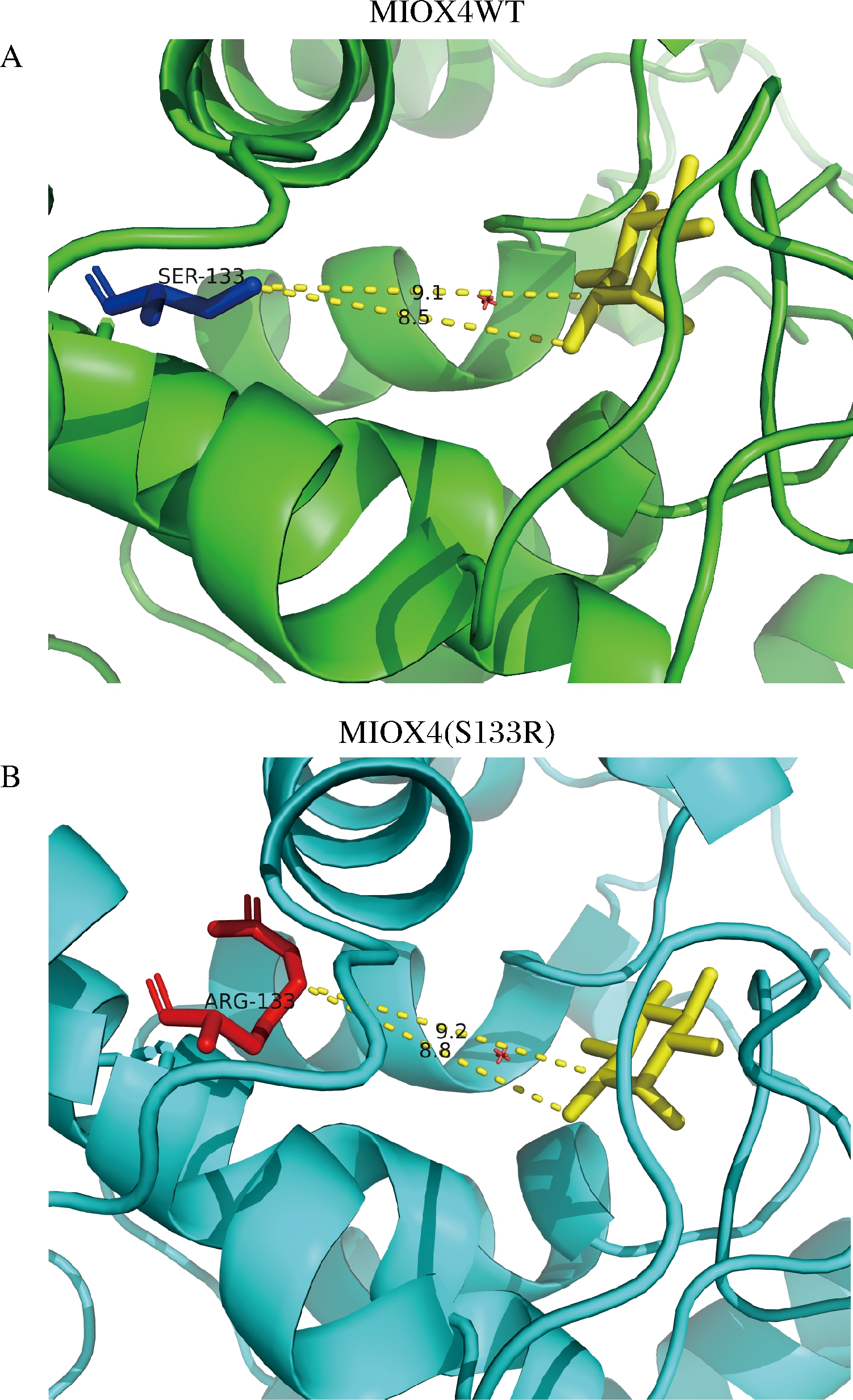
A-野生型MIOX4第133位的丝氨酸Ser与底物肌醇的空间距离;B-突变后133位的精氨酸Arg与底物肌醇的空间距离
图12 野生型MIOX4和突变型MIOX4(S133R)蛋白结构的比较
Fig.12 Comparison of the protein structure of wild-type MIOX4 and mutant MIOX4(S133R)
3 结论
目前,葡萄糖二酸的产量经代谢工程及合成生物学的方法已大大提高[11-12],但肌醇转化成葡萄糖醛酸的过程依旧是葡萄糖二酸代谢的限速步骤,因此提高肌醇加氧酶MIOX4的活性显得尤为重要。定向进化是一种非常强大的蛋白质工程工具,可以在不深入了解蛋白质结构和酶-底物相互作用的情况下改善酶的性能。本研究以酿酒酵母为宿主,对来自拟南芥的肌醇加氧酶MIOX4进行定向提高其活性。采用易错PCR的方法来构建MIOX4突变体文库,利用大肠杆菌葡萄糖二酸传感器将葡萄糖二酸产量转变为荧光强度对突变体文库进行初筛,得到了60株荧光较高的菌株。通过进一步对这60株菌株进行摇瓶发酵,获得了24株葡萄糖二酸产量高于对照的菌株。最后发现,4个MIOX4的突变体(S133R、K88R、E72V、T40P)的葡萄糖二酸产量较野生型分别提高了53%、30%、21%、17%,其中S133R的产量提高最显著。本研究结果同时进一步证明了MIOX4在葡萄糖二酸生物合成过程中起着重要作用,为后续提高葡萄糖二酸的产量奠定了基础。
[1] SINGH J, GUPTA K P.Induction of apoptosis by calcium D-glucar- ate in 7, 12-dimethyl benz[a]anthracene-exposed mouse skin[J].Journal of Environmental Pathology, Toxicology and Oncology, 2007, 26(1):63-73.
[2] KIELY D E, CHEN L, LIN T H.Hydroxylated nylons based on unprotected esterified D-glucaric acid by simple condensation reactions[J].Journal of the American Chemical Society, 1994, 116(2):571-578.
[3] BOZELL J J, PETERSEN G R.Technology development for the pro- duction of biobased products from biorefinery carbohydrates-the US Department of Energy’s “ Top10 ” revisited[J].Green Chemistry, 2010, 12(4):539.
[4] SMITH T N, HASH K, DAVEY C L, et al.Modifications in the nitric acid oxidation of D-glucose[J].Carbohydrate Research, 2012, 350:6-13.
[5] MOON T S, YOON S H, LANZA A M, et al.Production of glucaric acid from a synthetic pathway in recombinant Escherichia coli[J].Applied and Environmental Microbiology, 2009, 75(3):589-595.
[6] GUPTA A, HICKS M A, MANCHESTER S P, et al.Porting the synthetic D-glucaric acid pathway from Escherichia coli to Saccharo- myces cerevisiae[J].Biotechnology Journal,2016, 11(9):1 201-1 208.
[7] LIU Y, GONG X, WANG C, et al.Production of glucaric acid from myo-inositol in engineered Pichia pastoris[J].Enzyme and Microbial Technology, 2016, 91:8-16.
[8] LEE C C, KIBBLEWHITE R E, PAAVOLA C D, et al.Production of glucaric acid from hemicellulose substrate by rosettasome enzyme assemblies[J].Molecular Biotechnology, 2016, 58(7):489-496.
[9] SHIUE E, PRATHER K L J.Improving D-glucaric acid production from myo-inositol in E.coli by increasing MIOX stability and myo-inositol transport[J].Metabolic Engineering, 2014, 22:22-31.
[10] MOON T S, DUEBER J E, SHIUE E, et al.Use of modular, synthetic scaffolds for improved production of glucaric acid in engineered E.coli[J].Metabolic Engineering, 2010, 12(3):298-305.
[11] CHEN N, WANG J Y, ZHAO Y Y, et al.Metabolic engineering of Saccharomyces cerevisiae for efficient production of glucaric acid at high titer[J].Microbial Cell Factories, 2018, 17(1):67.
[12] 李杰, 赵运英, 邓禹.高效合成葡萄糖二酸酿酒酵母工程菌的构建[J].生物工程学报, 2022, 38(2):705-718.
LI J, ZHAO Y Y, DENG Y.Engineering Saccharomyces cerevisiae for efficient production of glucaric acid[J].Chinese Journal of Biotechnology, 2022, 38(2):705-718.
[13] PACKER M S, LIU D R.Methods for the directed evolution of proteins[J].Nature Reviews Genetics, 2015, 16(7):379-394.
[14] 李树, 张伟, 赵春梅.易错PCR技术定向进化褐藻胶裂解酶Alg-2的分析[J].食品科学, 2019, 40(4):146-151.
LI S, ZHANG W, ZHAO C M.Directed evolution of alginate lyase Alg-2 based on error prone PCR[J].Food Science, 2019, 40(4):146-151.
[15] LIU Y H, HU B, XU Y J, et al. Improvement of the acid stability of Bacillus licheniformis alpha amylase by error-prone PCR[J].Journal of Applied Microbiology, 2012, 113(3):541-549.
[16] BLATTNER F R, PLUNKETT III G, BLOCH C A, et al.The complete genome sequence of Escherichia coli K-12[J].Science, 1997, 277(5 331):1 453-1 462.
[17] 王毳, 刘叶, 巩旭, 等. 构建葡萄糖二酸指示系统筛选肌醇加氧酶突变株[J].生物工程学报, 2018, 34(11):1 772-1 783.
WANG C, LIU Y, GONG X, et al. Construction of a glucaric acid biosensor for screening myo-inositol oxygenase variants[J].Chinese Journal of Biotechnology, 2018, 34(11): 1 772-1 783.
[18] DING N N, YUAN Z Q, ZHANG X J, et al. Programmable crossribosome-binding sites to fine-tune the dynamic range of transcription factor-based biosensor[J].Nucleic Acids Research, 2020, 48(18):10 602-10 613.
[19] YANG J Y, ROY A, ZHANG Y.BioLiP:A semi-manually curated database for biologically relevant ligand-protein interactions[J].Nucleic Acids Research, 2021, 41(D1):D1 096-D1 103.
[20] 王睿, 喻晓蔚, 沙冲, 等.定向进化-易错PCR方法提高华根霉Rhizopus chinensis CCTCC M201021脂肪酶的活力[J].生物工程学报, 2009, 25(12):1 892-1 899.
WANG R, YU X W, SHA C, et al.Increasing activity of Rhizopus chinensis CCTCC M201021 lipase by directed evolution-error prone PCR[J].Chinese Journal of Bioengineering, 2009, 25(12):1 892-1 899.
[21] MADAN B, MISHRA P.Directed evolution of Bacillus licheniformis lipase for improvement of thermostability[J].Biochemical Engineering Journal, 2014, 91:276-282.
[22] ROGERS J K, CHURCH G M.Genetically encoded sensors enable real-time observation of metabolite production[J].Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(9):2 388-2 393.
[23] KARKHANE A A, YAKHCHALI B, JAZII F R, et al. The effect of substitution of Phe181 and Phe182 with Ala on activity, substrate specificity and stabilization of substrate at the active site of Bacillus thermocatenulatus lipase[J].Journal of Molecular Catalysis B:Enzymatic, 2009, 61(3-4):162-167.
[24] 薄秀梅, 张荣丽, 徐洲.MEKK3蛋白K391位点突变对其影响的生物信息学分析及活性鉴定[J].科学技术与工程, 2020, 20(13):5 066-5 073.
BO X M, ZHANG R L, XU Z.Bioinformatics analysis and activity identification of MEKK3 protein K391 site mutation on its protein[J].Science Technology and Engineering, 2020, 20(13):5 066-5 073.