水蜜桃(Prunus persica)是蔷薇科桃属植物,是一种富含维生素A、维生素C和果胶的夏季水果,具有美容养颜、活血促代谢、预防便秘等功效[1]。水蜜桃属于典型的跃变型果实,在采后会出现水分和营养物质的丧失、细菌污染等问题,极不易贮藏[2],将其加工为广受欢迎的水蜜桃汁可极大地延长产品的保质期,但在其加工过程中会分离出大量的水蜜桃渣。目前在我国,水蜜桃渣的加工利用有限,除部分桃渣被用作动物饲料外,大部分会作为加工废弃物处理,导致资源浪费和环境污染。水蜜桃渣中含有大量的水分和膳食纤维。其中总膳食纤维(total dietary fiber,TDF)根据在水中的溶解性分为不溶性膳食纤维(insoluble dietary fiber,IDF)和可溶性膳食纤维(soluble dietary fiber,SDF)。不溶性纤维包括纤维素、部分半纤维素和木质素,可减少食物通过肠胃的时间,增加粪便重量和体积,起到缓解便秘的作用;可溶性纤维包括果胶、树胶、β-葡聚糖、果聚糖以及一些半纤维素,其通过吸收水分,形成凝胶后延缓胃排空,减少营养吸收,延缓消化。相比于不溶性纤维,可溶性纤维更容易被肠道细菌发酵成短链脂肪酸,可调节肠道菌群平衡、预防肥胖和控制血糖[3]。本文针对水蜜桃渣,采用超声波辅助碱法提取其中的SDF并测定其性能,为其功能性产品奠定基础。
1 材料与方法
1.1 材料与试剂
实验用水蜜桃采自浙江省宁波市奉化区,品种为湖景蜜露。
氢氧化钠、无水乙醇、三(羟甲基)氨基甲烷、乙酸、七水合硫酸亚铁、六水合三氯亚铁、无水乙酸钠、无水葡萄糖,均为分析纯,国药集团化学试剂有限公司;硫酸、乙醚、丙酮,均为分析纯,杭州高晶精细化工有限公司;4-吗啉乙磺酸水合物、无水硫酸铜,均为分析纯,上海麦克林生化科技有限公司;热稳定α-淀粉酶(40 000 U/g)、蛋白酶(枯草杆菌)(150 U/mg)、糖化酶(100 000 U/mL),上海源叶生物科技有限公司。
1.2 仪器与设备
YM-060S型语盟牌超声清洗机,深圳市方奥微电子有限公司;TGL-16MS型高速冷冻离心机,上海卢湘仪离心机仪器有限公司;SCIENTZ-10 N型冷冻干燥机,宁波新芝生物科技股份有限公司;K9840型自动凯式定氮仪,山东海能科学仪器有限公司;UV-3200型紫外可见分光光度计,普美达;S-3400 N型扫描电子显微镜,日立;FT/IR-4700型傅里叶变换红外光谱仪,日本分光株式会社;DHR-2型流变仪,美国TA-WATERS有限公司。
1.3 实验方法
1.3.1 产品质量的分析测定方法
水分含量的测定:GB 5009.3—2016 《食品安全国家标准食品中水分的测定》;蛋白质含量的测定:GB 5009.5—2016《食品安全国家标准食品中蛋白质的测定》;脂肪含量的测定:GB 5009.6—2016 《食品安全国家标准食品中脂肪的测定》;灰分含量的测定:GB 5009.4—2016《食品安全国家标准食品中灰分的测定》;TDF、IDF、SDF含量的测定:GB 5009.88—2014《食品安全国家标准 食品中膳食纤维的测定》。
1.3.2 水蜜桃渣SDF的提取
先对水蜜桃渣粉进行脱糖处理,称取适量桃渣粉置于布氏漏斗中,按每克桃渣粉10 mL的比例用85%(体积分数)乙醇溶液冲洗,弃乙醇溶液,连续处理3次。脱糖后将桃渣粉置于60 ℃烘箱中干燥,过40目筛后置于4 ℃环境中保藏备用。
参考牛俊乐等[4]的提取方法:称取2.0 g备用的脱糖水蜜桃渣粉,按一定的料液比加入一定质量浓度的氢氧化钠溶液后,充分搅拌,然后在超声功率360 W 条件下进行一定时间的超声波处理后在一定温度下浸提一定时间。将处理后的水蜜桃渣原料液体放入离心机中,以8 000 r/min离心15 min后取上层清液。用乙酸溶液调为中性后加入上清液4倍体积的无水乙醇进行醇沉处理,静置2 h后用烘干至恒质量的定量中速滤纸抽滤得固体SDF。将抽滤后得到的滤纸在60 ℃条件下烘干至恒重。SDF提取率计算如公式(1)所示:
提取率![]()
(1)
式中:m1为SDF的质量,g;m2为脱糖桃渣的质量,g。
1.3.3 单因素试验设计
按照1.3.2的提取方法,以SDF提取率为指标,分别探讨超声时间、浸提温度、浸提时间、NaOH质量浓度、料液比各因素对水蜜桃渣中SDF提取率的影响。其中,超声时间分别设定为10、20、30、40、50 min;浸提温度分别设定为50、60、70、80、90 ℃;浸提时间分别设定为30、60、90、120、150 min;NaOH质量浓度分别设定为2、6、10、14、18 g/L;料液比分别设定为1∶15、1∶20、1∶25、1∶30、1∶35(g∶mL)。
1.3.4 Box-Behnken 试验设计
在单因素试验和实验室设备的基础上,确定超声波辅助处理的功率和时间以及浸提温度,采用Box-Behnken试验设计方法对浸提时间(A)、NaOH质量浓度(B)、料液比(C)这3个因素为自变量,以水蜜桃渣中的SDF提取率为响应值(Y)进行响应面优化。响应面分析因素与水平见表1。
表1 响应面分析因素与水平
Table 1 Coded levels and corresponding actual levels of independent variables used for Box-Behnken design
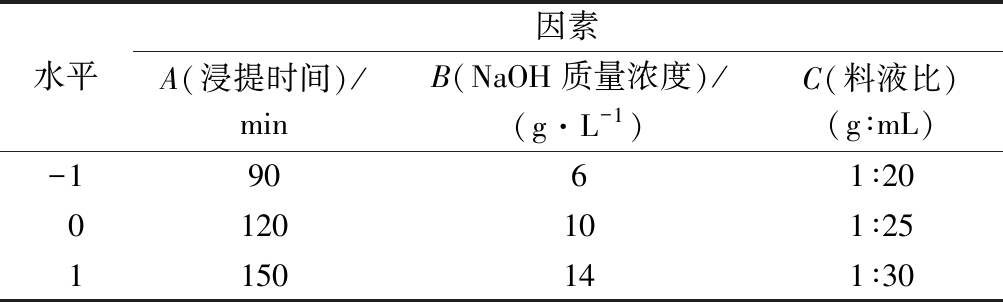
水平因素A(浸提时间)/minB(NaOH质量浓度)/(g·L-1)C(料液比)(g∶mL)-19061∶200120101∶251150141∶30
1.3.5 水蜜桃渣SDF的纯化
采用Sevage法对水蜜桃渣SDF溶液进行脱蛋白处理;采用10%(体积分数)双氧水于55 ℃水浴中进行脱色处理2 h;将样品溶液装入500 Da的透析袋中48 h脱去小分子物质[5],冷冻干燥后过40目筛,置于4 ℃环境中保藏,进行以下相关性能测定。
1.3.6 水蜜桃渣SDF的理化性质和结构表征
1.3.6.1 持水力和膨胀力测定
将250 mg SDF与10 mL蒸馏水加入离心管中,置于25 ℃的环境中混合24 h后,加入溶液4倍体积无水乙醇进行醇沉,然后在离心机中以4 000 r/min离心15 min,移去上清液,把离心管壁上的残留水分用滤纸吸去,称重,读取沉淀体积[6]。持水力、膨胀力计算分别如公式(2)、公式(3)所示:
持水力![]()
(2)
膨胀力![]()
(3)
式中:m1为SDF湿重,g;m0为SDF质量,g;V1为SDF醇沉后的沉淀体积,mL;V0为SDF粉末体积,mL。
1.3.6.2 水溶度测定
在烧杯中将0.1 g SDF与5 mL蒸馏水轻轻混合后,在90 ℃水浴条件下搅拌30 min,然后在离心机中以6 000 r/min离心15 min。收集上清液,干燥至恒重[7]。水溶度计算如公式(4)所示:
水溶度![]()
(4)
式中:m1为干燥后上清液的质量,g;m为SDF质量,g。
1.3.6.3 多糖含量测定
(1)总糖含量的测定
采用硫酸-苯酚法测定SDF的总糖含量。分别取质量浓度为10、20、40、60、80、100 μg/mL的葡萄糖标准液各1 mL,然后加入0.6 mL 5%(体积分数)苯酚和3 mL浓硫酸后混匀,在沸水浴中反应20 min,在490 nm处测定吸光值后绘制葡萄糖标准曲线。配制20 μg/mL SDF溶液,重复上述操作,计算出葡萄糖浓度。总糖含量的计算如公式(5)所示:
总糖含量![]()
(5)
式中:c为样品溶液的葡萄糖质量浓度,mg/mL;D为样品溶液的稀释倍数;V 为样品溶液的体积,mL;m为样品质量,mg。
(2)还原糖含量的测定
采用3,5-二硝基水杨酸法测定SDF的还原糖含量。分别取质量浓度为0.00、0.40、0.80、1.20、1.60、2.00 mg/mL的葡萄糖标准液各1 mL,加入2 mL 3,5-二硝基水杨酸试剂,在沸水浴中反应2 min,取出后迅速冷却,加入9 mL去离子水混匀,在540 nm处测定吸光值后绘制葡萄糖标准曲线。精确称取0.50 g SDF,加入50 mL去离子水混匀,在50 ℃水浴锅中溶解20 min,用去离子水定容至100 mL。取1 mL样品溶液后重复上述操作。还原糖含量的计算如公式(6)所示:
还原糖含量![]()
(6)
式中:c为样品溶液的葡萄糖质量浓度,mg/mL;V为样品溶液的体积,mL;m为样品质量,g;1 000为mg换算成g的系数。
1.3.6.4 紫外可见吸收光谱分析
取2 mg/mL的SDF溶液于石英比色皿中,使用紫外可见分光光度计进行190~700 nm的全波长扫描,分析紫外可见吸收光谱。
1.3.6.5 扫描电子显微镜分析
将样品固定在双面胶带上,喷金处理90 s,用扫描电子显微镜观察样品表观结构并拍照,放大倍数为500倍和2 000倍。
1.3.6.6 傅里叶变换红外光谱分析
将干燥后的样品与KBr混合并用干燥的玛瑙研钵充分研磨成均质粉末,用压片机压成薄片。用空白KBr作为背景,用傅里叶变换红外光谱仪于4 000~500 cm-1下扫描后得到样品红外光谱图。
1.3.6.7 静态流变特性测定
参照LIU等[8]的方法。用DHR-2流变仪测定SDF的静态流变特性,在25℃的条件下,测定质量浓度为2、6、10 g/100mL的样品水溶液在0.1~400 s-1的剪切速率下的表观黏度。
1.3.6.8 总抗氧化能力测定
采用铁离子还原/抗氧化能力法(ferric ion reducing antioxidant power,FRAP)测定SDF的总抗氧化能力。吸取0.00、0.20、0.40、0.60、0.80、1.00 mmol/L的FeSO4溶液各150 μL,加入4.50 mL的FRAP工作液,混匀,在37 ℃水浴锅中保持10 min,于593 nm处测定吸光度后绘制标准曲线。吸取0.00、1.20、2.40、3.60、4.80、6.00 mg/mL的SDF溶液各150 μL后重复上述操作。SDF总抗氧化能力用相同吸光度值的FeSO4溶液的浓度进行表征。
2 结果与分析
2.1 水蜜桃渣成分分析
分析水蜜桃渣(湿)的成分,结果如表2所示。
表2 水蜜桃渣(湿)成分 单位:%
Table 2 The composition of Prunus persica dregs (wet)
水分蛋白质脂肪灰分TDFIDFSDF85.99±0.440.82±0.010.41±0.010.54±0.023.31±0.081.97±0.061.45±0.06
计算可知,水蜜桃渣中SDF占TDF的41.48%,已知张晓雪等[9]提取沙棘果皮渣和刘素稳等[10]提取苹果渣的SDF分别占TDF的9.8%和33.57%。因此,水蜜桃渣相较于葡萄皮渣和苹果渣等水果渣更适宜提取SDF。水蜜桃渣中SDF∶TDF为1∶1.36,大于1∶3,属于高品质膳食纤维。
2.2 水蜜桃渣SDF提取单因素实验
2.2.1 超声时间对水蜜桃渣SDF提取率的影响
由图1可知,SDF提取率随超声时间延长呈先上升后下降的趋势,当超声时间为20 min时,SDF提取率可达到最大值18.65%,这是由于在20 min内,超声波使得细胞壁破裂,SDF溶出,提取率提高。而超声时间过长使部分SDF的链结构被超声波的剪切作用打断,导致SDF提取率下降。因此当超声时间为20 min时,SDF提取率较佳。
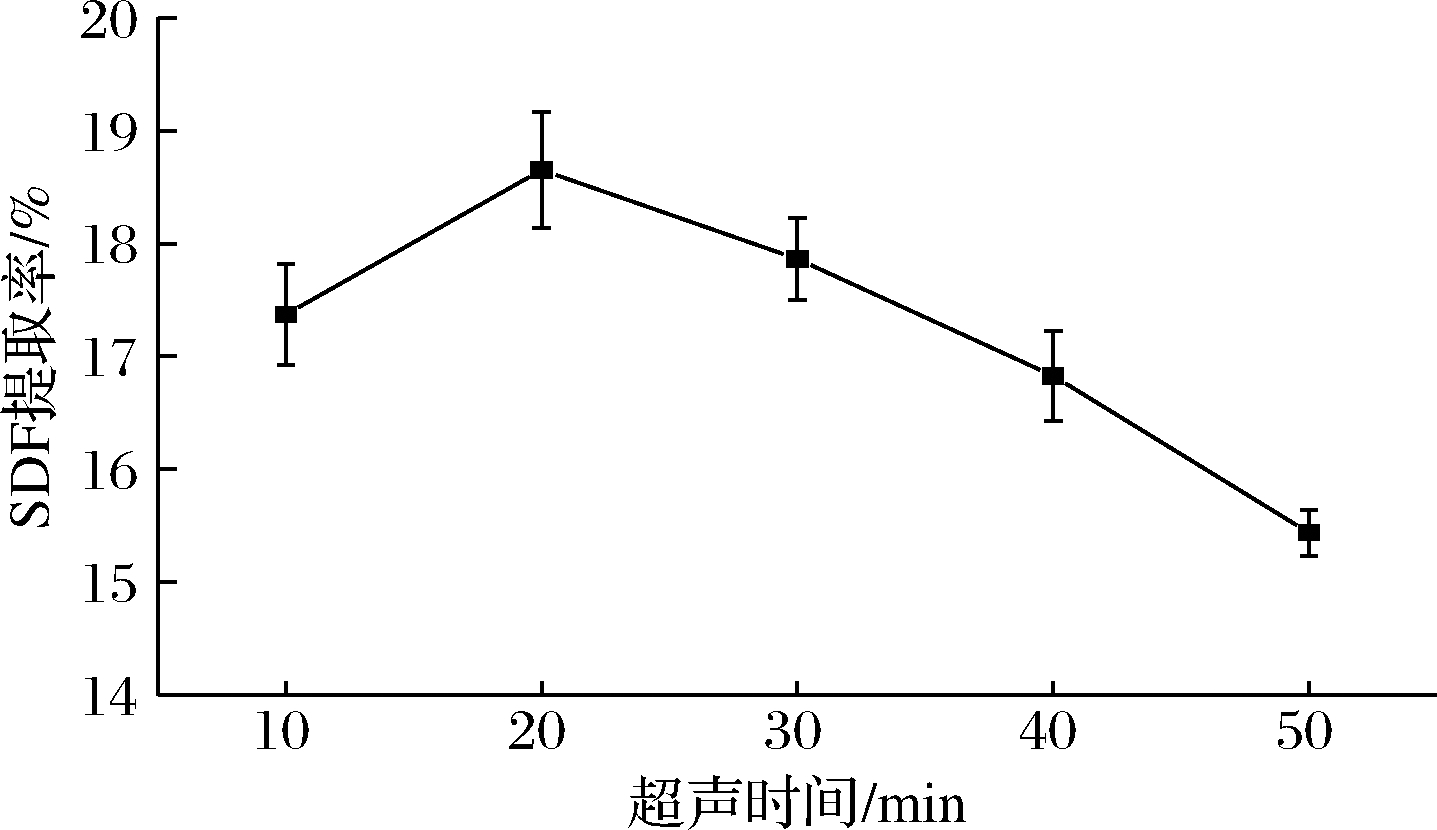
图1 超声时间对SDF提取率的影响
Fig.1 Effect of ultrasonic time on extraction yield of SDF
2.2.2 浸提温度对水蜜桃渣SDF提取率的影响
由图2可知,随着浸提温度的提高,SDF提取率呈先上升后下降的趋势,当浸提温度为80 ℃时,较高的浸提温度使水分子加快运动,各物质之间的振动与撞击使SDF从不溶性成分中脱离出来,使SDF提取率高达24.06%。但随着浸提温度的不断提高,导致SDF快速降解。因此当浸提温度为80 ℃时,SDF提取率较佳。

图2 浸提温度对SDF提取率的影响
Fig.2 Effect of extraction temperature on extraction yield of SDF
2.2.3 浸提时间对水蜜桃渣SDF提取率的影响
由图3可知,SDF提取率随浸提时间延长呈先上升后下降的趋势,当浸提时间为120 min时,SDF提取率可达到最大值27.75%,由于浸提时间延长,水蜜桃渣细胞壁破裂,SDF溶出。但当浸提时间过长时,导致部分SDF结构被破坏。因此当浸提时间为120 min时,SDF提取率较佳。
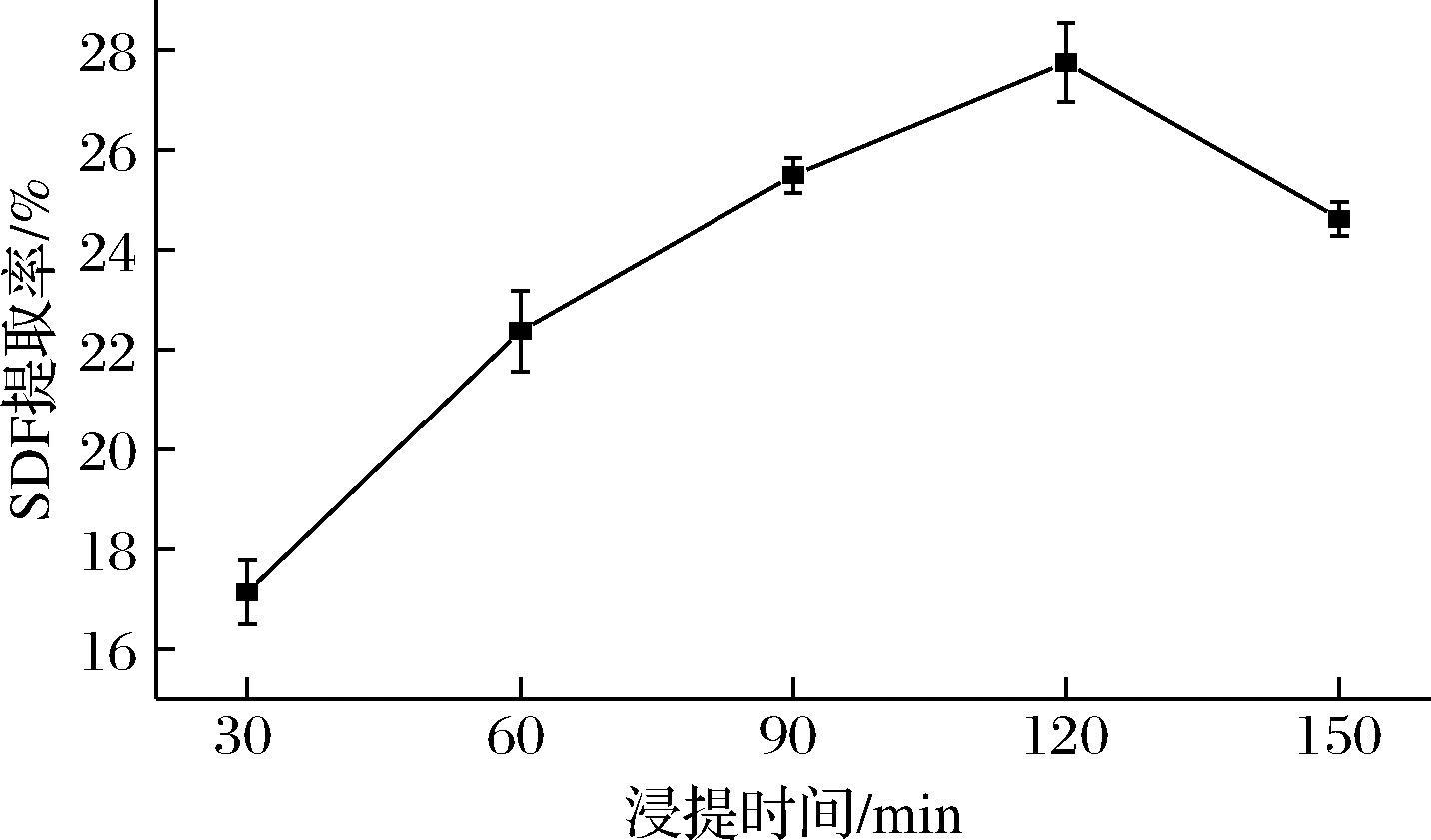
图3 浸提时间对SDF 提取率的影响
Fig.3 Effect of extraction time on extraction yield of SDF
2.2.4 NaOH质量浓度对水蜜桃渣SDF提取率的影响
由图4可知,NaOH质量浓度为2~10 g/L时,SDF提取率随着NaOH质量浓度的增加而上升,NaOH质量浓度为10 g/L时,SDF提取率达到最大值为27.01%,当NaOH质量浓度大于10 g/L,SDF提取率开始下降。NaOH质量浓度过高会导致果胶脱去果胶酯酸上的甲基后溶解,降低SDF提取率。因此NaOH质量浓度为10 g/L时,SDF提取率较佳。
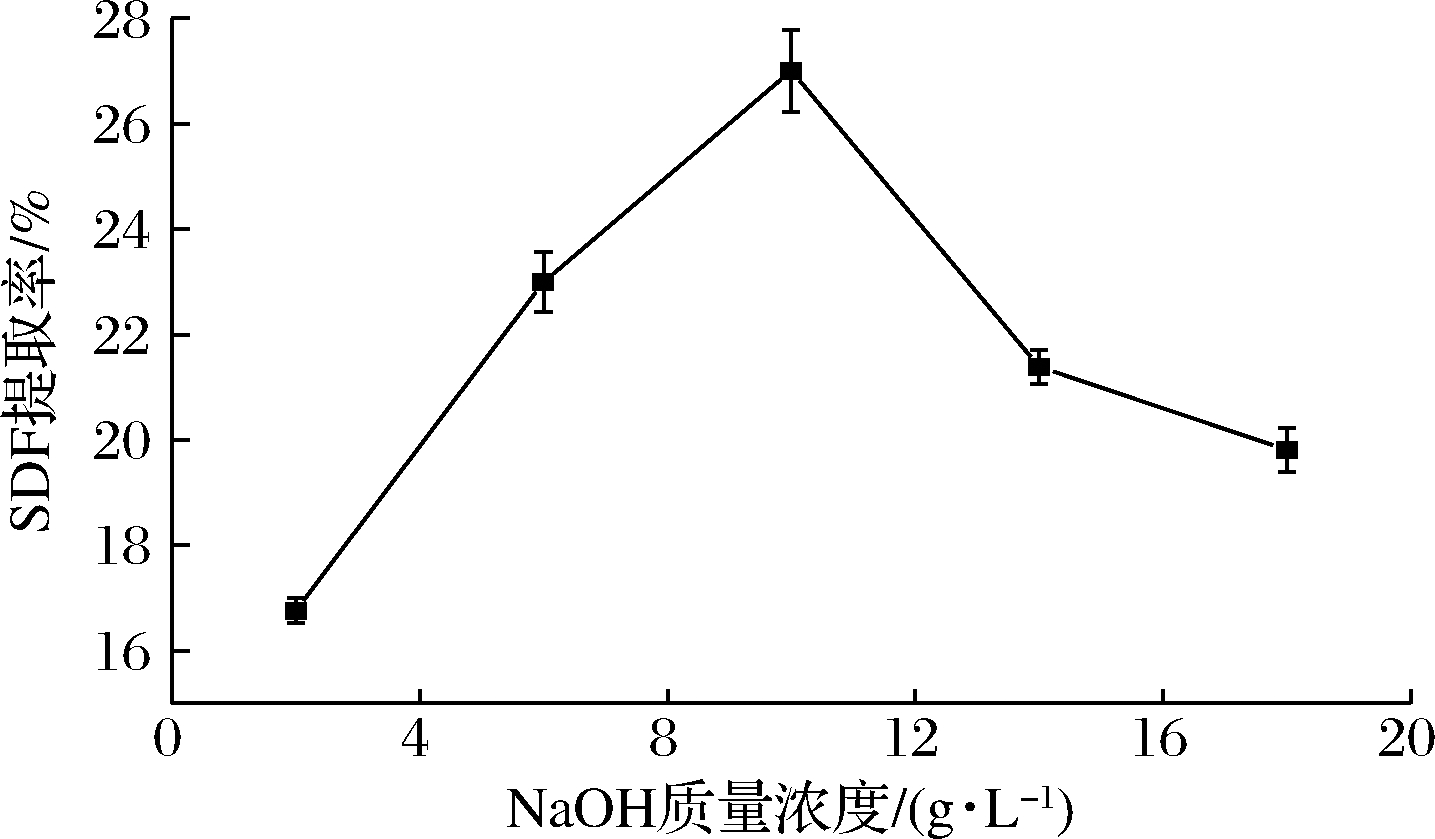
图4 NaOH质量浓度对SDF提取率的影响
Fig.4 Effect of NaOH concentration on extraction yield of SDF
2.2.5 料液比对水蜜桃渣SDF提取率的影响
由图5可知,SDF提取率会随着料液比的增大呈现先上升后下降的趋势,在料液比为1∶25(g∶mL)时提取率达到最大值28.04%。当料液比过低时,水蜜桃渣与溶剂接触面积小,SDF不易向溶剂中扩散溶出;当料液比过高时,会降低SDF浓度和浸提效果,不利于SDF提取。因此,当料液比为1∶25(g∶mL)时,SDF提取率较佳。

图5 料液比对SDF提取率的影响
Fig.5 Effect of solid-liquid ratio on extraction yield of SDF
2.3 水蜜桃渣SDF提取响应面试验
2.3.1 响应面试验设计与结果
在单因素试验基础上,通过响应面法对水蜜桃渣SDF提取工艺条件进行优化。响应面试验设计与结果见表3。
表3 响应面试验设计与结果
Table 3 Design and results of response surface experiment
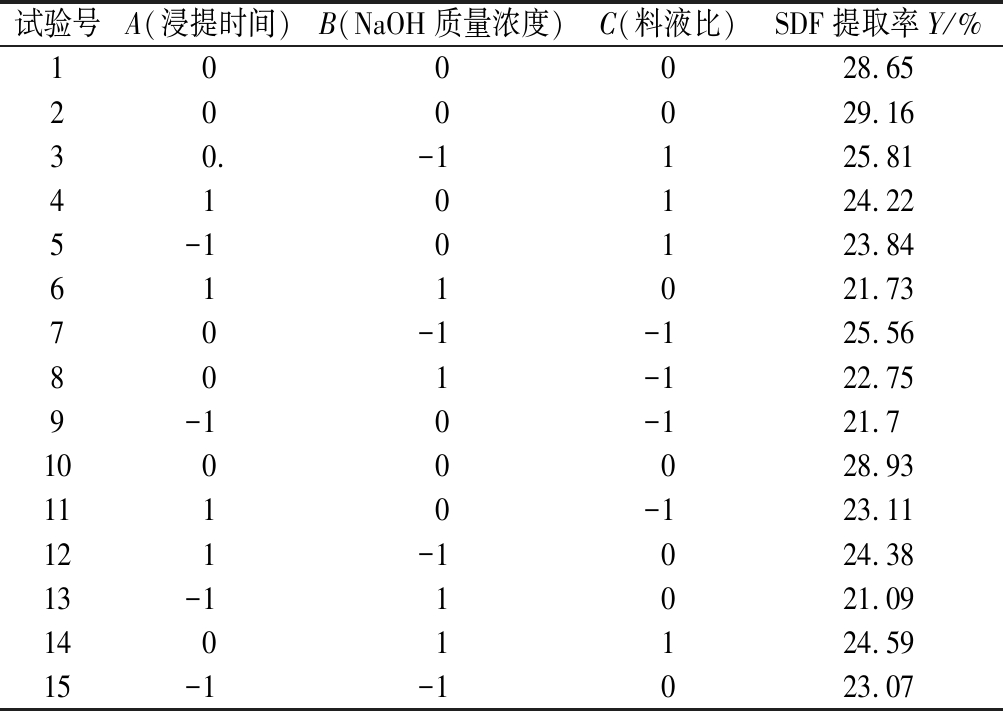
试验号A(浸提时间)B(NaOH质量浓度)C(料液比)SDF提取率Y/%100028.65200029.1630.-1125.81410124.225-10123.84611021.7370-1-125.56801-122.759-10-121.71000028.931110-123.11121-1024.3813-11021.091401124.5915-1-1023.07
2.3.2 模型方程建立与显著性检验
对表3数据利用Design-Expert 11.0.4软件进行分析,得到SDF提取率(Y)和浸提时间(A)、NaOH质量浓度(B)、料液比(C)这3个自变量的回归方程:
Y=28.91+0.47A-1.08B+0.67C-0.17AB-0.26AC+0.40BC-3.90A2-2.44B2-1.79 C2。
表4 响应面方差分析表
Table 4 Variance analysis of regression equation

来源平方和自由度均方F值P值显著性模型95.69910.63153.27<0.00 01∗∗A1.7511.7525.200.004 0∗B9.3719.37135.13<0.000 1∗∗C3.5613.5651.380.000 8∗AB0.112 210.112 21.620.259 4AC0.265 210.265 23.820.107 9BC0.632 010.632 09.110.029 5∗A256.24156.24810.74<0.000 1∗∗B222.04122.04317.63<0.000 1∗∗C211.87111.87171.09<0.000 1∗∗残差0.346 950.069 4失拟项0.216 430.072 11.110.507 2纯误差0.130 520.065 2总差96.0414R20.996 4R2Adj0.989 9
注:*表示差异显著(P<0.05);**表示差异极显著(P<0.01)
由表4可知,该回归方程模型极显著(P<0.000 1),失拟项P值不显著(P>0.05),方程模型的校正相关系数R2=0.996 4,校正绝对系数![]() 说明该模型的拟合程度较好,能较好反映各因素与SDF提取率之间的关系。其中B、A2、C2、B2的P值小于0.000 1,说明这些因素对SDF提取率影响极显著。根据F值可知,各因素对SDF提取率的影响大小依次为:NaOH质量浓度(B)>料液比(C)>浸提时间(A)。
说明该模型的拟合程度较好,能较好反映各因素与SDF提取率之间的关系。其中B、A2、C2、B2的P值小于0.000 1,说明这些因素对SDF提取率影响极显著。根据F值可知,各因素对SDF提取率的影响大小依次为:NaOH质量浓度(B)>料液比(C)>浸提时间(A)。
2.3.3 水蜜桃渣SDF提取响应面分析
图6直观地反映了浸提时间、NaOH质量浓度和料液比这3个因素交互作用对响应值的影响。随着各因素水平的增加,SDF提取率呈先上升后下降的趋势;响应面图上的曲线越陡说明该因素对响应面值的影响越大;等高线图呈椭圆形,说明各因素交互作用显著。由图6可知,NaOH质量浓度相较于浸提时间、料液比的响应曲面更陡峭,等高线更密集,表明NaOH质量浓度对SDF提取率的影响更大,这与表4方差分析表的结果一致。

a-浸提时间和NaOH质量浓度对SDF提取率影响的响应面图;b-浸提时间和NaOH质量浓度对SDF提取率影响的等高线图;c-浸提时间和料液比对SDF提取率影响的响应面图;d-浸提时间和料液比对SDF提取率影响的等高线图;e-NaOH质量浓度和料液比对SDF提取率影响的响应面图;f-NaOH质量浓度和料液比对SDF提取率影响的等高线图
图6 浸提时间、NaOH 质量浓度和料液比对SDF 提取率影响的响应面和等高线图
Fig.6 Response surface and contour plot of the effect of extraction time, NaOH concentration and solid-liquid ratio on the extraction yield of SDF
2.3.4 验证试验
通过Design-Expert 11.0.4软件分析得到水蜜桃渣SDF的最佳提取条件为浸提时间121.77 min、NaOH溶液质量浓度9.2 g/L、料液比1∶25.80(g∶mL),可得到SDF提取率的理论值为29.09%。为了进一步验证软件分析的可靠性,对优化后的参数进行3组验证试验,并考虑到试验的可行性,对提取条件稍做调整,即浸提时间120 min、NaOH溶液质量浓度9 g/L、料液比1∶25(g∶mL),可得到SDF提取率平均值为28.97%,与理论值误差仅为0.41%,因此说明响应面法优化模型能较好地预测水蜜桃渣SDF提取率,有较强的的实用价值。
2.4 水蜜桃渣SDF理化性质和结构表征
2.4.1 水化特性分析
SDF持水力和膨胀力分别为51.56 g/g和45.58 mL/g,远高于张严磊等[11]测得的碱提酸枣渣SDF的持水力0.60 g/g和膨胀力0.71 mL/g,DONG等[12]测得的酸提咖啡皮SDF的持水力5.39 g/g,以及高于彭章普等[13]测得的苹果渣碱溶性膳食纤维的持水力23.99 g/g和酸溶性膳食纤维的持水力43.42 g/g,但低于彭章普等[13]测得的苹果渣碱溶性膳食纤维的膨胀力67.42 mL/g。SDF水溶度的测定结果为96.55%,没有达到100% ,可能是由于在提取、纯化过程中混入了少许杂质。
由此可见,采用超声波辅助碱法提取的水蜜桃渣SDF 具有较高的持水力和膨胀力,说明该SDF 的水合性质较优。可能是因为碱溶液破坏了纤维内部结构增加其表面积,并且释放了大量的亲水基团羟基,以致吸附更多的水分子[14] 。纤维吸水膨胀后增加人体饱腹感,促进肠胃蠕动,起到控制肥胖和改善肠道环境的作用。
2.4.2 多糖含量及纯度
由图7可知,总糖和还原糖的葡萄糖标准曲线都具有良好的线性关系。将测得的样品吸光度值代入回归方程,可知SDF中总糖含量为(85.38±2.88)%、还原糖含量为(0.45±0.16)%,由此可得样品中的多糖含量为84.93%。如图8所示,SDF 在200 nm处附近有明显的多糖特征吸收峰,而在260、280 nm处没有明显的吸收峰,说明其核酸和蛋白质的含量较低,表明样品纯度较高。

a-总糖;b-还原糖
图7 葡萄糖标准曲线
Fig.7 The standard curve of glucose

图8 SDF紫外可见吸收光谱图
Fig.8 The UV-Vis absorption spectrum of SDF
2.4.3 扫描电子显微镜分析
图9为通过扫描电子显微镜不同倍数下(×500和×2 000)SDF的超微结构图。可观察到纤维表面有大量孔洞和褶皱,这是由于超声波的强剪切力和氢氧化钠的水解作用破坏了SDF的内部结构。这种蜂窝状的网络结构增加了SDF的表面积,使其具有良好的保水性和吸附能力[15],大大提高了SDF的功能特性。

a-×500;b-×2 000
图9 SDF扫描电子显微镜图
Fig.9 The scanning electron microscope diagram of SDF
2.4.4 SDF傅里叶变换红外光谱分析
由图10可知,该样品具有典型碳水化合物结构。3 411 cm-1附近的吸收宽峰是O—H的伸缩振动,由果胶和半纤维素产生,此处吸收峰强度较大,说明用碱法制备SDF使其链长变短,糖苷键断裂,分子间和分子内形成的氢键较多。2 933 cm-1附近是多糖甲基和亚甲基C—H的收缩振动产生的弱吸收峰,是多糖的特征吸收峰[15]。1 617 cm-1处的峰是C![]() O 的特征峰,说明样品中存在糖醛酸[16]。1 200~1 420 cm-1处的峰与C—H的变角振动有关,说明样品中可能含有木质素[17]。1 033 cm-1附近是C—O和C—C的收缩振动,主要来源于阿拉伯木聚糖和木聚糖[18]。634 cm-1附近是β型C—H的变角振动引起的[16]。1 417、1 237 cm-1处一般为低甲基果胶引起的吸收峰[19]。由此可得水蜜桃渣SDF主要成分为果胶和半纤维素,生物活性多样的果胶,具有抗肿瘤、抗氧化和预防肠胃道疾病的功能,还可作为功能型的食品添加剂,广泛应用于食品行业。
O 的特征峰,说明样品中存在糖醛酸[16]。1 200~1 420 cm-1处的峰与C—H的变角振动有关,说明样品中可能含有木质素[17]。1 033 cm-1附近是C—O和C—C的收缩振动,主要来源于阿拉伯木聚糖和木聚糖[18]。634 cm-1附近是β型C—H的变角振动引起的[16]。1 417、1 237 cm-1处一般为低甲基果胶引起的吸收峰[19]。由此可得水蜜桃渣SDF主要成分为果胶和半纤维素,生物活性多样的果胶,具有抗肿瘤、抗氧化和预防肠胃道疾病的功能,还可作为功能型的食品添加剂,广泛应用于食品行业。

图10 SDF傅里叶变换红外光谱图
Fig.10 The Fourier transform infrared spectrogram of SDF
2.4.5 SDF静态流变特性
如图11所示,在25 ℃下,表观黏度随着样品水溶液质量浓度的降低而降低,随着剪切速率的增加而急剧下降,表现出明显的剪切稀化现象,表明该样品为非牛顿流体, 具有假塑性特性[16] 。这与FENG等[20]的研究结果相似,推测是因为SDF 大分子链在低剪切速率和较高黏度时相互缠绕,而在高剪切速率下使分子骨架发生重排,微观结构相对疏松的SDF在重排过程中更易产生的小颗粒使其不能形成更细的网络,从而导致黏度降低[21] 。肠胃环境类似于低速剪切,说明SDF 在肠道中摩擦力较大,能够影响肠胃的蠕动和延缓肠道对营养物质的吸收。

图11 不同质量浓度SDF 水溶液的黏度曲线
Fig.11 The viscosity curves of SDF aqueous solution with
different mass concentrations
2.4.6 SDF总抗氧化能力
Fe3+和原力标准曲线见图12。由图13可知,水蜜桃渣SDF对Fe3+具有一定的还原能力,随着质量浓度的增加而增加。根据Fe3+还原力标准曲线y=0.443 7x-0.001 5可知,6 mg/mL SDF溶液的总抗氧化能力等同于0.32 mmol/L的FeSO4溶液,这与张启月等[22]采用酸法制备的樱桃酒渣SDF的总抗氧化能力对应0.30 mmol/L的FeSO4溶液的结果相似。通过超声波辅助碱法提取SDF 的结构疏松和分子质量小更有利于提供氢原子,样品中含有的糖醛酸也可以激发更多端基碳的氢原子,提高样品的抗氧化能力。

图12 Fe3+还原力标准曲线
Fig.12 The standard curve of Fe3+ reducing power
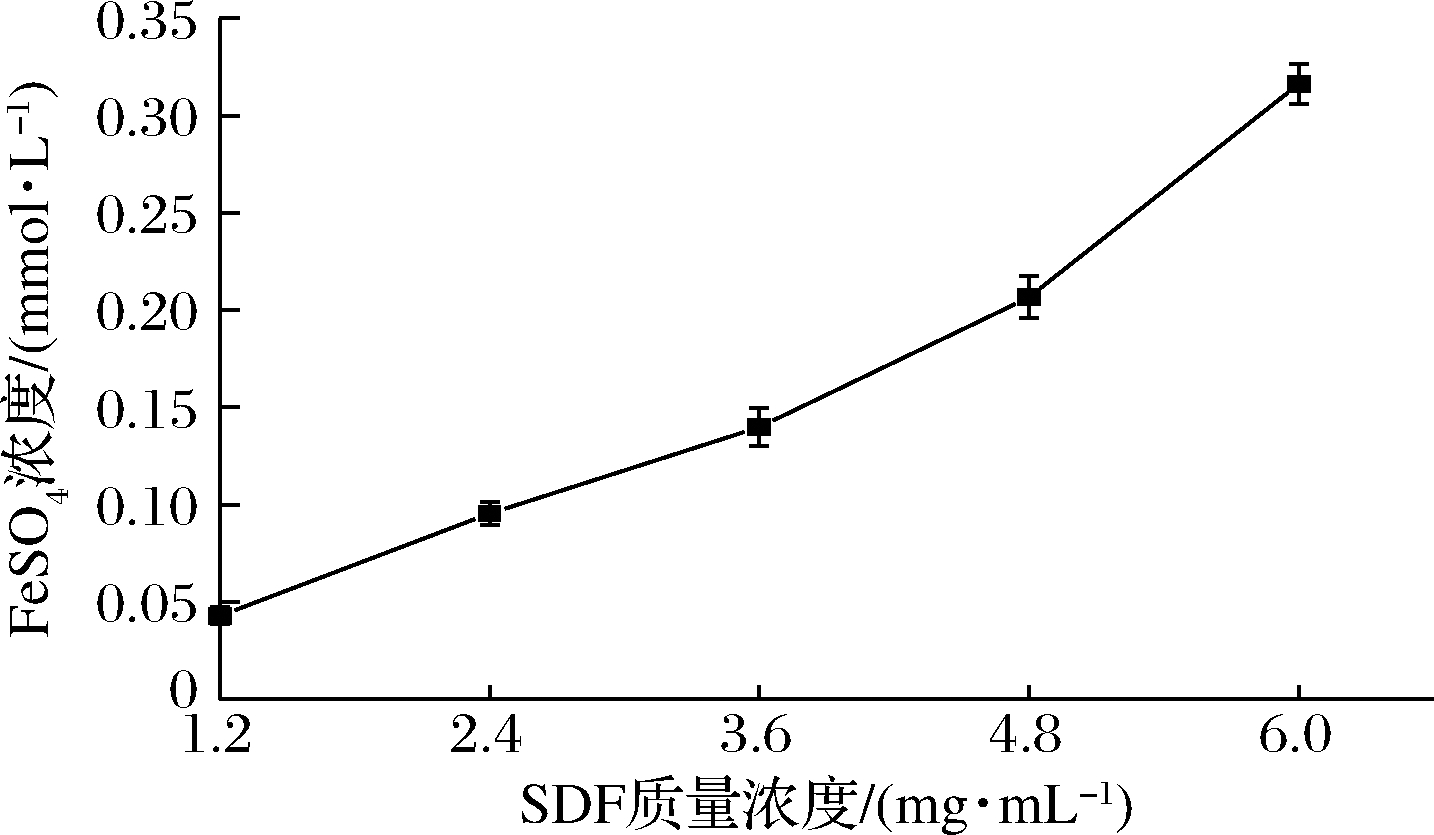
图13 SDF 水溶液对Fe3+还原力的影响
Fig.13 Effect of SDF aqueous solution on Fe3+reducing power
3 结论
采用超声波辅助碱法提取水蜜桃渣SDF,采用单因素试验和Box-Behnken试验对提取工艺进行优化,得到最佳工艺条件为:超声功率360 W、超声时间20 min、浸提温度80 ℃、浸提时间120 min、NaOH质量浓度9 g/L、料液比1∶25(g∶mL),提取率平均值可达28.97%,与理论值误差仅为0.41%,说明采用响应面法优化水蜜桃渣SDF的提取工艺参数准确可靠。
在适宜提取、纯化工艺条件下,对水蜜桃渣SDF的理化性质和结构进行了分析。得到样品的持水力为51.56 g/g、膨胀力为45.58 mL/g、水溶度为96.55%;样品的纯度较高,多糖含量为84.93%;样品为非牛顿流体,表观黏度随剪切速率的增加和样品溶液浓度的降低而下降;6 mg/mL样品溶液的总抗氧化能力等同于0.32 mmol/L的FeSO4溶液;样品表面有大量孔洞和褶皱增加了样品的表面积;样品具有典型碳水化合物结构的吸收峰,其主要成分为果胶和半纤维素,可有效地清除体内毒素,增殖有益菌。膳食纤维的理化性质决定其生理活性与功能,超声波辅助碱法提取的水蜜桃渣SDF的高持水力与高膨胀力表明其功能性较好, 具有降低血脂、预防肥胖的作用[23];SDF表面有大量孔洞,具有良好的吸附性能和一定的抗氧化能力,本研究结果可为水蜜桃渣SDF的综合利用与开发功能性食品提供理论依据。
[1] 朱菲, 郑云峰, 江凯, 等. 干型水蜜桃果酒酿造工艺研究[J].食品与发酵科技, 2019, 55(6):70-73.
ZHU F, ZHENG Y F, JIANG K, et al.Study on brewing technology of dry peach wine[J].Food and Fermentation Sciences & Technology, 2019, 55(6):70-73.
[2] CAO S F, HU Z C, ZHENG Y H, et al.Synergistic effect of heat treatment and salicylic acid on alleviating internal browning in coldstored peach fruit[J].Postharvest Biology and Technology, 2010, 58(2):93-97.
[3] YAN J K, WU L X, CAI W D, et al.Subcritical water extractionbased methods affect the physicochemical and functional properties of soluble dietary fibers from wheat bran [J].Food Chemistry, 2019, 298:124987.
[4] 牛俊乐, 麦馨允, 谭伟. 超声波辅助碱法提取蕨菜中水溶性膳食纤维[J].农产品加工, 2017(7):17-19.
NIU J L, MAI X Y, TAN W.Ultrasonic auxiliary and alkaline method to extract water soluble dietary fiber from the Pteridium aquilinum [J].Farm Products Processing, 2017(7):17-19.
[5] 杨娜, 王鸿飞, 宋佳敏, 等.超声波辅助提取裂褶菌多糖及分离纯化的研究 [J].核农学报, 2014, 28(11):2 015-2 024.
YANG N, WANG H F, SONG J M, et al.Uitrasonic assisted extraction and purification and determination of schizophyllian polysaccharose[J].Journal of Nuclear Agricultural Sciences, 2014, 28(11):2 015-2 024.
[6] XIA Q, GU M D, LIU J, et al.Novel composite gels of gelatin and soluble dietary fiber from black bean coats with interpenetrating polymer networks [J].Food Hydrocolloids, 2018, 83:72-78.
[7] WAN J, LIU C M, LIU W, et al.Optimization of instant edible films based on dietary fiber processed with dynamic high pressure microfluidization for barrier properties and water solubility [J].LWT-Food Science and Technology, 2015, 60(1):603-608.
[8] LIU J, WANG Z W, WANG Z Y, et al.Physicochemical and functional properties of soluble dietary fiber from different colored quinoa varieties (Chenopodium quinoa Willd) [J].Journal of Cereal Science, 2020, 95:103045.
[9] 张晓雪, 贾鸿震, 于长青, 等. 超声波-微波协同提取沙棘果皮渣中可溶性膳食纤维工艺优化[J].食品工业科技, 2020, 41(11):200-206;220.
ZHANG X X, JIA H Z, YU C Q, et al.Optimization of ultrasonicmicrowave synergistic extraction of soluble dietary fiber from seabuckthorn peel residue[J].Science and Technology of Food Industry, 2020, 41(11):200-206;220.
[10] 刘素稳, 郭朔, 刘畅, 等.微波辅助提取苹果渣可溶性膳食纤维[J].中国食品学报, 2010, 10(5):152-159.
LIU S W, GUO S, LIU C, et al.Extraction of soluble dietary fiber from apple pomace assisted by microwave [J].Journal of Chinese Institute of Food Science and Technology, 2010, 10(5):152-159.
[11] 张严磊, 施欢贤, 唐志书, 等.碱法同时提取酸枣渣可溶性与不溶性膳食纤维及其性能研究 [J].纤维素科学与技术, 2015, 23(4):43-48.
ZHANG Y L, SHI H X, TANG Z S, et al.Simultaneously extraction technology and properties of insoluble and soluble dietary fiber from wild jujube slag by alkali method [J].Journal of Cellulose Science and Technology, 2015, 23(4):43-48.
[12] DONG W J, WANG D D, HU R S, et al.Chemical composition, structural and functional properties of soluble dietary fiber obtained from coffee peel using different extraction methods[J].Food Research International, 2020, 136:109497.
[13] 彭章普, 龚伟中, 徐艳, 等.苹果渣可溶性膳食纤维提取工艺的研究[J].食品科技, 2007, 32(7):238-241.
PENG Z P, GONG W Z, XU Y, et al.Research of conditions for extraction of soluble dietary fiber from apple pomace[J].Food Science and Technology, 2007, 32(7):238-241.
[14] 李菁, 吴聪聪, 叶沁, 等.不同处理方法对豆渣膳食纤维结构和降血糖性质的影响[J].食品与发酵工业, 2021, 47(15):178-184.
LI J, WU C C, YE Q, et al.Effect of different treatments on structure and hypoglycemic properties of okara dietary fibers[J].Food and Fermentation Industries, 2021, 47(15):178-184.
[15] 尹立晨, 童群义.改性豆渣膳食纤维的理化性质、结构及其益生活性研究[J].食品与发酵工业, 2022, 48(3):141-148.
YIN L C, TONG Q Y.Study on the physicochemical properties, structure and prebiotic activity of modified okara dietary fiber[J].Food and Fermentation Industries, 2022, 48(3):141-148.
[16] CHEN H H, ZHAO C H, LI J, et al.Effects of extrusion on structural and physicochemical properties of soluble dietary fiber from nodes of Lotus root[J].LWT, 2018, 93:204-211.
[17] ZHANG Y, QI J R, ZENG W Q, et al.Properties of dietary fiber from Citrus obtained through alkaline hydrogen peroxide treatment and homogenization treatment [J].Food Chemistry, 2020, 311:125873.
[18] ALBA K, MACNAUGHTAN W, LAWS A P, et al.Fractionation and characterisation of dietary fibre from blackcurrant pomace [J].Food Hydrocolloids, 2018, 81:398-408.
[19] ZHONG L Z, FANG Z X, WAHLQVIST M L, et al.Extrusion cooking increases soluble dietary fibre of lupin seed coat [J].LWT, 2019, 99:547-554.
[20] FENG Z Q, DOU W, ALAXI S, et al.Modified soluble dietary fiber from black bean coats with its rheological and bile acid binding properties [J].Food Hydrocolloids, 2017, 62:94-101.
[21] MERIEM-BENZIANE M, ABDUL-WAHAB S A, BENAICHA M, et al.Investigating the rheological properties of light crude oil and the characteristics of its emulsions in order to improve pipeline flow[J].Fuel, 2012, 95:97-107.
[22] 张启月, 张士凯, 郗良卿, 等.不同提取方法对樱桃酒渣水溶性膳食纤维结构、理化与功能性质的影响[J].食品科学, 2021, 42(7):98-105.
ZHANG Q Y, ZHANG S K, XI L Q, et al.Effects of different extraction methods on the structure, physicochemical and functional properties of water-soluble dietary fiber from cherry wine dregs [J].Food Science, 2021, 42(7):98-105.
[23] FULLER S, BECK E, SALMAN H, et al.New horizons for the study of dietary fiber and health:A review[J].Plant Foods for Human Nutrition(Dordrecht, Netherlands), 2016, 71(1):1-12.