果胶具有良好的凝胶、增稠、吸附、乳化、稳定等功能,已用于食药、纺织、化工等众多领域[1]。植物果胶主要由α-D-(1,4)-半乳糖醛酸重复片段组成的平滑区和带有大量中性糖侧链的α-D-(1,4)-半乳糖醛酸和α-L-(1,2)-鼠李糖交替连接的毛发区组成,主要有3种结构域:均聚半乳糖醛酸、I-型聚鼠李糖半乳糖醛酸和Ⅱ-型聚鼠李糖半乳糖醛酸[2-4]。果胶的结构及其相应功能随着物种、生长环境、提取工艺等不同而有一定差别。目前天然植物果胶在抗癌、抗氧化等方面的功能已得到关注[2,4],但主要集中在柑橘和苹果果胶上。我国每年消耗果胶约5 000 t,但80%依赖进口,因此,发掘新的果胶资源是一个极具潜力的研究方向。
三叶木通(Akebia trifoliate koiaz)属于木通属落叶木质藤本植物,因其八九月份果实成熟,沿腹线自然开裂,故称“八月瓜”、“八月炸”、“爆肚拿”[5]。其果实呈长圆形,直或腰果状,个大饱满,果皮颜色因生长气候和地理位置而不同,多呈棕褐色、紫褐色或棕黄色,果肉乳白,浆汁甘甜,具有较高的营养价值和药用价值[5]。现代药理学研究证明,三叶木通富含黄酮、果酸、皂苷、多酚、萜类等活性成分,有保肝防癌、清热利尿,活血通络、生津止渴、抑菌美白之功效[6-7]。三叶木通广泛分布于我国黄河流域以南等省份,仅在贵州省野生三叶木通面积高达数万公顷。由于其极高的营养药用价值,人工栽培三叶木通已在贵州、陕西、四川、河南等省份规模化种植,每公顷产量为100~135 kg,最高每公顷达165 kg,产生了较高的社会经济效益。三叶木通厚重果皮占到果实总重量的50%以上,通常在食用果肉后将其丢弃。随着大规模的种植和推广,如果三叶木通果皮不加以开发利用,不仅造成资源的浪费,而且将对环境造成一定破坏。三叶木通果皮中果胶含量丰富,但有关三叶木通果胶的提取及药用功能研究鲜见报道。
本研究以三叶木通果皮为材料,采用酸提醇沉法对来自地理环境不同、气候差异的贵州凯里和河南南阳一带的三叶木通果胶进行提取并比较其理化性质和功能活性,以期为三叶木通资源的开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
三叶木通果实采自贵州凯里和河南南阳山区一带。用去离子水清洗三叶木通果实2~3遍,晾干水分后取其果皮,先置于45 ℃温水中浸泡20 min,去除可溶性的糖、色素及苦味素等成分,然后放入沸水中蒸煮10 min后再用去离子水淋洗2遍,纱布包好拧出水分,烘干箱内50 ℃烘干,粉碎,过20目筛,4 ℃保存备用。
人肺癌细胞株(A549)和人髓系慢性白血病细胞株(K562-2)由贵州大学生物实验室提供。
咔唑、D-半乳糖醛酸等单糖标准样品、焦性没食子酸,上海麦克林生化科技有限公司;牛血清蛋白(BR),国药集团化学试剂有限公司;考马斯亮蓝G-250,福州文莱生物科技有限公司;DPPH,思域化工有限公司;RPMI-1640培养基,北京钮因华信科技发展有限公司;四甲基偶氮唑蓝(methyl thiazolyl terazolium,MTT)、二甲基亚砜(BR)、优级胎牛血清、青霉素、链霉素混合液,北京索莱宝科技公司;胰蛋白酶,美国Sigma 公司。其他试剂均为分析纯。
1.2 仪器与设备
PHS-25酸度计、721G可见分光光度计,上海仪电分析仪器股份有限公司;傅立叶红外光谱仪,日本Shimadzu公司;LGJ-30S真空冷冻干燥箱,北京松源华兴科技发展有限公司;Spectra Mr型全波长酶标仪,美国Dynex公司;倒置显微镜,德国Leica公司;ICS-3000型高效液相离子交换色谱仪(配有脉冲安培检测器),美国DIONEX公司。
1.3 实验方法
果胶制备:三叶木通果皮干燥粉末20.00 g和酸水溶液(pH=2.00,亚硫酸调节)按1∶20(g∶mL)进行料液配比,90 ℃恒温浸提120 min,6层纱布过滤,滤渣重复提取1次,合并2次滤液,再在4 000 r/min下离心15 min,以除掉多余的淀粉、纤维素等不溶物,用水浴锅浓缩上清液至原体积的1/3,加入约1.5倍无水乙醇,冷却至常温后置于冰箱内4 ℃静置4 h后抽滤,滤出的果胶用60%(体积分数)乙醇反复洗涤2~3次,真空冷冻干燥48 h[8]。用上述方法分别获得贵州凯里果胶(PAG)和河南南阳果胶(PAH)制品。
果胶鉴定和干燥失重:采用国标GB 2553—2010对PAG和PAH三叶木通果胶进行鉴定和干燥失重测定。
果胶半乳糖醛酸含量:配制1.0 g/L半乳糖醛酸溶液,配制成7个不同质量浓度的系列标准溶液,分别加入12 mL浓H2SO4,冰浴,边冷却边加入半乳糖醛酸系列标准溶液各2 mL,沸水加热10 min,冷却至室温再加入1 mL 0.15%咔唑溶液,摇匀室温静置30 min,以蒸馏水作空白参比,530 nm波长下测定吸光度,以半乳糖醛酸浓度为横坐标,吸光度为纵坐标绘制标准曲线[9]。同法显色三叶木通果皮果胶溶液并测定其吸光度,计算其半乳糖醛酸的含量。
果胶酯化度(degree of esterification,DE)的评价:用少量无水乙醇润湿0.050 0 g果胶样品,再用100 mL去离子水溶解,滴加2~3滴酚酞指示剂,碱性标准溶液(0.1 mol/L NaOH)滴定至粉红色且30 s内不褪色,记录使用的NaOH体积(V1);加入20 mL 0.5 mol/L NaOH溶液,混匀静置15 min后加入20 mL标准酸性溶液(0.5 mol/L HCl)至粉红色消失,再滴加2~3滴酚酞指示剂,用上述碱性溶液滴定至浅粉红色即为终点,记录第2次用去的NaOH体积(V2)[10]。果胶DE计算如公式(1)所示:
(1)
果胶溶解度:采用酸化法测定果胶溶解度[10]。
果胶灰分含量、pH值和果胶酸不溶灰分含量:均采用轻工标准QBT 2484—2000《食品添加剂—果胶》进行测定。
多酚含量:用Folin-Ciocalten法制作没食子酸标准曲线[11]。果胶样液同法显色,由标准曲线计算果胶样品中多酚含量。
蛋白质含量:采用考马斯亮蓝标准曲线法测定果胶中蛋白质含量[12]。
三叶木通果胶中性糖组成测定:水解0.01 g三叶木通果胶样品,少量乙醇浸润后再加入2 mL去离子水溶解果胶;加入2 mL 8% H2SO4溶液,121 ℃ 60 min使其充分反应;冷却后加入0.16 mL 50% NaOH中和,稀释100倍,采用DINOXICS-3000型高效液相离子交换色谱仪进行定量分析(Dione Car- boPac PA20色谱柱和脉冲安培检测器)。色谱条件:柱温30 ℃,进样量10 μL,葡萄糖、半乳糖及阿拉伯糖的流动相均为0.2 mol/L NaOH,流速0.2 mL/min;鼠李糖和半乳糖醛酸的流动相为0.2 mol/L NaOH和0.5 mol/L CH3COONa,流速0.3 mL/min[13]。
羟自由基(·OH)清除能力:采用文献[14]的方法测定,510 nm处测定吸光度。
DPPH自由基清除能力:采用文献[14]的方法测定,517 nm处测定吸光度。
体外抗肿瘤活性:用MTT法测定三叶木通果胶对人肺癌细胞(A549)和人慢性髓系白血病细胞(K562-2)增殖的抑制率[15]。
1.3 数据统计分析
采用IBM SPSS Statistics 24及Origin Pro8进行数据分析处理和绘制图表,3次重复。
2 结果与分析
2.1 果胶鉴别
果胶的鉴别见图1。
上述提取冷却后两类果胶均形成黏稠状的液体(图1-A、图1-B),加入NaOH静止后出现了凝胶沉淀(图1-C、图1-D),说明提取的两产地三叶木通果胶均符合果胶的表观特征。PAG明显比PAH的成色好,这可能与三叶木通的品种、果皮的颜色及生长环境有关。

图1 三叶木通果胶鉴别图
Fig.1 Identification of pectin in Akebia trifoliata peels
注:A和B分别为提取冷却的贵州凯里和河南南阳三叶木通果胶;C和D分别为加入NaOH的贵州凯里和河南南阳三叶木通果胶
2.2 三叶木通果胶理化特性
由表1可知,2种产地果胶的干燥失重、灰分、酸不溶灰分、溶解度、pH等均符合国家食品安全果胶标准,且均为高酯果胶;果胶PAG半乳糖醛酸的含量(72.08%)和酯化度(89.50%)均低于果胶PAH半乳糖醛酸的含量(77.93%)和酯化度(91.60%);2种果胶的溶解度均大于80%。
表1 三叶木通果皮果胶理化性质指标测定
Table 1 Physical and chemical indexes of pectin in the Akebia trifoliata peels

指标GB25533—2010QB2484—2000PAGPAH干燥失重/%≤12≤810.3010.12灰分/%-≤52.973.31酸不溶灰分/%≤1≤10.910.95半乳糖醛酸含量/%≥65≥6572.0877.93溶解度/%--84.7582.02--84.7582.02pH-2.6~3.0(高酯)4.5~5.0(低酯)2.853.0酯化度/%--89.591.6
注:-表示无数据
2.3 果胶糖基成分分析
由表2可知,两产地三叶木通果胶的主要组成成分是酸性半乳糖醛酸基,中性糖主要包括葡萄糖基、半乳糖基、木糖基、鼠李糖基和阿拉伯糖等组成。其中PAG和PAH中酸性半乳糖醛酸的比例分别为65.10%和69.52%。这与表1中采用的显色法测定数值趋势一致,但有一定的差异,这可能是由于测定方法的不同所造成。PAG和PAH中的中性糖基总质量分数分别为16.76%和15.46%。
表2 三叶木通果皮果胶的糖基组成 单位:%
Table 2 Glycosyl components of pectin in the Akebia trifoliata peels
果胶名称半乳糖醛酸基葡萄糖基半乳糖基鼠李糖基阿拉伯糖基木糖基PAG65.10±2.039.60±0.184.12±0.051.98±0.090.75±0.010.31±0.02PAH69.52±1.938.82±0.203.97±0.111.84±0.050.62±0.040.21±0.04
2.4 三叶木通果皮果胶的红外光谱分析
三叶木通果胶的红外光谱图见图2。在3 353 cm-1左右的峰与O—H 的振动有关,表明果胶的结构中存在羟基,2 926 cm-1的峰可归因于C—H 的不对称拉伸振动[16] ;1 725 cm-1和1 622 cm-1的峰是由于C![]() O的拉伸振动[17] 。1 099 cm-1处的峰应归于C—O 键的弯曲振动[18-19] 。此外,1 000 cm-1左右的吸收峰对应芳香族和脂肪族C—H 基团的振动[19] 。与标准品果胶的红外光谱图比对后发现,本研究提取两地果胶图谱基本相似,且三叶木通果胶在1 725 cm-1吸收峰强度明显高于1 622 cm-1处,结合所测定的半乳糖醛酸的含量及pH 值,再次表明提取的果胶为高酯果胶。
O的拉伸振动[17] 。1 099 cm-1处的峰应归于C—O 键的弯曲振动[18-19] 。此外,1 000 cm-1左右的吸收峰对应芳香族和脂肪族C—H 基团的振动[19] 。与标准品果胶的红外光谱图比对后发现,本研究提取两地果胶图谱基本相似,且三叶木通果胶在1 725 cm-1吸收峰强度明显高于1 622 cm-1处,结合所测定的半乳糖醛酸的含量及pH 值,再次表明提取的果胶为高酯果胶。

图2 果胶PAG的红外光谱图
Fig.2 Infrared spectrum of pectin
2.5 蛋白质和多酚含量
由于提取果胶采用的是酸提醇沉法,部分溶于酸的物质(蛋白质和多酚等)可能会被提取出来,故对两物质的含量进行检测。由图3可知,两产地果胶中蛋白质和多酚的含量均较低。PAG中蛋白质的含量为2.3 mg/g,PAH中蛋白质的含量为2.56 mg/g,且二者差异不显著(P<0.05);PAG中多酚含量(6.15 mg/g)高于PAH中多酚的含量(3.83 mg/g),差异显著(P<0.05)。该研究结果说明果胶的抗氧化活性主要由果胶多糖引起。

图3 PAG和PAH三叶木通果胶中蛋白质及多酚的含量
Fig.3 Contents of proteins and polyphenols in PAG and PAH
注:柱上不同的小写字母分别代表两产地果胶中蛋白质及多酚的含量存在显著性差异(P<0.05)
2.6 三叶木通果胶对·OH清除能力
由图4可知,2个产地三叶木通果胶对·OH的清除能力虽不及维生素C,但均具有一定的清除作用。当质量浓度<0.5 mg/mL时,PAG和PAH果胶清除·OH 能力差异较小;当果胶质量浓度≥0.5 mg/mL时,PAH清除·OH能力显著高于PAG;当果胶液质量浓度≥3 mg/mL时,PAG清除·OH能力(44.7%)仅为PAH清除·OH能力(75.4%)的60%,说明来源不同的三叶木通果胶其抗氧化能力不同。SPSS 24.0软件Probit线性回归分析果胶PAG的IC50的值为3.3 mg/mL,PAH的IC50为1.72 mg/mL。

图4 果胶PAG、PAH对·OH的清除作用
Fig.4 Scavenging effect of PAG and PAH on hydroxyl radical
2.7 三叶木通果皮果胶对DPPH自由基的清除活性
DPPH是一种紫色溶液,其在517 nm处有特征吸收,当它获得氢后,其溶液的颜色会随着供氢体浓度的变化而逐渐变成黄色,吸光值也随之改变。由图5可知,当果胶液质量浓度大于0.2 mg/mL后,PAH清除DPPH自由基等能力远高于PAG,当果胶液的质量浓度达到1 mg/mL时,果胶PAH对DPPH自由基清除率(90.5%)为PAG对DPPH自由基清除率(10.4%)的9倍,几乎和维生素C对DPPH自由基清除率(95.6%)相当。SPSS 24.0软件Probit线性回归分析PAG的IC50值为3.55 mg/mL,PAH的IC50值为0.545 mg/mL。
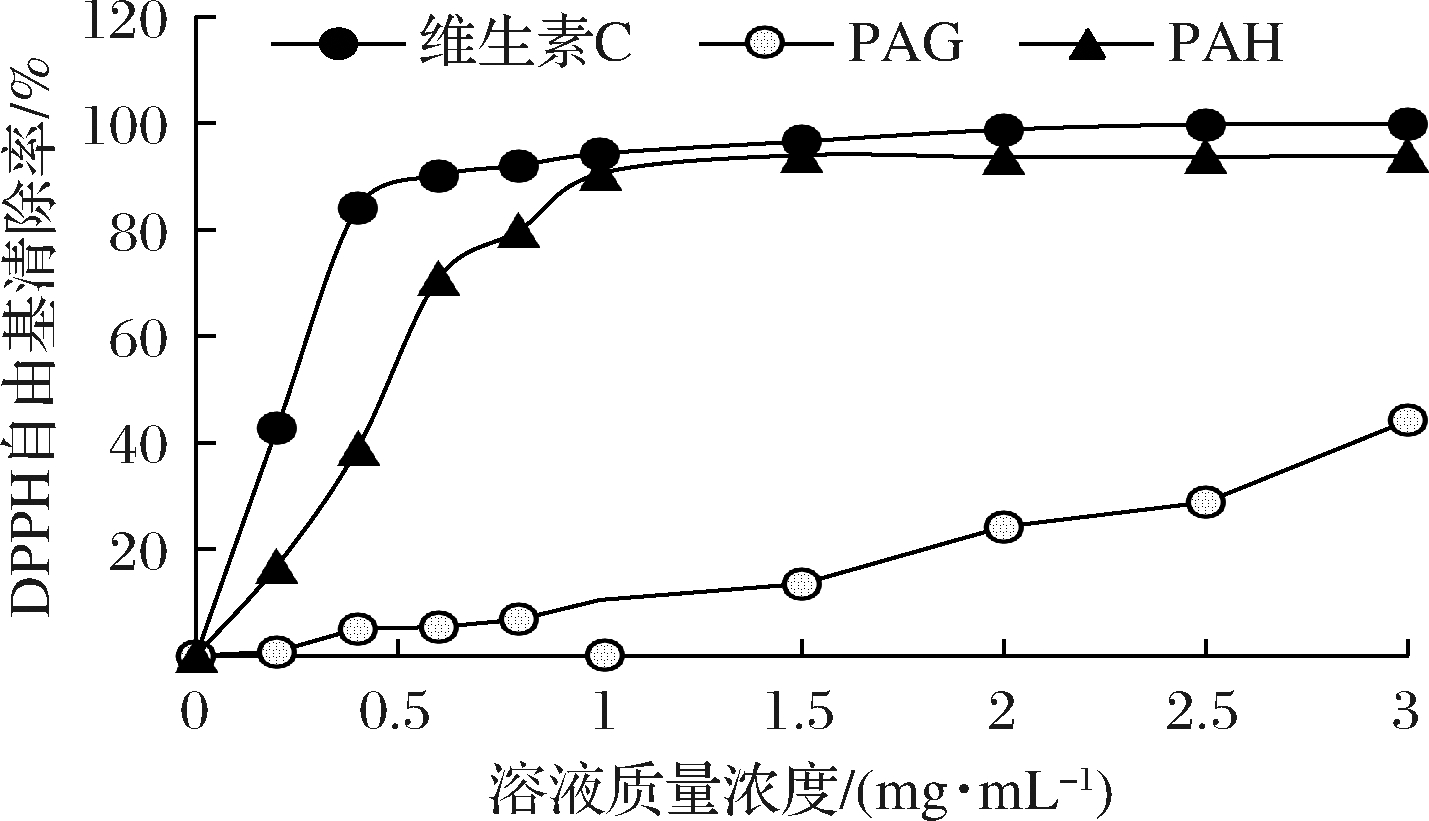
图5 PAG和PAH果胶对DPPH自由基的清除作用
Fig.5 Scavenging effect of PAG and PAH on DPPH radical
2.8 三叶木通果皮果胶体外抗癌活性
PAG和PAH果胶均对癌细胞A549及K562-2增殖具有一定的抑制作用(图6),果胶PAG对A549抑制率[(13.55±2.39)%]和对K562-2抑制率[(11.41±1.94)%]均高于果胶PAH对A549的抑制率[(11.29±3.57)%]及K562-2的抑制率[(9.70±2.23)%],差异性均不显著(P> 0.05);两产地果胶对A549的抑制作用均比K562-2略强。该研究结果初步说明三叶木通果胶在防治肺癌和髓系白血病等疾病方面具有一定的开发利用价值。已有文献表明,柑橘果胶降解后其产物的抗癌活性较降解前大副提高[20],故将三叶木通果胶进行降解改性以提高其抗癌活性将是后续要研究的重点。

图6 PAG和PAH果胶对癌细胞A549和K562-2增殖的抑制作用
Fig.6 Inhibitory effect of PAG and PAH on proliferation of cancer cells A549 and K562-2V
注:不同小写字母分别代表两产地果胶及吉非替尼对人肺癌细胞A549
和人慢性髓系白血病细胞K562-2的抑制作用存在显著差异(P<0.05)
3 结论
本研究选取南北气候差异较大的贵州凯里和河南南阳一带的三叶木通为原料,对两产地三叶木通果胶的理化性质、抗氧化能力进行测定评价,并初步探究两产地果胶对癌细胞A549和K562-2的抑制作用,以期为三叶木通这种新型水果寻找更多的开发利用价值。研究结果表明,酸提醇沉法制取的两产地果胶均为高酯果胶,其半乳糖醛酸含量、酯化度、pH等理化指标均符合果胶食品安全标准。灰分主要由一些金属氧化物及其盐类组成,过高的灰分能影响其品质,降低胶凝度和溶解度,色泽变差,故它是国家食品安全果胶标准的重要指标之一。本研究提取的三叶木通果胶灰分含量(≤3.31%)符合国家安全标准(≤5%),故其灰分可能不对提取果胶的理化特性产生显著影响。
提取果胶时,其提取溶剂的pH越低,越容易造成果胶脱酯并使半乳糖醛酸含量增加酯化度降低,同时果胶产率下降。本研究中的河南三叶木通果胶的酯化度(91.6%)高于石兵艳等[10]研究的陕西八月瓜果胶酯化度(82.84%),其原因可能是提取河南三叶木通果胶时溶剂pH值(pH=2)高于后者提取溶剂的pH值(pH=1.5),同时也造成了三叶木通果胶半乳糖醛酸含量(≥72.08%)低于后者提取的八月瓜果胶半乳糖醛酸含量(81.35%)。
两产地果胶对·OH和DPPH自由基均具有一定的清除能力,且与浓度成量效关系。在相同的果胶溶液浓度下,PAH(河南三叶木通果胶)清除DPPH自由基及·OH的能力均显著高于PAG(贵州产地三叶木通果胶);当溶液的质量浓度为4 mg/mL时,PAH对·OH的清除率(76.2%)高于马丽苹等[14]研究的商品苹果果胶(清除率为71.0%)。清除·OH的机制主要表现在抑制·OH的产生和清除反应产生的·OH两方面。多糖中的羧基可络合金属离子如Fe2+与Cu2+从而抑制金属离子与H2O2反应生成·OH,另一方面多糖中羟基和羧基能提供氢供体与·OH作用从而清除·OH。因此半乳糖醛酸含量高的三叶木通果胶清除·OH的能力更强。这与VENZON等[21]研究的甜橙果胶相似。同时研究结果还显示,PAH对DPPH自由基的清除率(93.9%)是姜美云等[22]研究的商品柑橘果胶(清除率<15%)的6倍和马丽苹等[14]研究商品苹果果胶(清除率<65%)的1.5倍。这可能由于该产地三叶木通果胶中半乳糖醛酸含量较高,其羧基更容易解离,使DPPH自由基更易还原成DPPH-H,从而对DPPH自由基的清除能力更强。
果胶的生物活性不仅与其半乳糖醛酸的含量有关,也与酯化度的大小有关。SALMAN等[23]研究了不同酯化度的柑橘果胶对炎症细胞因子产生的影响,结果显示高酯果胶能显著减少IL-1β的产生,抗炎效果更佳。本研究提取的三叶木通果胶其半乳糖醛酸含量、酯化度均高于商品柑橘果胶和商品苹果果胶,表明三叶木通果皮果胶在医药及保健方面具有更好地开发潜力。
MTT研究结果表明,2种产地三叶木通果胶的抗癌活性虽不及光谱抗癌药吉非替尼,但均对癌细胞A549和K562-2有较好的抑制作用,其中果胶PAG对2种实验癌细胞的抑制作用略强。在崇尚绿色、回归自然、倡导环保健康的今天,本研究从河南和贵州两产地的野生三叶木通果皮中提取出了高质量果胶并进行了理化特性研究,发现它们具有较好的抗氧化活性和抗癌能力,这为三叶木通资源的开发利用提供了理论依据。
[1] TAN H D, CHEN W, LIU Q S, et al.Pectin oligosaccharides ameliorate colon cancer by regulating oxidative stress- and inflammation- activated signaling pathways[J].Frontiers in Immunology, 2018, 9:1504.
[2] VORAGEN A G J, COENEN G J, VERHOEF R P, et al.Pectin, a versatile polysaccharide present in plant cell walls[J].Structural Chemistry, 2009, 20(2):263-275.
[3] KOUBALA B B, CHRISTIAENS S, KANSCI G, et al.Isolation and structural characterisation of papaya peel pectin[J].Food Research International, 2014, 55:215-221.
[4] 张英, 段双艳, 刘洋, 等.苹果皮果胶多糖的理化性质以及抑制人结肠癌细胞HT-29增殖活性的初步研究[J].食品与发酵工业, 2013, 39(8):26-31.
ZHANG Y, DUAN S Y, LIU Y, et al.Study on physicochemical properties of apple peel polysaccharides and its inhibitory activities against HT-29 cells in vitro [J].Food and Fermentation Industries, 2013, 39(8):26-31.
[5] 中国科学院中国植物志编辑委员会.中国植物志[M].北京:科学出版社, 2001:4-9.
Editorial Committee of Flora of China, Chinese Academy of Sciences.Flora of China[M].Beijing:Science Press, 2001:4-9.
[6] WANG X Y, YU N X, PENG H L, et al.The profiling of bioactives in Akebia trifoliata pericarp and metabolites, bioavailability and in vivo anti-inflammatory activities in DSS-induced colitis mice[J].Food & Function, 2019, 10(7):3 977-3 991.
[7] 罗宗洪, 蔡圣宝, 易俊洁.八月瓜的化学组成、抗氧化性及α-葡萄糖苷酶活性抑制研究[J].食品与发酵工业, 2020, 46(1):130-135.
LUO Z H, CAI S B, YI J J.Phytochemical composition, antioxidant activity and α-glucosidase inhibitory ability of Akebia trifoliata[J].Food and Fermentation Industries, 2020, 46(1):130-135.
[8] 张孟琴, 孔繁伦, 田爱琴, 等.三叶木通果皮果胶沉析条件的研究[J].食品工业科技, 2007, 28(12):79-81;84.
ZHANG M Q, KONG F L, TIAN A Q, et al.Study on the precipita- tion conditions of pectin from the pericarp of Akebia trifoliata[J].Science and Technology of Food Industry, 2007, 28(12):79-81;84..
[9] YEOH S, SHI J, LANGRISH T A G.Comparisons between different techniques for water-based extraction of pectin from orange peels[J].Desalination, 2008, 218(1-3):229-237.
[10] 石兵艳, 赵飞, 王芸, 等.八月瓜果胶的性能测试研究[J].陕西科技大学学报, 2019, 37(3):39-46.
SHI B Y, ZHAO F, WANG Y, et al.A study on the performance test of Akebia trifoliata pectin[J].Journal of Shaanxi University of Science & Technology, 2019, 37(3):39-46.
[11] ZOU Y P, CHANG S K C, GU Y, et al.Antioxidant activity and phenolic compositions of lentil(Lens culinaris var.Morton)extract and its fractions[J].Journal of Agricultural and Food Chemistry, 2011, 59(6):2 268-2 276.
[12] 晋睿冲.豆腐柴叶中果胶提取、理化性质表征及生物活性初步研究[D].郑州:郑州大学, 2018.
JIN R C.Extraction, physicochemical properties, characterization and biological activity of pectin from Premna microphylla Turcz leaves[D].Zhengzhou:Zhengzhou University, 2018.
[13] FISCHER M, ARRIGONI E, AMAD R.Changes in the pectic substances of apples during development and postharvest ripening.Part 2:Analysis of the pecticfractions[J].Carbohydrate Polymers, 1994, 25(3):161-166.
R.Changes in the pectic substances of apples during development and postharvest ripening.Part 2:Analysis of the pecticfractions[J].Carbohydrate Polymers, 1994, 25(3):161-166.
[14] 马丽苹, 焦昆鹏, 罗磊, 等.改性苹果果胶性质及抗氧化活性[J].食品科学, 2017, 38(23):121-128.
MA L P, JIAO K P, LUO L, et al.Characterization and antioxidant activity of modified apple pectin[J].Food Science, 2017, 38(23):121-128.
[15] ILAGHI M, SHARIFI I, SHARIFIFAR F, et al.The potential role and apoptotic profile of three medicinal plant extracts on Leishmania tropica by MTT assay, macrophage model and flow cytometry analysis[J].Parasite Epidemiology and Control, 2021, 12: e00201.
[16] CUI J, GU X, WANG F J, et al.Purification and structural characterization of an α-glucosidase inhibitory polysaccharide from apricot (Armeniaca sibirica L.Lam.) pulp[J].Carbohydrate Polymers, 2015, 121:309-314.
[17] GRASSINO A N, BRNCIC M, VIKIC-TOPIC D, et al.Ultrasound assisted extraction and characterization of pectin from tomato waste[J].Food Chemistry, 2016, 198:93-100.
[18] ZHANG M Q, GUO L, ZHU M Y, et al.Akebia trifoliate koiaz peels extract as environmentally benign corrosion inhibitor for mild steel in HCl solutions:Integrated experimental and theoretical investigations[J].Journal of Industrial and Engineering Chemistry, 2021, 101:227-236.
[19] XU Y F, SONG S, WEI Y X, et al.Sulfated modification of the polysaccharide from Sphallerocarpus gracilis and its antioxidant activities[J].International Journal of Biological Macromolecules, 2016, 87:180-190.
[20] EINHORN-STOLL U, KASTNER H, HECHT T, et al.Modification and physico-chemical properties of citrus pectin-influence of enzymatic and acidic demethoxylation[J].Food Hydrocolloids, 2015, 51:338-345.
[21] VENZON S S, CANTERI M H G, GRANATO D, et al.Physicochemical properties of modified citrus pectins extracted from orange pomace[J].Journal of Food Science and Technology, 2015, 52(7):4 102-4 112.
[22] 姜美云, 唐硕, 王婷, 等.果胶多糖水热法降解及其产物体外抗氧化性评价[J].食品科学, 2019, 40(12):253-259.
JIANG M Y, TANG S, WANG T, et al.Degradation of pectic polysaccharide by hydrothermal treatment and antioxidant activity in vitro of the resulting products[J].Food Science, 2019, 40(12):253-259.
[23] SALMAN H, BERGMAN M, DJALDETTI M, et al.Citrus pectin affects cytokine production by human peripheral blood mononuclear cells[J].Biomedicine & Pharmacotherapy, 2008, 62(9):579-582.