胞外多糖(exopolysaccharides,EPS)是微生物在生长代谢过程中分泌到细胞壁外的一类化合物。根据其组成可分为两类,即仅由一种单糖组成的同多糖(homopolysaccharides,HoPS)和由2种或更多单糖组成的异多糖(heteropolysaccharides, HePS)。益生菌产生的EPS可通过参与物理屏障(也称“生物膜”)的形成,对细菌提供保护,帮助其克服肠胃道极端环境,从而增强在肠道内的生存能力。此外,EPS还具有抗氧化、抗癌、降胆固醇、抗炎和免疫调节等益生功能[1]。在各种产生EPS的微生物中,双歧杆菌属(Bifidobacterium)特定物种与乳杆菌一起被用于配制益生菌制品。双歧杆菌是人类肠道中最主要的早期定植细菌之一,被证明具有抗肿瘤、调节血糖、降血脂、增强免疫、改善认知障碍、调节肠胃道等益生功能[2]。研究表明,双歧杆菌分泌的EPS可能是双歧杆菌发挥益生功能的主要分子机制之一[3]。
双歧杆菌EPS的抗氧化能力和抑菌活性得到国内外许多专家研究和关注。XU等[4]发现从人粪便分离的B.animalis RH产生的EPS具有较强的DPPH自由基、羟自由基和超氧阴离子自由基清除活性,同时也可以增加小鼠血清中的超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase, CAT)和总抗氧化物的活性。谢莹等[5]研究发现,双歧杆菌BB12的EPS具有较强的还原力,并且DPPH自由基和超氧阴离子自由基的IC50均低于维生素C。WU等[6]发现,B.longum BCRC14634分泌的EPS对7种食品腐败菌和侵染菌均有抗菌活性。体内实验表明,通过喂养B.bifidum WBIN03产生的EPS能显著抑制Enterobacteria、Enterococci和Bacaeroides fragilis的生长,并且降低了小鼠肠道肠杆菌群的多样性[7]。
双歧杆菌分泌的EPS不仅具有良好的生物活性,还具有特殊的化学性能。双歧杆菌EPS在水溶液中具有良好的流变特性和增稠性,刘丽莎等[8]发现添加3%动物双歧杆菌EPS能显著提高酸豆乳的黏度、持水性和质构特性。在LI等[9]的研究中,理化分析表明EPS在0~220 ℃具有良好的热稳定性,可用于热加工食品。
本研究以百岁老人肠道中分离的5株双歧杆菌为研究对象,分离提取EPS,测定其产量并分析其化学组成、抗氧化活性和抑菌能力,采用傅里叶中远变换红外光谱、扫描电子显微镜(scanning electron microscope,SEM)、食品流变仪和差示扫描量热仪(differential scanning calorimetry,DSC)测定EPS的表观结构、耐热性和流变性,以期为后续EPS的功能特性研究和开发益生菌胞外多糖产品提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
假小链双歧杆菌BP-1(B. pseudocatenulatum BP-1)、长双歧杆菌BL-3(B.longum BL-3)、动物双歧杆菌BA-5(B.animalis subsp.lactis BA-5)、动物双歧杆菌BA-6(B.animalis subsp.lactis BA-6)和婴儿双歧杆菌BI-38 (B.infantis BI-38)分离于洛阳市百岁老人肠道中,保藏于本实验室,菌株保藏于甘油管中(-80 ℃)。
抑菌试验指示菌:大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)、单核细胞性李斯特菌(Listeria monocytogenes)为实验室保藏菌株。
1.1.2 培养基
双歧杆菌BS培养基(g/L):蛋白胨10,肝浸粉5,牛肉浸粉3,酵母浸粉5,胰酪蛋白胨8,可溶性淀粉0.5,氯化钠1,磷酸氢二钾1,磷酸二氢钾1,葡萄糖10,MgSO4·7 H2 O 0.01,MnSO4 0.005,L-半胱氨酸0.5,吐温80 1 mL,pH 7.2,115 ℃灭菌30 min。
LB培养基(g/L):胰蛋白胨10,酵母提取物5,氯化钠10,121 ℃灭菌20 min。
1.1.3 试剂
吐温80、无水乙醇、三氯乙酸、苯酚、浓硫酸、NaCl、抗坏血酸、焦性没食子酸,均为分析纯,天津市德恩化学试剂有限公司;DPPH,美国Sigma公司。
1.2 仪器与设备
BBS-SDC型超净工作台,济南鑫贝生物技术有限公司;THZ-103 B型恒温培养摇床,上海一恒科学仪器有限公司;TA DHR-2型食品流变仪,美国Waters公司;LGJ-10 D型真空冷冻干燥机,北京四环科学仪器厂有限公司;VERTEX 70傅立叶变换中远红外光谱仪,德国BRUKER公司。
1.3 实验方法
1.3.1 菌株培养
取实验室甘油管中冻藏的双歧杆菌解冻,以2%(体积分数)的接种量转接于BS液体培养基中,37 ℃ 厌氧培养48 h,继代培养3次。
1.3.2 EPS的分离提取
将已活化的菌液按2%接种量接种于1L液体培养基中,37 ℃厌氧培养48 h,在600 nm下测定培养液的吸光度。EPS的提取参考李洋[10]的方法并进行适当的修改,即:将发酵液在4 ℃,8 000 r/min条件下离心15 min,取上清液。将上清液用旋转蒸发仪浓缩为原体积的1/3,并加入3倍体积预冷的无水乙醇4 ℃静置过夜。然后在4 ℃,10 000 r/min条件下离心20 min,沉淀用20 mL超纯水溶解。待其溶解后加入三氯乙酸溶液至终质量分数为6%,4 ℃静置过夜,随后在4 ℃,10 000 r/min、离心20 min去除蛋白。将上清液装入透析袋(MW Cut-off 14 000 Da)中放入4 ℃冰箱用蒸馏水透析48 h,每8 h换1次水,即得到胞外粗多糖,通过冷冻干燥后得到粉末状胞外粗多糖,收集称重。
1.3.3 化学组成的测定
EPS总糖含量的测定采用苯酚-硫酸法;蛋白质含量的测定采用Bradford蛋白质染料结合法;糖醛酸含量的测定采用硫酸-咔唑法[11]。
1.3.4 抗氧化活性的测定
1.3.4.1 DPPH自由基清除活性
采用XIAO等[12]的方法测定DPPH自由基清除活性。将1.5 mL不同质量浓度(0.1、0.4、0.8、1.2、1.6 mg/mL)的样品溶液与1.5 mL 0.2 mmol/L DPPH-乙醇溶液充分混合。室温避光孵育30 min后,在517 nm下测定混合物的吸光度,以抗坏血酸(维生素C)为阳性对照。DPPH自由基清除能力计算如公式(1)所示:
清除率![]()
(1)
式中:A1为样品溶液与自由基反应后的吸光度;A0为样品溶液的吸光度,即以水代替自由基溶液,排除样品本身吸光度对结果的影响;A2为未加样品的吸光度,即以水代替样品。
1.3.4.2 羟自由基清除活性
羟自由基清除活性参考LIU等[13]的方法,稍做修改。取1 mL样品加入1 mL 6 mmol/L的FeSO4溶液、1 mL 9 mol/L的水杨酸-乙醇溶液,充分混匀后,加入1 mL 8.8 mmol/L的30% (质量分数) H2O2溶液开始反应,37 ℃孵育40 min,在510 nm下测定吸光度,以维生素C为阳性对照。羟自由基清除能力按公式(1)计算。
1.3.4.3 超氧阴离子自由基清除活性
采用曹艳华[14]的方法测定超氧阴离子自由基清除活性。将1 mL样品与4.5 mL 50 mmol/L pH 8.2的Tris-HCl缓冲液充分混匀,25 ℃保温30 min,加入0.3 mL 25 mmol/L邻苯三酚溶液,摇匀,25 ℃反应5 min。最后向反应体系中加入1 mL 8 mol/L盐酸以终止反应。以维生素C为阳性对照,测定反应物的OD320nm值。超氧阴离子自由基清除能力计算如公式(2)所示:
清除率![]()
(2)
式中:A1为样品溶液与自由基反应后的吸光度;A0为以水为对照的吸光度。
1.3.5 抑菌活性的测定
参考和丽等[15]的方法考察EPS的抑菌活性。将大肠杆菌、金黄色葡萄球菌和单增李斯特菌培养至对数生长期,使用生理盐水将菌悬液调至106 CFU/mL左右备用。将100 μL菌液接种于5 mL LB培养基中,加入EPS溶液至终质量浓度为0、0.5、1、2、4、8、16 mg/mL,37 ℃, 200 r/min条件下培养12 h,测定吸光度。抑菌率计算如公式(3)所示,每组3个平行:
抑制率![]()
(3)
式中:A1为EPS组培养后的吸光度;A0为EPS浓度为0培养后的吸光度;A2为同浓度EPS溶液的吸光度(排除样品本身吸光度对结果的影响)。
1.3.6 EPS的微观形态观察
取适量冻干之后的样品,将样品固定在扫描电镜样品台上,置于离子溅射仪中镀一层导电金膜后,对EPS 样品的外貌形态进行观察。
1.3.7 傅里叶变换中远光谱的分析
将干燥的样品与溴化钾按质量比1∶100混合研磨,压制成片,在400~4 000 cm-1和分辨率4 cm-1时进行扫描分析,得到各样品的红外光谱图。
1.3.8 流变学特性分析
采用DHR-1流变仪测定10 mg/mL EPS溶液的流变特性。夹具采用直径40 mm不锈钢平板,取1 mL EPS溶液于测量板上,狭缝距离设置为1.0 mm,温度25 ℃,剪切力0.01~300 s-1。采用稳态剪切模式测定溶液的表观黏度随剪切速率的变化。
1.3.9 差式扫描量热分析
称取3 mg干燥后的EPS样品于铝坩埚中,以空白坩埚为参比样品。温度设置为30~250 ℃,升温速率10 ℃/min,氮气速率100 mL/min,进行扫描检测。
1.4 统计分析
采用SPSS 25.0软件对数据进行统计学分析,所有试验重复3次,结果以“平均值±标准差”表示,并使用Origin 9.0.6进行相关图标绘制。
2 结果与分析
2.1 EPS的产量与化学组成分析
不同双歧杆菌在BS培养基上的生长情况和EPS产量如表1所示。5株双歧杆菌在生长过程中均能分泌EPS,但产量却不相同。其中,菌株BA-5的产量为(552.69±3.38) mg/L,显著高于其他菌株(P<0.05);BA-5在培养48 h后,其培养液OD600nm值达到1.417±0.024,同样高于其他菌株。此结果与熊江[16]报道的,菌株在0~48 h产胞外多糖能力与菌体生长能力呈正相关结果相一致。由表1可知,BL-3 EPS总糖含量(67.13±1.54)%高于其余4种EPS。BA-6 EPS的蛋白含量和糖醛酸含量显著高于其他4种EPS(P<0.05)。
表1 双歧杆菌胞外多糖的产量及化学组成
Table 1 Production and chemical composition of extracellular polysaccharide from Bifidobacteria
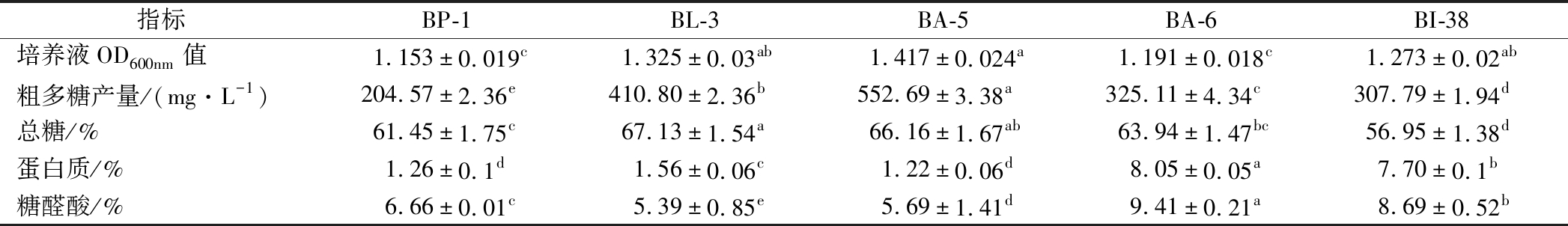
指标BP-1BL-3BA-5BA-6BI-38培养液OD600nm值1.153±0.019c1.325±0.03ab1.417±0.024a1.191±0.018c1.273±0.02ab粗多糖产量/(mg·L-1)204.57±2.36e410.80±2.36b552.69±3.38a325.11±4.34c307.79±1.94d总糖/%61.45±1.75c67.13±1.54a66.16±1.67ab63.94±1.47bc56.95±1.38d蛋白质/%1.26±0.1d1.56±0.06c1.22±0.06d8.05±0.05a7.70±0.1b糖醛酸/%6.66±0.01c5.39±0.85e5.69±1.41d9.41±0.21a8.69±0.52b
注:同一行具有不同上标字母的表示差异显著(P<0.05)
2.2 EPS的抗氧化活性
如图1-A所示,随着EPS浓度的增加,DPPH自由基清除能力逐渐增强,具有一定的浓度依赖性,但是始终低于维生素C的清除能力。在质量浓度为1.8 mg/mL时,各EPS对DPPH自由基清除率达到最大,其清除能力大小为BA-6[(70.82±0.77)%]>BI-38[(68.58±1.02)%]>BP-1[(67.25±5.36)%]>BL-3[(65.71±1.54)]%>BA-5[(29.58±0.36)%]。BA-5 EPS对DPPH自由基清除能力最弱,实验范围内的清除率均<30%,其余4种EPS清除效果比较接近。此外本实验清除率前4的EPS显著高于融合魏斯氏H2 EPS在质量浓度为5 mg/mL时的清除率[17]。EPS中含有的羟基、羧基等供氢物质,使其具有一定的DPPH自由基清除能力,不同的EPS DPPH自由基清除率差异可能与糖醛酸含量、蛋白质含量和分子质量等因素有关。
如图1-B所示,5种EPS均显示了一定的羟自由基清除能力,无论是维生素C还是多糖组,对羟自由基的清除活性随着浓度的增加而增加。BA-6 EPS为0.1~1.6 mg/mL时,其羟自由基清除率[(70.33±1.99)%]均高于其他样品同浓度下的清除率。此外BA-5 EPS在1.6 mg/mL的羟自由基清除率[(59.91±2.39)%]显著高于DPPH自由基清除率。AMIRI等[18]研究B.animalis BB12 EPS对羟自由基清除能力发现,在质量浓度为2 mg/mL时,羟自由基的清除率为(46.4±0.73)%。羟自由基是一种强氧化剂,能与生物大分子发生反应,对活细胞造成严重损伤,EPS中的羟基和羧基可以充当电子或氢供体,达到清除羟自由基的目的。
如图1-C所示,随着样品浓度的增加,各组EPS对超氧阴离子自由基的清除能力呈现先升高后趋于平缓的趋势。相比于其他EPS组分不足50%的清除率,BA-6的清除率达到了(67.78±0.67)%。研究表明,超氧阴离子自由基清除能力与分子中能够促进O—H键释放氢离子的亲电子成分有关,如酮基、醛基等[19]。此外,本研究结果与谢莹等[5]结果相一致,在多糖质量浓度达到0.25 mg/mL时,清除率的增加趋于平缓,猜测达到了饱和浓度。

A-EPS对DPPH自由基的清除能力;B-EPS对羟自由基的清除能力;C-EPS对超氧阴离子自由基的清除能力
图1 不同EPS对DPPH自由基、羟自由基和超氧阴离子自由基的清除能力
Fig.1 Scavenging ability of different EPS to DPPH radical,hydroxyl radical and superoxide anion radical
2.3 EPS的抑菌活性
以大肠杆菌、金黄色葡萄球菌和单增李斯特菌为指示菌,考察EPS的抑菌活性。如图2所示,虽然不同EPS对3种指示菌株的抑制能力不同,并且低浓度EPS对大肠杆菌和金黄色葡萄球菌的生长有促进效果,但随着EPS浓度的升高其抑制能力逐渐增强。5种EPS对于大肠杆菌的抑制并不明显,在1 mg/mL时,BL-3、BA-5和BI-38产生的EPS对大肠杆菌的生长有促进作用,随着浓度的增加其抑菌率也逐步增强至30%左右(图2-A)。除了BL-3 EPS对于金黄色葡萄球菌的抑菌率只有(26.16±0.94)%,其他4种EPS对金黄色葡萄球菌的抑菌率最高可达到(57.89±0.90)%(图2-B)。5种EPS对单增李斯特菌生长具有显著的抑制作用,当样品质量浓度达到16 mg/mL时,其抑菌率从高到低依次为BA-6[(94.96±1.43)%]>BA-38[(81.87±1.84)%]>BA-5[(76.21±1.19)%]>BP-1[(62.10±0.93)%]>BL-3[(60.27±0.94)%](图2-C)。LI等[20]通过体外实验发现B.bifidum WBIN03产生的EPS对7种病原菌的生长具有明显的抑制作用,而对白色念珠菌Z1无抑菌作用。研究发现,双歧杆菌EPS含有硫酸盐基团或特定的蛋白质通过螯合剥夺细菌生长所需的营养物质,从而抑制细菌的生长,以及通过断裂染色体DNA、抑制细菌二分裂增殖和破环生物膜等方式达到抑菌的效果[21]。
2.4 EPS的微观形态
SEM可以显示聚合物的表面形貌和表征聚合物的特性,5种EPS的SEM如图3所示,BP-1和BL-3均为片状,但BP-1表面略微凹凸不平,而BL-3表面呈现疏松多孔的形态。BA-5呈现片状、适度分支结构,表面光滑具有光泽。BA-6内部为大量空洞的蜂窝状结构,来自L.plantarum R040 EPS具有与本研究相似的结构,该结构有助于EPS发生填孔效应,增加对亚甲基蓝染料的吸附效果[22]。BI-38为没有孔结构的片状且上面具有不规则的网状结构,沟纹表面光滑,纵横交错呈实体状。EPS表面微观结构的差异,可能与多糖内单糖组成及糖苷键的链接方式等因素有关。

A-EPS对大肠杆菌的抑菌活性;B-EPS对金黄色葡萄球菌的抑菌活性;C-EPS对单增李斯特菌的抑菌活性
图2 不同EPS对大肠杆菌、金黄色葡萄球菌和单增李斯特菌的抑菌能力
Fig.2 Antimicrobial activity of different EPS against Escherichia coli,Staphylococcus aureus and Listeria monocytogenes

A-BP-1;B-BL-3;C-BA-5;D-BA-6;E-BI-38
图3 不同EPS的微观结构图
Fig.3 Microstructure diagram of different EPS
2.5 傅里叶中外红外光谱分析
如图4所示,在EPS的红外图谱中除了谱带的强度没有显著差异,可以清楚的观察到多糖的典型吸收峰。具体如下:在3 600~3 200 cm-1出现宽而强的吸收峰,归属为羟基(—OH)的伸缩振动,是糖类的特征峰。在3 200~2 800 cm-1内出现的弱峰是由于烯烃CH2的非对称拉伸振动。在1 730~1 630 cm-1出现的峰归属于二级氨基、氨酰基(—CONH—)或者羰基(C![]() O)振动伸缩,该峰的存在表明可能含有糖醛酸[23] 。C—H 变角振动和N—H 弯曲振动在1 600~1 400 cm-1处存在峰,在1 240 cm-1附近出现的吸收峰与S
O)振动伸缩,该峰的存在表明可能含有糖醛酸[23] 。C—H 变角振动和N—H 弯曲振动在1 600~1 400 cm-1处存在峰,在1 240 cm-1附近出现的吸收峰与S![]() O不对称伸缩振动有关。在1 200~1 000 cm-1内的吸收峰通常被定义为多糖的指纹区域,1 153 cm-1附近出现的峰归因于多糖中吡喃糖中的糖苷键(C—O—C)和连接键(C—O—H),1 053 cm-1附近的峰表明EPS包含α-(1→6)糖苷键[10]。BP-1、BL-3和BA-5产生的EPS在670 cm-1附近的峰被认为是糖苷键的存在,BP-1、BL-3、BA-6和BI-38的EPS在581 cm-1附近的吸收峰可能是由于葡萄糖单元中吡喃糖环的骨架振动[24]。此外,890 cm-1是典型的β-型糖苷键链接特征吸收峰,而在本图谱中此处没有峰,表明以上EPS为是α-吡喃糖苷型且含有α-(1→6)糖苷键。
O不对称伸缩振动有关。在1 200~1 000 cm-1内的吸收峰通常被定义为多糖的指纹区域,1 153 cm-1附近出现的峰归因于多糖中吡喃糖中的糖苷键(C—O—C)和连接键(C—O—H),1 053 cm-1附近的峰表明EPS包含α-(1→6)糖苷键[10]。BP-1、BL-3和BA-5产生的EPS在670 cm-1附近的峰被认为是糖苷键的存在,BP-1、BL-3、BA-6和BI-38的EPS在581 cm-1附近的吸收峰可能是由于葡萄糖单元中吡喃糖环的骨架振动[24]。此外,890 cm-1是典型的β-型糖苷键链接特征吸收峰,而在本图谱中此处没有峰,表明以上EPS为是α-吡喃糖苷型且含有α-(1→6)糖苷键。

图4 不同EPS的红外光谱图
Fig.4 Infrared spectra of different EPS
2.6 EPS的流变特性
不同EPS表观黏度变化情况如图5所示,EPS溶液的表观黏度随着剪切速率的提高(0.01~300 s-1)而降低,表现出明显的剪切变稀行为,符合假塑性流体特征,为“非牛顿流体”。但这种结构容易被剪切应力破坏,所以,随着剪切速率的增加,溶液黏度急剧降低,当剪切速率超过一定范围后,体系的分子链形成比较稳定有序的结构,剪切速率的变化对表观黏度造成的影响不明显[25]。剪切速率较低时,BP-1、BL-3和BI-38 EPS的表观黏度差异不明显,而BA-5和BA-6 EPS溶液的表观黏度明显大于另外3个样品。根据前面的化学组成分析发现,BA-5 EPS含有较高的多糖成分,BA-6 EPS的蛋白质和多糖的总含量也高于其他3 者,这或许是EPS溶液具有较高的初始表观黏度的原因。

图5 不同EPS溶液的表观黏度
Fig.5 Apparent viscosity of different EPS solutions
2.7 EPS的DSC分析
DSC可以用来研究高分子化合物的热学性能及稳定性。EPS由于分子间相互作用,可形成糖链凝聚缠结、相互交联的趋势,当达到玻璃化转变温度(Tg)时,聚合链重组而产生热作用,在DSC曲线上体现为吸热峰[26]。5种EPS的DSC曲线如图6所示。BP-1、BL-3、BA-5、BA-6和BI-38分别在79.5、80.5、74、80、88 ℃有强放热峰,这可能因为玻璃化转变导致EPS中游离/束缚水分的蒸发,说明EPS中含有大量的羧基。随着温度的升高至250 ℃没有出现明显的放热峰,这表明EPS在30~250 ℃没有发生氧化分解,具有良好的热稳定性。D AZ-MONTES等[27]发现Leuconostoc mesenteroides SF3 EPS的玻璃化转变温度为90 ℃,EPS在热稳定上的差异可能与分子结构、分子质量、单糖组成有关。
AZ-MONTES等[27]发现Leuconostoc mesenteroides SF3 EPS的玻璃化转变温度为90 ℃,EPS在热稳定上的差异可能与分子结构、分子质量、单糖组成有关。

图6 不同EPS溶液的DSC图谱
Fig.6 DSC spectra of different EPS solutions
3 结论
本研究以水提醇沉法对5株双歧杆菌胞外多糖进行提取,其产量从大到小为:BA-5[(552.69±3.38) mg/L]>BL-3[(410.8±2.36) mg/L]>BA-6[(325.11±4.34) mg/L]>BI-38[(307.79±1.94) mg/L]>BP-1[(204.57±2.36) mg/L];此外,BA-6所分泌的EPS蛋白质以及糖醛酸含显著高于其他4种EPS(P<0.05)。通过体外抗氧化试验发现,EPS的抗氧化能力随浓度的增加而加强,其中BA-6、BL-3、BP-1和BI-38具有显著的DPPH自由基清除能力和羟自由基清除能力,此外BA-6对于超氧阴离子的清除能力显著高于其他4种EPS。抑菌实验发现,5种EPS对于大肠杆菌、金黄色葡萄球菌和单增李斯特菌具有一定的抑菌效果,其中,对于单增李斯特菌具有明显的抑制作用,并且BA-6的抑菌率高达(94.96±1.43)%。BA-6的EPS表现出较好的抗氧化能力和抑菌活性,可能因为半乳糖醛酸含量最高并且含有较多的蛋白质。5种EPS的表观形态存在一定的差异,红外图谱分析发现5种EPS除了谱带的强度外,官能团种类没有显著差异。流变特性的研究结果发现,BA-6和BA-5的初始表观黏度明显高于其他3种,此外,在30~250 ℃,5种EPS具有良好的热稳定性。综上,不同种双歧杆菌EPS功能特性具有差异,并且同种不同源的双歧杆菌菌株之间(动物双歧杆菌BA-5和BA-6)所产EPS也存在一定的生物活性差异。动物双歧杆菌BA-6具有较高的抗氧化能力和抑菌性能,是具有良好发展和应用前景的天然抗氧剂和食品添加剂。后续可对动物双歧杆菌BA-6的结构进一步深入解析并探索其体内抗氧化活性功能。
[1] XU Y M, CUI Y L, YUE F F, et al.Exopolysaccharides produced by lactic acid bacteria and Bifidobacteria:Structures, physiochemical functions and applications in the food industry[J].Food Hydrocolloids, 2019, 94:475-499.
[2] INTURRI R, MANGANO K, SANTAGATI M, et al.Immunomodulatory effects of Bifidobacterium longum W11produced exopolysaccharide on cytokine production[J].Current Pharmaceutical Biotechnology, 2017, 18(11):883-889.
[3] 白少峰, 陈华海, 王欣, 等.双歧杆菌胞外多糖研究进展[J].中国微生态学杂志, 2017, 29(10):1 207-1 211;1 218.
BAI S F, CHEN H H, WANG X, et al.Advance in research on Bifidobacterial surface-exopolysaccharide[J].Chinese Journal of Microecology, 2017, 29(10):1 207-1 211;1 218.
[4] XU R H, SHANG N, LI P L.In vitro and in vivo antioxidant activity of exopolysaccharide fractions from Bifidobacterium animalis RH[J].Anaerobe, 2011, 17(5):226-231.
[5] 谢莹, 蔡国林, 刘逸凡, 等.双歧杆菌Bb12胞外多糖发酵条件优化及抗氧化活性研究[J].食品与发酵工业, 2019, 45(23):55-59.
XIE Y, CAI G L, LIU Y F, et al.Optimization of fermentation conditions and antioxidant activities of exopolysaccharide from Bifidobacterium lactis Bb12[J].Food and Fermentation Industries, 2019, 45(23):55-59.
[6] WU M H, PAN T M, WU Y J, et al.Exopolysaccharide activities from probiotic Bifidobacterium:Immunomodulatory effects(on J774A.1 macrophages)and antimicrobial properties[J].Interna- tional Journal of Food Microbiology, 2010, 144(1):104-110.
[7] LI S J, CHEN T T, XU F, et al.The beneficial effect of exopolysaccharides from Bifidobacterium bifidum WBIN03 on microbial diversity in mouse intestine[J].Journal of the Science of Food and Agriculture, 2014, 94(2):256-264.
[8] 刘丽莎, 彭义交, 田旭, 等.双歧杆菌胞外多糖对酸豆乳品质的影响[J].食品科学, 2016, 37(11):120-124.
LIU L S, PENG Y J, TIAN X, et al.Effect of exopolysaccharides produced by Bifidobacterium on properties of soya yogurt[J].Food Science, 2016, 37(11):120-124.
[9] LI Y, LIU Y M, CAO C X, et al.Extraction and biological activity of exopolysaccharide produced by Leuconostoc mesenteroides SN-8[J].International Journal of Biological Macromolecules, 2020, 157:36-44.
[10] 李洋.肠膜明串珠菌SN-8胞外多糖分离纯化, 结构鉴定及功能特性研究[D].沈阳:沈阳农业大学, 2020.
LI Y.Isolation, purification, structural identification and functional properties of extracellular polysaccharide from Leuconostoc mesenteroides SN-8[D].Shenyang:Shenyang Agricultural University, 2020.
[11] 周佳敏.鼠李糖乳杆菌胞外多糖的纯化及降脂和调节肠道菌群活性研究[D].杭州:浙江工商大学, 2020.
ZHOU J M.Purification of exopolysaccharides of Lactobacillus rhamnosus and their hypolipidemic and intestinal flora-regulating activities[D].Hangzhou:Zhejiang Gongshang University, 2020.
[12] XIAO Z Q, ZHANG Q, DAI J, et al.Structural characterization, antioxidant and antimicrobial activity of water-soluble polysaccharides from bamboo(Phyllostachys pubescens Mazel)leaves[J].International Journal of Biological Macromolecules, 2020, 142:432-442.
[13] LIU Y, DU Y Q, WANG J H, et al.Structural analysis and antioxidant activities of polysaccharide isolated from Jinqian mushroom[J].International Journal of Biological Macromolecules, 2014, 64:63-68.
[14] 曹艳华.超声波提取洋葱中多酚物质工艺优化及抗氧化活性研究[D].洛阳:河南科技大学, 2018.
CAO Y H.Study on ultrasonic extraction process and antioxidant activity of onion polyphenol[D].Luoyang:Henan University of Science and Technology, 2018.
[15] 和丽, 熊海涛, 王雪峰, 等.响应面试验优化复合酶法制备青刺果抗菌肽的工艺研究[J].中国油脂, 2021, 46(6):33-37.HE L, XIONG H T, WANG X F, et al.Optimization of preparation of antimicrobial peptides from Prinsepia utilis Royle by compound enzymes using response surface methodology[J].China Oils and Fats, 2021, 46(6):33-37.
[16] 熊江.动物双歧杆菌乳亚种BZ11, BZ25的性能评价及合生元制备[D].贵阳:贵州大学, 2017.
XIONG J.Properties evaluation of Bifidobacterium animalis subsp. lactis BZ11, BZ25 and preparation of biostime[D].Guiyang:Guizhou University, 2017.
[17] 姜静, 杜仁鹏, 郭尚旭, 等.融合魏斯氏菌胞外多糖的分离纯化及其生化特性[J].食品科学, 2020, 41(1):9-15.
JIANG J, DU R P, GUO S X, et al.Separation, purification and biochemical properties of exopolysaccharides from Weissella confusa [J].Food Science, 2020, 41(1):9-15.
[18] AMIRI S,REZAEI MOKAKRAM R,SOWTI KHIABANI M, et al.Exopolysaccharides production by Lactobacillus acidophilus LA5 and Bifidobacterium animalis subsp.lactis BB12:Optimization of fermentation variables and characterization of structure and bioac- tivities[J].International Journal of Biological Macromolecules, 2019, 123:752-765.
[19] HUANG S Q, DING S D, FAN L P.Antioxidant activities of five polysaccharides from Inonotus obliquus[J].International Journal of Biological Macromolecules, 2012, 50(5):1 183-1 187.
[20] LI S J, HUANG R H, SHAH N P.et al.Antioxidant and antibacterial activities of exopolysaccharides from Bifidobacterium bifidum WBIN03 and Lactobacillus plantarum R315[J].Journal of Dairy Science, 2014, 97(12):7 334-7 343.
[21] HE F, YANG Y, YANG G, et al.Studies on antibacterial activity and antibacterial mechanism of a novel polysaccharide from Strepto- myces virginia H03[J].Food Control, 2010, 21(9):1 257-1 262.
[22] LI C C, CHEN D, DING J, et al. A novel hetero-exopolysaccharide for the adsorption of methylene blue from aqueous solutions:Isotherm, kinetic, and mechanism studies[J].Journal of Cleaner Production, 2020, 265:121800.
[23] DI W, ZHANG L W, WANG S M, et al.Physicochemical characterization and antitumour activity of exopolysaccharides produced by Lactobacillus casei SB27 from yak milk[J].Carbohydrate Polymers, 2017, 171:307-315.
[24] CARMONA-GARC A R,BELLO-PÉREZ L A,AGUIRRE-CRUZ A,et al.Effect of ultrasonic treatment on the morphological, physicochem- ical, functional, and rheological properties of starches with different granule size[J].Starch-Stärke, 2016, 68(9-10):972-979.
A R,BELLO-PÉREZ L A,AGUIRRE-CRUZ A,et al.Effect of ultrasonic treatment on the morphological, physicochem- ical, functional, and rheological properties of starches with different granule size[J].Starch-Stärke, 2016, 68(9-10):972-979.
[25] 李秀秀, 尚静, 杨曦, 等.多糖的增稠、胶凝及乳化特性研究进展[J].食品科学, 2021, 42(15):300-308.
LI X X, SHANG J, YANG X, et al.A review on thickening, gelling and emulsifying properties of polysaccharides[J].Food Science, 2021, 42(15):300-308.
[26] 李梦钰, 刘会平, 贾琦, 等.天冬多糖理化性质和流变学特性研究[J].食品与发酵工业, 2021, 47(5):48-56.
LI M Y, LIU H P, JIA Q, et al.Physicochemical properties and rheological properties of Asparagus radix polysaccharide[J].Food and Fermentation Industries, 2021, 47(5):48-56.
[27] D AZ-MONTES E, Y
AZ-MONTES E, Y
 EZ-FERN
EZ-FERN NDEZ J, CASTRO-MU
NDEZ J, CASTRO-MU OZ R.Characterization of oligodextran produced by Leuconostoc mesenteroides SF3 and its effect on film-forming properties of chitosan[J].Materials Today Communications, 2021, 28:102487.
OZ R.Characterization of oligodextran produced by Leuconostoc mesenteroides SF3 and its effect on film-forming properties of chitosan[J].Materials Today Communications, 2021, 28:102487.