莲藕作为我国重要的水生经济作物,广泛种植于湖北、湖南、江西、福建等地。莲藕富含水分、蛋白质、碳水化合物、膳食纤维、胡萝卜素、视黄醇、核黄素、维生素C和维生素E等[1-3]物质,具有较高的食用价值。
莲藕根据口感品质可以分为三大类。一类是粉质藕,口感柔软、黏度大、适于煨汤,制作藕粉和糯米藕等,常见的有鄂莲5号;另一类是脆质藕,口感脆嫩、黏度低、适于凉拌或清炒,常见的有鄂莲3号;另有口感居于两者之间的品种如鄂莲4号。莲藕也是我国出口的重要蔬菜之一,具有较高的经济价值。由于莲藕富含水分、外表皮薄、容易被损坏、贮藏期间易失水干缩和褐变变色,所以将新鲜莲藕进行鲜切加工,供应餐饮业使用或作为即食产品成为了莲藕销售的主流方式[4-6]。然而鲜切后的莲藕在加工和贮藏期间容易变质,存放的时间短,影响产品的出口和销售[7]。褐变是限制莲藕品质的重要因素,鲜切莲藕的褐变以酶促褐变为主,相关机理的研究主要集中于酚、酚酶区域性分布学说、自由基伤害假说和保护酶系统假说[8]。然而不同口感鲜切莲藕褐变的生理生化差异及机制研究却鲜有报道,这对于筛选适合鲜切加工的莲藕品种至关重要。因此作者选用了3种不同口感的莲藕品种,通过对其鲜切后的外观和生理生化水平进行分析,结合相关基因的表达,研究不同口感莲藕褐变的生理生化特征及其分子机制,以及鲜切产品的适用性[9],旨在为解决莲藕褐变提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
试验所用莲藕品种为鄂莲3号;鄂莲4号和鄂莲5号均由广昌白莲研究所提供。选取品种一致,大小正常,颜色均匀无机械损伤的莲藕,备用。
1.1.2 试剂
乙二胺四乙酸、氮蓝四唑、乙酸、碳酸氢钠、过氧化氢、磷酸二氢钾、磷酸氢二钾、对氨基苯磺酸、α-萘胺、甲硫氨酸、氮蓝四唑,国药集团化学试剂有限公司;氢氧化钠、草酸、酚酞、甲醇、愈创木酚、核黄素、酒石酸钠、苯酚、乙醇、乙酸钠,天津市光复精细化工研究所。
1.2 仪器与设备
高速冷冻离心机、A590型双束紫外可见分光光度计,翔艺仪器(上海)有限公司;干式恒温器,杭州奥盛仪器有限公司;电热式恒温水槽,翔艺仪器(上海)有限公司;电子天平,赛多利斯科学仪器(北京)有限公司;JJ200型电子天平,常熟市双杰测试仪器厂;电热恒温鼓风干燥箱,翔艺仪器(上海)有限公司;MX-S可调式漩涡混匀仪,北京鑫润科诺仪器仪表有限公司;SX-500灭菌锅,翔艺仪器(上海)有限公司;微孔板扫描分光光度计,BioTek仪器。
1.3 实验方法
每天测定一次褐变度、呼吸强度、还原糖、可溶性蛋白质、总酚、维生素C、丙二醛(malonic dialdehyde,MDA)、超氧阴离子自由基![]() 的含量。每天测定一次多酚氧化酶(polyphenol oxidase,PPO)、抗坏血酸过氧化物酶(aseorbate peroxidase,APX)、过氧化氢酶(catalase,CAT)、锰超氧化物歧化酶(Mn-superoxidedismutase,Mn-SOD)、铜锌超氧化物歧化酶(Cu,Zn-superoxide dismutase,Cu,Zn-SOD)、过氧化物酶(peroxidase,POD),以上试验至少重复3次,并进行统计学分析。
的含量。每天测定一次多酚氧化酶(polyphenol oxidase,PPO)、抗坏血酸过氧化物酶(aseorbate peroxidase,APX)、过氧化氢酶(catalase,CAT)、锰超氧化物歧化酶(Mn-superoxidedismutase,Mn-SOD)、铜锌超氧化物歧化酶(Cu,Zn-superoxide dismutase,Cu,Zn-SOD)、过氧化物酶(peroxidase,POD),以上试验至少重复3次,并进行统计学分析。
1.3.1 褐变度、呼吸强度、MDA含量和![]() 含量的测定
含量的测定
采用消光值法分析莲藕的褐变度[10] 。在波长410 nm 处测定吸光度;通过静置碱液吸收法研究鲜切莲藕的呼吸强度[11] ;通过硫代巴比妥酸法测量MDA含量[12] 。分别在紫外波长或450 nm、532 nm和600 nm处测定其吸光度;采用羟胺氧化法测量![]() 含量[13] 。在波长530 nm处测定吸光度。
含量[13] 。在波长530 nm处测定吸光度。
1.3.2 还原糖含量、可溶性蛋白质含量、总酚含量和维生素C含量的测定
在波长540 nm处测定吸光度,采用DNS(3,5-二硝基水杨酸)比色法测量还原糖[14];在595 nm处测定其吸光度,采用考马斯亮蓝法测定蛋白质的含量[16];总酚含量的测定采用HCl-甲醇法[16]。在波长290 nm处测定吸光度;采用二氯酚靛酚滴定法测定维生素C含量。
1.3.3 抗氧化系统酶活性分析
采用愈创木酚氧化法分析POD活性[17],在波长470 nm处测定吸光度。每隔半分钟记录其吸光度的数值,连续记录6次,酶活力大小用每分钟A470改变0.01表示;氮蓝四唑光化还原法分析SOD活性[18]。通常用抑制氮蓝四唑光化还原的50%作为1个酶活性单位来表示SOD活性。
采用丙酮法提取PPO酶粗酶液,在波长420 nm处测定吸光度计算PPO酶活性,在波长595 nm处测吸光度算得PPO酶总蛋白量,计算出PPO酶比活力[19]。
1.3.4 APX、CAT、Mn-SOD、Cu,Zn-SOD、PPO和POD荧光定量分析
用Hipure piant RNA mini kit 试剂盒提取不同口感不同时期莲藕的RNA,再把RNA反转录成cDNA。用定量酶进行定量分析[20]。本文章所用引物如表1所示。
表1 文章所用引物
Table 1 Primers used in the article

引物名称引物序列NnPPO-FTTCTAATGCCTCCACCTCTNnPPO-RTTCCTCCTGTCCAACCTC5SRNA-FGGATGCGATCATACCAGCAC5SRNA-RGGGAATGCAACACGAGGACTMnSOD-FAGGGTTAGGGTTTAGTCATMnSOD-RAGAGCCTTATTGTAGTTGGTCuZnSOD-FATGGTGAAGGCTGTTGCGCuZnSOD-RTCCTGTTACTTTAGTTGATFeSOD-FATGGGGTCCTGTTTCAFeSOD-RTCAAGCCACAGGAATPOD-FGATACCCAGAGTTGTGAGCPOD-RAAAGCAATCGTGGAAGAACAT-FCAAACCCAATCCTAAGTCCAT-RATCCATGTGCCTGTAATCAPX-FTTCATCCTCCCAGTGCCGAPX-RCATCCCAAACGAACCAAAOligo(dT)TTTTTTTTTTTTTTTTTT
2 结果与分析
2.1 鲜切莲藕的外观
通过观察不同口感鲜切莲藕的褐变过程,发现低温贮藏第1天不同口感的鲜切莲藕开始发生褐变,如图1所示。低温贮藏第2天鄂莲4号褐变最显著;鄂莲3号在贮藏第4天和第5天时褐变明显;鄂莲5号分别在低温贮藏第3天和第4天褐变明显。鄂莲3号鲜切第0天,外观偏白偏亮更适合做鲜切加工。

图1 不同口感鲜切莲藕褐变表观变化
Fig.1 Apparent changes of browning of fresh cut
lotus roots with different tastes
2.2 还原糖含量、可溶性蛋白质含量、总酚含量和维生素C 含量
试验所用的鲜切鄂莲3 号、鄂莲4 号和鄂莲5 号贮藏期间还原糖含量、可溶性蛋白质含量、总酚含量和维生素C 含量的变化如图2 所示。还原糖的变化与莲藕的褐变和呼吸作用有关,还原糖主要来源于总糖的分解,还原糖的消耗主要因为呼吸作用,在整个贮藏期间3 种莲藕还原糖含量都成上升趋势。随着贮藏时间的延长,褐变莲藕内还原糖含量延长,鄂莲4 号的变化幅度较大,但鄂莲3 号的还原糖含量较低,变化幅度较小。随着贮藏时间的延长,3 个品种的可溶性蛋白质含量降低,但鄂莲3 号相对于其他2个品种下降幅度较小,但3 个品种总的变化趋势相同。
酚类化合物是植物组织褐变的重要底物之一,新鲜莲藕中的酚类化合物容易被酚类酶氧化和褐变,从而使鲜切莲藕发生表观变化。实验结果表明,不同品种莲藕总酚延长含量存在差异,鄂莲4 号在鲜切第1 天总酚延长含量最低,鄂莲3 号和鄂莲5 号总酚延长含量基本一样。在整个贮藏期间,鄂莲3 号和鄂莲5 号变化幅度较为平缓,鄂莲4 号在第4 天总酚含量下降明显。鲜切莲藕体内维生素C 在氧化酶的作用下可发生降解,从而导致含量下降。在整个贮藏期间,鄂莲3 号、鄂莲4 号和鄂莲5 号这3 个品种中莲藕的维生素C 含量都呈下降趋势,但是鄂莲4 号前3 d 持续降低,最后1 d 略微升高,鄂莲3 号和鄂莲5 号,这2 个品种贮藏第1 天略微升高,之后缓慢降低。这一结果显示不同品种的莲藕中维生素C 在鲜切后的贮藏期间的变化规律是不同的。

a-还原糖;b-可溶性蛋白;c-总酚;d-维生素C
图2 不同莲藕品质变化
Fig.2 Quality changes of different lotus roots
2.3 褐变度、呼吸强度、MDA含量和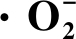 含量
含量
研究分析了低温贮藏期间鄂莲3号、鄂莲4号和鄂莲5号鲜切莲藕褐变度、呼吸强度、MDA含量和![]() 含量的变化,如图3所示。色泽变化是评价鲜切莲藕品质优劣的重要指标之一。鲜切莲藕因与空气接触面增大,因此其褐变速率加快,严重影响鲜切莲藕的感官品质。褐变度的总体趋势都是先升高后降低,不同口感的鲜切莲藕贮藏第1天褐变度达到最大值,随后开始降低。但在低温贮藏期间,鄂莲3号的褐变度始终低于其他2个品种,鄂莲4号的褐变度要比其他2个品种都高。呼吸强度影响莲藕的品质变化速率,呼吸强度越大莲藕品质裂变越快。3个品种呼吸强度的变化曲线基本一致,即随着贮藏时间的延长,呼吸强度也逐渐增强。鄂莲3号的呼吸强度低于其他2个品种,增加的幅度较小,而鄂莲4号的呼吸强度最高。MDA是果蔬在逆境条件下膜脂过氧化的产物之一,其含量的多少可以反映莲藕的品质。在整个贮藏期间这3个品种MDA含量均呈上升趋势,鄂莲3号的MDA含量低于鄂莲4号和鄂莲5号。MDA含量越高,其发生褐变的可能性就越大。推测鄂莲4号和鄂莲5号比鄂莲3号MDA含量高是其易发生褐变的主要原因。
含量的变化,如图3所示。色泽变化是评价鲜切莲藕品质优劣的重要指标之一。鲜切莲藕因与空气接触面增大,因此其褐变速率加快,严重影响鲜切莲藕的感官品质。褐变度的总体趋势都是先升高后降低,不同口感的鲜切莲藕贮藏第1天褐变度达到最大值,随后开始降低。但在低温贮藏期间,鄂莲3号的褐变度始终低于其他2个品种,鄂莲4号的褐变度要比其他2个品种都高。呼吸强度影响莲藕的品质变化速率,呼吸强度越大莲藕品质裂变越快。3个品种呼吸强度的变化曲线基本一致,即随着贮藏时间的延长,呼吸强度也逐渐增强。鄂莲3号的呼吸强度低于其他2个品种,增加的幅度较小,而鄂莲4号的呼吸强度最高。MDA是果蔬在逆境条件下膜脂过氧化的产物之一,其含量的多少可以反映莲藕的品质。在整个贮藏期间这3个品种MDA含量均呈上升趋势,鄂莲3号的MDA含量低于鄂莲4号和鄂莲5号。MDA含量越高,其发生褐变的可能性就越大。推测鄂莲4号和鄂莲5号比鄂莲3号MDA含量高是其易发生褐变的主要原因。![]() 含量的增加可作为果蔬组织衰老的标志,在贮藏期间3个莲藕品种的
含量的增加可作为果蔬组织衰老的标志,在贮藏期间3个莲藕品种的![]() 含量都呈上升趋势。鄂莲3号中的
含量都呈上升趋势。鄂莲3号中的![]() 含量在褐变期间都要比鄂莲4号和鄂莲5号中的
含量在褐变期间都要比鄂莲4号和鄂莲5号中的![]() 含量高,但第4天3种莲藕
含量高,但第4天3种莲藕![]() 含量基本一样,由此可知不同种类莲藕贮藏鲜切期间
含量基本一样,由此可知不同种类莲藕贮藏鲜切期间![]() 的含量变化差异不明显。
的含量变化差异不明显。
2.4 抗氧化系统酶的活性
POD是植物体内清除过氧化物、降低活性氧伤害的一种关键酶。活性越高,植物体清除过氧化物的能力就越强,对植物的保护作用也就越大。如图4所示,在整个贮藏期间鄂莲4号POD的酶活下降显著,加快莲藕褐变的过程。鄂莲3号在整个贮藏期POD活性维持平稳状态,有利于减缓褐变过程。SOD具有清除![]() 减轻细胞损伤的能力。因此活性越强,越有利于消除活性氧对组织的损伤。鲜切莲藕贮藏过程中,鄂莲3号、鄂莲4号和鄂莲5号的SOD活性都呈现下降趋势,但是鲜切后鄂莲3号的酶活仍比同期鄂莲5号和鄂莲4号高,这可能也是不同品种间褐变特性差别大的原因。PPO是引起鲜切果蔬褐变的主要酶类之一,主要负责催化酚类底物氧化的一种氧化还原酶类。鄂莲3号在鲜切低温贮藏期间PPO酶的酶活力比另外2个品种的酶活力都低,这与前面得出的鄂莲3号适合做鲜切加工的结果是一致的。
减轻细胞损伤的能力。因此活性越强,越有利于消除活性氧对组织的损伤。鲜切莲藕贮藏过程中,鄂莲3号、鄂莲4号和鄂莲5号的SOD活性都呈现下降趋势,但是鲜切后鄂莲3号的酶活仍比同期鄂莲5号和鄂莲4号高,这可能也是不同品种间褐变特性差别大的原因。PPO是引起鲜切果蔬褐变的主要酶类之一,主要负责催化酚类底物氧化的一种氧化还原酶类。鄂莲3号在鲜切低温贮藏期间PPO酶的酶活力比另外2个品种的酶活力都低,这与前面得出的鄂莲3号适合做鲜切加工的结果是一致的。

a-褐变度;b-呼吸强度;![]() 含量
含量
图3 不同莲藕生理生化的变化
Fig.3 Physiological and biochemical changes of different lotus roots

a-POD活性;b-SOD活性;c-PPO活性
图4 不同莲藕抗氧化系统酶活性的变化
Fig.4 Changes of enzyme activities of antioxidant system in different lotus roots
2.5 不同莲藕不同基因荧光定量分析
基因在mRNA水平的表达模式和其生物学功能具有密切关系。采用荧光定量PCR技术分析PPO、Mn-SOD、Cu,Zn-SOD、CAT、APX和POD基因在莲藕褐变中的表达模式,结果如图5所示。鄂莲3号的PPO基因在低温贮藏第2天时相对于鄂莲4号和鄂莲5号的表达量偏低,而鄂莲4号的PPO基因表达量在这天达到最大值,这与之前的褐变实验结果是一致的;鄂莲3号的POD基因表达量在低温贮藏第2天时远高于4号和鄂莲5号,这和之前的POD活性的结果是一致的;鄂莲3号的Mn-SOD基因表达量在鲜切低温贮藏第2天高于鄂莲4号和鄂莲5号。
3 结论
3.1 褐变对鲜切莲藕的品质影响
本实验选用了3种湖北种植的莲藕品种:鄂莲3号、鄂莲4号和鄂莲5号,发现不同品种的莲藕在鲜切贮藏期间各项指标存在着显著的差异,主要表现为鄂莲3号的还原糖含量、可溶性蛋白质含量、维生素C含量和总酚含量的变化幅度均比鄂莲4号和鄂莲5号低。鲜切莲藕中的可溶性蛋白质含量在整个贮藏期间处于相对平衡的状态。这是由于蛋白质发生了变性和水解反应,另一方面是因为新的游离蛋白被细胞释放出来。在贮藏后期,鲜切的莲藕产品发生了严重的褐变,总糖发生分解反应产生还原糖,其中大部分被莲藕的呼吸作用所消耗。在特定的条件下,只有一小部分的还原糖参与美拉德反应[21]。

a-APX;b-CAT;c-Mn-SOD;d-Cu,Zn-SOD;e-POD;f-PPO
图5 荧光定量分析表达
Fig.5 Quantitative real-time PCR analysis
3.2 褐变造成的不同口感鲜切莲藕的生理特征改变
研究测定了鲜切莲藕贮藏期间生理变化如呼吸强度、褐变度、MDA含量![]() 含量、POD活性和SOD活性的变化。有研究表明,鲜切莲藕在冷藏贮藏期间的呼吸强度逐渐上升,MDA的含量也逐渐升高,褐变度也是逐渐上升的[22]。本研究结果表明,鄂莲3号的呼吸强度低于其他2个品种,表明鲜切所引起的呼吸损伤对鄂莲3号的影响较小;随着贮藏时间的延长,3个品种莲藕的褐变度也逐渐增加,这与前人的研究结果一致[23],但是鄂莲4号的褐变度变化较大,表示不同品种莲藕的褐变特性存在差异。
含量、POD活性和SOD活性的变化。有研究表明,鲜切莲藕在冷藏贮藏期间的呼吸强度逐渐上升,MDA的含量也逐渐升高,褐变度也是逐渐上升的[22]。本研究结果表明,鄂莲3号的呼吸强度低于其他2个品种,表明鲜切所引起的呼吸损伤对鄂莲3号的影响较小;随着贮藏时间的延长,3个品种莲藕的褐变度也逐渐增加,这与前人的研究结果一致[23],但是鄂莲4号的褐变度变化较大,表示不同品种莲藕的褐变特性存在差异。
不同品种的莲藕中,SOD和POD是活性氧清除系统中主要的2种酶,它们的活性大小也有差异。鲜切贮藏期间的3个品种的莲藕在同一时间测定,鄂莲4号中的这2种酶的活性变化趋势都大于同期的其他2个品种,鄂莲3号的这2种酶活性变化相对平缓。结果表明,相比其他2个品种,鄂莲3号中的活性氧清除系统更强大,对不良的贮藏环境的应激能力和反应程度也比较强,能更好地保护植物细胞免受活性氧等有害物质的侵害以及减缓脂质过氧化作用的发生。
综上,鄂莲3号、鄂莲4号和鄂莲5号这3个品种的莲藕在品质和生理特性上都存在着明显的差别,表现为鄂莲3号的可溶性蛋白质、维生素C 和总酚的含量较高,褐变相关的酶SOD 和POD 活性较强。鄂莲3 号品种更适合鲜切加工。
[1] 张鹏, 颜碧, 贾晓昱, 等.鲜切莲藕防褐变剂配方优化及保鲜效果研究[J].食品与发酵工业, 2022, 48(1):169-175.
ZHANG P, YAN B, JIA X Y, et al.Formulation optimization and fresh-keeping effect study of anti-browning agent of fresh cut lotus root[J].Food and Fermentation Industries, 2022, 48(1):169-175.
[2] 程婷婷, 惠小涵, 尚欣欣, 等.10个产地莲藕营养成分分析与品质综合评价[J].食品工业科技, 2021, 42(8):320-325.
CHENG T T, HUI X H, SHANG X X, et al.Nutrient composition analysis and quality comprehensive evaluation of lotus root in 10 pro-ducing areas[J].Science and Technology of Food Industry, 2021, 42(8):320-325.
[3] SUN Y, ZHANG W, ZENG T, et al.Hydrogen sulfide inhibits enzymatic browning of fresh-cut lotus root slices by regulating phenolic metabolism[J].Food Chemistry, 2015, 177(15):376-381.
[4] 蒋娟, 姜丽, 傅淋然, 等.鲜切莲藕褐变期间酚类提取及其对自由基的清除能力[J].食品科学, 2013, 34(15):32-37.
JANG J, JIANG L, FU L R, et al.Extraction and free radical-scavenging activity of phenols from fresh-cut lotus roots during browning[J].Food Science, 2013, 34(15):32-37.
[5] ALI S, KHAN A S, ANJUM M A, et al.Aloe vera gel coating delays post-cut surface browning and maintains quality of cold stored lotus (Nelumbo Nucifera Gaertn.) root slices[J].Scientia Horticulturae, 2019, 256:108612.
[6] 程丽林, 吴波, 袁海君, 等.鲜切果蔬贮藏保鲜技术研究进展[J].保鲜与加工, 2019, 19(1):147-152.
CHENG L L, WU B, YUAN H J, et al.Research progress in storage and preservation technologies of fresh-cut fruits and vegetables[J].Storage and Process, 2019, 19(1):147-152.
[7] SUN Y, ZHANG W, ZENG T, et al.Hydrogen sulfide inhibits enzymatic browning of fresh-cut lotus root slices by regulating phenol- ic metabolism[J]. Food Chemistry, 2015, 177:376-381.
[8] 李佩艳, 党东阳, 尹飞, 等.鲜切莲藕防褐变复合保鲜剂配方优化及应用[J].中国食品添加剂, 2019, 30(12):137-142.
LI P Y, DANG D Y, YIN F, et al.Optimization and application of fresh-cut lotus root anti-browning compound preservative[J].China Food Additives, 2019, 30(12):137-142.
[9] CHEN J H, XU Y H, YI Y, et al.Regulations and mechanisms of 1-methylcyclopropene treatment on browning and quality of fresh-cut lotus (Nelumbo nucifera Gaertn.) root slices[J].Postharvest Biology and Technology, 2022, 185:111782.
[10] 李翠红, 冯毓琴, 魏丽娟, 等.保鲜剂对百合鳞片常温贮藏期间品质及抗氧化活性的影响[J].农产品质量与安全, 2018(3):87-91.
LI C H, FENG Y Q, WEI L J, et al.Effects of preservatives on quality and antioxidant activity of lily scales during normal temperature storage[J].Quality and Safety of Agricultural Products, 2018(3):87-91.
[11] 刘成红. 1-MCP结合真空包装双重处理对柿果贮藏保鲜效果影响的研究[D].天津:天津科技大学, 2008.
LIU C H. Studies on effects of 1-MCP treatment in combination with vacuum packing on storability of mopan persimmon[D].Tianjin: Tianjin University of Science & Technology, 2008.
[12] 谢晶, 潘家丽, 覃子倚, 等.褪黑素处理对百香果采后生理及质构特性的影响[J].保鲜与加工, 2021, 21(7):1-7.
XIE J, PAN J L, QIN Z Y, et al.Effects of melatonin treatment on physiology and texture properties of postharvest passion fruits[J]. Storage and Process, 2021, 21(7):1-7.
[13] 曾智驰, 章司晨, 石小翠, 等.野生稻近等基因系应答低温胁迫的生理生化指标分析[J].广西植物, 2021, 41(5):813-822.
ZHENG Z C, ZHANG S C, SHI X C, et al.Physiological and bio- chemical indexes of response to low temperature stress in near iso- genic lines of wild rice[J].Guihaia, 2021, 41(5):813-822.
[14] 余丽梅, 向平, 叶丽娟, 等.四种水果中还原糖含量的测定与分析[J].广东化工, 2021, 48(16):243-244;248.
YU L M, XIANG P, YE L J, et al.Determination and analysis of reducing suger in four kinds of fruits[J].Guangdong Chemical Industry, 2021, 48(16):243-244;248.
[15] 曲春香, 沈颂东, 王雪峰, 等.用考马斯亮蓝测定植物粗提液中可溶性蛋白质含量方法的研究[J].苏州大学学报(自然科学版), 2006, 22(2):82-85.
QU C X, SHEN S D, WANG X F, et al.Method research of measuring soluble protein contents of plant rough extraction using Coomassie Brilliant Blue[J].Journal of Suzhou University (Natural Science Edition), 2006, 22(2):82-85.
[16] 曹建康, 姜微波, 赵玉梅.果蔬采后生理生化实验指导[M]. 北京:中国轻工业出版社, 2007.
CAO J K, JIANG W B, ZHAO Y M.Physiological and Biochemical Experiment Guidance of Postharvest Fruits and Vegetables[M].Beijing:China Light Industry Press, 2007.
[17] 刘银萍. ‘洛阳红’花期花瓣抗氧化酶SOD、POD和CAT活性的研究[J].河南林业科技, 2020, 40(3):13-15;41.
LIU Y P.The Study of antioxidants of ‘ Luoyanghong’ on petals about SOD, POD, and CAT during florescences[J].Journal of Henan Forestry Science and Technology, 2020, 40(3):13-15;41.
[18] 陈启镌, 廖文彬.绿豆富硒过程中超氧化物歧化酶活性变化研究[J].现代食品, 2021(7):192-196.
CHEN Q J, LIAO W B.Study on the changes of superoxide dismutase activity in mung bean during selenium enrichment[J].Modern Food, 2021(7):192-196.
[19] 郑天闻, 徐婷婷, 范亚苇, 等.莲子多酚氧化酶的酶学性质[J].食品工业科技, 2014, 35(2):162-165;170.
ZHENG T W, XU T T, FAN Y W, et al.Enzymatic properties of polyphenol oxidase from lotus seed[J].Science and Technology of Food Industry, 2014, 35(2):162-165;170.
[20] 刘芳, 赵金红, 朱明慧, 等.多酚氧化酶结构及褐变机理研究进展[J].食品研究与开发, 2015, 36(6):113-119.
LIU F, ZHAO J H, ZHU M H, et al.Advances in research of the structure and browning mechanism of polyphenol oxidase[J].Food Research and Development, 2015, 36(6):113-119.
[21] 许晓春, 林朝朋, 徐齐钻.几种保鲜剂处理对切分莲藕贮藏效果的影响[J].北方园艺, 2008(2):242-244.
XU X C, LIN C P, XU Q Z.Effects of several antistaling agents treatment on storage of fresh-cut lotus roots[J].Northern Horticulture, 2008(2):242-244.
[22] 许金蓉, 周俊斌, 王清章, 等.不同品种莲藕生理生化特性研究[J].现代食品科技, 2003, 19(4):24-27.
XU J R, ZHOU J B, WANG Q Z, et al.Study on the biochemistry and physiology of different kinds lotus root[J].Modern Food Science & Technology, 2003, 19(4):24-27.
[23] 张桂.果蔬采后呼吸强度的测定方法[J].理化检验(化学分册), 2005(8):596-597.
ZHANG G.Method of determination of respiration strength for vegetables and fruits after reaping[J].Physical Testing and Chemical Analysis Part B:Chemical Analysis, 2005(8):596-597.