我国是肉类生产和消费的第一大国,2020年中国猪肉进口量为480 万t,占全球猪肉进口总量的46.31%[1] 。其中猪肉肉糜类食品因其加工方式简便、营养可口、方便使用而得到人们的青睐。但是冷藏猪肉糜在加工、贮藏、运输、销售过程中,难免会受到诸多因素的影响,使得猪肉糜氧化变质。其中脂肪和蛋白氧化是影响肉及其肉制品品质的2个重要因素,脂肪氧化更是会导致猪肉变色、产生异味和有毒物质[2-3]。
冷藏是肉与肉制品常用的有效贮藏方式,但肉在冷藏时大部分化学反应仍旧活跃,因此如何减少贮藏过程中肉糜的氧化显得极为重要。目前合成类抗氧化剂,例如丁基羟基茴香醚(butyl hydroxy anisd,BHA)、没食子酸丙酯(propyl gallate, PG)、特丁基对苯二酚(tert-butylhydroquinone, TBHQ)、三羟基苯丁酮(three-handshake broadcast protocol, THBP)和丁基化羟基甲苯(butylated hydroxytoluene, BHT) 已经被广泛应用为肉类工业中脂质和蛋白质的抗氧化剂[4] 。但是长期食用合成类抗氧化剂会对人体产生基因毒性效应。有研究报道,人工合成抗氧化剂对人体具有潜在危害,例如致癌、致畸等[5-6]。随着人们生活水平的提高和健康意识的增强,绿色天然食品日益受到消费者的青睐。因此天然抗氧化剂取代人工合成抗氧化剂已成为研究热点和发展趋势[7-8] 。以植物多酚作为天然抗氧化剂代表,研究其诱导调控肌肉蛋白氧化及对功能特性的影响已成为肉品科学技术领域的研究热点。植物多酚具有优良的抗菌、抗炎和抗氧化等生理功效,广泛存在于中草药、香辛料、水果蔬菜、果皮果渣等农产品及其加工副产物中[9] ,因而备受关注。现有研究表明,在肉制品加工与贮藏过程中,植物多酚具有抑制脂肪氧化,调控肉蛋白氧化程度进而影响蛋白功能特性的作用[4,10] 。
马齿苋(Portulaca oleracea L.)为马齿苋科马齿苋属一年生肉质草本植物,是一种传统的野菜和药食同源的植物[11] 。WANG等[12]将马齿苋提取物(Purslane extract, PE) 应用于冷藏兔肉糜中,发现马齿苋提取物是一种优良的自由基清除剂,具有较好的抗氧化能力,也可以抑制油脂的氧化酸败。但目前对马齿苋研究集中在其多糖的提取分离纯化以及马齿苋多糖的抗氧化、降糖作用。马齿苋提取物对于肉及肉制品脂肪和蛋白质的影响非常复杂,直接将马齿苋提取物应用于肉及肉制品抗氧化和提高产品质量的研究甚少,对于内在机理尚未明晰,缺乏深入研究。因此本研究拟以猪肉糜为研究对象,以马齿苋提取物对肉脂肪和蛋白质氧化抑制作用为切入点,通过测定猪肉饼的硫代巴比妥酸(thiobarbituric acid,TBA)值、羰基、巯基含量等指标,探讨其对脂肪、蛋白氧化的影响,为肉制品的贮藏保鲜提供理论依据。
1 材料与方法
1.1 材料与仪器
新鲜猪背最长肌购于重庆市南岸区五公里人人乐超市;马齿苋提取物(纯度98%)购于常青藤生物工程有限公司。
BHA(纯度98%)、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA,AR)、3,6-二氧杂-1,8-辛二胺四乙酸[ethylenebis(oxyethylenenitrilo)tetraacetic acid,EGTA,AR],阿拉丁试剂有限公司;溴酚蓝(AR),重庆川东化工(集团)有限公司;异丙醇(AR)、焦性没食子酸、石油醚、氢氧化钾、三氯乙酸(AR)、甘氨酸(AR)、乙醚(AR)、氯化镁(AR),成都市科隆化学品有限公司;2-硝基苯甲酸(2-nitrobenzoic acid, DTNB, AR)、2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH, AR)、哌嗪-1, 4-二乙磺酸(piperazine-1, 4-bisethanesulfonic acid,PIPES,AR),上海泰坦化学有限公司;三羧甲基氨基甲烷(AR),兰杰柯科技有限公司。
TDZ5-WS多管架自动平衡离心机、TDZ4-WS低速台式离心机,长沙湘仪离心机仪器有限公司;HH-S11-1-S电热恒温水浴锅,上海龙跃仪器设备有限公司;CR400色差仪,日本美能达公司生产;Ultra-Turrax T25高速匀浆器,德国IKA-WERKE;TA-XTplus质构仪,英国stable Micro System公司;UV-1900紫外可见分光光度计,翱艺仪器(上海)有限公司;DGG-9070A电热恒温鼓风干燥箱,上海齐欣科学仪器有限公司;pHS-3C+酸度计,成都世纪方舟科技有限公司;KQ3200DE数控超声波清洗机,昆山市超声仪器有限公司;DZ47-60D16高速冷冻离心机,四川蜀科仪器有限公司。
1.2 实验方法
1.2.1 样品处理
将新鲜猪肉洗净去皮,剔除可见的结缔组织,并将肥肉与瘦肉分开,用吸水纸将表面的水吸干,切成小条,按照瘦肉与肥肉质量比2∶1,放入粉碎机中,同时按照配方加入马齿苋提取物溶液,混合均匀绞成肉糜。随机分为5组,第1组为空白对照组(不添加任何抗氧化剂),第2、3、4组分别添加0.2、0.4、0.8 g/kg马齿苋提取物,第5组添加0.8 g/kg BHA作为阳性对照。混匀后,称取肉糜约50 g,制成(直径为8 cm、厚度1 cm)肉饼,用保鲜膜封好,放置于冰箱中冷藏(4 ℃),并在1、3、6、9 d测定各项指标。
1.2.2 TBA值测定
参照JONGBERG等[13]的方法,并做适当修改。称取5 g猪肉糜,置于100 mL烧杯中,倒入15 mL混合溶液(含7.5%三氯乙酸、0.1%没食子酸和0.1%EDTA,质量分数),用均质匀浆机进行均质60 s(4 500 r/min),再将混合液转移到塑料离心管中,离心(5 min,4 500 r/min,4 ℃),3层纱布过滤,去沉淀,取上清液;将2.5 mL滤液和2.5 mL配制好的0.02 mol/L TBA液一起加入10 mL试管中,沸水浴中反应50 min,取出试管冷却,产生颜色反应,静置分层后用紫外可见分光光度计在532 nm和600 nm处测定吸光值。TBA值计算如公式(1)所示:
TBA值![]()
(1)
式中:A532,532 nm处吸光度;A600,600 nm处的吸光值;V,上清液体积,mL;M,丙二醛的摩尔质量,72 g/mol;m,样品质量,g;l,光程,1 cm;ε,摩尔消光系数,156 000 L/(mol·cm)。
1.2.3 肌原纤维蛋白的提取
参照熊杰等[8]的研究方法进行,适当进行修改。在贮藏期内,称取7 g相应贮藏时期的冷藏猪肉糜于烧杯中,向其加入4倍体积的蛋白提取液(pH 6.0的20 mmol/L磷酸缓冲液,1 mmol/L EDTA、0.1 mol/L NaCl和2 mmol/L MgCl2)进行均质,时间为60 s。利用高速冷冻离心机在4 ℃、4 500 n/min条件下离心15 min,舍去上清液,留下沉淀,再加入4倍体积的蛋白提取液,重复同样的步骤3次,此时获得的蛋白沉淀,再加入4倍体积洗液(0.1 mol/L NaCl,4 ℃),进行均质60 s,用3层纱布过滤掉匀浆中的不溶性肌纤维,再次冷冻离心。此时获得的膏体即为肌原纤维蛋白样品,将其保存于离心管中,冰箱内冷藏(4 ℃)保存,并在48 h内用完。
1.2.4 羰基含量的测定
参照熊杰等[14]的研究方法,并稍作修改。室温下,称取蛋白膏1.000 g,溶于25 mL的15 mmol/L PIPES缓冲液,制备为40 mg/mL蛋白液。取40 mg/mL蛋白液2 mL和4 mL的10 mmol/L DNPH(溶解于2 mol/L HCl)于塑料离心管中。空白对照组则加入2 mL 蛋白液和4 mL的2 mol/L的HCl溶液。在恒温培养箱中,37 ℃避光反应1 h,每隔15 min漩涡1次。之后,加入5 mL的20%(质量分数)三氯乙酸溶液,终止反应并且沉淀蛋白,静置5 min 后,置于多管架离心机中离心10 min(4 000 r/ min)。倒掉上清液,留下沉淀,加入10 mL洗色液[V(乙醇)∶V(乙酸乙酯)=1∶1],充分洗涤,于离心机中离心10 min(4 000 r/min),倒掉上清液,留下沉淀,重复3 次,用以除去未反应试剂(DNPH)。充分洗涤3 次后,去上清液,在空气中挥干洗色液。最后加入5 mL 6 mol/ L 盐酸胍溶液(溶于20 mmol/L NaH2PO4,pH 2.3)溶解所得到的沉淀,37 ℃ 避光反应15 min。所得溶液置于离心机中于离心10 min(4 000 r/min,25 ℃),取上清液,于370 nm处测定吸光值。计算如公式(2)所示:
羰基含量![]()
(2)
式中:A370,处理组在370 nm下的吸光值;A0,对照组在370 nm下的吸光值;ε,摩尔消光系数,22.0mL/(mmol·cm);d,比色光径,1 cm;C,蛋白质量浓度,mg/mL;V反总,盐酸胍体积,mL;V样,样液体积,mL。
1.2.5 总巯基含量的测定
参照ZHANG等[15]的研究方法,并稍作修改。配制Tris-甘氨酸溶液(含10.4 g/L Tris、0.9 g/L甘氨酸、1.2 g/L EDTA)备用。量取1 mL的40 mg/mL蛋白液和7 mL的1%(质量分数)NaCl(用Tris-甘氨酸溶解)配制质量浓度为5 mg/mL的蛋白液。取0.5 mL 的5 mg/mL蛋白液、5 mL的1.5%(质量分数)十二烷基硫酸钠(sodium dodecyl sulfate,SDS)溶液(用Tris-甘氨酸溶解)和0.5 mL Ellman′s 试剂于10 mL离心管中,充分混匀,避光反应15 min(25 ℃),设定波长为412 nm测定吸光值。计算如公式(3)所示:
总巯基含量![]()
(3)
式中:A,样品412 nm处吸光度;DF,稀释倍数;ε,摩尔吸光系数,13 600 L/(mol·cm);L,光程,cm;ρ,蛋白质量浓度,mg/mL。
1.2.6 表面疏水的测定
参照CHELH等[16]的研究方法,略作修改。取3 mL 40 mg/mL蛋白液和21 mL 20 mmol/L磷酸缓冲溶液(pH 7.0)配制5 mg/mL的蛋白液,取配制后的蛋白溶液5 mL加入50 μL溴酚蓝(1 mg/mL),混匀,离心10 min(4 000 r/min),倒出上清液,在595 nm处测定吸光值。同时设立空白对照组(未添加5 mg/mL的蛋白液,添加5 mL 20 mmol/L磷酸缓冲溶液,加入50 μL 溴酚蓝为,与样品组同样混匀,离心,测定吸光度)。计算如公式(4)所示:
溴酚蓝结合量![]()
(4)
式中:A对照,对照组吸光值;A样品,样品组吸光值。
1.2.7 色泽的测定
使用手持色差仪测定肉糜的颜色,先对手持色差仪进行白板校正,然后随机在样品上测定3 次,记录L*(亮度)、a*(红度)、b*(黄度)3组数据。
1.2.8 肉糜质构测定
将猪肉糜整合为5 cm3小方块,利用全质构分析模式对猪肉糜进行质构测试,质构参数设定参照彭新颜等[3]的方法稍作修改:测试前速度为2.0 mm/s,测试中速度为1.0 mm/s,测试后速度为1.0 mm/s,距离样品初始距离为10 mm,压缩比为75% ,时间为5 s,使用全质构分析模式,2次挤压循环。每组均设置3个平行组别。
1.3 数据分析处理
对每个测定指标进行3次平行实验,即重复测定3次,用SPSS 26.0统计分析软件进行分析数据以及计算显著差异性(P<0.05),比较各个浓度之间的差异性,实验结果用平均值±标准差![]() 表示,最后用Origin软件绘图。
表示,最后用Origin软件绘图。
2 结果与分析
2.1 马齿苋提取物对冷藏猪肉糜TBA 值的影响
不同马齿苋提取物添加量对冷藏猪肉糜TBA值的影响如图1所示。
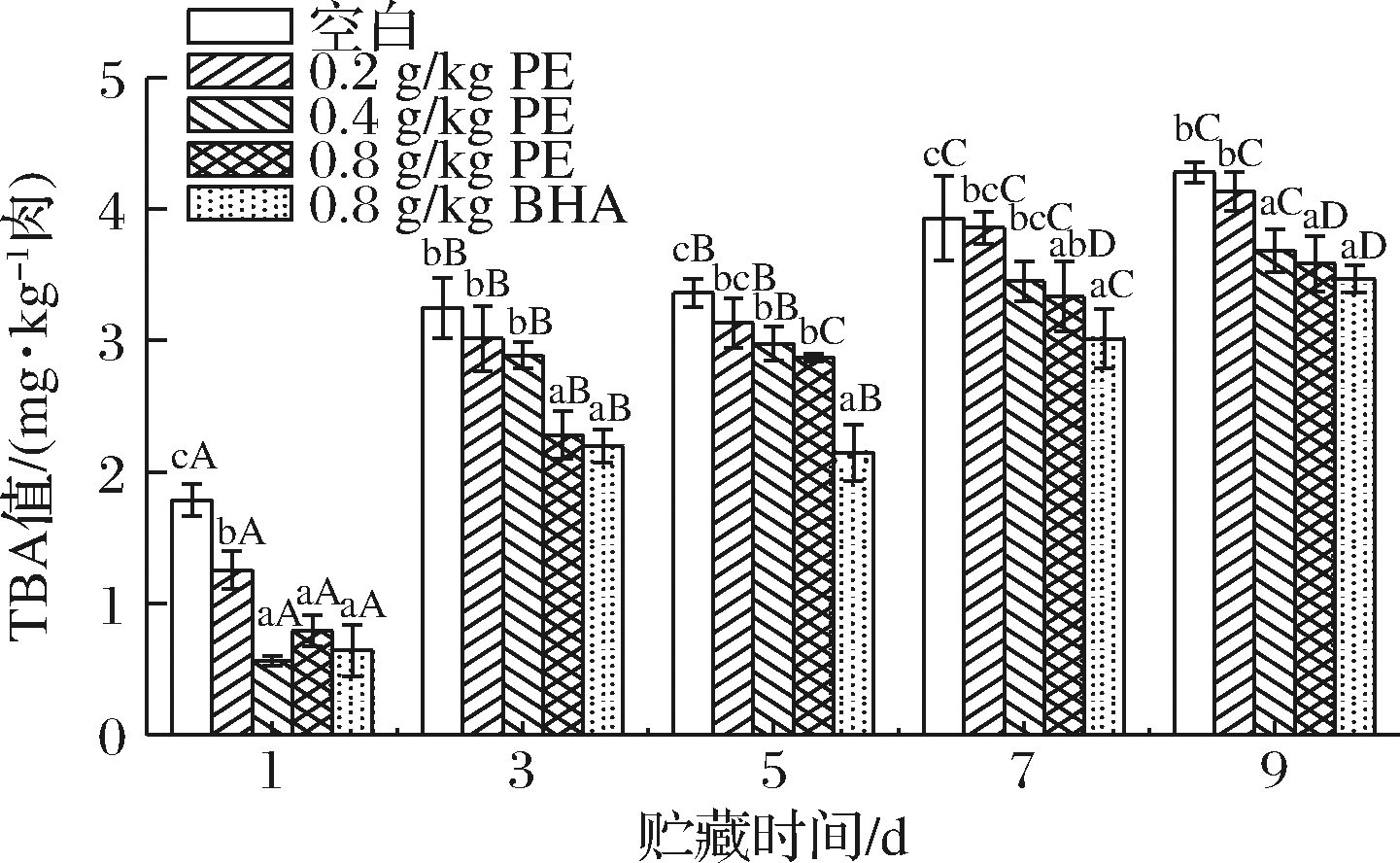
图1 马齿苋提取物对冷藏猪肉糜TBA值的影响
Fig.1 Effect of PE on TBA value of chilled minced pork
注:大写字母不同表示同一处理组不同冷藏时间差异显著(P<0.05);小写字母不同表示同一冷藏时间不同处理组差异显著(P<0.05)(下同)
由图1可知,随着贮藏时间的延长,所有组的TBA值均上升。同时也可以看出添加马齿苋提取物和BHA的实验组可以使TBA值增加幅度降低。空白组TBA值由1.78 mg/kg上升到4.33 mg/kg,说明猪肉糜随着时间的延长而发生脂肪氧化,丙二醛含量也不断升高。9 d时,0.4、0.8 g/kg马齿苋提取物组和BHA组的TBA值显著小于空白组(P<0.05),说明马齿苋提取物和BHA能够显著抑制猪肉糜脂肪氧化,减少丙二醛的生成,且马齿苋提取物组抑制脂肪氧化的作用呈剂量依赖性。其原因可能是马齿苋中含有丰富的多酚、黄酮类物质,能清除自由基,有较强抗氧化活性[7]。0.4、0.8 g/kg马齿苋提取物组和BHA组猪肉糜的TBA值在9 d时差异不显著(P>0.05),但显著低于空白组,说明马齿苋提取物能够有效缓解TBA的增长,并且浓度越高抑制效果越明显。这与CUNHA等[17]的研究结果相似,植物提取物能有效抑制TBA的增长,XU等[18]研究表明白藜芦醇可以缓解鱼油乳清分离蛋白乳剂中脂质和蛋白质的共氧化。
2.2 马齿苋提取物对冷藏猪肉糜羰基的影响
不同添加量马齿苋提取物对冷藏过程中猪肉糜羰基含量的影响,如图2所示。

图2 马齿苋提取物对冷藏猪肉糜羰基含量的影响
Fig.2 Effect of PE on carbonyl content of chilled minced pork
羰基含量的多少是衡量蛋白质氧化程度高低的重要指标,蛋白氧化程度越高,羰基含量也随之升高。由图2可知,空白组和处理组的羰基含量都随着贮藏时间的延长不断上升,说明猪肉糜在冷藏期间蛋白氧化越来越严重。空白组由0.099 4 nmol/mg显著上升到0.726 8 nmol/mg,说明易受到自由基攻击的带有—NH或—NH2的氨基酸侧链及肽键断裂,产生羰基及其衍生物[3]。7~9 d,空白组羰基含量显著上升,说明此时蛋白氧化程度加剧,该现象与脂肪氧化剧烈程度有关,自由基随着脂肪氧化程度的增高而升高,自由基攻击蛋白质的机率也就越大,进而羰基含量上升[19]。而马齿苋提取物组和BHA组增长幅度显著小于空白组(P<0.05),增长率在0.59%~0.84%内,说明马齿苋提取物和BHA具有一定抑制蛋白质氧化的能力,并在一定添加量范围内,马齿苋提取物对蛋白氧化的抑制率与其添加量呈正相关,可能是因为马齿苋提取物含有大量的多酚类化合物,而植物多酚可以作为自由基、活性物质和非自由基衍生物的清除剂以及过渡金属的螯合剂[20],进而缓解蛋白质的氧化。在1~9 d,马齿苋提取物处理组的羰基含量都显著高于BHA,由此也说明马齿苋提取物对于缓解蛋白氧化的作用不及BHA。
2.3 马齿苋提取物对冷藏猪肉糜总巯基的影响
蛋白质的氧化会导致巯基含量的减少,因此巯基含量的测定也是描述蛋白氧化程度的一个重要指标。由图3可知,冷藏猪肉糜的巯基含量随着冷藏时间的延长减少。空白组由最初的20.45 nmol/mg,下降至10.15 nmol/mg,说明蛋白质内部的巯基基团被氧化成非二硫键,贮藏时间延长,氧化加剧,巯基损失严重或巯基与巯基之间的共价交联产生二硫键,从而导致巯基基团的减少[21]。这可能是由于在复杂的Fenton氧化体系中,铁催化产生的氧自由基(超氧阴离子自由基、羟自由基和过氧化氢自由基),以及脂质氧化产生的自由基(L·、LO·、LOO·)通过氧化巯基形成二硫键进而减少其含量[3]。并且从图3可以看出,马齿苋和BHA处理的肌原纤维蛋白的巯基含量都高于空白组,但是BHA显著高于马齿苋处理组。说明,马齿苋同BHA一样,可以有效抑制巯基含量的损失,但马齿苋的抑制能力不及BHA,该结果与徐谓[22]的研究结果一致,该研究发现甘草提取物具有保护巯基减少的能力。贮藏时间为1、3、9 d时,0.8 g/kg马齿苋提取物的巯基含量低于0.2、0.4 g/kg马齿苋提取物组,但是差异不显著(P>0.05)。当贮藏时间达到9 d时,BHA组与马齿苋处理组的巯基含量均显著高于空白组(P<0.05),说明马齿苋提取物可以降低巯基的损失速度,且在贮藏初期低添加量马齿苋提取物效果优于高添加量,在贮藏后期不同添加量间无显著性差异。

图3 马齿苋提取物对冷藏猪肉糜巯基的影响
Fig.3 Effect of PE on sulfhydryl group content of chilled minced pork
2.4 马齿苋提取物对冷藏猪肉糜表面疏水性的影响
表面疏水性是蛋白质疏水性氨基酸残基分布的一个重要特征,蛋白质表面疏水性的增加,是由于蛋白质分子内部原有疏水基团暴露增多,或者是氧化过程中引入了疏水组分。通常以与溴酚蓝的结合量来反映表面疏水性的变化程度。由图4可知,空白组与各处理组的溴酚蓝含量随着时间的延长而增加。空白组溴酚蓝含量由第1天的8.45 μg显著上升到第9天的54.68 μg,说明表面疏水性随着贮藏时间的延长而逐步增加,这与贾娜等[23-24]的研究一致。在贮藏期间,马齿苋提取物与BHA处理组的猪肉糜的表面疏水性显著低于空白组(P<0.05),说明在贮藏期间,马齿苋和BHA可以降低疏水性基团的暴露,降低表面疏水性增加的程度,并在一定添加量范围内,马齿苋提取物缓解蛋白质表面疏水性增加的能力与其添加量呈正相关。在第5、7、9天时,BHA处理组的蛋白质表面疏水性低于0.8 g/kg马齿苋提取物,但差异不显著(P>0.05),说明马齿苋提取物与BHA抑制蛋白质表面疏水性增加的能力相当,但两者均不能完全抑制猪肉糜蛋白质表面疏水性的增加。有研究表明,天然多酚类物质与膳食蛋白质的共价与非共价结合可以降低表面疏水性,结合位点主要是蛋白质暴露出的疏水表面,酚类化合物与之结合,可以减少自由基对蛋白质的攻击[25]。马齿苋提取物能够降低猪肉糜蛋白表面疏水性可能是因为马齿苋提取物中含有大量的酚类物质,与蛋白质相互作用,减少了疏水性基团的暴露,从而降低了蛋白质表面疏水性的升高程度。

图4 马齿苋提取物对冷藏猪肉糜表面疏水的影响
Fig.4 Effect of PE on surface hydrophobicity of chilled minced pork
2.5 马齿苋提取物对冷藏猪肉糜色泽的影响
不同添加量马齿苋提取物对冷藏过程中猪肉糜色泽的影响如图5~图7所示。
由图5可知,随着时间的延长,空白组与各处理组的亮度值均出现了先下降后上升趋势。出现该现象的原因可能是贮藏初期,猪肉糜表面水分不断蒸发,光泽度下降,所以L*下降[24];随着时间的延长,猪肉糜开始发生氧化反应,蛋白质的持水能力开始降低,导致猪肉糜内部的水分开始溢出,浮于表面,因此光的折射度增加,从而L*上升。9 d时,马齿苋、BHA处理组的L*值显著小于空白组(P<0.05),说明两者均可以有效提高蛋白质的持水性,减少水分损失并且中等添加量的马齿苋提取物的效果最佳。

图5 马齿苋提取物对冷藏猪肉糜L*的影响
Fig.5 Effect of PE on L* of chilled minced pork

图6 马齿苋提取物对冷藏猪肉糜a*的影响
Fig.6 Effect of PE on a* of chilled minced pork
a*的变化受肉糜中肌红蛋白含量的影响,可以用其表征肌红蛋白的氧化程度。从图6可以看出,随着贮藏时间的延长,a*逐渐下降。空白组由贮藏初期的20.24下降到9 d的11.73,说明猪肉糜中的肌红蛋白逐渐发生氧化成高铁肌红蛋白从而加深了肉糜的颜色,致使猪肉糜颜色变暗,a*下降。在贮藏3、5、7、9 d时,马齿苋提取物处理组的a*均显著高于空白组与BHA组(P<0.05),说明马齿苋提取物具有防止肌红蛋白被氧化的能力,效果强于BHA,且抑制能力与其添加量呈负相关。可能是由于马齿苋提取物含有多酚、黄酮等活性物质,能阻止与肌红蛋白结合的脂质过氧化基,防止肌红蛋白的氧化,而添加量过高可能更易发生分子间的共价或非共价反应,导致其抗氧化能力减弱。
如图7所示,空白组b*由1 d的6.11上升到9 d的6.59,说明蛋白质分子发生变性、脂肪发生氧化会引起了b*值的上升。空白组与各处理组的b*值随贮藏时间的延长均呈现不同程度的上升趋势,但是上升趋势不明显(P>0.05)。在贮藏后期,空白组b*值大于马齿苋提取物和BHA处理组,但无显著差异(P>0.05),说明马齿苋提取物和BHA可以抑制b*值上升但作用并不是很明显。

图7 马齿苋提取物对冷藏猪肉糜b*的影响
Fig.7 Effect of PE on b* of chilled minced pork
2.6 马齿苋提取物对冷藏猪肉糜质构的影响
猪肉的硬度、弹性、黏聚性、咀嚼性是检验肉糜品质变化的重要指标。由表1可知,空白组与各处理组的硬度随着时间的延长都呈现上升趋势,说明蛋白质氧化会导致肉的持水性下降,使肉的凝胶结构发生变化,肉质逐渐变硬,这与彭新颜等[3]的结论一致。并且空白组的硬度显著高于添加马齿苋提取物或BHA的实验组(P<0.05),说明马齿苋提取物与BHA可以抑制肉质变硬。不同添加量马齿苋提取物的实验组相比可以看出,马齿苋提取物对抑制肉质变硬的能力与马齿苋浓度呈反比。
由表1可知,猪肉糜的弹性和黏聚性均随着时间延长而下降,这与彭新颜等[3]的结论一致。有研究表明,脂肪的氧化反应,会损害蛋白质,造成蛋白质氧化,从而使蛋白质的凝胶结构变化,最终猪肉糜的肉质变得松散,引起了弹性和黏聚性下降[3]。贮藏9 d,马齿苋提取物处理组的弹性与空白组弹性差异并不显著(P>0.05),但马齿苋处理组黏聚性与空白组差异却很显著(P<0.05),说明马齿苋提取物减缓猪肉糜弹性降低的作用不突出,但具有减缓肉糜黏聚性降低的作用。
咀嚼性大致为硬度、弹性以及黏聚性的乘积,它可以综合反映肉质的感官品质。由表1可以看出,贮藏时间越长,咀嚼性越低。贮藏9 d,BHA组咀嚼性最高,其次是0.8 g/kg马齿苋提取物组,且显著高于空白组(10.1)(P<0.05),说明马齿苋提取物可以显著减缓咀嚼性降低的能力。
表1 马齿苋提取物对冷藏猪肉糜质构的影响
Table 1 Effect of PE on texturalproperties of chilled minced pork
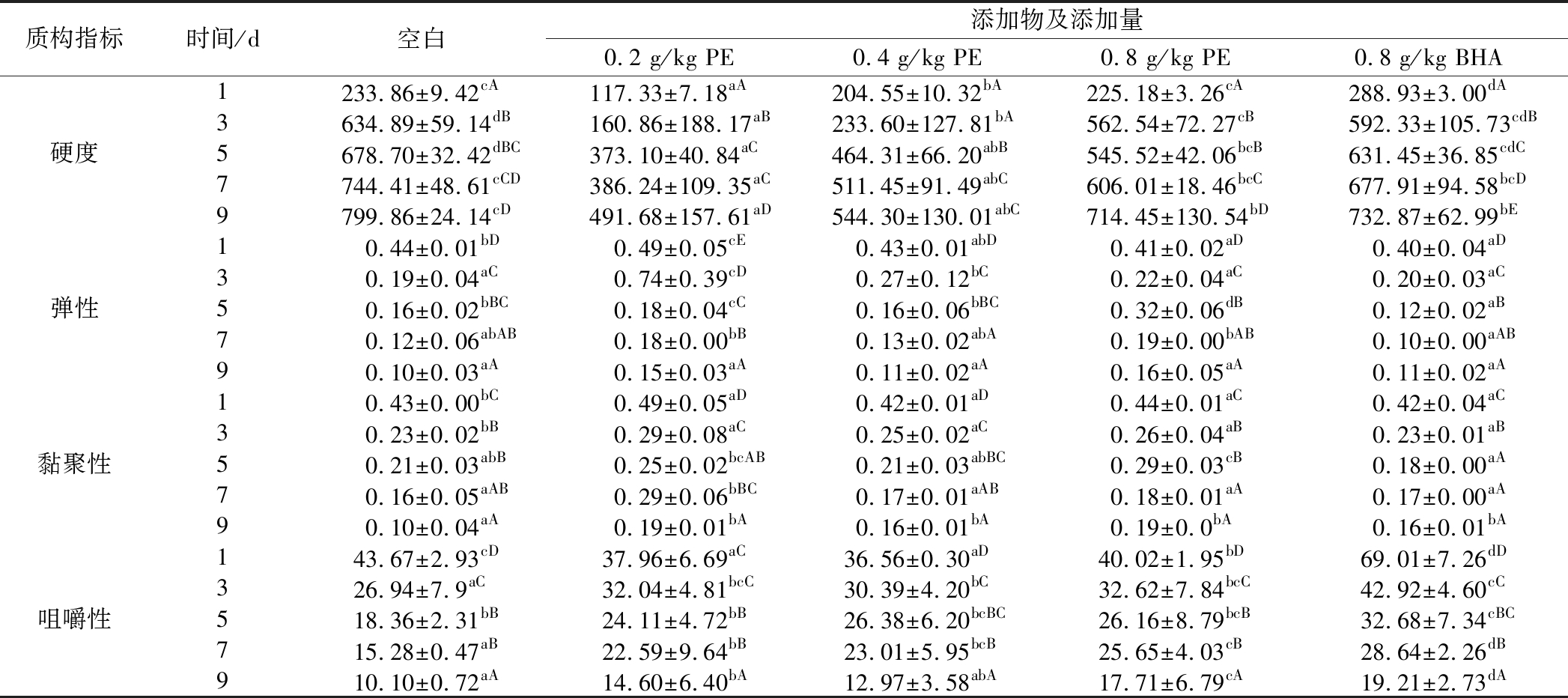
质构指标时间/d空白添加物及添加量0.2 g/kg PE0.4 g/kg PE0.8 g/kg PE0.8 g/kg BHA1233.86±9.42cA117.33±7.18aA204.55±10.32bA225.18±3.26cA288.93±3.00dA3634.89±59.14dB160.86±188.17aB233.60±127.81bA562.54±72.27cB592.33±105.73cdB硬度5678.70±32.42dBC373.10±40.84aC464.31±66.20abB545.52±42.06bcB631.45±36.85cdC7744.41±48.61cCD386.24±109.35aC511.45±91.49abC606.01±18.46bcC677.91±94.58bcD9799.86±24.14cD491.68±157.61aD544.30±130.01abC714.45±130.54bD732.87±62.99bE10.44±0.01bD0.49±0.05cE0.43±0.01abD0.41±0.02aD0.40±0.04aD30.19±0.04aC0.74±0.39cD0.27±0.12bC0.22±0.04aC0.20±0.03aC弹性50.16±0.02bBC0.18±0.04cC0.16±0.06bBC0.32±0.06dB0.12±0.02aB70.12±0.06abAB0.18±0.00bB0.13±0.02abA0.19±0.00bAB0.10±0.00aAB90.10±0.03aA0.15±0.03aA0.11±0.02aA0.16±0.05aA0.11±0.02aA10.43±0.00bC0.49±0.05aD0.42±0.01aD0.44±0.01aC0.42±0.04aC30.23±0.02bB0.29±0.08aC0.25±0.02aC0.26±0.04aB0.23±0.01aB黏聚性50.21±0.03abB0.25±0.02bcAB0.21±0.03abBC0.29±0.03cB0.18±0.00aA70.16±0.05aAB0.29±0.06bBC0.17±0.01aAB0.18±0.01aA0.17±0.00aA90.10±0.04aA0.19±0.01bA0.16±0.01bA0.19±0.0bA0.16±0.01bA143.67±2.93cD37.96±6.69aC36.56±0.30aD40.02±1.95bD69.01±7.26dD326.94±7.9aC32.04±4.81bcC30.39±4.20bC32.62±7.84bcC42.92±4.60cC咀嚼性518.36±2.31bB24.11±4.72bB26.38±6.20bcBC26.16±8.79bcB32.68±7.34cBC715.28±0.47aB22.59±9.64bB23.01±5.95bcB25.65±4.03cB28.64±2.26dB910.10±0.72aA14.60±6.40bA12.97±3.58abA17.71±6.79cA19.21±2.73dA
注:大写字母不同表示同一处理组不同冷藏时间差异显著(P<0.05);小写字母不同表示同一冷藏时间不同处理组差异显著(P<0.05)
3 结论
空白组的猪肉糜在贮藏过程中(4 ℃,9 d),TBA值由1.78 mg/kg显著上升到4.33 mg/kg,而马齿苋提取物与BHA显著降低了脂肪氧化程度;空白组猪肉糜蛋白质羰基含量与巯基含量在贮藏过程中显著上升或下降,马齿苋提取物与BHA组在贮藏后期,可以有效减少羰基含量上升并有效降低巯基含量的损失;空白组猪肉糜的表面疏水性随贮藏时间的延长而增大,马齿苋提取物与BHA可以减少表面疏水性增加的程度;在猪肉糜色泽方面,在贮藏后期,马齿苋提取物的L*值显著低于空白组,a*值显著高于空白组。因此不同添加量的马齿苋提取物的添加能产生与BHA 类似的作用。因此,马齿苋提取物可作为一种天然的抗氧化剂添加到肉及肉制品中,并且其作用效果呈浓度依赖性,除了对L*值影响是中添加量马齿苋提取物优于低添加量和高添加量外,其他指标均表明,不管是贮藏初期还是后期,高添加量马齿苋提取物效果均优于中添加量与低添加量提取物。实际应用中要根据所考虑指标,进行添加量上的选择,这样才能最大程度上发挥马齿苋提取物抑制肉制品脂肪和蛋白氧化的作用,有效改善猪肉糜品质特性。
[1] 张海峰, 温春燕, 李慧琪.2020 年世界生猪产业发展情况及2021 年趋势[J].猪业科学, 2021, 38(2):34-38.
ZHANG H F, WEN C Y, LI H Q.Development of world pig industry in 2020 and its market trend in 2021 [J].Swine Industry Science, 2021, 38(2):34-38.
[2] CHENG W W, SUN D W, PU H B, et al.Heterospectral two-dimensional correlation analysis with near-infrared hyperspectral imaging for monitoring oxidative damage of pork myofibrils during frozen storage[J].Food Chemistry, 2018, 248:119-127.
[3] 彭新颜, 刘媛, 贺红军, 等.乳清多肽对抑制反复冻融猪肉糜氧化和改善品质的影响[J].食品科学,2020, 41(4):7-14.
PENG X Y, LIU Y, HE H J, et al.Effects of whey protein peptides on oxidation inhibition and quality improvement of chopped pork during repeated freezing-thawing [J].Food Science,2020, 41(4):7-14.
[4] JIANG J, XIONG Y L.Natural antioxidants as food and feed additives to promote health benefits and quality of meat products:A review [J].Meat Science, 2016, 120:107-117.
[5] 曹云刚. 植物多酚对肉蛋白氧化稳定性和功能特性的影响机理及应用[D].无锡:江南大学, 2016.
CAO Y G.Effect of plant-derived polyphenols on oxidative stability and functional properties of meat protein:Mechanism and application [D].Wuxi:Jiangnan University, 2016.
[6] 郝教敏, 杨文平, 靳明凯, 等.黑麦多酚提取物对猪肉丸冷藏期间氧化稳定性和品质的影响[J].食品科学,2020,41(9):175-181.
HAO J M, YANG W P, JIN M K, et al.Effect of rye polyphenol extract on oxidative stability and quality of pork meatballs during refrigerated storage [J].Food Science,2020,41(9):175-181.
[7] KARRE L, LOPEZ K, GETTY K J K.Natural antioxidants in meat and poultry products [J].Meat Science, 2013, 94(2):220-227.
[8] 熊杰, 伯朝英, 常海军, 等.鼠曲草提取物对·OH诱导的肌原纤维蛋白氧化及结构的影响[J].食品工业科技,2022,43(3):72-80.
XIONG J, BO Z Y, CHANG H J, et al.Effects of the extract of Gnaphalium affine on the oxidation and structure of myofibrillar protein induced by ·OH[J].Science and Technology of Food Industry,2022, 43(3):72-80.
[9] SHAHIDI F, AMBIGAIPALAN P.Phenolics and polyphenolics in foods, beverages and spices:Antioxidant activity and health effects—A review[J].Journal of Functional Foods, 2015, 18:820-897.
[10] GUO A Q, JIANG J, TRUE A D, et al.Myofibrillar protein cross-linking and gelling behavior modified by structurally relevant phenolic compounds [J].Journal of Agricultural and Food Chemistry, 2021, 69(4):1 308-1 317.
[11] 贺江飞. 马齿苋[J].湖南中医杂志,2021,37(8):96.
HE J F.Purslane[J].Journal of Hunan Traditional Chinese Medicine, 201,37(8):96.
[12] WANG Z F, HE Z F, ZHANG D, et al.Antioxidant activity of purslane extract and its inhibitory effect on the lipid and protein oxidation of rabbit meat patties during chilled storage[J].Journal of the Science of Food and Agriculture, 2021, 101 (5):1 953-1 962.
[13] JONGBERG S, TØRNGREN M A, GUNVIG A, et al.Effect of green tea or rosemary extract on protein oxidation in Bologna type sausages prepared from oxidatively stressed pork[J].Meat Science,2013, 93(3):538-546.
[14] 熊杰, 伯朝英, 常海军.甘草提取物对冷藏鸡肉糜脂肪和蛋白质氧化及品质特性的影响[J].食品工业科技,2021,42(1):75-81;88.
XIONG J, BO Z Y, CHANG H J.Effects of licorice extract on oxidation and quality characteristics of fat and protein in refrigerated chicken meat batter[J].Science and Technology of Food Industry,2021, 42(1):75-81;88.
[15] ZHANG Z Y, YANG Y L, ZHOU P, et al.Effects of high pressure modification on conformation and gelation properties of myofibrillar protein [J].Food Chemistry, 2017, 217:678-686.
[16] CHELH I, GATELLIER P, SANTÉ-LHOUTELLIER V.Technical note:A simplified procedure for myofibril hydrophobicity determination[J].Meat Science,2006,74(4):681-683.
[17] CUNHA L C M, MONTEIRO M L G, LORENZO J M, et al.Natural antioxidants in processing and storage stability of sheep and goat meat products[J].Food Research International,2018,111:379-390.
[18] XU M F, LIAN Z H, CHEN X Q, et al.Effects of resveratrol on lipid and protein co-oxidation in fish oil-enriched whey protein isolate emulsions[J].Food Chemistry,2021,365:130525.
[19] JOYNER P M.Protein adducts and protein oxidation as molecular mechanisms of flavonoid bioactivity[J].Molecules (Basel, Switzerland), 2021, 26(16):5 102.
[20] KAFANTARIS I, KOTSAMPASI B, CHRISTODOULOU V, et al.Grape pomace improves antioxidant capacity and faecal microflora of lambs[J].Journal of Animal Physiology and Animal Nutrition, 2017, 101(5):e108-e121.
[21] 韩馨蕊, 李颖, 刘苗苗, 等.安石榴苷与焦磷酸钠对肌原纤维蛋白氧化稳定性及凝胶性能的影响[J].食品科学, 2022, 43(8):15-21.
HAN X R, LI Y, LIU M M, et al.Effect of punicalagin combined with sodium pyrophosphate on the oxidative stability and gel proper ties of myofibrillar protein[J].Food Science, 2022, 43(8):15-21.
[22] 徐谓. 甘草提取物的抗氧化特性及其在兔肉中的应用研究[D].重庆:西南大学,2017.
XU W.Research on antioxidant ability of licorice extracts and the application in rabbit meat [D ]. Chongqing:Southwest University, 2017.
[23] 贾娜, 刘丹, 王乐田, 等.儿茶素对冷藏猪肉糜脂肪和蛋白氧化及品质特性的影响[J].中国食品学报,2018,18 (12):210-218.
JIA N, LIU D,WANG L T, et al.Effect of catechin on lipid/protein oxidation and quality of minced pork during chilled storage [J].Journal of Chinese Institute of Food Science and Technology, 2018, 18(12):210-218.
[24] 贾娜, 孙嘉, 王乐田, 等.没食子酸对猪肉糜脂肪和蛋白氧化的抑制作用及对肉糜品质特性的影响[J].肉类研究, 2019, 33(3):1-6.
JIA N, SUN J, WANG L T, et al.Effect of gallic acid on inhibition of lipid and protein oxidation and quality of pork patties during chilled storage [J].Meat Research, 2019, 33(3):1-6.
[25] JIA J J, GAO X, HAO M H, et al.Comparison of binding interaction between β-lactoglobulin and three common polyphenols using multi-spectroscopy and modeling methods [J].Food Chemistry, 2017, 228:143-151.