郫县豆瓣是我国传统优势发酵食品,因其鲜辣醇厚、瓣粒香脆、香气浓郁,被誉为“川菜之魂”[1]。作为调味品,郫县豆瓣不仅给予人们感官上的享受,也提供了维生素、矿物质和其他营养物质,从而表现出对人体健康的有益影响[2]。2018年,郫县豆瓣及衍生产品覆盖全国超过65%的餐饮业,产值近200亿,品牌价值提升至656.36亿元[3]。在郫县豆瓣生产过程中,蚕豆曲的制备是首要且关键工序[4]。而在蚕豆曲制备过程中,原料大分子是否充分降解为小分子物质,从而为后续高盐发酵提供充足营养,决定了郫县豆瓣的整体发酵质量及生产品质。
米曲霉是一种通常含有高效且丰富水解酶系的菌种,包括淀粉酶、蛋白酶、果胶酶等,是蚕豆曲生产的关键微生物[5]。目前,郫县豆瓣蚕豆曲发酵多采用纯种米曲霉沪酿3.042,该菌株于1976年由上海酿造研究所经紫外诱变及长期驯化得到(原始菌株:米曲霉AS 3.863),生长速度快、繁殖力强、水解酶活力高却不平衡,距今已有近半个世纪的工业应用历史[6-7]。为进一步提高制曲过程曲霉活力,几十年来,科研人员从未停止过优质米曲霉菌种或菌剂的研发及获取[8-9]。TANG等[10]从传统酿造郫县豆瓣、酱油酱醅中分离筛选高产蛋白酶菌株,并使用黑曲霉QH-3和米曲霉QM-6共培养制曲有效提高蚕豆曲水解酶活力,且成曲曲香更为浓郁。刘丹等[11]采用米曲霉与红曲霉混合制作黄豆酱大曲,还原糖含量显著提高,风味物质的种类和感官评分均较纯种黄豆酱有所提升,更多有工业应用潜力的优质菌种或复合菌剂亟待开发。
本研究从传统酿造食品微生物菌种资源库中分离筛选鉴定2株具有优良发酵特性的曲霉菌株,经鉴定为米曲霉LBM 30007和米曲霉LBM 30008。经基础发酵特征检验,本研究发现不同米曲霉菌株具有发酵互补性能。设计包括米曲霉沪酿3.042在内的复合菌剂制曲,发现复合菌剂能明显提升制曲过程中的水解酶活力、氨基酸态氮浓度及鲜味氨基酸浓度。本研究设计了一种制曲用复合菌剂的构建策略,筛选获得并鉴定优质米曲霉菌株及复合菌剂,具有郫县豆瓣工业化生产的应用潜力,同时为其他高盐高氮发酵食品工业化应用提供理论借鉴。
1 材料与方法
1.1 材料
1.1.1 菌种
米曲霉沪酿3.042购自中国工业微生物菌种保藏管理中心(编号CICC 2399);菌株LBM 30007、LBM 30008等生物学分类被初步鉴定为曲霉的50株菌均保藏于江南大学酿造微生物学与应用酶学研究室菌种库,其中,28株曲霉于2019—2021年分离纯化自发酵酱样品,22株曲霉于1980—2021年分离筛选自发酵酱油酱醪样品。
1.1.2 材料与试剂
面粉、麸皮、蚕豆,市售;脱脂奶粉、L-亮氨酸-对硝基苯胺、果胶、半乳糖醛酸,生工生物工程(上海)股份有限公司;琼脂粉、酪氨酸、干酪素、福林酚试剂、葡萄糖、可溶性淀粉、无水乙醇、硫酸、盐酸、氢氧化钠、碳酸钠、三氯乙酸、乳酸、乳酸钠、磷酸二氢钠、磷酸氢二钠、硼砂、4-硝基苯胺、三(羟甲基)氨基甲烷、甲醛、酚酞、邻苯二甲酸氢钾、磺基水杨酸、3,5-二硝基水杨酸、酒石酸钾钠、苯酚、硫酸钠、醋酸、醋酸钠、碘、碘化钾、羧甲基纤维素钠,国药集团化学试剂有限公司;Miracloth,Merck公司。
1.1.3 培养基
PDA培养基购自国药集团化学试剂有限公司,按试剂瓶说明配制。
酸性脱脂奶粉培养基:A液为25 g/L脱脂奶粉水溶液,B液为20 g/L琼脂水溶液。A液与B液分别115 ℃灭菌30 min,使用时在无菌环境下按体积比2∶3 混合,并用盐酸调节pH至3.0。
种曲培养基∶按照麸皮与面粉质量比7∶3在250 mL 三角瓶中加入20 g过10目筛的干料,并加入干料量70%(质量分数)的水,拌匀。121 ℃灭菌20 min。
1.2 仪器与设备
电子分析天平、pH计,Mettler Toledo公司;高压湿热自动蒸汽灭菌锅,Tomy公司;超净工作台,苏州净化设备有限公司;培养箱,上海森信实验仪器有限公司;高速离心机,Eppendorf公司;CytationTM 3多功能酶标仪,BioTek公司;BX51光学显微镜,Olympus公司;Quanta 200扫描电子显微镜,Fei公司;L-8900氨基酸分析仪,Hitachi公司;KjeltecTM 8000凯氏定氮仪,FOSS公司;SBA-40X生物传感分析仪,济南研科实验仪器有限公司。
1.3 实验方法
1.3.1 优质米曲霉的获得
(1)菌种培养与孢子悬浮液的制备
将曲霉菌种在PDA平板上点种,30 ℃恒温培养3~5 d。待产孢充分后,每个平板加入适量无菌水,用无菌涂布棒在菌丝表面轻轻刮拭,将孢子刮下。将收集到的孢子洗脱液摇匀,用Miracloth对洗脱液进行过滤,收集滤液,即获得孢子悬浮液,置于4 ℃保存。
(2)高产酸性蛋白酶曲霉菌株的筛选
将孢子悬浮液摇匀后取适量用于血球计数,获得孢子悬液母液的浓度。将母液梯度稀释至孢子浓度为106个/mL,接种100 μL于直径为150 mm的筛选培养基,每平板8株,30 ℃恒温培养3 d,挑选在pH 3.0的脱脂奶粉培养基中透明圈/菌落直径比均大的菌株。筛选时以米曲霉沪酿3.042为对照,设置3个平行。
(3)菌落的形态学观察
取培养成熟的培养基平板,肉眼观察菌落形态特征,扫描电子显微镜观察生物精细结构,特别是菌丝分支情况及分生孢子梗结构,参照《真菌鉴定手册》对菌株进行形态学鉴定[12]。
(4)系统发育树构建
对菌株LBM 30007、LBM 30008及米曲霉沪酿3.042 进行全基因组测序及拼接,信息公布于NCBI GenBank数据库(https://www.ncbi.nlm.nih.gov/genbank/),项目登录号为PRJNA800656;另外,从NCBI基因组数据库(https://www.ncbi.nlm.nih.gov/genome/)获取8株曲霉属黄绿组菌株、4株非黄绿组曲霉菌株、1株青霉及1株粗糙脉孢霉的全基因组序列[13]。构建前述17株霉菌的系统发育树,建树时,OrthoFinder v2.4.1[14]查找同源基因→MAFFT[15]多序列比对→ Gblocks(http://molevol.cmima.csic.es/castresana/Gblocks_ server.html)去除分歧和模糊对齐的位点,调取保守区域→SeqKit(https://bioinf.shenwei.me/seqkit/)连接→ IQ-TREE v1.6.12(ht- tp://www.iqtree.org/)确定最佳氨基酸替代模型后构建最大似然系统发育树→iTOL(https://itol.embl.de/)进化树可视化及美化。
1.3.2 制曲工艺
种曲制作:将平板培养菌种的孢子用接种针接入种曲培养基,摇匀后30 ℃培养4 d,每日搅拌使曲料松散。
蚕豆曲制作:将蚕豆瓣用自来水冲洗3次除杂,95 ℃烫瓣20 s,再将蚕豆在45 ℃清水中浸泡20 min,沥干水分。按干蚕豆瓣与小麦粉的质量比100∶30进行拌粉。按6.75×106个孢子/g干蚕豆瓣的比例加入种曲,混合均匀后置于恒温恒湿培养箱中培养(0~20 h时,控制温度30 ℃、湿度90%;20 h至结束,控制温度28 ℃、湿度80%)。当曲料逐渐出现嫩黄绿色孢子后(约72 h),即可出曲,检测成曲的酶活力及氨基酸含量。
多菌种混合制曲时,米曲霉LBM 30008分生孢子占比30%,米曲霉LBM 30007占比30%,米曲霉沪酿3.042占比40%,种曲接种量同上(6.75×106个孢子/g干蚕豆瓣)。
1.3.3 检测方法
(1)孢子数测定
三角瓶种曲克孢子数测定按照SB/T 10315—1999 《孢子数测定法》规定的方法进行测定。
(2)酶活力测定
粗酶液制备:准确称取2.00 g种曲或大曲,充分研磨,去离子水或缓冲液定容至20 mL后40 ℃水浴1 h,每隔10 min搅拌l次,用滤纸过滤,滤液即为待测酶液,用于后续酶活力测定。
淀粉酶活力测定参照褚清龙等[16]的方法,在40 ℃,1 g曲样1 min水解1 mg淀粉的酶量定义为1个酶活力单位。糖化酶、果胶酶、纤维素酶活力测定采用DNS法[17],在40 ℃、pH 4.8条件下,1 min催化水解淀粉产生1 mg葡萄糖的酶量定义为1个糖化酶活力单位;pH 4.4、40 ℃水浴条件下,1 min催化果胶质水解产生1 μg半乳糖醛酸的酶量定义为1个果胶酶活力单位;在40 ℃、pH 4.8条件下,1 h水解CMC产生相当于1 mg葡萄糖的酶量定义为1个纤维素酶活力单位。蛋白酶活力按照GB/T 23527—2009《蛋白酶制剂》规定的方法进行测定,在40 ℃下1 min水解酪蛋白产生1 μg酪氨酸,定义为1个蛋白酶活力单位。氨肽酶活力测定时以L-亮氨酸-对硝基苯胺为底物,在40 ℃、pH 8.0条件下,1 min水解亮氨酸对硝基苯胺生成1 μg对硝基苯胺所需的酶量定义为1个酶活力单位[18]。
(3)理化指标检测
氨基酸态氮检测参照GB 5009.235—2016 《食品安全国家标准 食品中氨基酸态氮的测定》方法。游离氨基酸测定具体操作参考已有研究[19],即样品预处理方法为取4 g样品加入16 mL超纯水中,振荡混匀后,冰浴超声30 min;将超声后的液体于10 000 r/min,4 ℃ 离心5 min,取1 mL上清液加入等体积的10%磺基水杨酸,4 ℃静置4 h以沉淀蛋白质,10 000 r/min,4 ℃ 离心10 min,0.02 mol/L HCl稀释至上机浓度,过膜后进氨基酸分析仪。
1.4 数据处理
采用Excel处理数据,表示为平均值±标准差;采用Origin 2021b绘制图表;采用TBtools绘制热图,并对每一列数据进行标准化处理。
2 结果与分析
2.1 高产酸性蛋白酶曲霉菌株的筛选
为获得在酸性条件下具有较高蛋白降解活力的菌种,本研究在江南大学酿造微生物与应用酶学研究室菌种库中获得曲霉50株,并通过检测pH 3.0条件下脱脂奶粉培养基中透明圈大小初筛具有较高酸性蛋白酶活力的曲霉菌株。如图1所示,曲霉LBM 30007、LBM 30008在酸性环境水解酪蛋白能力较强,透明圈/菌落直径比大于米曲霉沪酿3.042(图1),用于后续研究。
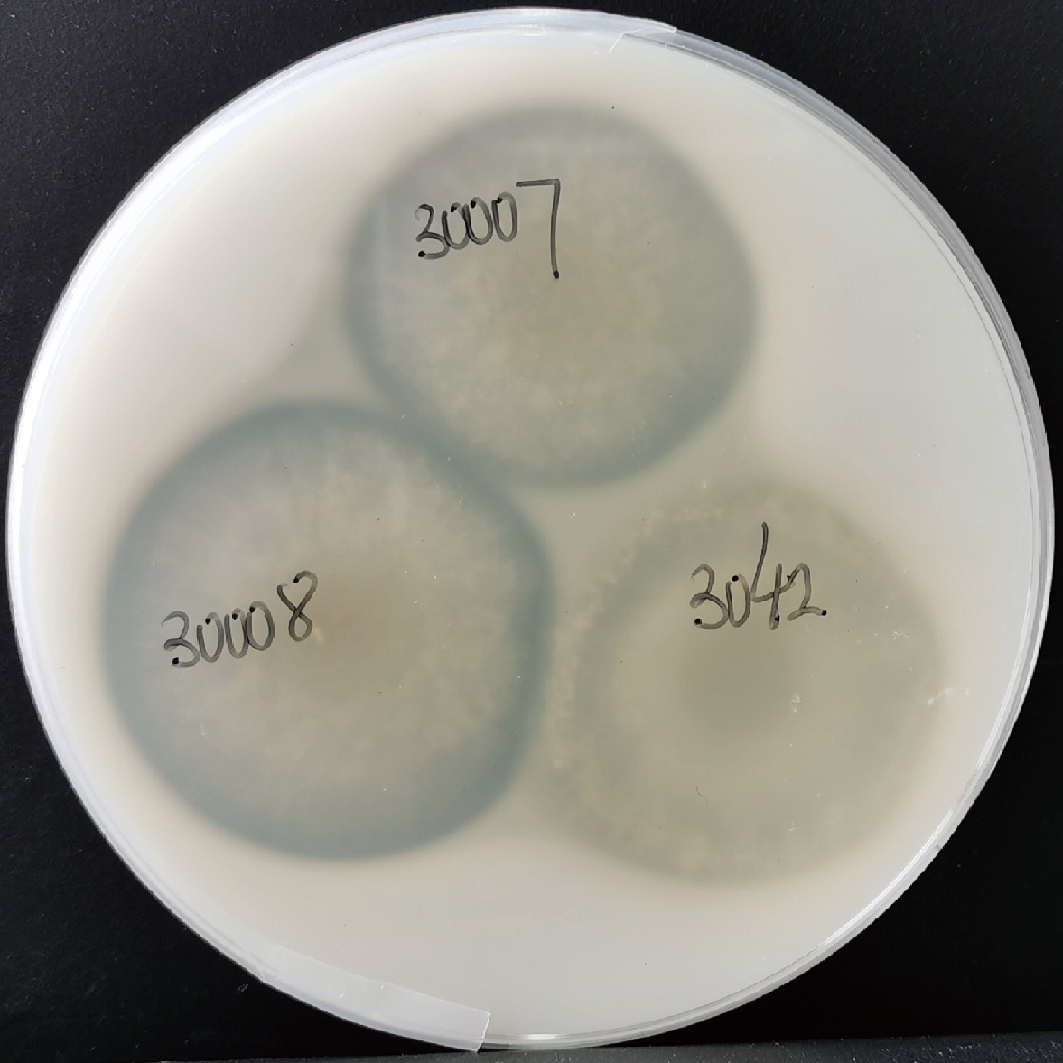
30007-曲霉LBM 30007;30008-曲霉LBM 30008;3042-米曲霉沪酿3.042
图1 高产酸性蛋白酶曲霉菌株筛选
Fig.1 Screening of aspergillar strains with high-producing acid protease
2.2 菌株种属鉴定
2.2.1 形态学鉴定
将如上2株曲霉LBM 30007、LBM 30008与米曲霉沪酿3.042在PDA培养基中培养5 d,如图2所示,3种曲霉菌种在形态学上有明显差异。菌株LBM 30007在PDA培养基上培养成熟时,菌落质地为丝绒状,颜色为黄绿色,边缘不规则(图2-a)。菌株LBM 30008菌落为橄榄黄色,丝绒状,具有不明显辐射状沟纹,边缘整齐(图2-b)。沪酿3.042菌落为茶绿色,絮状,黄绿色边缘相对整齐(图2-c)。利用显微镜同时放大1 200倍,观察发现,3种曲霉分生孢子梗均发生于基质或气生菌丝,分生孢子梗茎粗糙,分生孢子头呈辐射状,顶囊为球型,表面可育,产孢结构单层并产生球型、粗糙分生孢子(图2-d~图2-f)。然而,在分生孢子直径方面,菌株LBM 30007和LBM 30008大于米曲霉沪酿3.042。
依据《真菌鉴定手册》、与米曲霉沪酿3.042的菌落形态和显微形态进行比对,基本可以确认LBM 30007和LBM 30008生物学分类为曲霉属(Aspergillus)黄绿组(Flavi)。

a-菌株LBM 30007的菌落形态;b-菌株LBM 30008的菌落形态;c-米曲霉沪酿3.042的菌落形态;d-菌株LBM 30007的显微形态;e-菌株LBM 30008的显微形态;f-米曲霉沪酿3.042的显微形态
图2 菌株LBM 30007、LBM 30008及米曲霉沪酿3.042的菌落形态和显微形态
Fig.2 Colony and microscopic morphology of strain LBM 30007,LBM 30008, and A.oryzae HN 3.042
2.2.2 系统发育分析
为明确菌株LBM 30007和LBM 30008的生物学分类地位和系统发育关系,选取9株曲霉属环绕亚属黄绿组菌株(A.leporis CBS 151.66、A.coremiiformis CBS 553.77、A.alliaceus CBS 536.65、A.pseudonomiae CBS 119388、A.tamarii CBS 117 626、A.transmontanensis CBS 130015、A.flavus NRRL 3357、A.oryzae RIB40及A.oryzae HN 3.042)、3株曲霉属环绕亚属非黄绿组菌株(A.niger ATCC 1015、A.terreus NIH2624和A.steynii IBT 23096)、1株曲霉属巢状亚属菌株(A.nidulans FGSC A4)、1株青霉属菌株(Penicillium rubens 43M1)及1株粗糙脉孢霉(Neurospora crassa OR74A),比较17株霉菌的全基因组,基于单拷贝直系同源基因构建系统发育树(图3)。
系统发育关系如图3所示,进化树拓扑结构及分类学分类与前人研究一致[13]。菌株LBM 30007和LBM 30008为曲霉属黄绿组,验证了形态学鉴定结论。另外,菌株LBM 30007和LBM 30008与日本米曲霉RIB 40、中国米曲霉沪酿3.042亲缘关系最为接近,可进一步判断其属于米曲霉。
综合形态学鉴定及系统发育分析结果,可以判断菌株LBM 30007和LBM 30008均为米曲霉。
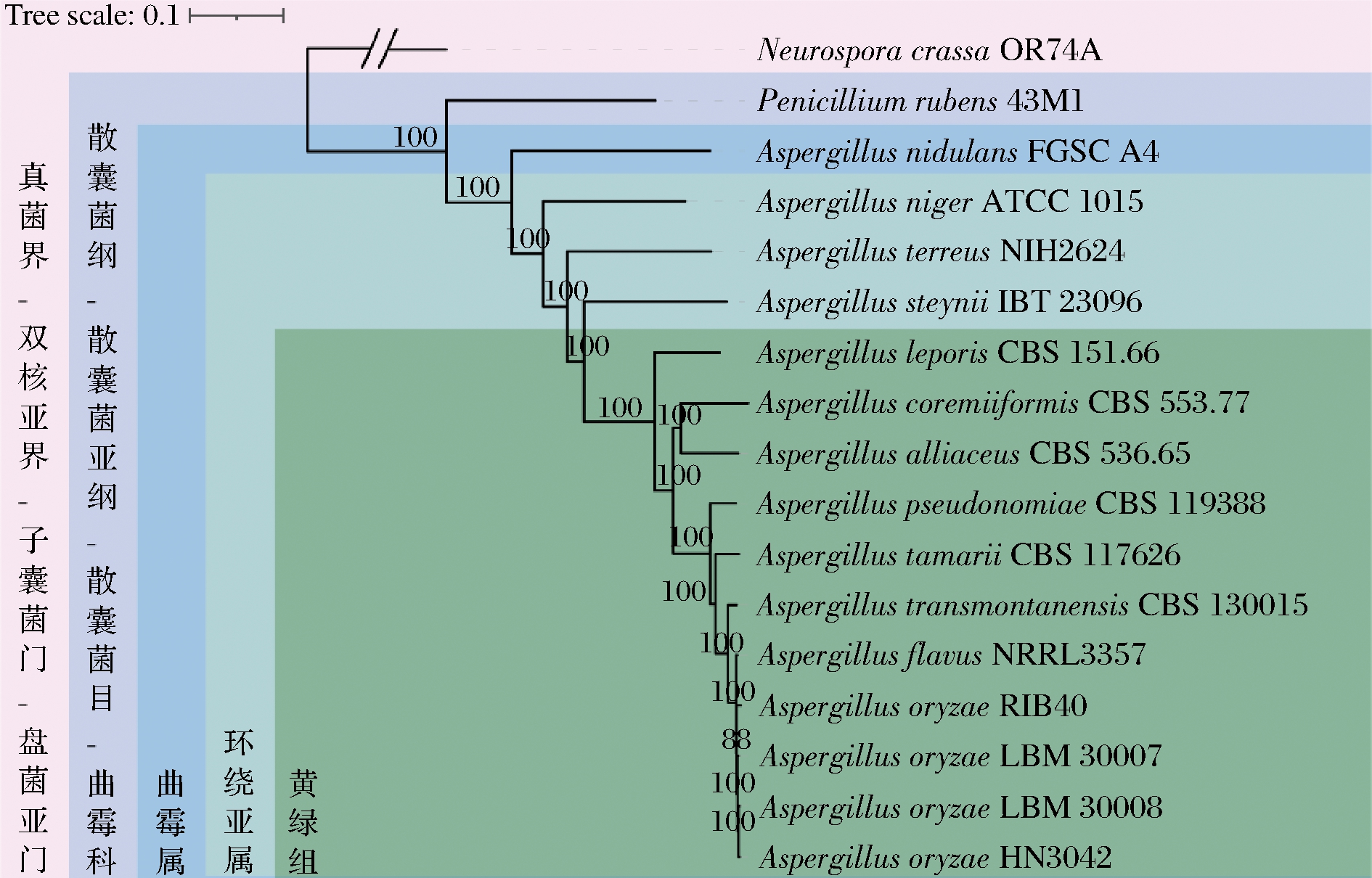
图3 菌株LBM 30007、LBM 30008与其他15株真菌的系统发育树
Fig.3 Phylogenetic tree of strain LBM 30007,LBM 30008,and 15 other fungi
2.3 米曲霉的基础发酵表型特性
米曲霉的基础发酵特征是判断其是否适合作为制曲菌种的基础。在本研究中,作者利用蒸煮麸皮面粉为培养基,分别使用米曲霉LBM 30007、LBM 30008及沪酿3.042制作种曲,观察种曲感官特征,测定产孢情况、水解酶活力等制曲关键指标,挖掘不同米曲霉的生产应用潜能。
2.3.1 米曲霉产孢数量评价
米曲霉产孢数量是曲种质量评价中的关键指标之一[20],高产孢曲种有利于大幅提升种曲生产效率,因此,一般要求曲种产孢量不低于6×109个/g干基。如表1所示,经过4 d的培养,米曲霉沪酿3.042产生大量分生孢子(1.50×1010 个/g干基);相较而言,米曲霉LBM 30007和LBM 30008产孢数量较少,分别为7.25×109个/g干基及4.38×109个/g干基。从产孢数量来看,米曲霉沪酿3.042仍拥有绝对优势。米曲霉LBM 30007满足曲种产孢量的要求,米曲霉LBM 30008接近曲种产孢量的基本要求。
表1 种曲质量评价
Table 1 Quality evaluation of seed koji

菌株感官孢子数/(个·g-1干基)沪酿3.042孢子丰盈、飞扬,呈绿色,疏松柔软,有曲香味,无异味1.50×1010LBM 30007孢子丰满、飞扬,呈黄绿色,较蓬松柔软,曲香味浓,无异味7.25×109LBM 30008孢子肥大密多、飞扬,呈黄绿色,蓬松柔软,曲香味浓,无异味4.38×109
2.3.2 米曲霉酶系特征分析
酶系特征,特别是水解酶系特征,是评价曲种质量的关键指标之二。经过4 d的培养,3株米曲霉分泌产生的淀粉酶、糖化酶、果胶酶、纤维素酶、亮氨酸氨肽酶、蛋白酶(酸性、中性、碱性)活力如图4所示,米曲霉LBM 30007酶系最为均衡,其中,糖化酶活力较高,有助于淀粉质原料降解。另外,LBM 30007产生的酸性、碱性及中性蛋白酶活力也极具优势,结合孢子产生性能,本研究认为米曲霉LBM 30007是一种有潜力的制曲用菌。相反地,米曲霉LBM 30008具有较高的淀粉酶和果胶酶活力,其他水解酶活力整体较低。然而,该菌种的孢子萌发时间极短(未发表数据),有希望在制曲过程中抑制杂菌污染。综合判断,2株米曲霉LBM 30007及LBM 30008在孢子形成、孢子萌发速率及水解酶活力方面各有特点,有希望在郫县豆瓣蚕豆醅发酵方面发挥作用。
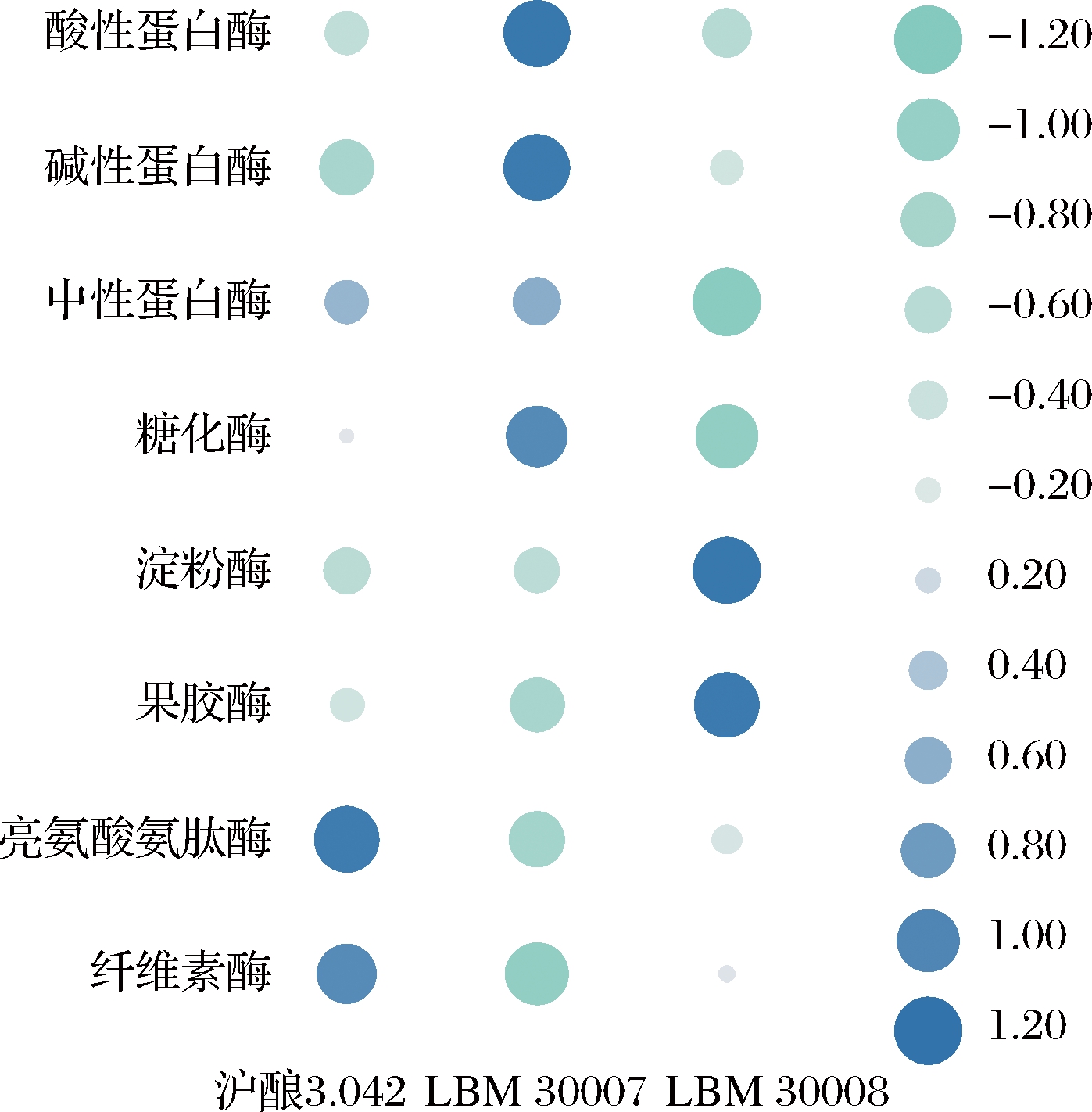
图4 种曲酶活力
Fig.4 Enzymatic activities of seed koji
2.4 单菌与混菌制曲比对
为进一步探究米曲霉LBM 30007和LBM 30008在郫县豆瓣蚕豆曲制作过程中的制曲性能,改善米曲霉沪酿3.042单菌制曲酶系不均衡可能导致的原料降解不充分问题,本研究分别使用米曲霉沪酿3.042、LBM 30007、LBM 30008纯菌种制曲、组合上述3株米曲霉进行复合菌剂制曲,检测成曲酶活力及与蛋白质利用相关的理化指标。
2.4.1 制曲过程曲料感官变化
本研究模拟郫县豆瓣蚕豆曲原料预处理过程及制曲过程,分别利用米曲霉沪酿3.042、LBM 30007、LBM 30008三株米曲霉进行纯种制曲及复合制曲,并跟踪监测单菌株及复合菌剂制作郫县豆瓣蚕豆曲过程中曲料的感官变化。如图5所示,制曲第1天时,曲料白色菌丝丛生,无孢子,微有蚕豆香,质地柔软,富有弹性,稍有结块,需将曲料打散;第2天时,菌丝丰满,几乎布满嫩绿色孢子,有曲香味,质地较硬且蓬松;第3天时,孢子丰满,呈黄绿色,曲香浓郁,无酸味、氨味等不良异味,质地较硬且蓬松。然而,与复合菌种制曲相比,单一菌株制曲显示菌种生长较慢、曲香稍欠缺。因此,本研究推测复合制曲有提高原料利用率,缩短制曲周期,改善成曲风味的潜力。

图5 制曲过程中曲料的外观变化
Fig.5 Appearance changes during the process of koji-making
2.4.2 成曲酶活力与氨基态氮含量
蛋白酶将原料中的蛋白质分解为胨、多肽、低分子肽和氨基酸,是非挥发性滋味物质及挥发性风味物质的前体。另外,亮氨酸氨肽酶从多肽N端水解氨基酸,有助于苦味的去除、鲜味物质的积累。在郫县豆瓣蚕豆曲制备过程中,单菌株及复合菌株制曲产蛋白水解酶情况如图6-a、图6-b所示,显示不同菌株制曲酶活力存在较大差异。米曲霉LBM 30007在中性、酸性蛋白酶及亮氨酸氨肽酶活力分别为沪酿3.042的1.9倍、1.2倍和1.8倍,有利于蛋白质原料的充分降解。另外,复合菌种制备的曲料中,酸性、中性蛋白酶及亮氨酸氨肽酶活力均较单菌株制曲有所提升,分别达到153.54、703.22、392.51 U/g。其中,酸性蛋白酶活力较沪酿3.042制曲提高了23.25%。如上结果表明,复合制曲中,菌株之间的竞争协同作用正向影响了蛋白水解酶的产生,能够有效提高蚕豆曲中蛋白酶活力及蛋白酶系均衡度。
此外,复合菌种制曲的优势也反映在蚕豆成曲的氨基酸态氮含量上(图6-c)。氨基酸态氮是判定发酵产品发酵程度的特性指标。如图6-c所示,采用复合米曲霉菌株制曲时,成熟的蚕豆曲中氨基酸态氮含量高于单菌制曲,较沪酿3.042制曲提高了0.14 g/100g。
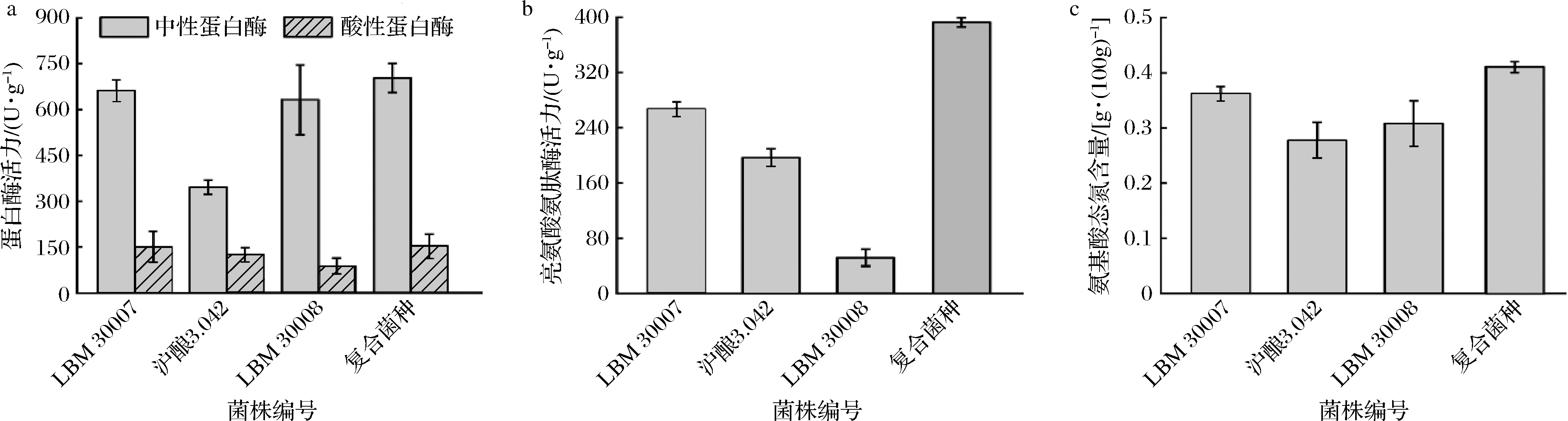
a-蛋白水解酶;b-亮氨酸氨肽酶;c-氨基酸态氮
图6 成曲酶活力及氨基酸态氮含量
Fig.6 Enzymatic activities and amino acid nitrogen content of koji
2.4.3 成曲游离氨基酸测定及分析
菌株及复合菌株制备的郫县豆瓣蚕豆曲的游离氨基酸结果如表2所示。不同菌株制曲的游离氨基酸总量差异不大,分布在18.36~21.16 g/L,但游离氨基酸组成差异较大。从氨基酸风味及其占全部氨基酸比重来看,米曲霉LBM 30008制曲鲜味氨基酸(谷氨酸、天冬氨酸)比重最大,为21.12%,沪酿3.042 鲜味氨基酸占比最小(18.36%);米曲霉LBM 30007制曲甜味氨基酸(苏氨酸、丝氨酸、甘氨酸、丙氨酸、脯氨酸、赖氨酸)比重最大,为36.57%,混菌制曲最小(35.39%);米曲霉沪酿3.042制曲苦味氨基酸(甲硫氨酸、组氨酸、精氨酸、异亮氨酸、亮氨酸、酪氨酸、苯丙氨酸、缬氨酸)比重最大,为45.11%,LBM 30008最小(42.88%)。综上,米曲霉LBM 30008制曲后,游离氨基酸,特别是鲜味及甜味氨基酸比例更优。从氨基酸比例及绝对含量来看,复合菌剂制曲产生了最高浓度的游离氨基酸,且鲜味、甜味、苦味氨基酸含量均高于单菌种制曲。另外,复合菌剂制曲较沪酿3.042制曲产生了更高比例的鲜味氨基酸(11.33%),甜味及苦味氨基酸含量轻微下降,分别下降了3.11%和2.31%。由此推测,复合菌株制备的郫县豆瓣鲜味可能更加浓郁。
表2 成曲游离氨基酸含量 单位:g/L
Table 2 Free amino acid content of koji
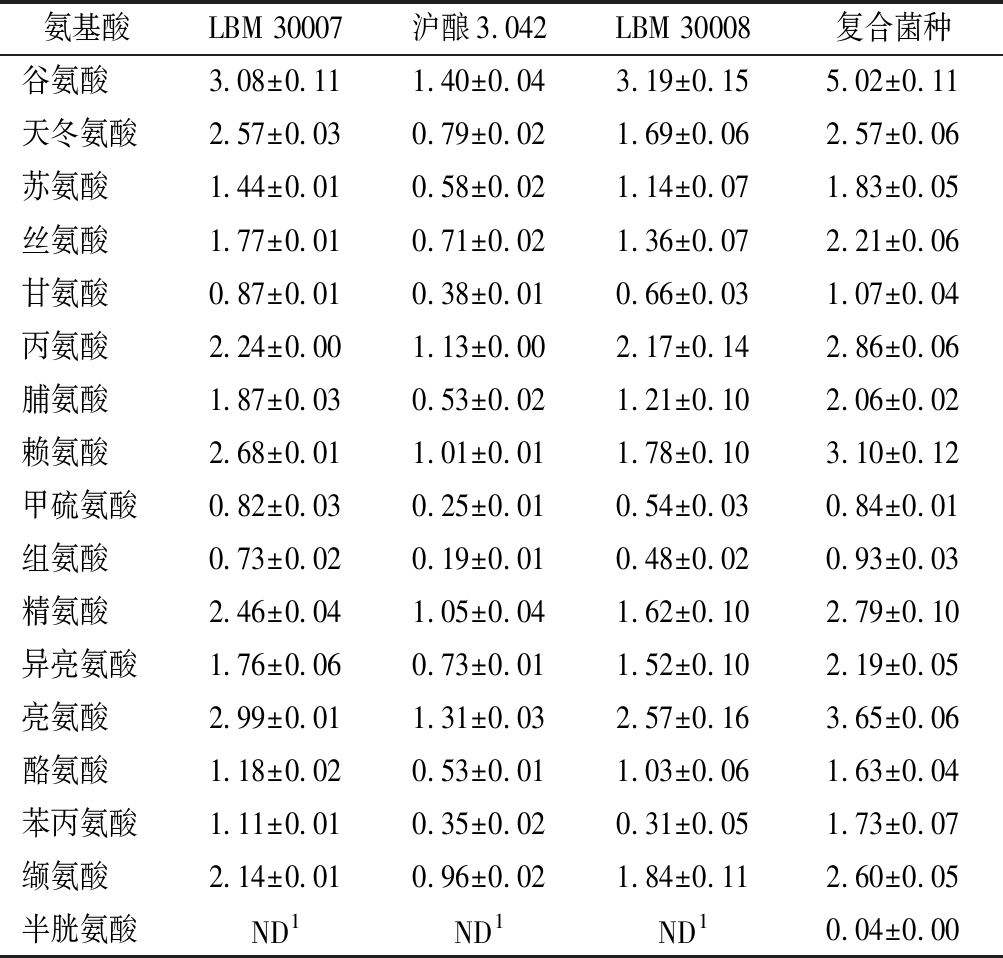
氨基酸LBM 30007沪酿3.042LBM 30008复合菌种谷氨酸3.08±0.111.40±0.043.19±0.155.02±0.11天冬氨酸2.57±0.030.79±0.021.69±0.062.57±0.06苏氨酸1.44±0.010.58±0.021.14±0.071.83±0.05丝氨酸1.77±0.010.71±0.021.36±0.072.21±0.06甘氨酸0.87±0.010.38±0.010.66±0.031.07±0.04丙氨酸2.24±0.001.13±0.002.17±0.142.86±0.06脯氨酸1.87±0.030.53±0.021.21±0.102.06±0.02赖氨酸2.68±0.011.01±0.011.78±0.103.10±0.12甲硫氨酸0.82±0.030.25±0.010.54±0.030.84±0.01组氨酸0.73±0.020.19±0.010.48±0.020.93±0.03精氨酸2.46±0.041.05±0.041.62±0.102.79±0.10异亮氨酸1.76±0.060.73±0.011.52±0.102.19±0.05亮氨酸2.99±0.011.31±0.032.57±0.163.65±0.06酪氨酸1.18±0.020.53±0.011.03±0.061.63±0.04苯丙氨酸1.11±0.010.35±0.020.31±0.051.73±0.07缬氨酸2.14±0.010.96±0.021.84±0.112.60±0.05半胱氨酸ND1ND1ND10.04±0.00
注:ND1表示未检测到
3 讨论与结论
本研究从江南大学酿造微生物学与应用酶学研究室初筛获得2株在酸性条件下具有较高蛋白水解酶活性的菌株,分别为曲霉LBM 30007及LBM 30008。经表型(包括显微表型)及系统发育分析,鉴定如上2株菌为米曲霉。对米曲霉沪酿3.042、LBM 30007及LBM 30008进行基础发酵表型特性分析,发现与沪酿3.042相比,米曲霉LBM 30007在蛋白及淀粉水解酶活力方面具有优势,LBM 30008在孢子萌发速率方面有优势,因此,将3种米曲霉进行组合制曲,可能会提高郫县豆瓣蚕豆醅蛋白降解效率。将3株米曲霉进行复合制曲,用于制备郫县豆瓣蚕豆醅,结果显示,复合制曲的酸性和中性蛋白酶活力、亮氨酸氨肽酶活力、氨基酸态氮含量及鲜味氨基酸含量均有所提升,弥补了LBM 30007、LBM 30008繁殖能力较差以及沪酿3.042酶系不均衡的缺陷,有助于制备品质更为优良、风味更加浓郁的郫县豆瓣成曲。本研究鉴定获得的优质米曲霉菌株及复合菌剂,对郫县豆瓣在内的高盐高氮发酵食品具有潜在应用价值。
[1] LI X Y, ZHAO C S, ZHENG C, et al. Characteristics of microbial community and aroma compounds in traditional fermentation of Pixian broad bean paste as compared to industrial fermentation[J]. International Journal of Food Properties, 2017, 20:S2 520-S2 531.
[2] LIN H, YU X, FANG J, et al. Flavor compounds in Pixian broadbean paste:Non-volatile organic acids and amino acids[J]. Molecules. 2018, 23(6):1 299.
[3] 蒋浩然, 李莹. “川菜之魂” 郫县豆瓣的品牌之路[J]. 中国品牌, 2019, 143(5):70-72.
JIANG H R, LI Y. The brand road of " Soul of Sichuan Cuisine" Pixian broad bean paste[J]. China Brand, 2019, 143(5):70-72.
[4] 邓扬龙. 郫县豆瓣中产气微生物的分离、鉴定及其生物特性研究[D]. 成都:西华大学,2020.
DENG Y L.Isolation, identification and biological characteristics of the aerogenic microorganism in Pixian broad bean paste[D].Chengdu: Xihua University, 2020.
[5] ZHANG L J, BAO Y D, CHEN H F, et al. Functional microbiota for polypeptide degradation during hypertonic moromi-fermentation of Pixian broad bean paste[J]. Foods, 2020, 9(7):930.
[6] 张艳芳. 多菌株制曲促进酶系优化与提高酱油质量的研究[D]. 无锡:江南大学,2009.
ZHANG Y F. Study on optimizing enzyme system by using mutistrains during koji making and improving quality of soy sauce[D]. Wuxi:Jiangnan University, 2009.
[7] 上海市粮油工业公司酿造实验工场. 米曲霉3. 042菌株的选育[J]. 微生物学报, 1976, 16(1):70.
Shanghai grain and oil industry company brewing experimental factory.Breeding of Aspergillus oryzae strain 3.042[J].Acta Microbiologica Sinica, 1976, 16(1):70.
[8] 李洁芝, 邓维琴, 张其圣, 等. 7株米曲霉与沪酿3.042发酵制备郫县豆瓣用甜瓣子的对比研究[J]. 中国调味品, 2020, 45(5):124-129.
LI J Z, DENG W Q, ZHANG Q S, et al. Comparative study on fermentation of seven strains of Aspergillus oryzae and Huniang 3.042 for preparation of sweet beansused for Pixian broad bean paste[J]. China Condiment, 2020, 45(5):124-129.
[9] HU H L, VAV DEN BRINK J, GRUBEN B S, et al. Improved enzyme production by co-cultivation of Aspergillus niger and Aspergillus oryzae and with other fungi[J].International Biodeterioration & Biodegradation,2011, 65(1):248-252.
[10] TANG J, CHEN T T, HU Q, et al. Improved protease activity of Pixian broad bean paste with cocultivation of Aspergillus oryzae QM-6 and Aspergillus niger QH-3[J]. Electronic Journal of Biotechnology, 2020, 44:33-40.
[11] 刘丹, 葛予宁, 徐晗, 等. 混菌制曲和酱渣添加对黄豆酱理化指标动态变化的影响[J]. 中国酿造,2020,39(7):125-130.
LIU D, GE Y N, XU H, et al. Effects of mixed starter-making and sauce residue addition on the dynamic changes of physical and chemical indexes of soybean paste[J]. China Brewing, 2020,39(7):125-130.
[12] 魏景超. 真菌鉴定手册[M]. 上海: 上海科学技术出版社,1979:405-642.
WEI J C. Fungal Identification Manual [M]. Shanghai: Shanghai Scientific & Technical Publishers, 1979:405-642.
[13] KJ☞RBØLLING I, VESTH T, FRISVAD J C, et al.A comparative genomics study of 23 Aspergillus species from section Flavi[J].Na-ture Communications, 2020,11(1):1 106.
[14] EMMS D M, KELLY S. OrthoFinder:Phylogenetic orthology inference for comparative genomics [J]. Genome Biology, 2019, 20(1):238.
[15] KATOH K, STANDLEY D M. MAFFT Multiple sequence alignment software version 7:Improvements in performance and usability[J]. Molecular Biology and Evolution, 2013, 30(4):772-780.
[16] 褚清龙, 刘新育, 吕向云, 等. 酸性α-淀粉酶高产菌株的原生质体诱变选育[J]. 安徽农业科学, 2011, 39 (13):7 701-7 702.
CHU Q L, LIU X Y, LYU X Y, et al. Screening and breeding of high-yield strains for acid α-amylase by UV mutagenesis[J]. Journal of Anhui Agricultural Sciences, 2011, 39(13):7 701-7 702.
[17] 赵谋明, 林涵玉, 梁卓雄, 等. 传统酿造酱油酱醪中的霉菌筛选及其部分酶系特征分析[J]. 现代食品科技, 2020, 36(6):114-120.
ZHAO M M, LIN H Y, LIANG Z X, et al. Screening of molds in traditional soy sauce moromi and analysis of some enzymatic characteristics[J]. Modern Food Science and Technology, 2020, 36(6):114-120.
[18] NAMPOOTHIRI K M,NAGY V,KOVACS K,et al.L-leucine aminopeptidase production by filamentous Aspergillus fungi[J].Letters in Applied Microbiology,2005,41(6):498-504.
[19] 鲍奕达.郫县豆瓣酿造微生物来源分析及多肽降解功能微生物解析[D].无锡:江南大学,2020.
BAO Y D.Source tracking of microbial community and functional microbiota analysis for polypeptide-degrading in Pixian broad bean paste[D].Wuxi:Jiangnan University,2020.
[20] 巩传友,孙岩.如何确保酱油种曲质量[J].中国酿造,2005,24(7):43-44.
GONG C Y,SUN Y.How to ensure the quality of soy sauce koji[J].China Brewing,2005,24(7):43-44.