乳铁蛋白是一种相对分子质量在80 kDa左右的铁结合蛋白[1],与血清转铁蛋白、卵转铁蛋白、黑素转铁蛋白和碳酸酐酶抑制剂等[2]蛋白同属于同个家族。乳铁蛋白在奶制品中含量极为丰富[3],特别是初乳中[4],在泪液、人和哺乳动物的胰液、胆汁和小肠分泌液中也存在[5],具有抗菌、抗病毒、抗癌、抗氧化和调节机体免疫反应[6-7]等生物活性。有研究发现乳铁蛋白经过水解后得到的小分子多肽还具有血管紧张素转化酶(angiotensin converting enzyme,ACE)抑制活性[8],研究人员对其水解产生的生物活性多肽展开大量研究[9]。目前对于其水解物分离纯化的方法主要有超滤[10]、凝胶色谱法[11]、大孔吸附树脂(macroporous adsorption resin,MAR)[12]等。MAR因具有容易循环使用、吸附强、反应条件温和、稳定性高等[13]优点,经常被用于蛋白质、多肽、多酚和多糖的提取分离[14-15]。潘道东等[16]采用DA201-C大孔吸附树脂对ACE抑制肽进行分离后,其抑制活性提高,程云辉等[17]利用DA201-C大孔吸附树脂分离纯化麦胚蛋白降压肽,降压活性提高,刁静静等[18]利用XAD-7HP大孔吸附树脂对玉米抗氧化肽分离纯化,其抗氧化活性和纯度均提高。大孔树脂是一种分子筛,分子表面还具有疏水性,能与多肽表面的疏水区域,通过疏水相互作用进行不同程度的吸附。利用大孔吸附树脂的疏水性与不同孔径,可以对混合物分离纯化。因此,本文利用DA201-C大孔吸附树脂对超滤后的乳铁蛋白溶液进行分离,以对大肠杆菌和金黄色葡萄球菌的抑菌活性为指标,以期得到活性更强、纯度更高的抗菌肽,为乳铁蛋白抗菌肽的分离纯化提供参考,也为开发抗菌肽类产品提供支持。
1 材料与方法
1.1 材料与试剂
乳铁蛋白,汇泉生物科技有限公司;10 000 Da超滤离心管和3 000 Da超滤离心管,美国Millipore公司;DA201-C大孔吸附树脂,Solarbio 科技有限公司;LB培养基(g/100mL),酵母提取物0.5 g,胰蛋白胨1 g,氯化钠1 g,pH 7.0,固体培养基加2%的琼脂粉。其他试剂均为国产分析纯。
大肠杆菌(Escherillus coli ATCC51459)和金黄色葡萄球菌(Staphylococcus aureus ATCC29213) 均来自西南民族大学食品科学与工程实验室。
1.2 仪器与设备
UV1810S紫外-可见分光光度计,上海佑科仪器仪表有限公司;HZ85-2磁力搅拌器,北京中兴伟业仪器有限公司;MP511 Lab pH计,上海三信仪表厂;Centrifuge 5804R高速离心机,德国艾本德公司;超净工作台,苏州市安泰空气技术有限公司;D-37520型真空冷冻干燥机,德国CHRiST公司;MOF-4086 S超低温冰箱,日本三洋公司;恒流泵、自动部分收集器、紫外检测仪、玻璃层析柱(1.0 cm×50 cm)、电脑采集器,上海泸西分析仪器厂。
1.3 实验方法
1.3.1 乳铁蛋白酶解液的制备
参考张晨玥[19]的方法,称取一定量的乳铁蛋白粉,配成质量浓度为30 mg/mL的乳铁蛋白溶液,置于磁力搅拌器上搅拌,将温度升到45 ℃,1.0 mol/L盐酸调pH到2.0,称取一定量的胃蛋白酶,最终的加酶量[E]/[S]是3%,酶解2 h,酶解过程中不断搅拌,并滴加1.0 mol/L的氢氧化钠溶液维持反应溶液的pH值。酶解结束后升温到80 ℃,保持15 min,调pH到7.0,15 000×g离心30 min,取上清液冷冻干燥制得冻干粉备用。
1.3.2 乳铁蛋白抗菌肽超滤液的制备
取冻干粉用去离子水配制成质量浓度为10~20 mg/mL的溶液,分别使用10 000 Da和3 000 Da的超滤离心管,4 000 r/min离心20 min,会得到分子质量>10 000 Da、分子质量为10 000~3 000 Da和分子质量<3 000 Da的3种肽段组分,分别收集冷冻干燥,进行抑菌活性的测定,选择活性高的肽段组分进行DA201-C大孔吸附树脂的分离纯化。
1.3.3 DA201-C大孔吸附树脂对乳铁蛋白抗菌肽的分离纯化
1.3.3.1 大孔树脂的预处理
取一定量的大孔吸附树脂,先用无水乙醇浸泡24 h,使树脂充分浸泡,在使用去离子水继续洗至用紫外分光光度计检测220 nm处无吸收峰,继续用去离子水充分漂洗,洗净乙醇,70 ℃下真空干燥,备用。
1.3.3.2 DA201-C大孔树脂的吸附动力学实验
将2 g处理好的干树脂加入250 mL具塞锥形瓶中,用95%(体积分数)的无水乙醇充分溶胀,用去离子水洗净无乙醇,再加入10 mg/mL的乳铁蛋白抗菌肽溶液100 mL,塞好塞子,放入25 ℃恒温振荡器中振荡12 h(振荡速度为150 r/min),间隔1 h取样,测定溶液肽含量,大孔树脂的吸附量和吸附率计算如公式(1)、公式(2)所示:
吸附率![]()
(1)
吸附量![]()
(2)
式中:C0:原液蛋白质质量浓度,mg/mL;C1:吸附液蛋白质质量浓度,mg/mL;V1:吸附溶液的体积,mL;M0:干树脂重量,g。
1.3.3.3 不同洗脱剂对DA201-C大孔树脂静态解吸影响
将2 g处理好的干树脂加入到250 mL的具塞锥形瓶中,用一定体积分数的无水乙醇溶胀后,再用去离子水洗涤,洗至无乙醇味,加入10 mg/mL的乳铁蛋白抗菌肽溶液100 mL,盖好塞子,在25 ℃的恒温振荡器中12 h振荡,之后过滤锥形瓶中的溶液,加入去离子水,轻轻洗涤树脂。分别选择水和35%、55%、75%、95%的乙醇溶液为解吸剂分别加入锥形瓶中,置于摇床中(转速150 r/min)解吸24 h,测定解吸液中抗菌肽的质量浓度。解吸率计算如公式(3)所示:
解吸率![]()
(3)
式中:C1:解吸液中抗菌肽质量浓度,mg/mL;V1:解吸液体积,mL;Q0:吸附量,mg/g;M0:树脂质量,g。
1.3.3.4 不同上样流速对DA201-C大孔树脂动态吸附性能的影响
室温条件下,将DA201-C大孔吸附树脂装入层析柱(1.0 cm×50 cm、床体积25 mL)中,将质量浓度20 mg/mL的乳铁蛋白抗菌肽溶液分别以1.5、2、2.5 mL/min的流速流经层析柱,分别以5、6、6 mL收集1管,用紫外分光光度计检测流出液的吸光值,以A220nm=0.05为穿透点,比较不同上样流速时的穿透体积和吸附量。
1.3.3.5 不同质量浓度对DA201-C大孔树脂动态吸附性能的影响
在层析柱中装满DA201-C大孔吸附树脂(床体积25 mL),室温条件下,将质量浓度20、25、30 mg/mL以1.5 mL/min的流速流经层析柱,比较不同质量浓度时乳铁蛋白抗菌肽的穿透体积和吸附量。
1.3.3.6 不同离子强度对DA201-C大孔树脂动态吸附性能的影响
室温下,把DA201-C大孔树脂转入层析柱中(床体积25 mL),分别以0.2、0.4、0.6、0.8、1.0 mol/L的NaCl溶液配制20 mg/mL的乳铁蛋白抗菌肽溶液,以1.5 mL/min的流速流经层析柱,比较不同离子强度的溶液对乳铁蛋白抗菌肽的穿透体积和吸附量。
1.3.4 不同浓度(体积分数)乙醇对抗菌肽梯度洗脱
在室温条件下,用质量浓度20 mg/mL、离子强度0.6 mol/L的抗菌肽以1.5 mL/min的流速流经层析柱,用紫外检测器检测流出液的吸光度,以A220nm=0.05 为穿透点,停止上样,先用35%乙醇以2 mL/min的流速洗脱至没有组分流出,再用55%乙醇继续洗脱至没有组分流出,最后用75% 乙醇继续洗脱至没有组分流出,停止洗脱,分别收集各洗脱峰。旋转蒸发后冷冻干燥,测定各组分的抗菌性。
1.3.5 蛋白质浓度的测定
采用双缩脲法[20],稍作修改。
1.3.6 抑菌率的测定
参考王新保[9]的方法,取装有4 mL无菌LB液体培养基的试管数管,分别编号,样品组分别加0.5 mL的菌悬液和0.5 mL的抗菌肽溶液,对照组加0.5 mL的菌悬液和0.5 mL的无菌水,以加1 mL无菌水为空白组,在恒温摇床(37 ℃,121 r/min)中培养6 h,560 nm 下测定吸光度,实验每组做3个平行实验。抑菌率计算如公式(4)所示:
抑菌率![]()
(4)
1.3.7 氨基酸组成的测定
采用氨基酸自动分析仪分析测定。
1.3.8 蛋白质或多肽疏水值的计算[21]
蛋白质式多肽疏水值计算如公式(5)和公式(6)所示:
(5)
Q=ΣΔQi
(6)
式中:AAi,100 g蛋白质中每种氨基酸的含量,g;Mi,各种氨基酸的摩尔质量,g/mol;ΣAAi/Mi,100 g蛋白质中氨基酸的总摩尔数,mol;Δfti:氨基酸侧链疏水性值,kJ/mol;Qi:蛋白质的疏水性值;ΔQi,各氨基酸的疏水性值;Q,各氨基酸疏水性值之和。
1.4 数据统计与处理
用Origin 2017软件作图,SPSS 18.0软件进行数据统计处理,差异显著性采用Duncan′s法进行多重比较,P<0.05表示差异显著。
2 结果与分析
2.1 酶解前后及不同超滤分子段的抑菌活性
分别称取乳铁蛋白粉和酶解后的乳铁蛋白水解粉,配成浓度为8%(体积分数)的溶液,以大肠杆菌和金黄色葡萄球菌为指示菌进行抑菌实验。由表1可知,未酶解的乳铁蛋白粉在浓度为8%时,抑菌性未检测出,可能是乳铁蛋白浓度不够高,但对它在进行酶解后,就有一定的抑菌性,对大肠杆菌和金黄色葡萄球菌的抑菌率分别达到70.59%和58.46%,说明乳铁蛋白经过酶解后,产生了具有抑菌活性的小分子多肽。
表1 乳铁蛋白酶解前后的抑菌率
Table 1 Antibacterial rate of lactoferrinase before and after hydrolysis

菌种抑菌率未酶解乳铁蛋白酶解后的乳铁蛋白大肠杆菌 -70.59%金黄色葡萄球菌-58.46%
注:“-”表示未检出(下同)
称取3种分子质量范围的乳铁蛋白抗菌肽进行抑菌实验。由表2数据可知,分子质量>10 000 Da和分子质量10 000~3 000 Da的肽段在所测浓度范围均没有抑菌性,而分子质量<3 000 Da的抗菌肽则有一定的抑菌活性。
表2 超滤后产物的抑菌率
Table 2 Antibacterial rate of ultrafiltration products
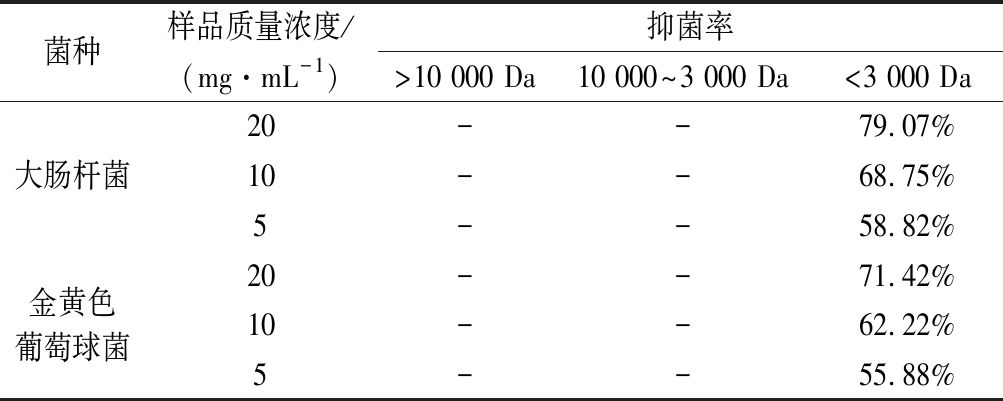
菌种样品质量浓度/(mg·mL-1)抑菌率>10 000 Da10 000~3 000 Da<3 000 Da大肠杆菌20--79.07%10--68.75%5--58.82%金黄色葡萄球菌20--71.42%10--62.22%5--55.88%
3.2 DA201-C大孔吸附树脂吸附动力学实验结果
以牛血清白蛋白质量浓度为横坐标吸光度为纵坐标,绘制蛋白浓度-标准曲线,得线性方程y=0.042 9x+0.000 6,R2=0.998 2(图1)。
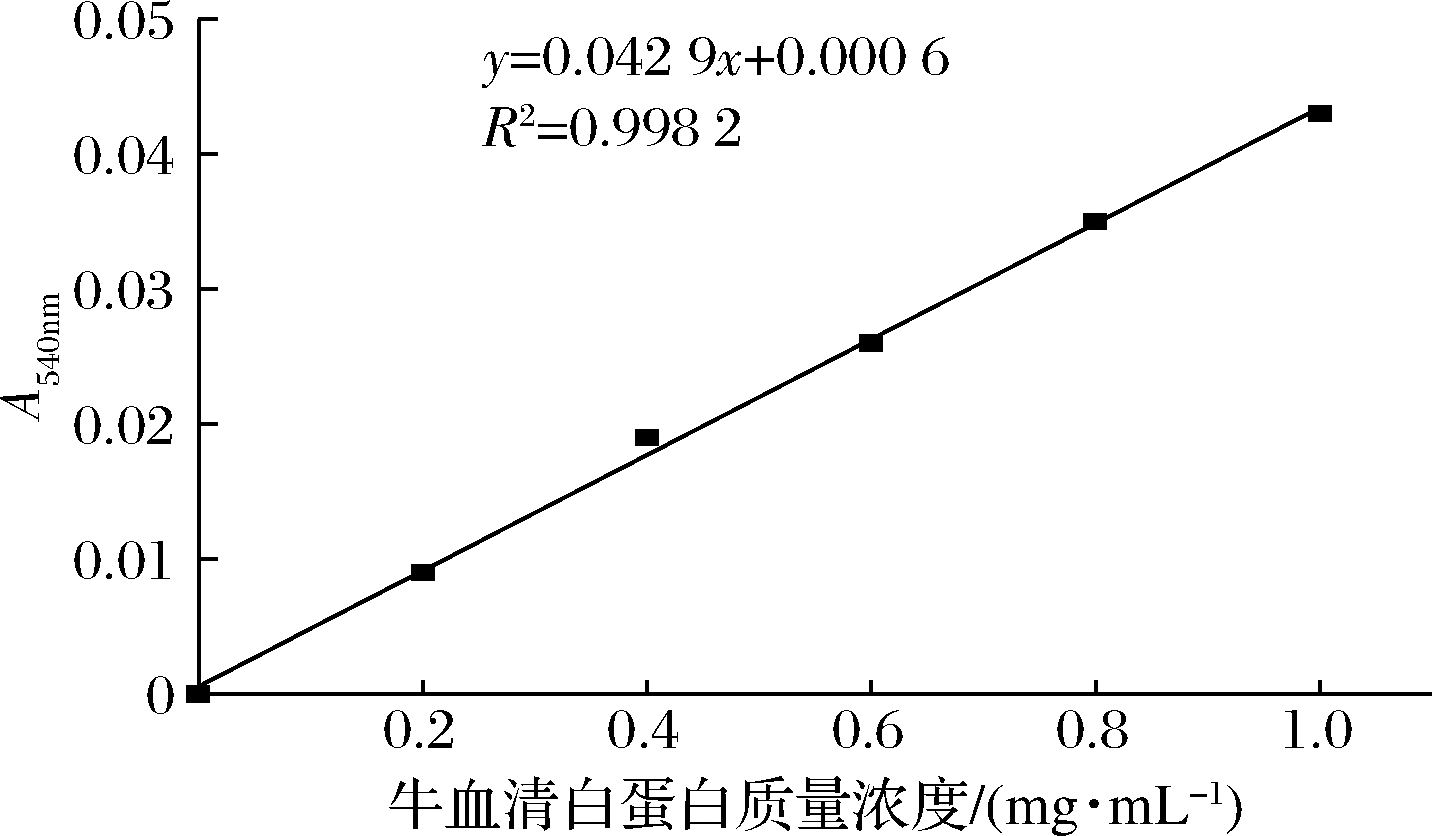
图1 牛血清白蛋白浓度-标准曲线
Fig.1 Standard curve of bovine serum albumin concentration-absorbance
图2是DA201-C大孔吸附树脂对乳铁蛋白抗菌肽的吸附动力学曲线,反映了吸附量和吸附率随时间的变化。由图2可知,DA201-C大孔吸附树脂对乳铁蛋白抗菌肽的吸附量和吸附率在前2 h是很快,随后慢慢平缓。前2 h空白,树脂对水解液中的多肽进行快速吸附,吸附率和吸附量能达到80%左右,3 h后,树脂表面吸附位点趋于饱和,树脂不再吸附,吸附量和吸附率趋于稳定。
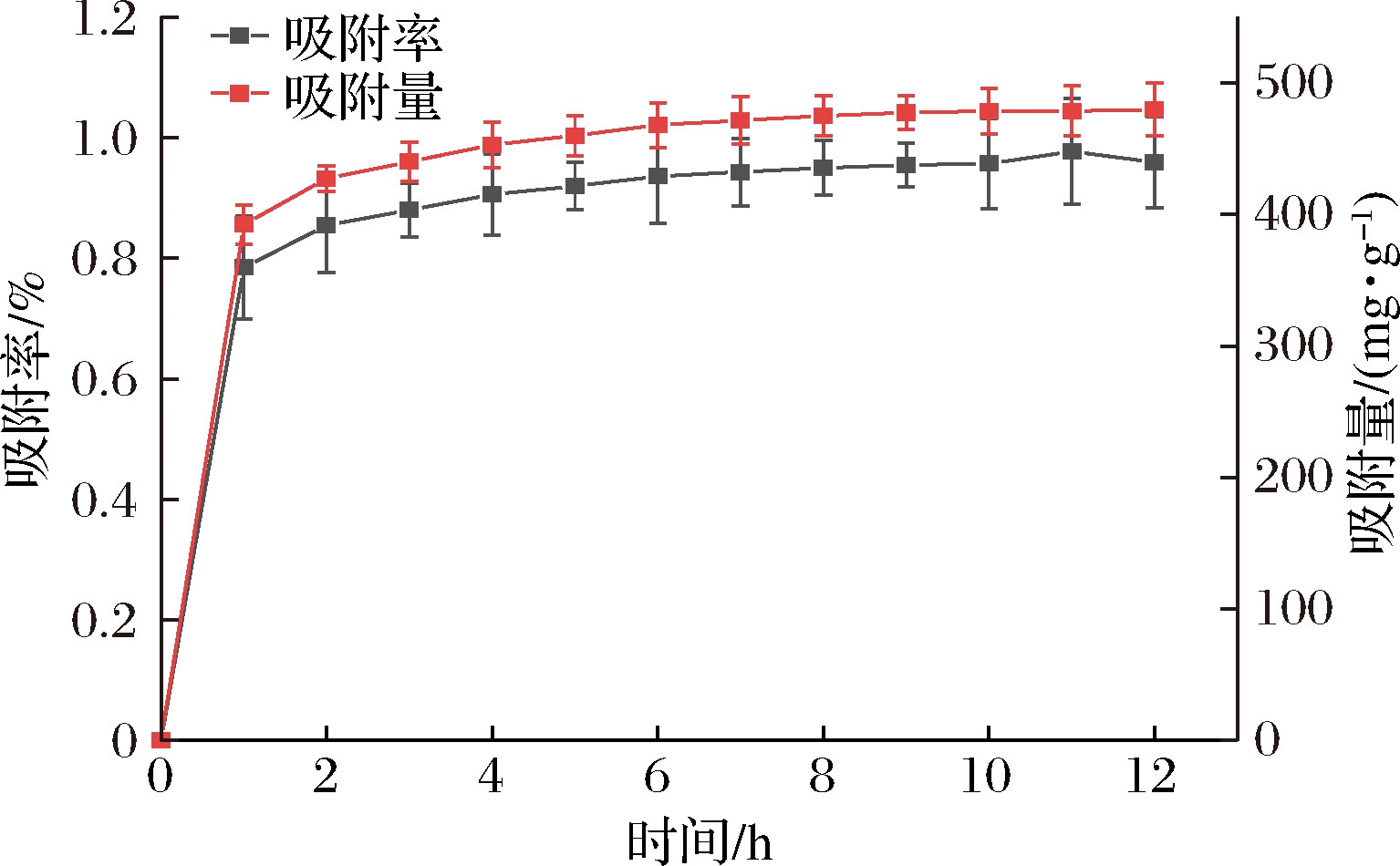
图2 DA201-C大孔树脂静态吸附曲线
Fig.2 Static adsorption curve of DA201-C macroporous resin
2.3 DA201-C大孔吸附树脂的静态解吸
不同浓度乙醇溶液对吸附了抗菌肽的DA201-C树脂解吸,结果如图3所示。由图3可以看出,经过超滤后的乳铁蛋白抗菌肽在水中的解吸效果不佳,其解吸率为13.31%,但是当乙醇浓度(体积分数)为35%、55%、75%和95%时,解吸率分别是57.95%、86.04%、95.35%和62.13%,可以看到随着乙醇浓度的提高,其解吸率也在升高,但是当乙醇浓度>75%时,其解吸率开始下降。这可能是由于乳铁蛋白抗菌肽在95%乙醇中溶解性不好所致,故本实验在动态解吸中选用75%乙醇浓度为解吸浓度。
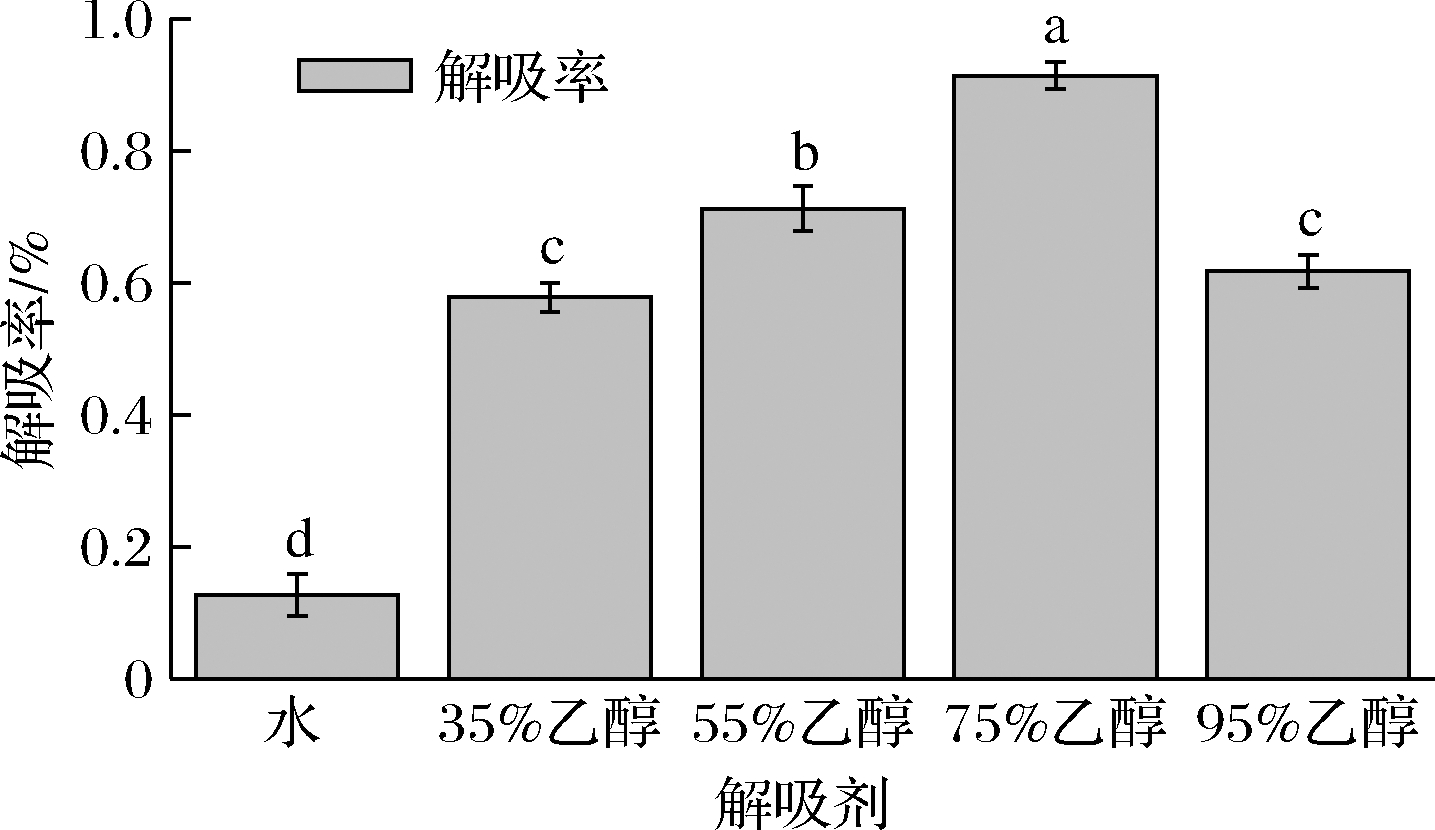
图3 不同解吸剂对抗菌肽的解吸率
Fig.3 The desorption rate of antimicrobial peptides with different desorption agents
注:图中不同处理组间小写字母不同表示差异显著(P<0.05),反之差异不显著
2.4 DA201-C大孔吸附树脂动态实验
2.4.1 不同上样流速对DA201-C动态吸附性能的影响
要提高吸附效率,不仅要考虑样品浓度、溶液的离子强度,还要考虑上样的流速,如果以相同的浓度和离子强度的样品溶液,上样的流速过快,吸附的物质还没扩散到树脂的内部就会被冲洗下来,树脂的吸附量会减少;反之速度过慢,分析时间会变长,影响实验效率。实验分别以1.5、2.0、2.5 mL/min的上样流速,得到DA201-C大孔树脂对超滤后的乳铁蛋白抗菌肽溶液的穿透曲线和穿透点通液量,如图4和图5所示。结果表明,随着流速的增加,溶液的通液量在减少。这可能由于上样流速太快,溶质还未来得及吸附就流出层析柱,但是如果流速过慢,虽然吸附量提高但纯化时间延长,效率不高,所以综合考虑,选择1.5 mL/min进行上样。
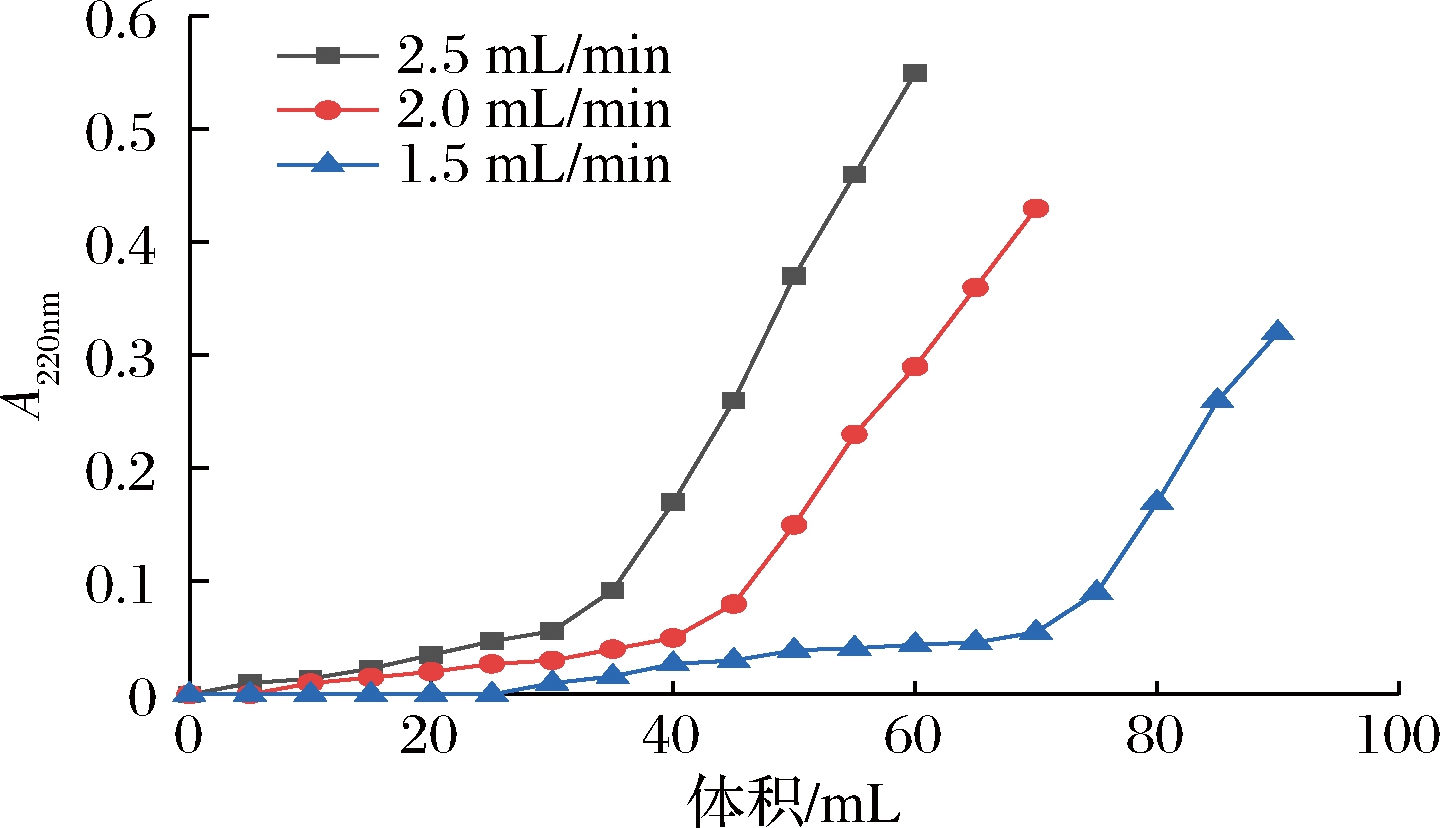
图4 不同上样流速对抗菌肽的穿透曲线
Fig.4 Penetration curves of antimicrobial peptides with different loading velocities

图5 不同上样流速对抗菌肽的穿透体积和吸附量
Fig.5 The penetration volume and adsorption capacity of antimicrobial peptides at different loading flow rates
注:图中同条件不同处理组间小写字母不同表示差异显著(P<0.05),反之差异不显著(图7、图9同)
2.4.2 不同样品质量浓度对DA201-C动态吸附性能的影响
取样品质量浓度15、20、25、30 mg/mL以1.5 mL/min的上样流速上柱,得到不同样品浓度对抗菌肽的穿透曲线、穿透体积和吸附量。由图6和图7可知,当上样浓度增加,大孔树脂的吸附量和穿透体积慢慢增加达到饱和后又慢慢减小。虽然吸附量随着被吸附物质浓度提高而增大,但被吸附物质浓度的提高是有限度的,不能超过大孔吸附树脂的吸附容量。所以可以适当提高物质的浓度来增加大孔树脂的吸附量,最后综合各方面的因素考虑,本实验选择20 mg/mL质量浓度上柱。
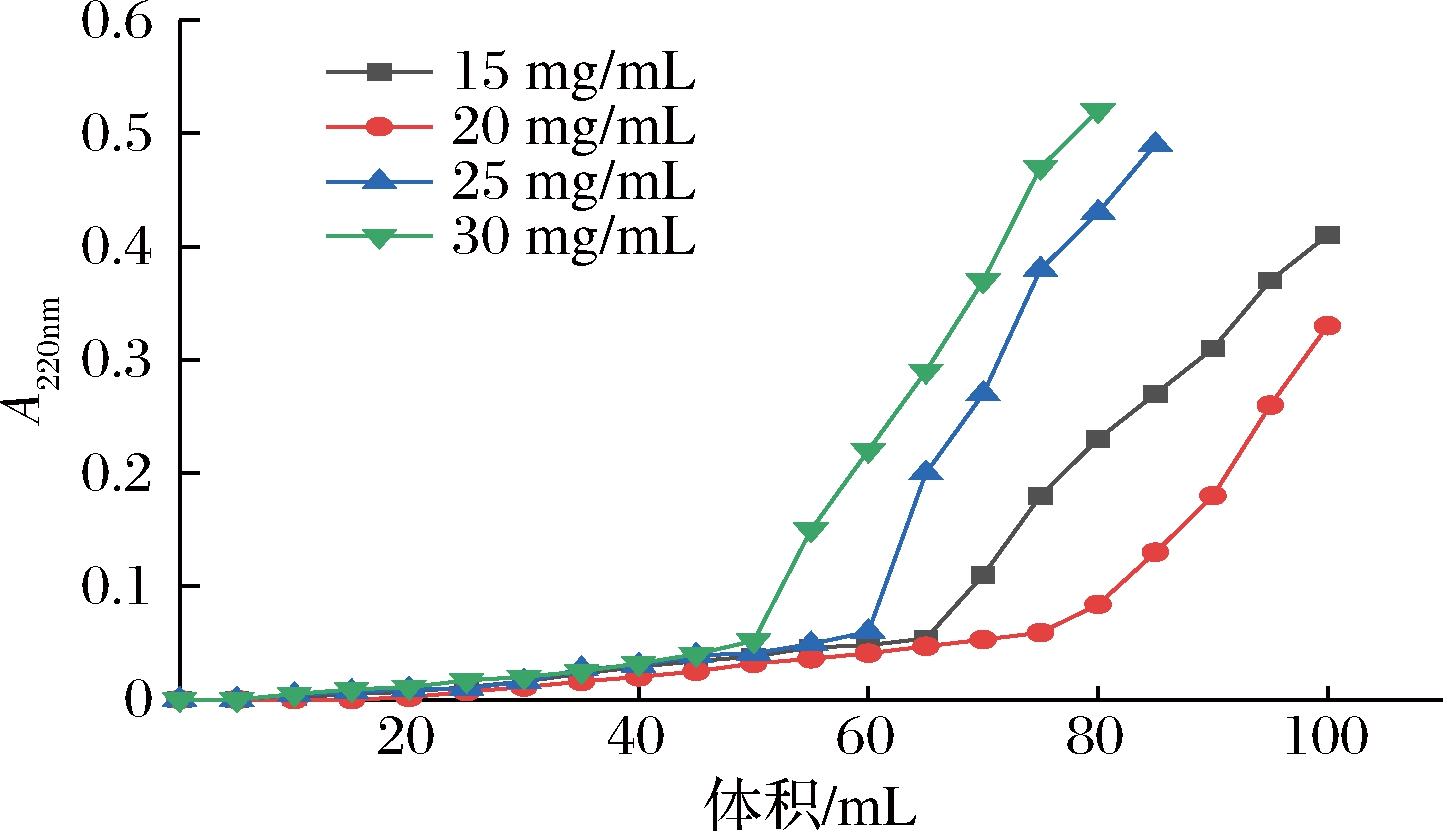
图6 不同样品浓度对抗菌肽的穿透曲线
Fig.6 Penetration curves of antimicrobial peptides with different sample concentrations

图7 不同样品质量浓度对抗菌肽的穿透体积和吸附量
Fig.7 The penetration volume and adsorption capacity of antimicrobial peptides in different sample concentrations
2.4.3 不同离子强度对DA201-C动态吸附性能的影响
为探讨离子强度对DA201-C大孔吸附树脂的影响,以不同浓度的NaCl溶液配制乳铁蛋白抗菌肽上柱分析,得到不同离子强度下的穿透曲线,并比较了不同离子强度对乳铁蛋白抗菌肽的穿透体积和吸附量的影响。由图8和图9可知,当NaCl浓度在0.6 mol/L时,DA201-C大孔树脂对乳铁蛋白抗菌肽的吸附量最大,有着一定促吸附作用。但是当NaCl的浓度高于0.6 mol/L时,吸附量下降。这可能是由于样液中多肽表面的带电氨基酸吸附更多的盐离子,使其疏水性下降,所以本实验选择离子强度在0.6 mol/L样品液上柱。

图8 不同离子强度对抗菌肽的穿透曲线
Fig.8 Penetration curves of antimicrobial peptides with
different ionic intensities
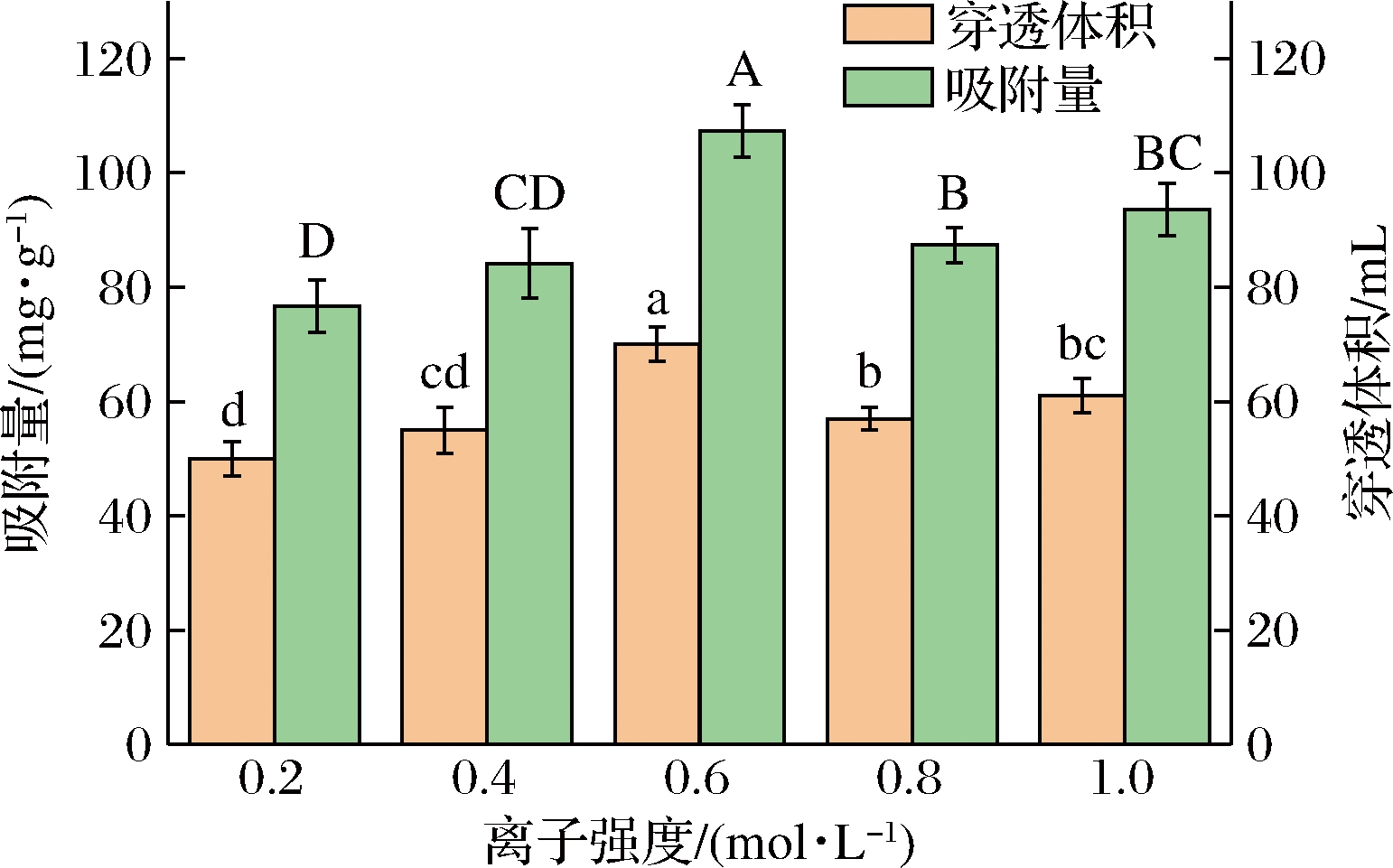
图9 不同离子强度对抗菌肽的穿透体积和吸附量
Fig.9 Penetration volume and adsorption capacity of antimicrobial peptides with different ionic strength
2.5 不同浓度乙醇对乳铁蛋白抗菌肽的分离纯化
使用35%、55%和75%(体积分数)的乙醇对乳铁蛋白抗菌肽进行梯度洗脱,得到峰1、峰2和峰3三个组分,如图10所示,分别单独收集3个峰的洗脱液冷冻干燥,测抑菌活性。由表3可知,随着乙醇浓度的提高,洗脱液对大肠杆菌和金黄色葡萄球菌的抑菌性逐渐提高,75%的乙醇洗脱液其抑菌率最高,分别到达80.95%和74.42%。

图10 不同浓度乙醇梯度洗脱峰图
Fig.10 Gradient elution peaks of different
concentrations of ethanol
表3 不同浓度乙醇洗脱液的抑菌率
Table 3 Antibacterial rates of ethanol eluents with different concentrations
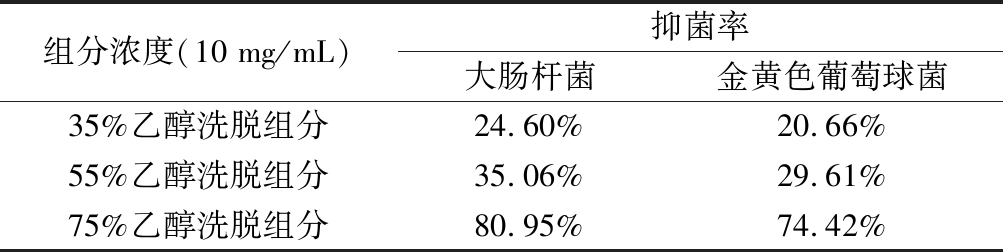
组分浓度(10 mg/mL)抑菌率大肠杆菌金黄色葡萄球菌35%乙醇洗脱组分24.60%20.66%55%乙醇洗脱组分35.06%29.61%75%乙醇洗脱组分80.95%74.42%
抗菌肽的抗菌活性与疏水性及正电荷性都有关[22-23],采用DA201-C大孔树脂对乳铁蛋白抗菌肽用不同浓度乙醇进行梯度洗脱,得到不同疏水性的洗脱成分,其活性也不相同。表4是各浓度乙醇梯度洗脱成分的氨基酸组成分析表,据此计算出疏水性氨基酸的疏水值、带正电荷氨基酸的比例和疏水性氨基酸的比例。由表4可知,不同浓度的乙醇洗脱组分的疏水性值从4.914 kJ/mol增加到5.454 kJ/mol,疏水性氨基酸的比例也从40.23%增加到44.6%,抗菌肽的疏水性值及疏水性氨基酸比例的增加会利于抗菌肽插入疏水的磷脂双分子层中,提高抗菌肽对微生物细胞膜的作用活性。研究也表明,提高抗菌肽的疏水性,其抗菌活性得到提高,而抗菌肽的溶血活性也提高[24]。75%乙醇洗脱成分的疏水性最强,它也展现出了最强的抗菌活性,其中75%乙醇洗脱成分正电荷氨基酸的比例是3种洗脱成分中最高的,为22.58%。目前发现的抗菌肽绝大部分都是阳离子肽[22]。抗菌肽对细菌的抑菌作用不仅取决于疏水性强弱还与所带正电荷多少有关,抗菌肽的正电荷性提高,有利于阳离子肽与细菌壁膜上磷壁酸等负电性物质结合,从而提高抗菌活性。研究也表明,抗菌肽与细胞壁上的脂多糖结合程度与所带正电荷的数量和疏水性强弱有很大关系[25]。
表4 乙醇梯度洗脱组分的氨基酸组成
Table 4 Results of amino acid analysis

氨基酸分子质量侧链疏水性值/氨基酸含量/[g·(100g)-1蛋白质](g·mol-1)(kJ·mol-1)35%乙醇55%乙醇75%乙醇Asp133.12.259.335.15.13Glu147.12.310.597.266.53Ser105.10.176.388.343.94His155.22.093.129.144.12Gly75.105.521.275.22Thr119.11.845.544.165.6Arg174.23.055.324.449.34Ala89.13.055.774.277.7Tyr181.2124.9412.35.04Cys121.203.321.741.06Val117.17.066.364.217.43Met149.25.433.024.62.22Phe165.211.085.297.277.24Ile131.212.413.548.655.15Leu131.210.126.47.076.04Lys146.26.275.714.459.12Pro115.110.879.855.328.82
3 结论
抗生素的滥用会导致细菌耐药性等问题,抗菌肽部分替代抗生素可成为解决细菌耐药问题的有效途径。乳铁蛋白抗菌肽是乳铁蛋白水解后得到的一系列分子质量的多肽混合物,而小分子质量的乳铁蛋白多肽具有广谱的抑菌活性。为得到抑菌活性高的抗菌多肽,本研究利用DA201-C大孔树脂对超滤后的低分子质量范围的乳铁蛋白水解液进行分离纯化,以穿透曲线、穿透体积及吸附量为指标,纯化乳铁蛋白抗菌肽的最佳工艺条件为:NaCl浓度0.6 mol/L、上样流速1.5 mL/min、上样质量浓度20 mg/mL。此外还探讨了不同体积分数乙醇溶液对抗菌肽的梯度洗脱,75%乙醇洗脱组分对大肠杆菌和金黄色葡萄球菌的抑菌率最大,分别为80.95%和74.42%,相比于分离纯化前的抗菌肽溶液提高了12%左右。氨基酸分析结果表明,抗菌肽的抗菌性与氨基酸的疏水性和带正电荷的数量有很大关联,75%乙醇洗脱组分疏水性和正电荷性都最大,也体现出最强的抑菌活性。抗菌肽表面正电荷增加有利于肽利用静电相互作用与带负电的细菌表面结合,疏水性的增加则会有利于其穿透细菌细胞膜,致使细胞死亡。该研究结果对乳源抗菌肽的制备具有一定的指导意义,在下一步的纯化步骤中可根据抗菌肽电荷性的不同采用阳离子交换树脂进行分离纯化。
[1] 陈立平, 赵平, 任广旭, 等.乳铁蛋白的研究现状与进展[J].农产品加工, 2019(8):68-70.
CHEN L P, ZHAO P, REN G X, et al.Research status and progress of lactoferrin[J].Farm Products Processing, 2019(8):68-70.
[2] 肖红艳, 兰欣怡, 张佩华.乳铁蛋白生物学功能研究进展[J].中国奶牛, 2021(4):46-50.
XIAO H Y, LAN X Y, ZHANG P H.Research progress in biological function of lactoferrin[J].China Dairy Cattle, 2021(4):46-50.
[3] 刘水灵, 安清聪.乳铁蛋白的免疫功能及其在养猪生产上的应用[J].家畜生态学报, 2017, 38(11):80-83.
LIU S L, AN Q C.Application of lactoferrin and its immune function in swine production[J].Journal of Domastici Animali Ecology, 2017, 38(11):80-83.
[4] CORNISH J, CALLON K E, NAOT D, et al.Lactoferrin is a potent regulator of bone cell activity and increases bone formation in vivo [J].Endocrinology, 2004, 145(9):4 366-4 374.
[5] 安芹, 汪雄, 王文利, 等.乳铁蛋白调控脂肪细胞发育代谢的研究进展[J/OL].食品科学, 2022,43(17):372-379.
AN Q, WANG X, WANG W L, et al.Research progress of lactoferrin in regulating the development and metabolism of adipocytes[J].Food Science, 2022,43(17):372-379.
[6] EVANS J C, MURUGESAN D, POST J M, et al.Targeting Mycobacterium tuberculosis CoaBC through chemical inhibition of 4′-phos- phopantothenoyl-l-cysteine synthetase (CoaB) activity[J].ACS Infectious Diseases, 2021, 7(6):1 666-1 679.
[7] WANG B, TIMILSENA Y P, BLANCH E, et al.Lactoferrin:Structure, function, denaturation and digestion[J].Critical Reviews in Food Science and Nutrition, 2019, 59(4):580-596.
[8] RUIZ-GIMÉNEZ P, SALOM J B, MARCOS J F, et al.Antihypertensive effect of a bovine lactoferrin pepsin hydrolysate:Identification of novel active peptides[J].Food Chemistry, 2012, 131(1):266-273.
[9] 王新保. 乳铁蛋白抗菌肽的制备及分离纯化[D].无锡:江南大学, 2008.
WANG X B.Preparation and isolation of lactoferrin antimicrobial peptide[D].Wuxi:Jiangnan University, 2008.
[10] 薛媛, 杨沫, 魏君慧, 等.白灵菇蛋白质的理化及功能特性[J].食品工业科技, 2018, 39(16):37-41.
XUE Y, YANG M, WEI J H, et al.Physicochemical and functional properties of protein from Pleurotus nebrodensis[J].Science and Technology of Food Industry, 2018, 39(16):37-41.
[11] 胡二坤, 郭兴凤, 郑慧.凝胶过滤色谱分离纯化鱼蛋白酶解产物[J].食品工业, 2020, 41(12):240-243.
HU E K, GUO X F, ZHENG H.Separation and purification of fish protein hydrolysate by gel chromatography[J].The Food Industry, 2020, 41(12):240-243.
[12] SUN X D, DONG J, LI J N, et al.Facile preparation of polysaccharide functionalized macroporous adsorption resin for highly selective enrichment of glycopeptides[J]. Journal of Chromatography A, 2017, 1498: 72-79.
[13] 张巧智, 毕爽, 马文君, 等.水酶法水解液中大豆多肽的吸附纯化及其氨基酸组成分析[J].大豆科技, 2019(S1):416-424.
ZHANG Q Z, BI S, MA W J, et al.Purification and amino acid composition of peptides from soybean byproduct protein hydrolysate from aqueous enzymatic extraction of soybean oil[J].Soybean Science and Technology, 2019(S1):416-424.
[14] 魏达凤, 朱瑜瑜, 王杨, 等.大孔树脂分离纯化枸杞多糖的研究[J].山东化工, 2019, 48(2):25-27;32.
WEI D F, ZHU Y Y, WANG Y, et al.Study on separation and purification of Lycium barbarum polysaccharide with macroporous resin[J].Shandong Chemical Industry, 2019, 48(2):25-27;32.
[15] HOU M Y, ZHANG L B.Adsorption/desorption characteristics and chromatographic purification of polyphenols from Vernonia patula (Dryand.) Merr.using macroporous adsorption resin[J].Industrial Crops & Products, 2021, 170:113729.
[16] 潘道东, 林璐.DA201-C大孔吸附树脂静态吸附ACE抑制肽的研究[J].食品科学, 2009, 30(5):20-23.
PAN D D, LIN L.Study on static adsorption of angiotensin converting enzyme inhibitory peptide onto DA201-C macroporous resin[J].Food Science, 2009, 30(5):20-23.
[17] 程云辉, 王璋, 许时婴.大孔吸附树脂对麦胚肽的吸附特性研究[J].食品与机械, 2005, 21(6):7-12.
CHENG Y H, WANG Z, XU S Y.Study on adsorption and separation of macroporous resin for wheat germ peptide[J].Food and Machinery, 2005, 21(6):7-12.
[18] 刁静静, 陈洪生, 李朝阳.单柱层析分离高活性玉米抗氧化肽技术参数的研究[J].食品工业, 2018, 39(1):92-96.
DIAO J J, CHEN H S, LI C Y.Technique parametric of separation and purification of zein antioxidant peptides with chromatographic fractionation[J].The Food Industry, 2018, 39(1):92-96.
[19] 张晨玥. 乳铁蛋白水解物中抗菌肽的分离纯化[D].成都:西南民族大学, 2021.
ZHANG C Y.Isolation and purification of antimicrobial peptides from lactoferrin hydrolysates[D].Chengdu:Southwest Minzu University, 2021.
[20] LEVIN R, BRAUER R W.The biuret reaction for the determination of proteins;an improved reagent and its application[J].The Journal of Laboratory and Clinical Medicine, 1951, 38(3):474-480.
[21] ZHANG X Y, LIU C, NEPAL S, et al.A hybrid approach for scalable sub-tree anonymization over big data using MapReduce on cloud[J]. Journal of Computer and System Sciences, 2014, 80(5):1 008-1 020.
[22] 康媛媛, 孟珺, 王艳阳, 等.抗菌肽功能特性与作用机制的研究进展[J].食品科技, 2021, 46(1):265-270.
KANG Y Y, MENG J, WANG Y Y, et al.Research progress on functional characteristics and mechanism of antimicrobial peptides[J].Food Science and Technology, 2021, 46(1):265-270.
[23] SUN J B, XIA Y Q, LI D, et al.Relationship between peptide structure and antimicrobial activity as studied by de novo designed peptides[J].Biochimica et Biophysica Acta, 2014, 1 838(12):2 985-2 993.
[24] JIANG Z Q, KULLBERG B J, VAN DER LEE H, et al.Effects of hydrophobicity on the antifungal activity of α-helical antimicrobial peptides[J].Chemical Biology & Drug Design, 2008, 72(6):483-495.
[25] SINGH S, PAPAREDDY P, KALLE M, et al.Effects of linear amphiphilicity on membrane interactions of C-terminal thrombin peptides[J].RSC Adv, 2014, 4(71):37 582-37 591.