D-阿拉伯糖醇是一种重要的功能性糖醇,被美国能源部评为12种生物基平台化合物之一[1]。D-阿拉伯糖醇具有与木糖醇相似的化学结构和性质以及更低的热量[2-3],作为具有潜力的糖替代品可用于治疗肥胖和预防龋齿等健康相关领域[4]。生物法合成D-阿拉伯糖醇与化学法相比较,不需要昂贵的催化剂和高温高压的生产条件,具有绿色环保的优点[5]。目前根据研究报道,能够合成D-阿拉伯糖醇的酵母菌种类主要有假丝酵母属[6]、德巴利酵母属[7]、柯达酵母属[8]、汉逊酵母属[9]、接合酵母属等[10]。酵母菌利用木糖合成D-阿拉伯糖醇可能经过以下代谢途径:木糖经木糖还原酶催化得到木糖醇,木糖醇由木糖醇脱氢酶(xylitol dehydrogenase,XDH)得到木酮糖,木酮糖经D-阿拉伯糖醇脱氢酶合成D-阿拉伯糖醇[11]。
21世纪,利用木质纤维素替代淀粉质底物用于生产高价值产品已进行了深入的研究[12]。除了木质纤维素水解产生葡萄糖的代谢利用,半纤维素水解产生木糖的代谢利用也备受关注。然而在木质纤维预处理中还会形成呋喃醛和酚醛等生物有毒产物,限制和影响了微生物的生长代谢[13]。热带假丝酵母具备出色的抗逆性和木糖利用能力,在利用木质纤维素水解液合成化学品具有很大的潜力[14-16]。本研究以实验室前期构建,带有CRISPR Cas9编辑系统的尿嘧啶缺陷型热带假丝酵母CU-208出发菌株[17],参考文献[18]的方法,鉴定内源D-阿拉伯糖醇脱氢酶(D-arabitol dehydrogenase,ARD)基因功能。进行如下代谢改造:敲除了木酮糖激酶(xylukinase,XKS)基因,阻断木糖流向磷酸戊糖途径,积累前体物质木糖醇;过表达XDH基因,减少中间产物木糖醇的积累,过表达经过密码子优化的外源D-阿拉伯糖醇脱氢酶(D-arabitol dehydrogenase,ADH)基因,使D-木酮糖能转化为D-阿拉伯糖醇。过表达6-磷酸-葡萄糖脱氢酶(glucose-6-phosphate dehydrogenase, ZWF)基因,增强磷酸戊糖途径,增加辅酶NADPH的积累;探索了一条以葡萄糖为辅助碳源,利用木糖生产D-阿拉伯糖醇的代谢改造方法(图1)。
1 材料与方法
1.1 材料
1.1.1 质粒、菌株和引物
本实验中所使用的载体pMD19-T Simple购自TaKaRa公司,菌株见表1,ATCC 20336为野生型菌株,CU-208为本实验室构建带有CRISPR Cas9编辑系统的URA3缺陷型热带假丝酵母;质粒Tm-gda324-URA3、Ts-PGAPDH-GFP-T、Ts-FAOF-gda324-URA3-FAOR、Ts-DLD24F-gda324-URA3-DLD24R、Ts-DLDsgRNA、Ts-sgRNA、Ts-sgURA3由本实验室保藏;引物M13F,M13R,FAO1-R,FAO1-F,ACT1-F,ACT1-R由本实验室保藏;PCR引物见表2,基因测序和基因合成由苏州金唯智生物科技有限公司提供。

图1 热带假丝酵母中D-阿拉伯糖醇的参考代谢途径
Fig.1 Reference metabolic pathway of D-arabitol in C.tropicalis
注:XR:木糖还原酶(xylose reductase);EMP:糖酵解途径(embden-meyerhof-parnas pathway);TCA:三羧酸循环(tricarboxylic acid cycle);PPP:磷酸戊糖途径(pentose phosphate pathway);![]() :外源途径
:外源途径
表1 本研究所用菌株
Table 1 Strains used in this study

菌株名称基因型来源ATCC 20336URA3/URA3本实验室CU-208ura3/ura3 cat::CRISPR-Cas9本实验室ARDDura3/ura3 cat::CRISPR-Cas9 ard::gda324-URA3本研究ARDOura3/ura3 cat::CRISPR-Cas9 fao1::PGAPDH-ARD-T-gda324-URA3本研究FYM01ura3/ura3 xks::PGAPDH-XDH-T-gda324-URA3/xks::PGAPDH-XDH-T-gda324-URA3 cat::CRISPR-Cas9本研究FYM01Tura3/ura3 xks::PGAPDH-XDH-T-gda324-URA3/xks::PGAPDH-XDH-T-gda324 cat::CRISPR-Cas9本研究FYM02ura3/ura3 xks::PGAPDH-XDH-T-gda324/xks::PGAPDH-XDH-T-gda324 cat::CRISPR-Cas9 ard::gda-URA3本研究FYM02Tura3/ura3 xks::PGAPDH-XDH-T-gda324/xks::PGAPDH-XDH-T-gda324 cat::CRISPR-Cas9 ard::gda本研究FYM03ura3/ura3 fao::PGAPDH-ADH-T-gda324-URA3本研究FYM04ura3/ura3 xks::PGAPDH-XDH-T-gda324/xks::PGAPDH-XDH-T-gda324本研究cat::CRISPR-Cas9 fao1::PGAPDH-ADH-T-gda324-URA3 ard:gdaFYM04Tura3/ura3 xks::PGAPDH-XDH-T-gda324/xks::PGAPDH-XDH-T-gda324 cat::CRISPR-Cas9本研究fao1::PGAPDH-ADH-T-gda324 ard::gdaura3/ura3 xks::PGAPDH-XDH-T-gda324/xks::PGAPDH-XDH-T-gda324 cat::CRISPR-Cas9FYM05fao1::PGAPDH-ADH-T-gda324-URA3 ard dld24::PGAPDH-ZWF-T-gda324-URA3/本研究dld24::PGAPDH-ZWF-T-gda324-URA3 ard::gda
表2 本研究所用引物
Table 2 Primers used in this study

引物名称序列(5′→3′)酶切位点XKS-FTTTAAGGCGTCCTGTCGGXKS-RGTTGAAAAATTTTCTACGCACTTCTUXKS-FAACTGCAGTGGTGTTTGTGGAGGAAGAAPst I-UXKS-RGGTCTAGACCATTTTCGGACCAGTGAATXba IVXKS-FATCGTTGGAGTGGATAAGTATCAXDH-FTCAATTAAAGAATTTAAACAGCCACCATGACCCCAAACCCATCCTTXDH-RCCTAGAGTTTGTTGGATAGCTATTCTGGACCGTCAATCAAACATARD-1FTCAATTAAAGAATTTAAACAATGGACTCCTCATCTTACTGGTCTARD-1RCCTAGAGTTTGTTGGATAGTTACCAACATTCGTAACCACCAARD-2FGGCAGAGAGTCTCACAAGCAGAARD-2RTGAAGATGAGGAGAATGTCACGGVARD-2FCGTACTTGCCCTTCATCTGCUARD-1FAACTGCAGACCAGTAAGATGAGGAGTCCATPst I-UARD-1RGGTCTAGAGAACTACACTAGGGGCATGTTTATTXba IVFAOGTGGCATGCCACAGATATACCAGTAADH-FTCAATTAAAGAATTTAAACAATGGTTGCTTCCGTTGCTGTADH-RCCTAGAGTTTGTTGGATAGCTACCATGGAATTTCCTTACSgRNAXKS-FAGACAAGTACAAGGTCAGTTTTAGAGCTAGAAATAGSgRNAXKS-RTGACCTTGTACTTGTCTTGCAAGAACCGGGAATSgRNAFAO-FACCCTTTCCGGACATACGACGTTTTAGAGCTAGAAATAGSgRNAFAO-RGTCGTATGTCCGGAAAGGGTTGCAAGAACCGGGAATDLD24-F:ACTTATCCTCGAACCCAGATGDLD24-R:TTCCAAACTCCCGCCTCVDLD24-F:CAACAAATCCCAATTCGAGTXKSPGAPDH-FTTCTTCCTCCACAAACACCAAACGTGGTATGGTTGTAAGAAACAT-FAOPGAPDH-FTACGTTGCCCCTTTATGTAACGTGGTATGGTTGTAAGAAACATFDLD24PGAPDH-FACGGATCACACCTCATGTTTAACGTGGTATGGTTGTAAGAAACATTermintor-RTGACGTCCTAGAAGCTTAGTTCTGGTTTAGAAGTAGGGACTGTZWF-FTCAATTAAAGAATTTAAACAGCCACCATGTCTTATGATTCATTCGGTGAZWF-RTTTACCTCTTTGCAGAAAACTTAGATCTTACCCTTGACATCGGQPCRARD-FACCGAGATGAAGACAGAGQPCRARD-RTACAAGATGGAACCGACAA
注:下划线表示酶切位点
1.1.2 培养基、试剂和仪器
LB培养基(g/L):酵母粉5,蛋白胨10,NaCl 10;YPD培养基(g/L):酵母粉10,蛋白胨20,葡萄糖20;MM平板(g/L):YNB 6.7,(NH4)2 SO4 10,葡萄糖20;五氟乳清酸培养基(g/L):YNB 6.7,(NH4)2 SO4 10,葡萄糖20,尿嘧啶0.02,五氟乳清酸2;木糖鉴定培养基(g/L):YNB 6.7,(NH4)2 SO4 10,木糖20 ;葡萄糖鉴定培养基(g/L):酵母粉10,蛋白胨20,葡萄糖50;木糖发酵培养基(g/L):酵母粉10,YNB 1.7,(NH4)2 SO4 10,葡萄糖20,木糖80;相应的固体培养基在原有培养基基础上加入20 g/L的琼脂粉。
D-阿拉伯糖醇标品,坛墨质检科技股份有限公司;木糖标品,上海阿拉丁生化科技股份有限公司:5-氟乳清酸,上海麦克林生化科技有限公司;酵母RNA提取试剂盒,上海生物工程股份有限公司;逆转录试剂盒,宝生物工程(大连)有限公司;荧光定量PCR试剂盒,南京诺唯赞生物科技股份有限公司;胞内NADPH试剂盒,上海维晟生物公司;PR-96EPCR扩增仪,杭州米欧仪器有限公司;UV2000紫外可见分光光度计,上海尤尼科有限公司,1260 Infinity高效液相色谱仪,安捷伦科技有限公司;SBA-40C生物传感仪,山东生物研究所。
1.2 实验方法
1.2.1 敲除框的构建
根据本实验室ATCC 20336基因组测序结果和NCBI进行比对,找到热带假丝酵母中D-阿拉伯糖醇脱氢酶基因ard,用引物ARD-2F和ARD-2R,以热带假丝酵母基因组为模板PCR扩增得到基因ard,使用连接酶SolutionI连接载体pMD19-T Simple得到质粒Ts-ARD,测序验证正确,用UARD-1F和UARD-1R以Ts-ARD 为模板,反向PCR得到载体片段ARDF-Ts- ARDR,用Pst I和Xba I酶切ARDF-Ts-ARDR,用相同的酶,双酶切Tm-gda324-URA3,得到片段gda324-URA3,用SolutionI连接片段ARDF-Ts-ARDR和gda324-URA3得到和Ts-ARDF-gda324-URA3-ARDR(图2-a);同样采取上述方法构建得到质粒Ts- XKSF-gda324-URA3-XKSR。
1.2.2 表达框的构建
用引物ARD-1F,ARD-1R,以热带假丝酵母基因组为模板,扩增基因ard,用Hind Ⅲ和Sal Ⅰ 酶切质粒Ts-PGAPDH-GFP-T,得到片段PGAPDH-Ts-T,将PGAPDH-Ts-T 与基因ard一步连接,得到Ts-PGAPDH- ARD-T,用引物FAOPGAPDH-F和Termintor-R以Ts-PGAPDH-ARD-T为模板扩增得到片段PGAPDH-ARD-T,使用Pst Ⅰ 酶切质粒Ts- FAOF-gda324-URA3-FAOR,得到片段FAOF-Ts-gda234- URA3-FAOR,将片段PGAPDH-ARD-T 和FAOF-Ts-gda234-URA3-FAOR 一步连接得到质粒Ts-FAOF-PGAPDH-ARD-T-gda324-URA3-FAOR(图2-b),同样采取上述方法构建质粒Ts-XKSF-PGAPDH-XDH-T-gda324-URA3-XKSR,Ts-DLD24F-PGAPDH-ZWF-T-gda324-URA3-DLD24R。
1.2.3 sgRNA构建
Ts-sgRNA 为本实验室构建的质粒,以整合位点PAM前端20 bp的序列替换掉Ts-sgRNA 上相应的20 bp 序列,即可得到该位点的sgRNA。通过将待整合位点序列导入软件SgRNACas9 V.3.0设计出sgRNA,设计SgRNAXKS-F和SgRNAXKS-R,SgRNAARD-F和SgRNAARD-R,SgRNAFAO-F和SgRNAFAO-R,以Ts-sgRNA 为模板全质粒PCR,用酶Dpn I消化2 h消除原质粒Ts-sgRNA,将消化完的PCR产物转化JM109,提质粒后测序得到正确替换的质粒,使用金唯智公司的通用引物M13 F和M13 R以正确的质粒为模板,得到XKS、ARD、FAO 位点的sgRNA,在酵母转化时与敲除框或整合框一同转化,能有效提高转化效率。

a-ard基因敲除框;b-ard基因整合框
图2 ard 基因敲除框和ard 基因整合框的构建
Fig.2 Construction of ard disruption cassette and ard integration cassette
1.2.4 热带假丝酵母氯化锂转化
热带假丝酵母氯化锂转化方法参考文献[19],转化子标记基因URA3的弹出方法参考文献[20]。
1.2.5 基因转录水平测定
使用软件Beacon Designer 7.9设计荧光定量所需要的引物QPCRARD-F和QPCRARD-R。参PCR考文献[21]测定ARD基因转录水平。
1.2.6 测定胞内辅酶NADPH
将待测菌株划线于YPD平板培养2~3 d,接种单菌落于20 mL YPD液体培养基中,置于30 ℃摇床200 r/min过夜培养。使用上海维晟生物公司试剂盒NADP/NADPH Quantification Colorimetric Kit测定NADPH/NADPt,其中NADPt=NADPH+NADP+。
1.2.7 摇瓶实验
FYM01生长曲线:将待测菌株在YPD平板上划线,接种单菌落于20 mL YPD液体培养基中,置于30 ℃ 摇床中200 r/min过夜培养,取1 mL于1.5 mL无菌离心管内,用无菌水洗净残余培养基,转接于木糖鉴定培养基中,每12 h测定1次OD600值。
重组菌株摇瓶发酵:将发酵菌株划线于YPD平板,接种单菌落于20 mL YPD液体培养基,置于30 ℃,200 r/min摇床过夜培养,转接于50 mL木糖发酵培养基中,30 ℃,200 r/min摇床培养,隔12 h测OD600值,取样1 mL存于-20 ℃,待测定发酵液中成分。
2 结果与分析
2.1 内源D-阿拉伯糖醇脱氢酶的功能鉴定
2.1.1 内源D-阿拉伯糖醇酶基因敲除与过表达
为了研究ARD对D-阿拉伯糖醇合成的影响,我们以CU-208为出发菌株,利用CRISPR Cas9敲除了基因组上的ard 基因。其中敲除框质粒Ts-ARDF- gda324-URA3-ARDR用Xba I、Pst I双酶切,获得大小为3.3 kb,1.9 kb的片段(图3-a);用引物ARD-2F和ARD-2R以Ts-ARD-gda324-URA-ARD为模板扩增出线性片段ARDF-gda324-URA-ARDR后,用于转化,用同源臂外侧引物VARD-2F和同源臂内侧引物ARD-2R验证,正确转化子大小2.6 kb(图3-b),得到菌株ARDD。
据野生型热带假丝酵母ATCC 20336全基因组测序和NCBI比对得到D-阿拉伯糖醇脱氢酶序列,以ATCC 20336基因组为模板扩增得到0.8 kb的ard 基因(图3-c),测序正确。以构建好的Ts-FAO-PGAPDH-ARD-T-gda324-URA3-FAO 为模板,用引物FAO1-F和FAO1-R扩增出片段FAO-PGAPDH-ARD-T-gda324-URA3用于转化,获得的转化子提取基因组,用同源臂外侧引物VFAOF和外侧引物FAO1-R验证,结果见图3-d。野生型菌株ATCC 20336的扩增片段大小为3.3 kb,过表达ard 基因转化子扩增片段为5.3 kb,得到验证正确菌株ARDO。
2.1.2 内源D-阿拉伯糖醇脱氢酶基因的转录水平分析
以肌动蛋白基因(act)为内参基因,测定菌株ATCC 20336、ARDD和ARDO的内源基因ard转录水平,结果显示,由于菌株ARDD中已敲除ard基因,并未检测到ard基因转录信号(图4)。而由于菌株ARDO中过表达ard基因,相对丰度为对照的15.7倍。结果表明ARDD的ard基因成功敲除,且ARDO的ard基因转录水平较高,成功过表达ard基因。

a-质粒Ts-ARDF-gda324-URA3-ARDR-酶切验证增
(M-5 000 bp核酸marker,1-质粒酶切);b-ard基因敲除
(M-5 000 bp核酸marker,1-ard 敲除基因转化子,2-ATCC 20336
对照);c-基因ard 扩增结果(M-5 000 bp核酸marker,1-ard 基因);d-ard 基因整合(M-10 000 bp核酸marker,1-ATCC 20336对照,2~3-ard基因整合转化子)
图3 ard基因敲除与ard 基因整合菌株的PCR验证
Fig.3 PCR identification of ard gene disruption and ard gene integration strains

图4 ard基因在不同菌株中的表达水平
Fig.4 Gene expression levels of ard in different strains
2.1.3 敲除或过表达内源D-阿拉伯糖醇脱氢酶基因对D-阿拉伯糖醇产量的影响
将菌株ATCC 20336,ARDD,ARDO转接于 50 mL 葡萄糖鉴定培养基中,放置于30 ℃摇床,转速200 r/min培养108 h后,D-阿拉伯糖醇产量见图5,菌株ATCC 20336、ARDD和ARDO的D-阿拉伯糖醇产量分别为2.293、3.84、1.71 g/L,菌株ARDD的D-阿拉伯糖醇产量高于野生型菌株,而菌株ARDO的D-阿拉伯糖醇产量低于野生型菌株,由此分析可知在热带假丝酵母中ard 基因可能参与分解D-阿拉伯糖醇。

图5 菌株ATCC 20336、ARDD和ARDO在葡萄糖鉴定
培养基中D-阿拉伯糖醇的产量
Fig.5 Production of D-arabitol by strains ATCC 20336,ARDD and ARDO in glucose identification medium
2.2 利用木糖生产D-阿拉伯糖醇的热带假丝酵母的构建与评估
2.2.1 木酮糖激酶基因敲除与木糖醇脱氢酶基因过表达
以CU-208为出发菌株,敲除木酮糖激酶同时过表达木糖醇脱氢酶构建FYM01,步骤参考 2.1.1。将菌株FYM01和野生型菌株ATCC 20336分别接种于20 mL木糖鉴定培养基中,每隔12 h测定OD600值,结果见图6,FYM01的生长受到了明显的限制,这是因为FYM01敲除了木糖代谢途径中的木酮糖激酶,阻断了木糖下游代谢途径,无法从木糖进入磷酸戊糖途径,所以在木糖为唯一碳源的培养基中,木糖无法作为提供生长的所需的能量,菌株无法生长。
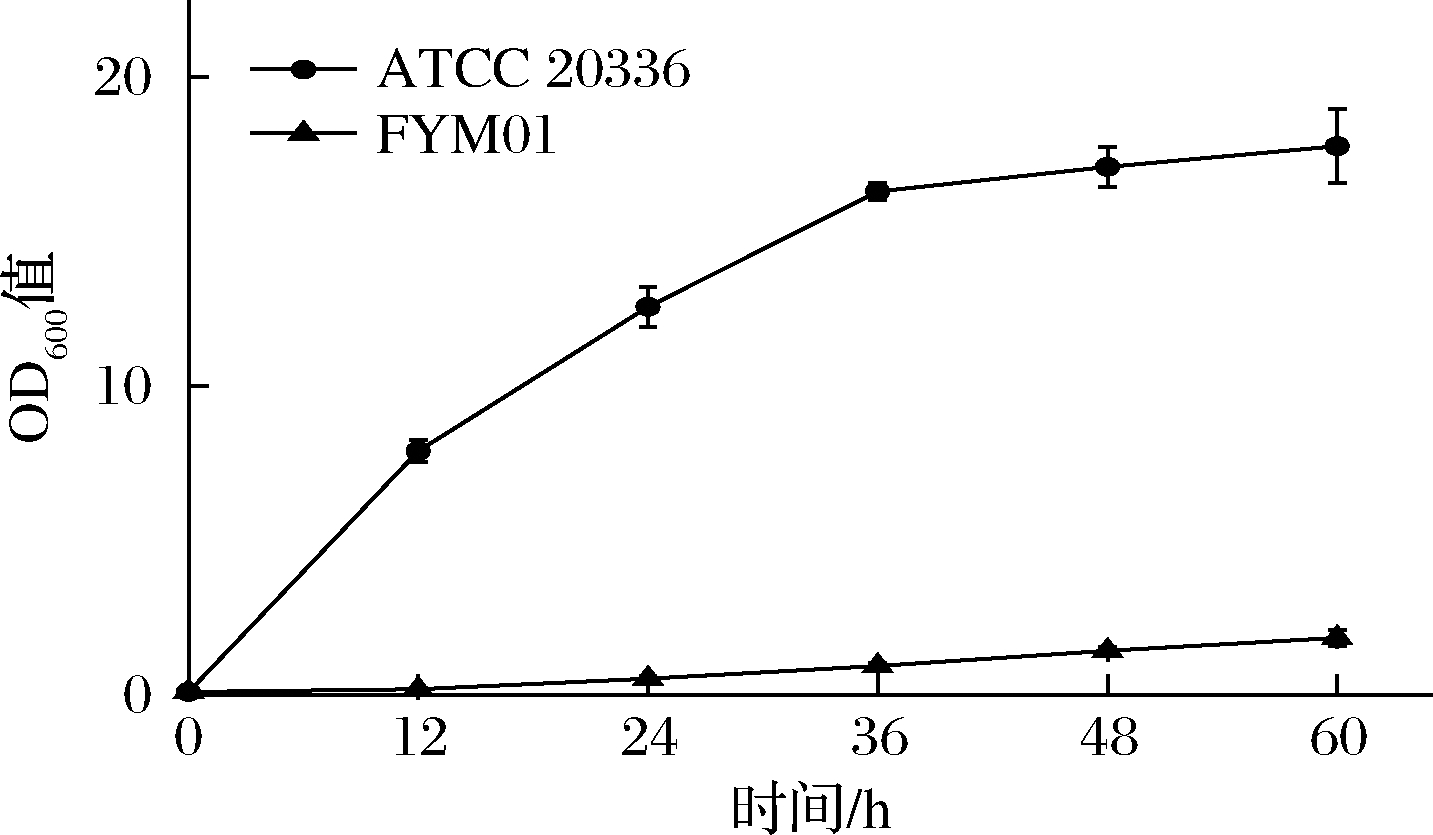
图6 菌株ATCC 20336和FYM01在木糖鉴定培养基中的生长情况
Fig.6 Growth curve of strains ATCC 20336 and FYM01in xylose identification medium
2.2.2 外源D-阿拉伯糖醇脱氢酶基因adh 的过表达对D-阿拉伯糖醇产量的影响
分别以CU-208和FYM02T为出发菌株,过表达来源于圆红冬孢酵母的外源D-阿拉伯糖醇脱氢酶基因adh,获得菌株FYM03和FYM04,步骤参考2.1.1。将菌株ATCC 20336,FYM03,FYM04转接至50 mL木糖发酵培养基,放置于30 ℃摇床,转速200 r/min培养108 h后,测定D-阿拉伯糖醇产量,结果见图7,过表达外源D-阿拉伯糖醇脱氢酶后,相对于野生型菌株ATCC 20336 D-阿拉伯糖醇产量有明显提升。菌株ATCC 20336、FYM03和FYM04 D-阿拉伯糖醇产量分别为0.92、6.42、4.72 g/L,FYM03和FYM04分别相较于野生型提高了6.97倍和5.13倍,其中ATCC 20336与 FYM03将木糖完全利用,而FYM04发酵只利用了21.36 g木糖。推测可能是阻断木糖途径后,将导致还原力供应不足,木糖无法有效的利用[22-23],需增强辅酶的供应。

图7 菌株ATCC 20336、FYM03和FYM04在木糖发酵培养基中D-阿拉伯糖醇的产量
Fig.7 Production of D-arabitol by strains ATCC 20336,FYM03 and FYM04 in xylose fermentation medium
2.2.3 过表达内源葡萄糖-6-磷酸脱氢酶对的胞内NADPH浓度的影响
根据文献报道文献[22],过表达葡萄糖-6-磷酸脱氢酶基因zwf可以增加代谢路径中NADPH的供应。在FYM04T的基础上过表达zwf构建FYM05,步骤参考2.1.1,将菌株接种于50 mL YPD培养基中置于30 ℃摇床转速为200 r/min培养24 h后,使用NADP/NADPH Quantification Colorimetric Kit试剂盒测定过表达zwf的FYM05和野生菌株ATCC 20336胞内NADPH/NADPt,结果见图8,在过表达了内源基因zwf后,NADPH/NADPt的比值达到了0.445。说明过表达zwf基因有效增强了胞内的磷酸戊糖途径,积累更多了的NADPH,使得细胞获得了更多的还原力。

图8 菌株ATCC 20336和FYM05胞内NADPH/NADPt比例
Fig.8 The intracellular NADPH/NADPt ratio in strains ATCC 20336 and FYM05
2.3 重组菌株FYM05发酵生产D-阿拉伯糖醇
将菌株ATCC 20336和FYM05转接50 mL木糖发酵培养基中,30 ℃,200 r/min发酵108 h,测定发酵过程中的OD600值、木糖、葡萄糖、D-阿拉伯糖醇浓度变化,结果如图9所示,图9-a是ATCC 20336和FYM05在木糖发酵培养基中的生长情况,菌株FYM05在36 h之后生长变得缓慢,结合图9-b,在36 h后,葡萄糖耗尽,因为菌株FYM05敲除了木酮糖激酶基因xks,无法利用木糖生长,所以生长进入稳定期,而野生型菌株ATCC 20336能继续以木糖作为生长碳源,图9-b反应培养基中木糖和葡萄糖的浓度,FYM05在葡萄糖利用完之后,继续了利用34.17 g/L木糖,仍有45.83 g/L木糖没有被利用,这可能与发酵后期菌体生长受到限制有关,而野生型菌株ATCC 20336能够在葡萄糖耗尽后将木糖利用完。图9-c反映D-阿拉伯糖醇的产量,FYM05在96 h时达到最高产量11.35 g/L,相较于野生型菌株ATCC 20336在84 h达到的最高产量0.97 g/L提高了11.7倍。

a-ATCC 20336和FYM05生长曲线;b-发酵液中木糖和葡萄糖的浓度;c-发酵液中D-阿拉伯糖醇产量
图9 菌株ATCC 20336和FYM05在木糖发酵培养基发酵结果
Fig.9 Fermentation results of strains ATCC 20336 and FYM05 in xylose fermentation medium
3 结论与讨论
本研究从热带假丝酵母木糖代谢途径出发,鉴定了热带假丝酵母内源基因ard参与了D-阿拉伯糖醇的分解;并开发了以木糖为底物生产D-阿拉伯糖醇的代谢途径改造策略,通过敲除木酮糖激酶并过表达木糖醇脱氢酶,阻断了木糖利用途径并强化木糖合成D-阿拉伯糖醇上游途径,使菌株不能利用木糖生长,敲除内源基因ard,减少D-阿拉伯糖醇的消耗,表达外源基因adh,使热带假丝酵母可以利用木糖合成D-阿拉伯糖醇。而在阻断木糖进入磷酸戊糖途径后,菌体还原力不足,导致木糖利用受抑制,过表达内源基因zwf,增强了磷酸戊糖途径,提供了更多的NADPH。经过上述改造后,获得了1株以木糖为底物生产D-阿拉伯糖醇的菌株FYM05,经发酵培养后,其产D-阿拉伯糖醇产量较野生型菌株ATCC 20336提高了11.7倍。但是目前仍然存在一些问题,比如在敲除木酮糖激酶后,木糖不能完全被用于生产D-阿拉伯糖醇,以及D-阿拉伯糖醇产量还有较大的提升空间等。
本研究探索了热带假丝酵母利用木糖生产D-阿拉伯糖醇代谢改造方法,得到1株D-阿拉伯糖醇产量为11.35 g/L的菌株,为针对酵母利用木糖生产D-阿拉伯糖醇的代谢改造和进一步研究酵母利用半纤维素生成D-阿拉伯糖醇提供了参考。
[1] KORDOWSKA-WIATER M. Production of arabitol by yeasts: Current status and future prospects[J].Journal of Applied Microbiology,2015,119(2):303-314.
[2] QI X H, LUO Y, WANG, X et al.Enhanced D-arabitol production by Zygosaccharomyces rouxii JM-C46:Isolation of strains and process of repeated-batch fermentation[J].Journal of Industrial Microbiology & Biotechnology, 2015, 42(5):807-812.
[3] 黄魏, 王晓丹, 李豆南, 等.微生物发酵产D-阿拉伯糖醇的研究进展[J].中国酿造, 2017, 36(9):6-10.
HUANG W, WANG X D, LI D N, et al.Research progress of D-arabitol production by microbial fermentation[J].China Brewing, 2017, 36(9):6-10.
[4] YOUNG H.Sweeteners and Sugar Alternatives in Food Technology[M].London:Blackwell Publishing, 2006:205-218.
[5] TOYODA T, OHTAGUCHI K.Selection of Kluyveromyces yeasts for the production of D-arabitol from lactose[J].Journal of Chemical Engineering of Japan, 2009, 42(7):508-511.
[6] 宋卫斌, 林燕青, 胡海燕, 等.产D-阿拉伯醇菌株的筛选、鉴定及其产D-阿拉伯醇条件的优化[J].微生物学报, 2011, 51(3):332-339.
SONG W B, LIN Y Q, HU H Y, et al.Isolation and identification of a novel Candida sp.H2 producing D-arabitol and optimization of D-arabitol production[J].Acta Microbiologica Sinica, 2011, 51(3):332-339.
[7] 张丽丽.高产D-阿拉伯糖醇酵母菌株的筛选及其发酵条件的研究[D].无锡:江南大学, 2009.
ZHANG L L.Screening of yeast strains and fermentation conditions for hight yield production of D-arabitol[D].Wuxi:Jiangnan Univer- sity, 2009.
[8] 蔡莉, 张扬, 朱宏阳, 等.1株产D-阿拉伯糖醇的菌株的分离筛选及鉴定[J].食品与发酵工业, 2009, 35(1):23-26.
CAI L, ZHANG Y, ZHU H Y, et al.Isolation and identification of a novel D-arabitol producing strain[J].Food and Fermentation Industries, 2009, 35(1):23-26.
[9] 钱卫东, 宁肖肖, 赵德志, 等.利用组合策略提高汉逊酵母发酵生产D-阿拉伯糖醇[J].安徽农业科学, 2014, 42(23):7 726-7 728.
QIAN W D, NING X X, ZHAO D Z, et al.An optimal combination strategy to increase D-arabitol production by Hansenula polymorpha[J].Journal of Anhui Agricultural Sciences, 2014, 42(23):7 726-7 728.
[10] 王惠莲, 杨廉婉, 那淑敏, 等.耐高渗透压酵母生产甘油及阿拉伯糖醇的研究——Ⅲ.Zygosaccharomyces chevalieri Guill.2.309产生甘油的条件[J].微生物学报, 1963, 9(2):200-201.
WANG H L, YANG L W, NA S M, et al.Studies on the production of glycerol and arabitol by osmophilic yeasts Ⅲ.Carbohydrate metabolism in osmophilic yeasts[J].Acta Microbiologica Sinica, 1963, 9(2):200-201.
[11] JAGTAP S S, RAO C V.Production of D-arabitol from D-xylose by the oleaginous yeast Rhodosporidium toruloides IFO0880[J].Applied Microbiology and Biotechnology, 2018, 102(1):143-151.
[12] GALL D L, RALPH J, DONOHUE T J, et al.Biochemical transformation of lignin for deriving valued commodities from lignocellulose[J].Current Opinion in Biotechnology, 2017, 45:120-126.
[13] 周平平.生物炼制发酵微生物的呋喃醛和酚醛抑制物脱毒机制和应用研究[D].上海:华东理工大学, 2019.
ZHOU P P.Analysis of detoxification mechanism of furan and phenolic aldehyde inhibitors of biorefinery fermenting strains and its extended applications[D].Shanghai:East China University of Science and Technology, 2019.
[14] 王旭.产D-阿拉伯糖醇酵母菌株的筛选、发酵与产木糖醇基因工程菌的构建[D].镇江:江苏大学, 2015.
WANG X.The isolation and fermentation of yeast strain producing D-arabitol and construction of genetic engineering strain producing xylitol[D].Zhenjiang:Jiangsu University, 2015.
[15] 周桂雄.代谢未脱毒木质纤维素稀酸水解物产乙醇耐毒酵母菌的筛选及特性研究[D].北京:首都师范大学, 2009.
ZHOU G X.Isolation and characterization of inhibitor-tolerant yeast strains for ethanol production from dilute-acid lignocellulosic hydrolysate without detoxification[D].Beijing:Capital Normal University, 2009.
[16] SOMANI A, SMITH D, HEGARTY M, et al.Draft genome assemblies of xylose-utilizing Candida tropicalis and Candida boidinii with potential application in biochemical and biofuel production[J].Genome Announcements, 2018, 6(7):e01594-e01517.
[17] ZHANG L, ZHANG H, LIU Y, et al.A CRISPR-Cas9 system for mul- tiple genome editing and pathway assembly in Candida tropicalis[J].Biotechnology and Bioengineering, 2020, 117(2):531-542.
[18] WONG B, LEESON S, GRINDLE S, et al.D-arabitol metabolism in Candida albicans:Construction and analysis of mutants lacking D-arabitol dehydrogenase[J].Journal of Bacteriology, 1995, 177(11):2 971-2 976.
[19] HAAS L O, CREGG J M, GLEESON M A.Development of an integrative DNA transformation system for the yeast Candida tropicalis[J].Journal of Bacteriology, 1990, 172(8):4 571-4 577.
[20] 王世杰, 张海冰, 沈微, 等.代谢工程改造热带假丝酵母高效合成中链ω-羟基脂肪酸[J].微生物学报, 2022, 62(1):77-89.
WANG S J, ZHANG H B, SHEN W, et al.Efficient synthesis of medium-chain ω-hydroxy fatty acids by metabolic engineering in Candida tropicalis[J].Acta Microbiologica Sinica, 2022, 62(1):77-89.
[21] 黄玉堃, 张利华, 张海冰, 等.代谢改造热带假丝酵母提高D-乳酸的产量[J].食品与发酵工业, 2021, 47(24):109-115.
HUANG Y K, ZHANG L H, ZHANG H B, et al.Metabolic engineer- ing of Candida tropicalis to improve D-lactic acid production[J].Food and Fermentation Industries, 2021, 47(24):109-115.
[22] ZHANG L H, CHEN Z, WANG J H, et al.Stepwise metabolic engineering of Candida tropicalis for efficient xylitol production from xylose mother liquor[J].Microbial Cell Factories, 2021, 20(1):105.
[23] 李敬知.辅酶合成对酿酒酵母异丁醇产量的影响[D].天津:河北工业大学, 2017.
LI J Z.Effect of cofactor biosynthesis on isobutanol yield in Saccha- romyces cerevisiae [D].Tianjing:Hebei University of Technology, 2017.